ГОСТ 30726-2001
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕМетоды выявления и определения количества бактерий вида Escherichia coli
|
Москва
Стандартинформ
2010 |
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским институтом консервной и овощесушильной промышленности (ВНИИКОП) и МТК 93 «Продукты переработки плодов и овощей»
ВНЕСЕН Еосстандартом России
2 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол № 19 от 24 мая 2001 г.)
За принятие проголосовали:
|
Наименование государства |
Наименование национального органа по стандартизации |
|
Азербайджанская Республика |
Азгосстандарт |
|
Республика Армения |
Армгосстандарт |
|
Беларусь |
Госстандарт Республики Беларусь |
|
Грузия |
Грузстандарт |
|
Республика Казахстан |
Госстандарт Республики Казахстан |
|
Кыргызская Республика |
Кыргызстандарт |
|
Республика Молдова |
Молдовастандарт |
|
Российская Федерация |
Госстандарт России |
|
Республика Таджикистан |
Т аджикстандарт |
|
Туркменистан |
Главгосслужба «Туркменстандартлары» |
|
Республика Узбекистан |
Узгосстандарт |
|
Украина |
Госстандарт Украины |
3 Постановлением Еосударственного комитета Российской Федерации по стандартизации и метрологии от 27 июля 2001 г. № 297-ст межгосударственный стандарт РОСТ 30726—2001 введен в действие в качестве государственного стандарта Российской Федерации с 1 июля 2002 г.
4 ВВЕДЕН ВПЕРВЫЕ
5 ПЕРЕИЗДАНИЕ. Апрель 2010 г.
© ИПК Издательство стандартов, 2001 © СТАНДАРТИНФОРМ, 2010
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания на территории Российской Федерации без разрешения Федерального агентства по техническому регулированию и метрологии
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТПРОДУКТЫ ПИЩЕВЫЕ Методы выявления и определения количества бактерий вида Escherichia coli
Food-stuffs. Methods for detection and determination of Escherichia coli
Дата введения 2002—07—01
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и устанавливает метод выявления в определенной навеске пищевого продукта бактерий вида Escherichia coli (E.coli) и три метода определения их количества: метод наиболее вероятного числа (НВЧ) и методы посева в или на агари-зованные селективно-диагностические среды.
Выбор метода определения количества E.coli зависит от предполагаемой обсемененности продукта бактериями семейства Enterobacteriaceae и осуществляется в соответствии с требованиями ЕОСТ 30518*.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ЕОСТ 9284—75 Стекла предметные для микропрепаратов. Технические условия ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 24104-88** Весы лабораторные общего назначения и образцовые. Общие технические условия
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов ГОСТ 29184-91 Продукты пищевые. Методы выявления и определения количества бактерий семейства Enterobacteriaceae
ЕОСТ 30425—97 Консервы. Метод определения промышленной стерильности ГОСТ 30518-97/ГОСТ Р 50474-93 Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)
ГОСТ 30519-97/Р 50480—93*** Продукты пищевые. Метод выявления бактерий рода Salmonella
3 Сущность методов
Методы выявления и определения НВЧ Е.СоИ основаны на высеве определенного количества продукта и (или) разведений навески продукта в жидкую селективную среду с лактозой, инкубировании посевов, учете положительных колб (пробирок), пересеве культуральной жидкости на поверх-
* На территории Российской Федерации действует ГОСТ Р 52816-2007.
** С 1 июля 2002 г. введен в действие ГОСТ 24104-2001. На территории Российской Федерации действует ГОСТ Р 53228-2008.
*** На территории Российской Федерации действует ГОСТ Р 52814-2007 (ИСО 6579:2002).
Издание официальное
ность агаризованной селективно-диагностической среды для дальнейшего подтверждения по биохимическим и культуральным признакам роста принадлежности выделенных колоний к E.coli.
Методы определения количества E.coli посевом в или на агаризованные селективно-диагностические среды основаны на высеве определенного количества продукта или его разведений в или на агаризованную селективно-диагностическую среду, инкубировании посевов, подсчете типичных для E.coli колоний, подтверждении по биохимическим и культуральным признакам роста принадлежности выделенных колоний к E.coli.
4 Отбор и подготовка проб
Отбор и подготовка проб — по ЕОСТ 26668, ЕОСТ 26669.
5 Аппаратура, материалы, реактивы (в т. ч. индикаторы)
Для проведения анализа применяют аппаратуру, материалы и реактивы по ЕОСТ 10444.1 со следующими дополнениями:
весы лабораторные общего назначения по ЕОСТ 24104 с наибольшим пределом взвешивания до 1 кг и допустимой погрешностью ±10 мг (для взвешивания продукта) и весы с наибольшим пределом взвешивания 200 г, 2-го класса точности (для взвешивания реактивов);
микроскоп биологический с приспособлением для фазово-контрастного микроскопирования, обеспечивающий увеличение 900—1000х; петлю бактериологическую; поплавки (трубки Дархема); стекла предметные по ГОСТ 9284;
термостаты с диапазоном рабочих температур 28—55 °С, позволяющие поддерживать заданную температуру с допустимой погрешностью ± 1 °С; бриллиантовый зеленый; генцианвиолет;
желчь говяжью сухую или натуральную; магний сернокислый; метиловый красный; метиловый фиолетовый;
натрий-аммоний фосфорнокислый двузамещенный; сорбит;
феноловый красный; целлобиоза.
6 Подготовка к анализу6.1 Приготовление растворов и реактивов
6.1.1 Реактив Кларка: 0,1 г метилового красного растворяют в 300 см3 этилового спирта и добавляют 200 см3 дистиллированной воды. Реактив хранят в посуде из темного стекла не более 1 мес при температуре (4+2) °С.
6.1.2 Реактивы Ковача и Эрлиха готовят по ГОСТ 30519.
6.1.3 Спиртовой раствор а-нафтола готовят по ГОСТ 30519.
6.1.4 Приготовление индикаторных бумажек для обнаружения индола: 3—5 г парадиметиламино-бензальдегида, 10 см3 концентрированной фосфорной кислоты и 50 см3 этилового спирта тщательно перемешивают в фарфоровой ступке. В полученном растворе смачивают полоски фильтровальной бумаги, высушивают и нарезают узкими полосками шириной около 1 см. Цвет полученных бумажек — желтый. Индикаторные бумажки хранят не более 1 мес в темном месте.
6.1.5 Раствор гидроокиси калия массовой концентрации 400 г/дм3: 40 г гидроокиси калия переносят в мерную колбу вместимостью 100 см3 и растворяют в дистиллированной воде. Раствор доводят до метки.
6.1.6 Реактивы и растворы для окраски по Граму готовят по ГОСТ 10444.1.
ГОСТ 30726-20016.2 Приготовление питательных сред
6.2.1 Бульон лактозный с бриллиантовым зеленым и желчью готовят по ГОСТ 30518.
6.2.2 Бульон Мак-Конки готовят по ГОСТ 30518.
6.2.3 Бульон глюкозо-фосфатный, сухой промышленного производства.
6.2.4 Бульон мясо-пептонный с триптофаном: 0,05 г L-триптофана растворяют в 100 см3 мясо-пептонного бульона, приготовленного по ГОСТ 10444.1, разливают в пробирки по 6—7 см3 и стерилизуют при температуре (121+1) °С в течение 20 мин.
6.2.5 Бульон Хоттингера готовят по ГОСТ 10444.1.
6.2.6 Среду Кесслер готовят по ГОСТ 30518.
6.2.7 Среда Кларка: в 1 дм3 дистиллированной воды при нагревании растворяют 5,0 г пептона,
5,0 г глюкозы, 5,0 г фосфорнокислого двузамещенного калия, охлаждают до 45—55 °С и устанавливают pH таким образом, чтобы после стерилизации он составлял при 25 °С (7,2+0,1). Среду разливают по 5—6 см3 в пробирки и стерилизуют при температуре (121+1) °С в течение 15 мин или дробным методом — текучим паром по 30 мин три дня подряд.
6.2.8 Среда (типа Кл игл ера) для первичной дифференциации энтеробактерий, сухая промышленного производства.
6.2.9 Среда Козера: в 1 дм3 дистиллированной воды при нагревании растворяют 1,5 г фосфорнокислого двузамещенного натрия-аммония, 1,0 г фосфорнокислого однозамещенного калия, 0,2 г сернокислого магния и 2,5 г лимоннокислого натрия, охлаждают до 45—55 °С и устанавливают pH таким образом, чтобы после стерилизации он составлял (7,2+0,1) при 25 °С. Среду стерилизуют при температуре (121+1) °С в течение 15 мин.
После стерилизации к 1 дм3 среды добавляют 10 см3 спиртового раствора бромтимолового синего массовой концентрации 5 г/дм3, затем среду разливают по 6—7 см3 в стерильные пробирки. Приготовленная среда имеет оливково-зеленый цвет.
6.2.10 Среда Симмонса: к среде Козера перед стерилизацией добавляют 18—20 г агара. Среду после стерилизации и добавления раствора бромтимолового синего разливают по 6—7 см3 в стерильные пробирки или в чашки Петри. Среду в пробирках скашивают.
Цитратный агар Симмонса выпускается промышленностью в сухом виде.
6.2.11 Среды с углеводами (среды Гисса) готовят по ГОСТ 10444.1 или используют для приготовления сухие среды промышленного производства.
Допускается сухую среду Гисса с углеводами готовить на основе сухого питательного агара: к 7,3 г сухого питательного агара прибавляют 3,65 г соответствующего углевода (глюкозы, лактозы, целлобиозы или сорбита), 0,38 г натрия фосфорнокислого двузамещенного, 3,65 г натрия хлористого, 0,02 г бромкрезолового пурпурового. Смесь тщательно перемешивают в фарфоровой ступке и хранят герметично закрытой в темном месте. Полученные 15 г порошка рассчитаны на приготовление 1 дм3 среды. При приготовлении среды порошок тщательно размешивают в дистиллированной воде, кипятят 1—2 мин, не допуская пригорания, фильтруют, разливают по 5—6 см3 в пробирки и стерилизуют при температуре (110+1) °С в течение 20 мин или дробным методом — текучим паром по 30 мин три дня подряд. Приготовленная среда имеет фиолетовый цвет.
6.2.12 Среда Эндо, сухая промышленного производства.
6.2.13 Трехсахарный агар готовят по ГОСТ 30519.
6.2.14 Среды из сухих препаратов промышленного производства готовят по прописям, указанным на этикетках.
6.2.15 Тест-системы для биохимической идентификации промышленного производства.
7 Проведение анализа
7.1 Посевы для определения количества E.coli в 1 г (см3) продукта и выявления E.coli в определенной навеске продукта проводят по ЕОСТ 30518.
Посевы на агаризованной и жидких средах инкубируют при температуре (36+1) °С в течение 24—48 ч. Чашки Петри инкубируют дном вверх. Посевы просматривают через (24+3) ч, отмечают положительные посевы в жидких средах, а окончательный учет проводят через (48+3) ч.
Положительными считают посевы в жидкие среды, в которых имеет место рост микроорганизмов, проявляющийся в помутнении среды, образовании газа, подкислении среды (то есть изменении цвета среды).
107
7.2 Для подтверждения принадлежности микроорганизмов, выросших в жидких средах, к E.coli делают пересевы по ГОСТ 26670 на поверхность среды Эндо, приготовленной по 6.2.12.
Посевы инкубируют при температуре (36+1) °С в течение (24+3) ч.
7.3 Посевы на агаризованной среде по 7.1 и 7.2 просматривают после инкубирования и отмечают рост характерных для E.coli колоний.
На среде Эндо E.coli образуют колонии от бледно-розового до темно-красного цвета часто с металлическим блеском.
Для дальнейшего подтверждения принадлежности выросших колоний к E.coli отбирают по три колонии каждого типа.
Из отобранных колоний приготавливают мазки, окрашивают их по Ераму по ЕОСТ 30425. Параллельно в каждой отобранной колонии у бактерий по ЕОСТ 29184 определяют отсутствие оксидазы.
Оксидазоотрицательные бактерии пересевают на поверхность мясо-пептонного агара или среды, приготовленной из сухого питательного агара. Посевы инкубируют до появления видимого роста при температуре (36+1) °С.
7.4 У оксидазоотрицательных грамотрицательных культур (палочки размером 1, Н1,5 х 2^6 мкм), выросших в пересевах по 7.3, определяют возможность образования индола, ацетоина, сероводорода, утилизации цитрата, интенсивность ферментации углеводов с образованием кислоты, ферментацию сорбита, глюкозы и лактозы.
7.4.1 Определение образования индола
Культуру высевают в пробирку с бульоном Хоттингера, приготовленным по 6.2.5, или мясо-пептонным бульоном с триптофаном, приготовленным по 6.2.4. Под пробку в пробирку помещают полоску индикаторной бумажки, приготовленной по 6.1.4. Посевы инкубируют при температуре (36+1) °С в течение 24 ч. Если за время инкубирования посевов в среде накапливается индол, то желтый цвет индикаторной бумажки меняется на цвет от сиренево-розового до интенсивного малинового.
Образование индола можно определить с помощью реактивов Эрлиха и Ковача, приготовленных по 6.1.2. Для этого к 5 см3 24-часовой культуры добавляют 1 см3 одного из реактивов. Образование красного слоя на поверхности культуральной жидкости указывает на положительную реакцию.
Е.соИ образует индол.
7.4.2 Определение образования ацетоина (реакция Фогес-Проскауэра)
Культуру высевают в пробирки со средой Кларка, приготовленной по 6.2.7. Посевы инкубируют при температуре (36+1) °С в течение 48 ч.
После инкубирования посевов к 1 см3 отобранной культуральной жидкости прибавляют 0,6 см3 раствора а-нафтола, приготовленного по 6.1.3, и 0,2 см3 раствора гидроокиси калия, приготовленного по 6.1.5. После прибавления каждого реактива пробирку встряхивают. Появление розового окрашивания через 15—60 мин указывает на положительную реакцию.
Е.соИ не образует ацетоин.
7.4.3 Определение утилизации цитрата
Культуру высевают в пробирки со средой Козера, приготовленной по 6.2.9, или на поверхность среды Симмонса, приготовленной по 6.2.10. Посевы инкубируют при температуре (36+1) °С в течение 24—48 ч. Изменение оливково-зеленого цвета сред на васильковый, синий указывает на положительную реакцию.
Е.соИ не утилизирует цитрат.
7.4.4 Определение интенсивности ферментации углеводов с образованием кислоты (реакция с метил-рот)
Культуру высевают в пробирки с глюкозо-фосфатным бульоном или средой Кларка или используют посевы после отбора 1 см3 культуральной жидкости по 7.4.2. Посевы инкубируют при температуре (36+1) °С в течение 48 ч. К 5 см3 культуральной жидкости прибавляют 5—10 капель реактива Кларка, приготовленного по 6.1.1. Появление через 1 мин красного цвета культуральной жидкости указывает на ферментацию углеводов до pH ниже 5,0.
Е.соИ интенсивно ферментирует углеводы (реакция с метил-рот положительная).
7.4.5 Определение ферментации сорбита, глюкозы и лактозы
Культуру высевают в среды Еисса с сорбитом или глюкозой, или лактозой приготовленные по 6.2.11. Посевы инкубируют при температуре (36+1) °С в течение 24 ч, а на среде Еисса с лактозой при температуре (44+1) °С в течение 24 ч.
108
ГОСТ 30726-2001
E.coli ферментирует глюкозу, лактозу и сорбит.
При ферментации глюкозы образуется газ. Ферментацию глюкозы можно учитывать в засеянных косяках трехсахарного агара или среды Кл игл ера по изменению цвета столбика среды и образованию в нем газа.
Ферментацию лактозы учитывают по изменению цвета скошенной поверхности среды Кл игл ера.
Ферментацию сорбита учитывают по изменению цвета среды.
У культур типичных для E.coli по всем изученным признакам, но не ферментирующим сорбит, изучают возможность ферментации целлобиозы на среде, приготовленной по 6.2.11, при температуре (36+1) °С в течение 24 ч. E.coli не ферментирует целлобиозу, цвет среды не меняется.
7.4.6 Определение образования сероводорода
Образование сероводорода учитывают в посевах на среду Кл игл ера или трехсахарный агар после инкубирования посевов при температуре (36+1) °С в течение 24 ч. Почернение в столбике среды указывает на образование сероводорода.
E.coli не образует сероводород.
7.4.7 Для биохимической идентификации выявленных бактерий допускается использование тест-систем промышленного производства.
8 Обработка результатов анализа
8.1 Результаты оценивают по каждой пробе отдельно.
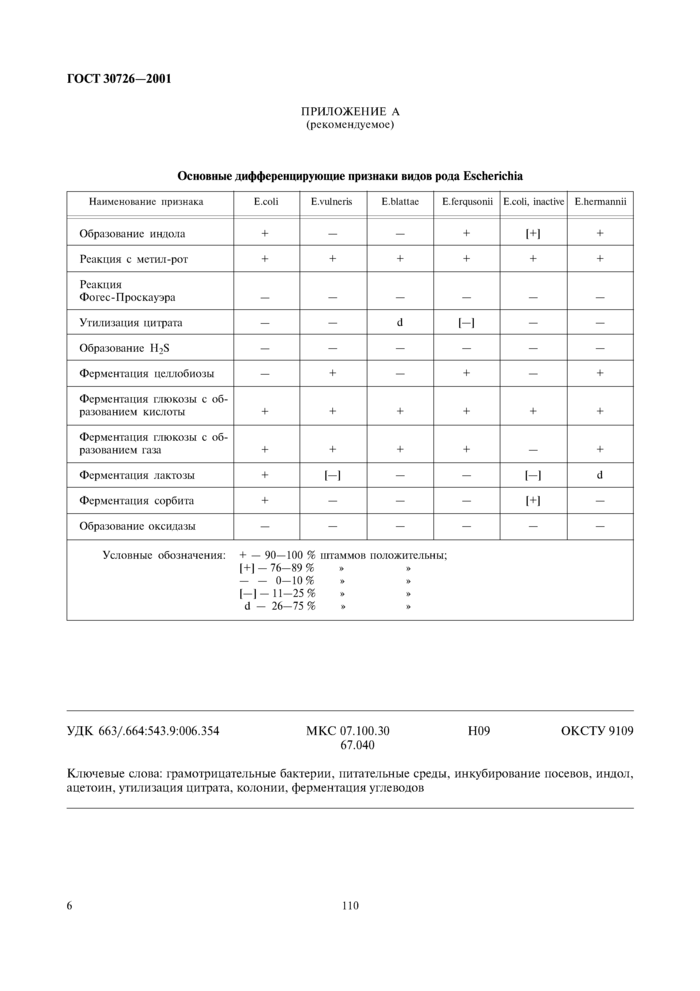
8.2 К бактериям E.coli относят оксидазоотрицательные не образующие спор грамотрицательные палочки, обладающие способностью ферментации лактозы при температуре (44+1) °С, ферментирующие глюкозу и сорбит, дающие положительную реакцию с метил-рот, образующие индол, необразующие ацетоин и не утилизирующие цитрат. Бактерии не ферментирующие сорбит и целлобиозу, но по другим биохимическим признакам давшие типичные для E.coli реакции, относят к сорбитотрицатель-ным штаммам E.coli. Основные дифференцирующие признаки видов рода Escherichia приведены в приложении А.
8.3 Посевы навески продукта в жидкие среды считают положительными, если при последующем пересеве и подтверждении характерных колоний хотя бы в одной колонии будут обнаружены Е.соИ.
8.4 НВЧ E.coli в 1 г (см3) продукта определяют по количеству положительных колб (пробирок) по ЕОСТ 26670.
8.5 Если при подтверждении характерных колоний (при определении количества E.coli посевом «в» или «на» агаризованные среды) в 66 % случаев, то есть не менее чем в 2 из 3 колоний, подтвержден рост E.coli, то считают, что все характерные колонии, выросшие на чашке Петри (см. 7.3), принадлежат к E.coli. В остальных случаях количество E.coli определяют, исходя из процентного отношения подтвержденных колоний к общему количеству характерных колоний, взятых для подтверждения.
Пересчет количества E.coli, определенного посевом в (или «на») агаризованные среды, на 1 г (см3) продукта проводят по ЕОСТ 26670.
8.6 Результаты определения количества Е.соИ и выявления их в определенной навеске продукта записывают по ЕОСТ 26670.
109
ПРИЛОЖЕНИЕ А
(рекомендуемое)
|
Основные дифференцирующие признаки видов рода Escherichia |
|
Наименование признака |
E.coli |
E.vulneris |
E.blattae |
E.ferqusonii |
E.coli, inactive |
E.heimannii |
|
Образование индола |
+ |
— |
— |
+ |
[+] |
+ |
|
Реакция с метил-рот |
+ |
+ |
+ |
+ |
+ |
+ |
|
Реакция
Фогес - Проскауэра |
— |
— |
— |
— |
— |
— |
|
Утилизация цитрата |
— |
— |
d |
[-] |
— |
— |
|
Образование H2S |
— |
— |
— |
— |
— |
— |
|
Ферментация целлобиозы |
— |
+ |
— |
+ |
— |
+ |
|
Ферментация глюкозы с образованием кислоты |
+ |
+ |
+ |
+ |
+ |
+ |
|
Ферментация глюкозы с образованием газа |
+ |
+ |
+ |
+ |
— |
+ |
|
Ферментация лактозы |
+ |
[-] |
— |
— |
[-] |
d |
|
Ферментация сорбита |
+ |
— |
— |
— |
[+] |
— |
|
Образование оксидазы |
— |
— |
— |
— |
— |
— |
|
Условные обозначения: + — 90—100 % штаммов положительны;
[+] - 76-89 % » »
- - 0-10% » »
[-]-11-25% » » d - 26-75 % » » |
|
УДК 663/.664:543.9:006.354 МКС 07Л00.30 Н09 ОКСТУ9Ю9
67.040
Ключевые слова: грамотрицательные бактерии, питательные среды, инкубирование посевов, индол, ацетоин, утилизация цитрата, колонии, ферментация углеводов