ГОСТ 30519-97
Продукты пищевые. Метод выявления бактерий рода Sаlmоnеllа
Купить ГОСТ 30519-97 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на пищевые продукты и устанавливает метод выявления в определенной навеске продукта бактерий рода Salmonella.
Переиздание
Оглавление
1 Сущность метода
2 Отбор и подготовка проб
3 Аппаратура, материалы, реактивы
4 Подготовка к анализу
4.1 Приготовление растворов и реактивов
4.2 Приготовление питательных сред
5 Проведение анализа
5.1 Неселективное предварительное обогащение
5.2 Селективное обогащение
5.3 Выделение и идентификации культур на агаризованных дифференциально-диагностических средах
5.4 Биохимическое подтверждение принадлежности выделенных характерных колоний к бактериям рода Salmonella
5.6 Серологическое подтверждение принадлежности культур к бактериям рода Salmonella
6 Оценка результатов
Приложение (обязательное) Биохимическая характеристика четырех подродов Salmonella и атипичных видов, входящих в подрод Salmonella I
| Дата введения | 16.04.1998 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.07.2020 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел Электроэнергия
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
Организации:
| 23.04.1997 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 11 |
|---|---|---|---|
| 16.04.1998 | Утвержден | Госстандарт России | 122 |
| Разработан | ВНИИКОП | ||
| Разработан | ТК 93 Продукты переработки плодов и овощей | ||
| Издан | ИПК Издательство стандартов | 2001 г. |
Food products. Method for detection of Salmonella
ГОСТ 24104-88Весы лабораторные общего назначения и образцовые. Общие технические условия. Заменен на ГОСТ 24104-2001.- ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
- ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
- ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
- ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
- ГОСТ 4209-77 Реактивы. Магний хлористый 6-водный. Технические условия
- ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
- ГОСТ 6691-77 Реактивы. Карбамид. Технические условия
- ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9536-79Спирт изобутиловый технический. Технические условия. Заменен на ГОСТ 9536-2013.- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ Метод выявления бактерий рода Salmonella
Издание официальное
МКЖГОСУДАРСТВКННЫЙ СОВЕТ НО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ Минск
Предисловие
1 РАЗРАБОТАН И ВНЕСЕН Всероссийским научно-исследовательским институтом консервной и овощссушилыюй промышленности (ВНИИКОП) и Техническим комитетом по стандартизации ТК 93 «Продукты переработки плодов и овощей*
2 ПРИНЯТ Межгосударстветшым советом по стандартизации, метрологам и сертификации (протокол № 11 от 23 апреля 1997 г.)
За принятие проголосовали:
|
Наименование государства |
Наименование национального органа по стандартны ни и |
|
Республика Беларусь |
Госстандарт Республики Беларусь |
|
Республика Казахстан |
Госстандарт Республики Казахстан |
|
Кыргызская Республика |
Кыргызстандарт |
|
Республика Молдова |
Молдова стандарт |
|
Российская Федерация |
Госстандарт России |
|
Республика Таджикистан |
Таджик госстандарт |
|
Туркменистан |
Главгосинспекция «Туркменстандартлары» |
|
Республика Узбекистан |
Узгос стандарт |
3 Постановлением Госстандарта России от 16 апреля 1998 г. № 122 ГОСТ 30519-97 введен в действие в качестве государственного стандарта Российской Федерации с момента принятия указанного постановления и признан имеющим одинаковую силу с ГОСТ Р 50480-93 на территории Российской Федерации в связи с полной аутентичностью их содержания
4 ВВЕДЕН ВПЕРВЫЕ
5 ПЕРЕИЗДАНИЕ
II
Настоящий стандарт нс может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания на территории Российской Федерации без разрешения Федерального агентства по техническому регулированию и метрологии
79
Группа Н09
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ГОСТ 30519-97 ГОСТ P 50480-93
ПРОДУКТЫ ПИЩЕВЫЕ
Метол выявления бактерий рола Salmonella
Food products.
Method for detection of Salmonella
МКС 07.100.30 ОКСТУ 9109
Дата введения 1994—01—01
Настоящий стандарт распространяется на пищевые продукты и устанавливает метод выяате-ния в определенной навеске продукта бактерий рода Salmonella.
1 Сущность метола
Метод выяапсния бактерий рода Salmonella основан на высеве определенного количества продукта в жидкую неселективную среду, инкубировании посевов, последующем выя&лении в этих посевах бактерий, способных развиваться в жидких селективных средах, образующих типичные колонии на агаризованных дифференциально-диагностических средах, имеющих типичные для бактерий рода Salmonella биохимические и серологические характеристики.
2 Отбор и подготовка проб
Отбор и подготовка проб — по ГОСТ 26668, ГОСТ 26669 или по нормативно-технической документации на анализируемый продутег.
3 Аппаратура, материалы, реактивы
Для проведения анализа применяют аппаратуру, материалы и реактивы по ГОСТ 10444.1, а также указанные ниже:
весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 241041 2 с наибольшим пределом взвешивания 200 г, 2-го класса точности (для взвешивания реактивов);
весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 24104 с наибольшим пределом взвешивания I кг, 4-го класса точности (для взвешивания продукта); микроскоп световой биологический с увеличением 900—1000'; петлю бактериологическую; стекла предметные по ГОСТ 9284; стекла покровные по ГОСТ 6672;
термостат с диапазоном рабочих температур 28 2С—55 2С, позволяющий поддерживать заданную температуру с допустимой погрешностью ±1 2С. спирт изобугиловый по ГОСТ 9536; бриллиа>гговый зеленый; желчь сухую или натуральную;
• С 1 июля 2002 г. введен в действие ГОСТ 24104-2001 (здесь и далее).
контрольный штамп бактерий рола Salmonella , не относящихся к тифозной группе;
магний хлористый по ГОСТ 4209;
мочевину по ГОСТ 6691;
сухие агглютинирующие адсорбированные поливалентные сальмонеллезные сыворотки основных групп А, В, С, D, Е и редких групп;
феноловый красный.
4 Подготовка к анализу
4.1 Приготовление растворов и реактивов
4.1.1 Раствор бриллиантового зеленого концентрации 5 г/дм3: 0.5 г бриллиантового зеленого переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см3 и доводят дистиллированной водой до метки. Раствор хранят в закрытом сосуде из темного стекла при комнатной температуре нс более 3 мсс.
4.1.2 Раствор фенолового красного концентрации 4 г/дм3:0.4 г фенолового красного переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см3 и доводят дистиллированной водой до метки. Раствор хранят в закрытом сосуде из темного стекла при комнатной температуре не более 3 мсс.
4.1.3 Реактив Эрлиха: 1,0 г парадиметиламинобензальдегида растворяют в 95 см3 этилового спирта объемной концентрации 96 % и прибавляют 80 см3 концентрированной соляной кислоты (р = 1,18-1,19 г/см3).
4.1.4 Реактив Ковача: перемешивают 5,0 г парадиметиламинобензальдегида, 25 см3 концентрированной соляной кислоты и 75 см3 изобутилового спирта.
4.1.5 Спиртовой раствор ос-нафтола концентрации 50 г/дм3: 5,0 г а-нафтола помещают в колбу вместимостью 100 см3, растворяют в этиловом спирте объемной концентрации 96 % и доводят раствор этиловым спиртом до метки. Раствор готовят непосредственно перед применением.
4.1.6 Спиртовой раствор фенолового красного концентрации 2 г/дм3:0,2 г фенолового красного переносят в колбу вместимостью 100 см3, растворяют в этиловом спирте объемной концентрации 50 % и доводят раствор этиловым спиртом до метки.
4.1.7 Сухие агглютинирующие адсорбционные поливалс1гтныс сальмонеллезные сыворотки готовят перед употреблением по прописи, указанной в прилагаемом к ним наставлении.
4.2 Приготовление питательных сред
4.2.1 Забуфсрснная пептонная вода: 10,0 г пептона, 5,0 г хлористого натрия, 9,0 г двузамещенно-го фосфорно-кислого натрия (Na2HP04 • 12Н20), 1,5 г однозамещенного фосфорно-кислого калия растворяют при нагревании в 1000 см3 дистиллированной воды, устанавливают pH так, чтобы после стерилизации он составлял при температуре 25 *С 7,0±0,1. Разливают по колбам в количестве, ■зависящем от навески анализируемого продукта (если навеска равна 25 г, то разливают по 225 см3, то есть I : 9), и стерилизуют при температуре (121 ±1) *С в течение 20 мин.
4.2.2 Магниевая среда: готовят путем соединения трех растворов.
Приготовление раствора 1:8,4 г пегтгона, 14,3 г хлористого натрия, 40 см3 дрожжевого экстракта, приготовленного по ГОСТ 10444.1,2,85 г однозамещенного фосфорно-кислого калия растворяют при нагревании в 1780 см3 дистиллированной воды.
Приготовление раствора 2: 71,4 г хлористого магния (MgCI2 • 6Н20) растворяют при нагревании в 180 см3 дистиллированной воды.
Раствор 3: берут 1,8 см3 раствора бриллиантового зеленого, приготовленного по 4.1.1.
Приготовленные растворы соединяют, устанавливают pH так, чтобы после стерилизации он составлял при температуре 25 “С 7,2±0,2, рахливают в колбы или флаконы по 100 см3 и стерилизуют при температуре (112± 1) *С в течение 30 мин.
4.2.3 Селенитовая среда: готовят из двух растворов.
Приготовление раствора 1: 5,0 г пептона, 7,0 безводного двузамещенного фосфорно-кислого натрия, 3,0 г безводного однозамещенного фосфорно-кислого натрия, 4,0 г лактозы растворяют при нагревании в 1000 см3 дистиллированной воды, охлаждают до 45 *С —55 ‘С, если необходимо, путем изменения соотношения фосфатных солей устанавливают pH 7,0±0,1. Среду разливают по 100 см3 в колбы или флаконы и стерилизуют текучим паром по 30 мин в течение двух дней или при температуре (112± 1) *С в течение 30 мин.
Приготоалснис раствора 2: 10,0 г кислого сслснисто-кислого натрия (NaMScOj) растворяют асептически в 100 см3 стерильной дистиллированной воды. Раствор готовят непосредственно перед употреблением.
Приготоатение среды: к 100 см3 раствора 1 прибавляют 4 см3 раствора 2.
Стерилизация приготоатенной среды нс допускается, так как при этом происходит редукция кислого селенисто-кислого натрия, выпадает осадок красного цвета и среда становится непригодной. Селенитовая среда выпускается в сухом виде и готовится по прописи, указанной на этикетке.
4.2.4 Тетратионатная среда (Мю.иер-Кауфман)
Приготоатение основы среды: в 100 см3 мясо-псптонного бульона, приготоатенного по ГОСТ 10444.1, помещают 4,5 г стерильного углекислого кальция. Углекислый кальций стерилизуют по ГОСТ 10444.1.
Приготоатенную основу стерилизуют при температуре (121 ±1) *С в течение 20 мин.
При приготоатении среды к 100 см3 основы среды асептически прибаатяют:
10 см3 раствора гипосульфита натрия (Na^Oj • 5Н20);
2 см3 йодного раствора;
0,2 см3 раствора бриллиантового зеленого;
5 см3 раствора желчи.
Указанные растворы прибаатяют к основе среды в приведенном выше порядке, перемешивая смесь после каждого прибаатения.
Среду допускается испотьзовать в течение одной недели посте приготоатсния.
Указанные выше растворы, прибаатяемые к основе среды, готовят следующим образом: раствор гипосульфита натрия: 50,0 г гипосульфита натрия помещают в колбу вместимостью 100 см3, растворяют в дистиллированной воде и доводят дистиллированной водой до метки. Раствор перстивают в колбу или флакон и стерилизуют текучим паром в течение 30 мин или при температуре (121 ± 1) *С в течение 20 мин;
йодный раствор: 25,0 йодистого катия помещают в колбу вместимостью 100 см3, растворяют в небольшом количестве дистиллированной воды, прибавляют 20,0 г кристаллического йода, растворяют его. Объем раствора доводят дистиллированной водой до метки.
Раствор хранят в плотно закрытом темном сосуде; раствор бриллиантового зеленого готовят по 4.1.1;
раствор желчи: 10,0 г сухой желчи растворяют в 100 см3 дистиллированной воды или используют натуральную желчь. Раствор желчи или натуральную желчь стерилизуют при температуре (121 ± 1) *С в течение 20 мин.
4.2.5 Дифференциально-диагностические среды (сухие): висмут-сульфит агар (Вильсон-Блсра);
среду Плоскирсва; среду Эндо; среду Левина.
Среды готовят по прописи, указанной на этикетке.
4.2.6 Трехсахарный агар: 10,0 г пептона, 3,0 г сухого дрожжевого экстракта или 15 см3 дрожжевого экстракта, приготовленного по ГОСТ 10444.1, 10,0 г лактозы, 10,0 г сахарозы, 1,0 г глюкозы, 0,3 г цитрата железа (или 0,2 г аммоний-железо сульфата (NH4)2Fc(S04)2 • 6Н20 или 0,2 г сернокислого железа FcS04 • 6Н20), 0,3 г гипосульфита натрия, 6 см3 раствора фенолового красного, приготовленного по п. 4.1.2, 15,0 г агара растворяют при нагревании в 1000 см3 мясо-псптонного бульона, приготовленного по ГОСТ 10444.1, охлаждают до 45 *С—55 *С и устанавливают pH так, чтобы после стерилизации он составлял при температуре 25 *С 7,2±0,2. Среду разливают в пробирки по 6—7 см3 и стерилизуют при температуре (121 ± 1) *С в течение 10 мин.
4.2.7. Агар Кристенсена с мочевиной: среда готовится путем соединения основы среды и раствора мочевины.
Основа среды: 1,0 г пептона, 1,0 г глюкозы, 5,0 г хлористого натрия, 2,0 г безводного однозамс-шенного фосфорнокислого калия, 3 см3 раствора фенолового красного, приготовленного по 4.1.2, 15,0 агара растворяют при нагревании в 1000 см3 дистиллированной воды, охлаждают до 45 *С—55 ‘С и устанавливают pH так, чтобы после стерилизации он составлял при температуре 25 *С 6,7±0,1.
Основу среды мерно рахпивают в колбы или флаконы и стерилизуют при температуре (121 ± I) *С в течение 20 мин.
Раствор мочевины концентрации 400 г/дм3: 40,0 г мочевины помешают в колбу вместимостью 100 см3, растворяют в дистиллированной воде, объем раствора доводят дистиллированной водой до метки.
82
Раствор мочевины стерилизуют фильтрацией по ГОСТ 26670 или текучим паром в течение 30 мин.
При приготоапснии среды к 950 см3 основы прибаатяют асептически 50 см3 раствора мочевины, разливают в стерильные пробирки по 6—7 см3.
4.2.8 После стерилизации среды, приготоапенные по 4.2.6 и 4.2.7, скашивают так, чтобы оставался столбик высотой 2—2,5 см.
4.2.9. Полужидкий мясо-пептонный агар: готовят по ГОСТ 10444.1 так же, как мясо-псптонный агар, но при приготоапснии добаапяют 4,0—8,0 г агара на 1000 см3 мясо-псптонного бульона, перед стерилизацией среду разливают по 6—7 см3 в пробирки.
4.2.10 Мясо-псптонный бульон с глюкозой: готовят по ГОСТ 10444.1. Для посевов используют среду, разлитую в пробирки по 6—7 см3.
4.2.11 Бульон Хоттингера: готовят по ГОСТ 10444.1. Для посевов используют среду, разлитую в пробирки по 6—7 см3.
4.2.12 Мясо-пептонный бульон с 0,05 % L-триптофана: 0,05 L-триптофана растворяют в 100 см3 мясо-псптонного бульона, приготовленного по ГОСТ 10444.1, разливают в пробирки по 6—7 см3 и стерилизуют при температуре (121 ± 1) *С в течение 20 мин.
4.2.13 Среды с углеводами (среды Гисса): готовят по ГОСТ 10444.1 или используют сухие среды с углеводами, которые готовят по прописи, указанной на этикетке.
4.2.14 Мясо-пептонный агар: готовят по ГОСТ 10444.1 или испапьзуют среду, приготоапенную из сухого питательного агара.
Среду из сухого питательного агара готовят по прописи, указанной на этикетке.
5 Проведение анализа
5.1 Нссслсктивнос предварительное обогащение
Навеску продукта, в массе (объеме) которой нормативно-технической документацией на анапи-зирусмый продукт предусматривается отсутствие бактерий рода Salmonella, высевают в забуференную пептонную воду, приготовленную по 4.2.1. Соотношение массы (объема) продукта и забуференной пептонной воды I : 9.
При посеве жидких высококислотных продуктов для предотвращения снижения pH питательных сред на 0,5 и более pH продукта перед посевом доводят до 7,0±0,2.
При посеве твердых высококислотных продуктов доводят pH до 7,0±0,2 в посевах.
Доведение pH проводят асептически с помощью стерильных растворов гидроксида натрия и соляной кислоты, приготоапенных по ГОСТ 10444.1. Количество добаапясмого раствора гидроксида натрия устанавливают опытным путем.
Посевы инкубируют при температуре (36±1) *С в течение 18—20 ч.
5.2 Селективное обогащение
Культуры, полученные после инкубирования по 5.1, пересевают в две среды для селективного обогащения. Для этого по 10 см3 культуры переносят в 100 см3 магниевой среды, приготовленной по 4.2.2, и в 100 см3 тстратионатной среды, приготоапенной по 4.2.4, или по 10 см3 культуры переносят в 100 см3 селенитовой среды, приготовленной по 4.2.3, и в 100 см3 тстратионатной среды.
Посевы инкубируют в течение 24—48 ч на магниевой и селенитовой средах при температуре (36±1) *С, а на тстратионатной среде при температуре (43±1) *С.
5.3 Выделение и идентификация культур на авизованных дифференциально-диагностических средах
Культуры через 24 и 48 ч инкубирования по 5.2 пересевают (по ГОСТ 26670) на три авизованные среды, приготоапенные по 4.2.5: висмут-сульфит агар, среду Плоскирева и среду Эндо (или среду Левина).
Допускается использование одной чашки каждой из сред одновременного высева с двух селективных сред.
Посевы инкубируют при температуре (36±1) ‘С в течение 24 • —48 ч.
После 24 ч инкубирования посевов проводят предварительный учет результатов, а после 48 ч — окончательный.
После инкубирования посевов отмечают на дифферсшшально-лиапюстических средах рост колоний, характерных для бактерий рода Salmonella:
4
на висмут-сульфит агаре колонии черные с характерным металлическим блеском, а также зеленоватые с темнозеленым ободком и с пигментированием среды под колониями;
83
на среде Плоскирсва колонии бесцветные прозрачные, но более плотные, чем на среде Эндо;
на среде Эндо колонии круглые бесцветные или слегка розоватые, прозрачные;
на среде Левина колонии прозрачные, слабо-розовые или розовато-фиолетовые.
При отсутствии в посевах на дифференииалыю-диагностических средах характерных для бактерий рода Salmonella колоний дают заключение об отсутствии бактерий рода Salmonella в анализируемой навеске продукта.
При наличии хотя бы на одной диффсрснциально-диапсостичсской среде характерных для бактерий рола Salmonella колоний проводят их дальнейшее изучение.
5.4 Биохимическое подтверждение принадлежности выделенных характерных колоний к бактериям рода Salmonella
5.4.1 Нс менее трех характерных колоний с каждой дифференциально-диагностической среды (см. 5.3) пересевают на скошенную поверхность мясо-псптонного агара или среды из сухого питательного агара, приготовленных по 4.2.14, и часть колоний пересевают штрихом по поверхности и уколом в столбик трехсахарного агара, приготовленного по 4.2.6.
Посевы инкубируют при температуре (36±1) *С в течение 24 ч.
5.4.2 Из отобранных по 5.4.1 для биохимического подтверждения колоний приготовляют мазки и окрашивают по Граму.
Бактерии рода Salmonella являются грамоотри нательным и палочками с закругленными концами.
5.4.3 После инкубирования посевов, как указано в 5.4.1, проводят учет результатов ферментации лактозы, глюкозы и сахарозы на трехсахарном агаре:
пожелтение скошенной части среды указывает на ферментацию лактозы или сахарозы или обоих сахаров;
пожелтение столбика среды с разрывом агара или пузырьками газа указывает на ферментацию глюкозы с образованием газа, пожелтение столбика среды без разрывов или пузырьков газа указывает на ферментацию глюкозы без образования газа;
почернение среды в столбике указывает на образование сероводорода.
Типичными для бактерий рода Salmonella являются культуры, ферментирующие глюкозу с образованием или без образования газа, не фсрмс1гтирующие лактозу и сахарозу, образующие сероводород.
Дальнейшему изучению подвергают также лактозоположитсльныс бактерии или бактерии, нс образующие сероводород, но обязательно ферментирующие глюкозу с образованием или без образования газа.
5.4.4 У культур, отобранных согласно 5.4.3 и пересеянных предварительно, как указано в 5.4.1, на поверхность мясо-псптонного агара или среды, приготовленной из сухого питательного агара, изучают возможность расщепления мочевины, образования ацетоина и индола, ферментации сахарозы и маннита и подвижность.
5.4.5 Определение расщепления мочевины
Культуры пересевают штрихом на поверхность агара Кристенсена с мочевиной, приготовленного по 4.2.7.
Посевы инкубируют при температуре (36±1) *С в течение 24 ч.
При положительной реакции — расщеплении мочевины цвет среды от розового до светло-вишневого. Для урсазоположитсльных бактерий реакция часто становится видимой после 2 ч инкубирования.
Бактерии рода Salmonella не расщепляют мочевину.
5.4.6 Определение образования ацетоина (реакция Фогес-Проскауера)
Культуры пересевают в мясо-псптонный бульон с глюкозой, приготовленный по 4.2.10.
Посевы инкубируют при температуре (36± 1) *С в течение 48 ч.
После инкубирования к 1 см3 отобранной культуральной жидкости прибавляют 0,6 см3 раствора а-нафтола, приготовленного по 4.1.5, 0,2 см3 раствора гидроксида калия концентрации 400 г/дм3. После прибавления каждого реактива пробирку встряхивают. Появление розового окрашивания через 15 мин указывает на положительную реакцию.
Бактерии рода Salmonella нс образуют ацетоина (реакция Фогес-Проскауера отрицательная).
5.4.7 Определение образования индола
Культуры пересевают в бульон Хоттингера, приготовленный по 4.2.11, или в мясо-псптонный бульон с L-триптофаном, приготовленный по 4.2.12.
Посевы инкубируют при температуре (36±1) *С в течение 24 ч.
После инкубирования к посевам прибавляют по I см3 реактива Эрлиха или Ковача, приготовленных соответственно по 4.1.3 и 4.1.4.
Образование красного слоя указывает на положительную реакцию.
Бактерии рода Salmonella не образуют индол.
84
РОСТ 30519—97/ГОСТ Р 50480-93
5.4.8 Определение ферментации маннита и сахарозы
Культуры пересевают в среды Гисса с маннитом или сахарозой, приготовленные по 4.2.13.
Посевы инкубируют при температуре (36±1) *С в течение 24 ч.
Бактерии рола Salmonella нс сбраживают сахарозу, нс сбраживают маннит. При сбраживании маннита цвет среды изменяется, образуется или не образуется газ.
5.4.9 Определение подвижности
Культуры пересевают уколом в полужидкий мясо-пептонный агар.
Посевы инкубируют при температуре (36±1) *С в течение 24 ч.
При росте подвижных культур отмечается диффузный рост по всему столбику агара, при росте неподвижных культур — вдоль места укола.
Большинство штаммов бактерий рода Salmonella подвижны.
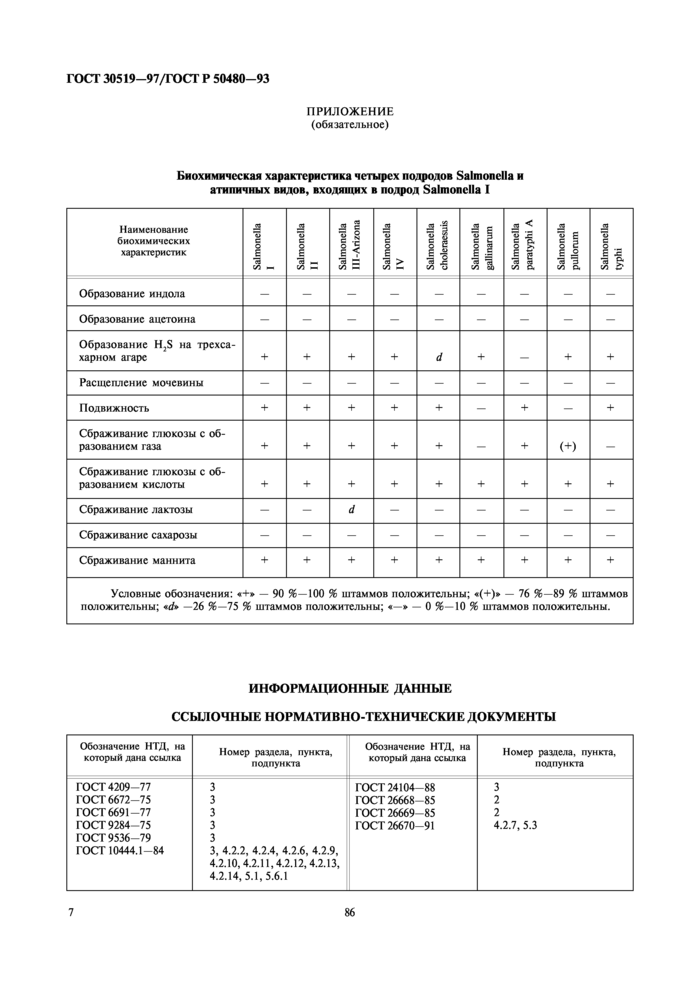
5.5 Результаты биохимического подтверждения культур оценивают, пользуясь таблицей приложения.
5.6 Серологическое подтверждение принадлежности культур к бактериям рода Salmonella
Серологическое подтверждение принадлежности к бактериям рода Salmonella проводят с культурами, давшими типичные биохимические реакции согласно приложению, и предварительно пересеянными, как указано в 5.4.1, на поверхность мясо-пептонного агара или среды, приготовленной из сухого питательного агара.
5.6.1 Определение самоаггл ют ин ирующих штаммов
Помещают каплю физиологического раствора, приготовленного по ГОСТ 10444.1, на тщательно очищенное предметное стекло. Диспергируют в этой капле часть тестируемой колонии так, чтобы получилось гомогенная и густая суспензия.
Покачивают осторожно стекло в течение 30—60 с. Отмечают результаты на темном фоне, лучше с помощью увеличительного стекла. Если наблюдается в разной степени склеивание бактерий, то есть образование осадка, то считают, что тестируемые штаммы обладают самоагглютинацисй.
Штаммы бактерий, обладающие самоагглютинацисй, не подвергают дальнейшей серологической идентификации.
5.6.2 Onpede.ienue наличия 0-антигенов
Штаммы, у которых не выявлено самоагглютинании, испытывают в реакции агглютинации с агглютинирующими адсорбированными поливалентными сальмонсллсзными сыворотками основных групп А, В, С, D, Е, а затем, если не выявлено 0-антигенов с сыворотками основных групп, ставят реакцию с сыворотками редких групп.
Подготовка сывороток к постановке реакции агглютинации и методика ее проведения указаны в наставлении, прилагаемом к сывороткам.
Агглютинация (наличие 0-антигенов) проявляется в виде склеивания бактериальной массы и полного или частичного просветления жидкости.
При отрицательной реакции агглютинации культура после тщательного смешивания с каплей сыворотки образует гомогенную смесь.
5.7 При определении биохимических и серологических характеристик выделенных культур в качестве контроля используют типичный по этим показателям штамп бактерий рода Salmonella, указанный в разделе 3.
6 Оценка результатов
6.1 Результаты оценивают по каждой пробе отдельно.
6.2 Интерпретация биохимических и серологических испытаний
Культуры, показавшие типичные биохимические и серологические реакции, относят к бактериям рода Salmonella.
Предположительно к бактериям рода Salmonella относят:
культуры, у которых нс обнаружено самоагглютинании и 0-антигенов, но показавшие типичные биохимические реакции;
культуры, у которых обнаружена самоагглютинация и типичные биохимические реакции.
Культуры, у которых не обнаружено самоагглютинании, не давшие типичных биохимических и серологических реакций, не относят к бактериям рода Salmonella.
6.3 Результаты выявления бактерий рода Salmonella в определенной навеске продукта записывают: «бактерии рода Salmonella обнаружены в А' г (см3) продукта* или «бактерии рода Salmonella не обнаружены в X г (см3) продукта*.
А'-масса (объем) навески продукта, в которой выявляли бактерии рода Salmonella.
6
ПРИЛОЖЕНИЕ
(обязательное)
Биохимическая характеристика четырех полролов Salmonella и атипичных видов, входящих в подрод Salmonella I
|
Наименование биохимических характеристик |
1 1- |
Salmonella II |
Salmonella III-Arizona |
Salmonella IV |
Salmonella choleraesuis |
J3 E I В II |
Salmonella paratyphi A |
Salmonella pullorum |
J If |
|
Образование индола | |||||||||
|
Образование аистоина | |||||||||
|
Образование H;S на трехсахарном агаре |
+ |
+ |
+ |
+ |
d |
+ |
— |
+ |
+ |
|
Расщепление мочевины | |||||||||
|
Подвижность |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
+ |
|
Сбраживание глюкозы с образованием газа |
+ |
+ |
+ |
+ |
+ |
— |
+ |
<+) |
— |
|
Сбраживание глюкозы с образованием кислоты |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Сбраживание лактозы |
- |
- |
d |
- |
- |
- |
- |
- |
- |
|
Сбраживание сахарозы | |||||||||
|
Сбраживание маннита |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Условные обозначения: «+* — 90 %—100 % штаммов положительны; «(+)► — 76 96—89 % штаммов положительны; «</* -26 %—75 % штаммов положительны; «—* — 0 %-10 % штаммов положительны. | |||||||||
ИНФОРМАЦИОННЫЕ ДАННЫЕ ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
| ||||||||||||||||||||
|
86 |
1
Издание официальное
2