ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРОДУКТЫ ПИЩЕВЫЕМетоды выявления и определения бактерий Listeria monocytogenes
Предисловие
1 РАЗРАБОТАН Государственным научным учреждением Всероссийским научно-исследовательским институтом мясной промышленности им. В.М. Горбатова РАСХН (головная организация); Государственным учреждением Научно-исследовательским институтом питания РАМН; Государственным учреждением Научно-исследовательским институтом эпидемиологии и микробиологии им. Н.Ф.Гамалеи РАМН; Государственным унитарным предприятием Государственным научно-исследовательским и проектно-конструкторским институтом по развитию и эксплуатации флота; Государственным учреждением Всероссийским научно-исследовательским институтом ветеринарной вирусологии и микробиологии РАСХН
ВНЕСЕН Техническим комитетом по стандартизации ТК 226 «Мясо и мясная продукция*
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 12 июля 2002 г. № 277-ст
3 Настоящий стандарт гармонизирован с международным стандартом ИСО 11290.2—98 «Микробиология продуктов питания и животных кормов. Горизонтальный метод обнаружения и подсчета микроорганизмов Listeria monocytogenes. Часть 2. Метод подсчета* в части пн. 9.1.9.2.9.3.9.4.1— 9.4.4.
9.5.1 - 9.5.3. В.4. В.5
4 ВВЕДЕН ВПЕРВЫЕ
5 ПЕРЕИЗДАНИЕ. Апрель 2010 г.
© ИНК Издательство стандартов. 2002 © СТАНДАРТИНФОРМ. 2010
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания на территории Российской Федерации без разрешения Федерального агентстаа по техническому регулированию и метрологии
112
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРОДУКТЫ ПИЩЕВЫЕ
Методы выявлении и определения бактерий Listeria monocytogenes
Pood products. Methods for detection and determination of Listeria monocytogenes bacteria
Дата введения 2003—07—01
1 Область применения
Настоящий стандарт распространяется на мишеные продукты, в том числе на продукты детского. лечебного и специализированного питания: мясо, включая мясо птицы, субпродукты и мясные продукты; рыбу, нерыбные объекты промысла и продукты, вырабатываемые из них; молоко и молочные продукты; маргарин, майонез, свежие и свежезамороженные овощи, картофель, салаты из овощей и устанавливает метод выявления и определения в них бактерий вида Listeria monocytogenes.
Метод основан на высеве определенного количества пищевого продукта в жидкую селективную питательную среду (с предварительным обогащением), последующем пересеве на агарнзонанные селективно-диагностические среды и культивировании посевов при оптимальных условиях. Принадлежность выявленных колоний к Listeria monocytogenes определяют по биологическим свойствам.
2 Нормативные ссылки
В настоящем стандаргс использованы ссылки на следующие стандарты;
ГОСТ 3145-84 Часы механические с сигнальным устройством. Общие технические условия ГОСТ 4288-76* Изделия кулинарные и полуфабрикаты из рубленого мяса. Правила приемки и методы испытаний
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия ГОСТ 7631-2008 Рыба, нерыбные объекты и продукция из них. Методы определения органолептических и физических показателей
ГОСТ 7702.2.0-95/ГОСТ Р 50396.0-92 Мясо 1гтииы. субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим испытаниям
ГОСТ 9225-84 Молоко и молочные продукты. Методы микробиологического анализа**
ГОСТ 9284— 75 Стекла предметные для микропрепаратов. Технические условия ГОСТ 9792-73 Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб
ГОСТ 9958-81 Изделия колбасные и продукты из мяса. Методы бактериологического анализа ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10444.8-88 Продукты пищевые. Метод определения Bacillus cereus
ГОСТ 13928-84 Молоко и сливки заготовляемые. Правила приемки, методы отбора проб и подготовка их к анализу
ГОСТ 21237-75 Мясо. Методы бактериологического анализа
* На территории Российской Федерации в части раздела «Правила приемки» действует ГОСТ Р 52675- 2006.
** Па icppiiropmt Российской Федерации действует ГОСТ Р 53430-2009.
Издание официальное
ГОСТ 25706-83 Лупы. Типы, основные параметры. Общие технические требования ГОСТ 26668-85 Продукты нишевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов ГОСТ 26809-86 Молоко и молочные продукты. Правила приемки, методы отбор;» и подготовка проб к анализу
ГОСТ 29227-91 (ИСО 835-1—81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования.
ГОСТ 30004.2-93 Майонезы. Правила приемки и методы испытаний ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности ГОСТ 31339-2006 Рыба, нерыбные объекты и продукция из них. Правила приемки и методы отбора проб
ГОСТ Р 51447-99 (ИСО 3100-1—91) Мясо и мясные продукты. Методы отбора проб ГОСТ Р 51448-99 (ИСО 3100-2—88) Мясо и мясные продукты. Методы подготовки проб для микробиологических исследований
ГОСТ Р 52179-2003 Маргарины, жиры для кулинарии, кондитерской, хлебопекарной и маточной промышленности. Правила приемки и методы контроля
СП 1.2.731—99 Безопасность работы с микроорганизмами III—IV групп патогенности и гельминтами
3 Определения и сокращения
В настоящем стандарте применяют следующие термины с соответствующими определениями и сокращениями:
бактерии рода listeria (далее — листерин): Грамиоложи тельные неспорообразующие короткие палочки с закругленными концами, иногда почти кокки, одиночные или в коротких цепочках (0.4—0.5х0.5—2.0 мкм). реже образуют длинные нити.
Listeria monocytogenes: Вид бактерий рода Listeria, патогенный для человека и животных, принадлежность к которому устанавливают путем дифференциации от непатогенных видов Listeria по культуральным, биохимическим и биологическим свойствам.
МПА — мясопеитонный агар.
МПБ — мясопеитонный бульон.
ПБЛ — питательный бульон для выделения и культивирования листерий.
ПАЛ — питательный агар для выделения листерий.
4 .Аппаратура, материалы и реактивы
4.1 Аппаратура, материалы и реактивы — по ГОСТ 10444.1 со следующими дополнениями: анализатор иммунно-ферментный типа «mini VIDAS* с использованием стриповою набора YIDAS LMO;
дозаторы пииеточные по 11|: лупа по ГОСТ 25706;
микроскоп биалогический с иммерсионной системой и увеличением 900х: pH-метр модели 2696 но |2|:
петля бактериологическая из платины/иридин. никеля, хрома или пластиковая диаметром 3 мм; пипетки градуированные по ГОСТ 29227. второю класса точности: пипетки пастеровские;
слайды или планшеты для иммунологических реакций по |3|;
стекла покровные по ГОСТ 6672;
стекла предметные по ГОСТ 9284;
термометр цифровой по |4|;
часы механические сигнальные по ГОСТ 3145;
бактериофаглистерийный L-3A по |5|:
гидролиза» казеина панкреатический;
диагн ости кум анти тельный латексный для выявления листерий «Лнстерия-АО-тест* по |6|;
114
ГОСТ Р 51921-2002
манноза:
система «API Listeria» для определения ферментативных свойств по |7|; стандарт мутности Макфарланда. соответствующий 1 ЕЛ; сыворотка поливалентная листериозная агглютинирующая по |8|; тест-штамм Listeria monocytogenes 766; тест-штамм Rhodococcus equi гемолитический; тест-штамм Staphylococcus aureus гемолитический.
5 Отбор и полю тика проб
5.1 Отбор и подготовку проб нишевых продуктов проводят в соответствии с ГОСТ 26668. ГОСТ 26669. а также в соответствии с нормативными и техническими документами на конкретные виды продуктов.
Масса или объем навески должны составлять (25 ± 0,1) г (см3), (50 — 100 г или 50 — 100 см' — для продуктов детского, лечебного и специализированного питания).
5.2 Отбор и подготовку проб мяса, включая мясо птицы, субпродуктов, мясных полуфабрикатов, колбасных изделий и других мясных продуктов, в том числе продуктов детского, лечебного и спецналн-зированного питания, проводят по 5.1 и ГОСТ 4288 (1.3. 2.1. 2.11.3). ГОСТ 7702.2.0/ГОСТ Р 50396.0. ГОСТ 9792. ГОСТ 9958 (3.33), ГОСТ 21237 (1.1-1.3. 3.3). ГОСТ Р 51447. ГОСТ Р 51448.
5.3 Отбор и подготовку проб молока и молочных продуктов, в том числе продуктов детского, лечебного и специализированного питания, проводят по 5.1 и ГОСТ 9225 (1.1 — 1.7). ГОСТ 13928. ГОСТ 26809. |9|.
5.4 Отбор и подготовку проб маргарина и майонеза проводят по 5.1 и ГОСТ Р 52179 (2.1). ГОСТ 30004.2 (1.2. 2.1). |10|.
5.5 Отбор и подготовку проб рыбы, нерыбных объектов промысла и продуктов, вырабатываемых из них. в том числе продуктов детского, лечебного и специализированного питания проводят по 5.1 и ГОСТ 7631. ГОСТ 31339 (1.3. 4.1 - 4.3). |М| и |12|.
5.6 OiOop и подготовку проб плодоовощной продукции, в том числе продуктов детского, лечебного и специализированного питания, проводят по 5.1 и |13|.
6 Подготовка к исследованию
6.1 Приготовление растворов
6.1.1 Пептонно-солевой раствор для приготовления разведений — по ГОСТ 26669 (1.2).
6.1.2 Растворы и реактивы для окраски по Граму — по ГОСТ 10444.1 (4.25).
6.1.3 Физиологический раствор — по ГОСТ 10444.1 (4.29).
6.1.4 Раствор с объемной долей перекиси водорода 3 % — но ГОСТ 10444.1 (4.33).
6.1.5 Приготовление растворов шит постановки реакции нитратредукции.
Раствор А готовят по ГОСТ 10444.8 (3.1.7).
Раствор Ь готовят но ГОСТ 10444.8 (3.1.6).
Непосредственно перед постановкой реакции растворы А и Б смешивают.
6.2 Приготовление питательных сред
6.2.1 Среды дтя поддержания выделенных культур и культивирования бактерий рода Listeria
6.2.1.1 МПБ с 1 % глюкозы - по ГОСТ 10444.1 (5.13).
6.2.1.2 МПА с 1 % глюкозы - по ГОСТ 10444.1 (5.13)
6.2.1.3 Триптон-соевый бульон с дрожжевым экстрактом (TSYEB) — по |14|.
6.2.1.4 Триптон-соевый агар с дрожжевым экстрактом (TSYEA) — по 114|.
6.2.1.5 Трипказо-соевый бульон (TSB) — по |15|.
6.2.1.6 Трипказо-соевый агар (TSA) — по |15|.
6.2.1.7 Состав питательных сред и способы приготовления приведены в приложении А. 1.1 — А. 1.4.
6.2.2 Среды селективные дая предварительного обогащения
6.2.2.1 ПБЛ I - по 1161.
6.2.2.2 Бульон Фразера иолуконцентрированный (Half Fraser broth) — но |14|. |15|.
6.2.2.3 Состав питательных сред и способы приготовления приведены в приложении А (А.2.1. А.2.2).
115
6.2.3 Среды селективные для обогащения
6.2.3.1 ПБЛ II - по |16|.
6.2.3.2 Бульон Фразера (Fraser broth)— no |14|. |15|.
6.2.3.3 Состав питательных сред и способы приготошения приведены в приложении А (А.3.1. А.3.2).
6.2.4 Среды селективно-диагностические
6.2.4.1 Среда ПАЛ - по |18|.
6.2.4.2 Оксфордский агар (Oxford agar) — по |14|, |15|.
6.2.4.3 ПАЛКАМ агар (PALCAM agar) - но |14|. 1151. |17|.
6.2.4 4 Состав питательных сред и способы приготовления приведены в приложении А (А.4.1—А.4.3).
6.2.5 Среды для изучения биологических свойств при идентификации листсрий
6.2.5.1 Питательная среда ГРМ № 1 — по |19|.
6.2.5.2 Кровяной агар
К 100 см1 растопленного и охлажденного до 45 — 50'С МПА с 1% глюкозы добавляют 5 — 10 см'стерильно взятой дефибринированной крови животных. Смесь осторожно перемешивают и разливают в чашки Петри (не более 10 см' на чашку). Слой агара должен быть равномерно окрашен в красный цвет. Среду подсушивают при (37 ±1) *С в соответствии с ГОСТ 26670 (4.2.1) и хранят не более 2 сут при температуре (4 ± 1) *С. Среда должна иметь pH 7.2 — 7.4.
Для посева используют теплые чашки.
6.2.5.3 Лецитин-агар с активированным углем и без угля
К питательной среде ГРМ № 1 перед стерилизацией добавляют 0.5 % активированного угля, растертою до порошкообразного состояния.
Желток куриного яйца разводят с соблюдением правил асептики в 150 см' физиологического раствора и добавляют в количестве 5 % по объему к стерилизованной и охлажденной до 40 — 45 °С питательной среде. Разливают в чашки Петри не более 20 см' на чашку и подсушивают при (37 ± 1) *С.
Аналогично готовят агар с добавлением желтка без добавления активированного угля.
6.2.5.4 Нитратную среду готовят но ГОСТ 10444.8 (3.2.9).
6.2.5.5 Полужидкую питательную среду (Listeria motility medium) для определения подвижности листерий готовят в соответствии с приложением А.5.1.
6.2.5.6 Среды Гисса готовят по ГОСТ 10444.1 (5.29). используя в качестве углевода рамнозу. ксилозу, маннозу и маннит.
6.2.5.7 МП Б с 0.5 % глюкозы готовят по ГОСТ 10444.1 (5.13). но при приготовлении добавляют 5 г глюкозы.
6.2.5.8 МПА готовят по ГОСТ 10444.1 (5.12).
6.3 Среды по 6.2.2. 6.2.3, 6.2.4 готовят накануне или непосредственно перед использованием в соответствии с указанием на этикетке.
Готовые среды хранят в темноте, так как отдельные компоненты, входящие в их состав, например акрифлавин. могут окисляться на свету, образуя продукты, подавляющие рост листерий.
7 Проведение исследования
7.1 Предварительное селективное обогащение
Навеску нишевого продукта массой (25 ± 0.1) г или объемом (25 ± 0.1) см'по 5.1 вносят в 225 см' одной из жидких сред для предварительного обогащения, приготовленных по 6.2.2. Содержимое встряхивают 25-кратными круговыми движениями радиусом 30 см.
Массу навески продуктов детского, лечебного или специализированного питания отбирают по 5.1. Соотношение между количеством высеваемого продукта и питательной средой должно составлять 1:9.
Посевы культивируют при температуре (30 ± 1) *С в течение (24 ±2) ч.
При росте листерий на полуконцентрированном бульоне Фразера, содержащем эскулин, отмечают почернение среды за счет гидролиза гликозида эскулина до глюкозы и эскулетина. Эскулетин реагируете ионами железа, образуя комплекс черного или оливкового цвета.
На ПБЛ I. не содержащем эскулин, почернение не происходит.
116
ГОСТ P 51921-2002
7.2 Селективное обогащение
После инкубирования продукта по 7.1 содержимое среды, независимо от наличия в ней изменений, в количестве 0.1 см3 пересевают в 10 см3 одной из жидких сред обогащения. Посевы инкубируют при температуре (37 ± 1) *С в течение 48 ч.
На бульоне Фразера, содержащем эскулин. отмечают почернение среды, как признак возможного присутствия листерий.
На среде ПБЛ II почернение не происходит.
7.3 Выявление характерных колоний на авизованных селективно-диагностических средах
7.3.1 Из пробирок посте инкубирования но 7.2. независимо от наличия tun отсутствия признаков роста, в том числе почернения, делают посев бактериологической петлей из культуральной жидкости на поверхность одной из агаризованных селективно-диагностических сред, указанных в 6.2.4. Допускается проводить пересев нар&ыельно на поверхность двух плотных селективно-диагностических сред.
Посевной материал растирают по поверхности шпателем или распределяют петлей в виде штриха. Подготовку чашек Петри со средой к посеву и посев проводят по ГОСТ 26670.
Посевы инкубируют при температуре (37±1) *С в течение 24—48 ч.
7.3.2 После инкубирования но 7.3.1 чашки с посевами просматривают и отмечают рост характерных колоний.
При отсутствии роста характерных колоний листерий на селективно-диагностических средах, указанных в 6.2.4, исследование прекращают и делают заключение об отсутствии Listeria monocytogenes в исследуемой пробе продукта.
На среде ПАЛ ростлистерий сопровождается потреблением эскулина и почернением колоний и питательной среды. Через 24 ч инкубирования они образуют мелкие серовато-желтые колонии с черным ореолом диаметром от 1.0 до 2.0 мм. Посторонняя кокковая микрофлора образует выпуклые колонии лимонно-желтого цвета диаметром от 1.0 до 4.0 мм. окруженные слабым (шли без него) покраснением питательной среды.
На ПАЛКАМ агаре (PALCAM agar) через 24 ч инкубирования листернй формируют мелкие серовато-зеленые или оливково-зеленые колонии с черным ореолом диаметром от 1.0 до 1.5 мм. иногда с черным центром. Через 48 ч колонии диаметром 1.5—2.0 мм приобретают зеленую окраску с углубленными центрами, окруженными черным ореолом. Посторонняя кокковая микрофлора образует выпуклые желтые колонии диаметром от 1,0 до 4,0 мм.
На Оксфордском агаре колонии листерий через 24 ч инкубирования — мелкие диаметром I мм сероватые, окруженные черным ореолом. Через 48 ч — более темные около 2 мм в диаметре с черным ореолом и углубленным центром.
При появлении сплошного роста листерий проводят пересев бактериологической петлей из зон наибольшего почернения среды штрихами на поверхность двух чашек Петри с одной из агарнзованных селективно-диагностических сред, указанных в 6.2.4. для получения изолированных колоний.
Посевы инкубируют при температуре (37 ± I) *С в течение 24 — 48 ч.
7.3.3 Для определения принадлежности характерных колоний к бактериям рода Listeria олбирают отдельных колоний, выращенных на агарнзованных селективно-диагностических средах по 7.3.1. и пересевают бактериологической петлей на среды: МПА с 1 % глюкозы и/или триитон-соевый агаре дрожжевым экстрактом (TSYEA). грипказо-соевый агар (TSA). МПБ с 1 % глюкозы и/или трипгон-соевый бульон с дрожжевым экстрактом (TSYEB), лрипказо-соевый бульон (TSB).
Посевы инкубируют при температуре (37 ± I) ‘С в течение 24 ч.
Получение чистой культуры проводят по ГОСТ 26670.
На МПА с 1 % глюкозы листерии имеют вид мелких сероватых полупрозрачных колоний.
На триптон-соевом агаре с дрожжевым экстрактом (TSYEA) и трмиказо-соевом агаре (TSA) типичные колонии листерий от 1,0 до 2,0 мм в диаметре, выпуклые, бесцветные, непрозрачные.
На всех указанных средах вид колоний напоминает «капли росы*.
Рост листерий на среддх: МПБ с I % глюкозы, триптон-соевом бульоне с дрожжевым экстрактом (TSYEB). трипказо-соевом бульоне (TSB) характеризуется равномерным помутнением среды, при встряхивании которой наблюдаются так называемые муаровые волны.
7.4 Подтверждение принадлежности выявленных колоний к бактериям рода Listeria
Для подтверждения принадлежности выделенных микроорганизмов к роду Listeria у полученных на средах культивирования чистых культур по 7.3.3 проверяют отсутствие капсул и спор, окраску по Граму. определяют присутствие каталазы (каталазную активность), подвижность бактерий при двух температурах инкубирования: (22 ± 1) и (37 ± 1) *С. нигратредуцируюшие свойства.
117
7.4.1 Из посевов но 7.3.3 готовят препараты, окрашивают их но Граму по ГОСТ 30425 (приложение Г.2) и мнкроскопируют. Бактерии рола Listeria являются неположительными тонкими короткими палочками, спор и капсул не образуют.
7.4.2 Каталазную активность культур определяют в соответствии с ГОСТ 30425 (приложение Г. I) по способности каталазы рахтагать перекись водорода с выделением пузырьков газа.
Бактерии рола Listeria являются каталазоположительными.
7.4.3 Подвижность культур определяют при посеве уколом в среду, приготовленную по 6.2.5.5. Посевы инкубируют при двух температурах: (22 ± 1) и (37 ± 1) "С в течение 48 ч.
Бактерии рода Listeria подвижны при (22 ± 1) *С, образуют характерный рост вокруг линии укола, похожий на зонтик, и неподвижны или слабоподвижны при (37 ± 1) 'С.
7.4.4 Постановку реакции нитратредукции проводят но ГОСТ 10444.8 (4.2.5)
Бактерии рода Listeria не восстанавливают нитраты до нитритов (за исключением непатогенной Listeria grayi).
7.4.5 Обнаружение в посевах неположительных коротких тонких палочек, каталазоположительных. не восстанавливающих нитраты до нитритов, подвижных при (22 ± 1) 'С и неподвижных или слабоподвижных при (37 ± I) ‘С. указывает на принадлежность выделенных микроорганизмов к бактериям рода Listeria.
7.5 Подтверждение принадлежности выявленных колоний к ви,лу Listeria monocytogenes
Дифференциацию выделенных культур проводят в aim этапа: сначала определяют принадлежность выделенных микроорганизмов к бактериям рода Listeria, а затем подтверждают их принадлежность к виду Listeria monocytogenes.
Определение принадлежности выделенных микроорганизмов к бактериям рода Listeria проводят по 7.4.
Для подтверждения принадлежности выделенных бактерий рода Listeria к виду Listeria monocytogenes у выделенных микроорганизмов определяют ферментативные свойства (способность ферментировать углеводы на средах Гисса с применением маннита, ксилозы, маннозы и рамнозы). |)-1смалитичсскую активность (способность образовывать зоны просветления за счет растворения эритроцитов под или вокруг колоний при посеве на поверхность кровяного агара), леиитиназную активность на средах с активированным углем и без угля, а также дополнительно проводят идентификацию Listeria monocytogenes путем постановки реакции агглютинации на стекле с поливалентной сывороткой или антительным латексным диагностикумом «Листерия—AG-тест».
Допускается для быстрого определения ферментативных свойств Listeria monocytogenes применять систему биохимической идентификации «API Listeria*.
Допускается ускоренная идентификация Listeria monocytogenes с применением анализатора типа «mini VIDAS*, а также дополнительное иаюльзование листерийного бактериофага L-3A дт идентификации.
7.5.1 Определение ферментативных свойств Listeria monocytogenes
7.5.1.1 Культуры, полученные по 7.3.3. пересевают уколом в среды Гисса по 6.2.5.6. Посевы инкубируют до 7 сут при температуре (37 ± 1) *С. ежедневно проверяя кислого- и газообразование. Наличие ферментативной активности в отношении углеводов определяют по изменению окраски сред за счет образования кислоты и/или газа. При появлении этих признаков проводят учет результатов. Большинство бактерий рода Listeria не ферментируют маннит (за исключением Listeria grayi).
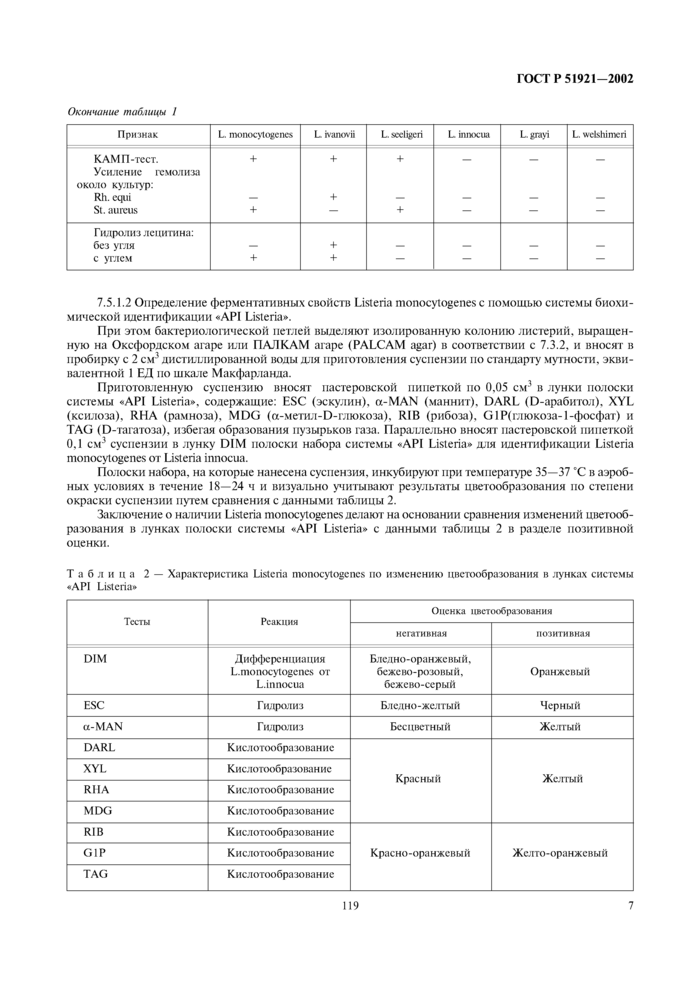
Listeria monocytogenes ферментируют маннозу и рамнозу с образованием кислоты и не ферментируют маннит и ксилозу (таблица 1).
|
Таблица 1— Характеристика видов бактерий рода Listeria |
|
Признак |
L. monocytogenes |
L harovii |
L. seel vert |
L innocua |
L grayi |
L. wdshimeri |
|
Ферментации:
маннита |
|
|
|
|
+ |
|
|
ксилозы |
— |
+ |
+ |
— |
— |
+ |
|
маннозы |
+ |
+ |
+ |
— |
+ |
— |
|
рамнозы |
+ |
— |
— |
± |
+ |
± |
|
Р-гсмолиз |
+ |
+ |
+ |
— |
— |
— |
|
ГОСТ Р 51921-2002
|
Окончание таб.шцы I |
|
Признак |
L. monocytogenes |
L ivanovii |
L. sccligeri |
L innocua |
Lgrayi |
L. wetshimeri |
|
КАМП-тест. |
+ |
+ |
+ |
_ |
_ |
— |
|
Усиление гемолиза |
|
|
|
|
|
|
|
около культур: |
|
|
|
|
|
|
|
Rh. equi |
— |
+ |
— |
— |
— |
— |
|
St. aureus |
+ |
— |
+ |
— |
— |
— |
|
Г илролиз лецитина: |
|
|
|
|
|
|
|
без угля |
— |
+ |
— |
— |
— |
— |
|
с углем |
+ |
+ |
— |
— |
— |
— |
|
7.5.1.2 Определение ферментативных свойств Listeria monocytogenes с помощью системы биохимической идентификации -API Listeria*.
При этом бактериологической петлей выделяют изолированную колонию листерий. выращенную на Оксфордском агаре или ПАЛКАМ агаре (PALCAM agar) в соответствии с 7.3.2. и вносят в пробирку с 2 см3 дистиллированной воды для приготовления суспензии но стандарту мутности, эквивалентной I ЕД по шкале Макфарланда.
Приготовленную суспензию вносят пастеровской пипеткой но 0.05 см3 в лунки полоски системы -API Listeria*, содержащие: ESC (эскулин), «-MAN (маннит). DARL (D-арабитол). XYL (ксилоза). RHA (рамноза). MDG (а-метил-Р-глюкоза). RIB (рибоза). С1Р(глюкоза-1-фосфат) и TAG (D-тагатоза), избегая образования пузырьков газа, Параллельно вносят пастеровской пипеткой 0.1 см3 суспензии в лунку DIM полоски набора системы -API Listeria* для идентификации Listeria monocytogenes от Listeria innocua.
Полоски набора, на которые нанесена суспензия, инкубируют при температуре 35—37 ‘С в аэробных условиях в течение 18—24 ч и визуально учитывают результаты цветообразования по степени окраски суспензии путем сравнения с данными таблицы 2.
Заключение о наличии Listeria monocytogenes делают на основании сравнения изменений цветообразования в лунках полоски системы -API Listeria* с данными таблицы 2 в разделе позитивной оценки.
|
Табл и ц а 2 — Характеристика Listeria monocytogenes но изменению цветообразования в лунках системы -API Listeria* |
|
Тесты |
Реакция |
Оценка цветообразования |
|
негативная |
позитивная |
|
DIM |
Дифференциации
L.monocytogcnes от L.innocua |
Блсд но-оранжс вы й. бежево-розовый, бежево-серый |
Оранжевый |
|
ESC |
Г илролиз |
Блелно-желтый |
Черный |
|
a-MAN |
Г илролиз |
Бесцветный |
Желтый |
|
DARL |
Кнслогообразо ванне |
Красный |
Желтый |
|
XYL |
Кислотообразован ис |
|
RHA |
Кнслогообразо ванне |
|
MDG |
Кнслогообразо ванне |
|
RIB |
Кнслотообра зо ванне |
Красно-оранжевый |
Желто-оранжевый |
|
GIP |
Кислотообразованис |
|
TAG |
Кнслотообра зо ванне |
|
|
119 7 |
7.5.2 Определение р-гемолитической активности
7.5.2.1 Для определения Р-гемолитической активности выделяют изолированную катонию листерий, полученную по 7.3.3. и высевают бактериологической петлей на поверхность кровяного агара, приготовленного с добавлением стерильной дефибринированной крови животных по 6.2.5.2. Посевы инкубируют при температуре (37+1) *С в течение 24 ч.
Чашки просматривают в проходящем свете и отмечают образование зон р-гемолнза.
Listeria monocytogenes обладает р-гемолитической активностью с образованием узких зон просветления среды под или вокруг колоний.
7.5.2.2 Допускается вспомогательно для подтверждения гемолитической активности использовать КЛ М П -тест (CAM P-test).
7.5.2.2.1 Двухсуточные культуры гемолитических штаммов Staphylococcus aureus и Rhodococcus equi высевают на кровяной агар, как показано на рисунке 1. Между вертикальными линиями Staphylococcus aureus и Rhodococcus equi. как показано на рисунке I. засевают нардтлельными линиями исследуемые культуры на расстоянии друг от друга не менее 1 см и от вертикальных линий — 0.5 см.
7.5.2.2.2 Желательно для контроля сделать посев тест-штамма Listeria monocytogenes 766 аналогично посеву исследуемых культур по 7.5.2.2.I.
7.5.2.2.3 Посевы инкубируют при температуре (37 ± 1) * С в течение 24 ч. Отмечают изменение (расширение и просветление) зоны гемолиза в зонах, соседствующих с вертикальными штрихами стафилококка и родококка.
Listeria monocytogenes даст положительную КАМП-реакцию (расширение и просветление зоны гемолиза) около штриха Staphylococcus aureus и отрицательную (отсутствие изменений зоны гемолиза) — окаю штриха Rhodococcus equi.
R и S — культуры RImxIococcus equi и Staphylococcus aureus соответственно; параллельные горитонтальные линии — исследуемые культуры
Рисунок 1 — Схема посева при постановке КАМ Г1-теста
7.5.3 Определение лешггиназной активности
7.5.3.1 Дно чашек Петри делят на несколько секторов или квадратов и исследуемые культуры, полученные но 7.3.3. высевают короткими штрихами по одной на сектор (квадрат). Засев каждой исследуемой культуры проводят параллельно на чашки, содержащие и нс содержащие уголь.
Посевы инкубируют при температуре (37 ± 1) *С в течение 48 ч.
Чашки просматривают в проходящем свете и отмечают наличие (отсутствие) лецитиназиой активности на чашках, содержащих и не содержащих активированный уголь.
Listeria monocytogenes дает азотную зону помутнения шириной 3.0 — 6.0 мм на питательной среде с активированным углем за счет гид рати за лецитина.
Listeria monocytogenes гидролизует лецитин только в присутствии активированного угля. На среде, не содержащей активированный уголь. Listeria monocytogenes не обладает лецитиназной активностью (таблица 1).
7.5.3.2 Желательно для контроля сделать посев тест-штамма Listeria monocytogenes 766 аналогично посеву исследуемых культур по 7.5.3.1.
7.5.4 Постановка реакции агглютинации дтя идентификации Listeria monocytogenes
Реакцию агглютинации дтя идентификации Listeria monocytogenes выполняют на стекле с помощью пашвалентной листериозной агглютинирующей сыворотки, содержащей антитела 0-11. V. VI. VII. IX и Н-АВ.
Предназначенную дтя идентификации чистую культуру, выращенную в течение 24 ч в питательном бульоне по 7.3.3 при (37±1) 'С. засевают бактериологической петлей частым штрихом в две
8 120