ГОСТ 30425-97
Консервы. Метод определения промышленной стерильности
Купить ГОСТ 30425-97 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на все виды полных консервов и устанавливает метод определения их промышленной стерильности.
Переиздание (июнь 2011 г.)
Оглавление
1 Область применения
2 Нормативные ссылки
3 Сущность метода
4 Отбор проб
5 Аппаратура, материалы, реактивы, краски, индикаторы и питательные среды
6 Подготовка к анализу
7 Проведение анализа
8 Оценка результатов анализа
Приложение А (рекомендуемое) Термины, применяемые в стандарте, и пояснения к ним
Приложение Б (рекомендуемое) Схема проведения анализа консервов на промышленную стерильность
Приложение В (рекомендуемое) Способы культивирования посевов в анаэробных условиях
Приложение Г (рекомендуемое) Тесты для определения принадлежности микроорганизмов к определенной группе
| Дата введения | 01.01.1998 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел Электроэнергия
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел Экология
Организации:
| 25.04.1997 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 11 |
|---|---|---|---|
| 18.08.1997 | Утвержден | Государственный комитет Российской Федерации по стандартизации, метрологии и сертификации | 279 |
| Издан | ИПК Издательство стандартов | 1997 г. | |
| Разработан | ВНИИКОП | ||
| Издан | Стандартинформ | 2011 г. | |
| Издан | Стандартинформ | 2010 г. | |
| Разработан | МТК 93 Продукты переработки плодов и овощей |
Canned foods. Method for determination of commercial sterility
- ГОСТ 18963-73 Вода питьевая. Методы санитарно-бактериологического анализа
ГОСТ 24104-88Весы лабораторные общего назначения и образцовые. Общие технические условия. Заменен на ГОСТ 24104-2001.- ГОСТ 24104-2001 Весы лабораторные. Общие технические требования
ГОСТ 10444.11-89Продукты пищевые. Методы определения молочнокислых микроорганизмов. Заменен на ГОСТ 10444.11-2013.ГОСТ 10444.12-88Продукты пищевые. Метод определения дрожжей и плесневых грибов. Заменен на ГОСТ 10444.12-2013.- ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
- ГОСТ 10444.7-86 Продукты пищевые. Методы выявления ботулинических токсинов и Сlostridium botulinum
ГОСТ 10444.8-88Продукты пищевые. Метод определения Bacillus cereus. Заменен на ГОСТ 10444.8-2013.- ГОСТ 21241-89 Пинцеты медицинские. Общие технические требования и методы испытаний
- ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26188-84Продукты переработки плодов и овощей, консервы мясные и мясорастительные. Метод определения рН. Заменен на ГОСТ 26188-2016.- ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
- ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
- ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
- ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
- ГОСТ 30518-97 Продукты пищевые. Метод выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)
- ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
- ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
- ГОСТ Р 52816-2007 Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)
- ГОСТ Р 53415-2009 Вода. Отбор проб для микробиологического анализа
- ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9
стр. 10
стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
КОНСЕРВЫ
Метод определения промышленной стерильности
Издание официальное
Москва
Стандартимформ
2011
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским институтом консервной и овоще-суши льной промышленности (ВНИИКОП) и МТК 93 «Продукты переработки плодов и овощей*
ВНЕСЕН Госстандартом России
2 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протока! № 11 от 25 апреля 1997 г.)
За принятие проголосовали:
|
Наименование государства |
Наименование национальною органа по стандартизации |
|
Азербайджанская Республика Республика Армения Республика Белоруссия Республика Казахстан Киршзская Республика Республика Молдова Российская Федерация Республика Таджикистан Республика Узбекистан Украина |
Азгосстанларт Арм госс г.пиар г Госстандарт Белоруссии Госстандарт Республики Казахстан Киргизе га нларт Молловастанларт Госстандарт России Талжикгосстанларт Узгосстанларт Госстандарт Украины |
3 Постановлением Государственного комитета Российской Федерации по стандартизации, метрологии и сертификации от 18 августа 1997 г. N° 279 межгосударственный стандарт ГОСТ 30425-97 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1 января 1998 г.
5 ВЗАМЕН ГОСТ 10444.3-85. ГОСТ 10444.4-85. ГОСТ 10444.5-85. ГОСТ 10444.6-85
6 ПЕРЕИЗДАНИЕ. Июнь 2011 г.
© ИПК Издательство стандартов. 1997 © СТАНДАРТИНФОРМ. 2011
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания на территории Российской Федерации без разрешения Федерального агентства по техническому регулированию и метрологии
256
МЕЖГОСУДАРСТВЕННЫЙ
ГОСТ 30425-97 СТАНДАРТ
КОНСЕРВЫ
Метод определения промышленной стерильности
Canned foods.
Method for determination of commercial sterility
Дата введения 1998-01-01
1 Область применения
Настоящий стандарт распространяется на вес виды полных консервов и устанавливает метод определения их промышленной стерильности.
Термины, применяемые в стандарте, и пояснения к ним приведены в приложении А.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 6672-75 Стекла покровные дли микропрепаратов. Технические условия ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10444.7-86 Продукты нишевые. Методы выявления ботулинических токсинов и Clostridium botulinum
ГОСТ 10444.8-88 Продукты нишевые. Метод определения Bacillus cereus ГОСТ 10444.9-88 Продукты пищевые. Метод определения Clostridium perfringens ГОСТ 10444.11-89 Продукты нишевые. Методы определения молочнокислых микроорганизмов ГОСТ 10444.12-88 Продукты пищевые. Метод определения дрожжей и плесневых грибов ГОСТ 10444.15-94 Продукты нишевые. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
ГОСТ 18963-73* Вода питьевая. Методы санитарно-бактериологического анализа ГОСТ 21241-89 Ниниеты медицинские. Общие технические требования и методы испытаний ГОСТ 24104-88** Весы лабораторные общего назначения и образцовые. Общие технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26188-84 Продукты переработки плодов и овощей, консервы мясные и мясорастительные. Метод определения pH
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты нишевые и вкусовые. Подготовки! проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов ГОСТ 29227-91 (ИСО 835-1—81) Посуда лабораторная стеклянная. Пинетки фадуированные. Часть 1. Общие требования
• С I июля 2011 г. на герришрии Российской Федерации действует ГОСТ Р 53415-2009.
•• С 1 июля 2002 г. введен в действие ГОСТ 24104-2001. На территории Российской Федерации действует ГОСТ Р 53228-2008.
И найме официальное
ГОСТ 30518-97/ГОСТ Р 50474-97 Продукты нишевые. Методы выявления и определения количества бактерии фупны кишечных палочек (колиформных бактерий)1
3 Сущность метола
Метод основан на определении внешнего вида и герметичности консервов, выявлении в продукте жизнеспособных микроорганизмов и. при необходимости, определении их количества, микроско-пиронанпи продукта, а в случаях, предусмотренных нормативным документом на конкретный mu консервов, определении pH продукта.
Схема проведения анализа консервов на промышленную стерильность приведена в приложении Б.
4 Oitfop проб
Отбор проб по ГОСТ 26668.
5 Аппаратура, материалы, реактивы, краски, индикаторы и питательные среды
Для проведения анализа применяют:
баню водяную с терморегулятором, позволяющим поддерживать температуру от 20 до 100 ’С и пределом допускаемой погрешности ±1 1С;
весы лабораторные общего назначения по ГОСТ 24104 с наибольшим пределом взвешивания до 1 кг и пределом допускаемой погрешности ±10 мг;
гомогенизатор лабораторный или размельчитель тканей; горелку газовую или спиртовую;
колбы атоскодонные конические или круглые разной вместимости по ГОСТ 25336; микроскоп биологический с приспособлением для фазово-контрастного микроскопироваиия. обеспечивающий увеличение 900— 1000х; петлю бактериологическую; пинцет по ГОСТ 21241;
пипетки градуированные вместимостью 1. 2. 5 и 10 см3 но ГОСТ 29227 исполнений 1 и 2; пробирки бактериологические по ГОСТ 25336;
растворы реактивов, красок, индикаторов и питательные среды но ГОСТ 10444.1 и ГОСТ 30518-97/ГОСТ Р 50474-97. лакгозо-пептон ну го среду по ГОСТ 18963;
реактивы, обеспечивающие анаэробные условия культивирования посегюв по ГОСТ 10444.1. и (или) анаэростат; pH-метр;
стек;га предметные по ГОСТ 9284; стекла покровные по ГОСТ 6672;
термостаты, обеспечивающие поддержание температур 55—62 1С. (37±1) 1С, (30±!) 'С гг (24±1) 1С;
трубки Вейона.
Допускается использование другой аппаратуры, ма териалов, реактивов, по техническим характеристикам не уступающих указанным выше.
6 Подготовка к анализу
6.1 Осмотр, регистрацию, санитарную обработку, контроль герметичности тары и термостатиро-вание консервов проводят но ГОСТ 26669.
6.2 Если обнаружена негерметичность швов или укупорки тары или посте термостатирования и охлаждения консервов до комнатной температуры обнаружены дефектные банки, то консервы не подлежат оценке на промышленную стерильность и не подвергаются дальнейшему анализу.
6.3 Перед анализом пастеризованных газированных фруктовых соков гг напитков необходимое количество продукта отбирают в стерильную колбу с пагной пробкой. Отобранную пробу помешают
в водяную баню температурой 30—35 'С и, встряхивая колбу, освобождают продукт от двуокиси углерода, конец освобождения определяют по отсутствию выделения пузырьков газа. Затем продукт нейтрализуют до рН(7.0±0.3) раствором гидроокиси натрия массовой концентрацией 100 г/дм3, предварительно простерилизованным при температуре (120± 1) 'С в течение 15 мин. Значение pH контролируют по индикаторной бумаге или с помощью pH-метра, ятя чего небольшое количество продукта отбирают в отдельную посуду.
7 Проведение анализа
7.1 Навески консервов ятя высева в питательные среды отбирают по ГОСТ 26668. В подозрительных консервах при наличии кольца на фанице продукта с тарой или осадка на дне банки навески отбирают без предварительного перемешивания продукта ятя того, чтобы в навеску попята часть осадка или кольца.
При шраниченном количестве единиц упаковок допускается отбирать навески консервов из упаковок, прошедших термостатирование при температуре 30—37 *С. яш выявления не только мезо-фильных, но и термофильных микроорганизмов.
7.2 Навески консервов ятя определения pH отбирают по ГОСТ 26188 с соблюдением правил асептики непосредственно после отбора навесок по 7.1. одновременно отбирают навески ятя микро-сконирования консервированного продукта.
7.3 Масса или объем навески продукта должны составлять:
ятя высева в две пробирки с жидкой питательной средой — (2,0±0.1) г или (2.010.1) см1 при выявлении аэробных, факультативно-анаэробных и анаэробных микроорганизмов;
ятя высева в две пробирки с питательной средой — (10.010.1) г или (10.010,1) см* при выявлении анаэробных микроорганизмов в консервах детского и диетического питания:
ятя высева глубинным методом в чашку Петри — (1.010.1) г тын (1.010.1) см';
ятя приготовления разведения не менее (10.010.1) г или (10.010.1) см3;
ятя определения pH в количестве, необходимом яш погружения электродов в анализируемый продукт.
7.4 Посте отбора навесок продукта консервы сохраняют до окончания анализа и оформления результатов при температуре (412) *С в условиях, исключающих их повторное заражение микроорганизмами. Если в посевах будут выявлены жизнеспособные микроорганизмы, то при необходимости, из соответствующей банки, хранящейся при температуре (412) *С. в соответствии с требованиями нормативного документа отбирают дополнительные навески продукта яш высева в питательные среды с целью количественного подсчета обнаруженных микроорганизмов.
7.5 Для определения промышленной стерильности консервов в каждой единице упаковки консервов устанавливают отсутствие (присутствие) тех групп микроорганизмов, показатели и нормы по которым приведены в нормативном документе на анализируемый вид консервов.
В случаях, предусмотренных нормативным документом на конкретный вид консервированного продукта, а также при выяснении причин возникновения дефектов консервов проводят подсчет количества или наиболее вероятного числа (НВЧ) выявляемых микроорганизмов.
7.6 При отсутствии требований к микробиологическим показателям в зависимости от принадлеж-ности консервов к определенной группе в них вы я иля ют следующие микроорганизмы (деление консервов на фунпы приведено в приложении А):
В низкокислотных консервах (фуппы А), предназначенных к реализации при температуре ниже 40 *С. выявляют жизнеспособные мезофильные аэробные, факультативно-анаэробные и анаэробные микроорганизмы.
В низкокислотных консервах (группы А), которые могут при реализации подвергаться воздействию температуры 40 ’С и выше, дополнительно выявляют термофильные аэробные, факультативноанаэробные и анаэробные микроорганизмы, выделяя среди них кислотообразующие бациллы.
В консервах ipynn Ь и В выявляют мезофильные анаэробные микроорганизмы, плесневые фибы. дрожжи и молочнокислые микроорганизмы.
В консервах фунпы Г выявляют плесневые фибы, дрожжи и молочнокислые микроорганизмы.
3
В концентрированных плодово-ягодных консервах фуппы Г (соках концентрированных, варенье, джеме, повидле, конфитюре и др.) выявляют плесневые грибы и дрожжи.
259
В пастеризованных газированных фруктовых соках и напитках (группы Е) определяют количество:
мезофильных аэробных и факультативно-анаэробных микроорганизмов;
бактерий группы кишечных палочек (колиформных бактерий);
плесневых грибов.
Кроме этого, в консервах группы Е выявляют дрожжи и молочнокислые микроорганизмы.
7.7 Выявление и определение количества аэробных, факультативно-анаэробных и анаэробных микроорганизмов
7.7.1 Для выявления жизнеспособных мезоф ильных аэробных и факультативно-анаэробных микроорганизмов в каждую из двух пробирок, содержащих по 5—6 см1 жидкой питательной среды, вносят по (I.OiO.I)r или (1.0±0.1) см' консервированного продукта.
Перечень используемых для выявления мезофильных аэробных и факультативно-анаэробных микроорганизмов питательных сред, их состав и приготовление по ГОСТ 10444.1.
7.7.2 Для выявления жизнеспособных мезофильных анаэробных микроорганизмов на дно каждой из двух пробирок с регенерированной питательной средой вносят по (1.010.1) г или (1.010.1) см’ консервированного продукта, при анализе консервов детского или диетического питания в каждую пробирку вносят но (5.010.1) г или (5.010.1) см ' консервированного продукта.
Питательную среду регенерируют непосредственно перед использованием (приложение В. пункт В.2).
Перечень используемых для выявления мезофильных анаэробных микроорганизмов питательных сред, их состав и приготовление по ГОСТ 10444.1.
Высота слоя среды с внесенным продуктом в обычных пробирках должна быть 10—11 см. а в высоких, куда высевают (5,010,1) г или (5,010.1) см3 продукта — 14—15 см. Количество питательной среды в высоких пробирках при этом должно составлять около 30 см '.
Сразу после посева на поверхность жилкой питательной среды, если она приготовлена без вазелинового маета, наслаивают голодный агар или вазелиновое масло, или парафиновую смесь, приготовленные по ГОСТ 10444.1. в таком количестве, чтобы образовался слой высотой около 2 см.
Допускается применение свежеприготовленных питательных сред без настаивания голодного агара. вазелинового масла или парафиновой смеси (вазелиновое масло тормозит развитие анаэробных микроорганизмов при их пересеве с жидкой среды на агаризованную).
7.7.3 Посевы для выявления термофильных аэробных, факультативно-анаэробных и анаэробных микроорганизмов проводят но 7.7.1 и 7.7.2 (термофильные аэробные и факультативно-анаэробные микроорганизмы — но 7.7.1, термофильные анаэробные микроорганизмы — по 7.7.2) на питательные среды по ГОСТ 10444.1 для выя&тения этих групп микроорганизмов. Термофильные анаэробные микроорганизмы в консервах детского и диетического питания выявляют в (2.010.1) г или (2.010.1) см' продукта.
7.7.4 При необходимости подсчета НВЧ аэробных, факультативно-анаэробных или анаэробных микроорганизмов посев продукта проводят с учетом требований ГОСТ 26670.
7.7.5 Посевы дтя выявления или подсчета количества мезофильных микроорганизмов термоста-тируют при температуре (3011) *С. термофильных — при 55—62 "С до появления видимых признаков роста, но не менее 5 сут дтя мезофильных микроорганизмов и не менее 3 сут дтя термофильных микроорганизмов.
4
7.7.6 При необходимости подтверждения присутствия в консервах бацилл и (или) клостридий в споровой форме навески консервированного продукта дополнительно вносят параллельно в две пробирки со средами, указанными в 7.7.1, и (или) 7.7.2 и (или) 7.7.3. Посевы прогревают при температуре (8011) ‘С в течение 20 мин при выявлении спор мезофильных микроорганизмов, при температуре (9511) 'С в течение 20 мин при выявлении спор термофильных микроорганизмов. Для про1рева пробирки с посевами помещают в предварительно нагретую до 50 *С водяную баню таким образом, чтобы уровень содержимого пробирок был на 2—3 см ниже, чем уровень воды в бане. Одновременно в водяную баню помещают контрольную пробирку с водой и термометром. Уровень воды в контрольной пробирке должен соответствовать уровню содержимого пробирок с посевами. Время термообработки начинают отсчитывать с того момента, когда температура воды в контрольной пробирке достигнет требуемой величины (8011) *С или (9511) °С. Период подогрева содержимого пробирок до требуемой температу ры должен быть 2—3 мин. Посевы после 20 мин термообработки немедленно охлаждают в струе водопроводной воды и затем термостатируют по 7.7.5.
260
7.7.7 Во время термостатирования посевов проводят ежедневные наблюдения за появлением признаков развития микроорганизмов: помутнения среды, образования газа, пленки, осадка.
Но мере необходимости из посевов отбирают культуральную жидкость для определения морфологии клеток, наличия спор, отношения к окраске но Граму. наличия глобул в бациллярных клетках и каталазной активности.
Тесты для определения принадлежности микроорганизмов к определенной группе приведены в приложении Г.
7.7.8 Принадлежность выделенных микроорганизмов к типичным группам мезофильных бани.и устанавливают но культуральным особенностям развития, способности к спорообразованию в аэробных условиях, положительной окраске по Граму. наличию каталазы, морфологическим особенностям протоплазмы клеток или спорангий.
Принадлежность микроорганизмов к мезоф ильным кл острил иям устанавливают но культуральным особенностям развития, газообразованию, сульфитредуцируюшсй активности, способности к спорообразованию в анаэробных условиях, морфологии клеток, положительной окраске по Граму. отсутствию каталазы.
Принадлежность к термофильным аэробным и факультативно-анаэробным микроорганизмам устанавливают по изменению цвета среды, если она содержит индикатор — бромкрезолоный пурпурный. морфологии клеток, наличию спор, отношению к окраске по Граму, каталазной активности.
Принадлежность к термофильным анаэробным микроорганизмам устанавливают по культуральным особенностям развития, газообразованию, сульфатредуцируюшей активности, способности к спорообразованию в анаэробных условиях, морфологии клеток, отношению к окраске по Граму, каталазной активности.
Отсутствие среди выявленных микроорганизмов устанавливают С. botulinum — по ГОСТ 10444.7. B.cereus — по ГОСТ 10444.8. С. perfringens — по ГОСТ 10444.9.
7.7.9 В случаях, когда присутствие продукта в культуральной жидкости затрудняет выявление жизнеспособных микроорганизмов, пересевают культуральную жидкость из посевов на чашки Петри. Для выявления анаэробных микроорганизмов проводят пересевы в пробирки или в трубки Вейона, или в чашки Петри иод стекло или культивируют посевы в условиях, указанных в приложении В. Для получения отдельных колоний проводят посевы с использованием десятикратных разведений культуральной жидкости.
При подозрении на присутствие D. nigrificans в посевах на термофильные анаэробные микроорганизмы для пересевов используют молочно-сульфатную среду или среды, содержашие сульфиты. Посевы термостатируют при температуре 55—62 *С в течение 48 ч. Спорообразующие клостридин образуют большое количество газа на средах с глюкозой. D. nigrificans вызывает почернение сред, содержащих сульфиты или сульфаты.
7.7.10 Определение количества мезоф ильных аэробных и факультативно-анаэробных микроорганизмов в пастеризованных газированных фруктовых соках и напитках проводят по ГОСТ 10444.15.
7.8 Выявление и определение количества плесневых грибов и дрожжей
Для выявления и определения количества плесневых грибов и дрожжей по (1.010.1) г или (1,0±0.1) см3 консервированного продукта вносят параыельно в две чашки Петри, которые заливают одной из агаризованных питательных сред, указанных в ГОСТ 10444.12.
Выяаленис плесневых грибов и дрожжей проводят путем посева продукта параыельно в две пробирки с 5—6 см3 жидкого солодового сусла или среды Сабуро. Посевы термостатируют при температуре (24±1) *С. Через 3 сут проводят предварительный учет типичных колоний или появления характерных признаков роста на жидких средах.
Если в посевах на агаризованных средах присутствуют мукоровые быстро растущие грибы, то при предварительном количественном подсчете типичных колоний необходимо чашки Петри переворачивать очень осторожно, не допуская того, чтобы споры этих грибов осыпались и дали рост вторичных колоний. Через 5 сут проводят окончательный учет результатов термостатирования посевов.
7.9 Выявление молочнокислых микроорганизмов
5
Для ныяаления молочнокислых микроорганизмов по (1.010.1) г или (1.010.1) см3 консервированного продукта вносят параыельно в две пробирки с жидкой питательной средой или в чашки Петри, которые заливают агаризованной средой.
261
Перечень используемых для выявления молочнокислых микроорганизмов питательных сред, их состав и приготовление приведены в ГОСТ 10444.11.
Посевы термостатируют при температуре (30±1) °С не более 5 сут или при температуре (37± 1) °С не более 3 суг.
Принадлежность к молочнокислым микроорганизмам устанавливают но ГОСТ 10444.11 по культуральным признакам развития, морфологии клеток, по положительной окраске по Граму, отсутствию каталазы.
7.10 Выявление бактерий группы кишечных палочек (колиформных бактерий) в пастеризованных газированных фруктовых соках и напитках
Продукт, подготовленный по 6.3. для выявления колиформных бактерий высевают в количестве: трех объемов но 100 см3. трех объемов по 10 см3 и трех объемов по 1см3. Каждый объем по 100 см3 и 10 см3 высевают соответственно в такое же количество одной из питательных сред двойной концентрации, а каждый объем но 1 см3 — в 10 см3 среды нормальной концентрации.
Перечень питательных сред для выявления колиформных бактерий, их состав и приготовление по ГОСТ Р 52816.
Объемы продукта 100 и 10 см3 можно высевать соответственно в 10 и I см3 концентрированной лактозо-нептонной среды, а 1 см3 — в 10 см3 лактозо-пептонной среды нормальной концентрации. Лактозо-псптонную среду концентрированную и нормальной концентрации готовят по ГОСТ 18963.
Если продукта из одной упаковочной единицы недостаточно дзя определения микробиологических показателей, то обьединяют две или более единицы в одну. Термостатарованне посевов, пересевы на среду Эндо дзя выделения чистой культуры, подтверждение принадлежности выросших микроорганизмов к коли(|юрмным бактериям проводят но ГОСТ 30518/ГОСТ Р 50474.
7.11 Определение принадлежности выявленных микроорганизмов к определенной группе в соответствии с приложением А
7.12 Параллельно с посевом на питательные среды готовят препараты из продукта дш фазовоконтрастного микроскопирования и (или) для окраски по Граму. Если жировые включения продукта затрудняют микроскопирование, то на нсостывшес после фиксации предметное стекло наносят каплю ксилола и удаляют его немедленно фильтровальной бумагой.
В препаратах выявляют жизнеспособные и нежизнеспособные микробные клетки, устанавливают их морфологию и присутствие спор, подсчитывают число обнаруженных микроорганизмов в нале зрения микроскопа при увеличении: окуляр 10* и объектив 90х. В препарате просматривают не менее 10 полей зрения.
7.13 В случаях, предусмотренных требованиями нормативного документа, в каждой исследуемой упаковочной единице консервов определяют значение pH д>я выявления возможного прокисания продукта.
8 Опенка результатов анализа
8.1 Промышленную стерильность оценивают но каждой упаковочной единице консервов отдельно.
По результатам определения герметичности тары, по внешнему виду консервов после термоста-тирования. по результатам микроскопирования консервированного продукта, значению pH и составу, а в случаях, указанных в нормативной документации, и по катнчеству обнаруженных в продукте микроорганизмов консервы оценивают как не подлежащие оценке на промышленную стерильность, отвечающие (или не отвечающие) требованиям промышленной стерильности.
8.2 Консервы не подлежат оценке на промышленную стерильность если:
обнаружена негерметичностъ швов или укупорки тары;
после термостатирования и охлаждения консервов до комнатной температуры обнаружены дефектные банки;
при микроскопировании консервированного продукта, выработанного из продуктов, приготовленных без испальзованпя микробных культур, обнаружено большое число микроорганизмов (свыше 10 клеток в нале зрения):
pH консервированного продукта меньше на 0.5 и более допустимого значения, указанного в нормативном документе на конкретный вид консервов.
8.3 Если при анализе консервированного продукта в герметично укупоренной таре продукт сохранил посте термостатирования нормальный внешний вид, значение его pH соответствует значению.
6 262
указанному в нормативном документе, а при ммкроскопмрованмм продукта обнаружены единичные клетки (не более 10). и в посевах не обнаружены жизнеспособные микроорганизмы, то консервы считают I |ром ышлен но-стерил ьн ыми.
8.4 Микроорганизмы, обнаруженные в посевах, классифицируют по группам.
8.4.1 Мезофильные аэробные и факультативно-анаэробные спорообразуюшие бацтьыы. выделяя среди них молочнокислые бациллы рода Sporolactobacillus и (или) бациллы рода Bacillus, включающие бациллы групп B.subtilis, и (или) B.cereus. и (или) B.polyrayxa. и (или) другие неустановленные виды.
Классификация по группам в соответствии с приложением А.
8.4.2 Мезофильные анаэробные спорообразуюшие клостридии с указанием при необходимости их сульфитредуцирующей способности, и (или) другие анаэробные микроорганизмы с обязательным указанием отсутствия среди выявленных клостридии C.botulinum и C.perfringens.
8.4.3 Термофильные спорообразующие аэробные и факультативно-анаэробные микроорганизмы с указанием их кислотообразующей способности и(или) термофильные спорообразуюшие анаэробные микроорганизмы с указанием их сульфатредуцируюшей способности.
8.4.4 Неспорообраэуюшие бактерии и (или) кокки, и (или) дрожжи, и (или) плесневые грибы в чистой культуре или в смеси со спорообразующими видами.
8.5 Если в нормативном документе на конкретный вид консервированного продукта приведены требования к видовому составу и (или) количеству обнаруженных микроорганизмов, то консервы, отвечающие этим требованиям, и требованиям 8.3 по внешнему виду, по результатам микроскопиро-вания и по значению pH. считают промышленно-стерильными.
8.6 Если хотя бы в одном из посевов обнаружены микроорганизмы, указанные в 8.4.4. то такие консервы оценивают как не отвечающие требованиям промышленной стерильности.
Если нормативным документом на конкретный вид консервированного продукта предусматривается присутствие в консервах микроорганизмов, указанных в 8.4.4. то такие консервы оценивают как отвечающие требовашгям промышленной стерильности.
8.7 Если хотя бы в одном из посевов обнаружены мезофильные клостридии C.botulinum и (или) C.perfringens. то консервы оценивают как не отвечающие требованиям промышленной стерильности.
8.8 Если в нормативном документе на определенные виды консервов не приведены требования к видовому составу и (или) количеству обнаруженных микроорганизмов, то при оценке промышленной стерильности руководствуются следующими указаниями.
Для групп А и Б:
из мезофильных аэробных и факультативно-анаэробных башил в консервах допускаются только башылы фуппы B.subtilis. В нормальных по внешнему виду консервах их количество не должно превышать II клеток в I г или 1 см3 продукта;
из мезофильных клострндий в консервах не допускается присутствие C.botulinum и (или) C.perfringens. В нормальных по внешнему виду консервах количество .мезофильных клострндий (исключая C.botulinum и (или) C.perfringens) не должно превышать одной клетки в I г или I см3 продукта.
В консервах детского и диетического питания наличие мезофильных клострндий нс допускается;
при обнаружении термофильных микроорганизмов консервы должны храниться при температуре не выше 20 *С.
В консервах детского и диетического питания наличие термофильных микроорганизмов не допускается;
наличие микроортанизмов. указанных в 8.4.4. в консервах нс допускается.
Дтя группы В:
из мезофильных аэробных и факультативно-анаэробных башыл в консервах допускаются негазо-образующие виды, нс более 90 КОЕ в 1 г или 1 см3 продукта:
наличие мезофильных клострндий и микроорганизмов, указанных в 8.4.4. оценивается как для групп А и Б.
Дтя группы Г:
микроорганизмы, указанные в 8.4.4. нс допускаются.
Дтя группы Е:
7
микробиологические показатели, их характеристики и нормы устанавливаются в нормативных документах на конкретные продукты.
263
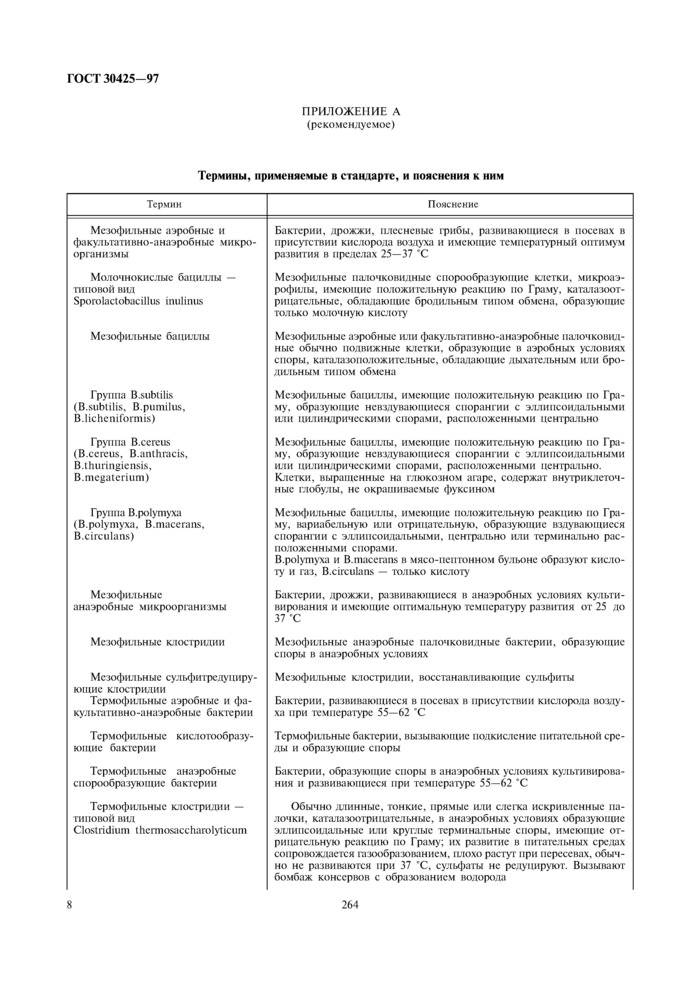
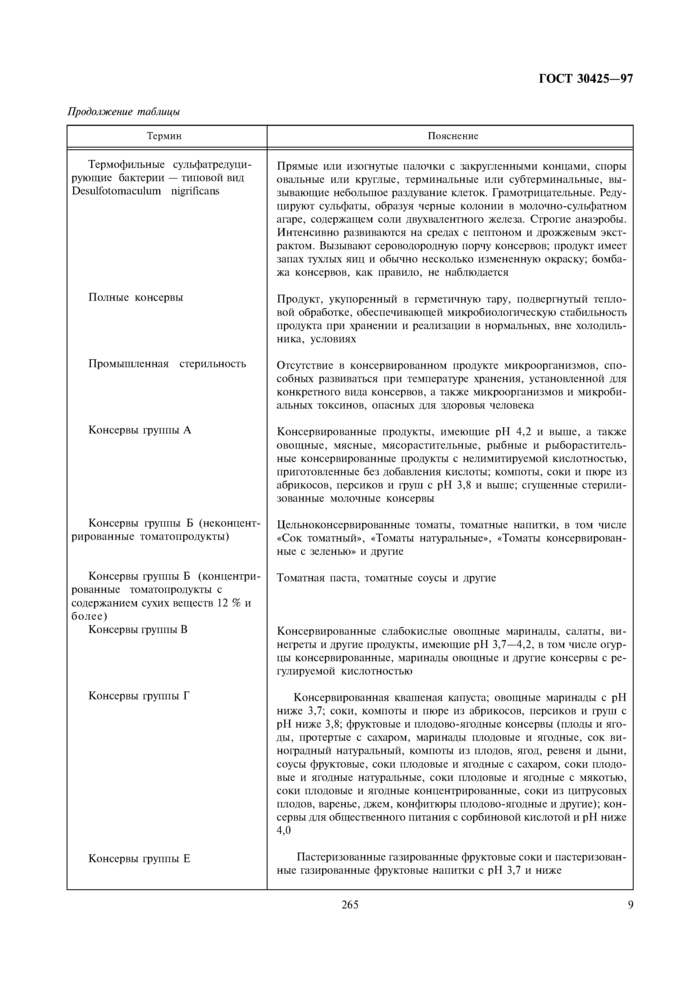
ПРИЛОЖЕНИЕ А
(рекомендуемое)
Термины, применяемые в стандарте, и пояснения к ним
|
Термин |
Пояснение |
|
Мезофильные аэробные и факультативно-анаэробные микроорганизмы |
Бактерии, дрожжи, плесневые фибы. развивающиеся в посевах в присутствии кислорода воздуха и имеющие температурный оптимум развития в пределах 25—37 *С |
|
Молочнокислые бациллы — шпоной вил Sporolactobacillus inulinus |
Мезофильные палочковидные снорообразукипие клетки, микроаэ-рофилы. имеющие положительную реакцию по Граму, каталазоот-рицатсльныс, обладающие бродильным типом обмена, образующие только молочную кислоту |
|
Мезофильные бациллы |
Мезофильные аэробные или факультативно-анаэробные палочковидные обычно подвижные клетки, образующие в аэробных условиях споры, кагалазополож и тельные, обладающие дыхательным или бродильным типом обмена |
|
Группа B.subtilis (B.subtilis. B.pumilus. B.lichcniformis) |
Мезофильные бациллы, имеющие положительную реакцию по Граму, образующие нсвзлувающисся спорангии с эллипсоидальными ИЛИ цилиндрическими спорами, расположенными центрально |
|
Группа B.ccrcus (B.cercus, B.anlhracLs, B.thuringiensis, B.megaterium) |
Мезофильные бациллы, имеющие положительную реакцию по Граму, образующие нсвзлувающисся спорангии с эллипсоидальными или цилиндрическими спорами, расположенными центрально. Клетки, выращенные на глюкозном агаре, содержат внутриклеточные глобулы, нс окрашиваемые фуксином |
|
Группа B.polymyxa (B.polymyxa, B.niaccrans, B.circulans) |
Мезофильные бациллы, имеющие положительную реакцию по Г раму. вариабельную или отрицательную, образующие вздувающиеся спорангии с эллипсоидальными, центрально пли терминально расположенными спорами. B.polymyxa и В. mace runs н мясо-псп тонном бульоне образуют кислоту и газ. B.circulans — только кислоту |
|
Me юфильные анаэробные микроорганизмы |
Бактерии, дрожжи, развивающиеся в анаэробных условиях культивирования и имеющие оптимальную температуру развития от 25 до 37 ’С |
|
Мезофильные клострцдии |
Мезофильные анаэробные наточковидные бактерии, образующие споры в анаэробных условиях |
|
Меэофил ьн ыс сульфитрсдутшру-ющне кл острил и и Термофильные аэробные и факультативно-анаэробные бак герии |
Мезофильные клосгридии. восстанавливающие сульфиты Бактерии, развивающиеся в посевах в присутствии кислорода возлу-ха при температуре 55—62 'С |
|
Термофильные кистотообразу-ющис бактерии |
Термофильные бактерии, вы зывающие подкисление питательной среды и образующие споры |
|
Термофильные анаэробные спорообразующис бактерии |
Бактерии, образующие споры в анаэробных условиях культивирования и развивающиеся при температуре 55—62 *С |
|
Термофильные клострилии — типовой вил Clostridium thcrmosaccharolyticum |
Обычно длинные, тонкие, прямые или степса искривленные палочки. катала зоотри нательные. в анаэробных условиях образующие эхтипсоилальныс или круглые терминальные споры, имеющие отрицательную реакцию по Граму; их разните в питательных средах сопровождается газообразованием, плохо растут при пересевах, обычно не развиваются при 37 'С. сульфаты не редуцируют. Вызывают бомбаж консервов с образованием водорода |
|
X |
264 |
1
На территории Российской Федерации действует ГОСТ Р 52816-2007.