ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
Продукция пищевая специализированная
КОНСЕРВЫ МЯСНЫЕ СТЕРИЛИЗОВАННЫЕ ФАРШЕВЫЕ БИОКОРРИГИРУЮЩЕГО ДЕЙСТВИЯ
Технические условия
Издание официальное
Москва
Стандартинформ
2017
Предисловие
1 РАЗРАБОТАН Федеральным государственным бюджетным научным учреждением «Всероссийский научно-исследовательский институт мясной промышленности имени В.М. Горбатова» (ФГБНУ «ВНИИМП им. В.М. Горбатова»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 36
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 22 августа 2017 г. № 942-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случав пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ, 2017
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
Времяпролетный масс-спектрометр, оснащенный УФ-лазером (Nd), со скоростью регистрации спектров не менее 1 кГц, диаметром фокуса 10 мкм, точностью определения масс 1 ppm.
Листы целлофановые, размером 24 х 24 см.
Стандарт белков (смесь 14 рекомбинантных белков от 10до250кДа).
Весы лабораторные по ГОСТ Р 53228 с пределом допускаемой абсолютной погрешности однократного взвешивания не более г0.1 мг.
pH-метр со стеклянным и хлорсеребряным электродами (или комбинированным стеклянным электродом) с диапазоном измерений от 0 до 14 ед.
Стаканы по ГОСТ 25336 типа В, исполнения 1, номинальной вместимостью 10.50,100,200 см3. Колбы конические по ГОСТ 25336 с делениями, типа Кн. исполнения 2. вместимостью 50.100.200. 500 и 1000 см3.
Цилиндры мерные по ГОСТ 1770. 2 класс точности, вместимостью 10. 25. 50. 100. 250. 500 и 1000 см3.
N.N.N'.N'-Тетраметилэтилендиамин (ТЕМЕД) для электрофореза, массовая доля основного вещества не менее 99.0 %.
Персульфат аммония для электрофореза, массовая доля основного вещества не менее 98,0 %. N.N'-Метилен-бис-акриламид (МБА). массовая доля основного вещества не менее 99.0 %.
Трис (гидроксиметил) аминометан (Трис) сверхчистый, массовая доля основного вещества не менее 99,9 %.
Додецилсульфат натрия (SDS) для электрофореза, массовая доля основного вещества не менее 98.5%.
2-меркаптоэтанол. массовая доля основного вещества не менее 95.0 %.
Акриламид (АА) для электрофореза, массовая доля основного вещества не менее 99.0 %.
Глицерин для электрофореза, массовая доля основного вещества не менее 99,0 %.
Глицин для электрофореза. массовая доля основного вещества не менее 99.0 %.
Кислота фосфорная, массовая доля основного вещества не менее 85%.
Индикатор Бромфеноловый синий, массовая доля основного вещества не менее 99,9 %.
Кумасси G-250. особой чистоты, массовая доля основного вещества не менее 99.9 %.
Мочевина для электрофореза.
Амфолины для изофокусирования, ч. д. а.. 40 % раствор, градиентом 5-7,2-11,3-10.
Тритон Х-100.
Смола ионообменная Амберлит МБ-1.
Агароза для электрофореза.
Ацетонитрил.
Трипсин модифицированный.
Кислота трифторуксусная (ТФУ).
Кислота 2,5-дигидроксибензойная.
Г идрокарбонат аммония.
Спирт изопропиловый абсолютированный по ГОСТ 9805.
Натрий хлористый по ГОСТ 4233.
Кислота уксусная по ГОСТ 61.
Кислота серная по ГОСТ 2184.
Натрия гидроокись по ГОСТ 4328.
Нитрат серебра.
Вода дистиллированная по ГОСТ 6709 или вода для лабораторного анализа по ГОСТ Р 52501. Вода бидистиллированная.
Шприцы Хамильтон объемами 0.01 см3,0,05 см3,0,1 см3.
Пробирки Эппендорф 1,5 см3 с крышкой.
Бумага фильтровальная 11 мм.
Центрифуга с регулируемой скоростью вращения 15000 об/мин.
Холодильник по ГОСТ 26678.
Дозатор пипеточный переменного объема дозирования 0.020—0.200 см3 с относительной погрешностью дозирования =1 %.
Дозатор пипеточный переменного объема дозирования 0.200—1.000 см3 с относительной погрешностью дозирования =1 %.
Дозатор пипеточный переменного объема дозирования 1.000—5.000 см3 с относительной погрешностью дозирования =1 %.
Мешалка магнитная.
8
ГОСТ P 57622—2017
Электромешалка для перемешивания раствора в «градиент-формере».
Насос перистальтический.
Палочка стеклянная.
7.3 Подготовка к проведению измерений
7.3.1 Приготовление растворов
7.3.1.1 Приготовление физиологического раствора
В мерную колбу вместимостью 1000 см3 вносят 9,0 г натрия хлористого и доводят объем колбы до метки дистиллированной водой. Содержимое колбы перемешивают. Раствор хранят при температуре 4 °С не более 30 сут.
7.3.1.2 Приготовление лизирующего раствора для гомогенизации пробы
В стакане вместимостью 100 см3 растворяют (57 ±0.01) г мочевины, пипеточным дозатором переменного объема дозирования 1.000—5,000 см3 добавляют 5 см3 2-меркаптоэтанола. 2 см3 Тритона Х-100 и 2 см3 смеси амфолинов с pH 3—10 ед. pH. Доводят полученный объем бидистиллированной водой до метки, перемешивают и переливают в коническую колбу вместимостью 100 см3 и плотно закрывают пробкой. Раствор хранят при температуре (4 г 2) °С не более 30 сут.
7.3.1.3 Приготовление растворов мономеров (30 % и 56 %) для 1-го и 2-го направлений
Для 1-го направления в стакан вместимостью 100 см3 (для 30 %) вносят 30 г акриламида. 1.6 г МБА. доводят бидистиллированной водой до метки и перемешивают на магнитной мешалке до полного растворения.
Для 2-го направления в колбу вместимостью 500 см3 (для 56 %). вносят 280 г акриламида. 4 г МБА. доводят бидистиллированной водой до метки и перемешивают на магнитной мешалке до полного растворения.
Полученные растворы фильтруют и переливают в конические колбы вместимостью 100 см3 и 500 см3 и плотно закрывают пробкой. Раствор для 1-го направления хранят при температуре (4 г 2) °С, раствор для 2-го направления хранят при температуре (20 г 2) *С. не более 30 сут.
7.3.1.4 Приготовление буферного раствора для разделяющего геля 1.0 М Трис-НС1
В колбу вместимостью 500 см3 вносят (60.75 г 0.01) г трис-(гидрооксиметил)аминометана и 400 см3 бидистиллированной воды, доводят pH концентрированной серной кислотой до 8.8 ед. pH. Объем доводят бидистиллированной водой до метки, переливают в коническую колбу вместимостью 500 см3 и плотно закрывают пробкой. Раствор хранят при температуре (4 ± 2) °С не более 30 сут.
7.3.1.5 Приготовление буферного раствора для концентрирующего геля 0,5 М Трис-НС1
В колбу вместимостью 500 см3 вносят (30.25 = 0.01) г трис-(гидрооксиметил)аминометана и. с помощью мерного цилиндра. 400 см3 бидистиллированной воды. pH доводят концентрированной серной кислотой до 6,8 ед. pH. Объем доводят бидистиллированной водой до метки, переливают в коническую колбу вместимостью 500 см3 и плотно закрывают пробкой. Раствор хранят при температуре (4 = 2) °С не более 30 сут.
7.3.1.6 Приготовление 10 %-ного раствора додецилсульфата натрия
В стакан вместимостью 100 см3 вносят (10.00 г 0,01) г додецилсульфата натрия (SDS) и 70 см3 бидистиллированной воды с помощью мерного цилиндра, аккуратно перемешивают, доводят полученный объем до метки и фильтруют. Раствор переливают в коническую колбу вместимостью 100 см3 и закрывают притертой пробкой. Раствор хранят при температуре (20 г 2) ®С не более 30 сут.
7.3.1.7 Приготовление 10 %-ного раствора персульфата аммония
В стакан вместимостью 10 см3 вносят (0.2 г 0.01) г персульфата аммония и 2 см3 бидистиллированной воды с помощью дозатора пипеточного переменного объема дозирования 1.000—5,000 см3, аккуратно перемешивают. Раствор должен быть свежеприготовленным.
7.3.1.8 Приготовление защитного раствора для полимеризационных трубок
В стакан вместимостью 10 см3 с помощью пипеточного дозатора (переменный объем дозирования 0.200—1.000 см3) вносят 1 см3 лизирующего раствора и 1 см3 бидистиллированной воды, аккуратно перемешивают. Раствор должен быть свежеприготовленным.
7.3.1.9 Приготовление раствора 20 %-ного Тритона Х-100
В стакан вместимостью 10 см3 с помощью пипеточного дозатора (переменный объем дозирования 1.000—5,000 см3) вносят 2 см3 Тритона Х-100 и 8 см3 бидистиллированной воды, аккуратно перемешивают. Раствор хранят при температуре (4 ± 2) °С не более 30 сут.
7.3.1.10 Приготовление переводного (белкового) буфера
В стакан вместимостью 100 см3 вносят (30 ±0.01) г мочевины, с помощью мерного цилиндра
12,5 см3 раствора 0,5 М трис-(гидрооксиметил)аминометана при pH 6,8 ед. pH; 5 см3 2-меркаптоэтано-ла и 20см310 %-ного раствора додецилсульфата натрия. Объем доводят бидистиллированной водой до
9
метки, тщательно перемешивают и переносят в коническую колбу вместимостью 100 см3 с притертой пробкой. Раствор хранят при температуре (4 ± 2) °С, не более 30 сут.
7.3.1.11 Приготовление электродного буфера pH = 8,3 ед. pH
В колбу вместимостью 1000 см3 вносят (18.00 ±0.01) г трис-(гидрооксиметил)аминометана. (86,40 ±0.01) г глицина, (6,00 ±0.01) г додецилсульфата натрия и, с помощью мерного цилиндра, 500 см3 бидистиллированной воды. Полученный объем доводят бидистиллированной водой до 600 см3, тщательно перемешивают и переносят в бутыль вместимостью 6000 см3, плотно закрывают. Раствор хранят при температуре (20 г 2) *С не более 30 сут.
7.3.1.12 Приготовление окрашивающего раствора
В коническую колбу вместимостью 500 см3 вносят (1,00 ± 0,01) г Кумасси G-250 бриллиантового голубого, добавляют 500 см3 изопропилового спирта, 200 см3 уксусной кислоты и доводят объем бидистиллированной водой до 400 см3. Содержимое тщательно перемешивают и переносят в бутыль вместимостью 2000 см3, плотно закрывают. Раствор хранят при температуре (20 г 2) *С не более 30 сут в плотно закрытой бутылке под тягой.
7.3.1.13 Приготовление дегидратирующего раствора для сушки гелей
В коническую колбу вместимостью 500 см3 вносят с помощью мерного цилиндра 250 см3 этилового спирта и 15 см3 глицерина. Объем доводят бидистиллированной водой до 500 см3, тщательно перемешивают и переносят в колбу вместимостью 500 см3. Раствор хранят при температуре (20 ± 2) °С не более 30 сут в плотно закрытой бутылке под тягой.
7.3.1.14 Приготовление агарозы для фиксирования трубок
В стакан вместимостью 100 см3 вносят (0.5 ± 0,01) г агарозы, (0,1 ± 0,01) г бромфенолового синего и добавляют 50 см3 электродного буфера. С помощью мерного цилиндра переносят полученный раствор в коническую колбу, объемом 100 см3. Раствор хранят при температуре (20 ± 2) °С не более 90 сут.
7.3.1.15 Приготовление анодного буфера для изоэлектрофокусирования
В колбу вместимостью 200 см3 вносят 196 мг фосфорной кислоты и, с помощью мерного цилиндра, приливают дистиллированной воды до метки. Раствор должен быть свежеприготовленным.
7.3.1.16 Приготовление катодного буфера для изоэлектрофокусирования
В колбу вместимостью 200 см3 вносят 160 мг гидроокиси натрия и приливают дистиллированной воды до метки. Раствор должен быть свежеприготовленным.
7.3.1.17 Приготовление полимеризационной смеси ПААГ-1
В стакан или колбу вместимостью 50 см3 вносят 12 г мочевины, с помощью пипеточного дозатора (переменный объем дозирования 1,000—5,000 см3) 6.75 см3 дистиллированной воды, 3 см3 30 %-ного раствора мономеров для 1-го направления и 2,25 см3 20 %-ного раствора ТритонаХ-100. После полного растворения мочевины смесь обрабатывают ионообменной смолой Амберлит, фильтруют и добавляют 225 см3 амфолинов pH 3,5—10 ед. pH и, с помощью пипеточного дозатора (переменный объем дозирования 0,200—1.000 см3). 0.9 см3 амфолинов pH 5—7 ед. pH. Затем смесь дегазируют и непосредственно перед заливкой в трубки к ней. с помощью пипеточного дозатора (переменный объем дозирования 0,020—0,200 см3), добавляют 0,0325 см3 10 %-ного персульфата аммония и 0,0225 см3 ТЕМЕД. Для составления 12 колонок ПААГ необходимо 20 см3 полимеризационной смеси. Раствор должен быть свежеприготовленным.
7.3.1.18 Приготовление «легкого» раствора для ПААГ-2 (концентрация АА 7.5 %)
В коническую колбу вместимостью 200 см3 для получения 109 см3 готового раствора с помощью мерного цилиндра вносят 39,6 см31 М Трис-HCI буфера (pH = 8,8 ед. pH), 1,1 см3 10 %-ного раствора SDS с помощью пипеточного дозатора (переменный объем дозирования 1,000—5,000 см3). 0,058 см3 ТЕМЕД. с помощью пипеточного дозатора (переменный объем дозирования 0,020-0,200 см3). 13,8 см3 60 %-ного раствора мономеров для 2-го направления, 54,2 см3 дистиллированной воды и 0,264 см3 10 %-ного раствора персульфата аммония, с помощью пипеточного дозатора (переменный объем дозирования 0,200—1.000 см3). Раствор должен быть свежеприготовленным.
7.3.1.19 Приготовление «тяжелого» раствора для ПААГ-2 (концентрация АА 25 %)
В коническую колбу вместимостью 200 см3 для получения 109 см3 готового раствора вносят 39,6см3 1 М Трис-HCI буфера (pH = 8,8ед. pH), 1,1 см310 %-ного раствора SDS, с помощью пипеточного дозатора (переменный объем дозирования 1,000—5,000 см3), 0,058 см3 ТЕМЕД. с помощью пипеточного дозатора (переменный объем дозирования 0,020—0,200 см3). 46 см3 60 %-ного раствора мономеров для 2-го направления, 22,5 см3 бидистиллированной воды и 0,264 см3 10 %-ного раствора персульфата аммония, с помощью пипеточного дозатора (переменный объем дозирования 0,200—1,000 см3). Раствор должен быть свежеприготовленным.
Ю
ГОСТ P 57622—2017
7.3.1.20 Приготовление 20 %-ногораствора ацеонитрила
В стакан вместимостью 10 см3 вносят 79 мг гидрокарбоната аммония и 10 см3 бидистилированной воды, и, с помощью пипеточного дозатора (переменный объем дозирования 1,000—5,000 см3), отбирают 6 см3 полученного раствора и добавляют 4 г ацетонитрила. Раствор должен быть свежеприготовленным.
7.3.1.21 Приготовление раствора модифицированного трипсина
В коническую колбу вместимостью 1000 см3 вносят 3,95 г гидрокарбоната аммония и доводят объем до метки дисстилированной водой. В полученный раствор добавляют 15 мг модифицированного трипсина.
7.3.1.22 Приготовление 0.5 %-ного раствора ТФУ в 50 %-ном водном растворе ацетонитрила
В стакан вместимостью 10 см3 с помощью пипеточного дозатора (переменный объем дозирования 1,000—5,000 см3) вносят 5 см3 бидистиллированной воды, 5 г ацетонитрила и 0,05 см3 ТФУ, с помощью пипеточного дозатора (переменный объем дозирования 0,020—0,200 см3). Тщательно перемешивают. Раствор должен быть свежеприготовленным.
7.3.1.23 Приготовление фиксирующего раствора
В стеклянную пробирку вместимостью 10 см3 вносят 7,9 см3 бидистиллированной воды, 2 г ацетонитрила. 0,01 см3 ТФУ и 0.2 см3 2,5-дигидро-ксибензойной кислоты. Тщательно перемешивают. Раствор должен быть свежеприготовленным.
7.3.2 Подготовка пробы к испытанию
10 г консервов количественно переносят в стакан вместимостью 50 см3, перемешивают и трижды промывают холодным физиологическим раствором, после чего гомогенизируют (перемешиванием) с 2 см3 лизирующего раствора. Полученный гомогенат центрифугируют на центрифуге при 7000 об/мин в течение 10 мин. Надосадочную жидкость (белковый экстракт) сливают в мерный цилиндр вместимостью 10 см3 и измеряют ее объем. Белковый экстракт с помощью пипеточного дозатора (переменный объем дозирования 0,020—0,200 см3), наносят на трубку геля ИЭФ в количестве 0,050 см3 или 0,075 см3. Пробы хранят в пробирках Эппендорф в холодильнике при температуре минус 30 °С не более 7 сут.
7.3.3 Подготовка ПААГ для проведения измерений
7.3.3.1 Приготовление ПААГ-1 для фракционирования белков в первом направлении
Для фракционирования белков в первом направлении (изоэлектрофокусирование в градиенте pH. созданном амфолинами, IEF) приготовленную непосредственно перед измерением полимеризацион-ную смесь ПААГ-1 в стеклянные трубки вносят шприцом, заполняя трубки снизу вверх до одинакового уровня на 2—3 см ниже верхнего края (высота колонки геля 13 см). Сверху с помощью пипеточного дозатора (переменный объем дозирования 0,020—0,200 см3), наслаивают по 0,050 см3 дистиллированной воды. Через 30—40 мин по окончании полимеризации (затвердевания) геля воду над его поверхностью удаляют и трубки устанавливают в гель-электрофоретическую камеру. В нижний резервуар камеры наливают катодный буфер. В трубки с помощью пипеточного дозатора (переменный объем дозирования 0,020—0,200 см3) наносят пробы анализируемые белковых экстрактов в объеме 0,100 см3 (100 мкг белка). Сверху на пробы, по краям трубки, наслаивают защитный раствор, верхнюю камеру прибора заполняют анодным буфером.
7.3.3.2 Приготовление ПААГ-2 для фракционирования белков во втором направлении
Для фракционирования белков во втором направлении (электрофорез в присутствии SDS, SDS-PAGE) приготовленную непосредственно перед измерением полимеризационную смесь ПААГ-2 готовят в специальных блоках для полимеризации из двух стеклянных пластин.
Подготовка блоков: у левого, правого и нижнего краев между пластинами устанавливают узкие пластиковые слейсеры. плотно фиксируют пластины и спейсеры между собой и герметизируют блок. ПААГ-2 формируют в собранных блоках в виде гелевых пластин с градиентом концентрации акриламида 7,5—25 %. Полимеризационную смесь составляют из двух растворов: «легкого» (концентрация АА 7,5 %) и «тяжелого» (концентрация АА 25 %).
Для составления полимеризационной смеси используют «градиент — фермер». Перед началом работы (оба крана перекрыты) в сосуд с внешним выходом заливают 18 см3 «тяжелого» раствора, а в другой сосуд — 18 см3 «легкого» раствора. Затем в сосуд с внешним выходом устанавливают электромешалку и включают ее, а к внешнему выходу подсоединяют перистальтический насос. Далее открывают оба крана, включают перистальтический насос и с его помощью заполняют формирующейся в сосуде с внешним выходом полимеризационной смесью (с линейно уменьшающейся концентрацией АА от 25 % до 7.5 %) пространство между двумя стеклами для электрофореза в блоке для полимеризации. После заполнения блока на полимеризационную смесь для ПААГ-2 наслаивали воду. Через 30—40 мин по окончании полимеризации геля воду над его поверхностью удаляют и заливают раствор, формирующий концентрирующий ПААГ (ПААГ-К).
11
7.3.3.3 Приготовление полимеризационной смеси для ПААГ-К
На 6 пластинах ПААГ-2 готовят 50 см3 полимеризационной смеси для ПААГ-К. состоящей из 3.3 см3 60 %-ного раствора мономеров для 2-го направления, 33,3 см3 дистиллированной воды, 12,7 см3 Трис-HCI буфера (pH = 6,8 ед. pH). 0,5 см3 10 %-ного раствора SDS. 0,0375 см3 ТЕМЕД и 0,375 см3 10 %-ного раствора персульфата аммония. Сверху осторожно наслаивают небольшое количество воды.
Через 20—30 мин по окончании полимеризации ПААГ-К, сформированные в блоках пластины ПААГ-2 с линейным градиентом концентрации акриламида 7,5—25 % готовы к проведению измерений.
7.4 Фракционирование белков методом двумерного электрофореза
7.4.1 Фракционирование белков в первом направлении — изоэлектрофокусирование в амфол иновом градиенте pH в тонких колонках ПААГ-1
В гель-электрофоретическую камеру устанавливают трубки, содержащие ПААГ-1, в нижний резервуар которой предварительно вносят катодный раствор. В каждую трубку на поверхность ПААГ-1 наносят 0,05—0,075 см3 анализируемого белкового экстракта. Затем сверху на каждую трубку до краев наслаивают защитный раствор.
Верхнюю камеру прибора заполняют анодным раствором. Готовую к использованию гель-электрофоретическую камеру подсоединяют к источнику электроэнергии и выполняют изоэлектрофокусирование.
Изоэлектрофокусирование проводят сначала 30 мин при напряжении 400 В (достигая 200 В/ч) и затем при напряжении 1000 В (до суммарного 3600 В/ч).
По окончании изоэлектрофокусирования колонки геля вынимают из трубок с помощью шприца с тонкой иглой, наполненного водой, вымачивают в 5 см3 «переводного» раствора в течение 10 мин при (20 г 2) °С и используют для фракционирования во втором направлении. Колонки хранят в холодильнике при температуре минус 20 *С не более 30 сут для последующего завершения анализа.
7.4.2 Фракционирование белков во втором направлении — электрофорез в пластинах ПААГ в присутствии SDS(SDS-PAGE)
Каждую колонку ПААГ-1, полученную после фракционирования в первом направлении, выкладывают на торец градиентной пластины ПААГ-2 и заливают расплавленным раствором агарозы для фиксации. Параллельно до образования геля агарозы на торце каждой градиентной пластины рядом с уложенной колонкой ПААГ-1 формируют лунку для нанесения образца, содержащего стандарт белков (0,04 см3 в каждую лунку). Через 5 мин. по окончании затвердевания агарозного геля, пластину помещают в прибор для вертикального электрофореза. SDS-PAGE проводят в течение 16—18 ч (сначала 1ч — 15 мА/гель. 15—17 ч — 5 мА/гель). затем устанавливают завершающие параметры — 30 мА/гель (250 В, 13 Вт) и завершают фракционирование, когда маркерный краситель (бромфеноловый синий) достигает нижнего края гелевых пластин. Окраску полученных гелей проводят с помощью раствора, содержащего Кумасси G-250, а затем, после отмывки 10 %-ной уксусной кислотой, завершают окрашивание нитратом серебра.
Готовые гели помещают в дегидратирующий раствор, целлофановые листы и рамы для сушки гелей.
7.5 Масс-спектрометрическая идентификация Апо А-1
7.5.1 Подготовка к масс-спектрометрии
На влажных гелях, полученных не позднее чем через 48 ч после завершения отмывки от несвязав-шегося красителя, выбирают белковую фракцию Мм/pl (эксп.) = 25,0/4,95, Мм/pl (расчет.) = 30,3/5,38. Выбранные для идентификации белковые фракции вырезают из гелевых пластин (фрагменты не более 3—4 мм3), дважды промывают для удаления красителя в 0,1 см3 раствора ацетонитрила в течение 20 мин при 37 °С. После удаления раствора, для дегидратации геля добавляют 0.1 см3 ацетонитрила. Удалив ацетонитрил и высушив фрагмент геля, прибавляют к нему 0,035 см3 раствора модифицированного трипсина. Гидролиз проводят в течение 2 ч при 37 °С, затем к раствору добавляют 0,00525 см3 раствора ТФУ и тщательно перемешивают. Надгелевый раствор — анализируемую пробу (0,0005 см3) смешивают на мишени с эквивалентным объемом фиксирующего раствора, и высушивают на воздухе.
7.5.2 Проведение испытаний
Масс-спектры получают на времяпролетном масс-спектрометре в режиме положительных ионов с использованием рефлектрона, точность измеренных моноизотолных масс после докалибровки по пикам автолиза трипсина составляет 0,007 % (70 ррт).
Спектры получают в диапазоне масс 500—6500 mlz, выбирая мощность лазера оптимальную для наилучшего разрешения и калибруют их. используя внутренние стандарты.
12
ГОСТ P 57622—2017
Для получения спектров фрагментации используют тандемный режим прибора при детекции положительных ионов. Фрагментацию ионов индуцируют подачей гелия в область начального участка траектории свободного дрейфа ионов (давление инертного газа 2—7—10 Па).
7.6 Обработка результатов
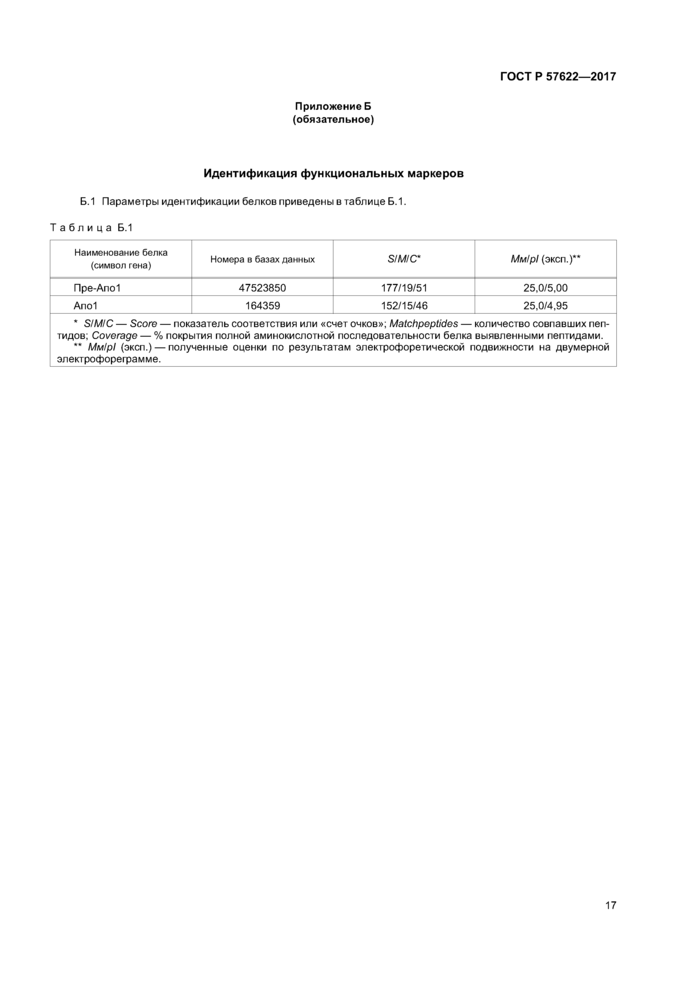
Идентификацию белков проводят с помощью программы Mascot, с точностью определения массы МН+, равной 0,01 % (допускается возможность модификации цистеинов акриламидом и окисления метионинов), по доступным базам данных. При совпадении более 75 % последовательности выявленных пептидов с последовательностью кандидатного белка достоверно принимают, что консервы содержат функциональный маркер (см. таблицу Б. 1 (приложение Б)).
8 Идентификация тканеспецифичных пептидов методом высокоэффективной жидкостной хроматографии
8.1 Сущность метода
Метод основан на применении обращенно-фазной высокоэффективной жидкостной хроматографии. Массовую концентрацию или массовую долю тканеспецифичных пептидов в консервах определяют спектрофотометрическим детектором в ультрафиолетовой области спектра при длине волны 243 нм.
8.2 Аппаратура, материалы, реактивы, подготовка пробы к испытанию — по ГОСТ 33422.
8.3 Подготовка к испытанию
8.3.1 Приготовление растворов
8.3.1.1 Приготовление 20 %-ного раствора ацетонитрила
В коническую колбу вместимостью 100 см3 вносят 20 см3 ацетонитрила и доводят до метки дистиллированной водой
8.3.1.2 Приготовление буферного раствора трис-(гидроксиметил)аминометана молярной концентрации 0.1 М/дм3 (раствор Трис-НС1)
В коническую колбу вместимостью 1000 см3 вносят 12.11 г трис-(оксиметил)аминометана и доводят до метки дистиллированной водой, pH доводят концентрированной соляной кислотой до 8,0 ед. pH. контролируя pH-метром, переносят в колбе вместимостью 1000 см3, плотно закрывают пробкой. Раствор хранят при температуре (4 = 2) °С не более 30 сут в плотно закрытой колбе.
8.3.1.3 Приготовление смеси ацетонитрила с раствором соляной кислоты молярной концентрации с = (HCI) 0.1 М/дм3 (4:1,8)
В коническую колбу вместимостью 100 см3 вносят 70—80 см3 дистиллированной воды, с помощью механического дозатора приливают 0.85 см3 концентрированной соляной кислоты (р = 1,188 r/см3) и доводят объем до метки дистиллированной водой. Ацетонитрил смешивают с раствором соляной кислоты молярной концентрации 0.1 М/дм3 в соотношении 4:1.8. Раствор хранят при температуре (4 ± 2) вС не более 30 сут в плотно закрытой колбе.
8.3.1.4 Приготовление смеси бутанола с хлористым ацетилом (4:1)
В четыре объема бутанола по каплям прибавляют один объем ацетила. Приготовление раствора проводят под вытяжкой, с охлаждением раствора проточной водой или льдом. Раствор готовят в небольших колбах непосредственно перед испытанием.
8.3.1.5 Приготовление 1 %-ного раствора муравьиной кислоты
В коническую колбу вместимостью 1000 см3 вносят 900 см3 дистиллированной воды и 10 см3 муравьиной кислоты, тщательно перемешивают и доводят объем до метки дистиллированной водой. Раствор хранят при температуре (4 г 2) °С не более 30 сут в плотно закрытой колбе.
8.3.1.6 Приготовление подвижной фазы хроматографической системы
Для проведения хроматографического анализа используют двухкомпонентную подвижную фазу:
- элюент А: ацетонитрил — метанол (1:1):
- элюент Б: 1 %-ный раствор муравьиной кислоты.
Перед проведением испытаний элюенты дегазируют на ультразвуковой бане.
8.4 Проведение испытаний
8.4.1 Хроматографические условия измерений
Условия проведения ВЭЖХ-МС/МС анализа подбирают в зависимости от вида применяемого жидкостного хроматографа, масс-слектрометрического детектора и хроматографической колонки.
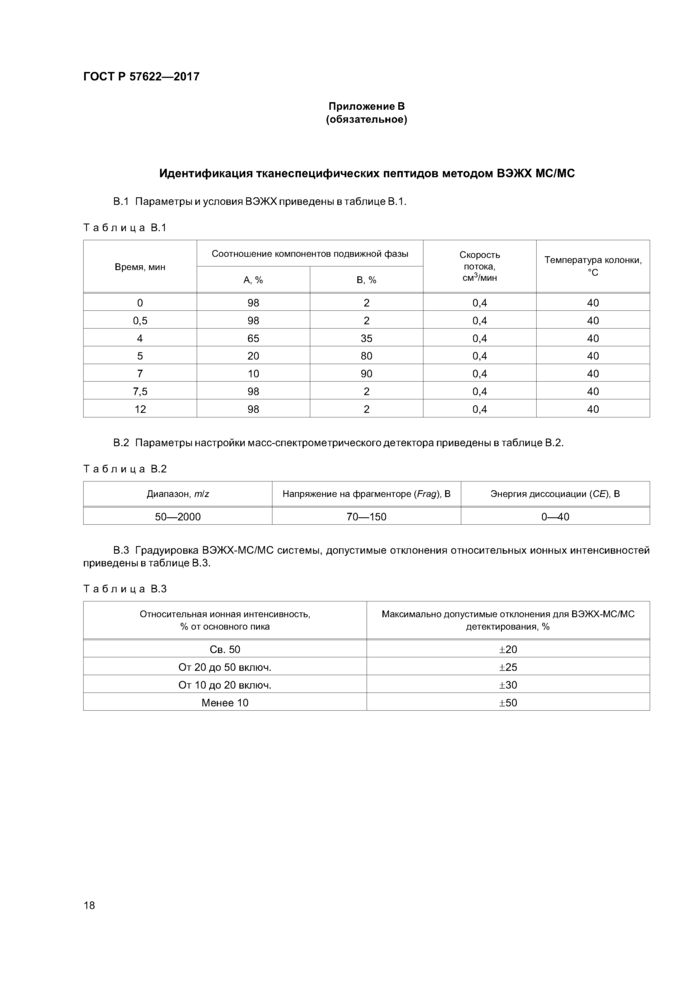
Разделение проводят в режиме градиентного элюирования, соотношение элюентов, скорость потока и температура указаны в таблице В.1 (приложение В). Объем вводимой пробы — 0.01 см3.
13
ГОСТ Р 57622-2017
Содержание
1 Область применения...................................................1
2 Нормативные ссылки..................................................1
3 Термины и определения................................................3
4 Технические требования................................................4
5 Правила приемки.....................................................6
6 Методы контроля.....................................................6
7 Идентификация функциональных маркеров методом двумерного электрофореза............7
8 Идентификация тканеспецифичных пептидов методом высокоэффективной жидкостной
хроматографии.....................................................13
9 Транспортирование и хранение...........................................14
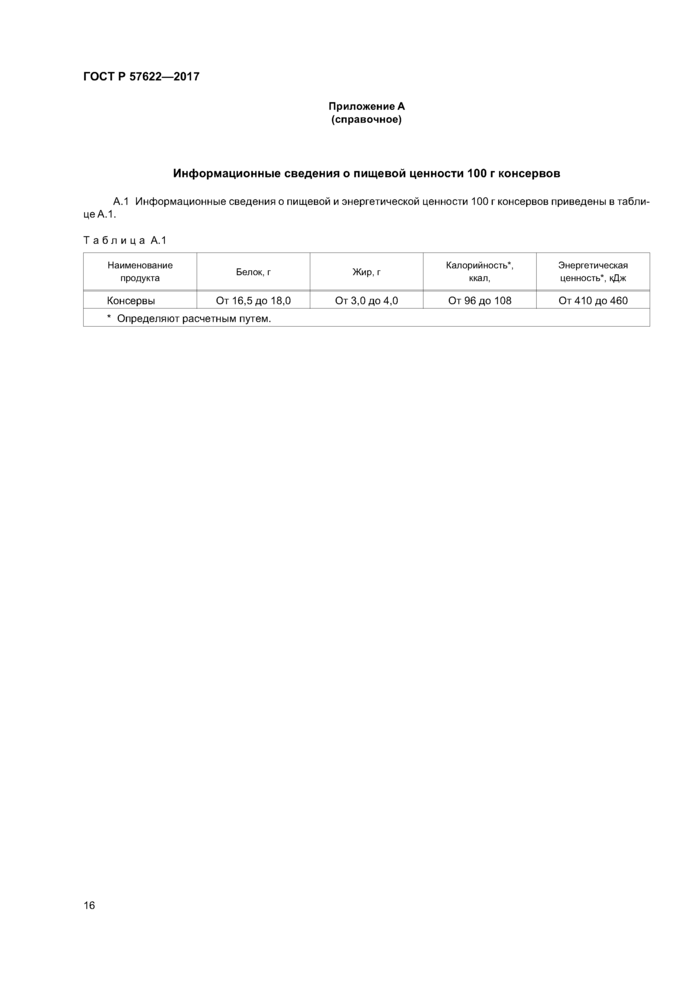
Приложение А (справочное) Информационные сведения о пищевой ценности 100 г консервов . ... 16
Приложение Б (обязательное) Идентификация функциональных маркеров................17
Приложение В (обязательное) Идентификация тканеспецифических пептидов методом
ВЭЖХМС/МС..............................................18
Библиография........................................................19
III
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Продукция пищевая специализированная
КОНСЕРВЫ МЯСНЫЕ СТЕРИЛИЗОВАННЫЕ ФАРШЕВЫЕ БИОКОРРИГИРУЮЩЕГО ДЕЙСТВИЯ
Технические условия
Specialized food products. Canned sterilized minced meat with biocorrecting effect. Specifications
Дата введения — 2018—07—01
1 Область применения
Настоящий стандарт распространяется на специализированные фаршевые мясные стерилизованные консервы биокорригирующего действия (далее — консервы), предназначенные для диетического профилактического питания с целью снижения риска развития гиперлипидемий и атеросклероза.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 8.579 Государственная система обеспечения единства измерений. Требования к количеству фасованных товаров в упаковках любого вида при их производстве, расфасовке, продаже и импорте
ГОСТ 61 Реактивы. Кислота уксусная. Технические условия ГОСТ 1341 Пергамент растительный. Технические условия ГОСТ 1760 Подпергамент. Технические условия
ГОСТ 1770 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ ISO 1841-2 Мясо и мясные продукты. Потенциометрический метод определения массовой доли хлоридов
ГОСТ 2184 Кислота серная техническая. Технические условия ГОСТ 4233 Реактивы. Натрий хлористый. Технические условия ГОСТ 4328 Реактивы. Натрия гидроокись. Технические условия ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ ISO 7218 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ 7269 Мясо. Методы отбора образцов и органолептические методы определения свежести ГОСТ 8273 Бумага оберточная. Технические условия
ГОСТ 8756.0 Продукты пищевые консервированные Отбор проб и подготовка их к испытанию ГОСТ 8756.1 Продукты пищевые консервированные. Методы определения органолептических показателей, массы нетто или объема массовой доли составных частей
ГОСТ 8756.18 Продукты пищевые консервированные. Метод определения внешнего вида, герметичности тары и состояния внутренней поверхности металлической тары
ГОСТ 9142 Ящики из гофрированного картона. Общие технические условия ГОСТ 9805 Спирт изопропиловый. Технические условия
ГОСТ 9959 Мясо и мясные продукты. Общие условия проведения органолептической оценки
Издание официальное
ГОСТ 10444.7 Продукты пищевые. Методы выявления ботулинических токсинов и Clostndium botulinum
ГОСТ 10444.8 (ISO 7932:2004) Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод подсчета презумптивных бактерий Bacillus cereus. Метод подсчета колоний при температуре 30 °С
ГОСТ 10444.9 Продукты пищевые. Метод определения Clostndium perfnngens ГОСТ 10444.12 Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества дрожжей и плесневых грибов
ГОСТ 10444.15 Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
ГОСТ 10574 Продукты мясные. Методы определения крахмала
ГОСТ 13534 Консервы мясные и мясорастительные. Упаковка, маркировка и транспортирование ГОСТ 14192 Маркировка грузов
ГОСТ 15846 Продукция, отправляемая в районы Крайнего Севера и приравненные к ним местности. Упаковка, маркировка, транспортирование и хранение
ГОСТ 19496 Мясо и мясные продукты. Метод гистологического исследования ГОСТ 21650 Средства скрепления тарно-штучных грузов в транспортных пакетах. Общие требования
ГОСТ 23392 Мясо Методы химического и микроскопического анализа свежести
ГОСТ 24297 Верификация закупленной продукции. Организация проведения и методы контроля
ГОСТ 24597 Пакеты тарно-штучных грузов. Основные параметры и размеры
ГОСТ 25011 Мясо и мясные продукты. Методы определения белка
ГОСТ 25336 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25951 Пленка полиэтиленовая термоусадочная. Технические условия ГОСТ 26183 Продукты переработки плодов и овощей, консервы мясные и мясорастительные. Метод определения жира
ГОСТ 26186 Продукты переработки плодов и овощей, консервы мясные и мясорастительные. Методы определения хлоридов
ГОСТ 26663 Пакеты транспортные. Формирование с применением средств пакетирования. Общие технические требования
ГОСТ 26669 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов ГОСТ 26671 Продукты переработки фруктов и овощей, консервы мясные и мясорастительные. Подготовка проб для лабораторных анализов
ГОСТ 26678 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
ГОСТ 26927 Сырье и продукты пищевые. Методы определения ртути
ГОСТ 26929 Сырье и продукты пищевые. Подготовка проб. Минерализация для определения содержания токсичных элементов
ГОСТ 26930 Сырье и продукты пищевые. Метод определения мышьяка ГОСТ 26932 Сырье и продукты пищевые. Методы определения свинца ГОСТ 26933 Сырье и продукты пищевые. Методы определения кадмия ГОСТ 26935 Продукты пищевые консервированные. Метод определения олова ГОСТ 28560 Продукты пищевые. Метод выявления бактерий родов Proteus. Morganella, Provi-dencia
ГОСТ 29185 (ISO 15213:2003) Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета сульфитредуцирующих бактерий, растущих в анаэробных условиях ГОСТ 29301 Продукты мясные. Метод определения крахмала
ГОСТ 30178 Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов
ГОСТ 30425 Консервы. Метод определения промышленной стерильности ГОСТ 30538 Продукты пищевые. Методика определения токсичных элементов атомно-эмиссионным методом
ГОСТ 31479 Мясо и мясные продукты. Метод гистологической идентификации состава ГОСТ 31628 Продукты пищевые и продовольственное сырье. Инверсионно-вольтамперометри-ческий метод определения массовой концентрации мышьяка
ГОСТ 31659 (ISO 6579:2002) Продукты пищевые. Метод выявления бактерий рода Salmonella
ГОСТ Р 57622-2017
ГОСТ 31694 Продукты пищевые, продовольственное сырье. Метод определения остаточного содержания антибиотиков тетрациклиновой группы с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектором
ГОСТ 31719 Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный)
ГОСТ 31746 (ISO 6888-1:1999, ISO 6888-2:1999, ISO 6888-3:1999) Продукты пищевые. Методы выявления и определения количества коагулазоположител ьных стафилококков и Staphylococcus aureus ГОСТ 31747 Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)
ГОСТ 31796 Мясо и мясные продукты. Ускоренный гистологический метод определения структурных компонентов состава
ГОСТ 31903 Продукты пищевые. Экспресс-метод определения антибиотиков ГОСТ 31904 Продукты пищевые. Методы отбора проб для микробиологических испытаний ГОСТ 32161 Продукты пищевые. Метод определения содержания цезия Cs-137 ГОСТ 32164 Продукты пищевые. Метод отбора проб для определения стронция Sr-90 и цезия Cs-137
ГОСТ 32308 Мясо и мясные продукты. Определение содержания хлорорганических пестицидов методом газожидкостной хроматографии
ГОСТ 33422 Мясо и мясные продукты. Определение массовой доли йодтирозинов методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектором ГОСТ Р 51289 Ящики полимерные многооборотные. Общие технические условия ГОСТ Р 51301 Продукты пищевые и продовольственное сырье. Инверсионно-вольтамперометри-ческие методы определения содержания токсичных элементов (кадмия, свинца, меди и цинка)
ГОСТ Р 51447 Мясо и мясные продукты. Методы отбора проб
ГОСТ Р 51448 Мясо и мясные продукты. Методы подготовки проб для микробиологических исследований
ГОСТ Р 51480 Мясо и мясные продукты. Определение массовой доли хлоридов Метод Фольгарда ГОСТ Р 51574 Соль поваренная пищевая. Технические условия
ГОСТ Р 51766 Сырье и продукты пищевые . Атомно-абсорбционный метод определения мышьяка ГОСТ Р 52501 Вода для лабораторного анализа. Технические условия
ГОСТ Р 53228 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ Р 53876 Крахмал картофельный. Технические условия ГОСТ Р 54366 Блоки из субпродуктов замороженные. Технические условия ГОСТ Р 54463 Тара из картона и комбинированных материалов для пищевой продукции. Технические условия
ГОСТ Р 55480 Мясо и мясные продукты. Метод определения кислотного числа ГОСТ Р 55572 Консервы мясные. Общие технические условия
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общею пользования — на официальном сайте Федеральною агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этою стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данногоизменения. Если ссылочный стандарт отменен беззамены, тоположе-ние. в котором дана ссылка на него, рекомендуется применять в части, не затративающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по (1), (2] и (3), а также следующие термины с соответствующими определениями:
3.1 пищевые продукты биокорригирующего действия: Пищевые продукты и пищевые добавки, применяемые для профилактики, коррекции и поддержания в физиологических границах функциональной активности органов и систем человека.
3
3.2 функциональный маркер: Вещество белковой или пептидной природы, обеспечивающее заявленное биокорригирующее действие продукта.
3.3 тканеспецифичный пептид: Вещество пептидной природы, содержащееся в определенной ткани и обладающее направленным биологическим действием.
3.4 Апо 1: Алипопротеин Апо1, основной белок в составе липопротеинов высокой плотности, обеспечивает все транспортные функции липопротеидов.
3.5 лре-Апо А-1: Белок-предшественник Апо 1.
4 Технические требования
4.1 Консервы должны соответствовать требованиям [1]. (2). [3]. настоящего стандарта и вырабатываться по технологической инструкции по производству пищевых специализированных мясных стерилизованных фаршевых консервов.
4.2 Характеристики
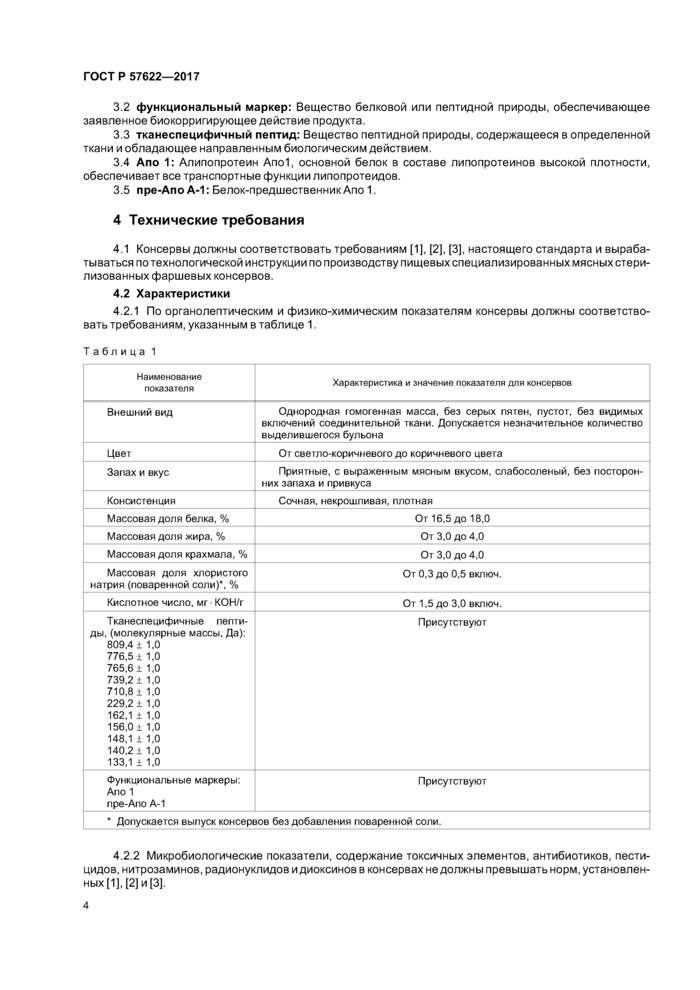
4.2.1 По органолептическим и физико-химическим показателям консервы должны соответствовать требованиям, указанным в таблице 1.
|
Таблица 1 |
|
Наименование
показателя |
Характеристика и значение показателя для консервов |
|
Внешний вид |
Однородная гомогенная масса, без серых пятен, пустот, без видимых включений соединительной ткани. Допускается незначительное количество выделившегося бульона |
|
Цое г |
От светло-коричневого до коричневого цвета |
|
Запах и окус |
Приятные, с выраженным мясным вкусом, слабосоленый, без посторонних запаха и привкуса |
|
Консистенция |
Сочная, некрошливая. плотная |
|
Массовая доля белка. % |
От 16.5 до 18.0 |
|
Массовая доля жира. % |
От 3.0 до 4.0 |
|
Массовая доля крахмала. % |
От 3.0 до 4.0 |
|
Массовая доля хлористого натрия (поваренной соли)*, % |
От 0.3 до 0.5 включ. |
|
Кислотное число, мг КОН/г |
От 1.5 до 3.0 включ. |
|
Тканеспецифичные пептиды, (молекулярные массы. Да):
809.4 ± 1.0
776.5 i 1.0
765.6 1 1.0
739.21 1.0 710.81 1.0
229.21 1.0 162.11 1.0
156.01 1,0
148.1 1 1.0
140.21 1.0
133.1 1 1.0 |
Присутствуют |
|
Функциональные маркеры: Апо 1
пре-Ало А-1 |
Присутствуют |
|
* Допускается выпуск консервов без добавления поваренной соли. |
|
4.2.2 Микробиологические показатели, содержание токсичных элементов, антибиотиков, пестицидов, нитрозаминов, радионуклидов и диоксинов в консервах не должны превышать норм, установленных (1]. [2J и (3].
4
ГОСТ P 57622—2017
4.2.3 Консервы должны быть герметично укупорены и стерилизованы.
4.3 Требования к сырью и материалам
4.3.1 Для производства консервов применяют:
- сердца свиные замороженные в блоках по ГОСТ Р 54366:
- аорты свиные замороженные:
- соль поваренную пищевую выварочную или каменную, самосадочную, садочную помолов № 0 и 1 не ниже первого сорта по ГОСТ Р 51574;
- крахмал картофельный не ниже второго сорта по ГОСТ Р 53876:
- воду питьевую по [4].
4.3.2 Используемое при производстве консервов:
- сырье животного происхождения должно быть получено от здоровых животных, подлежит ветеринарно-санитарной экспертизе и должно соответствовать требованиям (1) и (2);
- прочее сырье (ингредиенты) должно соответствовать требованиям (2) и (3).
4.3.3 Не допускается применение:
- сердца и аорты хряков;
- мясных ингредиентов, замороженных более одного раза или сырья в замороженном состоянии со сроком годности более 6 мес, с признаками окислительной порчи;
- генетически модифицированных сырьевых компонентов.
4.4 Маркировка
4.4.1 Консервы в потребительской упаковке должны иметь маркировку, характеризующую продукцию и отвечающую требованиям (1). (3], (5) с указанием следующей дополнительной информации:
- сведения о том. что продукт предназначен для диетического профилактического питания с целью снижения риска развития гиперлипидемий и атеросклероза;
- обозначение настоящего стандарта;
- пищевая ценность 100 г консервов (см. приложение А) и рекомендации по приготовлению («Перед употреблением рекомендуется разогреть»).
Дополнительные информационные данные, возможные для указания в маркировке потребительской упаковки:
- без консервантов;
- без добавления соли (в консервах без добавления соли);
- без использования ГМО.
Маркировочные надписи наносят в соответствии с ГОСТ 13534 и ГОСТ Р 55572.
Пример маркировки
•Продукция пищевая специализированная диетического профилактического питания для снижения риска развития гиперлипидемий и атеросклероза. Мясные консервы стерилизованные фаршевые биокорригирующего действия•.
4.4.2 Маркировка транспортной упаковки — по [1). [5). ГОСТ 13534. ГОСТ 14192 иГОСТР55572.с нанесением манипуляционных знаков: «Беречь от влаги», «Пределы температуры», «Верх» и информационной надписи о сроке годности и условиях хранения.
4.4.3 Маркировку наносят на одну из сторон транспортной упаковки путем наклеивания ярлыка с указанием следующих дополнительных данных:
- масса нетто;
- сведения о том. что продукт предназначен для диетического профилактического питания с целью снижения риска развития гиперлипидемии и атеросклероза;
- обозначение настоящего стандарта.
4.4.4 Маркировка консервов, отправляемых в районы Крайнего Севера и приравненные к ним местности. — поГОСТ 15846.
4.5 Упаковка
4.5.1 Потребительская и транспортная упаковка, упаковочные материалы и скрепляющие средства должны соответствовать требованиям (6], ГОСТ 13534, обеспечивать сохранность и качество консервов при транспортировании и хранении в течение всего срока годности.
4.5.2 Упаковку консервов проводят по ГОСТ 13534 и ГОСТ Р 55572.
4.5.3 Консервы в потребительской упаковке помещают в транспортную упаковку — ящики из гофрированного картона по ГОСТ Р 54463, ГОСТ 9142, полимерные многооборотные ящики по ГОСТ Р 51289 или в термоусадочную пленку по ГОСТ 25951.
5
4.5.4 Многооборотная упаковка должна иметь крышку. При отсутствии крышки допускается для местной реализации упаковку накрывать подпергаментом по ГОСТ 1760, пергаментом по ГОСТ 1341, оберточной бумагой по ГОСТ 8273 или полимерной пленкой.
4.5.5 Допускается использовать другие виды упаковки, соответствующие требованиям, изложен-нымв4.5.1.
4.5.6 В каждую единицу транспортной упаковки упаковывают консервы одной даты выработки и одного вида упаковки.
4.5.7 Масса нетто консервов в одной потребительской упаковочной единице должна соответствовать номинальной, указанной в маркировке продукта в потребительской упаковке, с учетом допустимых отклонений.
Пределы допускаемых отрицательных отклонений массы нетто одной упаковочной единицы от номинальной — по ГОСТ 8.579.
4.5.8 Масса нетто консервов в ящиках из гофрированного картона должна быть не более 20 кг. в контейнерах и таре-оборудовании — не более 250 кг; масса брутто продукции в многооборотной упаковки — не более 30 кг.
4.5.9 Упаковка консервов, отправляемых в районы Крайнего Севера и приравненные к ним местности, — поГОСТ 15846.
5 Правила приемки
5.1 Правила приемки — по ГОСТ 24297, ГОСТ Р 55572 и настоящему стандарту.
5.2 Консервы принимают партиями.
Партией считают определенное количество продукции, одинаково упакованной, произведенной (изготовленной) одним изготовителем в определенный промежуток времени, сопровождаемое товаросопроводительной документацией, обеспечивающей прослеживаемость продукции.
5.3 Органолептические показатели консервов определяются в каждой партии.
5.4 Физико-химические показатели, массовые доли хлористого натрия (поваренной соли), крахмала, микробиологические показатели определяют в каждой партии, а также по требованию контролирующей организации или потребителя.
5.5 Содержания токсичных элементов, антибиотиков, пестицидов, нитрозаминов и радионуклидов осуществляют с периодичностью, установленной в программе производственного контроля.
5.6 Контроль за содержанием диоксинов проводят в случаях ухудшения экологической ситуации, связанной с авариями, техногенными и природными катастрофами, приводящими к образованию и попаданию диоксинов в окружающую среду, в случае обоснованного предположения о возможном их наличии в продовольственном сырье.
5.7 Идентификацию консервов по рецептурному составу, гистологическую идентификацию сырьевого состава консервов и отсутствие ГМО проводят по требованию контролирующей организации или потребителя.
5.8 При отрицательных результатах испытаний хотя бы по одному показателю качества или безопасности партия консервов приемке не подлежит.
6 Методы контроля
6.1 Отбор проб — по ГОСТ Р 51447, ГОСТ 31904, ГОСТ 8756.0. ГОСТ 32164.
6.2 Подготовка проб для определения токсичных элементов — по ГОСТ 26929. ГОСТ 26671.
6.3 Подготовка проб к микробиологическим исследованиям — по ГОСТ Р 51448, ГОСТ 26669.
Общие требования проведения микробиологического контроля — по ГОСТ ISO 7218.
6.4 Определение органолептических показателей — по ГОСТ 7269, ГОСТ 8756.1, ГОСТ 9959.
6.5 Определение внешнего вида, герметичности упаковки и состояния внутренней поверхности металлической упаковки — поГОСТ 8756.18.
6.6 Определение физико-химических показателей:
- массовой доли жира — по ГОСТ 26183;
- массовой доли белка— по ГОСТ 25011;
- массовой доли крахмала — поГОСТ 10574, ГОСТ 29301;
- массовой доли хлористого натрия (поваренной соли) — по ГОСТ Р 51480, ГОСТ ISO 1841-2, ГОСТ 26186;
- кислотное число —по ГОСТ Р 55480.
6
ГОСТ P 57622—2017
6.7 Определение микробиологических показателей:
- количества мезофильных аэробных и факультативно-анаэробных микроорганизмов — по ГОСТ 10444.15;
- бактерий группы кишечных палочек (колиформ) — по ГОСТ 31747;
- бактерий рода Proteus — по ГОСТ 28560;
- Staphylococcus aureus — по ГОСТ 31746;
- сульфитредуцирующих клостридий — по ГОСТ 29185, ГОСТ 10444.7, ГОСТ 10444.9;
- Bacillus cereus — по ГОСТ 10444.8;
- патогенных микроорганизмов, в том числе:
- Salmonella — по ГОСТ 31659;
- дрожжей, плесневых грибов — поГОСТ 10444 12.
6.8 Определение промышленной стерильности — по ГОСТ 30425.
6.9 Определение содержания токсичных элементов:
- ртути — по ГОСТ 26927;
- мышьяка — по ГОСТ Р 51766, ГОСТ 26930, ГОСТ 30538, ГОСТ 31628;
- свинца — по ГОСТ Р 51301. ГОСТ 26932, ГОСТ 30178, ГОСТ 30538;
- кадмия — по ГОСТ Р 51301, ГОСТ 26933, ГОСТ 30178, ГОСТ 30538;
- олова — по ГОСТ 26935, ГОСТ 30538.
6.10 Определение антибиотиков — по ГОСТ 31903, ГОСТ 31694.
6.11 Определение пестицидов — по ГОСТ 32308.
6.12 Определение радионуклидов — по ГОСТ 32161.
6.13 Определение нитрозаминов — по [7].
6.14 Определение диоксинов — по [8].
6.15 В случае разногласия по составу и видовой принадлежности используемого сырья проводят идентификацию сырьевого состава консервов:
- молекулярным методом по ГОСТ 31719;
- гистологическим методом по ГОСТ 19496, ГОСТ 31479, ГОСТ 31796.
6.16 Идентификацию функциональных маркеров — в соответствии с разделом 7.
6.17 Идентификацию тканеспецифических пептидов — в соответствии с разделом 8.
6.18 В случае разногласий в оценке свежести используемого сырья свежесть мясных ингредиентов определяют по ГОСТ 7269 и ГОСТ 23392.
7 Идентификация функциональных маркеров методом двумерного электрофореза
7.1 Сущность метода
Метод основан на электрофоретическом разделении экстрагированных белковых фракций в двух направлениях путем сочетания изоэлектрического фокусирования и электрофореза в полиакриламидном геле. Идентификацию функциональных маркеров проводят масс-спектрометрическим путем трип-синолиза белковых фракций и сопоставления аминокислотных последовательностей с кандидатным белком баз данных.
7.2 Аппаратура, материалы, реактивы
Камера для электрофореза, вертикальная, типа Страдиера укомплектованная:
- высоковольтным источником тока (500 Вт. 2.5 А. 500 В);
- адаптером для проведения изофокусирования;
- стеклянными пластинами для электрофореза, размером 200 х 200 х 1 мм, держателями для стекол;
- градиент-формером (16,5 х 11.2 х 18 см), представляющим собой два одинаковых по размерам сообщающихся сосуда, емкостью 2 х 400 см3, соединение между которыми перекрывается краном, при этом один из сосудов должен иметь внешний выход, перекрывающийся краном;
- гребенками для электрофореза (толщиной 1.0— 1,5 мм, 10 зубцами);
- спейсерами для электрофореза (200 х 10 х 1 мм);
- стеклянными трубками для изофокусирования в амфолиновом градиенте, 180 см, внутренним диаметром 2,4 мм;
- рамами для сушки гелей 24 х 24 см;
- иглами для заливки геля в трубки и для экструдии геля из трубки.
7