ГОСТ Р 53047-2008
Препараты ферментные. Методы определения ферментативной активности ксиланазы
Купить ГОСТ Р 53047-2008 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает методы определения ферментативной активности ксиланазы (экзо- и эндоксиланазной активностей) ферментных препаратов и ферментсодержащих смесей с использованием окрашенного субстрата и ксилана.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Метод определения ферментативной активности ксиланазы с субстратом ксиланом
4.1 Характеристики метода
4.2 Средства измерений, вспомогательное оборудование и реактивы
4.3 Подготовка к анализу
4.4 Подготовка пробы
4.5 Проведение анализа
4.6 Обработка результатов
4.7 Сходимость и воспроизводимость результатов
5 Определение ферментативной активности ксиланазы с окрашенным субстратом
5.1 Характеристики метода
5.2 Средства измерений, вспомогательное оборудование и реактивы
5.3 Подготовка к анализу
5.4 Подготовка пробы
5.5 Проведение анализа
5.6 Обработка результатов
5.7 Сходимость и воспроизводимость результатов
Библиография
| Дата введения | 01.01.2010 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.07.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел Электроэнергия
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел Экология
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
- Раздел 65.120 Корма для животных
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
- Раздел Электроэнергия
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
- Раздел 65.120 Корма для животных
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
Организации:
| 16.12.2008 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 416-ст |
|---|---|---|---|
| Разработан | ФГУ ВГНКИ | ||
| Разработан | НТЦ Лекбиотех | ||
| Издан | Стандартинформ | 2009 г. |
Enzyme preparation. Methods of xylanase ferment activity detection
- ГОСТ 24104-2001 Весы лабораторные. Общие технические требования
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 13867-68 Продукты химические. Обозначение чистоты
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 199-78 Реактивы. Натрий уксуснокислый 3-водный. Технические условия
- ГОСТ 20264.0-74 Препараты ферментные. Правила приемки и методы отбора проб
- ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
- ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
- ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
- ГОСТ 5845-79 Реактивы. Калий-натрий виннокислый 4-водный. Технические условия
- ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
- ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
- ГОСТ Р 51652-2000 Спирт этиловый ректификованный из пищевого сырья. Технические условия
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6
стр. 7

стр. 8

стр. 9
стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСТР
53047-
2008
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ПРЕПАРАТЫ ФЕРМЕНТНЫЕМетоды определения ферментативной активностиксиланазы
ксиланазы
Издание официальное
со
о
о
I
CN
Москва
Стандартинформ
2009
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0 — 2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным учреждением «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГУ «ВГНКИ») и Научно-техническим центром «Лекарства и биотехнология» (НТЦ «Лекбиотех»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 454 «Охрана жизни и здоровья животных и ветеринарно-санитарная безопасность продуктов животного происхождения и кормов»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 16декабря2008 г. №416-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ. 2009
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Содержание
1 Область применения...................................................1
2 Нормативные ссылки..................................................1
3 Термины и определения................................................2
4 Метод определения ферментативной активности ксиланазы с субстратом ксиланом..........2
4.1 Характеристика метода..............................................2
4.2 Средства измерений, вспомогательное оборудование и реактивы...................2
4.3 Подготовка к анализу................................................3
4.4 Подготовка пробы..................................................5
4.5 Проведение анализа................................................5
4.6 Обработка результатов..............................................5
4.7 Сходимость и воспроизводимость результатов...............................6
5 Определение ферментативной активности ксиланазы с окрашенным субстратом............6
5.1 Характеристика метода..............................................6
5.2 Средства измерений, вспомогательное оборудование и реактивы...................6
5.3 Подготовка к анализу................................................7
5.4 Подготовка пробы..................................................8
5.5 Проведение анализа................................................8
5.6 Обработка результатов..............................................8
5.7 Сходимость и воспроизводимость результатов...............................9
Библиография........................................................10
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРЕПАРАТЫ ФЕРМЕНТНЫЕ
Методы определения ферментативной активности ксиланазы
Enzyme preparations.
Methods of xylanase ferment activity detection
Дата введения — 2010—01—01
1 Область применения
Настоящий стандарт устанавливает методы определения ферментативной активности ксиланазы (экзо- и эндоксиланазной активностей) ферментных препаратов и ферментсодержащих смесей с использованием окрашенного субстрата и ксилана.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р 51652-2000 Спирт этиловый ректификованный из пищевогосырья. Технические условия ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия ГОСТ 199-78 Реактивы. Натрий уксуснокислый 3-водный. Технические условия ГОСТ 1770-74 (ИСО 1042 —83, ИСО 4788—80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 5845-79 Реактивы. Калий-натрий виннокислый 4-водный. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия ГОСТ 13867-68 Продукты химические. Обозначения чистоты ГОСТ 20264.0-74 Препараты ферментные. Правила приемки и методы отбора проб ГОСТ 24104-2001 Весы лабораторные Общие технические требования
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 29227-91 (ИСО 8351-1—81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на нето. применяется в части, не затрагивающей эту ссылку.
Издание официальное
3 Термины и определения
В настоящем стандарте применяют следующие термины с соответствующими определениями:
3.1 гидролиз: Расщепление исходного соединения на два более простых в присутствии молекул воды.
3.2 ферментативный гидролиз: Гидролиз высокомолекулярных соединений под воздействием катализаторов белковой природы — гидролитических ферментов (гидролаз. класс 3(1]).
3.3 субстрат: Соединение или вещество, на которое воздействует данный фермент.
3.4 ксилан: Высокомолекулярное соединение, полимер ксилозы с (И .4 гликозидными связями, с водой образует коллоидные растворы.
3.5 азо-ксилан: Высокомолекулярное соединение ксилана. к которому привязан хромофор -азо-группа, имеющее желто-оранжевое окрашивание.
3.6 экзоксиланаза (системное название: экзо-1,4-ксилозидаза, или (йссилозидаза,
К.Ф.3.2.1.37 [1J): Фермент, катализирующий гидролиз(VI .4 связи цепей ксиланов, ксилоолигосахаридов, ксилобиозы со стороны концов, содержащих нередуцирующие остатки ксилозы, с отщеплением свободной ксилозы.
3.7 эндоксиланаза (эндо-1,4-|М)-ксилан ксиланогидролаза, К.Ф.3.2.1.8[1]): Фермент, катализирующий гидролиз (VI .4 ксилозидных связей в цепи ксиланов с неупорядоченным расщеплением молекулы на крупные фрагменты (олигосахариды).
4 Метод определения ферментативной активности ксиланазыс субстратом ксиланом
4.1 Характеристика метода
4.1.1 Метод основан на количественном определении редуцирующих (восстанавливающих) сахаров. образующихся при действии фермента ксиланазы (экзоксиланазы) на (VI ,4 связи ксилана приопре-делении в стандартных условиях.
Метод используется при возникновении разногласий в качестве арбитражного.
4.1.2 За единицу ферментативной активности ксиланазы (1 ед. КсА) принимают количество фермента, действующего на ксилан с высвобождением 1 мкмоля восстанавливающих сахаров (в пересчете на ксилозу) за 1 мин при стандартных условиях (температура 50 °С. значение pH 4.7. продолжительность гидролиза 10 мин).
4.1.3 Содержание редуцирующих сахаров, образующихся в результате ферментативной реакции, определяют колориметрическим методом с ДНС-реактивом при длине волны 540 нм и рассчитывают по градуировочному графику, построенному для ксилозы. Диапазон измерений контролируемого показателя 180—5000 ед. КсА.
4.2 Средства измерений, вспомогательное оборудование и реактивы
4.2.1 Для определения ферментативной активности ксиланазы используют следующие средства измерений и оборудование:
- фотоэлектроколориметр (ФЭК) или спектрофотометр (СФ) любого типа, которые обеспечивают измерения при длине волны 540 нм, с погрешностью измерения коэффициента пропускания не более 1 % (не более 0.01 единицы оптической плотности):
- pH-метр любого типа для измерения в диапазоне от 0 до 14 pH. с пределом допускаемой погрешности в эксплуатации = 0.1 единиц pH;
- магнитную мешалку любой марки, которая обеспечивает скорость вращения до 800 мин-1;
- ультратермостат или водяной термостат с точностью регулирования температуры = 1 °С;
- весы лабораторные по ГОСТ 24104, высокого класса точности, с наибольшим пределом взвешивания 200 г. ценой поверочного деления 0.1 мг и пределом допускаемой погрешности 8 эксплуатации ± 0.15 мг; а также с наибольшим пределом взвешивания 1 кг. ценой поверочного деления 20 мг и пределом допускаемой погрешности в эксплуатации ± 30 мг;
- лабораторную центрифугу любого типа, которая обеспечивает скорость вращения не менее 7000 мин-1;
- водяную баню любого типа, которая обеспечивает поддержание температуры (100 ± 1) °С;
- таймер любого типа с погрешностью г 30 с;
- секундомер с емкостью шкалы счетчика 1 мин. ценой деления 1 с и погрешностью = 1.5 с; 1
- механическую мельницу, обеспечивающую размалывание исследуемого образца ферментного препарата до полного прохода пробы через сито;
- сито с размером отверстий 1.0 мм. сделанное из металлического проволочного тканого материала.
4,2.2 Для определения ферментативной активности ксиланазы используют следующие лабораторную посуду и материалы;
- колбы мерные 1(2)-50,100,200,500,1000-2 по ГОСТ 1770;
- воронки ВФ — 1 (2)-60-ПОР 500 ТХС по ГОСТ 25336;
- пробирки П1-14-120 ХС или П1-16-150 ХС по ГОСТ 25336;
- пипетки по ГОСТ 29227;
- пипетки автоматические вместимостью от 0.1 до 1.0 см2с наконечниками;
- колбы и стаканы (бюксы) СВ 19/9 и 24/10 по ГОСТ 25336:
- стаканы В-1-25,50,100,150,250,600,800,1000 ТС по ГОСТ 25336;
- цилиндры 1(2.3,4)-50 (100) по ГОСТ 1770;
- эксикатор любого исполнения по ГОСТ 25336;
- ступку и пестик фарфоровые по ГОСТ 9147.
4 .2.3 Для определения ферментативной активности ксиланазы используют следующие реактивы;
- кислоту уксусную ледяную по ГОСТ 61;
- натрий уксуснокислый трехводный по ГОСТ 199;
- калий-натрий виннокислый четырехводный по ГОСТ 5845;
- натрия гидроокись по ГОСТ 4328;
- воду дистиллированную по ГОСТ 6709;
- кислоту 3.5-динитросалициловую (ДНС) кристаллическую с содержанием основного вещества
98 %;
- D-ксилозу с содержанием основного вещества 98 % — 99 %;
- ксилан из овса или березовый с содержанием остатков ксилозы.
4.2.4 Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч.д.а.) по ГОСТ 13867.
4.2.5 Допускается применение других средств измерений и вспомогательного оборудования с метрологическими и техническими характеристиками, а также реактивов по качеству не ниже указанных.
4.3 Подготовка к анализу
4.3.1 Приготовление ацетатного буферного раствора молярной концентрации 0,1 моль/дм2 с pH 4,7 из растворов уксусной кислоты и уксуснокислого натрия
4.3.1.1 Приготовление раствора уксусной кислоты
В мерную колбу вместимостью 1 дм2 вносят 5,7 см2 ледяной уксусной кислоты, разводят приблизительно 300.0 см2дистиллированной воды. Доводят до метки дистиллированной водой и перемешивают.
Срок хранения при комнатной температуре — не более 1 мес.
4.3.1.2 Приготовление раствора уксуснокислого натрия
В мерную колбу вместимостью 1 дм2 помещают 13,6 г уксуснокислого натрия и растворяют приблизительно в 300,0 см2 дистиллированной воды. Затем доводят до метки дистиллированной водой и перемешивают.
Срок хранения при комнатной температуре — не более 1 мес.
4.3.1.3 Для приготовления ацетатного буферного раствора смешивают равные объемы растворов уксусной кислоты по 4.3.1.1 и уксуснокислого натрия по 4.3.1.2. При необходимости доводят pH раствора до 4,7 одним из исходных растворов.
Срок хранения при комнатной температуре не более 1 мес.
4.3.2 Для приготовления раствора натрия гидроокиси массовой доли 10,7 % растворяют 16.05 г гидроокиси натрия в 150 см2 дистиллированной воды. Полученный раствор охлаждают до комнатной температуры.
4.3.3 Приготовление реактива динитросалициловой кислоты (ДНС) массовой доли 1 %
В стакан вместимостью 1 дм2 вносят 10,0 г ДНС, добавляют 400,0 см2 дистиллированной воды и перемешивают на магнитной мешалке в течение (25—30) мин при комнатной температуре. Затем, при постоянном перемешивании, постепенно добавляют 150,0 см2 раствора гидроокиси натрия по 4.3.2.
При этом окраска раствора меняется от светло-желтой до ярко-желтой.
Стакан с полученным раствором помещают в водяную баню с температурой (47 * 1) вС, постепенно небольшими порциями добавляют 300 г виннокислого калия-натрия и перемешивают до полного растворения реактива.
Раствор охлаждают до комнатной температуры, переносят в мерную колбу вместимостью 1 дм3 и доводят объем до метки дистиллированной водой. Приготовленный реактив должен иметь ярко-желтое окрашивание (без красного оттенка).
Срок хранения в темной бутыли при комнатной температуре — не более 6 мес.
При необходимости (в случае образования осадка) раствор фильтруют через воронку со стеклянным фильтром.
4.3.4 Приготовление раствора субстрата ксилана массовой доли 1 %
В коническую колбу вместимостью 100 см3 вносят 0,5 г ксилана. добавляют от 20 до 30 см3 ацетатного буферного раствора по 4.3.1. перемешивают и растворяют при нагревании на водяной бане с температурой от 60 °С до 70 °С. Затем колбу с раствором охлаждают, доливают буферным раствором до 50 г (по массе) и тщательно перемешивают.
При наличии осадка или опалесценции раствор осветляют центрифугированием при 7000 мин-1 в течение 10—15 мин или фильтрованием через фильтр со стекловолокном.
Субстрат готовят в день проведения анализа.
4.3.5 Приготовление рабочих стандартных растворов ксилозы
4.3.5.1 Приготовление основного стандартного раствора ксилозы молярной (массовой) концентрации 10мкмоль/см3(1500мкг/см3)
В мерную колбу вместимостью 100 см3 помещают 150 мг высушенной при температуре 105 °С в течение 1 ч и охлажденной в эксикаторе ксилозы, взвешенной с точностью до 0.0001 г. растворяют в небольшом количестве ацетатного буферного раствора по 4.3.1, тщательно перемешивают и доводят объем до метки.
4.3.5.2 Приготовление рабочих стандартных растворов ксилозы
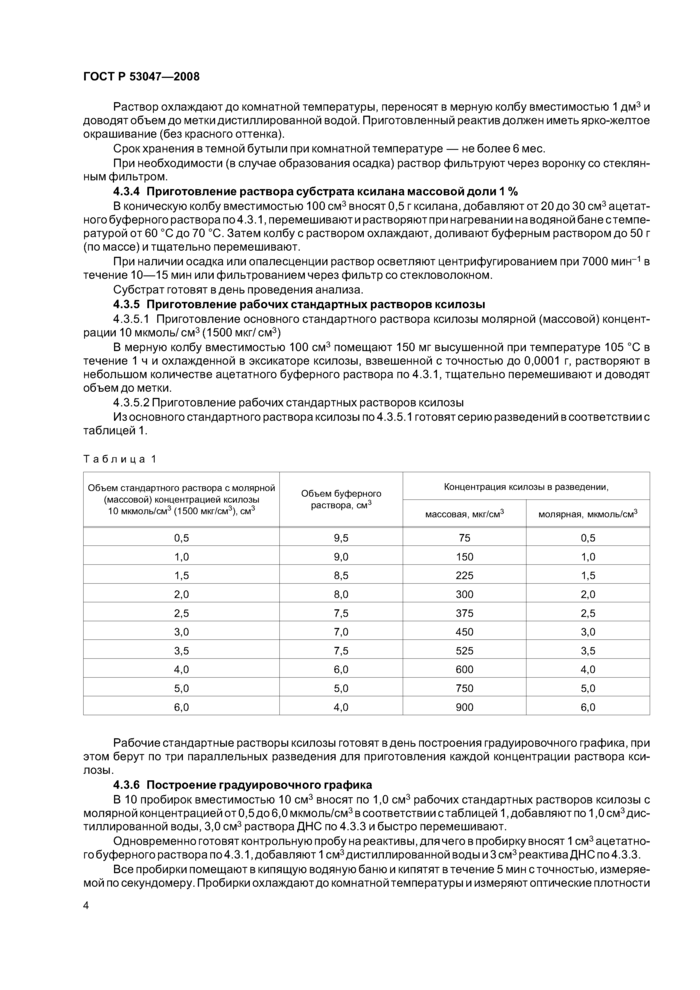
Из основного стандартного раствора ксилозы по 4.3.5.1 готовят серию разведений в соответствии с таблицей 1.
|
Таблица 1 | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
Рабочие стандартные растворы ксилозы готовят в день построения градуировочного графика, при этом берут по три параллельных разведения для приготовления каждой концентрации раствора ксилозы.
4.3.6 Построение градуировочного графика
В 10 пробирок вместимостью 10 см3 вносят по 1.0 см3 рабочих стандартных растворов ксилозы с молярной концентрацией от 0.5 до 6.0 мкмоль/см3 в соответствии с таблицей 1. добавляют по 1.0 см3 дистиллированной воды, 3,0 см3 раствора ДНС по 4.3.3 и быстро перемешивают.
Одновременно готовят контрольную пробу на реактивы, для чего в пробирку вносят 1 см3 ацетатно-гобуферного раствора по4.3.1, добавляют 1см3 дистиллированной водыиЗсм3реактиваДНСпо4.3.3.
Все пробирки помещают в кипящую водяную баню и кипятят в течение 5 мин с точностью, измеряемой по секундомеру. Пробирки охлаждают до комнатной температуры и измеряют оптические плотности
4
растворов на фотоэлектроколориметре или спектрофотометре при длине волны 540 нм в кюветах с толщиной поглощающего свет слоя 10 мм, против контрольной пробы на реактивы.
По полученным значениям строят градуировочный график оптической плотности (поглощения) как функции от молярной концентрации ксилозы (мкмоль/см3). Рабочая зона градуировочного графика лежит в пределах от 0.15 до 0,65 единиц оптической плотности (ед. ОП).
Для построения каждой точки градуировочного графика вычисляют среднеарифметическое значение оптической плотности трех параллельных измерений.
Градуировочный график строят для каждой новой партии реактивов, а также при замене прибора.
4.4 Подготовка пробы
4 .4.1 Отбор проб проводят по ГОСТ 20264.0.
Анализируемые образцы в форме порошка или микрокапсулированные можно использовать без предварительной подготовки. Анализируемые образцы в форме гранул следует измельчать (например, в механической мельнице или фарфоровой ступке) и просеивать через сито с диаметром отверстий не более 1 мм.
4.4.2 Приготовление основного раствора анализируемого образца
В плоскодонную стеклянную колбу помещают навеску анализируемого образца массой от 0.1 до 10 г* с точностью до 0.2 мг и суспендируют в небольшом количестве дистиллированной воды (до 50 см3) на магнитной мешалке в течение 15 мин (порошок, микрогранулы, микрокапсулы) или 60 мин (корма, смеси кормовые). Суспензию количественно переносят в мерную колбу вместимостью 100 см3 и доводят объем дистиллированной водой до метки. Полученную суспензию центрифугируют при частоте вращения 7000 мин-1 в течение 15 мин. Для анализа используют надосадочную жидкость.
4.4.3 Приготовление рабочего раствора анализируемого образца
Рабочий раствор готовят из основного раствора по 4.4.2 путем разведения его в дистиллированной воде таким образом, чтобы при определении активности оптические плотности опытных и контрольного растворов находились в пределах рабочей зоны градуировочного графика.
Рабочий раствор должен содержать от 0.5 до 5,0 единиц активности в 1 см3.
Раствор готовят вдень определения.
4.5 Проведение анализа
4.5.1 В три пробирки (две опытные и одну контрольную) вносят по 1 см3 субстрата ксилана по 4.3.4. Пробирки закрывают пробками, помещают в ультратермостат с температурой (50 = 1) °С и выдерживают в течение 5 мин.
4.5.2 В две опытные пробирки добавляют по 1 см3 рабочего раствора анализируемого образца по 4.4.3, предварительно прогретого при температуре 50 °С, и тщательно перемешивают. Три пробирки (две опытные и одну контрольную) помещают в ультратермостат с температурой (50 г 1) вС на 10 мин (с точностью, определяемой по секундомеру).
4.5.3 В контрольную пробирку вносят 1 см3 рабочего раствора анализируемого образца по 4.4.3. В три пробирки (две опытные и одну контрольную) добавляют по 3 см3 реактива ДНС по 4.3.3 и тщательно перемешивают.
4.5.4 Все три пробирки помещают в кипящую водяную баню на 5 мин (с точностью, определяемой по секундомеру).
4.5.5 Пробирки (две опытные и одну контрольную) охлаждают до комнатной температуры и коло-риметрируют содержимое на фотоэлектроколориметре или спектрофотометре при длине волны 540 нм. в кюветах с толщиной поглощающего свет слоя 10 мм, против контрольной пробы на реактивы.
Если значения оптических плотностей опытных проб находятся за пределами рабочей зоны градуировочного графика, определение активности следует повторить с раствором, имеющим большее или меньшее содержание фермента.
4.6 Обработка результатов
4.6.1 Молярную концентрацию ксилозы (в мкмоль/см3) в опытных и контрольном растворах определяют по градуировочному графику.
4.6.2 Ферментативную активность ксиланазы КсА в анализируемом образце, ед/г, рассчитывают по формуле
КсА=(Со~С*)' (1)
fc
где С0 — молярная концентрация ксилозы в анализируемой пробе в соответствии с градуировочным графиком, мкмоль/см3;
В зависимости от предполагаемой активности.
5
С, — молярная концентрация ксилозы в контрольной пробе в соответствии с градуировочным графиком, мкмоль/см3; t — продолжительность гидролиза, мин;
с — массовая концентрация ферментного препарата в 1 см3 рабочего раствора анализируемого образца, г/см3, рассчитывают по формуле
где т — масса навески ферментного препарата, г;
V — объем разведения навески при приготовлении основного раствора, см3;
Р — разведение основного раствора ферментного препарата для приготовления рабочего раствора по л . 4.4.3.
4.6.3 За окончательный результат принимают среднеарифметическое значение результатов двух параллельных определений, округленное до первого десятичного знака (X г Д),ед/г, при доверительной вероятности Р= 0,95, где Д = 0.01ЙХ. Г раницы погрешности 6 = г 7 %.
4.7 Сходимость и воспроизводимость результатов
Результаты измерений, полученные в условиях повторяемости (сходимости), признаются удовлетворительными. если выполняется условие приемлемости:
|Х,-Х2|<; rO.OI X. (3)
где X, и Х2 — результаты двух параллельных определений, полученные в условиях повторяемости при Р = 0.95. ед/г;
X — среднеарифметическое двух параллельных определений, ед/г; г = 5 % — предел повторяемости (сходимости).
Результаты измерений, полученные в условиях воспроизводимости, признаются удовлетворительными, если выполняется условие приемлемости:
|Х, -X2\<.R 0,01 X. (4)
где X, и — результаты двух определений, выполненных в двух разных лабораториях, ед/г;
X — среднеарифметическое двух определений, выполненных в двух разных лабораториях, ед/г;
R = 10 % — предел воспроизводимости.
5 Определение ферментативной активности ксиланазы с окрашенным субстратом
5.1 Характеристика метода
5.1.1 Метод основан на количественном определении степени деградации (гидролиза) специфического субстрата — окрашенного производного ксилана (азоксилана) — в результате действия ксиланазы (эндоксиланазы) при определенных стандартных условиях (температура 40 *С, pH 4.7, продолжительность гидролиза — 20 мин). Диапазон измерений контролируемого показателя 500 — 1000 ед. КсА.
5.1.2 В качестве субстрата используют азоксилан.
5.1.3 Продукты реакции — олигомеры с «пришитым» красителем определяют по увеличению поглощения при длине волны 490 нм.
5.1.4 Для определения активности ферментного препарата измеряют интенсивность окраски, освобожденной им из окрашенного субстрата, в сравнении с образцом ксиланазы. имеющим известную ферментативную активность.
5.1.5 Ферментативную активность исследуемого образца определяют по градуировочному графику, построенному для образца ксиланазы с известной ферментативной активностью, и выражают в единицах КсА по 4.1.2.
5.2 Средства измерений, вспомогательное оборудование и реактивы
5.2.1 Для определения ферментативной активности ксиланазы сокращенным субстратом используют средства измерений и оборудование по 4.2.1, а также:
- прибор типа вортекс или аналогичный, со скоростью встряхивания от 500 до 2500 мин-1;
- фотоэлектроколориметр (ФЭК) или спектрофотометр (СФ) любого типа, которые обеспечивают измерения при длине волны 490 нм, с погрешностью измерения коэффициента пропускания не более 1 % (не более 0.01 единицы оптической плотности).
6
5.2.2 Для определения ферментативной активности ксиланазы с окрашенным субстратом используют лабораторную посуду и материалы по 4.2.2. реактивы по 4.2.3, а также:
- азоксилан;
- ксиланазу (внутренний стандарт) с известной ферментативной активностью, определенной в разделе 4;
- спирт этиловый 96 % по ГОСТ Р 51652.
5.2.3. Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч д.а.) по ГОСТ 13867.
5.2.4 Допускается применение других средств измерений и вспомогательного оборудования с метрологическими характеристиками, а также реактивов по качеству не ниже указанных.
5.3 Подготовка к анализу
5.3.1 Приготовление ацетатного буферного раствора молярной концентрации 0.1 моль/дм3, pH 4.7 проводят в соответствии с 4.3.1.
5.3.2 Приготовление раствора окрашенного субстрата
В коническую колбу вместимостью 200 см3 вносят 1.0 г азоксилана. добавляют 40 см3 дистиллированной воды. Колбу помещают на магнитную мешалку с обогревом, доводят до кипения и кипятят 2 мин. Затем уменьшают температуру нагрева до 50 °С — 70 °С и раствор выдерживают на магнитной мешалке еще 10 мин.
Колбу с раствором охлаждают до комнатной температуры 20 °С — 25 ®С. Затем раствор переносят в мерную колбу вместимостью 50 см3, доводят объем до метки дистиллированной водой и перемешивают.
Срок хранения при температуре 5 °С — 2 нед.
5.3.3 Приготовление рабочих стандартных растворов ксиланазы
5.3.3.1 Приготовление основного стандартного раствора ксиланазы
В мерную колбу вместимостью 50 см3 помещают навеску ксиланазы. взвешенной с точностью до 0.0001 г, с известной активностью (например: 1.0000 г ксиланазы с активностью 900 ед/г), растворяют в небольшом количестве ацетатного буферного раствора по 4.3.1, тщательно перемешивают и доводят объем до метки.
В мерную колбу вместимостью 50 см3 вносят 2 см3 полученного раствора. доводят до метки ацетатным буферным раствором по 4.3.1 и перемешивают.
5.3.3.2 Приготовление рабочих стандартных растворов ксиланазы
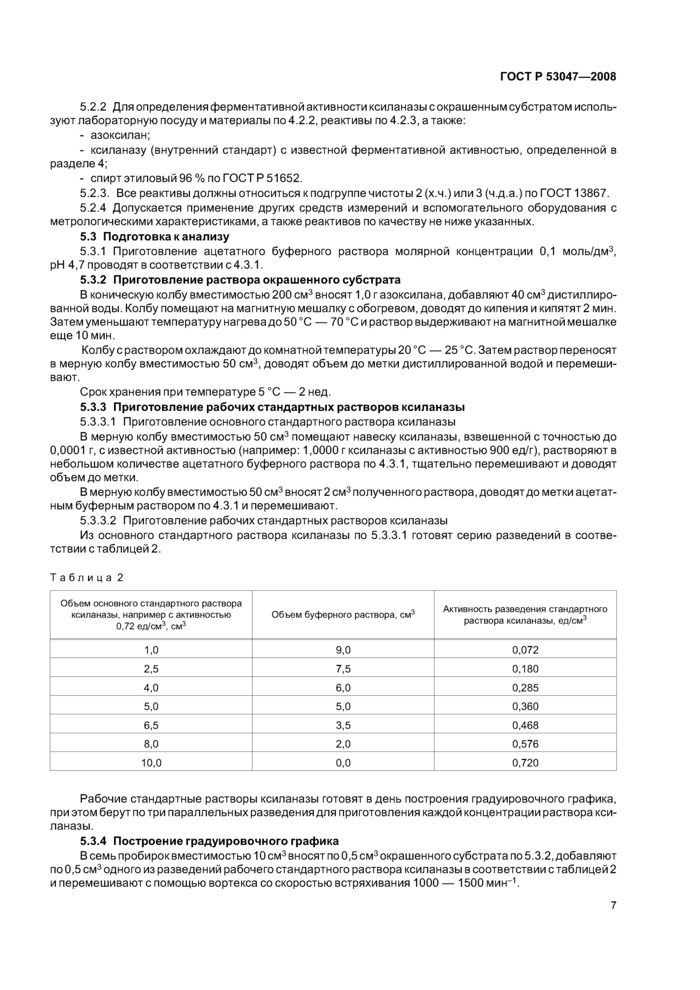
Из основного стандартного раствора ксиланазы по 5.3.3.1 готовят серию разведений в соответствии с таблицей 2.
|
Таблица 2 | ||||||||||||||||||||||||
|
Рабочие стандартные растворы ксиланазы готовят в день построения градуировочного графика, при этом берут по три параллельных разведения для приготовления каждой концентрации раствора ксиланазы.
5.3.4 Построение градуировочного графика
В семь пробирок вместимостью 10 см3 вносят по 0.5 см3 окрашенного субстрата по 5.3.2. добавляют по 0,5 см3 одного из разведений рабочего стандартного раствора ксиланазы в соответствии с таблицей 2 и перемешивают с помощью вортекса со скоростью встряхивания 1000 — 1500 мин-1.
1
2