МР 1.2.0048-11
Порядок и методы определения органотропности и токсикокинетических параметров искусственных наноматериалов в тестах на лабораторных животных
Купить МР 1.2.0048-11 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации определяют порядок и методы оценки органотропности и токсикокинетических параметров искусственных наночастиц и наноматериалов в тестах на лабораторных животных.
Оглавление
I. Область применения
II. Введение
III. Нормативные ссылки
IV. Общие положения
V. Порядок определения органотропности и токсикокинетических параметров искусственных наноматериалов
5.1. Биологические модели
5.2. Методы нейтронной активации препаратов наночастиц и наноматериалов, и содержащих их биологических образцов
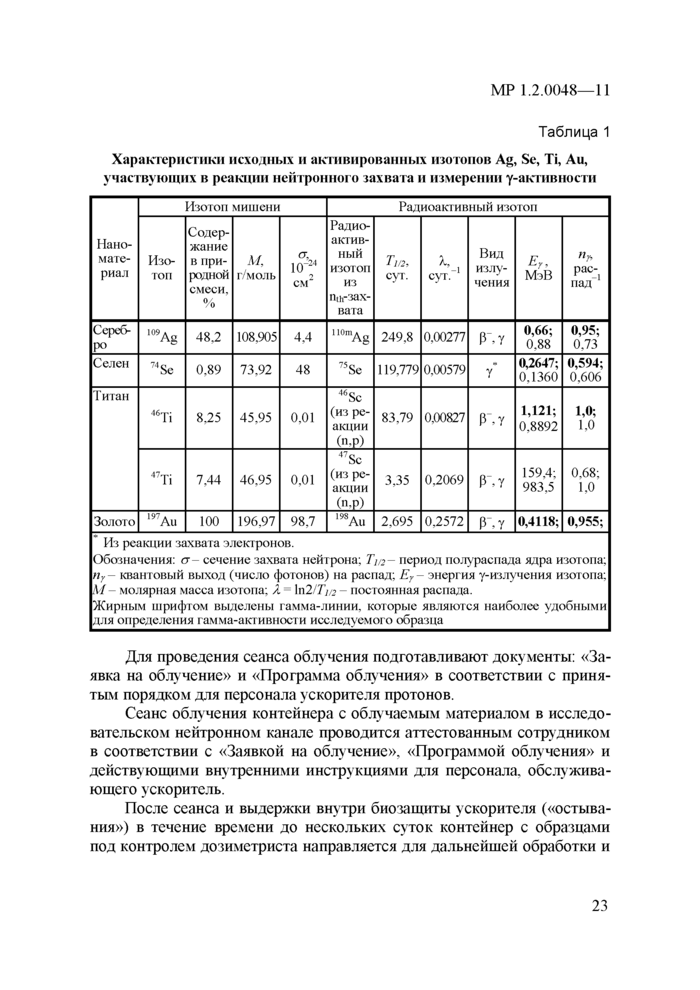
5.3. Метод гамма-спектрометрического анализа содержания меченных радионуклидами наночастиц и наноматериалов в биологических образцах
5.4. Оценка методом нейтронно-активационного анализа биораспределения и бионакопления наночастиц и наноматериалов
Приложение 1. Основные обозначения и сокращения
Приложение 2. Термины и определения
Приложение 3. Рекомендуемая литература по радиоизотопным методам исследования наноматериалов
| Дата введения | 27.11.2011 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 27.11.2011 | Утвержден | Главный государственный санитарный врач Российской Федерации | |
|---|---|---|---|
| Разработан | НИИ питания РАМН | ||
| Разработан | Институт биохимии им. А.Н. Баха РАН | ||
| Разработан | ФГБУ Российский научный центр Курчатовский Институт | ||
| Разработан | Центр Биоинженерия РАН | ||
| Издан | Роспотребнадзор | 2012 г. |
- ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- ГОСТ Р ИСО 14644-1-2000 Чистые помещения и связанные с ними контролируемые среды. Часть 1. Классификация чистоты воздуха
ГОСТ 7.32-2001Система стандартов по информации, библиотечному и издательскому делу. Отчет о научно-исследовательской работе. Структура и правила оформления. Заменен на ГОСТ 7.32-2017.- Федеральный закон 7-ФЗ Об охране окружающей среды
- ГОСТ 24104-2001 Весы лабораторные. Общие технические требования
- Федеральный закон 184-ФЗ О техническом регулировании
- Федеральный закон 3-ФЗ О радиационной безопасности населения
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
- ГОСТ 26678-85 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
- ГОСТ 8.395-80 Государственная система обеспечения единства измерений. Нормальные условия измерений при поверке. Общие требования
- СП 2.2.2.1327-03 Гигиенические требования к организации технологических процессов, производственному оборудованию и рабочему инструменту
- ГОСТ Р 51652-2000 Спирт этиловый ректификованный из пищевого сырья. Технические условия
- ГОСТ Р ИСО/МЭК 17025-2006 Общие требования к компетентности испытательных и калибровочных лабораторий
- Федеральный закон 102-ФЗ Об обеспечении единства измерений
- СанПиН 2.6.1.2523-09 Нормы радиационной безопасности (НРБ-99/2009)
- МР 1.2.2522-09 Выявление наноматериалов, представляющих потенциальную опасность для здоровья человека
- МУ 1.2.2520-09 Токсиколого-гигиеническая оценка безопасности наноматериалов
- МУ 1.2.2636-10 Проведение санитарно-эпидемиологической экспертизы продукции, полученной с использованием нанотехнологий и наноматериалов
- МР 1.2.2641-10 Определение приоритетных видов наноматериалов в объектах окружающей среды, пищевых продуктах и живых организмах
- СП 2.6.1.2612-10 Основные санитарные правила обеспечения радиационной безопасности
- МУ 1.2.2741-10 Порядок отбора проб для выявления и идентификации наноматериалов в лабораторных животных
- МР 1.2.0022-11 Порядок отбора проб для контроля за наноматериалами
- Федеральный закон 29-ФЗ О качестве и безопасности пищевых продуктов
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22
стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
Федеральная служба но надзору в ефере защиты прав потребителей и благополучии человека
1.2. ГИГИЕНА. ТОКСИКОЛОГИЯ. САНИТАРИЯ
Порядок и методы определения органотропности и токсикокинетических параметров искусственных наноматериалов в тестах на лабораторных животных
Методические рекомендации МР 1.2.0048—11
ББК51.2
П59
П59 Порядок и методы определения органотропности и токси-кокинетических параметров искусственных нано материалов в тестах на лабораторных животных: Методические рекомендации.—М.: Федеральный центр гигиены и эпидемиологии Ро-спотрсбнад юра. 2012.—34 с.
1. Разработаны Учреждением Российской академии медицинских наук «Научно-исследовательский институт питания» РАМН (В. А. Тутельян, И. В. Гмошинский, С. А. Хотимченко, М. М. Гапнаров.
Л. С. Василевская. В. К. Мазо. В. В. Бессонов. О. И. Передеряев.
Е. А. Арианова. О. II. Тананова. А. А. Шумакова. Р. В. Распопов.
В. А. Шипелин); ФГБУ «Российский научный центр «Курчатовский Институт» (В. Ф. Демин. В. М. Шмелев. IO. II. Бузулуков, Е. С. Альбицкая.
И. Е. Захарченко. К). Н. Симирский. В. В. Трусов. А. А. Голосная,
В. А. Демин. А. С. Воронцов. Н. А. Смагина. А. А. Христофорова.
Д. И. Татарников); Учреждением Российской Академии наук «Институт биохимии им. А. Н. Баха» РАН (В. О. Попов. Б. Б. Дзантиев. А. В. Жердев,
И. В. Сафенкова, Т. А. Платонова. С. М. Придворова); Учреждением Российской академии наук «Центр «Биоинженерия» РАН (К. Г. Скрябин).
2. Разработаны в рамках Федеральной целевой программы «Развитие инфраструктуры наноиндустрии в Российской Федерации на 2008 2011 годы».
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации I'. Г. Онищенко 27 ноября 2011 г.
4. Введены в действие 27 ноября 2011 г.
5. Введены впервые.
ББК51.2
€ Роспотребнадзор, 2012
Федеральным центр гигиены и эпидемиологии Роспотребнадзора, 2012
MP 1.2.0048—11
ществляемыми в целях обеспечения качества, достоверности и воспроизводимости результатов исследования.
4.8. Организации (лаборатории), проводящие исследования по определению органотропности и токсикокинетических параметров искусственных наноматериалов в тестах на лабораторных животных, должны быть укомплектованы необходимым оборудованием и средствами измерений, прошедшими поверю (калибровку) в установленном порядке. Эксплуатация оборудования и средств измерений проводится в соответствии с техническим паспортом и инструкцией по применению. Результаты проведения поверки (калибровки) и текущего ремонта оборудования фиксируются в специальном журнале, досту пном в любое время сотрудникам, эксплуатирующим оборудование или обеспечивающим его обслуживание. Применяются средства измерений, имеющие сертификат и зарегистрированные в Государственном реестре средств измерений.
4.9. Организации (лаборатории), проводящие исследования по определению органотропности и токсикокинетических параметров искусственных наноматериалов в тестах на лабораторных животных, должны иметь помещения для содержания и работы с лабораторными животными (виварии, клиники лабораторных животных), требования к которым изложены в санитарных правилах по устройству, оборудованию и содержанию вивариев и в МУ 1.2.2869—11 «Порядок оценки токсического действия наноматсриалов на лабораторных животных».
4.10. Организации (лаборатории), проводящие исследования по определению органотропности и токсикокинетических параметров иску сственных наноматериалов, должны соблюдать правила обращения с источниками ионизирующего излучения, установленными в СП 2.6.1.2612— 10 «Основные санитарные правила обеспечения радиационной безопасности (ОСПОРБ 99/2010)». Все источники ионизирующего излучения подлежат учёту и контролю в установленном порядке. Получение, передача. хранение, использование и утилизация источников ионизирующего излучения осуществляются в соответствии с действующими нормативными правовыми актами СП 2.6.1.2612—10 «Основные санитарные правила обеспечения радиационной безопасности (ОСПОРБ 99/2010)», СанПиН 2.6.1.2523—09 «Нормы радиационной безопасности (НРБ-99/2009)».
4.11. Документом, подтверждающим результаты проведённых исследований по определению органотропности и токсикокинетических параметров искусственных наноматсриалов. является отчёт о проведённом исследовании. Отчет содержит следующие сведения:
11
• название исследования:
• адрес организации:
• даты начала и завершения исследований;
• цель и задачи исследования:
• характеристика тестируемого наноматериала (химический состав. CAS-номср. средний, минимальный и максимальный размер частиц, форма частиц, наличие примесей, состав дисперсионной среды (носителя) в соответствии с МУ 1.2.2636—10 «Проведение санитарно-эпидемиологической экспертизы продукции, полученной с использованием нанотехнологий и наноматериалов»);
• применяемая биологическая модель и обоснование ее использования:
• перечень исследованных биологических образцов и применяемых стандартных образцов:
• вид. линию, пол и возраст используемых лабораторных животных:
• состав применяемых рационов, условия содержания животных:
• метод введения наночасти ц/наноматериалов. применяемые дозы, длительность и кратность введения:
• характеристики применяемых источников ионизирующего излучения (изотопный состав, химическая форма, спектральные (энергетические) характеристики излучения, период полураспада. МЗА):
• план (дизайн) исследования:
• перечень использованных средств измерений и вспомогательного оборудования и режимы их работы:
• методы статистической обработки результатов:
• результаты исследования, представленные в виде обобщающих таблиц, рисунков с соответствующей статистической обработкой и комментариев к ним:
• заключение, выводы, список использованных источников.
Оформление отчёта о результатах исследования должно соответствовать требованиям ГОСТ 7.32-2001 «Отчёт о научно-исследовательской работе. Структу ра и правила оформления».
Отчет о результатах проведенного исследования составляется ответственным исполнителем, утверждается руководителем организации и скрепляется печатью организации.
4.12. Организация (лаборатория), проводящая исследования по определению органотропностн и токсикокинетических параметров искусственных наноматериалов, должна обеспечить конфиденциальность
MP 1.2.0048—11
результатов исследований в рамках принятых сю обязательств и в соответствии с законодательством Российской Федерации.
V. Порядок определения органотронноеi и и токснкокинетнческнх параметров искусственных наноматериалов
5.1. Биологические моде./и
5.1.1. Исследования по определению органотропности и токсико-кинетических параметров искусственных наноматериалов проводят на крысах самцах линии Вистар или нелинейных крысах исходной массой 80—100 г (при тестировании в условиях подострого или хронического воздействия) или 200—250 г (в условиях острого опыта). Численность групп животных устанавливается в соответствии с задачами исследования. но во всех случаях составляет не менее 4 особей. Животные всех групп на протяжении всего периода тестирования получают полусинтс-тичсский рацион в соответствии с МУ 1.2.2520—09 «Токсиколого-гигиеническая оценка безопасности наноматериалов». Крыс размещают в клетках из ударопрочной пластмассы группами по 3—4 особи: рацион и питьевую воду предоставляют в режиме свободного неограниченного доступа.
Примечание: возможно использование при проведении тестирования крыс других линий, а также животных других видов, в частности, линейных мышей. Используемые схемы и дозы введения нано материала при этом должны быть модифицированы в соответствии с видовыми особенностями используемых организмов.
5.1.2. При введении животным препаратов наночастиц и наноматериалов (как немеченых, так и меченных радионуклидами) их диспергируют в носителе (дисперсионной среде) под действием ультразвука. Частота. мощность и длительность ультразвуковой обработки подбираются эмпирически так. чтобы избежать образования крупных агрегатов наночастиц. При необходимости качество диспергирования наноматериала проверяют методом электронной микроскопии согласно МР 1.2.2641—10 «Определение приоритетных видов наноматериалов в объектах окружающей среды, живых организмах и пищевых продуктах». В случае использования препаратов наночастиц, меченных радионуклидами. рекомендуется предварительно отработать методику приготовления и введения животным препарата с использованием немеченого аналога наноматериала (т. н. «холодный опыт»).
13
5.1.3. В качестве дисперсионной среды при введении наноматериалов животным внутрижелудочно (в/ж) рекомендуется использовать дистиллированную (деионизованную) воду. При внутрикишечном (в/к) введении предпочтительно использование изотонического (0.15 М) раствора NaCl. Дисперсии наноматериала для парентерального введения готовят в стерильном апирогенном физиологическом растворе (0.15 М NaCl) по ГФ СССР X, 426. При приготовлении дисперсий наночастиц и наноматериалов, особенно хтя внутрикишечного и парентерального введения, нежелательно использование каких-либо иных растворов и дисперсионных сред, в том числе содержащих ПАВ. pH дисперсионной среды для внутрикишечного введения наноматериалов должен находиться в интервале 5—7. ионная сила не должна превышать 0.15 моль/дм3.
5.1.4. Тестирование органотропности наночастиц и наноматсриалов проводят на животных, которым ежедневно на протяжении не менее 30 дней (предпочтительно от 60 до 180 дней) вводят тестируемые нано-материалы внутрижелудочно или иным способом в соответствии с МУ 1.2.2520—09 «Токсиколого-гигиеническая оценка безопасности наноматериалов» (п. 6.3.6). В условиях хронического эксперимента длительность введения наночастиц и наноматериалов должна составлять не менее 180 дней (предпочтительно 1 год и более), способ введения устанавливается в соответствии с задачами тестирования (возможно, в частности. диспергирование наноматсриала в корме и питьевой воде, при этом необходим ежедневный контроль количеств их потребления животными).
Вводимые дозы наноматериалов устанавливаются индивидуально в соответствии с задачами исследования. Рекомендуется использование, как минимум, двух доз. меньшую из которых устанавливают на основе анализа возможных сценариев пероральной экспозиции человека нано-материалом в условиях контаминации пищевых продуктов и воды отходами деятельности нанотехнологических производств и (или) возможного поступления наноматсриала. входящего в состав потребительской продукции, с учётом возможной неопределённое™ и 10-кратного коэффициента запаса, определяемого биологической природой используемой модели (тестирование на грызунах). Большую дозу наноматсриалов рекомендуется делать 10—100-кратно увеличенной (агравированной). При определении вводимых доз наноматериалов следует принимать во внимание сведения об их острой токсичности (LD50), если такие имеются.
5.1.5. Отбор, предварительную обработку и хранение проб биологических объектов - органов и тканей животных, которым вводили на-
14
MP 1.2.0048—11
ночастицы и наноматериалы, для определения их органотропности выполняют в соответствии с МУ 1.2.2741—10 «Порядок отбора проб для выявления и идентификации наноматериалов в лабораторных животных» и МУ 1.2.2745—10 «Порядок отбора проб для характеристики действия наноматериалов на лабораторных животных».
5.1.6. Тестирование органотропности и биорас пределе ния наночастиц и наноматерналов в остром опыте возможно с использованием модели in vivo (in situ), воспроизводимой путём введения дисперсии нано-матернала в изолированную петлю тонкой (подвздошной) кишки крысы в условиях сохранения в полном объеме кровообращения и иннервации в изолированном органе. Этим обеспечивается возможность (в отличие от пути введения наноматериала в желудок или перорально с кормом) создания достаточно высокой локальной концентрации наноматернала в просвете кишки, что позволяет осуществить гарантированную электронно-микроскопическую детекцию наноматернала на уровне его всасывания (проникновения в стенку тонкой кишки) и дальнейшего био-распрсдслсния по другим органам и тканям. Одновременно, метод электронной микроскопии позволяет выявить возможность развития уль-траструктурных изменений кишечной слизистой оболочки под влиянием локально действующих наноматериалов.
Воспроизведение модели острой внутрикишечной экспозиции наноматериалами осуществляется следующим образом.
Крыс исходной массой тела (200 ± 20) г (.\/± т) содержат на протяжении периода адаптации к условиям вивария на полисинтетическом рационе в соответствии с МУ 1.2.2520—09 «Токсиколого-гигиеническая оценка безопасности наноматериалов». За 16—18 ч до начала эксперимента животных переносят в клетки с сетчатым дном (для устранения копрофагии) и лишают корма. Доступ к воде нс ограничивают. Крыс подвергают анестезии гекссналом внутрнбрюшинно в дох 50 мг/кг массы тела в стерильном апирогенном физиологическом растворе (возможно использование других длительно действующих парентеральных анестезирующих средств; доза препарата должна быть установлена экспериментально). В асептических условиях через небольшой разрез брюшной стенки извлекают петлю подвздошной кишки длиной 4—5 см, содержащую Псйсровы бляшки (ПБ). осторожно их лиру ют се шёлковыми лигатурами, нс повреждая сосуды брыжейки и крупные нервы, и дистальнее нижней лигатуры прокалывают кишечную стенку тонкой инъекционной иглой, через которую в петлю кишки вводят 1 см3 дисперсии наночастиц в изотоническом (0.15 М) растворе хлорида натрия. Дисперсии наночастиц готовят, как указано в п. 5.1.3. Лигатуры плотно затяги-
15
вают, удаляя излишки шовного материала, петлю кишки осторожно возвращают в брюшную полость. кож> зашивают и помещают крыс в клетки на 3 ч. По окончании этого периода животным вводят гсксснал (ИХ) мг/кг массы тела), вскрывают брюшную полость и отбирают изолированную петлю подвздошной кишки. Немедленно после этого лигатуры из сегмента кишки удаляют, осторожно разрезают его вдоль линии прикрепления брыжейки и выделяют фрагменты, содержащие и нс содержащие ПБ. Эти фрагменты помещают в фиксатор (2.5 % (об./об.) глутаровый альдегид. 2.0% (об./об.) формалин, на фосфатно-солевом буфере, pH 6.9). который готовят по прописи, приведённой в МР 1.2.2641—10 «Определение приоритетных видов наноматериалов в объектах окружающей среды, живых организмах и пищевых продуктах» (пункт 5.1.3.3). В этот же фиксатор помещают образцы ткани печени, селезенки и. при необходимости, других органов (почки, гонады, головной мозг и прочес) хтя проведения электронно-микроскопического исследования.
Примечание с момента иссечения сегмента тонкой кишки до его помещения в фиксатор не должно проходить более 60 с во избежание некротических изменений в ткани кишки, вызванных гипоксией.
Фиксированный для электронно-микроскопического исследования материал кишки, содержащий и нс содержащий Пейеровые бляшки, делят на две или. в зависимости от задач исследования, три части, которые обрабатывают для электронно-микроскопического исследования в соответствии с МР 1.2.2641—10 «Определение приоритетных видов нанома-териалов в объектах окружающей среды, живых организмах и пищевых продуктах» (п. 5.1.4.5). в следующих трех режимах:
1) без какого-либо дополнительного контрастирования соединениями тяжёлых металлов (ряд 1):
2) с дофиксацисй и контрастированием тстроксидом осмия OsOj (ряд 2);
3) с контрастированием тстроксидом осмия и окрашиванием ура-нилацетатом и цитратом свинца (ряд 3. выполняется при необходимости в зависимости от задач тестирования).
Аналогичным образом (ряд 1. ряд 2) осуществляется обработка биологического материала других органов, отобранных для анализа.
Препараты исследуют методом электронной микроскопии в соответствии с МР 1.2.2641—10 «Определение приоритетных видов наноматериалов в объектах окружающей среды, живых организмах и пищевых продуктах» (пункт 5.1.6) с использованием дополнительных аналитических опций (снятие электронных дифрактограмм. спектров характсри-
16
MP 1.2.0048—11
Содержание
I. Область применения............................................................................................4
II. Введение................................................................................................................5
III. 11ормативные ссылки...........................................................................................7
IV. Общие положения................................................................................................9
V. 11орядок определения органотропности и токсикокинетических
параметров искусственных наноматериалов..................................................13
5.1. Биологические модели..............................................................................13
5.2. Метода нейтронной активации препаратов наночастиц и
нано материалов. и содержащих их биологических обра зцов...............19
5.3. Метод гамма-спектрометрического анализа содержания
меченных радионуклидами наночастиц и наноматериалов в биологических образцах...........................................................................24
5.4. Оценка методом нейтронно-активационного анализа
биораспределения и бионакопления наночастиц и наноматериалов.........................................................................................27
Приложение 1. Основные обозначения и сокращения..........................................32
Приложение 2. Термины и определения................................................................33
Приложение 3. Рекомендуемая литература по радиоизотопным методам
исследова! шя наноматериалов.....................................................35
3
УТВЕРЖДАЮ Руководитель Федеральной службы по над юру в сфере защиты прав потребителей и благополучия человека. Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
27 ноября 2011 г.
Дата введения: с момента утверждения
1.2. ГИГИЕНА. ТОКСИКОЛОГИЯ. САНИТАРИЯ
Порядок и методы определения органотропности и токсикокинетических параметров искусственных наноматериалов в тестах на лабораторных животных
Методические рекомендации МР 1.2.0048—11
I. Область применения
1.1. Настоящие методические рекомендации определяют порядок и методы оценки органотропности и токсикокинетических параметров искусственных наночастиц и наноматсриалов в тестах на лабораторных животных.
1.2. Настоящие методические рекомендации могут применяться:
• при оценке безопасности разрабатываемых новых и уже используемых наноматериалов:
• при оценке рисков, связанных с процессами производства, оборота. использования и утилизации на но материалов.
1.3. Методические рекомендации разработаны с целью обеспечения единства измерений и представления результатов при оценке органотропности и токсикокинетических параметров искусственных наночастиц и наноматсриалов.
1.4. Методические рекомендации предназначены для специалистов органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут быть использованы научно-исследовательскими организациями гигиенического профиля, медицинскими учебными заведениями и иными организацня-
MP 1.2.0048—11
ми, проводящими исследования по оценке безопасности наноматериалов и продукции наноиндустрии.
II. Введение
Наночастицы и наноматериалы рассматриваются в настоящее время как источник риска для здоровья человека и состояния окружающей среды. В числе наночастиц и наноматериалов, способных оказать неблагоприятное воздействие на состояние здоровья человека и природные экосистемы, рассматриваются производимые в промышленных масштабах наночастицы металлов, диоксида титана, кварца, оксида алюминия, углеродные нанотрубки, «квантовые точки» и многие другие. В соответствии с «Концепцией токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов», утверждённой постановлением Главного государственного санитарного врача Российской Федерации от 31 октября 2007 г. № 79. искусственные наноматериалы должны быть отнесены к новым видам материалов и продукции, характеристика потенциального риска которых для здоровья человека и состояния среды обитания во всех случаях является обязательной.
Важной характеристикой наночастиц и наноматсриалов. во многом определяющей их биологическое действие, является их органотроп-ность. то есть способность проникать через физиологические барьеры организма в определённые органы и ткани и накапливаться в них. Для оценки этих показателей в рамках Федеральной целевой программы «Развитие инфраструктуры наноиндустрии на 2008—2011 гг.» был разработан и утвержден в установленном порядке руководителем Федеральной службы по надзору в с<|>ерс защиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации ряд методических документов: МУ 1.2.2520—09 «Токсиколого-гигиеническая оценка безопасности наноматериалов»: МУ 1.2.2741—10 «Порядок отбора проб для выявления и идентификации наноматериалов в лабораторных животных»: МУ 1.2.2745—10 «Порядок отбора проб для характеристики действия наноматсриалов на лабораторных животных»; МУ 1.2.2869—11 «Порядок оценки токсического действия наноматсриалов на лабораторных животных»: МУ 1.2.2874— 11 «Порядок выявления и идентификации наноматсриалов в лабораторных животных»: МР 1.2.2639—10 «Использование методов количественного определения наноматсриалов на предприятиях наноиндустрии и в контролирующих организациях»: МР 1.2.2641—10 «Определение приоритетных видов наноматсриалов в объектах окружающей среды.
живых организмах и пищевых продуктах». Основными методами, рассматриваемыми в перечисленных документах в аспекте выявления, идентификации и количественного определения наноматериалов в органах и тканях животных, является, во-первых, метод трансмиссионной электронной микроскопии (ТЭМ). и. во-вторых, современные методы элементного анализа (атомно-эмиссионная спектрометрия и масс-спсктромстрия с индуктивно связанной плазмой).
Основными преимуществами ТЭМ являются, во-первых, исключительно высокая специфичность и наглядность выявления наноразмер-ных объектов в составе препаратов животных тканей и. во-вторых, возможность с использованием дополнительных опций дифракции электронов и спектров характеристических потерь энергии непосредственно устанавливать химический состав обнаруженных наноразмерных объектов. К ограничениям ТЭМ относится, в контексте исследований по нанобезопасности, недостаточно высокая чувствительность анализа, что нс всегда позволяет выявить наночастицы на ультратонкнх срезах биологических тканей при недостаточно высокой концентрации наночастиц в образце. Современные методы химического анализа обладают высокой чувствительностью, однако и её может быть недостаточно для выявления проникновения ультрамалых количеств наноматсриалов через биологические барьеры, в частности, через гемоэнцефалический барьер в ткани головного мозга. Кроме того, методы химического анализа абсолютно нсспсцифичны в отношении размерных характеристик анализируемых веществ и не способны отличить наночастицы от эндогенно присутствующих в организме химических соединений тех же элементов в традиционной форме дисперсности.
В задачи настоящих методических рекомендаций входит, во-первых. адаптация метода ПЭМ к анализу проникновения наночастиц через барьеры организма (в первую очередь через слизистую оболочку желудочно-кишечного тракта), позволяющая гарантированно выявлять такое проникновение в модельных условиях, приближенных к физиологическим. Во-вторых, впервые в качестве метода исследования органо-тропности и токснкокинстичсских свойств наночастиц и наноматсриалов предлагается использование метода радиоактивных индикаторов (МРИ) и тесно связанного с ним в аппаратур но-методическом отношении метода нейтронно-активационного анализа. Разработанные уже много десятилетий назад в целях проведения биохимического и физикохимического анализа, эти методы до настоящего времени являются уникальными с позиции своей чувствительности, а метод МРИ также и специфичности в отношении выявления ультрамалых форм меченых соединений. в том числе наночастиц, в составе биологических объектов.
6
MP 1.2.0048—11
III. Нормативные ссылки
3.1. Федеральный закон от 30 марта 1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
3.2. Федеральный закон от 2 января 2000 г. № 29-ФЗ «О качестве и безопасности пищевых продуктов».
3.3. Федеральный закон от 26 июня 2008 г. № 102-ФЗ «Об обеспечении единства измерений».
3.4. Федеральный закон от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании».
3.5. Федеральный закон от 10 января 2002 г. № 7-ФЗ «Об охране окружающей среды».
3.6. Федеральный закон от 9 января 1996 г. № 3-ФЗ «О радиационной безопасности населения».
3.7. Постановление Правительства Российской Федерации от 30 июня 2004 г. № 322 «Об утверждении Положения о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека».
3.8. Постановление Правительства Российской Федерации от 15 сентября 2005 г. № 569 «О Положении об осуществлении государственного санитарно-эпидемиологического надзора в Российской Федерации».
3.9. Приказ Министерства здравоохранения СССР от 12 августа 1977 г. № 755 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных».
3.10. Приказ Министерства здравоохранения и социального развития Российской Федерации от 23 авгу ста 2010 г. № 708н «Об утверждении Правил лабораторной практики».
3.11. Постановление Главного государственного санитарного врача Российской Федерации от 23 июля 2007 г. № 54 «О надзоре за продукцией. полученной с использованием нанотехнологий и содержащих наноматсриалы».
3.12. Постановление Главного государственного санитарного врача Российской Федерации от 31 октября 2007 г. №79 «Об утверждении Концепции токсикологических исследований, методологии оценки риска. методов идентификации и количественного определения наноматс-риалов».
3.13. СП 2.2.2.1327—03 «Гигиенические требования к организации техно логических процессов, производственному оборудованию и рабочему инструменту».
3.14. СП 2.6.1.2612—10 «Основные санитарные правила обеспечения радиационной безопасности (ОСПОРБ-99/20Ю)».
7
3.1$. СанПиН 2.6.1.2523—09 «Нормы радиационной безопасности (НРБ -99/2009)».
3.16. МУ 1.2.2520—09 «Токсиколого-гигиеническая оценка безопасности наноматериалов».
3.17. МУ 1.2.2636—10 «Проведение санитарно-эпидемиологической экспертизы продукции, полученной с использованием нанотехнологий и наноматериалов».
3.18. МУ 1.2.2741—10 «Порядок отбора проб для выявления и идентификации наноматсриалов в лабораторных животных».
3.19. МУ 1.2.2745—10 «Порядок отбора проб для характеристики действия наноматериалов на лабораторных животных».
3.20. МУ 1.2.2874—11 «Порядок выяалення и идентификации наноматериалов в лабораторных животных».
3.21. МУ 1.2.2869—11 «Порядок оценки токсического действия наноматериалов на лабораторных животных».
3.22. МР 1.2.2522—09 «Выявление наноматсриалов. представляющих потенциальную опасность для здоровья человека».
3.23. МР 1.2.0022—11 «Порядок отбора проб хля контроля за нано-материалами».
3.24. МР 1.2.2641—10 «Определение приоритетных видов наноматсриалов в объектах окружающей среды, живых организмах и пищевых продуктах».
3.25. МР 1.2.2639—10 «Использование методов количественного определения наноматсриалов на предприятиях наноиндустрии».
3.26. ГОСТ 7.32-2001 «Отчет о научно-исследовательской работе. Структура и правила оформления».
3.27. ГОСТ Р ИСО/МЭК 17025—2006 «Общие требования к компетентности испытательных и калибровочных лабораторий».
3.28. ГОСТ 24104-2001 «Весы лабораторные. Общие технические требования».
3.29. ГОСТ 25336-82 «Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры».
3.30. ГОСТ 26678-85 «Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия».
3.31. ГОСТ Р 51652-2000 «Спирт этиловый ректификованный из пищевого сырья. Технические условия».
3.32. ГОСТ 1770-74 «Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия».
MP 1.2.0048—11
3.33. ГОСТ 12.1.005-88 «Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны».
3.34. ГОСТ 12.1.007-76 «Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности».
3.35. ГОСТ 8.395-80 «ГСИ. Нормальные условия измерений при поверке. Общие требования».
3.36. ГОСТ Р ИСО 14644-1-2000 «Чистые помещения и связанные с ними контролируемые среды».
IV. Общие положения
4.1. Целью оценки органотропности и то кси ко кинетических параметров искусственных на но материалов в тестах на лабораторных животных являются:
• выявление органов и тканей, являющихся мишенями токсического действия наночастиц и наноматсриалов:
• установление возможных эффектов кумуляции наночастиц в организмах животных;
• токсиколого-гигиеническая и медико-бнологическая оценка безопасности наноматсриалов и продукции, их содержащей;
• гигиеническое нормирование содержания наноматсриалов в объектах окружающей среды и потребительской продукции;
• оценка риска для здоровья населения при поступлении нано материалов в организм с пищей, водой, атмосферным воздухом и иными путями;
• разработка мероприятий по охране здоровья населения и окружающей среды от воздействия наночастиц и наноматсриалов.
4.2. Оценка органотропности и токсикокинстичсских параметров искусственных наноматсриалов в тестах на лабораторных животных проводится в острых, подострых и хронических экспериментах in vivo, при путях поступления наночастиц и наноматсриалов. максимально приближенных к условиям экспонирования ими через объекты окружающей среды в обстановке реального воздействия, а также в модельных системах in vitro. воспроизводящих приближенные к физиологическим условия проникновения наночастиц и наноматсриалов через биологические барьеры.
4.3. Объектами оценки органотропности и токсикокинстичсских параметров искусственных наноматсриалов в тестах на лабораторных животных являются качественные и количественные показатели проникновения через барьеры организма, накопление наночастиц и нанома-
тсриалов в отдельных органах и тканях, скорость и пути выведения (клиренса) наночастиц и наноматериалов из организма.
4.4. Выбор биологического объекта воздействия наночастиц и наноматериалов (вида, линии лабораторных животных), принципы выбора действующих доз. пути, длительность и кратность введения наночастиц и наноматериалов, состав опытных и контрольных групп тестируемых организмов устанавливаются в соответствии с МУ 1.2.2520—09 «Токсиколого-гигиеническая оценка безопасности наноматериалов» и 1.2.2869—11 «Порядок оценки токсического действия наноматсриалов на лабораторных животных».
4.5. При выборе нано материалов, являющихся объектами оценки органотропности и токсикокинетичсских параметров в тестах на лабораторных животных, необходимо принимать во внимание:
• возможность экспозиции работников нанотехнологических производств. потребителей продукции наноиндустрии и населения в целом наночастицами и наноматериалами на данной территории, в условиях промышленного производства или при потреблении продукции определенного типа:
• данные литературы из источников, отвечающих критериям научной полноты и достоверности о наличии у тестируемых наноматериалов и их близких аналогов способности проникать через физиологические барьеры организма и внутрь клеток, накапливаться в органах и тканях;
• степень потенциальной опасности наноматсриалов для здоровья человека в соответствии с МР 1.2.2522—09 «Выявление наноматериалов. представляющих потенциальную опасность для здоровья человека».
4.6. Лаборатория (организация), проводящая исследования по органотропности и определению токсикокинетичсских параметров иску сственных наноматсриалов в тестах на лабораторных животных, должна быть аккредитована на проведение работ в области оценки безопасности наноматсриалов. В лаборатории должны соблюдаться правила надлежащей лабораторной практики в соответствии с приказом Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. № 708н «Об утверждении Правил лабораторной практики».
4.7. В организации (лаборатории), проводящей исследования по определению органотропности и токсикокинетичсских параметров искусственных наноматсриалов в тестах на лабораторных животных, должна быть разработана программа по обеспечению качества проводимых исследований. Все производственные операции проводятся в соответствии со стандартными операционными процедурами (СОП). осу-