ГОСТ 25794.1-83
Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования
Купить ГОСТ 25794.1-83 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на реактивы и устанавливает методы приготовления следующих титрованных растворов для кислотно-основного титрования и проверки их молярных концентраций.
Переиздание (по состоянию на март 2008 г.)
Оглавление
1 Общие указания
2 Приготовление титрованных растворов
Приложение 1 (обязательное)
Приложение 2 (обязательное) Калибровка мерной посуды
| Дата введения | 01.07.1984 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 71 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
- Раздел 71.040 Аналитическая химия
- Раздел 71 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
- Раздел Электроэнергия
- Раздел 71 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
- Раздел 71.040 Аналитическая химия
- Раздел 71 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
Организации:
| 23.05.1983 | Утвержден | Государственный комитет СССР по стандартам | 2302 |
|---|---|---|---|
| Разработан | Министерство химической промышленности СССР | ||
| Издан | Издательство стандартов | 1983 г. | |
| Издан | ИПК Издательство стандартов | 2001 г. | |
| Издан | ИПК Издательство стандартов | 2003 г. | |
| Издан | Стандартинформ | 2008 г. |
Reagents. Methods of preparation of standard volumetric solutions for acid-base titration
- ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
- ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
- ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
- ГОСТ 27025-86 Реактивы. Общие указания по проведению испытаний
- ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
- ГОСТ 29251-91 Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
- ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
- ГОСТ 4108-72 Реактивы. Барий хлорид 2-водный. Технические условия
- ГОСТ 4199-76 Реактивы. Натрий тетраборнокислый 10-водный. Технические условия
- ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
- ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4517-87Реактивы. Методы приготовления вспомогательных реактивов и растворов, применяемых при анализе. Заменен на ГОСТ 4517-2016.ГОСТ 4919.1-77Реактивы и особо чистые вещества. Методы приготовления растворов индикаторов. Заменен на ГОСТ 4919.1-2016.- ГОСТ 6341-75 Реактивы. Кислота янтарная. Технические условия
ГОСТ 6563-75Изделия технические из благородных металлов и сплавов. Технические условия. Заменен на ГОСТ 6563-2016.- ГОСТ 6755-88 Поглотитель химический известковый ХП-И. Технические условия
- ГОСТ 7837-76 Дробь охотничья, спортивная и картечь. Технические условия
- ГОСТ 83-79 Реактивы. Натрий углекислый. Технические условия
- ГОСТ 8504-71 Реактивы. Калий йодноватокислый кислый. Технические условия
- ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9
стр. 10

стр. 11

стр. 12
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
РЕАКТИВЫ
МЕТОДЫ ПРИГОТОВЛЕНИЯ ТИТРОВАННЫХ РАСТВОРОВ ДЛЯ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Издание официальное
ИПК ИЗДАТЕЛЬСТВО СТАНДАРТОВ Москва
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 23.05.83 № 2302
3. Стандарт соответствует СТ СЭВ 3674—82
4. ВВЕДЕН ВПЕРВЫЕ
5. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначение НТД. на который дана ссылка |
Номер пункта, приложения |
|
2.1.1 | |
|
1.9 | |
|
Приложение 2 | |
|
2.1.1. 2.2.1 | |
|
2.1.1 | |
|
2.1.1 | |
|
ГОСТ 42IM-77 |
2.1.1. 2.2.1 |
|
2.1.1 | |
|
2.2.1 | |
|
1.3. 1.4 | |
|
1.3 | |
|
2.2.1 | |
|
2.1.1.1 | |
|
1.4. 2.1.1. 2.2.1. приложение 2 | |
|
2.1.1 | |
|
Приложение 2 | |
|
2.2.1 | |
|
2.2.2 | |
|
2.1.1. 2.2.1. приложение 2 | |
|
1.5. 1.10. 2.1.1.2. 2.2.2 | |
|
1.9. 1.16. 2.1.1.2. приложение 2 | |
|
1.2 | |
|
2.1.1 | |
|
ТУ' 6-09-5169-84 |
2.1.1. 2.2.1 |
|
ТУ' 6-09-5171-84 |
2.1.1 |
|
ТУ 6-09-5331-87 |
2.1.1. 2.2.1 |
|
ТУ' 6-09-5360-87 |
6. Ограничение срока действия снято но протоколу № 7—95 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 11—95)
7. ИЗДАНИЕ (август 2003 г.) с Изменением № 1. утвержденным в декабре 1990 г. (ИУС 3—91)
Переиздание (по состоянию на март 2008 г.)
Редактор Р.Г. Говвркмккая Технический редактор В.Н. Прусакова Корректор М.В. Пучка»
Компьютерная верстка Л Л. Круговой
Подписано в печать 07.0S.200X. Формат 60x84V*. Бумага офсетная. Гарнитура Таймс. Печать офсетная.
Уел. неч. л. 1.40. Уч.-изд. л. 1.40. Тираж 184 экз. Зак. 463.
ФГУП «СТАНДАРТИ НФОРМ». 123995 Москва. Гранатный пер.. 4. wwM.gosTinro.ru infotfgoslinro.ru
Набрано во ФГУП «СТАНДАРТИ НФОРМ• на ПЭВМ Отпечатано в филиале ФГУП .СТАНДАРТИНФОРМ* — тип. «Московский печатник*. 105062 Москва. Лялин пер.. 6.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Реактивы
гост
25794.1-83
МЕТОДЫ ПРИГОТОВЛЕНИЯ ТИТРОВАННЫХ РАСТВОРОВ ДЛЯ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Reagents. Methods of preparation of standard volumetric solutions for acid-base titration
MKC 71.040.30 ОКСТУ 2609
Дата введения 01.07.84
Настоящий стандарт распространяется на реактивы и устанавливает методы приготовления следующих титрованных растворов для кислотно-основного титрования и проверки их молярных концентраций:
кислота серная, растворы молярных концентраций: с (‘/у H,S04) = I моль/дм3 (I н.); с (*/2 H,S04) = 0.5 моль/дм3 (0.5 н.); с (‘/у H,S04) = 0.1 моль/дм3 (0.1 н.); кислота соляная, растворы молярных концентраций: с (HCI) = 1 моль/дм3 (1 н.); с (НС1) = 0,5 моль/дм3 (0.5 н.); с (НС1) = 0.1 моль/дм3 (0.1 н.);
натрия гидроокись, растворы молярных концентраций: с (NaOH) = 1 моль/дм3 (1 н.); с (NaOH) = 0.5 моль/дм3 (0.5 н.): г (NaOH) = 0.1 моль/дм3 (0.1 н.).
1. ОБЩИЕ УКАЗАНИЯ
1.1. Титрованные растворы предназначены хш титриметрическнх определений и содержат в определенном объеме точно известные количества активного вещества.
За основу расчетов при приготовлении и проверке титрованных растворов взято понятие •молярная масса эквивалента». Числовое значение молярной массы эквивалента равно числовому значению ранее применявшегося грамм-ЭКВИВалента.
1.2. При приготовлении титрованных растворов должны соблюдаться требования ГОСТ 27025.
При взвешивании применяют лабораторные весы общего назначения лшов ВЛР-200 г и
ВЛ К'Г-500 г-М или ВЛЭ-200 г.
Допускается применять друше средства измерения с метрологическими характеристиками и оборудование с техническими характеристиками не хуже, а также реактивы но качеству не ниже ука занных.
(Измененная редакция. Изм. № I).
1.3. Растворы индикаторов готовят но ГОСТ 4919.1. Вспомогательные реактивы и растворы - но ГОСТ 4517.
1.4. Для приготовления растворов пироокисей используют дистиллированную воду, не содержащую углекислоты, приготовленную по ГОСТ 4517. Для приготовления других растворов и при титровании используют дистиллированную воду но ГОСТ 6709.
И 1дание официальное Перепечатка воспрещена
© Издательство стандартов. 1983 © ИПК Издательство стандартов. 2003 €> СТАНДАРТИНФОРМ. 2008
С. 2 ГОСТ 25794.1-83
1.5. Для приготовления титрованных растворов используют твердые вещества, взвешивая их (результат взвешивания в граммах записывают с точностью до второго десятичного знака), и концентрированные растворы веществ, отмеряя их пипеткой (ГОСТ 29227) или бюреткой (ГОСТ 29251) с иеной деления 0.1 см3. Допускается готовить тигрованные растворы, используя стандарт-титры (фиксаналы) в ампулах.
При приготовлении больших объемов титрованных растворов твердые вещества взвешивают на весах ВЛ КТ-1000 и концентрированные растворы отмеряют цилиндром.
1.4; 1.5. (Измененная редакция, Изм. .Ns I).
1.6. Приготовленные титрованные растворы тщательно перемешивают.
1.7. Определение точной молярной концентрации вещества в растворе
1.7.1. Точную молярную концентрацию г. моль/дм3, с коэффициентом поправки вычисляют по формуле
с = с, • К,
где с, — заданная молярная концентрация вещества в растворе, моль/дм3; к — коэффициент поправки.
1.7.2. Точную молярную концентрацию с. моль/дм3, без коэффициента поправки вычисляют по формуле
т.■ 1000
с = —!-
Мх V
где /и, — масса навески установочного вещества, г;
Л/, — молярная масса эквивалента установочного вещества, г/моль;
У— объем анализируемого раствора, израсходованный на титрование, см3.
Точная молярная концентрация вещества в растворе выражается четырьмя значащими цифрами после занятой.
1.8. Определение к о э ф ф ициент а и о п р а в к и
Коэффициент поправки (АО определяют но установочным веществам или их растворам.
1.8.1. При применении установочного вещества ко:я|>фициент поправки вычисляют по <|юр-
муле
1Г _ т1 • 1000 К~ А/, с, Г’
где w, — масса навески установочного вещества, г;
Л/, — молярная масса эквивалента установочного вещества, г/моль; с, — заданная молярная концентрация вещества в растворе, моль/дм3;
У— объем анализируемого раствора, израсходованный на титрование, см3.
1.8.2. При применении раствор;! установочного вещества (заданная молярная концентрация обоих растворов одинаковая) коэффициент поправки вычисляют но формуле
где V, — объем раствора установочного вещества, взятый или израсходованный на титрование, см3;
А', — коэффициент поправки раствора установочного вещества;
У — объем анализируемого раствора, взятый или израсходованный на титрование, см3.
1.9. При установлении коэффициента поправки необходимо применять калиброванную мерную посуду, гарантирующую требуемую точность измерения (приложение 2).
Титрование проводят в конических колбах (ГОСТ 25336) вместимостью 250 см3.
Воду добавляют цилиндром (ГОСТ 1770).
1.10. Для установления коэффициента поправки используют не менее трех навесок установочного вещества, взвешивая их (результат взвешивания в граммах записывают с точностью до четвертого знака). Необходимые массы навесок указаны в пунктах при определении коэффициентов поправки.
При применении растворов установочных веществ используют не менее трех разных объемов установочного вещества (например, от 30—40 см3 при применении бюреток вместимостью 50 см3 с ценой деления 0.10 см3 или от 15 до 20 см3 при применении бюреток вместимостью 25 см3 с ценой деления 0.05 см3. Применяются калиброванные бюретки по ГОСТ 29251 (приложение 2).
ГОСТ 25794.1-83 С. 3
1.11. Коэффициент поправки ним ист ют с точностью до четвертого десятичного знака по каждой навеске установочного вещества или по каждому объему раствора установочного веществ;». Расхождения между коэффициентами не должны превышать 0.001. Из вычисленных значений коэффициентов берут среднее арифметическое. Это значение коэффициента поправки должно быть равным 1.00±0.03. Если коэффициент поправки выходит из указанных пределов, то раствор соответственно укрепляют или разбавляют.
1.12. Коэффициент поправки рекомендуется устанавливать при 20 *С. при этой же температуре применяют титрованные растворы.
Если коэффициент поправки устанавливают и раствор применяют при других температурах, то вводят температурную поправку (см. табл. 1. 2 приложения 1).
1.9—1.12. (Измененная редакция. Изм. № 1).
1.13. Коэффициент поправки проверяют один раз в месяц, если раствор устойчив, соблюдены условия хранения, указанные в и. 1.17. и нет других указаний.
1.14. Допускается готовить растворы точной молярной концентрации, для которых коэффициент поправки не определяют. В этом случае навеску специально подготовленного установочного вещества пли ГСО 1-го разряда пт гитрнмегрии взвешиваю! (результат взвешивания записывают в граммах с точностью до четвертого десятич ною знака) и приготовление проводят в калиброванной мерной посуде.
(Измененная редакции. Изм. 1).
1.15. Если титрованный раствор применяют для потенциометрического титровании, коэффициент поправки устанавливают нотенциометрически в условиях проведения анализа.
1.16. Титрованные растворы готовят и храня г в стеклянных бутылках, склянках с тубусом (ГОСТ 25336). растворы щелочей — в полиэтиленовых бутылках.
Склянки с тубусом или бутылки должны быть соединены со склянками пт промывания газов СПЖ (ГОСТ 25336), содержащими некоторый объем того же раствора, а для щелочей еще с трубками типа ТХ-П (ГОСТ 25336). содержащими поглотитель ХП-И или другие поглотители углекислого газа.
Склянки с тубусом или бутылки дли растворов веществ, разлагающихся под действием света, должны быть из темного стекла или покрашены черным лаком.
(Измененная редакция. Изм. .N« 1).
1.17. Титрованные растворы хранят в помещениях при комнатной температуре в местах, защищенных от попадания прямых солнечных лучей.
1.18. На склянках с тубусом или бутылках с титрованным раствором указывают название раствора, заданную молярную концентрацию, коэффициент поправки, применяемый индикатор, дату (число, месяц, год) и температуру установления коэффициента поправки.
Допускается вместо заданной молярной концентрации и коэффициента поправки указывать значение точной молярной концентрации с четырьмя значащими цифрами после запятой. При потенциометрическом титровании вместо индикатор;» приводят указание о применении потенциометрического метода.
(Измененная редакции. Изм. № I).
1.19. Титрованные растворы, в которых при хранении появились хлопья или осадок, не должны применяться.
1.20 Титрованные растворы меньшей молярной концентрации вещества, чем указано в настоящем стандарте. 1хт>вят из титрованных растворов большей молярной концентрации соот-ветствующим разбавлением водой, не содержащей углекислоты, если нет других указаний. Коэффициент поправки титрованного раствора большей малярной концентрации переносится на раствор меньшей молярной концентрации с учетом разбавления в калиброванной мерной посуде.
Разбавленные титрованные растворы применяют свежеприготовленными.
(Измененная редакция. Изм. № I).
2. ПРИГОТОВЛЕНИЕ ТИТРОВАННЫХ РАСТВОРОВ
2.1. Кислоты серная и соляная, растворы молярных концентра-ци й: с(У2 H:S04) и с(НС1) = 1 моль/дм3; 0.5 моль/дм3 и 0.1 моль/дм3
Формула H2SO4 Относительная молекулярная масса — 98.07
Молярная масса эквивалента — 49.04 г/моль
Формула НС1
Относительная малекулярная масса — 36.46
Малярная масса эквивалента — 36.46 г/моль
2.1.1. Реактивы и растворы
Вода дистиллированная по ГОСТ 6709.
Барий хлористый но ГОСТ 4108. раствор массовой долей 20 %.
Кислота серная по ГОСТ 4204.
Кислота соляная по ГОСТ 3118, концентрированная и растворы концентраций: с (HCI) = = 0.1 моль/дм3 (0.1 н.) и 0.01 моль/дм3 (0.01 н.).
Фенолфталеин (индикатор) но ТУ 6—09—5360. спиртовой раствор с массовой долей 0.1 %.
Метиловый оранжевый (индикатор) по ТУ 6—09—5171. раствор с массовой долей 0.1 %.
Метиловый красный (индикатор) по ТУ 6—09—5169. спиртовой раствор с массовой долей
0.1 %.
Смешанный кислотно-основной индикатор (метиловый красный и метиленовый гол>бой).
Натрия бромид по ТУ 6—09—5331.
Натрий тетраборнокислый 10-водный по ГОСТ 4199. препарат с массовой долей основного вещества (100.0±0.2) сс. юювяг по и. 2.1.1.1;
Натрий хлористый по ГОСТ 4233.
Натрий углекислый по ГОСТ 83. предварительно прокаленный; готовят по н. 2.1.1.2.
Поглотитель химический известковый ХП-И по ГОСТ 6755 или известь натронная.
Спирт этиловый ректификованный технический по ГОСТ 18300.
2.1.1.1. Приготовление 10-водного т е т р а бор н о к и сл ого натрия
Для получения препарата, точно отвечавшего формуле Na7B4Or 10Н,О. 100 г препарата растворяют в 550 см3 воды при 50—60 *С (при более высокой температуре кристаллизуется NaiB407 5Н}0). Раствор фильтруют, охлаждают до 25—30 *С и энергично перемешивают. При этом происходит кристаллизация 10-водного тетраборнокислого натрия. Образующиеся кристаллы отфильтровывают и вторично подвергают кристаллизации в тех же условиях. Затем кристхыы высушивают между листами фильтровальной бумаги, помешают тонким слоем в чашку Петри и доводят до постоянной массы, выдерживая в эксикаторе над смоченными водой кристаллами бромида натрия. Кристаллы 10-водного тетраборнокислого натрия сохраняют в стаканчике для взвешивания (ГОСТ 25336) в том же эксикаторе при тех же условиях.
Массовую долю воды определяют С1едуюшим образом: 10.00 г препарата, перекристаллизо-ванного и доведенного до постоянной массы, высушивают в платиновом тигле (ГОСТ 6563) сначала на водяной бане, затем на песчаной бане или в сушильном шкафу (примерно 200 *С). после этого — в муфельной печи при 700—800 °С до постоянной массы (результат взвешивания записывают в граммах до третьего десятичного знака), что составляет 0.01 % избытка или недостатка влаги).
2.1.1.2. Приготовление безводного углекислого натрия
Углекислый натрий прокаливают при 270—300 ’С до постоянной массы в день установки титра. Для этого некоторое количество препарата в платиновом тигле с крышкой помещают на песчаную баню гак. чтобы уровень песка снаружи был нс ниже уровня препарата в тигле. Термометр помешают в песок около тигля, причем резервуар со ртутью термометра должен находиться на уровне препарата в тигле. Баню нагревают постепенно до 270—300 °С. препарат выдерживают при этой температуре около 2 ч. периодически перемешивая платиновым шпателем и тщательно следя за тем. чтобы температура не поднималась свыше 300 *С. Прокаливание допускается проводить в высокотемпературном электрическом шкафу с регулируемой температурой. После охлаждения препарат взвешивают и повторяют прокаливание до достижения постоянной массы.
Для контроля полноты прокаливании навеску 0.15—0.25 г прокаленного препарата растворяют в воде, прибавляют 5—7 г хлористого натрия, охлаждают до 0 'С. прибавляют 2—3 капли раствора фенолфталеина и титруют из бюретки 1(2)—2—50—0,1 (ГОСТ 29251) раствором соляной кислоты
0.1 моль/дм3 до обесцвечивания раствора. Замечают показания бюретки («а• см'), затем прибавляют 1 каплю раствора метилового оранжевого, продолжают титрование до перехода желтой окраски раствора в розовую и замечают показания бюретки от начала титрования (•б» см3). Если отношение
^ = 2. прокаливание считают законченным. Если отношение - > 2 (т. е. не весь бикарбонат
превратился в карбонат), прокаливание продолжают.
Прокаленный препарат переносят в банку с пришлифованной пробкой и сохраняют в эксикаторе с известковым химическим поглотителем ХП-И. Массовая доля основного вещества должна быть (100±0.2) %.
Массовую долю гидроокиси натрия в углекислом натрии определяют следующим образом: 30 см3 воды помещают в коническую колбу Кн-1 —100—14/23 ТХС (ГОСТ 25336) и кипятят в
ГОСТ 25794.1-83 С. 5
течение 2 мин. Затем прибавляют 2 г анализируемого углекислого натрия и закрывают колбу пробкой, в которую вставлена трубка с известковым химическим поглотителем ХП-Й. Сразу после растворения соли к горячему раствору приливают 25 см3 раствора хлористого бария и две капли раствора фенолфталеина. После этого колбу закрывают той же пробкой, взбалтывают и охлаждают. Если раствор окрасится, его титруют из бюретки 6—2—2(5) или 7—2—3(10) (ГОСТ 29251) до обесцвечивания раствором соляной кислоты 0.01 маль/дм3. На титрование должно расходоваться не более 1 см3 раствора соляной кислоты, что соответствует массовой доле гидроокиси натрия 0.02 %.
2.1.2. Пригонит, юние растворов кис. ют
Растворы кислот готовят разбавлением соответствующих концентрированных кислот. Для приготовления 1 дм3 раствора берут объемы серной и соляной кислоты, указанные в табл. 1. 2.
|
Таблица 1 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
|
Таблица 2 | ||||||||||||||||||||||
| ||||||||||||||||||||||
Отмеренный объем кислоты осторожно при перемешивании вливают в воду и доводят объем раствора водой до 1 дм3.
2.1—2.1.2. (Измененная редакция, Изм. № I).
2.1.3. Определение ком/н/нщиента поправки
2.1.3.1. Определение коэффициента поправки по безводному углекислому натрию
Формула Na2COj.
Относительная молекулярная масса — 105,99.
Молярная масса эквивалента — 53.00 г/моль.
В зависимости от молярной концентрации приготовленного раствора кислоты навески безводного углекислого натрия взвешивают в закрытом стаканчике для взвешивания в соответствии с табл. 3.
Навеску помещают в коническую колбу, прибавляют 40 см3 воды, добавляют 3—4 капли раствора смешанного индикатора и титруют из бюретки раствором кислоты до перехода зеленой окраски раствора в крас но-фиолетовую (для растворов массовой концентрации 0.1 маль/дм3 переход наблюдается на фоне молочного стекла).
|
Таблица 3 | |||||||||
| |||||||||
Затем раствор нагревают, кипятят 2—3 мин для удаления углекислоты и посте охлаждения продолжают титрование до перехода вновь появившейся окраски раствора в красно-фиолетовую.
Допускается применять в качестве индикатора метиловый оранжевый, при этом окраска раствора переходит из желтой в оранжевую.
2.1.3.2. Определение коэффициента поправки по W-водному тетрабор-нокислому натрию (для раствора молярной концентрации 0.1 моль/дм*)
Формула Na2B407 10Н2О.
Относительная молекулярная масса — 381.37.
Молярная масса эквивалента — 190.68 г/моль.
0.6000—0.8000 г 10-водного тетра борнокислого натрия помешают в коническую колбу, рас-люряют при энергичном взб&гтывании в 30—60 см3 теплой (50—60 *С) воды, охлаждают до комнатной температуры, добавляют 3—4 капли раствора метилового красною и титруют из бюретки раствором серной или соляной кислоты концентрации 0.1 моль/дм3 до перехода желтой окраски в розовато-оранже вую.
2.1.3.1; 2.1.3.2. (Измененная редакция. Изм. № 1).
2.1.3.3. (Исключен, Изм. № I).
2.1.4. Растворы кислот, которые хранятся продолжительное время, могут увеличивать свою молярную концентрацию за счет испарения воды. При наличии на стенках склянки с тубусом или бутылки капель воды раствор перед применением необходимо взба.гтывать.
2.2. Натрия гидроокись. растворы молярных концентраций: с (NaOH) = 1 мол ь/д м3. 0.5 м о л ь/д м3 и 0.1 м о л ь/д м3
Формула NaOH.
Относительная молекулярная масса — 40.00.
Молярная масса эквивалента — 40.00 г/моль.
2.2.1. Реактивы и растворы
Вода дистиллированная по ГОСТ 6709.
Калий йодноватокислый по ГОСТ 8504. препарат с массовой долей основного вещества (100.0±0.2) %; готовят высушиванием при 100 'С до постоянной массы. При необходимости проводят перекристаллизацию (два-три раза) из трехкратного количества воды с перемешиванием во время кристаллизации.
Кислота серная по ГОСТ 4204. растворы молярных концентраций: с 0/2 H,S04) = 1 моль/дм3 (1 н.); 0.5 моль/дм3 (0.5 н.); 0.1 моль/дм3 (0.1 н.) или
кислота соляная по ГОСТ 3118. растворы молярных концентраций с (НО) = 1 моль/дм3 (1 н.); 0.5 моль/дм3 (0.5 н.): 0.1 моль/дм3 (0.1 н.).
Метиловый оранжевый (индикатор) по ТУ 6—09—5171. раствор с массовой долей 0.1 %.
Фенолфталеин (индикатор) по ТУ 6—09—5360. спиртовой раствор с массовой долей I %.
Смешанный кислотно-основной индикатор (метиловый красный и метиленовый голубой).
Натрия гидроокись по ГОСТ 4328.
Кислота янтарная по ГОСТ 6341. препарате массовой долей основного вещества (100.0±0.2) %. готовят следующим образом: 100 г препарата растворяют при кипячении в 165 см3 воды, раствор фильтруют и охлаждают при перемешивании до комнатной температуры, выделившиеся криста,ыы отфильтровывают и вторично нерекристаллизовывают в тех же условиях, затем высушивают между листами фильтровальной бумаги до тех пор, пока они не перестанут прилипать к стеклянной палочке. Пере кристаллизованную янтарную кислоту пересыпают в банку с пришлифованной пробкой и хранят в эксикаторе, наполненном хлоридом кальция, высушенным при НИ) *С. В день установления коэффициента поправки навеску помещают в стаканчик для взвешивания и сушат до постоянной массы при температуре (100±5) *С.
Калий гидрофталат (калий фтале во кислый кислый).
Спирт этиловый ректификованный технический по ГОСТ 18300.
2.2.2. Приготов. гение растворов
250 г гидроокиси натрия растворяют в фарфоровом (Г ОСТ 9147) или фторопластовом стакане в 250 см3 воды. После охлаждения раствора до комнатной температуры его переносят в стеклянный или полиэтиленовый сосуд, закрывают резиновой или полиэтиленовой пробкой и в течение 2—3 недель выдерживают до полного осаждения углекислого натрия, не растворимого в растворе гидроокиси натрия указанной конценграции.
В отстоявшемся прозрачном концентрированном растворе устанавливают массовую концентрацию гидроокиси натрия по плотности (с применением таблиц) или титрованием. При титримет-рическом определении 1 см3 раствора, отобранного пипеткой 4(5)—2—1 (ГОСТ 29227). доводят водой до 40 см3 и титруют из бюретки (ГОСТ 29251) вместимостью 50 см3 раствором серной или
ГОСТ 25794.1-83 С. 7
соляной кислоты молярной концентрации I моль/дм3. 1 см3 раствора серной кислоты молярной концентрации томно с ('/, H2S04) = 1 моль/дм3 или соляной кислоты молярной концентрации точное (НС1)= 1 моль/дм'соответстнует 0,04 г гидроокиси натрия.
Для приготовления I дм3 раствора гидроокиси натрия берут объемы концентрированною раствора, соответствующие массам гидроокиси натрия в граммах, указанным в табл. 4.
|
Таблица 4 | ||||||||
|
Затем объем раствора доводят водой до I дм3.
Раствор концентрации 1 моль/дм3 хранят в полиэтиленовой или стеклянной склянке с тубусом и бутылке, парафинированной внутри.
2.1.4—2.2.2 (Измененная редакция, Изм. № 1).
2.2.3. Определение коэффициента поправки
2.2.3.1. Определение коэффициента поправки по соляной или серной кислоте
30—40 см' раствора кислоты соответствующей концентрации, отмеренных из бюретки, помещают в коническую колбу, добавляют 3—4 капли раствора смешанного индикатора и титруют из бюретки раствором гидроокиси натрия до перехода красно-фиолетовой окраски раствора в зеленую.
Раствор гидроокиси натрия с коэффициентом поправки, определенным по соляной или серной кислоте, рекомендуется применять при титровании сильных минеральных кислот.
2.2.3.2. Определение коэффициента поправки по йодноватокислому калию (для раствора молярной концентрации 0.1 моль/дм3 (0.1 н.)
Формула KJOyHJOj.
Относительная молекулярная масса — 389.91.
Молярная масса эквивалента — 389.91 г/моль.
1.2000— 1.5000 г кислого йодноватокислого калия помещают в коническую колбу и растворяют в 100 см3 горячей воды. После охлаждения добавляют 3—4 юный раствора смешанного индикатора и титруют из бюретки раствором пироокиси натрия до перехода красно-фиолетовой окраски в зеленую.
Раствор гидроокиси натрия с коэффициентом поправки, определенным по кислому йодноватокислому калию, рекомендуется применять при титровании сильных минеральных кислот.
2.2.3.3. Определение коэффициента поправки по янтарной кислоте
Формула СО:Н(СН>)2СО,Н.
Относительная молекулярная масса — 118.09.
Молярная масса эквивалента — 59.04 г/моль.
В зависимости ОТ молярной концентрации приготовленного раствора гидроокиси натрия навески янтарной кислоты взвешивают в стаканчике для взвешивания в соответствии с табл. 5.
|
Таблица 5 | ||||||||
|
Навеску янтарной кислоты помещают в коническую колбу, растворяют в 40 см' воды, добавляют 2—3 капли раствора фенолфталеина и титруют из бюретки раствором пир<юкиси натрия до появления не исчезающей в течение 50—60 с розовой окраски.
Раствор гидроокиси натрия с коэффициентом поправки, определенным по янтарной кислоте, рекомендуется применять при титровании органических кислот и слабых минеральных кислот.
2.2.3.1—2.2.3.3. (Измененная редакция, Изм. № 1).
2.2.3.4. Допускается определять коэффициент поправки по кислому фталевокислому калию с применением фенолфталеина в качестве индикатора или ГСО 1-го разряда № 2216—81.
(Введен дополнительно. Изм. № 1).
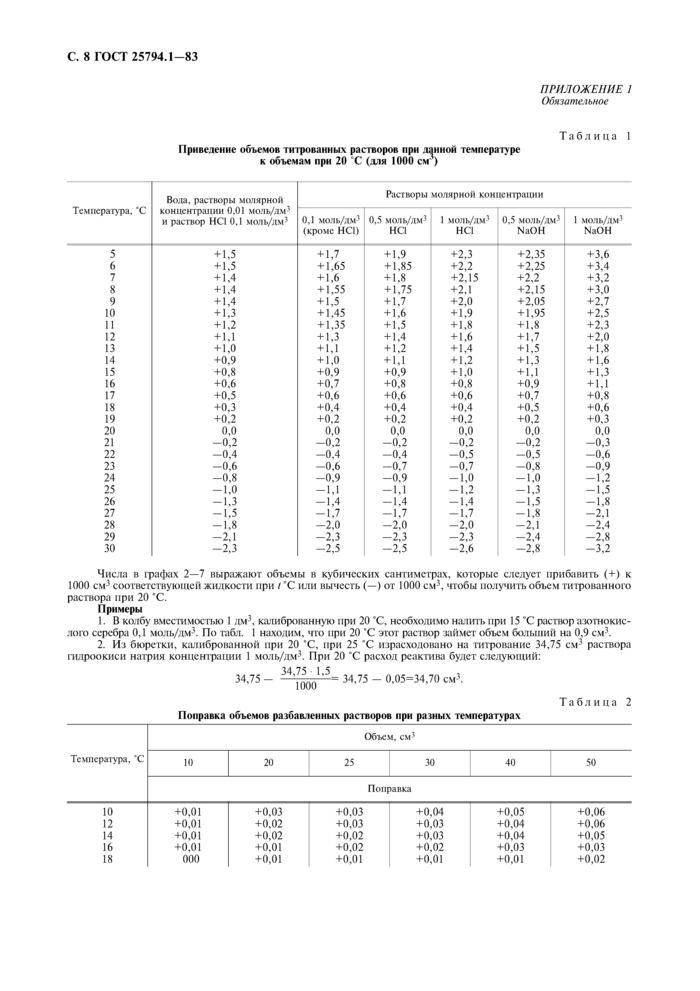
ПРИЛОЖЕНИЕ I Обязательное
|
Приведение объемов титрованных растворов при ланкой температуре к объемам при 20 С (для 1000 см’) Таблица 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Числа в графах 2—7 выражают объемы в кубических сантиметрах, которые следует прибавить (+) к 1000 ем3 соответствующей жидкости при / 'С или вычесть (—) от 1000 см3, чтобы получить объем титрованного раствора при 20 'С.
Примеры
1. В колбу вместимостью 1 дм3, калиброванную при 20 'С. необходимо наиггь при 15 *С раствор а югнокис-лого серебра 0.1 моль/дм3. По табл. 1 находим, что при 20 *С этот раствор займет объем больший на 0.9 см3.
2. Из бюретки, калиброванной при 20 ‘С, при 25 'С израсходовано на титрование 34,75 см3 раствора пироокиси натрии концентрации I моль/дм3. При 20 *С расход реактива будет следующий:
34.75 - 34,^К5= 34.75 - 0.05=34.70 см3.
|
Таблица 2 Поправка объемов ратбааленныч растворов при ратных температурах | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||