ГОСТ Р ИСО 11137-2000
Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Радиационная стерилизация
Устанавливает требования к валидации, управлению и текущему контролю процесса радиационной стерилизации медицинской продукции. Он распространяется на радиационно-технологические установки непрерывного и циклического типа, использующие ионизирующее излучение радионуклидов Со 60 и Cs 137, а также на радиационно-технологические установки с использованием генераторов электронного и тормозного излучения.
В стандарте не рассматривается проектирование, лицензирование, обучение оператора и факторы, связанные с радиационной безопасностью, а также оценка пригодности продукции для использования по назначению после радиационной стерилизации. Использование биологических индикаторов для валидации или контроля процесса и испытания на стерильность выпускаемой продукции не рассматривается, поскольку эти индикаторы для процесса радиационной стерилизации не рекомендуются.
Рекомендуется использовать ГОСТ Р ИСО 11137-1-2008 (ИУС 4-2009), ГОСТ Р ИСО 11137-2-2008 (ИУС 4-2009), ГОСТ Р ИСО 11137-3-2008 (ИУС 4-2009)
Оглавление
1 Область применения
2 Нормативные ссылки
3 Определения
4 Документация
5 Персонал
6 Валидация процесса стерилизации
6.1 Общие положения
6.2 Аттестация продукции
6.3 Аттестация оборудования
6.4 Аттестация процесса
6.5 Валидация
6.6 Поддержание результатов валидации
7 Текущий контроль процесса
7.1 Технические требования к процессу
7.2 Обращение с продукцией
7.3 Техническое обслуживание
7.4 Облучение продукции
7.5 Документация на процесс
7.6 Приемка стерилизации
8 Управление и контроль
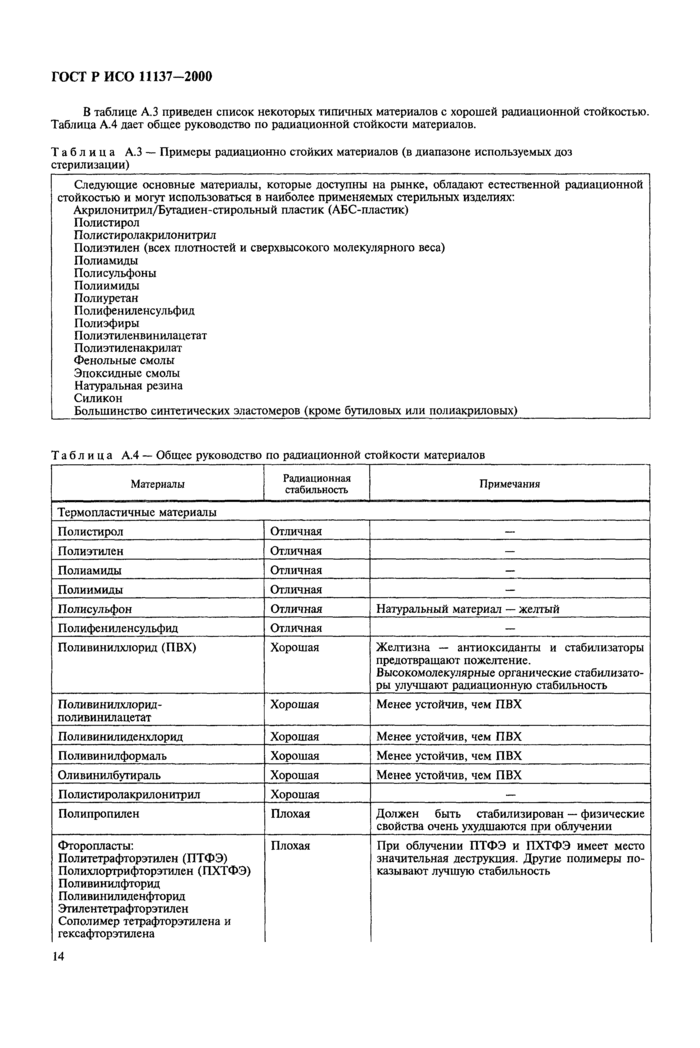
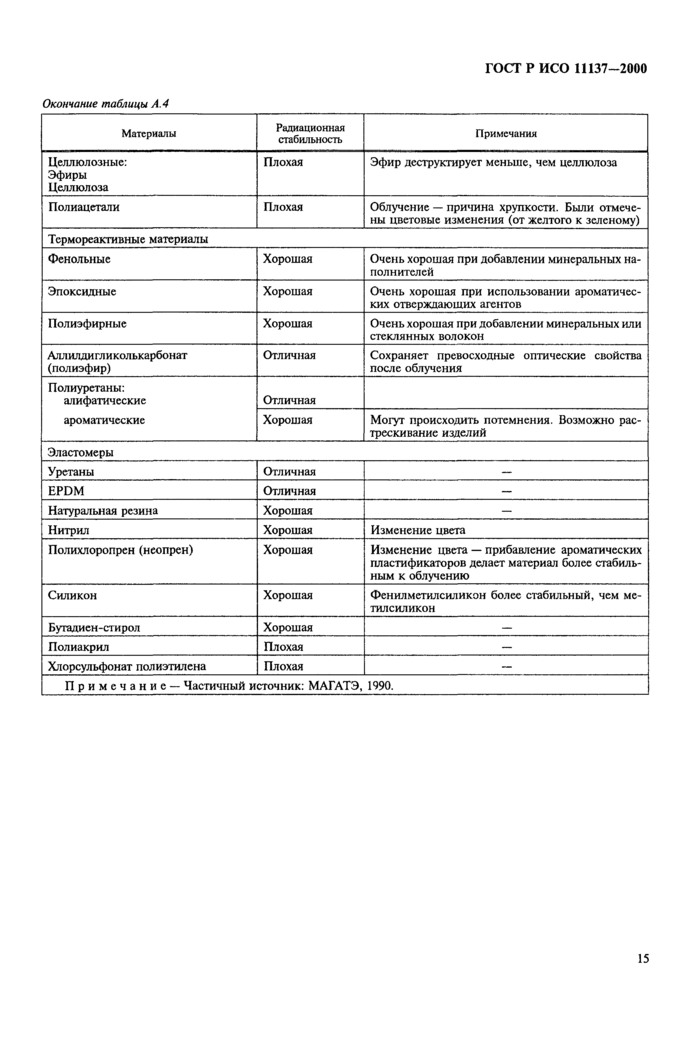
Приложение А Испытания изделий и упаковочных материалов
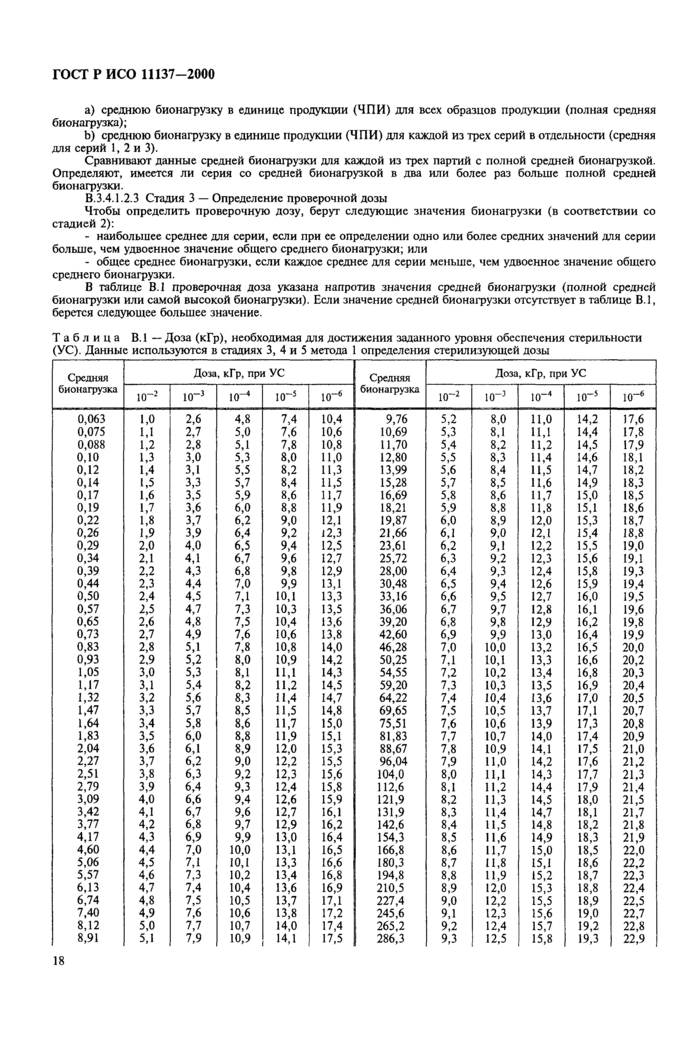
Приложение В Методы определения стерилизующей дозы
Приложение С Библиография
46 страниц
| Дата введения | 01.07.2001 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.01.2010 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 14.08.2000 | Утвержден | Госстандарт России | 207-ст |
|---|---|---|---|
| Разработан | Московская медицинская академия им. И.М. Сеченова | ||
| Разработан | АСИНКОМ | ||
| Разработан | ВНИИФТРИ Госстандарта РФ | ||
| Издан | ИПК Издательство стандартов | 2001 г. |
Sterilization of health care products. Requirements for validation and routine control. Radiation sterilization
- ГОСТ Р ИСО 9001-96 Системы качества. Модель обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании
- ГОСТ Р ИСО 9002-96 Системы качества. Модель обеспечения качества при производстве, монтаже и обслуживании
ГОСТ Р 50325-92Изделия медицинского назначения. Методика дозиметрии при проведении процесса радиационной стерилизации. Заменен на ГОСТ Р 50325-2011.- ГОСТ Р ИСО 11737-1-2000 Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
стр. 18
стр. 19

стр. 20

стр. 21
стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Стерилизация медицинской продукцииТРЕБОВАНИЯ К ВАЛИДАЦИИ И ТЕКУЩЕМУ КОНТРОЛЮ
Радиационная стерилизация
БЗ 9—2000
БЗ 9—2000
Издание официальное
ГОССТАНДАРТ РОССИИ Москва
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ), ВНИИФТРИ Госстандарта России и Московской медицинской академией им. И.М. Сеченова
ВНЕСЕН Техническим комитетом по стандартизации ТК 383 «Стерилизация медицинской продукции* Госстандарта России
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 14 августа 2000 г. N9 207-ст
3 Настоящий стандарт содержит аутентичный текст международного стандарта ИСО 11137-95 «Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Радиационная стерилизация*
4 ВВЕДЕН ВПЕРВЫЕ
© ИПК Издательство стандартов, 2001
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта России II
Содержание
1 Область применения....................................................... 1
2 Нормативные ссылки...................................................... 1
3 Определения............................................................. 1
4 Документация............................................................ 5
5 Персонал............................................................... 5
6 Валидация процесса стерилизации............................................ 5
6.1 Общие положения..................................................... 5
6.2 Аттестация продукции.................................................. 6
6.3 Аттестация оборудования................................................ 6
6.4 Аттестация процесса.................................................... 8
6.5 Валидация........................................................... 8
6.6 Поддержание результатов валидации....................................... 8
7 Текущий контроль процесса................................................ 9
7.1 Технические требования к процессу........................................ 9
7.2 Обращение с продукцией................................................ 9
7.3 Техническое обслуживание............................................... 9
7.4 Облучение продукции................................................... 9
7.5 Документация на процесс................................................10
7.6 Приемка стерилизации..................................................11
8 Управление и контроль.....................................................11
Приложение А Испытания изделий и упаковочных материалов........................12
Приложение В Методы определения стерилизующей дозы............................16
Приложение С Библиография.................................................37
Ш
Введение
Настоящий стандарт содержит требования по обеспечению проведения процесса радиационной стерилизации. К ним относятся документированные программы работ, при помощи которых устанавливаются нормы, обеспечивающие проведение радиационного процесса в регламентированных условиях, при которых производимая продукция постоянно обрабатывается в заданном диапазоне поглощенных доз.
Радиационный процесс — это физический процесс, связанный с облучением изделия ионизирующим излучением. Изделие облучают на специальном оборудовании гамма-излучением радионуклидов кобальта-60 (Со60), или цезия-137 (Cs137) или пучком электронного или рентгеновского излучения, генерируемого ускорителем электронов. При правильном проведении радиационная стерилизация является безопасным и надежным промышленным процессом.
Стерилизация является примером процесса, эффективность которого не может быть проверена ретроспективным контролем и испытанием продукции. Важно понимать, что для валидированного и точно контролируемого процесса стерилизации облучение не является единственным условием гарантии того, что изделие стерильно и пригодно для использования по назначению. Следует уделять внимание микробиологическому состоянию сырья и/или комплектующих, микробиологическим защитным свойствам упаковки и контролю внешних условий изготовления, сборки, упаковки и хранения продукции.
Стерильный продукт — это продукт, который не содержит жизнеспособных микроорганизмов. Продукция, изготовленная в контролируемых условиях, может быть до стерилизации загрязнена микроорганизмами, хотя обычно в небольшом количестве. Такая продукция, по определению, нестерильна. Цель стерилизации — дезактивировать микробиологическую контаминацию на нестерильной продукции. Дезактивация микроорганизмов физическими и химическими методами подчиняется экспоненциальному закону. Следовательно, можно рассчитать конечную вероятность выживания микроорганизмов независимо от значения стерилизующей дозы или способа обработки. Вероятность выживания является функцией числа и типа (штамма) микроорганизмов, имеющихся на продукции, процесса гибели при стерилизации и, в отдельных случаях, условий окружающей среды, в которой находятся микроорганизмы при обработке. Из этого следует, что стерильность конкретного объекта в общем числе стерилизуемой продукции не может быть гарантирована в абсолютном смысле.
Уровень обеспечения стерильности (УС) вычисляется математически и определяет вероятность наличия жизнеспособного микроорганизма на отдельной единице продукции.
Первичный изготовитель несет полную ответственность за обеспечение правильности и адекватности всех операций при стерилизации и испытаниях на соответствие техническим требованиям на данную продукцию. В то же время ответственный за облучение персонал отвечает за обработку изделий в требуемом диапазоне доз в соответствии с требованиями валидированного процесса.
В связи с введением ГОСТ 30392-95/ГОСТ Р 50325-92 приложение С к ИСО 11137 о дозиметрии в настоящий стандарт не включено.
ГУ
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Стерилизация медицинской продукции
ТРЕБОВАНИЯ К ВАЛИДАЦИИ И ТЕКУЩЕМУ КОНТРОЛЮ
Радиационная стерилизация
Sterilization of health саге products.
Requirements for validation and routine control. Radiation sterilization
Дата введения 2001—07—01
1 Область применения
1.1 Настоящий стандарт устанавливает требования к валидации, управлению и текущему контролю процесса радиационной стерилизации медицинской продукции. Он распространяется на радиационно-технологические установки непрерывного и циклического типа, использующие ионизирующее излучение радионуклидов Со60 и Cs137, а также на радиационно-технологические установки с использованием генераторов электронного и тормозного излучения.
Дополнительная информация приведена в приложениях А — С. В настоящем стандарте нс рассматривается проектирование, лицензирование, обучение оператора и факторы, связанные с радиационной безопасностью, а также оценка пригодности продукции для использования по назначению после радиационной стерилизации. Использование биологических индикаторов для валидации или контроля процесса и испытания на стерильность выпускаемой продукции не рассматривается, поскольку эти индикаторы для процесса радиационной стерилизации не рекомендуются.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 30392-95/ГОСТ Р 50325-92 Изделия медицинского назначения. Методика дозиметрии при проведении процесса радиационной стерилизации
ГОСТ Р ИСО 9001-96 Системы качества. Модель обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании
ГОСТ Р ИСО 9002-96 Системы качества. Модель обеспечения качества при производстве, монтаже и обслуживании.
ГОСТ Р ИСО 11737-1-2000 Стерилизация медицинской продукции. Микробиологические методы. Оценка популяции микроорганизмов в продукции.
ИСО 11737-2—98 Стерилизация медицинских изделий. Микробиологические методы. Испытания на стерильность, проводимые при валидации процессов стерилизации.
3 Определения
В настоящем стандарте используют следующие термины с соответствующими определениями:
3.1 Медицинская продукция (health саге product) и соответствующие термины:
3.1.1 партия, серия (batch): Определенное количество нерасфасованной, промежуточной или готовой продукции, которая изготовлена в течение определенного цикла производства и имеет однородные характеристики и качество.
3.1.2 медицинская продукция (health саге product): Медицинские изделия, лекарственные средства (фармацевтические и биологические) и изделия для диагностики in vitro.
3.1.3 первичный изготовитель (primary manufacturer): Компания или организация, ответственная за изготовление, выпуск, качество и безопасность медицинской продукции.
Издание официальное
3.1.4 категория продукции (product category):
1) Для стерилизации гамма- или тормозным излучением — Продукция с одинаковой объемной плотностью, обусловливающей одинаковый характер распределения доз.
2) Для стерилизации электронным излучением — Продукция с одинаковой максимальной поверхностной плотностью, обусловливающей одинаковый характер распределения доз.
3.1.5 единица продукции (product unit): Медицинская продукция, комплект изделий или компонентов в первичной упаковке.
3.2 Радиационно-технологическая установка (Irradiator) и соответствующие термины:
3.2.1 радиационно-технологическая установка периодического действия (batch (type) irradiator): Радиационно-технологическая установка, у которой загрузка и выгрузка контейнеров для облучения производится, когда источник ионизирующего излучения находится в положении хранения.
3.2.2 объемная плотность (bulk density): Масса продукции и всей соответствующей упаковки в контейнере для облучения, деленная на объем, определяемый размерами внешней упаковки.
3.2.3 радиационно-технологическая установка непрерывного действия (continuous (type) irradiator): Установка, которая может быть загружена продукцией и разгружена, когда источник находится в рабочем положении.
3.2.4 контейнер для облучения (irradiation container): Подвеска, тележка, поддон или другой контейнер, в котором производится облучение продукции.
3.2.5 радиационно-технологическая установка (РТУ) (irradiator): Комплекс средств, обеспечивающий безопасное и надежное проведение стерилизации, имеющий в своем составе источник излучения, конвейер и механизмы привода источника, а также устройства безопасности и защиту.
3.2.6 ответственный за облучение (irradiator operator): Компания или организация, ответственная за облучение медицинской продукции требуемой дозой.
3.2.7 поверхностная плотность (surface density): Масса элементарного столбика продукции, вырезанного в направлении распространения пучка электронов вдоль всего контейнера для облучения до самой отдаленной его точки, отнесенная к площади поперечного сечения столбика.
Примечание — Единица поверхностной плотности — г/см2.
3.2.8 установка таймера (timer setting): Выбранный интервал времени, в течение которого контейнер для облучения должен находиться в каждой позиции при облучении. Она определяет продолжительность облучения.
3.3 Источники излучения (radiation sources) и соответствующие термины:
3.3.1 средний ток пучка (average beam current): Усредненный во времени поток электронов, производимый генератором электронов.
3.3.2 тормозное излучение (bremsstrahlung): Фотонное ихтучение с непрерывным энергетическим спектром, возникающее при уменьшении кинетической энергии заряженных частиц.
Примечание — На практике тормозное ихтучение получают при торможении электронов в каком-либо материале (конвертере). Спектр тормозного излучения зависит от энергии электронов, материала и толщины конвертера и содержит фотоны с энергией от нуля до максимальной энергии электронов.
3.3.3 конвертер (converter): Мишень для электронов высокой энергии, обычно из материала, имеющего высокий атомный номер, в котором возникает тормозное излучение в результате потери энергии падающих электронов.
3.3.4 электронный пучок (electron beam): Непрерывный или импульсный поток электронов высокой энергии.
3.3.5 энергия электронов (electron energy): Кинетическая энергия электронов в электронном пучке.
3.3.6 гамма-излучение (gamma ray): Коротковолновое электромагнитное излучение (фотоны), испускаемое радиоактивными веществами в процессе ядерных реакций.
Примечания
1 Имеет широкое применение.
2 Гамма-ихтучение, используемое для облучения медицинской продукции, — это проникающее фотонное излучение высокой энергии, испускаемое радионуклидными источниками Со60 или Cs137.
3.3.7 активность источника (source activity): Мера радиоактивности радионуклида Со60 или Cs137, измеряемая в беккерелях или кюри (1 Кюри (Ки) - 3,7 х 1010 беккерелей (Бк), где 1 Бк = 1 распаду в секунду).
3.3.8 Тормозное ихтучение (x-rays): Коротковолновое электромагнитное излучение, возникающее при ускорении, торможении или отражении электронов высокой энергии сильными электрическим или магнитным полями атомов мишени.
2
Примечания
1 Имеет широкое применение.
2 Термин включает как тормозное излучение, возникающее при торможении электрона около атомного ядра, так и характеристическое моноэнергетическое ихтучение, возникающее при переходе атомных электронов на более низкие энергетические уровни. В настоящем стандарте определение применяется для тормозного излучения.
3.4 Термины, относящиеся к измерению дозы (dose measurement):
3.4.1 поглощенная доза (absorbed dose): Количество энергии излучения, переданное единице массы облучаемого материала. Единица поглощенной дозы — грей (Гр). 1 Гр эквивалентен поглощению 1 Дж на 1 кг (равняется 100 рад).
3.4.2 доза (dose): (см. «поглощенная доза»).
3.4.3 дозиметр (dosimeter): Устройство или система, имеющие воспроизводимый и поддающийся измерению отклик к ионизирующему излучению, которые используются для измерения поглощенной дозы в данном материале.
3.4.4 дозиметрия (dosimetry): Измерение поглощенной дозы с помощью дозиметров.
3.4.5 дозиметрическая система (dosimetry system): Система, используемая для определения поглощенной дозы, состоящая из детекторов, измерительной аппаратуры и методики ее применения.
3.4.6 дозиметр — первичный эталон (primary standard dosimeter): Дозиметр самого высокого метрологического качества, утвержденный и хранящийся как эталон единицы поглощенной дозы национальной или международной организацией по стандартизации.
3.4.7 образцовый дозиметр (reference standard dosimeter): Дозиметр высокого метрологического качества, используемый как эталон для обеспечения единства измерений и передачи размера единицы поглощенной дозы от первичного эталона рабочим дозиметрам.
3.4.8 рабочий дозиметр (routine dosimeter): Дозиметр, калиброванный с помощью первичного, рабочего эталона или эталона сравнения и используемый для технических измерений поглощенной дозы.
3.4.9 дозиметр — эталон сравнения (transfer standard dosimeter): Дозиметр, часто образцовый дозиметр (рабочий эталон), предназначенный для использования в качестве вспомогательного средства измерения для сравнения дозиметрических измерений, проводимых в разных местах.
3.5 Валидация (validation) и соответствующие термины:
3.5.1 калибровка (calibration): Сличение измерительной системы или прибора неизвестной точности с измерительной системой или прибором известной точности (в соответствии с поверочной схемой), с целью обнаружения, установления соотношений, учета или устранения регулированием любых отклонений показаний калибруемой измерительной системы или прибора от заданных допусков.
3.5.2 аттестация установленного оборудования (installation qualification): Получение и документальное подтверждение того, что оборудование поставлено, установлено в соответствии с техническими требованиями и функционирует с заданными параметрами при использовании в соответствии с инструкциями по эксплуатации.
3.5.3 национальный эталон (national standard): Эталон, признанный решением национальных органов в качестве исходного для всех остальных эталонов рассматриваемой величины в стране.
3.5.4 аттестация процесса (process qualification): Получение и документальное подтверждение уверенности в том, что процесс стерилизации обеспечит производство медицинской продукции необходимого качества.
3.5.5 аттестация продукции (product qualification): Получение и документальное подтверждение уверенности о том, что медицинская продукция будет пригодна после облучения для использования по назначению.
3.5.6 валидация (validation): Документально подтвержденное доказательство того, что рассматриваемый процесс с высокой степенью уверенности будет постоянно давать продукцию, соответствующую заданным характеристикам и требованиям к качеству.
3.6 Стерильность (sterile) и соответствующие термины:
3.6.1 стерильность (sterile): Отсутствие жизнеспособных микроорганизмов.
Примечание — На практике утверждение об абсолютном отсутствии любых форм жизнеспособных
микроорганизмов нс может быть доказано (см. 3.6.3).
3.6.2 уровень обеспечения стерильности (УС) (sterility assurance level (SAL): Вероятность наличия жизнеспособного микроорганизма на единице продукции после стерилизации.
Примечание — УС обычно выражается величиной 10-п.
3
3.6.3 стерилизация (sterilization): Валидированный процесс освобождения продукции от жизнеспособных микроорганизмов.
Примечание — Природа отмирания микроорганизмов в процессе стерилизации описывается экспоненциальной функцией. Поэтому можно говорить только о вероятности наличия микроорганизмов на любой отдельно взятой единице продукции. Вероятность может быть очень малой, но она никогда не может быть равна нулю. Вероятность может быть выражена в виде уровня обеспечения стерильности (УС).
3.6.4 стерилизующая доза (sterilization dose): Минимальная поглощенная доза, необходимая для достижения указанного уровня обеспечения стерильности (УС).
3.7 Термины, связанные с определением дозы
3.7.1 бионагрузка (bioburden): Популяция жизнеспособных микроорганизмов на продукции.
Примечание — В контексте радиационной стерилизации бионагрузка определяется непосредственно перед стерилизацией (инициальная контаминация).
3.7.2 положительная доля (fraction positive): Частное от деления количества образцов, давших положительный результат контроля стерильности, на общее количество исследованных образцов.
3.7.3 возрастающая доза (incremental dose): Доза из серии значений доз, при которых облучается определенное количество единиц продукции или их частей, используемая в методе определения стерилизующей лозы для установления или подтверждения ее значения.
3.7.4 радиационная стойкость (radiation stability): Способность медицинской продукции сохранять свои функциональные свойства в течение всего срока годности после облучения максимальной дозой.
3.7.5 проверка стерилизующей дозы (sterilization dose audit): Действия, определяющие необходимость изменения стерилизующей дозы.
3.8 Термины, употребляемые в приложении В
3.8.1 испытание на стерильность (sterility testing): Испытание, выполненное с целью установления наличия жизнеспособных микроорганизмов на единице продукции.
3.8.2 испытание на стерильность с положительным результатом (positive sterility test): Испытания, которые обнаруживают рост микроорганизмов после инкубации.
3.8.3 испытания на стерильность с отрицательным результатом (negative sterility test): Испытания, которые показывают отсутствие роста микроорганизмов посте инкубации.
3.8.4 ложноположительный результат (false positive): Результат испытания, при котором помутнение испытательной среды, являющееся стедствием вторичного загрязнения микроорганизмами или взаимодействием между образцом и испытательной средой, приписывается испытуемому образцу.
3.8.5 ложноотрниательный результат (false negative): Результат испытания, который интерпретируют как отсутствие роста в то время, когда рост присутствует, но не обнаруживается, или когда жизнеспособные микроорганизмы нс смогли вырасти.
3.8.6 аэробный организм (aerobic organism): Микроорганизм, использующий кислород в качестве акцептора электронов при метаболизме.
3.8.7 анаэробный организм (anaerobic organism):
1) Микроорганизмы, которые не используют кислород как акцептор электронов при метаболизме.
2) Микроорганизмы, которые растут только при отсутствии кислорода.
3.8.8 факультативный микроорганизм (facultative organism): Микроорганизм, способный как к аэробному, так и к анаэробному метаболизму.
3.8.9 часть продукции для испытания (ЧПИ) (sample item portion (SIP)): Определенная часть единицы медицинской продукции, которую используют при испытаниях.
3.8.10 проверочная доза (verification dose) (£1, кГр): Значение дозы, обеспечивающее УС = 10“2 для единицы продукции или ее части и используемое в методике определение стерилизующей дозы при ее установлении или подтверждении.
3.8.11 D10, кГр: Доза излучения при определенных условиях обработки, необходимая для уменьшения однородной популяции микроорганизмов в 10 раз в предположении, что инактивация микроорганизмов подчиняется кинетическому уравнению первого порядка.
4 Документация
Чтобы гарантировать воспроизводимость валидации, производственные процессы и все другие элементы, которые будут влиять на процесс стерилизации, должны быть полностью документированы. Оформление и ведение документации следует выполнять в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
5 Персонал
Должен быть назначен квалифицированный персонал, ответственный за валидацию и текущий контроль радиационной стерилизации в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6 Валидация процесса стерилизации
6.1 Общие положения
Валидация процесса стерилизации должна включать следующие элементы:
a) аттестацию продукции, облученной на предварительно аттестованной установке радиационной стерилизации;
b) аттестацию установленного оборудования;
c) апсстацию процесса с использованием конкретной или моделирующей ее продукции на аттестованном оборудовании;
d) процедуру официального рассмотрения и утверждения администрацией документации по перечислениям а), Ь) и с);
с) действия, направленные на поддержание результатов валидации.
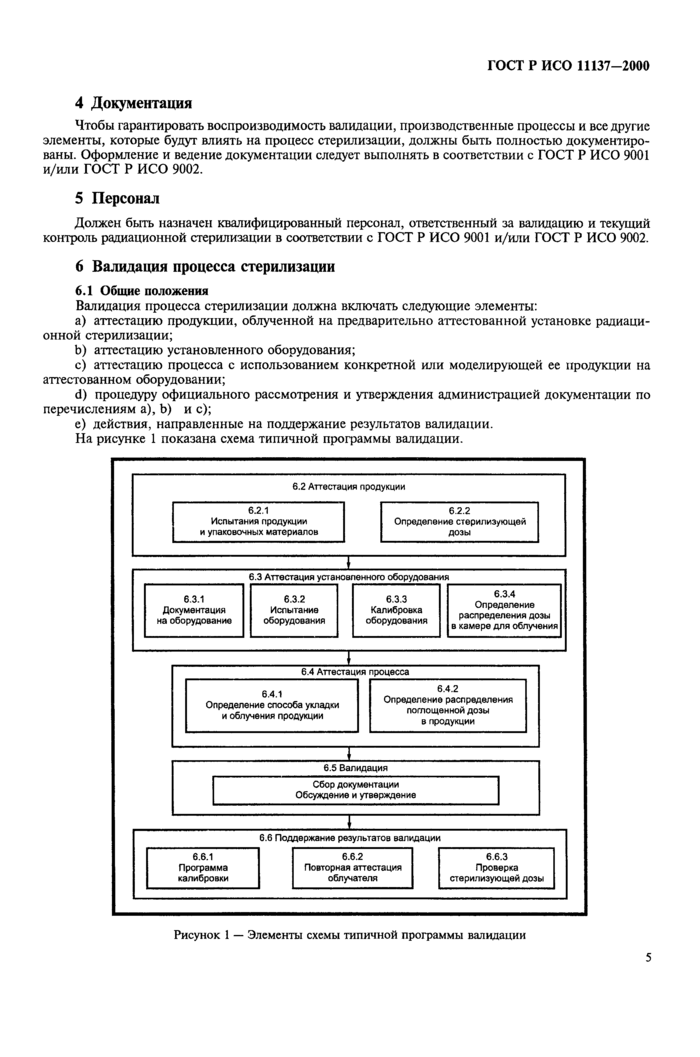
На рисунке 1 показана схема типичной программы валидации.
|
6.2 Аттестация продукции | |||||||||
|
| ||||||||||||||||||||||||||||||||
|
6 4 Аттестация процесса 6.4.1 Определение способе укладки и облучения продукции 6.4.2 Определение распределения поглощенной дозы в продукции | ||||||||||||||||||||||||||||||||
6.5 Валидация
Сбор документации Обсуждение и утверждение
т
|
в.в Поддержание результатов валидации | |||||||||||||||
| |||||||||||||||
|
Рисунок 1 — Элементы схемы типичной программы валидации |
6.2 Аттестация продукции
6.2.1 Испытания продукции и упаковочных материалов
До использования метода радиационной стерилизации для производства медицинской продукции необходимо оценить влияние ионизирующего излучения на материалы, из которых изготовлена продукция (и/или ее компоненты) и упаковочные материалы. Должно быть показано, что качество, безопасность и функциональные свойства продукции сохраняются в течение всего срока годности.
Эта проверка должна охватывать все характеристики, существенно влияющие на качество, безопасность и функциональные свойства продукции. Обычно при разработке программы испытаний должны быть приняты во внимание: возможные изменения процесса изготовления продукции и его допуски, диапазон доз излучения, вид излучения, сырье и условия хранения. Для каждого вида продукции и упаковочного материала должна быть установлена максимально допустимая доза излучения.
Руководство по испытанию изделий и упаковочных материалов приведено в приложении А.
6.2.2 Выбор стерилизующей дозы
6.2.2.1 Для определения стерилизующей дозы нужно определить количество и радиорезистентность естественной микрофлоры изделия. Доза должна быть достаточной для обеспечения заранее заданного уровня стерильности (УС).
При выборе стерилизующей дозы используется один из двух подходов:
a) выбор стерилизующей дозы, использующий:
1) информацию о бионагрузке или
2) информацию, полученную при облучении возрастающей дозой.
Примечание — Методы определения дозы дня радиационной стерилизации приведены в приложении В;
b) выбор стерилизующей дозы 25 кГр, после соответствующего обоснования.
6.2.2.2 Основными техническими требованиями при получении информации, необходимой для выбора стерилизующей дозы с использованием сведений о бионагрузке или положительной доле, и подтверждения выбора значения 25 кГр должны быть:
a) использование услуг компетентных микробиологических лабораторий;
b) выполнение микробиологических испытаний в соответствии с ГОСТ Р ИСО 11737-1 и/или ИСО 11737-2 (см. также |5|);
c) проведение облучения продукции на установках с использованием:
- источников ионизирующего излучения Со60 или Cs137 или
- пучков электронов и тормозного излучения при значениях энергии излучения и мощности дозы, подобных тем, которые используют в производстве изделий и способных обеспечить облучение с достаточной точностью при значениях дозы, начиная с 1 кГр.
6.2.3 Передача стерилизующей дозы
При передаче продукции с одной установки на другую значение стерилизующей дозы, определенное в соответствии с 6.2.1 и 6.2.2 для первой установки, следует использовать для второй, принимая во внимание следующие данные:
При передаче продукции с установки с электронным пучком или тормозным ихтучением на любую другую радиационно-технологическую установку (электронный пучок -* электронный пучок; тормозное излучение -> тормозное излучение; электронный пучок «-* тормозное излучение; электронный пучок «-> гамма-излучение; тормозное излучение <-> гамма излучение) должны был. получены данные, доказывающие, что различия характеристик двух установок, в частности энергии излучения и мощности дозы, а также распределения поглощенной дозы в продукции, не снижают уровень инактивации микроорганизмов при использовании той же самой стерилизующей дозы.
При передаче стерилизующей дозы между двумя гамма-установками должны быть данные, доказывающие, что отличия в распределении поглощенной дозы в продукции для двух установок не влияют на уровень инактивации микроорганизмов при использовании той же самой стерилизующей дозы.
6.3 Аттестация оборудования
Должна быть составлена, утверждена, и выполняться программа аттестации оборудования.
6.3.1 Документация на оборудование
Должна быть документация, описывающая конструкцию и действие радиационно-технологической установки (РТУ). Эта документация должна храниться в течение всего периода эксплуатации установки и включать в себя следующие документы:
а) технические требования на РТУ и его характеристики;
1
Обозначение дозы.