ГОСТ Р ИСО 11737-1-2000
Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции
Устанавливает общие критерии оценки популяции жизнеспособных микроорганизмов (бионагрузки) на медицинских изделиях или материалах, сырье или упаковках. Оценка бионагрузки состоит из подсчета и классификации популяции микроорганизмов. Стандарт не может быть применен при оценке или анализе вирусной контаминации или микробиологического контроля среды, в которой производятся медицинские изделия.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Определения
4 Общие положения
4.1 Документация
4.2 Персонал
4.3 Оборудование
4.4 Питательные среды и материалы
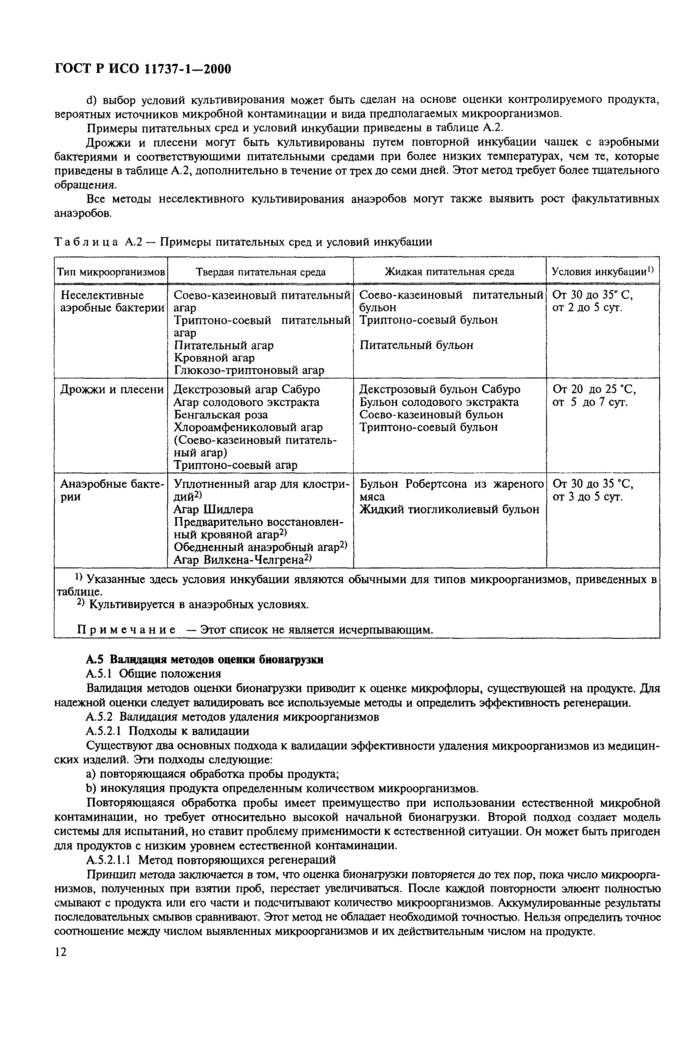
5 Отбор единиц продукции
5.1 Отбор единицы продукции
5.2 Часть продукции для испытания (ЧПИ)
6 Выбор методов
7 Валидация методов
8 Использование методов оценки
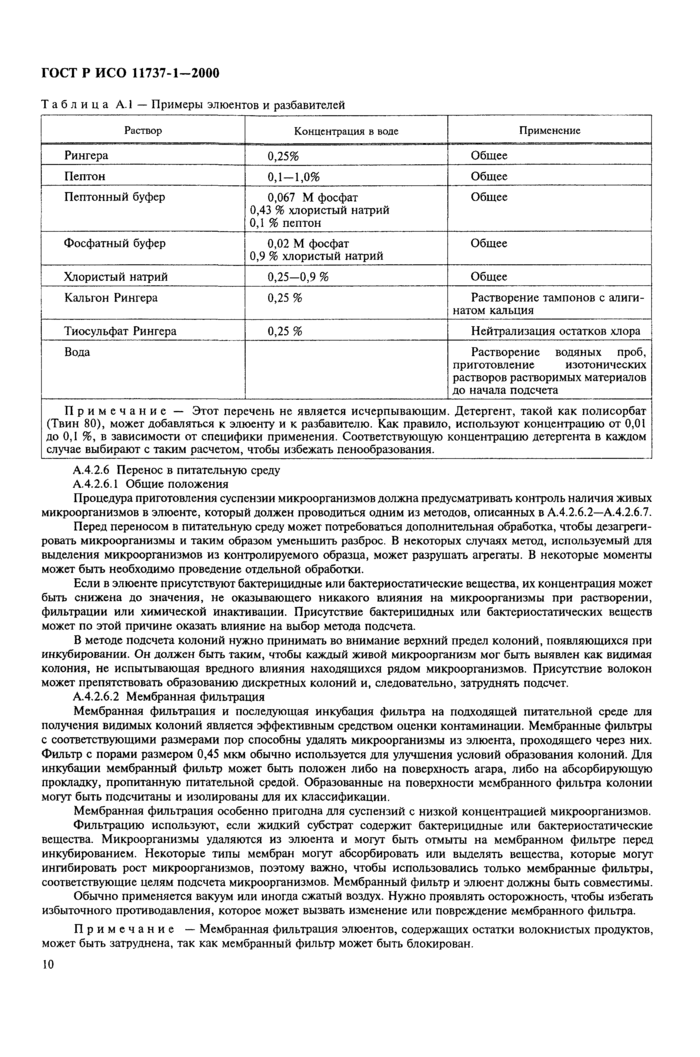
Приложение А Методы оценки популяции микроорганизмов на продукции
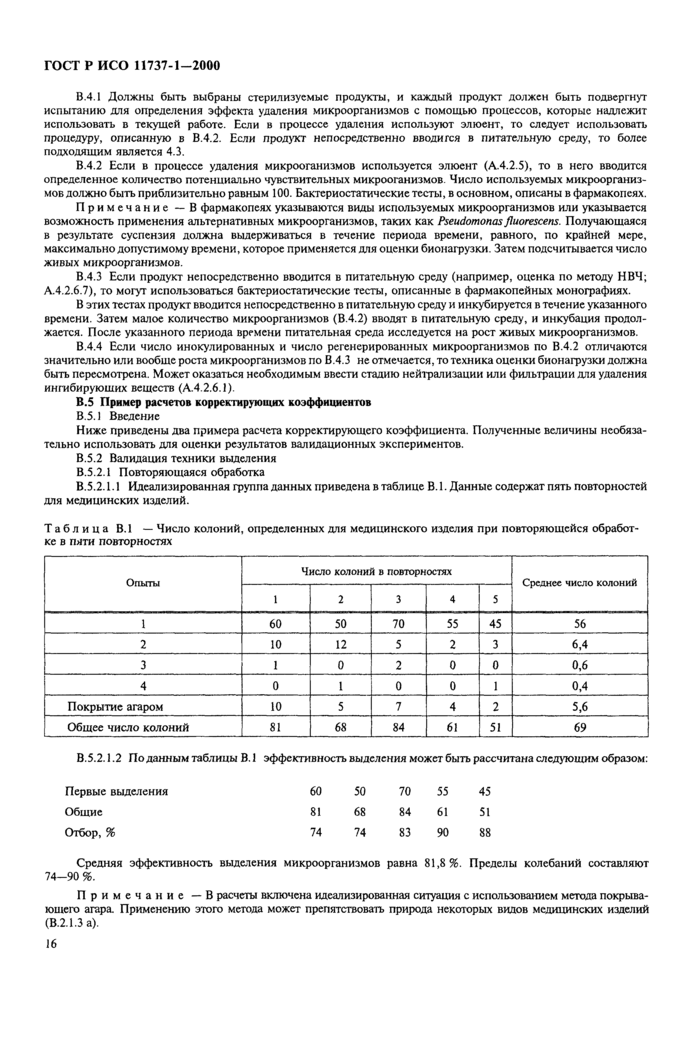
Приложение В Руководство по валидации микробиологических методов оценки
Приложение С Библиография
24 страницы
| Дата введения | 01.07.2001 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.01.2015 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел Электроэнергия
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 10.08.2000 | Утвержден | Госстандарт России | 206-ст |
|---|---|---|---|
| Разработан | Московская медицинская академия им. И.М. Сеченова | ||
| Разработан | АСИНКОМ | ||
| Разработан | Испытательный лабораторный центр Московского городского центра дезинфекции | ||
| Издан | ИПК Издательство стандартов | 2001 г. |
Sterilization of medical devices. Microbiological methods. Part 1. Estimation of population of microorganisms on products
- ГОСТ Р ИСО 9001-96 Системы качества. Модель обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании
- ГОСТ Р ИСО 9002-96 Системы качества. Модель обеспечения качества при производстве, монтаже и обслуживании
ГОСТ Р ИСО 11134-2000Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Промышленная стерилизация влажным теплом. Заменен на ГОСТ Р ИСО 17665-1-2016.- ГОСТ Р ИСО 11135-2000 Медицинские изделия. Валидация и текущий контроль стерилизации оксидом этилена
- ГОСТ Р ИСО 11138-2-2000 Стерилизация медицинской продукции. Биологические индикаторы. Часть 2. Биологические индикаторы для стерилизации оксидом этилена
- ГОСТ Р ИСО 11137-2-2008 Стерилизация медицинской продукции. Радиационная стерилизация. Часть 2. Установление стерилизующей дозы
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13
стр. 14

стр. 15
стр. 16

стр. 17

стр. 18

стр. 19
стр. 20

стр. 21

стр. 22

стр. 23

стр. 24
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Стерилизация медицинских изделий МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ
Часть 1
Оценка популяции микроорганизмов на продукции
БЗ 12-99/648
БЗ 12-99/648
Издание официальное
ГОССТАНДАРТ РОССИИ Москва
1 ПОДГОТОВЛЕН Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ), Московской медицинской академией им. И М. Сеченова и Испытательным лабораторным центром Московского городского центра дезинфекции
ВНЕСЕН Техническим комитетом по стандартизации ТК 383 «Стерилизация медицинской продукции* Госстандарта России
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 10 августа 2000 г. N? 206-ст
3 Настоящий стандарт содержит аутентичный текст международного стандарта ИСО 11737-1-95 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1: Оценка популяции микроорганизмов на продукции*
4 ВВЕДЕН ВПЕРВЫЕ
© ИПК Издательство стандартов. 2001
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта России
II
Содержание
1 Область применения....................................................... 1
2 Нормативные ссылки...................................................... 1
3 Определения............................................................. 1
4 Общие положения......................................................... 2
4.1 Документация......................................................... 2
4.2 Персонал............................................................. 3
4.3 Оборудование......................................................... 3
4.4 Питательные среды и материалы........................................... 3
5 Отбор единиц продукции................................................... 3
5.1 Отбор единицы продукции............................................... 3
5.2 Часть продукции для испытания (ЧПИ)..................................... 3
6 Выбор методов........................................................... 3
7 Валидация методов........................................................ 4
8 Использование методов оценки............................................... 4
Приложение А Методы оценки популяции микроорганизмов на продукции............... 5
Приложение В Руководство по валидации микробиологических методов оценки........... 14
Приложение С Библиография.................................................. 17
II!
Введение
Стерильный продукт — продукт, который не содержит живых микроорганизмов. Необходимо, чтобы микробиологическая контаминация медицинской продукции от всех источников была сведена до минимума всеми возможными мерами. Более того, отдельные единицы продукции, производимые при стандартных условиях производства в соответствии с требованиями систем качества для медицинской продукции, могут перед началом стерилизации содержать небольшое количество микроорганизмов. Такие единицы продукции являются нестерильными. Цель процесса стерилизации — инактивация микробиологических контаминантов (загрязнений) и, таким образом, превращение нестерильных препаратов в стерильные.
Инактивация чистых культур микроорганизмов физическими и/или химическими агентами, используемыми при стерилизации медицинской продукции, часто приближенно описывается экспоненциальным законом. Это означает, что, несмотря на усиленные методы стерилизации, всегда существует определенная вероятность того, что микроорганизм может оказаться выжившим. Вероятность выживания определяется числом, резистентностью микроорганизмов и средой, в которой они находятся в период обработки. Это означает, что стерильность любой из единиц продукции, подвергавшихся процессу стерилизации, не может быть гарантирована, и стерильность всех единиц продукции должна выражаться в понятиях вероятности наличия нестерильных единиц.
Требования к системам качества при проектировании (разработке), производстве, монтаже и обслуживании медицинских изделий даны в стандартах ИСО 9001 и ИСО 9002. Международные стандарты серии ИСО 9000 определяют некоторые производственные процессы как «специальные*, если результат не может быть полностью проверен последующим контролем и испытанием продукции. Поэтому процесс стерилизации должен быть валидирован до практического применения. Каждый процесс следует подвергать текущему контролю, а оборудование — необходимому обслуживанию.
Приняты международные стандарты, определяющие требования к валидации и текущему контролю процессов стерилизации медицинской продукции (см. ИСО 11134, ИСО 11135 и ИСО 11137). Однако важно иметь в виду, что проведение должным образом валидирован кого и точно контролируемого процесса стерилизации не является единственным фактором, связанным с обеспечением стерильности продукта и соответствия продукта своему назначению. Для эффективной валидации и текущего контроля процесса стерилизации также важно знать микробиологическую оценку данного процесса, т. е. количество, виды и свойства микроорганизмов.
Термин «бионагрузка* в общепринятом смысле употребляется для описания популяции жизнеспособных микроорганизмов, присутствующих в материале или продукте. Точное значение бионагрузки определить невозможно. На практике число жизнеспособных микроорганизмов оценивается с помощью определенных методов. Чтобы соотнести это число жизнеспособных микроорганизмов с бионагрузкой в материале или продукте, используется корректирующий коэффициент, который определяется во время валидационных экспериментов.
Величина бионагрузки может быть получена при исследовании уровней контаминации. Оценка бионагрузки является составной частью:
a) валидации и ревапидации процесса стерилизации, когда увеличение экспозиции при данных условиях стерилизации прямо отражается на оценке бионагрузки;
b) валидации и рсвалидаиии процесса стерилизации, для которого увеличение экспозиции при данных условиях стерилизации напрямую не связано с оценкой бионагрузки, но требуется общее представление о бионагрузке;
c) текущего контроля процесса производства стерильной продукции, для которого валидация установлена в соответствии с перечислением а);
d) текущего контроля процесса производства стерильной продукции, для которого валидация установлена в соответствии с перечислением Ь);
Оценка бионагрузки может также быть частью системы контроля качества производства медицинской продукции:
e) общей программы контроля производственной среды;
0 оценки эффективности процесса очистки от микроорганизмов;
g) процесса контроля нестерильных продуктов, для которых предусмотрена микробиологическая очистка;
h) контроля сырья, компонентов и упаковки.
Оценка бионагрузки для медицинских изделий состоит из четырех этапов:
- выделение микроорганизмов из медицинских изделий;
- передача этих выделенных микроорганизмов для культивирования;
- подсчет микроорганизмов с последующей характеристикой;
- учет корректирующего коэффициента (коэффициентов), рассчитанного при определении бионагрузки перед стерилизацией.
Из-за большого разнообразия материалов и конструкций различных видов медицинской продукции невозможно определить единственный метод удаления микроорганизмов для всех случаев. Более того, на выбор методов подсчета оказывает влияние вид ожидаемых контаминантов.
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Стерилизация медицинских изделий МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ Часть 1
Оценка популяции микроорганизмов на продукции
Sterilization of medical devices. Microbiological methods. Part I.
Estimation of population of microorganisms on products
Дата введения 2001—07—01
1 Область применения
1.1 Настоящий стандарт устанавливает общие критерии оценки популяции жизнеспособных микроорганизмов (бионагрузки) на медицинских изделиях или материалах, сырье или упаковках. Оценка бионагрузки состоит из подсчета и классификации популяции микроорганизмов.
Примечание — Методы оценки популяции микроорганизмов должны быть валидированы до начала их практического использования. Глубина необходимого анализа при классификации популяции зависит от цели использования полученных данных. В приложениях А и В приведены методы оценки бионагрузки и руководство по валидации микробиологических методов оценки.
1.2 Настоящий стандарт нс может быть применен при опенке или анализе вирусной контаминации или микробиологического контроля среды, в которой производятся медицинские изделия.
Примечание —Следует учитывать стандарты по системам качества (ГОСТ Р ИСО 9001 и ГОСТ Р ИСО 9002), которые предусматривают контроль всех стадий производства, включая процесс стерилизации. В настоящем стандарте нс излагается система контроля качества в производстве, но в тексте приведены ссылки на некоторые элементы такой системы.
2 Нормативные ссылки
В настоящем стандарте приведены ссылки на следующие стандарты:
ГОСТ Р ИСО 9001-96 Системы качества. Модель обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании
ГОСТ Р ИСО 9002-96 Системы качества. Модель обеспечения качества при производстве, монтаже и обслуживании
ГОСТ Р ИСО 11134-2000 Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Промышленная стерилизация влажным теплом
ГОСТ Р ИСО 11135-2000 Медицинские изделия. Валидация и текущий контроль. Стерилизация оксидом этилена
ГОСТ Р ИСО 11137-2000 Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Радиационная стерилизация
ГОСТ Р ИСО 11138-2-2000 Стерилизация медицинской продукции. Биологические индикаторы. Часть 2. Биологические индикаторы для стерилизации оксидом этилена
3 Определения
В настоящем стандарте использованы следующие термины с соответствующими определениями:
3.1 бнонагрузка (bioburden): Популяция жизнеспособных микроорганизмов в сырье, материалах, конечном продукте и/или в упаковке.
Издание официальное
3.2 оценка бионагрузки (bioburden estimate): Величина, которую оценивают по числу микроорганизмов, представляющих бионагрузку, путем подсчета жизнеспособных микроорганизмов или предстерилизационного числа, с учетом корректирующего коэффициента, учитывающего степень извлечения.
3.3 классификация (characterization): Процесс объединения микроорганизмов в широкие категории.
Примечание — Категории могут быть основаны, например, на морфологии колоний или клеток, свойствах окрашиваться красителями или других характеристиках.
3.4 корректирующий коэффициент (correction factor): Численный коэффициент, применяемый к числу жизнеспособных частиц, или предстсрилизационному числу, учитывающий неполное извлечение микроорганизмов из продукта при определении оценки бионагрузки.
3.5 условия культивирования (culture conditions): Установленное сочетание условий, включающее питательную среду, время и температуру инкубации для ускорения роста и размножения микроорганизмов.
3.6 медицинское изделие: Инструмент, аппарат, приспособление, материал, используемые отдельно или с другими изделиями, необходимым программным обеспечением, предназначенные для людей в целях:
- диагностики, профилактики, наблюдения, лечения или облегчения болезни;
- диагностики, наблюдения, лечения, облегчения или компенсации при травмах или инвалидности;
- исследования, замещения или изменения анатомии или физиологического процесса;
- контроля зачатия,
основное действие которых снаружи или внутри тела человека достигается без изменения фармакологических, иммунологических или метаболических средств, но которое может применяться совместно с ними.
3.7 иредстерилизационное число (presterilization count): Количество жизнеспособных микроорганизмов, обнаруженное перед стерилизацией.
3.8 продукция (продукт) (product): Общее понятие для обозначения сырья, промежуточных продуктов и готовых медицинских изделий.
3.9 эффективность извлечения (recovery efficiency): Мера способности конкретной методики извлекать микроорганизмы из продукта.
3.10 ревалидация (revalidation): Комплекс документированных процедур для подтверждения ранее проведенной валидации.
3.11 часть продукции для испытания — ЧПИ (sample item portion — SIP): Определенная часть единицы медицинской продукции, используемая при испытаниях.
3.12 валидация (validation): Документированная процедура получения, записи и объяснения результатов, необходимая для подтверждения того, что процесс неизменно дает продукцию, соответствующую предварительно определенным требованиям;
Примечание — Валидация методики оценки бионагрузки заключается в серии исследований для определения эффективности и воспроизводимости метода испытаний.
3.13 число живых микроорганизмов (viable count): Количество микроорганизмов, определяемое по росту дискретных колоний при установленных условиях культивирования.
Примечание — Дискретная колония необязательно происходит из одного живого микроорганизма.
4 Общие положения
4.1 Документация
4.1.1 Должны применяться методики документирования и инструкции по технике испытаний, предназначенные для работы и обслуживания соответствующего оборудования. Эти методики и инструкции после их разработки должны быть утверждены и контролироваться по ГОСТ Р ИСО 9001.
4.1.2 Следует обеспечить эффективное внедрение процедур и инструкций, предусмотренных настоящим стандартом.
4.1.3 Расчеты и данные должны быть проверены соответствующим образом.
Примечание — При расчетах с использованием электронной техники программное обеспечение
должно быть валидировано перед использованием, и протоколы этой валидации должны быть сохранены.
4.1.4 Протоколы начальных испытаний, расчеты, полученные данные и заключительные протоколы должны сохраняться, как предусмотрено в ГОСТ Р ИСО 9001. Протоколы должны включать данные о персонале, участвовавшем в отборе проб, подготовительных работах и испытании.
2
4.2 Персонал
4.2.1 Ответственность за оценку бионагрузки должна быть возложена на специальный персонал, как предусмотрено ГОСТ Р ИСО 9001.
4.2.2 Методики подготовки персонала должны быть указаны в соответствующей документации. Должны быть оформлены протоколы аттестации, обучения и оценки знаний персонала.
4.3 Оборудование
4.3.1 Должны быть подготовлены все единицы оборудования и приборов, необходимые для испытаний и выполнения измерений.
4.3.2 Оборудование, которое требует планового технического обслуживания, должно обслуживаться в соответствии с документированными инструкциями. Протоколы обслуживания должны быть сохранены.
4.3.3 Должна быть предусмотрена эффективная, документированная и обслуживаемая система для калибровки всех приборов, предназначенных для измерения и контроля. Эта система калибровки должна соответствовать ГОСТ Р ИСО 9001.
4.4 Питательные среды и материалы
Должны быть предусмотрены и документированы методы приготовления и стерилизации материалов, используемых при оценке бионагрузки, включая соответствующие тесты качества.
Примечание — Соответствующие тесты качества должны включать тесты ростовых свойств серий питательных сред (каждой серии питательной среды).
5 Отбор единиц продукции
5.1 Отбор единицы продукции
Методики отбора и обработки продукции для испытаний должны обеспечивать уверенность в том, что продукт является представительным для проведения текущего контроля.
5.2 Часть продукции для испытания (ЧПИ)
Если часть продукции, используемой при испытаниях (ЧПИ), меньше одной полной единицы продукции, предназначенной для применения, нужно обеспечить представительное число микроорганизмов, характеризующих бионагрузку всего продукта. Если установлено, что микроорганизмы распределены в продукции равномерно, то проба должна быть взята из одного любого места. При отсутствии такой уверенности проба должна быть взята из нескольких точек образцов продукции.
Примечание — Стандарты, содержащие требования к валидации и текущему контролю процесса стерилизации, должны определять критерии адекватности ЧПИ.
6 Выбор методов
6.1 Если выделение жизнеспособных микроорганизмов является частью методов анализа продукта, то факторы, влияющие на эффективность этого выделения, должны быть рассмотрены и протоколированы. К этим факторам относятся:
a) способность выделения микробной контаминации;
b) вероятный вид (виды) загрязняющих микроорганизмов и их расположение на продукте;
c) воздействие метода выделения на жизнеспособность микробной контаминации;
d) физическую или химическую природу продукта, подлежащего тестированию.
6.2 Если физическая или химическая природа испытуемой продукции (6.1 d) такова, что при этом могут выделяться вещества, оказывающие вредное влияние на число или виды определяемых микроорганизмов, должна использоваться система нейтрализации, удаления или, если такое невозможно, минимизации такого вредного влияния. Эффективность каждой системы должна быть показана.
Примечание —В приложении В приведены методы, которые могут быть использованы для опенки выделения бактерицидных или бактериостатических веществ.
6.3 Условия культивирования должны быть выбраны после рассмотрения видов ожидаемых микроорганизмов. Результаты такого анализа и основанные на нем выводы должны быть документированы.
6.4 Выбранные методы должны быть валидированы в соответствии с разделом 7.
3
7 Валидация методов
7.1 Каждая процедура валидации оценки бионагрузки должна быть документирована.
7.2 Процедуры валидации включают в себя:
a) оценку адекватности методов выделения микроорганизмов из продукции, если такое выделение является частью этих методов;
b) оценку адекватности методов определения числа выделяемых микроорганизмов, включая методы подсчета микроорганизмов и условий культивирования, и
c) определение эффективности метода отбора с учетом рассчитанного корректирующего коэффициента.
Примечание —В приложении В приведено руководство по валидации методов оценки бионагрузки
7.3 Любое изменение применяемого метода подлежит анализу, который должен включать:
a) оценку изменения;
b) определение эффективности выделения микроорганизмов рассматриваемым методом.
Примечание — Оценка изменения может означать, что предыдущая валидация и эффективность
выявления до сих пор действительны.
7.4 Валидация и любые данные последующей ревалидации должны периодически рассматриваться, объем рсвалидации должен определяться и документироваться. Процедуры рассмотрения валидации и ре валидации должны документироваться, и протоколы ревалидации должны сохраняться.
Отчет о ревалидации подписывают тс же лица (организации), которые готовили, рассматривали и принимали отчет о первичной валидации.
8 Использование методов оценки
8.1 Предстерилизационные числа должны определяться в соответствии с документированным плаиом(ами) отбора проб с определенными частотой отбора и объемом проб.
8.2 Если контаминанты, которые обычно не встречаются, выделены во время определения предстерилизационных чисел, то они должны быть охарактеризованы. Влияние таких контаминан-тов на процесс производства должно быть рассмотрено и документировано.
8.3 Допустимые пределы для каждого предстерилизационного числа или оценки бионагрузки должны устанавливаться на основе предыдущих данных и документироваться. Если эти пределы превышены, следует принимать корректирующие действия по ГОСТ Р ИСО 9001. Установленные пределы должны официально пересматриваться через определенные интервалы времени и, если необходимо, исправляться.
8.4 Статистические методы, применяемые для определения объема пробы, частота отбора проб и/или допустимые пределы должны соответствовать ГОСТ Р ИСО 9001.
8.5 Если для определения режима процесса стерилизации используют предстерилизационные числа (если только требования стандарта по валидации частного процесса стерилизации не предусматривают иного), то:
a) корректирующий коэффициент, основанный на эффективности отбора, определяют во время валидации (7.2) и используют при расчете предстерилизационного числа для оценки бионагрузки до того, как будет определен режим стерилизации;
b) резистентность микроорганизмов, составляющих популяцию присутствующих в продукте микроорганизмов, должна быть принята во внимание при определении режима обработки.
Примечание — При использовании микробиологических данных для определения стерилизующей дозы радиации (приложение В, ГОСТ Р ИСО 11137 и ИСО/ТО 13409 14)) прсдстерилизационное число может быть использовано для выбора контрольных и стерилизующих доз.
8.6 При использовании бионагрузки для определения режима процесса стерилизации:
a) должно быть рассмотрено влияние се на надежность стерильности, если принятые пределы превышены, и
b) характеристика контаминантов, которые обычно не встречаются, должна включать оценку резистентности этих контаминантов к процессу стерилизации. Для надежности стерильности должны быть оценены последствия присутствия в продукции контаминантов высокой резистентности к процессу стерилизации.
Все эти данные должны быть документированы и учтены при определении корректирующих действий. Эти корректирующие действия должны быть проведены в соответствии с ГОСТ Р ИСО 9001.
8.7 Изменения продукции и/или процессов должны быть официально рассмотрены с позиции вероятных изменений бионагрузки (см. также 8.3). Результаты рассмотрения должны быть документированы. При изменении бионагрузки должна быть проведена се специальная оценка для определения эффекта изменений.
ПРИЛОЖЕНИЕ Л (справочное)
Методы оценки популяции микроорганизмов на продукции
А.1 Введение
Эго приложение содержит руководство по реализации требований настоящего стандарта, служит для лучшего понимания этих требований, вносит ясность в важные вопросы, которым следует уделить внимание, но не является исчерпывающим.
Могут быть использованы другие методы, но эффективность их должна соответствовать требованиям настоящего стандарта.
А.2 Обские положения
Для того чтобы данные, полученные при оценке бионагрузки, были надежными и воспроизводимыми, важно, чтобы эти оценки проводились в контролируемых условиях. Лабораторные установки, используемые для получения оценок как у изготовителя медицинских изделий, так и в другом месте, должны обслуживаться и работать в соответствии с документированной системой качества.
Если бионагрузку оценивают в лаборатории под руководством изготовителя медицинских изделий, то в лаборатории должна быть введена система качества, действующая у изготовителя. Если используют внешнюю лабораторию, то рекомендуется се официально сертифицировать по соответствующему документу ИСО (например, ИСО/МЭК, Руководство 25).
Любая лаборатория должна организовать службу качества, что должно быть квалифицировано как политика качества. Полномочия и ответственность внутри лаборатории должны быть официально установлены И документированы. Определенное лицо должно быть назначено ответственным за разработку системы качества лаборатории и должно иметь достаточные полномочия для внедрения этой системы.
Работа лаборатории должна быть предметом регулярного внутреннего аудита. Результаты аудита должны документироваться и рассматриваться руководством лаборатории.
Руководство ИСО/МЭК 25 [1| дает основные принципы системы качества в лаборатории. Специфические требования к системам качества для изготовителей медицинских изделий даны в стандартах ИСО 13485 (5| и ИСО 13488 [6].
А.З Оборудование н материалы
А.3.1 Оборудование электронной обработки данных
Компьютеры могут использоваться в лабораториях для прямого и непрямого сбора, обработки и/или хранения данных. Оборудование и программное обеспечение, используемое для этих целей, должно находиться под контролем.
Используемая компьютерная система, включая оборудование и программное обеспечение, должна быть идентифицирована, и любые изменения, касающиеся их, должны быть документированы и соответствующим образом утверждены.
Для программного обеспечения необходимо иметь следующую документацию:
- прикладные программы, используемые в компьютерной системе;
- операционные программы;
- используемые массивы данных.
Все программное обеспечение должно контролироваться на предмет пригодности до начала его использования.
Если компьютерное программное обеспечение разработано на месте, должны быть предусмотрены следующие процедуры, гарантирующие:
- сохранность документации, включая систему программирования;
- сохранность протоколов контроля пригодности;
- документирование изменения программ;
- документирование изменений в оборудовании и официальную проверку перед началом использования.
Этот контроль должен также применяться к любому измененному или изготовленному на заказ пакету
программного обеспечения.
Необходимо предусмотреть процедуры определения и предотвращения несанкционированного изменения программного обеспечения.
Программное обеспечение, которое организует, классифицирует и представляет данные для статистических или других математических процедур, обрабатывает или анализирует электронные сохраняемые данные, должно позволять восстанавливать исходные входные данные. Могут потребоваться специальные процедуры архивирования компьютерных данных, и эти процедуры должны быть документированы.
5
А.3.2 Лабораторное оборудование
Должна быть предусмотрена система определения требований технического обслуживания для каждой части лабораторного оборудования.
Оборудование, не требующее калибровки, должно быть четко указано.
Любое оборудование или его части, контактирующие с продуктом во время испытаний, элюент (смывная жидкость), питательные среды и т.д. должны быть стерильными.
А.3.3 Микробиологические питательные среды
При приготовлении всех микробиологических сред и элюентов, используемых для удаления микроорганизмов из продукта, должна быть обеспечена их стерильность.
Должна быть показана способность микробиологической среды поддерживать рост микроорганизмов. Обычно это достигается применением теста роста для каждой серин питательной среды с использованием малого количества (между 10 и 100 колониеобразующих единиц) выбранных микроорганизмов. Тесты поддержки ростовых свойств обычно приведены в фармако леях, указывающих, какие микроорганизмы могут считаться подходящими
А.4 Выбор методов
А.4.1 Общие положения
ВЫБОР ПРОБЫ
I
jb’lB ИСПЫТАНИЙ
СБОР ОБРАЗЦОВ
ПЕРЕДАЧА ДЛЯ ИСПЫТАНИЙ В ЛАБОРАТОРИЮ
J
ОБРАБОТКА (если необходимо)
I
ПОСЕВ В ПИТАТЕЛЬНУЮ СРЕДУ
I
ИНКУБИРОВАНИЕ
I
ПОДСЧЕТ И ХАРАКТЕРИСТИКА (сети планируется)
ИНТЕРПРЕТАЦИЯ ДАННЫХ
Последовательность основных этапов методов оценки микробиологической контаминации следующая:
Лицо, ответственное за проведение такой процедуры, должно иметь необходимые знания о сырье, материалах, производственной среде, процессе производства и свойствах продукции, чтобы выбрать соответствующие методы оценки для каждого из этих этапов.
Ответственное лицо должно принимать в расчет особенность ситуации, решая вопросы периодичности отбора проб, выбора вида питательной среды и условий культивирования, а также длительность проведения расчета и валидации Документирование этих факторов и обоснований для принятия решений способствует последовательному рассмотрению методик.
Если оцененная бионагрузка предназначена для непосредственного определения условий стерилизации, то в программу оценки бионагрузки необходимо включить упаковочные материалы.
В идеале бионагрузка должна систематически оцениваться для каждого вида продукции. Однако учитывая разнообразие производимой продукции (часто в малых сериях), это нс всегда бывает оправданным. В этих обстоятельствах виды продукции могут быть сгруппированы на основе типовой продукции, эквивалентной производственной среды и используемого сырья. Разумное отнесение продукции к таким группам должно быть документировано и должно обеспечивать репрезентативность данных, обосновывающих группировку продукции.
А.4.2 Элементы оценки бионагрузки
А.4.2.1 Общие положения
Методы отбора и обработки проб должны быть такими, чтобы исключить непредвиденную контаминацию и значительное изменение количества и вида микроорганизмов в пробе. Система отбора проб должна позволять проводить последовательное сравнение периодов времени отбора проб.