ГОСТ Р ИСО 10993.9-99
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деструкции
Устанавливает основные принципы систематизированной оценки возможной или наблюдаемой биодеградации медицинских изделий, а также принципы составления плана и проведения исследований биодеградации.
Стандарт, за исключением приложений В и Г, представляет собой аутентичный текст международного стандарта ИСО 10993.9-99 "Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деструкции".
Оглавление
1 Область применения
2 Нормативные ссылки
3 Определения
4 Принципы планирования исследования деструкции
4.1 Общие положения
4.2 Предварительное рассмотрение
4.3 Планирование исследования
4.4 Характеристика продуктов деструкции медицинских изделий
5 Отчет об исследовании
Приложение А Обоснование необходимости проведения исследования деструкции
Приложение Б Дополнительная информация к плану изучения деструкции
Приложение В Некоторые методы определения концентрации металлов и других элементов в медико-биологических пробах
Приложение Г Библиография
12 страниц
| Дата введения | 01.01.2002 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.09.2010 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 29.12.1999 | Утвержден | Госстандарт России | 862-ст |
|---|---|---|---|
| Разработан | ВНИИИМТ | ||
| Издан | ИПК Издательство стандартов | 2000 г. |
Medical devices. Biological evaluation of medical devices. Part 9. Framework for identification and quantification of potential degradation products
- ГОСТ Р 50855-96 Контейнеры для крови и ее компонентов. Требования химической и биологической безопасности и методы испытаний
- ГОСТ Р 51148-98 Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогенность
ГОСТ Р ИСО 10993.13-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественное определение продуктов деструкции полимерных медицинских изделий. Заменен на ГОСТ Р ИСО 10993-13-2009.ГОСТ Р ИСО 10993.1-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования. Заменен на ГОСТ Р ИСО 10993-1-2009.
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9
стр. 10
стр. 11

стр. 12
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 9
Основные принципы идентификации и количественного определения потенциальных продуктов деструкции
БЗ 1-2000/801
Издание официальное
ГОССТАНДАРТ РОССИИ Москва
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники (ВНИИИМТ)
ВНЕСЕН Техническим комитетом по стандартизации ТК 422 «Оценка биологического действия медицинских изделий»
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. № 862-ст
3 Настоящий стандарт, за исключением приложений В и Г, представляет собой аутентичный текст международного стандарта ИСО 10993.9—99 «Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деструкции»
4 ВВЕДЕН ВПЕРВЫЕ
© ИПК Издательство стандартов, 2000
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта России
II
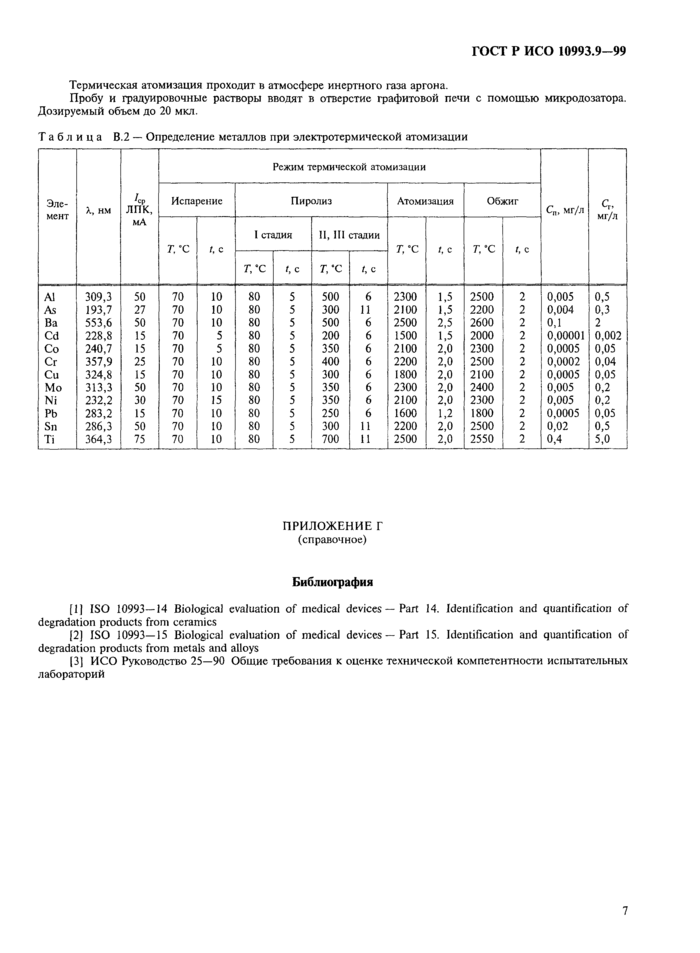
Термическая атомизация проходит в атмосфере инертного газа аргона.
|
Таблица В.2 — Определение металлов при электротермической атомизации | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Пробу и градуировочные растворы вводят в отверстие графитовой печи с помощью микродозатора. Дозируемый объем до 20 мкл.
ПРИЛОЖЕНИЕ Г (справочное)
Библиография
devices — Part 14. Identification and quantification of devices — Part 15. Identification and quantification of оценке технической компетентности испытательных
[1] ISO 10993—14 Biological evaluation of medical degradation products from ceramics
[2] ISO 10993—15 Biological evaluation of medical degradation products from metals and alloys
[3] ИСО Руководство 25—90 Общие требования к лабораторий
7
УДК 615.46:002:006.354 ОКС 01.140.20 Р20 ОКСТУ 9403
Ключевые слова: медицинское оборудование, хирургическое оборудование, хирургические инструменты, хирургические имплантаты, зубоврачебное оборудование, зубоврачебные инструменты, зубоврачебные материалы, исследования, биологические исследования, биодеградация
Редактор В.П Огурцов Технический редактор В.Н. Прусакова Корректор Р.Л. Ментова Компьютерная верстка Е.Н. Мартемьяновой
Изд. лиц. № 02354 от 14.07.2000. Сдано в набор 14.07.2000. Подписано в печать 28.09.2000. Уел. печ. л. 1,40.
Уч.-изд. л. 0,97. Тираж 171 экз. С 5928. Зак. 842.
ИПК Издательство стандартов, 107076, Москва, Колодезный пер., 14.
Набрано в Издательстве на ПЭВМ Филиал ИПК Издательство стандартов — тип. “Московский печатник”, 103062, Москва, Лялин пер., 6.
Плр № 080102
ГОСТ Р ИСО 10993.9-99
Содержание
1 Область применения....................................................... 1
2 Нормативные ссылки...................................................... 1
3 Определения............................................................. 1
4 Принципы планирования исследования деструкции............................... 2
4.1 Общие положения..................................................... 2
4.2 Предварительное рассмотрение....................................... 2
4.3 Планирование исследования............................................. 2
4.4 Характеристика продуктов деструкции медицинских изделий.................... 3
5 Отчет об исследовании..................................................... 3
Приложение А Обоснование необходимости проведения исследования деструкции........ 4
Приложение Б Дополнительная информация к плану изучения деструкции.............. 4
Приложение В Некоторые методы определения концентрации металлов и других элементов в
медико-биологических пробах..................................... 5
Приложение Г Библиография.................. 7
111
Введение
Соблюдение положений стандартов серии ГОСТ Р ИСО 10993 «Оценка биологического действия медицинских изделий» позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление конкретных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие специальную подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты этой серии являются руководящими документами для прогнозирования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых образцов.
В серию ГОСТ Р ИСО 10993, имеющую групповой заголовок «Изделия медицинские. Оценка биологического действия медицинских изделий», входят следующие части:
- часть 1 — оценка и исследования;
- часть 3 — исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
- часть 4 — исследование изделий, взаимодействующих с кровью;
- часть 5 — исследование на цитотоксичность: методы in vitro;
- часть 6 — исследование местного действия после имплантации;
- часть 7 — остаточное содержание этиленоксида после стерилизации;
- часть 9 — основные принципы идентификации и количественного определения потенциальных продуктов деструкции;
- часть 10 — исследование раздражающего и сенсибилизирующего действия;
- часть 11 — исследование общетоксического действия;
- часть 12 — приготовление проб и стандартные образцы;
- часть 13 — идентификация и количественное определение продуктов деструкции полимерных медицинских изделий;
- часть 16 — моделирование и исследование токсикокинетики продуктов деструкции и вымывания.
Настоящий стандарт устанавливает принципы идентификации и количественного определения продуктов деструкции материалов, из которых изготовлены медицинские изделия (полимеры, керамика, металлы и сплавы).
Полученную в ходе этих исследований информацию используют для оценки биологического действия материалов и изделий.
Стандарт определяет необходимость проведения и объем исследований по идентификации и количественному определению продуктов деструкции в зависимости от ряда условий.
Методы исследования, изложенные в стандарте, взяты из международных, национальных стандартов, директив и нормативов.
Допускается применение других методов, обеспечивающих оценку биологического действия медицинских изделий в соответствии с требованиями международных стандартов.
В приложении В изложены методики определения концентрации металлов и других элементов в медико-биологических пробах, применяемые в России при оценке биологического действия медицинских изделий.
К образцам изделий, представляемым на испытания, предъявляют требования в соответствии с ГОСТ Р 51148.
Приложение А является неотъемлемой частью настоящего стандарта. Приложения Б, В и Г носят справочный характер.
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МБДИЦИНСКИХ ИЗДЕЛИЙ
Часть 9
Основные принципы идентификации и количественного определения потенциальных
продуктов деструкции
Medical devices. Biological evaluation of medical devices.
Part 9. Framework for identification and quantification of potential degradation products
Дата введения 2002—01—01
1 Область применения
Настоящий стандарт устанавливает основные принципы систематизированной оценки возможной или наблюдаемой биодеградации медицинских изделий (далее — изделий), а также принципы составления плана и проведения исследований биодеградации.
Требования настоящего стандарта являются рекомендуемыми.
Стандарт не распространяется на:
- продукты биоинженерии на основе живой ткани;
- изучение возникновения продуктов деструкции в результате механических процессов. Методики получения продуктов деструкции этого типа изложены в стандартах на конкретные материалы;
- продукты миграции, которые не являются продуктами деструкции.
В случаях, если стандарты на изделия конкретных видов содержат приемлемые методы идентификации и количественного определения продуктов деструкции, их можно рассматривать как альтернативу.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты, содержащие положения, которые могут рассматриваться как разделы настоящего стандарта:
ГОСТ Р ИСО 10993.1-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ГОСТ Р ИСО 10993.13-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественное определение продуктов деструкции полимерных медицинских изделий
ГОСТ Р 50855-96 Контейнеры для крови и ее компонентов. Требования химической и биологической безопасности и методы испытаний
ГОСТ Р 51148-98 Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогенность
3 Определения
В настоящем стандарте используют термины, приведенные в ГОСТ Р ИСО 10993.1, а также следующие определения:
3.1 деструкция: Разрушение материала.
Издание официальное
3.2 биодеградация: Разрушение материала в результате воздействия биологической среды.
Примечание — Биодеградацию можно смоделировать в экспериментах in vitro.
3.3 изделие, рассасывающееся в физиологической среде: Медицинское изделие, разрушающееся или рассасывающееся в биологической среде организма.
3.4 продукт вымывания: Экстрагируемый компонент материала, не являющийся продуктом химической деструкции.
3.5 коррозия: Действие химических и электрохимических реакций на металлы и сплавы.
Примечание — Иногда термин «коррозия» используют шире для обозначения ухудшения качества других материалов. В настоящем стандарте он относится к металлам и сплавам.
3.6 вещество: Индивидуальный химический элемент, соединение или комплекс соединений.
3.7 фрагмент изделия: Одна из частей изделия.
3.8 продукт деструкции: Любая частица или химическое соединение, образовавшиеся при химическом разрушении исходного материала.
4 Принципы планирования исследования деструкции4.1 Общие положения
Подход к оценке деструкции зависит от природы исследуемого материала, медицинского изделия, условий применения и локализации конкретного изделия в организме. Когда исследуют конкретное медицинское изделие и есть подробная информация о химическом составе среды, в которой изделие будет применяться, исследование проводят в условиях, моделирующих параметры данной среды.
По возможности при планировании исследований деструкции используют стандарты для идентификации и количественного определения продуктов деструкции определенных групп материалов, например ГОСТ Р ИСО 10993.13 для полимеров, ИСО 10993.14 [1]—для керамики и ИСО 10993.15 [2] — для металлов и сплавов. При исследовании изделий, состоящих более чем из двух различных материалов, учитывают все соответствующие стандарты по деструкции.
4.2 Предварительное рассмотрение
Неотъемлемой частью оценки биологической безопасности изделия является тщательное прогнозирование способности материала к деструкции, включая ожидаемую и непредвиденную деструкцию.
Начальным этапом прогнозирования является оценка химических характеристик и известных механизмов деструкции. Затем оценивают необходимость экспериментального исследования биодеградации и составляют его план. На основе обзора литературы и ознакомления с предыдущим опытом клинического применения аналогичных материалов может возникнуть необходимость дальнейшей биологической оценки продуктов деструкции. Нет необходимости, а также не всегда имеется возможность проводить изучение деструкции для всех изделий. Обоснования необходимости изучения деструкции представлены в приложении А. Оценка необходимости проведения экспериментальных исследований деструкции должна включать обзор литературы и (или) ознакомление с данными об опыте клинического применения. Такая оценка может привести к заключению, что нет необходимости проведения экспериментальных исследований, когда изучаемое изделие успешно применяется в медицинской практике, а также имеются новые и опубликованные данные и аналогии с известными изделиями, материалами и продуктами деструкции.
Руководство по оценке биологического действия продуктов деструкции полимерных изделий (материалов) представлено в ГОСТ Р ИСО 10993.13.
4.3 Планирование исследования
План исследования должен быть составлен и оформлен в соответствии с положениями 4.1. В плане указывают методы анализа, с помощью которых изучают следующие характеристики продуктов деструкции:
- химические и физико-химические свойства;
- морфологию поверхности;
- биохимические свойства.
В плане также излагают методы, используемые для получения продуктов деструкции. В плане
ГОСТ Р ИСО 10993.9-99
исследования изделий, состоящих из многих фрагментов, учитывают каждый фрагмент или материал, а также синергическое влияние различных фрагментов на деструкцию.
4.4 Характеристика продуктов деструкции медицинских изделий
Продукты деструкции, полученные в ходе исследования, могут представлять собой частицы, растворимые соединения или ионы. Для определения характеристик продуктов деструкции используют соответствующие аналитические методы. Эти методы должны быть обоснованы и приведены в отчете об исследовании.
При составлении плана изучения деструкции следует учесть влияние процесса деструкции на биологические исследования.
Подходы к изучению биодеградации представлены в приложении Б.
План должен включать в себя следующее:
- идентификацию и характеристику изделия и (или) материала и предполагаемое применение;
- идентификацию и характеристику возможного механизма деструкции;
- идентификацию и характеристику известных, вероятных и потенциальных продуктов деструкции;
- методы исследования.
Примечания
1 Степень и скорость миграции продуктов деструкции зависят от таких факторов, как процессы производства, которые изменяют состав и структуру поверхности, миграция на поверхность из материала, химический состав физиологической среды и растворимость в ней и т.д.
2 Исследование может привести к заключению, что получено достаточное количество данных и нет необходимости в дальнейшем изучении.
5 Отчет об исследовании
В отчет об исследовании включают следующую информацию:
- описание материала и (или) изделия в соответствии с Б.2, включая предполагаемое применение и вид контакта с организмом;
- оценку деструкции и выводы по результатам оценки;
- идентификацию и количественное определение продуктов деструкции (например, форма и состояние продуктов деструкции, их стабильность и использованный контроль);
- описание методов изучения деструкции, условия исследования, тест-материалы и методики исследования, включая виды контроля;
- описание методов анализа, включая пределы обнаружения и виды контроля;
- документ о соответствии испытательной лаборатории системе управления качеством испытательных лабораторий и (или) Руководство ИСО 25 [3];
- краткое изложение результатов;
- интерпретация и обсуждение результатов.
3
ПРИЛОЖЕНИЕ А
(обязательное)
Обоснование необходимости проведения исследования деструкции
Необходимость проведения исследований деструкции рассматривают, если:
- изделие является рассасывающимся в биологической среде;
- изделие предназначено для имплантации на срок, превышающий 30 сут;
- есть информация о вероятной миграции токсичных веществ при контакте данного материала с организмом.
Изучение деструкции необязательно, если:
- количество возможных продуктов деструкции предсказуемо, и скорость образования продуктов деструкции подобна той, которая известна из медицинской практики как безопасная;
- если размер и форма частиц подобны тем, безопасность которых доказана опытом применения в медицинской практике;
- если уже существуют данные о деструкции, в том числе о веществах и продуктах деструкции при предполагаемом применении.
Необходимость исследований in vivo рассматривают на основе результатов исследований in vitro.
По возможности при изучении теоретически предсказуемых процессов деструкции учитывают эксперименты in vitro. Выполняя исследования in vivo, необходимо помнить о требованиях к защите животных. Для определения вероятности деструкции и идентификации предполагаемых продуктов деструкции и ее скорости обосновывают необходимость проведения исследований in vivo и in vitro.
ПРИЛОЖЕНИЕ Б (справочное)
Дополнительная информация к плану изучения деструкции
Б. 1 Общие положения
Настоящее приложение содержит положения, которые учитывают при оценке вероятной деструкции.
В случае отсутствия общей информации о деструкции изделий и материалов, а также о биологическом действии возможных продуктов деструкции проводят соответствующие экспериментальные исследования.
Б.2 Описание медицинского изделия и (или) материала включает:
- наименование медицинского изделия и (или) материала;
- назначение медицинского изделия;
- предполагаемое применение;
- предполагаемую биологическую среду;
- состав материала;
- подготовку материала (обработка, стерилизация);
- состояние поверхности;
- размеры;
- отдельный фрагмент;
- отдельный фрагмент, используемый в комбинации с другими;
- изделие, состоящее из нескольких фрагментов, — оценка каждого материала, входящего в состав;
- продолжительность контакта;
- другие характеристики.
Б.З Оценка возможных и известных продуктов деструкции
Б.3.1 Изменение основной массы материала
Ожидаемые и непредвиденные изменения основной массы материала могут приводить к образованию продуктов деструкции в виде частиц, а также повлиять на стабильность поверхности. Изменения основной массы материала могут происходить, например:
- в процессе изготовления;
- во время стерилизации;
- при проведении имплантации и во время пребывания имплантата в организме;
- в результате биоресорбции;
ГОСТ Р ИСО 10993.9-99
- при хранении и в связи с нестабильностью;
- при изменении физического состояния (набухание, фазовый переход и т.д.).
Б.3.2 Выход веществ с поверхности
Выход веществ с поверхности может происходить в следующих случаях:
- химические реакции;
- вымывание;
- миграция;
- деполимеризация;
- отслаивание, отшелушивание.
Б.3.3 Изделие, состоящее из нескольких компонентов или используемое вместе с другими изделиями
В дополнение к перечисленному необходимо рассмотреть следующие явления:
- разрушение структур;
- расслаивание;
- миграция веществ из одного фрагмента в другой.
ПРИЛОЖЕНИЕ В (справочное)
Некоторые методы определения концентрации металлов и других элементов в медико-биологических пробах
В.1 Количественный безэталонный элементный анализ вещества методом лазерной масс-спектрометрии
ВЛ.1 Принцип определения основан на анализе состава ионов, получаемых при взаимодействии лазерного излучения с исследуемым образцом. Излучение лазера в месте взаимодействия с поверхностью пробы вызывает испарение и ионизацию вещества. Ионы разделяются электростатическим и магнитным полем по отношению массы иона к заряду т/е и регистрируются фотодетектором.
При определенной плотности потока лазерного излучения достигается соответствие состава регистрируемого массового спектра составу анализируемого образца, вследствие этого интерпретация результатов анализа осуществляется без использования стандартных и контрольных образцов.
В. 1.2 Количественный безэталонный анализ содержания элементов в твердом веществе любой природы.
Характеристика метода:
- для проведения анализа необязательно иметь предварительную информацию о составе образца;
- простая пробоподготовка;
- медико-биологические пробы исследуют в своем естественном виде, без освобождения от органических веществ;
- полнота анализа, т.е. одновременное определение всех элементов Периодической системы Д.И. Менделеева;
- универсальность (возможность анализа объектов с целью определения различных примесей);
- одновременная регистрация всех элементов;
- широкий динамический диапазон, т.е. возможность определения основных, примесных и следовых составляющих;
- низкие пределы обнаружения — относительные (10"5 — 10~7) масс.% без использования концентрирования) и абсолютные (Ю“10 — 10~20) г, что позволяет расходовать предельно малые количества пробы, т.е. проводить практически неразрушающий анализ;
- возможность локального и послойного анализа с высоким разрешением по поверхности (<0,1 мкм) и глубине (3 нм).
В. 1.3 Анализ проводят на лазерном энергомасс-анализаторе с разрешающей способностью до 5000. Регистрация масс-спектров происходит на фотопластинке. Время, затрачиваемое на анализ, зависит от требуемой чувствительности (100 — 10~7) % и может изменяться от 15 мин до 2 ч. Масса пробы, необходимая для обеспечения максимальной чувствительности анализа, — 6 мг.
Относительная систематическая погрешность 50ТН:
$отн = 30 % в диапазоне малых концентраций (1-10—7 — Ы0~2) масс.%.
§отн = 20 % в диапазоне средних концентраций (110“2 — 1) масс.%.
§отн “ Ю % в диапазоне определения основы (1 — 100) масс.%.
Процедура выполнения методики изложена в документе МР № 3873—85, утвержденном Минздравом СССР 06.05.85.
5
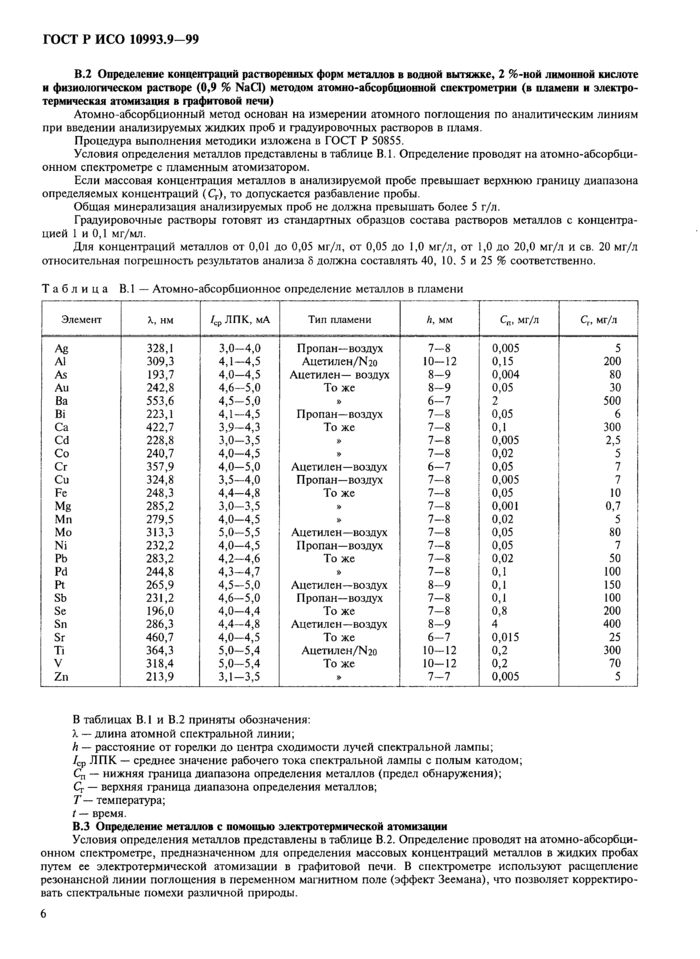
В.2 Определение концентраций растворенных форм металлов в водной вытяжке, 2 %-ной лимонной кислоте и физиологическом растворе (0,9 % NaCI) методом атомно-абсорбционной спектрометрии (в пламени и электротермическая атомизация в графитовой печи)
Атомно-абсорбционный метод основан на измерении атомного поглощения по аналитическим линиям при введении анализируемых жидких проб и градуировочных растворов в пламя.
Процедура выполнения методики изложена в ГОСТ Р 50855.
Условия определения металлов представлены в таблице В.1. Определение проводят на атомно-абсорбционном спектрометре с пламенным атомизатором.
Если массовая концентрация металлов в анализируемой пробе превышает верхнюю границу диапазона определяемых концентраций (Сг), то допускается разбавление пробы.
Общая минерализация анализируемых проб не должна превышать более 5 г/л.
Градуировочные растворы готовят из стандартных образцов состава растворов металлов с концентрацией 1 и 0,1 мг/мл.
Для концентраций металлов от 0,01 до 0,05 мг/л, от 0,05 до 1,0 мг/л, от 1,0 до 20,0 мг/л и св, 20 мг/л относительная погрешность результатов анализа 5 должна составлять 40, 10, 5 и 25 % соответственно.
|
Таблица В.1 — Атомно-абсорбционное определение металлов в пламени | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В таблицах В.1 и В.2 приняты обозначения:
X — длина атомной спектральной линии;
h — расстояние от горелки до центра сходимости лучей спектральной лампы;
/ср Л ПК — среднее значение рабочего тока спектральной лампы с полым катодом;
Qj — нижняя граница диапазона определения металлов (предел обнаружения);
Q — верхняя граница диапазона определения металлов;
Т — температура;
t — время.
В.З Определение металлов с помощью электротермической атомизации
Условия определения металлов представлены в таблице В.2. Определение проводят на атомно-абсорбционном спектрометре, предназначенном для определения массовых концентраций металлов в жидких пробах путем ее электротермической атомизации в графитовой печи. В спектрометре используют расщепление резонансной линии поглощения в переменном магнитном поле (эффект Зеемана), что позволяет корректировать спектральные помехи различной природы.
6