ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
11137-2—2008
СТЕРИЛИЗАЦИЯ МЕДИЦИНСКОЙ ПРОДУКЦИИ РАДИАЦИОННАЯ СТЕРИЛИЗАЦИЯ
Часть 2
Установление стерилизующей дозы
ISO 11137-2:2006
Sterilization of health care products — Radiation —
Establishing the sterilization dose
ш.
Москва
Стандартинформ
2010
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р1.0 —2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Фармстер» (ООО «Фармстер») на основе аутентичного перевода стандарта ВНИИКИ, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 383 «Стерилизация медицинской продукции»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 18 декабря 2008 г. № 574-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 11137-2:2006 «Стерилизация медицинской продукции. Радиационная стерилизация. Часть 2. Установление стерилизующей дозы» (ISO 11137-2:2006 «Sterilization of health care products — Radiation — Part 2: Establishing the sterilization dose»).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении А
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты». а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация. уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
©Стандартинформ, 2010
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
ГОСТ Р ИС011137-2— 2008
Содержание
1 Область применения....................................... 1
2 Нормативные ссылки ..................................... 1
3 Термины, определения и обозначения............................. 1
3.1 Термины и определения.................................. 1
3.2 Обозначения ...................................... 2
4 Определение и техническое обслуживание серии продукции для установления, обоснования и
проверки стерилизующей дозы ................................ 3
4.1 Общие вопросы ..................................... 3
4.2 Определение серийности продукции........................... 3
4.3 Обозначение продукта, представляющего серию продукции для проведения эксперимента с проверочной дозой или проверки стерилизующей дозы ............... 4
4.4 Техническое обслуживание серии продукции ....................... 5
4.5 Действия в случае обнаружения несоответствия стерилизующей дозы для серии продукции ............................................ 5
5 Выбор и испытание продукции для установления и проверки стерилизующей дозы....... 5
5.1 Характеристика продукции ................................ 5
5.2 Часть продукции для испытания (ЧПИ)........................... 6
5.3 Метод отбора образцов .................................. 7
5.4 Микробиологические испытания ............................. 7
5.5 Облучение ........................................ 7
6 Методы установления дозы................................... 7
7 Метод 1: установление дозы с использованием информации о бионагрузке.......... 8
7.1 Обоснование ....................................... 8
7.2 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой
£ 1.0 для нескольких партий продукции.......................... 9
7.3 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой
£1.0 для единичной партии продукции .......................... 13
7.4 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой в
интервале от 0.1 до 0.9 для нескольких или единичной партии продукции.......... 14
8 Метод 2: установление дозы с использованием информации о доле положительных результатов
из возрастающего дозирования для определения коэффициента экстраполяции......... 15
8.1 Обоснование....................................... 15
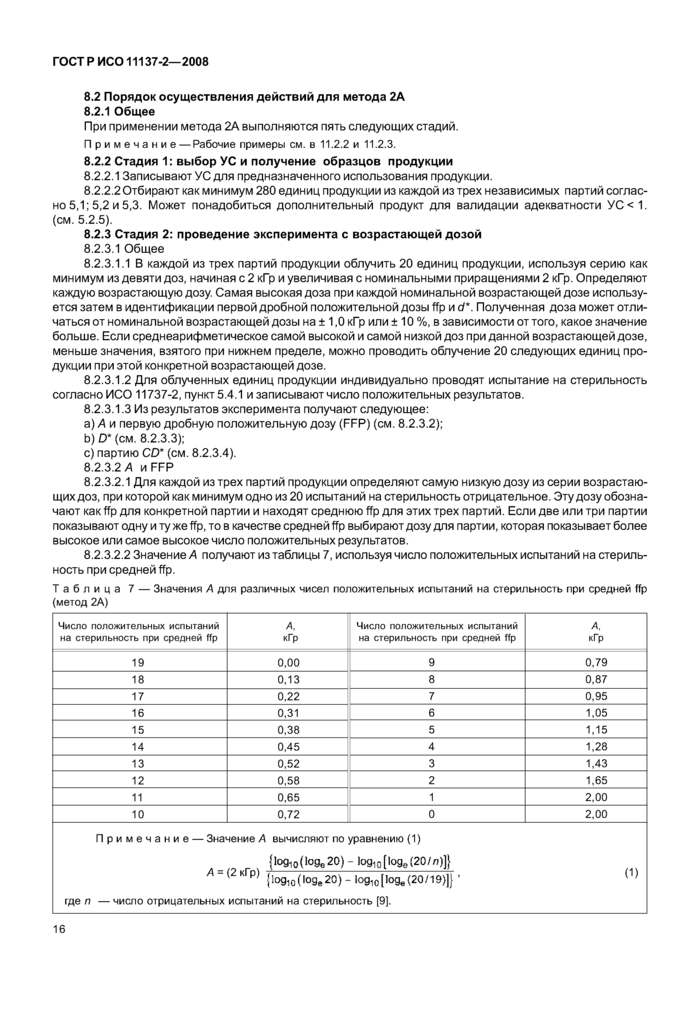
8.2 Порядок осуществления действий для метода 2А..................... 16
8.3 Порядок осуществления действий для метода 2В..................... 18
9 Метод VDmм: обоснование значений 25 кГр или 15 кГр как стерилизующей дозы......... 20
9.1 Обоснование........................................ 20
9.2 Процедура для метода s для нескольких партий продукции............. 21
9.3 Процедура для метода для единичной партии продукции............. 24
9.4 Процедура для метода VD^is для нескольких партий продукции............. 25
9.5 Процедура для метода для единичной партии продукции............. 27
10 Проведение проверки стерилизующей дозы.......................... 28
10.1 Цель и частота...................................... 28
10.2 Процедура для проведения проверки стерилизующей дозы, установленной с использованием метода 1 или 2................................... 28
10.3 Процедура проверки стерилизующей дозы, обоснованной с использованием метода VD^ 30
11 Рабочие примеры........................................ 33
11.1 Рабочие примеры для метода 1.............................. 33
11.2 Рабочие примеры для метода 2.............................. 36
11.3 Рабочие примеры для метода VDmax .......................... 44
11.4 Рабочий пример проверки стерилизующей дозы для установления дозы с использова
нием метода 1. заключением которого явилось требование увеличения стерилизующей дозы........................................... 46
III
11.5 Рабочий пример проверки стерилизующей дозы для установления дозы с использованием
метода 2А, заключением которого явилось требование увеличения стерилизующей дозы 47
11.6 Рабочий пример проверки стерилизующей дозы для обоснования стерилизующей дозы с
использованием метода VD^25.............................. 48
Приложение А (справочное) Сведения о соответствии национальных стандартов Российской
Федерации ссылочным международным стандартам................. 50
Библиография............................................ 51
IV
ГОСТ Р ИС011137-2— 2008
Введение
Серия стандартов ИСО 11137 под общим названием «Стерилизация медицинской продукции. Радиационная стерилизация» состоит из следующих стандартов:
- Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий;
- Часть 2. Установление стерилизующей дозы;
- Часть 3. Руководство по вопросам дозиметрии.
Настоящее первое издание указанной серии стандартов отменяет действие стандарта ИСО 11137—2000 и заменяет его.
V
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СТЕРИЛИЗАЦИЯ МЕДИЦИНСКОЙ ПРОДУКЦИИ РАДИАЦИОННАЯ СТЕРИЛИЗАЦИЯ
Часть 2
Установление стерилизующей дозы
Sterilization of health care products. Radiation. Part 2. Establishing the sterilization dose
Дата введения — 2010—01—01
1 Область применения
Настоящий стандарт устанавливает методы определения дозы, необходимой для удовлетворения установленного требования к стерильности, и методы для обоснования значений 25 или 15 кГр как стерилизующей дозы для достижения уровня обеспечения стерильности (УС) 10-6. Настоящий стандарт устанавливает методы проведения проверки дозы, для того чтобы продемонстрировать непрерывную эффективность стерилизующей дозы.
В настоящем стандарте определяются серии продукции/продуктов для установления дозы и проверки дозы.
2 Нормативные ссылки
Следующие ссылочные нормативные документы являются обязательными при применении данного документа. Для датированных ссылок применяется только цитированное издание документа. Для недатированных ссылок необходимо использовать самое последнее издание нормативного ссылочного документа (включая любые изменения).
ИСО 11137-1:2006 Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
ИС011737-1 Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции
ИС011737-2 Стерилизация медицинских изделий. Микробиологические методы. Часть 2. Испытания на стерильность, проводимые при валидации процессов стерилизации
ИСО 13485 Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования
3 Термины, определения и обозначения
3.1 Термины и определения
В настоящем стандарте применены термины по ИСО 11137-1, а также следующие термины с соответствующими определениями:
3.1.1 партия (batch): Определенное количество изделий, являющихся или предполагаемых единообразными по характеру и качеству, которые были изготовлены в определенном цикле производства.
[ИСО/ТС 11139:2006].
3.1.2 бионагрузка (bioburden): Популяция жизнеспособных организмов на/в продукции и/или системе защиты стерильности.
(ИСО/ТС 11139:2006].
Издание официальное
3.1.3 ложноположительный результат (false positive): Результат испытания, интерпретируемый как появление роста числа микроорганизмов, принадлежащих испытуемой продукции или ее части, в то время как этот рост обусловлен внешним микробным загрязнением или помутнением, вызванным взаимодействием между продукцией или ее частями и испытательной средой.
3.1.4 доля положительных результатов (fraction positive): Коэффициент, в котором числитель показывает число положительных испытаний, а знаменатель число проведенных испытаний.
3.1.5 возрастающая доза (incremental dose): Возрастающий ряд значений дозы, при которых облучается определенное количество продукции или ее частей, при определении и подтверждении стерилизующей дозы по методу 2В.
3.1.6 отрицательный результат испытания на стерильность (отрицательный тест) (negative test of sterility): Результат испытания, который не показывает никакого микробного роста в продукции или ее части, подвергнутых тесту на стерильность.
3.1.7 упаковочный комплект (packaging system): Комбинация системы защиты стерильности и защитной упаковки.
(ИСО/ТС 11139:2006).
3.1.8 положительный результат испытания на стерильность (положительный тест) (positive test of sterility): Результат испытания, который показывает микробный рост из продукции или ее части, подвергнутых тесту на стерильность.
3.1.9 часть продукции для испытания (ЧПИ) [sample item portion (SIP)): Определенная часть медицинской продукции, которая испытывается.
3.1.10 система защиты стерильности (sterile barrier system): Минимальная упаковка, которая предотвращает проникновение микроорганизмов и обеспечивает асептическое представление продукции в месте использования.
3.1.11 уровень обеспечения стерильности (УС) [sterility assurance level (SAL)): Вероятность возникновения жизнеспособного микроорганизма на единице продукции после стерилизации.
[ИСО/ТС 11139:2006).
Примечание — Данный термин имеет количественное значение, обычно 10~® или 10"3. При применении этого количественного значения к обеспечению стерильности, УС = 10"6 имеет более низкое значение, но дает более высокий уровень обеспечения стерильности, чем УС = 10"3.
3.1.12 проверка стерилизующей дозы (sterilization dose audit): Процедура, предпринятая для подтверждения соответствия установленной стерилизующей дозы.
3.1.13 верификационная доза (venfication dose): Значение дозы обеспечивающее УС = 10“2 для единицы продукции, используемое при определении стерилизующей дозы.
3.2 Обозначения
В настоящем стандарте применены следующие обозначения:
3.2.1 А — доза для корректировки средней дозы ffp путем ее уменьшения до дозы FFP.
3.2.2 СО* — число испытаний на стерильность с положительным результатом, полученное на основе испытаний, проведенных индивидуально на 100 единицах продукции, облученных в эксперименте с проверочной дозой по методу 2.
3.2.3 сГ —доза, полученная из эксперимента с возрастающей дозой, проведенного на единицах продукции, взятых из данной партии.
3.2.4 D* — первоначальная оценка дозы, обеспечивающей УС = 10'2 для испытываемых единиц продукции.
Примечание — Обычно это среднее из значений 3d*, полученных для данной продукции.
3.2.5 D** — окончательная оценка дозы, обеспечивающей УС = 10"2 для испытываемых единиц продукции, которая используется при вычислении стерилизующей дозы.
3.2.6 DD’ — доза, подаваемая в эксперименте с проверочной дозой по методу 2.
3.2.7 DS — оценка значения О10 для микроорганизмов, присутствующих на продукции после облучения дозой DD*.
3.2.8 значение D (D value, D10 value) — время или доза, требуемые для обеспечения инактивации 90 % популяции испытываемых микроорганизмов при установленных условиях.
[ИСО/ТС 11139:2006).
Примечание — В настоящем документе 01О применяется только для обозначения дозы, а не времени.
ГОСТ Р ИС011137-2—2008
3.2.9 первая дробная положительная доза (first fraction positive dose) ftp — самая низкая доза в ряду возрастающих доз, применяемых для единиц продукции, взятых изданной партии изделий, при которой как минимум одно из 20-ти одинаковых испытаний на стерильность имеет отрицательный результат.
3.2.10 первая дробная положительная доза (First Fraction Positive dose) FFP —доза, при которой ожидается 19 положительных результатов из 20-ти испытаний на стерильность, вычисленная путем вычитания А из среднего значения 3 ffp доз.
3.2.11 первая доза без положительных результатов (First No Positive dose) FNP — оценка дозы, обеспечивающей УС = 10"2 для испытываемых единиц продукции, которая используется в вычислении DS.
3.2.12 5— максимальная проверочная доза для подтверждения правильности выбора стерилизующей дозы 15 кГр, обеспечивающей достижение УС = 10"* для данной бионагрузки.
3.2.13 — максимальная проверочная доза для подтверждения правильности выбора стерилизующей дозы 25 кГр, обеспечивающей достижение УС = 10"6 для данной бионагрузки.
4 Определение и техническое обслуживание серии продукции для установления, обоснования и проверки стерилизующей дозы
4.1 Общие вопросы
Установление стерилизующей дозы и проведение проверки стерилизующей дозы являются процедурами. которые составляют часть определения процесса (см. ИС011137-1, раздел 8) и поддержания эффективности процесса (см. ИСО 11137-1, раздел 12). Для этих процедур продукцию можно сгруппировать по сериям; определение серии продукции основано главным образом на числе и типах микроорганизмов, присутствующих на или в продукции (бионагрузка). Тип микроорганизма характеризуется его стойкостью к облучению. Такие параметры, как плотность и конфигурация продукта в пределах упаковочного комплекта, не учитываются при установлении серии продукции, потому что они не являются факторами, которые влияют на бионагрузку.
При использовании серии продукции для установления стерилизующей дозы и для проверки этой дозы важно знать о рисках, таких как уменьшение возможности обнаружения случайного изменения в пределах производственного процесса, которое влияет на эффективность стерилизации. Кроме того, при использовании единичного продукта для представления серии продукции можно не обнаружить изменений, которые происходят в других компонентах этой серии продукции. Оценка риска, связанного с уменьшением возможности обнаружения изменений в других компонентах серии продукции, а также разработка и реализация плана технического обслуживания серии продукции должны быть проведены перед испытаниями.
Примечание — См. ИСО 14971 дли руководящих указаний по менеджменту рисков.
4.2 Определение серийности продукции
4.2.1 Критерии для определения серийности продукции должны быть документированы. Продукцию оценивают по этим критериям, и рассматриваются сходные черты между потенциальными компонентами серии продукции. Рассмотрение включает все параметры, связанные с продукцией, которые влияют на бионагрузку, включая, но не ограничиваясь этим, к ним относятся:
a) природа и источники сырьевых материалов, включая влияние (если таковое имеется) сырьевых материалов, которые могли быть получены более чем из одного источника;
b) компоненты;
c) конструкцию и размер продукции:
d) производственный процесс;
e) производственное оборудование;
f) производственную среду;
д) местонахождение производства.
Результат оценки и рассмотрения должен быть документирован (см. ИСО 11137-1:2006, пункт 4.1.2).
4.2.2 Продукт только тогда включают в серию продукции, когда подтверждается, что относящиеся к нему параметры (см. 4.2.1) аналогичны и находятся под контролем.
4.2.3 Для того, чтобы продукт был введен в серию продукции, должно быть продемонстрировано, что бионагрузка включает аналогичное число и аналогичные типы микроорганизмов.
3
4.2.4 Включение продукта более чем из одного местонахождения производства в серию продукции должно быть специально обосновано и документировано (см. ИСО 11137-1:2006, пункт 4.1.2). Должно быть рассмотрено влияние на бионагрузку:
a) географических и/или климатических различий между местонахождениями производства:
b) любых различий в управлении производственным процессом или окружающей средой;
c) источников сырьевых материалов и вспомогательных средств обработки (например, вода).
4.3 Обозначение продукта, представляющего серию продукции для проведения эксперимента с проверочной дозой или проверки стерилизующей дозы
4.3.1 Изделие для представления как серия продукции
4.3.1.1 Число и типы микроорганизмов на или в изделии должны применяться как основание для выбора изделия, который будет представлять серию продукции.
4.3.1.2 Серия продукции должна быть представлена:
a) главным изделием (см. 4.3.2);
или
b) эквивалентным изделием (см. 4.3.3);
или
c) имитирующим изделием (см. 4.3.4).
4.3.1.3 Формальная документированная оценка предпринимается для решения, какой из трех потенциальных представительных продуктов в 4.3.1.2 является подходящим. В этой оценке рассматривают следующее:
a) число микроорганизмов, составляющих бионагрузку;
b) типы микроорганизмов, составляющих бионагрузку;
c) окружающая среда, в которой появляются микроорганизмы;
d) размер продукта;
e) число компонентов:
f) сложность продукта:
д) степень автоматизации производства;
h) производственная среда.
4.3.2 Главное изделие
Элемент серии продукции считается главным изделием только тогда, когда оценка (см. 4.3.1.3) показывает, что признак этого элемента выше всех других элементов серии продукции. В некоторых ситуациях может быть несколько элементов в пределах серии продукции, каждый из которых может считаться главным продуктом. В таких случаях каждый из этих элементов может быть выбран как главное изделие, чтобы представлять серию продукции согласно 4.3.3.
4.3.3 Эквивалентное изделие
Группа продуктов считается эквивалентной только в том случае, если оценка (см. 4.3.1.3) показывает, что для элементов группы требуется одинаковая стерилизующая доза. Выбор эквивалентного продукта для представления серии должен быть случайным или проводиться согласно запланированной схеме включения различных элементов серии продукции. Объем производства и наличие продуктов следует учитывать при выборе эквивалентного продукта для представления серии продукции.
4.3.4 Имитирующее изделие
Имитирующее изделие может представлять серию продукции только в том случае, если оно составляет аналогичную или более значительную проблему для процесса стерилизации, чем элементы серии продукции. Имитирующее изделие упаковывают таким же образом и с использованием таких же материалов. что и подлинный продукт.
Примечание — Имитирующее изделие не предназначено для клинического использования, ею изготовляют только для установления или поддержания стерилизующей дозы.
Имитирующее изделие может быть:
a) изделием, аналогичным подлинному продукту по материалу и размеру и подвергаемый аналогичным производственным процессам (например, кусок материала, используемый для имплантатов, который проходит через весь производственный процесс);
b) комбинацией компонентов из продуктов в пределах серии продукции, которые, как правило, не комбинируются для использования (например, набор трубок, содержащий разнообразные фильтры, зажимы и задвижки, которые являются компонентами других продуктов в этой серии продукции).
4
ГОСТ Р ИС011137-2— 2008
4.4 Техническое обслуживание серии продукции
4.4.1 Периодическая экспертиза
Экспертиза должна проводиться с установленной частотой для гарантии, что серия продукции и продукты. используемые для представления каждой серии, остаются действительными. Ответственность за экспертизу продукта и/или процесса, которые могли повлиять на состав серии продукции, принадлежит компетентному персоналу. Такие проверки должны проводиться не меньше одного раза в год. Результат экспертизы должен быть документирован согласно ИСО 11137-1:2006. пункту 4.1.2.
4.4.2 Модификация продукции и/или производственного процесса
Модификации продукции, связанные с сырьевыми материалами (природа и источник), компонентами или конструкцией продукции (включая размер), и/или модификации производственного процесса, связанные с оборудованием, окружающей средой или местонахождением, должны оцениваться посредством официальной документированной системы контроля изменений. Такие модификации могут изменять положения. на основе которых была определена серия продукции или сделан выбор продукта для представления серии. Значительные модификации могут потребовать определения новой серии продукции или выбора другого образца продукции.
4.4.3 Регистрация данных
Регистрационные данные о сериях продукции следует хранить в соответствии с ИСО 11137-1:2006. пункт 4.1.2.
4.5 Действия в случае обнаружения несоответствия стерилизующей дозы для серии продукции
При установлении или проведении проверки стерилизующей дозы в случае обнаружения несоответствия значения стерилизующей дозы следует считать, что это значение стерилизующей дозы не соответствует всем элементам данной серии продукции. Соответствующие действия должны применяться ко всем продуктам, содержащим данную серию.
5 Выбор и испытание продукции для установления и проверки стерилизующей дозы
5.1 Характеристика продукции
5.1.1 Продукция для стерилизации может состоять из:
a) индивидуального медицинского продукта в упаковочном комплекте:
b) набора компонентов в упаковочном комплекте, которые собирают в месте использования для составления медицинского продукта, вместе с аксессуарами для использования этого продукта в сборе:
c) нескольких медицинских продуктов в упаковочном комплекте:
d) набора, включающего разнообразные медицинские продукты, связанные с процедурами.
Единицы продукции для установления и обоснования дозы берутся согласно таблице 1.
|
Таблица 1— Характеристика единиц продукции для установления и проверки стерилизующей дозы |
|
Тип продукции |
Единица для оценки бионагрузки верификации и/или эксперимента с возрастающей дозой |
Пояснение |
|
Индивидуальный медицинский продукт в упаковочном комплекте |
Индивидуальный медицинский продукт |
Каждый медицинский продукт используется в клинической практике самостоятельно |
|
Набор компонентов в упаковочном комплекте |
Комбинация всех компонентов продукта |
Компоненты собирают в продукт и используют вместе в клинической практике |
|
Несколько идентичных медицинских продуктов в упаковочном комплекте |
Единичный медицинский продукт, взятый из упаковочного комплекта |
Каждый медицинский продукт используется в клинической практике самостоятельно; УС индивидуального медицинского продукта в упаковочном комплекте удовлетворяет выбранному УС. хотя УС. связанный с этим упаковочным комплектом, может быть выше |
|
|
5 |