ГОСТ Р 51538-99
Системы качества. Изделия медицинские. Руководство по применению ГОСТ Р 51536-99 (ИСО 13485-96) и ГОСТ Р 51537-99 (ИСО 13488-96)
Купить ГОСТ Р 51538-99 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Представляет собой руководство по применению требований к системам качества медицинских изделий, содержащихся в ГОСТ Р 51536 и ГОСТ Р 51537, и может использоваться для лучшего понимания альтернативных методов. Руководство, представленное настоящим стандартом, применимо для: - поставщиков, желающих осуществлять и поддерживать системы качества; - организаций, сертифицирующих и лицензирующих системы качества медицинских изделий; - надзорных органов, в компетенцию которых входит контроль за выполнением регулирующих требований.
Разделы стандарта, за исключением пунктов 4.4.6 и 4.4.7, представляют собой аутентичный текст международного стандарта ИСО 14969-99 «Системы качества. Изделия медицинские. Руководство по применению ИСО 13485-96 и ИСО 13488-96»
Оглавление
1 Область применения
2 Нормативные ссылки
3 Определения
4 Требования к системе качества
4.1 Ответственность руководства
4.2 Система качества
4.3 Анализ контракта
4.4 Управление проектированием
4.5 Управление документацией и данными
4.6 Закупки
4.7 Управление продукцией, поставляемой потребителем
4.8 Идентификация и прослеживаемость продукции
4.9 Управление процессами
4.10 Контроль и испытания
4.11 Управление контрольным, измерительным и испытательным оборудованием
4.12 Статус контроля и испытаний
4.13 Управление несоответствующей продукцией
4.14 Корректирующие и предупреждающие действия
4.15 Погрузочно-разгрузочные работы, хранение, упаковка, консервация и поставка
4.16 Управление регистрацией данных о качестве
4.17 Внутренние проверки качества
4.18 Подготовка кадров
4.19 Обслуживание
4.20 Статистические методы
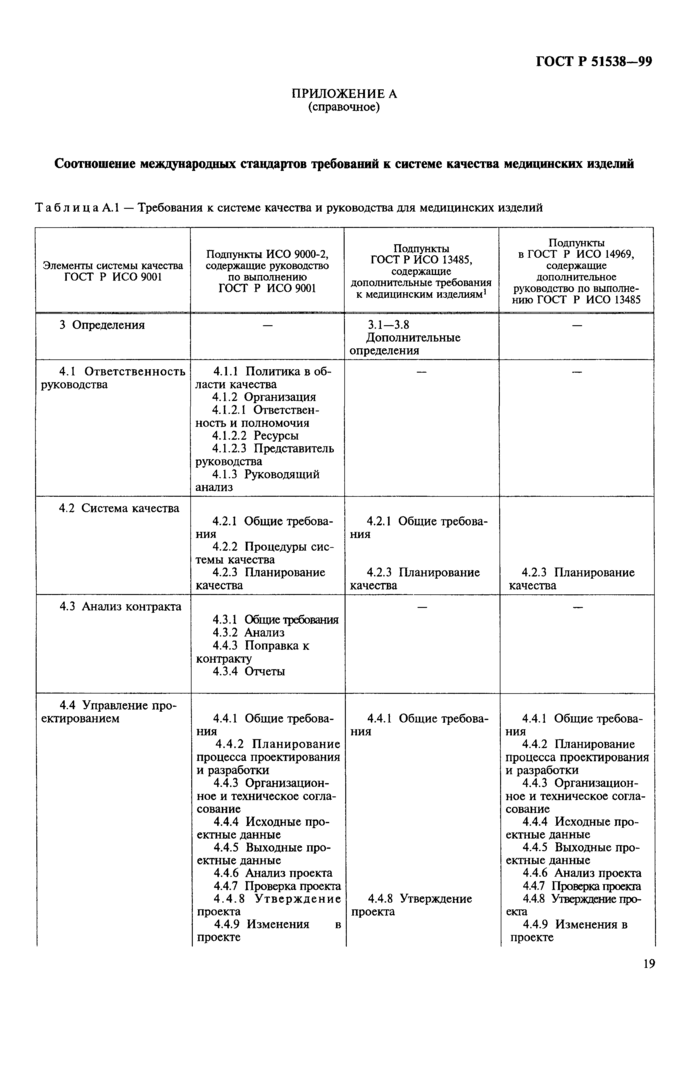
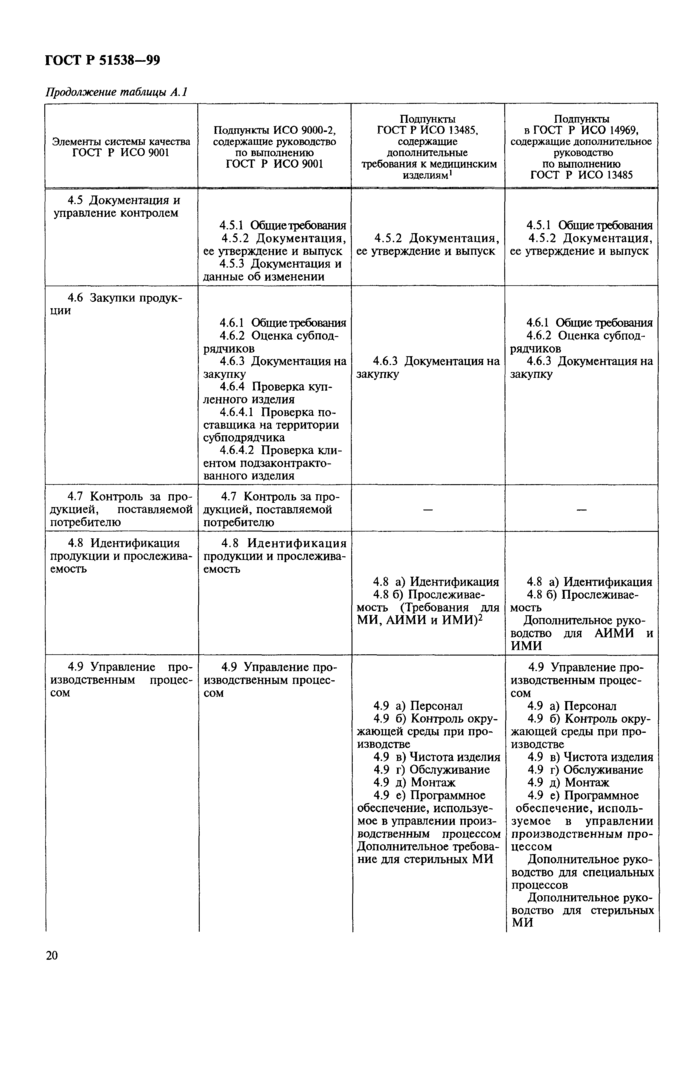
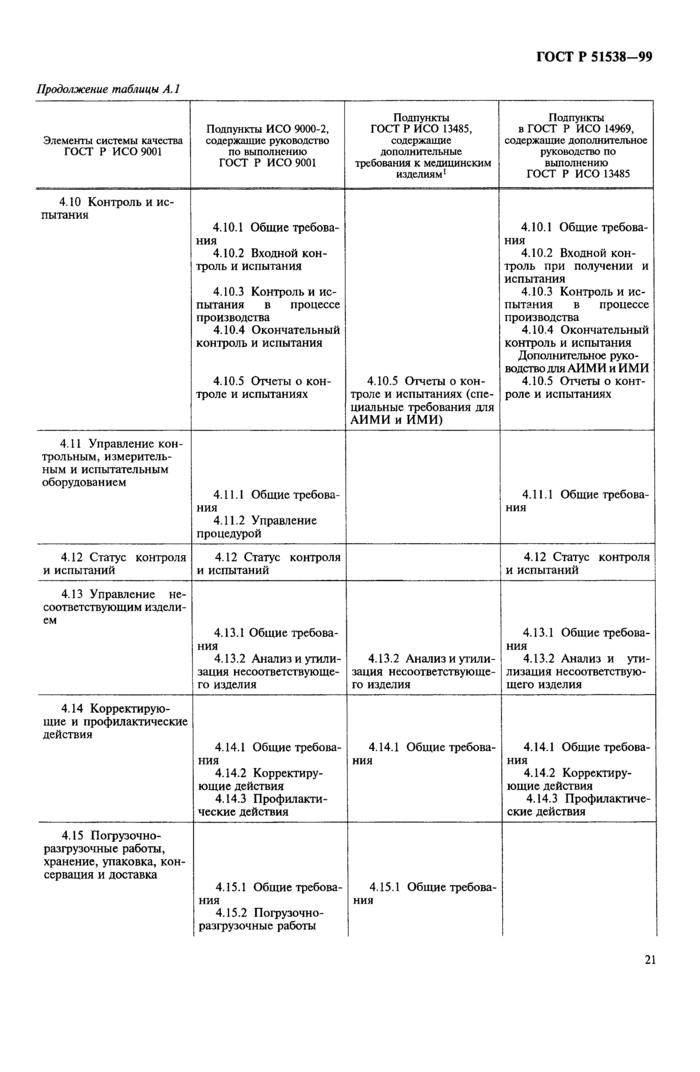
Приложение А Соотношение международных стандартов требований к системе качества медицинских изделий
Приложение В Термины, используемые в некоторых национальных регулирующих органах государственного регулирования
| Дата введения | 01.01.2001 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.01.2008 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 29.12.1999 | Утвержден | Госстандарт России | 859-ст |
|---|---|---|---|
| Разработан | ВНИИИМТ | ||
| Издан | ИПК Издательство стандартов | 2000 г. |
Quality systems. Medical devices. Guidance on the application of GOST R 51536-99 (ИСО 13485-96) and GOST R 51537-99 (ИСО 13488-96)
- ГОСТ Р ИСО 9001-96 Системы качества. Модель обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании
- ГОСТ Р ИСО 9002-96 Системы качества. Модель обеспечения качества при производстве, монтаже и обслуживании
ГОСТ Р 51536-99Системы качества. Изделия медицинские. Специальные требования по применению ГОСТ Р ИСО 9001-96. Заменен на ГОСТ Р ИСО 13485-2004.ГОСТ Р 51537-99Системы качества. Изделия медицинские. Специальные требования по применению ГОСТ Р ИСО 9002-96. Заменен на ГОСТ Р ИСО 13485-2004.
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22
стр. 23
стр. 24
стр. 25

стр. 26
стр. 27

стр. 28
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТ Р 51538-99 (ИСО 14969-99)
Системы качества
ИЗДЕЛИЯ МЕДИЦИНСКИЕ
Руководство по применению ГОСТ Р 51536-99 и ГОСТ Р 51537-99
БЗ 1-2000/750
Излание официальное
ГОССТАНДАРТ РОССИИ Москва
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники (ВНИИИМТ)
ВНЕСЕН Техническим комитетом по стандартизации ТК 11 «Медицинские приборы и аппараты*
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. N? 859-ст
3 Разделы настоящего стандарта, за исключением пунктов 4.4.6 и 4.4.7, представляют собой аутентичный текст международного стандарта ИСО 14969—99 «Системы качества. Изделия медицинские. Руководство по применению ИСО 13485—96 и ИСО 13488—96*
4 ВВЕДЕН ВПЕРВЫЕ
© ИПК Издательство стандартов, 2000
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта России
II
Содержание
1 Область применения....................................................... 1
2 Нормативные ссылки...................................................... 2
3 Определения............................................................. 2
4 Требования к системе качества............................................... 2
4.1 Ответственность руководства............................................. 2
4.2 Система качества...................................................... 2
4.3 Анализ контракта...................................................... 2
4.4 Управление проектированием............................................. 2
4.5 Управление документацией и данными...................................... 5
4.6 Закупки............................................................. 6
4.7 Управление продукцией, поставляемой потребителем........................... 7
4.8 Идентификация и прослеживаемость продукции............................... 7
4.9 Управление процессами................................................. 8
4.10 Контроль и испытания................................................. 11
4.11 Управление контрольным, измерительным и испытательным оборудованием.......... 12
4.12 Статус контроля и испытаний............................................ 12
4.13 Управление несоответствующей продукцией................................. 13
4.14 Корректирующие и предупреждающие действия.............................. 13
4.15 Погрузочно-разгрузочные работы, хранение, упаковка, консервация
и поставка........................................................... 15
4.16 Управление регистрацией данных о качестве................................. 16
4.17 Внутренние проверки качества........................................... 17
4.18 Подготовка кадров.................................................... 17
4.19 Обслуживание........................................................ 18
4.20 Статистические методы................................................. 18
Приложение А Соотношение международных стандартов требований к системе
качества медицинских изделий.................................... 19
Приложение В Термины, используемые в некоторых национальных регулирующих
органах государственного регулирования.............................22
Ш
Введение
ГОСТ Р 51538 является прямым применением международного стандарта ИСО 14969—99 «Системы качества. Изделия медицинские. Руководство по применению ИСО 13485—96 и ИСО 13488—96*, подготовленного Техническим комитетом ИСО 210 «Управление качеством и соответствующие аспекты для медицинских изделий*.
Настоящий стандарт представляет собой руководство по применению требований к системе качества при разработке, производстве, обслуживании и модернизации медицинских изделий с учетом требований ГОСТ Р 51536 и ГОСТ Р 51537. Эти стандарты устанавливают совместно с ГОСТ Р ИСО 9001 и ГОСТ Р ИСО 9002 требования к системе качества медицинских изделий. ГОСТ Р 51536 отличается от ГОСТ Р 51537 тем, что нс содержит требований по управлению проектированием.
При оценке применимости настоящего стандарта рассматривают назначение медицинского изделия, потенциальный риск, сопутствующий его использованию, и применимые регулирующие требования.
Термин «регулирующие требования*, используемый в настоящем стандарте, включает ту часть федерального закона, постановления, декрета или другого директивного документа, имеющего юридическую силу, которая применяется к системам качества изготовителей медицинских изделий.
IV
ГОСТ Р 51538-99 (ИСО 14969-99)
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Системы качества ИЗДЕЛИЯ МЕДИЦИНСКИЕ
Руководство по применению ГОСТ Р 51536-99( ИСО 13485—96) и ГОСТ Р 51537-99(ИСО 13488-96)
Quality systems. Medical devices.
Guidance on the application of GOST R 51536-99 (ISO 13485) and GOST R 51537-99 (ISO 13488-%)
Дата введения 2001-01-01
1 Область применения
Настоящий стандарт представляет собой руководство по применению требований к системам качества медицинских изделий (далее — изделий), содержащихся в ГОСТ Р 51536 и ГОСТ Р 51537, и может использоваться для лучшего понимания альтернативных методов.
Требования настоящего стандарта являются рекомендуемыми.
Руководство, представленное в настоящем стандарте, применимо для:
- поставщиков, желающих осуществлять и поддерживать системы качества, соответствующие ГОСТ Р 51536 и ГОСТ Р 51537;
- организаций, сертифицирующих и лицензирующих системы качества медицинских изделий;
- надзорных органов, в компетенцию которых входит контроль за выполнением регулирующих требований, приведенных в ГОСТ Р 51536 и ГОСТ Р 51537.
Эти организации и надзорные органы должны понять преимущества руководства и специальных правил, приведенных в данном стандарте.
а) Специальные правила для поставщиков
Требования настоящего стандарта применимы при разработке, производстве, монтаже и обслуживании изделий всех видов. В настоящем стандарте приведены концепции и методы, которые могут рассматриваться поставщиками при разработке и поддержании системы качества.
Изготовитель несет ответственность за выбор конкретного руководства, применимого к его процедурам и включенного в его систему качества. Изготовитель должен понимать, что если он добровольно включает требования настоящего стандарта в свою систему качества, руководство должно выполняться. Нарушение требований принятого руководства может быть определено как недостаток при проведении ответственных внутренних или внешних оценок системы качества, инспекций и проверок.
Изготовитель должен также понимать, что его система качества может быть определена как недостаточная при неполном соответствии требованиям настоящего стандарта.
б) Специальные правила для государственных инспекторов, органов по сертификации и лицензированию
Руководство, приведенное в настоящем стандарте, может быть полезно для рассматривающих систему качества государственных инспекторов, органов по сертификации и лицензированию.
Руководство, содержащееся в настоящем стандарте, не должно использоваться для выявления специфических недостатков систем качества. Только в случае, если такое руководство добровольно включено изготовителем в комплект документации или если такое руководство директивными документами определено как часть регулирующих требований, следование данному стандарту со стороны изготовителя обязательно.
Издание официальное
2 Нормативные ссылки
В настоящем стандарте используются ссылки на следующие стандарты:
ГОСТ Р ИСО 9001-96 Системы качества. Модельная обеспечения качества в проектировании, разработке, производстве, монтаже и обслуживании
ГОСТ Р ИСО 9002-96 Системы качества. Модель для обеспечения качества в производстве, монтаже и обслуживании
ГОСТ Р 51536-99 (ИСО 13485—96) Системы качества. Изделия медицинские. Специальные требования по применению ГОСТ Р ИСО 9001-96
ГОСТ Р 51537-99 (ИСО 13488—96) Системы качества. Изделия медицинские. Специальные требования по применению ГОСТ Р ИСО 9002-96
ИСО 8402-94* Управление качеством и обеспечение качества. Словарь
ИСО 9000-2-97* Управление качеством и обеспечение качества. Часть 2. Основные руководящие принципы по применению ИСО 9001, ИСО 9002 и ИСО 9003
3 Определения
В настоящем стандарте использованы термины, установленные в ИСО 8402, ГОСТ Р 51536 и ГОСТ Р 51537, за исключением термина «продукция», который установлен в ГОСТ Р ИСО 9001 и ГОСТ Р ИСО 9002.
4 Требования к системе качества
4.1 Ответственность руководства
4.1.1 Политика в области качества
Руководство по медицинским изделиям приведено в ИСО 9000-2, 4.1.1.
4.1.2 Организация
4.1.2.1 Ответственность и полномочия — по ИСО 9000-2, 4.1.2.1.
При необходимости должны быть назначены и обучены лица, исполняющие обязанности заместителей персонала, несущего ответственность за принятие решений, с помощью которых управляются элементы системы качества и производства.
4.1.2.2 Ресурсы-по ИСО 9000-2, 4.1.2.2.
4.1.2.3 Специальные руководства — по ИСО 9000-2, 4.1.2.3.
4.1.3 Анализ со стороны руководства — по ИСО 9000-2, 4.1.3.
4.2 Система качества
4.2.1 Общие положения — по ИСО 9000-2, 4.2.1.
4.2.2 Процедуры системы качества — по ИСО 9000-2, 4.2.2.
4.2.3 Планирование качества — по ИСО 9000-2, 4.2.3.
Пункт 4.2.3 ГОСТ Р 51536 иногда устанавливает другие термины (см. приложение В).
4.3 Анализ контракта
4.3.1 Общие положения — по ИСО 9000-2, 4.3.1
4.3.2 Анализ — по ИСО 9000-2, 4.3.2.
4.3.3 Поправка к контракту — по ИСО 9000-2, 4.3.3.
4.3.4 Регистрация данных — по ИСО 9000-2, 4.3.4.
4.4 Управление проектированием
4.4.1 Общие положения — по ИСО 9000-2, 4.4.1.
Степень оценки, проверки и утверждения изделий должна быть соразмерна с характером рисков и преимуществ, сопутствующих использованию медицинского изделия.
Анализ риска с применением различных методов анализа и классификации неисправностей проводят на различных стадиях проектирования. Такие методы могут также быть полезными при определении характера возможных недостатков проектирования и сопутствующих рисков. Эти методы могут также идентифицировать изменения, требуемые для увеличения надежности и безопасности. Применение методов анализа риска по ГОСТ Р ИСО 14971.1 (см. библиографию).
Документы и отчеты, связанные с проектированием, должны формировать часть комплекта технической документации (приложение В, пункт 1).
4.4.2 Планирование проектирования и разработки — по ИСО 9000-2, 4.4.2.
Международные стандарты — во ВНИИКИ Госстандарта России.
Планирование проектирования и разработки должно гарантировать, что процесс проектирования управляется соответствующим образом и цели проектирования выполнены. Выбранный метод и детали могут зависеть от сложности проекта и уровня риска, сопутствующего медицинскому изделию.
Обычно план проектирования включает методы обеспечения качества, методологию оценки, требования к документации, сохранение отчетов, ресурсы и последовательность действий, соответствующих специфическому проектированию или категории проектирования, выбору времени и содержанию обзора проектирования. План составляют на основе законов, стандартов, регулирующих требований, спецификаций и критериев приемки. Действия по проектированию определяют по уровню детализации, необходимой для проведения процесса проектирования способом, который обеспечивает формирование объективного доказательства завершения действий по проектированию. Планы проектирования не должны быть сложными. В них должны быть указаны действия, которые будут предприняты, и ответственснный за их выполнение. При необходимости, применяемые законы, стандарты, регулирующие требования, спецификации и критерии приемки могут быть включены в план.
Процесс принятия решения по вопросу, является ли клиническое исследование необходимым, должен быть основан на первоисточнике (ГОСТ Р 51536, примечание к 4.4.8).
4.4.3 Организационно-техническое взаимодействие — по ИСО 9000-2, 4.4.3.
К процессу проектирования изделий обычно привлекают персонал, занятый непосредственно процессом проектирования, и другие внутренние подразделения (службы маркетинга, закупок и продаж, производственные, испытательные службы, обеспечения качества, клинические и регулирующие отделы). Кроме того, могут быть привлечены внешние организации по отношению к изготовителю иааелий.
Процедуры оперативного взаимодействия разрабатывают для обеспечения гарантии того, что информация от всех подразделений организации является доступной участникам процесса проектирования.
Ошибки при взаимодействии подразделений на всех уровнях могут закончиться неспособностью организации устранить их, когда необходимо.
4.4.4 Исходные проектные данные — по ИСО 9000-2, 4.4.4.
Исходные проектные данные определяют для обеспечения эффективного уровня необходимых действий при проектировании и служат основой для выполнения, проверки и утверждения проектируемого изделия.
Примеры исходных проектных данных, которые должны быть установлены, рассмотрены, одобрены и зарегистрированы разработчиком (изготовителем), включают в себя:
- предполагаемое клиническое назначение;
- требования потребителя, например предполагаемые функциональные возможности изделия (показатели применения) и ограничения его применения;
- требования к показателям назначения, например, при нормальном использовании, хранении, погрузоразгрузочных работах и обслуживании;
- требования к различным вариантам маркировки в инструкции по использованию и обслуживанию;
- требования к окружающей среде, безопасности и регулирующие требования;
- эргономические и другие человеческие факторы;
- вспомогательные стандарты;
- элементы системы, если изделие используют в комбинации с другим изделием, например, другое оборудование или принадлежности. В этом случае исходные проектные данные должны полностью определять требования взаимодействия элементов системы.
При определении исходных проектных данных поставщик должен рассмотреть предполагаемое назначение, неправильное использование изделия и любые, связанные с его использованием, требования к специальной маркировке изделия и обучению потребителя (пользователя).
Документ (ы) по исходным проектным данным должен обновляться и переиздаваться по мере необходимости, вплоть до окончания срока службы изделия. Отчет должен сохранять все согласованные изменения исходных проектных данных, если они принимались в течение процесса проектирования.
Процесс передачи проектируемого изделия в производство протекает более успешно, если на стадии разработки исходных проектных данных принимают во внимание конечное производство (возможность производства, доступность частей/материалов, потребность в производственном оборудовании, обучение операторов и т.д.) и требования оценки соответствия изделия (процедуры, методы, оборудование).
4.4.5 Выходные проектные данные — по ИСО 9000-2, 4.4.5.
3
Выходные проектные данные могут включать требования к:
- сырью;
- составляющим частям;
- сборочным узлам;
- законченным изделиям;
- процессу создания и применения программного обеспечения;
- процедурам гарантии качества, включая критерии приемки;
- производственным и проверочным процедурам;
- упаковке и маркировке;
- процедуре идентификации и прослеживаемости;
- процедуре и материалам по монтажу и обслуживанию.
Документы по выходным проектным данным или дополнения к ним должны быть в виде отчетов/файлов, демонстрирующих, что каждый проект был разработан и проверен в соответствии с одобренным планом проекта.
Проектируемое изделие передают в производство после анализа и принятия требований и процедур. Адекватность требований, методов и процедур устанавливают в процессе утверждения, включая испытания готового изделия при фактических или моделируемых условиях применения.
4.4.6 Анализ проекта — по ИСО 9000-2, 4.4.6.
Для обеспечения объективности анализа проекта рекомендуется привлекать одного или нескольких экспертов, не несущих прямую ответственность за рассматриваемые действия по проектированию. Это позволяет рецензентам принять во внимание все аспекты интересов поставщика при производстве, маркетинге, проектировании, послепродажном обслуживании, поддержке и вероятную медицинскую эффективность проекта. Для медицинских изделий анализ должен также содержать следующие оценки:
- проведение анализа риска, гарантирующего, что вопросы безопасности были рассмотрены;
- адекватность маркировки;
- возможность изделия разумно выполнять предполагаемое медицинское назначение;
- адекватность упаковки, особенно для стерильных изделий;
- адекватность процесса стерилизации;
- совместимость изделия и метода стерилизации.
После завершения важных стадий процесса проектирования выходные проектные документы должны быть рассмотрены и приняты в установленном порядке для последующего выполнения.
Регистрация отчетов об анализе проекта должна быть идентифицирована и включать в себя принятые решения.
Примечание — Анализ проекта должен включать проверку учета требований действующих санитарных правил и норм.
4.4.7 Проверка проекта — по ИСО 9000-2, 4.4.7.
Как только проектируемое изделие переведено в материальную форму, его безопасность, показатели назначения и надежность должны быть проверены на соответствие исходным проектным данным. Такие проверки включают:
- анализ технических требований и рисунков;
- физические и химические лабораторные испытания;
- испытания in vitro;
- испытания in vivo;
- анализ упаковки и маркировки (см. 4.15.4).
Примечание — При проверке проекта необходимо убедиться, что документация по изготовлению, монтажу и обслуживанию медицинских изделий содержит требования безопасности в необходимом объеме.
4.4.8 Утверждение проекта — по ИСО 9000-2, 4.4.8.
Утверждение проектируемого изделия идет без проверки технических возможностей соответствия входных проектных характеристик и выходных проектных данных и предназначено для обеспечения того, что медицинское изделие отвечает потребностям потребителя и может использоваться по назначению. Это достигается при изучении подготовки и возможностей потенциального потребителя, инструкций потребителя, совместимости с другими системами и любых ограничений по применению изделия.
Экземпляры медицинских изделий, используемые для утверждения, должны быть изготовлены как окончательные изделия в отличие от первоначальных образцов. Утверждение проводят при фактических или моделируемых условиях применения, при этом может потребоваться проведение медицинских исследований.
4.4.9 Изменения проекта — по ИСО 9000-2, 4.4.9.
В зависимости от того, находится ли изделие в продаже в настоящее время или нет, перед разрешением изменений к принятому проектному изделию, среди прочих должны быть рассмотрены следующие вопросы:
- Будет ли изделие соответствовать требованиям после внесения изменений?
- Будет ли изделие соответствовать спецификациям после внесения изменений?
- Будет ли изделие использоваться по назначению?
- Будут ли влиять изменения на различные компоненты изделия или системы?
- Будет ли физический контакт с другими компонентами в изделии или системе?
- Создадут ли изменения проблемы при изготовлении, монтаже или применении?
- Останется ли изделие поддающимся проверке ?
- Затронут ли изменения регулирующий статус изделия?
4.5 Управление документацией и данными
4.5.1 Общие положения — по ИСО 9000-2, 4.5.1.
Примеры управления документацией и данными, которые должны быть подчинены формальным процедурам контроля:
- руководство по качеству;
- стандартные операционные процедуры, методики испытаний и рабочие инструкции;
- технические требования, рисунки, например, требования к закупкам, процессам, упаковке и маркировке;
- соответствующий рекламный материал, руководства потребителя, инструкции по эксплуатации и тщ.;
- электронные резервные копии версий документов на систему качества и требования.
На протяжении срока службы копии опубликованных внешних стандартов, регулирующих правил и практических законов, которые относятся к системе качества или требований к изделию, должны контролироваться таким образом, чтобы можно было ясно представлять, какая версия документа была использована.
4.5.2 Утверждение и выпуск документации и данных — по ИСО 9000-2, 4.5.2.
Установленная система для управления документацией и результатами должна:
- включать периодический анализ документации, если требуется системой качества;
- назначать ответственных за подготовку, проверку и выпуск документов;
- требовать анализа всей связанной с качеством документации для обеспечения уверенности в законченности и её правильности перед утверждением и выпуском;
- идентифицировать получателей контрольных копий документов;
- гарантировать быстрое аннулирование устаревших копий контролируемых документов (см. 4.5.2);
- определять метод регистрации, даты внесения изменений в документацию.
Процедуры управления документацией регулируют принятием постоянной структуры документов в рамках системы качества и указывают, какая информация из документации управления должна быть включена в индивидуальную контролируемую документацию. В рассмотрение необходимо включить:
- название и область применения;
- ссылочный номер документа;
- дату выпуска;
- статус пересмотра;
- дату проверки или частоту проверки, если требуется периодический анализ системы качества,
- историю проверки;
- организатора или автора;
- утверждающую персону (ы);
- персону (ы), ответственную за выпуск;
- порядок утилизации;
- нумерацию страниц и
- ссылку на электронную копию (файл компьютера), если она существует.
Система управления документацией должна обеспечивать возможность отличия управляемых и неуправляемых документов.
Сохранение четко отмеченной устаревшей и замененной управляемой документации помогает в обеспечении полной картины жизненного цикла изделия.
4.5.3 Изменения документов и данных — по ИСО 9000-2, 4.5.3.
Изменения документации и результатов, включая компьютерную документацию, производит уполномоченный персонал (например люди с правом доступа к документации и файлам данных, которые подлежат изменению). Утверждение уполномоченных для внесения изменений должно быть
5
зафиксировано в документации (или результатах) или в сопутствующем листе регистрации изменений. Для предотвращения неправомочных изменений в компьютерной документации и результатах их передают заинтересованным лицам, не уполномоченным вносить изменения, в виде, доступном «только для чтения».
4.6 Закупки
4.6.1 Общие положения — по ИСО 9000-2, 4.6.1.
Поставщик может из различных источников покупать изделия и услуги, которые могут непосредственно или косвенно затрагивать вопросы безопасности, эффективности и общего качества конечного медицинского изделия. К таким изделиям и услугам относятся:
- сырье;
- компоненты или сборочные узлы, изготовленные другими производителями, с использованием принадлежащего поставщику оборудования и (или) материалов, предоставленных поставщиком;
- компоненты или сборочные узлы, представляющие стандартные блоки из других источников;
- компоненты или сборочные узлы, изготовленные другими производителями по техническим документам поставщика;
- законченное изделие, носящее марку и (или) имя изготовителя изделия; это могут быть изделия, готовые к продаже или требующие некоторой дальнейшей доработки (типа упаковки и (или) стерилизации);
- упаковочный стандартный материал или материал, изготовленный по технической документации поставщика;
- маркировка, установленная по техническим документам поставщика;
- услуги следующих видов: механизация, высокотемпературная обработка, стерилизация, калибровка, испытание, санитарно-химический контроль, утилизация отходов производства, очистка, контроль окружающей среды, услуги прачечной, транспортирование, монтаж.
- консультационные услуги.
4.6.2 Оценка субподрядчиков — по ИСО 9000-2, 4.6.2.
Термин «субподрядчик» взят для включения претендентов в поставщики материалов, компонентов, сборочных узлов или законченных изделий или услуг.
Выбор потенциальных субподрядчиков обычно может включать оценку их производственных мощностей, способностей, навыков, ресурсов и т.д., демонстрирующих способность субподрядчика выполнить соответствующие требования для медицинских изделий.
Приемлемые субподрядчики должны быть занесены в контрольный список, в котором должны быть указаны:
- название фирмы и ее адрес;
- контактное лицо;
- название продукции или услуги, которые могут быть куплены.
Если поставщик закупает сборочные узлы, разработанные субподрядчиком, он должен получить от субподрядчика информацию, позволяющую проводить сервисное обслуживание изделий потенциальным покупателям.
Если субподрядчик поставляет законченное изделие поставщику для распространения под торговой маркой поставщика, поставщик должен знать о любых недостатках в системе качества субподрядчика, которая должна быть согласована с поставщиком.
Если выполнение требований технической документации связано с учетом уровня гарантии качества, достигнутой субподрядчиками, поставщик и потенциальные субподрядчики должны договариваться об уровнях стандартов системы качества и методов проверки, а также создавать условия для урегулирования споров относительно качества.
По возможности, поставщик должен получить согласие субподрядчика об уведомлении поставщика с целью одобрения изменений процессов, которые могли бы затрагивать качество купленного изделия или услуги. При получении уведомления о внесении изменений поставщик должен оценить их влияние на конечное изделие.
Контроль системы качества субподрядчика мог бы включать некоторые из следующих действий:
а) для поставщика коммерчески доступных изделий:
- периодическая проверка полученных изделий;
- контроль результатов проверки;
- проведение сертификации системы качества субподрядчика третьими лицами;
- получение сертификатов о соответствии изделия и (или) сертификатов об анализе производства;
б) проверка системы качества изделий по технической документации поставщика может требоваться в дополнение к перечислению а).
При проектировании контрольных действий поставщик должен рассмотреть результаты сер-