Государственное санитарно-эпидемиологическое нормирование _Российской Федерации_
1.2. ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Оценка безопасности наноматериалов in vitro и в модельных системах vivo
Методические рекомендации MP 1.2.2566—09
Издание официальное
Москва • 2010
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
1.2. ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Оценка безопасности наноматериалов in vitro и в модельных системах in vivo
Методические рекомендации МР 1.2.2566—09
MP 1.2.2566—09
дельных биологических тест-системах, назначает в соответствии с правилами надлежащей лабораторной практики ответственных лиц за мониторинг исследования из числа сотрудников, не участвующих в исследовании.
3.7. Стандартные операционные процедуры.
3.7.1. Стандартные операционные процедуры разрабатываются организацией, проводящей исследования безопасности наноматериалов на модельных биологических тест-системах, на все производственные операции, включая: поступление, идентификацию, маркировку, отбор, обработку проб, использование и хранение исследуемых проб, хранение и аттестацию стандартов; обслуживание и калибровку измерительных приборов и оборудования; ведение биологических тест-систем и их поддержание в функциональном состоянии; приготовление реактивов, ведение записей, отчетов и их хранение; обслуживание помещений; обезвреживание или утилизация наноматериалов и содержащих их образцов (если это необходимо); осуществление программы по обеспечению качества, и утверждаются руководителем организации.
3.7.2. Соблюдение стандартных операционных процедур осуществляется в целях обеспечения качества, достоверности и воспроизводимости результатов исследования.
3.7.3. Отклонения от стандартных операционных процедур должны быть документально оформлены, подписаны руководителем исследования и утверждены руководителем организации.
3.7.4. Организация, проводящая исследование по определению безопасности наноматериалов на модельных биологических тест-системах, обязана:
• иметь утвержденный порядок приема и учета поступления анализируемых проб и стандартов наноматериалов;
• проводить учет анализируемых проб и стандартов наноматериалов при поступлении, расходовании, возврате заказчику или их утилизации;
• принимать меры по обеспечению идентификации исследуемых веществ (название, химическая формула, номер серии, дата выпуска, условия хранения и срок годности) и их стабильности на протяжении всего исследования. Для образцов наноматериалов на этикетке дополнительно должны указываться степень дисперсности, размер, форма частиц, при необходимости удельная площадь поверхности и кристаллическая структура.
3.8. Меры конфиденциальности.
MP 1.2.2566—09
3.8.1. Сотрудники, принимающие участие в проведении исследований по безопасности наноматериалов на модельных биологических тест-системах, обязаны соблюдать конфиденциальность в отношении любых данных, полученных в ходе исследования, в соответствии с законодательством Российской Федерации.
3.8.2. Организация, проводящая исследования по определению безопасности наноматериалов, должна обеспечить конфиденциальность результатов исследований в рамках принятых ею обязательств и в соответствии с законодательством Российской Федерации.
4. Оценка безопасности наноматериалов в модельных системах in vitro, содержащих культуры микроорганизмов
4Л. Метод оценки безопасности наноматериалов в модельной системе нормальной микрофлоры кишечника человека в условиях in vitro
4ЛЛ. Принцип метода
Безопасность наноматериалов в отношении их влияния на микроорганизмы нормальной микрофлоры кишечника человека в условиях in vitro оценивают по влиянию наночастиц на ростовые, культуральные, морфологические, биохимические свойства этих микроорганизмов. Образцы наноматериалов в разных концентрациях одновременно с культурами основных видов нормальной микрофлоры кишечного тракта вносят в среду роста и проводят культивирование по стандартной методике.
4J.2. Характеристика используемых организмов и тест-систем
В качестве тест-микроорганизмов используют выделенные из стандартизированных коммерческих препаратов пробиотиков («Лактобак-терина», «Бифидумбактерина» и «Колибактерина») штаммы следующих микроорганизмов: Lactobacillus plantarum, Lactobacillus fermentii,
Lactobacillus acidophilus, Bifidobacterium bifidum, Escherichia coli.
4.L3. Приборы и оборудование Термостат, поддерживающий рабочую температуру 28—45 °С с отклонением
от заданной ± 1 °С ТУ 64-1 -1382—12
Шейкер фирмы «Elmi» или аналогичный Ламинарный шкаф марки ЛШ1 фирмы «Biokom» или аналогичный
11
Центрифуга со скоростью вращения ротора до 12 000 об./мин для пробирок объемом 15 см3 Встряхиватель вибрационный типа «Вортекс» со скоростью вращения до 3 000 об./мин Холодильник бытовой электрический Весы лабораторные общего назначения 2-го класса точности Мембранные установки для получения деионизированной воды Анализатор потенциометрический с погрешностью измерений pH ± 0,01 Облучатель бактерицидный настенный ОБН-150 ТУ 954-001-0492102—01 Дозаторы с переменным объёмом дозирования фирмы «Gilson»:
0,2—2,0 мм3 с шагом 0,01 мм3 и точностью ± 1,2 %;
2—20 мм3 с шагом 0,01 мм3 и точностью ± 0,8 %;
1—10 см3 с шагом 0,1 см3 и точностью ± 0,5 % или аналогичные
Дозаторы с переменным объёмом дозирования
фирмы «Ленпипет»: ТУ 9452-002-33189998—2002
0,5—10,0 мм3 с шагом 0,01 мм3 и точностью ± 0,8 %;
20—200 мм3 с шагом 0,1 мм3 и точностью ± 0,6 %;
100—1 000 мм3 с шагом 1 мм3 и точностью ± 3,0 %
Пробирки стерильные типа «Эппендорф», объемом 1,5 см3
Пробирки стерильные с крышкой фирмы «Costar», вместимостью 15 см3 или аналогичные Наконечники пластиковые, объемом 1—200 мм3 Наконечники пластиковые, объемом 200—
1 000 мм3
Перчатки резиновые
Колбы плоскодонные конические разной вместимости
Цилиндры стеклянные мерные лабораторные, вместимостью 25, 100, 1 000 см3 Воронки стеклянные
Флаконы стерильные, объемом 100 и 200 см3, фирмы «Costar» или аналогичные
MP 1.2.2566—09
4.1.4. Материалы и реактивы
Питательные среды:
- среда Бактофок (или другие аналогичные среды) для культивирования бифидобактерий;
- MRS agar (или другие аналогичные среды) для культивирования лактобацилл;
- среда Эндо для культивирования Escherichia coli;
- тиогликолевая среда для выращивания тест-микроорганизмов.
Физиологический раствор (0,85 % NaCl) для титрования микроорганизмов.
Допускаются к использованию реагенты и материалы аналогичного назначения других изготовителей, разрешенные к применению в установленном порядке и с характеристиками, обеспечивающими проведение исследований в соответствии с данным документом.
4.1.5. Стандартные образцы наноматериалов При калибровке метода используют следующие стандартные образцы: Образец Ns 1:
• Наименование (тривиальное): псевдоаденовирусные наночастицы.
• Название химическое (по номенклатуре IUPAC): не имеют.
• Происхождение: Российская Федерация, изготовитель: НИИЭМ им. Н. Ф. Гамалеи РАМН.
Образец Ns 2:
• Наименование (тривиальное): наноразмерные частицы серебра «А§Бион-2».
• Название химическое (по номенклатуре ШРАС): серебро.
• Происхождение: Российская Федерация, изготовитель: АНО «Институт нанотехнологий Международного фонда конверсии».
4.1.6. Методика введения тестируемого образца
Образцы наноматериалов в различных концентрациях вносят дозатором в пробирки, содержащие определенные разведения бактериальных культур видов нормальной микрофлоры кишечника человека.
4.1.7. Методика проведения анализа
4.1.7.1. Для оценки роста культур в присутствии наноматериалов проводят наращивание микробной массы тест-микроорганизмов с дальнейшим титрованием методом десятикратных серийных разведений от 10® до 102 КОЕ/мл.
13
MP 1.2.2566—09
4.1.7.2. Проводят сравнение двух рядов пробирок по 10 см3 тиогли-колевой среды (опытных и контрольных) с исследуемыми разведениями тест-микроорганизмов.
4.1.7.3. В опытные ряды вносятся испытуемые наноматериалы. В контрольных содержатся только тест-микроорганизмы. Инкубируют опытные и контрольные пробирки в термостате при 37 °С в течение 72 ч.
4.1.7.4. По окончании инкубирования проводят высевы из тиогли-колевой среды опытных и контрольных серий на плотные питательные среды (Бактофок, MRS agar и среду Эндо) для подсчета выросших колоний микроорганизмов.
4.1.7.5. Сравнивают число колоний тест-микроорганизмов в опытных и контрольных рядах, результаты оформляют в виде таблицы.
Проверку морфологических, культуральных, ростовых и биохимических качеств тест-микроорганизмов проводят с использованием стандартных систем API Ana, API 20Е.
4.1.8. Обработка данных
Исследуют качество выросших тест-микроорганизмов из опытных и контрольных серий по следующим показателям:
• визуальные признаки роста типичных колоний;
• культуральные, морфологические и биохимические свойства.
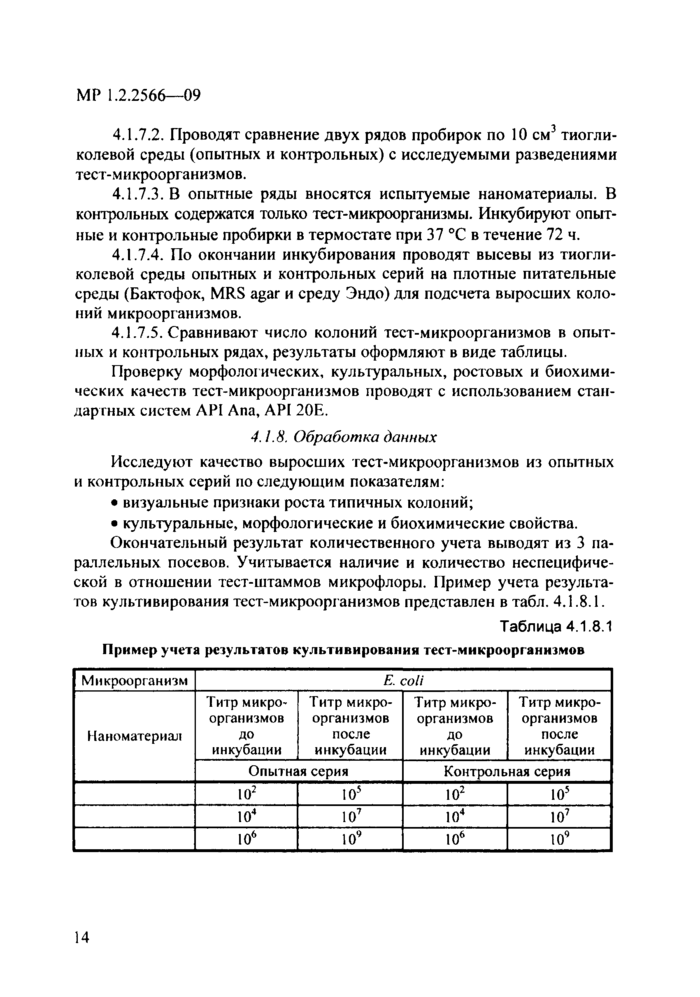
Окончательный результат количественного учета выводят из 3 параллельных посевов. Учитывается наличие и количество неспецифической в отношении тест-штаммов микрофлоры. Пример учета результатов культивирования тест-микроорганизмов представлен в табл. 4.1.8Л.
Таблица 4.1.8.1
|
Пример учета результатов культивирования тест-микроорганизмов |
|
Микроорганизм |
Е. coli |
|
|
Титр микро |
Титр микро |
Титр микро |
Титр микро |
|
|
организмов |
организмов |
организмов |
организмов |
|
Наноматериал |
до |
после |
ДО |
после |
|
|
инкубации |
инкубации |
инкубации |
инкубации |
|
|
Опытная серия |
Контрольная серия |
|
|
Ю2 |
105 |
102 |
105 |
|
|
104 |
107 |
ю4 |
107 |
|
|
106 |
109 |
ю6 |
109 |
|
MP 1.2.2566—09
Используются следующие критерии оценки воздействия нанопрепаратов на микрофлору:
• если количество КОЕ/мл тест-штаммов в средах с испытуемым наноматериалом и в средах без него достоверно не отличается, то делается вывод об отсутствии влияния испытуемой концентрации наноматериала в модели in vitro;
• в случае достоверного превышения КОЕ/мл тест-штаммов в средах с испытуемым наноматериалом и в средах без него не менее чем на один логарифмический порядок делается вывод о стимулирующем действии данного наноматериала в модели in vitro;
• в случае достоверного уменьшения КОЕ/мл тест-штаммов в средах с испытуемым наноматериалом и в средах без него не менее чем на один логарифмический порядок делается вывод об ингибирующем действии данного наноматериала в модели in vitro.
4.1.9. Представление результата
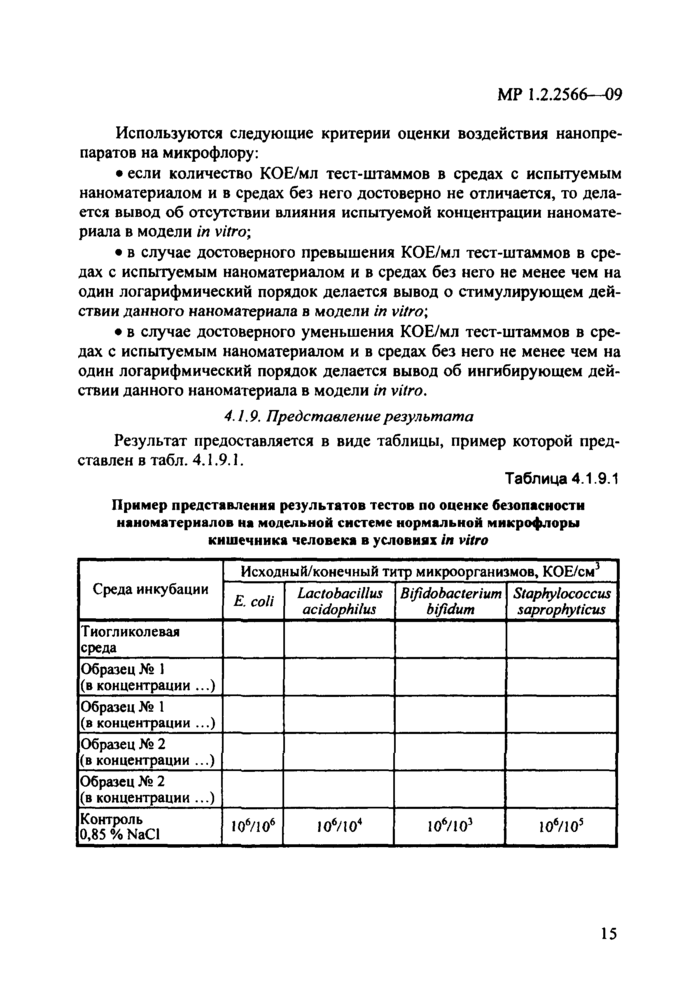
Результат предоставляется в виде таблицы, пример которой представлен в табл. 4.1.9.1.
Таблица 4.1.9.1
|
Пример представления результатов тестов по оценке безопасности наноматериалов на модельной системе нормальной микрофлоры кишечника человека в условиях in vitro |
|
Среда инкубации |
Исходный/конечный титр микроорганизмов, КОЕ/см |
|
Е. coli |
Lactobacillus
acidophilus |
Bifidobacterium
bifidum |
Staphylococcus
saprophyticus |
|
Тиогликолевая
среда |
|
|
|
|
|
Образец № 1 (вконцентрации ...) |
|
|
|
|
|
Образец № 1 (в концентрации ...) |
|
|
|
|
|
Образец № 2 (в концентрации ...) |
|
|
|
|
|
Образец № 2 (в концентрации ...) |
|
|
|
|
|
Контроль 0,85 % NaCl |
loVio6 |
о
| |
106/103 |
10‘/105 |
|
15
MP 1.2.2566—09
4.2, Метод оценки безопасности наноматериалов на модельной системе патогенной бактерии Chlamydia trachomatis
4.2. L Принцип метода
Безопасность наноматериалов в отношении влияния на рост патогенов оценивают по воздействию наночастиц на размножение этих микроорганизмов. В качестве модельного объекта используют культуру внутриклеточной патогенной бактерии Chlamydia trachomatis в условиях in vitro. Для оценки ингибирующего эффекта образцов наноматериалов на развитие С. trachomatis проводят анализ жизнеспособности этого патогена, культивируемого в присутствии различных концентраций наночастиц. Образцы наноматериалов в разных концентрациях одновременно с патогеном вносят в культуру клеток и проводят культивирование по стандартной методике. Эффект оценивают методом прямой иммунофлуоресценции и количественным методом на основе ИФА в сравнении с контрольным образцом (клетки, зараженные С. trachomatis без наночастиц).
В основе иммунофермснтного анализа лежит иммунная реакция антигена (Аг) с антителом (Ат), а присоединение к антителам ферментной метки позволяет учитывать результат реакции антиген-антитело по появлению ферментативной активности. Модификация метода для количественного учета хлам иди йной инфекции основана на выявлении антигена хламидий в составе хламидийных включений в культуре клеток, культивируемых в 96-луночной плашке. Величина оптической плотности, полученная после проведения стандартной реакции ИФА и учета результатов с помощью спектрофотометра, прямо пропорциональна уровню инфекции в определенных лунках. Измерение для каждого варианта проводится в 2 повторах. Положительным контролем является лунка, содержащая клетки, зараженные лабораторным штаммом хламидий в такой дозе, чтобы множественность инфекции (МОИ) составляла 1:1. Отрицательным контролем является лунка, содержащая клетки, зараженные лабораторным штаммом хламидий в дозе МОИ 1 : 1 и культивируемые в присутствии ингибирующей концентрации азитро-мицина (2 мг/см3). Исследуемым образцом является лунка, содержащая клетки, зараженные лабораторным штаммом хламидий в дозе с МОИ 1 : 1 и культивируемые в присутствии исследуемых наноматериалов в изучаемых концентрациях. Учет результатов проводится через 48 часов после заражения. Результаты количественного учета хламидийной инфекции выражают в процентах по отношению к положительному контролю.
MP 1.2.2566-09
4.2.2, Характеристика используемых организмов и тест-систем
Chlamydia trachomatis - патогенный для человека прокариотический микроорганизм, относится к III группе патогенности. Этот вид является возбудителем заболеваний с урогенитальной патологией, чаще всего передающихся половым путем. С. trachomatis также, как другие хламидии, имеет сложный жизненный цикл, который включает переход от элементарных телец к ретикулярным тельцам через промежуточные формы. Проникая в клетки организма хозяина путем эндоцитоза, хламидии персистируют в эпителиальных клетках, распространяясь по организму хозяина внутри моноцитов периферической крови. С. trachomatis паразитируют внутри вакуолей (фагосом) клетки-хозяина и препятствуют их слиянию с лизосомами, что предотвращает гибель патогена внутри клетки и приводит к длительному персистированию хламидий в макроорганизме.
В работе используют клеточную линию мышиных фибробластов McCoy, чувствительную к хламидийной инфекции.
4,2.3. Приборы и оборудование
Центрифуга с бакет- (горизонтальным) ротором с контейнерами для планшет Rotanta 460R фирмы «Hettich», Германия, или Jouan BR 3.111,
Франция, или аналогичная
Магнитная мешалка Heidolph MR 3001 или
аналогичная
Люминесцентный микроскоп ЛЮМАМ РПО 11,
МИКМЕД 2 с комбинацией фильтров СЗС24, БС8-3,
ФС-4 с зеленой боковой пластиной
Окуляры х 5, объектив для масляной иммерсии х 100
Инвертированный микроскоп Nicon eclipse TS 100
Окуляры C-W 10 х 5В/22, объектив х 20
Водяная баня с подогревом до 95 °С или
СВЧ-печь
Шкаф сушильный стерилизационный ШСС-80П ТУ 64-1-28-70—76 или аналогичный, позволяющий поддерживать температуру (160 ± 5) °С
Холодильник бытовой электрический ГОСТ 26678-85
Морозильная камера, обеспечивающая температуру (-70) °С
СОг-инкубатор Sanyo или аналогичный
17
MP 1.2.2566—09
Флаконы культуральные стерильные, объемом 100—200 см3
Флаконы культуральные стерильные фирмы Costar или аналогичные, площадь 25см2 Стерильные 96-луночные плоскодонные планшеты для клеточных культур фирмы Costar или аналогичные
Стерильные 24-луночные плоскодонные планшеты фирмы «Costar» или аналогичные Стерильные пластиковые пипетки, объемом 1,0,
2,0, 5,0, 10,0 см3
Покровные круглые стекла, диаметром 12—13 мм Весы лабораторные общего назначения
2-го класса точности ГОСТ 24104-2001
Мембранные установки для получения
деионизированной воды ОСТ 1-029.003—80
Анализатор потенциометрический
с погрешностью измерений pH ± 0,01 ГОСТ 27987-88
Облучатель бактерицидный настенный ОБН-150 ТУ 954-001-0492102—01 Дозаторы с переменным объёмом дозирования фирмы «Gilson»:
0,2—2,0 мм3 с шагом 0,01 мм3 и точностью ± 1,2 %;
2—20 мм3 с шагом 0,01 мм3 и точностью ± 0,8 %;
1—10 см3 с шагом 0,1 см3 и точностью ± 0,5 % или аналогичные
Дозаторы с переменным объёмом дозирования
фирмы «Ленпипет»: ТУ 9452-002-33189998—2002
0,5—10,0 мм3 с шагом 0,01 мм3 и точностью ± 0,8 %;
|
20—200 мм3 с шагом 0,1 мм3 и точностью + 0,6 %; 100—1 000 мм3 с шагом 1 мм3 и точностью ± 3 % Наконечники пластиковые, объемом 1—200 мм3 |
|
|
Наконечники пластиковые, объемом 200—1 000 мм3 |
|
|
Перчатки резиновые
Колбы плоскодонные конические разной |
ГОСТ 3-88 |
|
вместимости |
ГОСТ 1770-74 |
|
Цилиндры стеклянные мерные лабораторные, вместимостью 25, 100, 1 000 см3 |
ГОСТ 1770-74 |
|
Воронки стеклянные |
ГОСТ 25336-82 |
MP 1.2.2566—09
4.2.4. Материалы и реактивы
Среда RPMI 1640 с глутамином («ПанЭко»,
Москва) без антибиотиков, хранение при температуре 4 °С
Фетальная сыворотка крупного рогатого скота (Hyclone, США), хранение при -20 °С Раствор трипсина и раствор версена в соотношении 1:1, хранение при 4 °С
0,5 М раствор стерильной глюкозы. Приготовление раствора: 10,66 г глюкозы растворяют в 100 мл среды RPMI 1640, стерилизуют через фильтры Millipore (размер пор 0,45 мкм). Разливают по ампулам. Хранят при температуре -20 °С 0,2 %-й раствор циклогексимида (Koch Light Lab Ltd. Colnbrook Bucks, Англия). Приготовление раствора: 0,2 г циклогексимида растворяют в 100 мл среды RPMI 1640, фильтруют через фильтры Millipore (размер пор 0,45 мкм). Разливают по ампулам, хранят при температуре 4 °С Антибиотики: амфотерицин В (5 мкг/мл) и гентамицин (4 мкг/мл)
Родоспецифические моноклональные антитела к ЛПС Chlamydia (Хламоноскрин-1, ЗАО «Ниар-медик+», Москва)
0,1 М ФСБ (фосфатно-солевой буфер, pH 7,4)
Приготовление раствора: 6,8 г NaCl, 0,63 г КНР04, 1,48 г NaHP04 растворяют в 1 л дистиллированной НгО
1 %-й раствор БСА (бычий сывороточный альбумин, Sigma). Приготовление раствора: 1 г БСА растворить в 100 мл ФСБ 0,1 М ФСБ-Т (фосфатно-солевой буфер, pH 7,4 с 0,1 % Твина-20 (по объему),
0,3 %-й раствор тетраметилбензидина (ТМБ)
Стоп-реагент (12,5 %-й раствор серной кислоты)
Этанол 96 %
Допускаются к использованию реагенты и материалы аналогичного назначения других изготовителей, разрешенные к применению в уста-
19
ББК51.2
093
093 Оценка безопасности наноматериалов in vitro и в модельных системах in vivo: Методические рекомендации.—М: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010.—71с.
ISBN 978—5—7508—0881—6
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Г. Г. Онищенко); Учреждением Российской академии медицинских наук Научно-исследовательским институтом питания РАМН (В. А. Тутельян, И. В. Гмошинский, С. А. Хотимченко, С. А. Шевелева, Н. Р. Ефимочкина, И. В. Аксенов, Е. А. Арманова, В. В. Бессонов,
В. М. Верников, М. М. Гаппаров, Р. В. Распопов, О. И. Передеряев, О. Н. Та-нанова); Учреждением Российской академии медицинских наук Научно-исследовательским институтом эпидемиологии и микробиологии им. Почетного академика Н. Ф. Гамалеи РАМН (А. Л. Гинцбург, Б. С. Народицкий, М. М. Шма-ров, Д. Ю. Логунов, Л. Н. Нестеренко, Н. А. Зигангирова, Ю. М. Романова,
А. Ф. Мороз, М. В. Мезенцева, Д. В. Щебляков, И. Л. Тутыхина, Л. В. Чере-нова, А. И. Тухватулин, И. Ю. Грибова); Учреждением Российской академии наук Институтом проблем экологии и эволюции им. А. Н. Северцова РАН (Д. С. Павлов, Ю. Ю. Дгебуадзе, Е. С. Бродский, Е. Ю. Крысанов, Т. Б. Демидова, А. В. Купцов, Л. А. Пел ьгу нова); Государственным учеб но-научным учреждением Биологический факультет Московского государственного университета им. М. В. Ломоносова (М. П. Кирпичников, К. В. Шайтан, А. П. Бонар-цев, А. В. Феофанов); Центром «Биоинженерия» РАН (К. Г. Скрябин); Учреждением Российской академии наук Институтом биохимии им. А. Н. Баха РАН (В. О. Попов, Б. Б. Дзантиев, А. В. Жердев, Н. В. Голуб); Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт метрологической службы» (ФГУП ВНИИМС) (С. А. Ко-ноногов, С. С. Голубев); ООО «Интерлаб» (А. Н. Веденин, Г. В. Казыдуб).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 03.12.09 № 3).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации Г. Г. Онищенко ! 0 декабря 2009 г.
4. Введены в действие 10 декабря 2009 г.
5. Введены впервые.
ББК 51.2
ISBN 978—5—7508—0881—6
© Роспотребнадзор, 2010 О Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010
MP 1.2.2566—09
новленном порядке и с характеристиками, обеспечивающими проведение исследований в соответствии с данным документом.
4.2.5. Стандартные образцы наноматериалов
При калибровке метода используют стандартные образцы наноматериалов согласно п. 4.1.5.
4.2.6. Методика введения тестируемого образца
Готовят серию 5-кратных разведений образцов наноматериалов от известной исходной концентрации в среде для культивирования клеток (RPMI 1640 с 10% эмбриональной сыворотки). В лунки планшета, содержащие монослой клеток мышиных фибробластов McCoy, вносят дозатором приготовленные разведения наноматериалов в объеме, составляющем 10 % от общего объема культуральной среды в лунке планшета. Внесение образцов наноматериалов проводят одновременно с заражением монослоя культурой С. trachomatis.
4.2.7. Методика проведения анализа методом прямой иммунофлуоресценции
4.2.7.1. Культивирование клеток McCoy.
Клетки мышиных фибробластов McCoy культивируют в среде роста RPMI 1640 с 10% эмбриональной сыворотки, амфотерицином В (5 мкг/мл) и гентамицином (4 мкг/мл) во флаконах площадью 25 см2. При пересевах культуры клеток мышиных фибробластов культуральную среду роста сливают, добавляют 5 мл раствора версена с трипсином (в соотношении 1 : 1) и инкубируют при комнатной температуре 7 мин. Раствор версена с трипсином сливают и суспендируют клетки фибробластов в 2 мл среды RPMI 1640. Готовят взвесь клеток с концентрацией 1,2 х 105 клеток/мл в культуральной среде 1640 с 10 % эмбриональной сыворотки, амфотерицином В (5 мкг/мл) и гентамицином (4 мкг/мл) и вносят по 1 мл в каждую лунку культурального планшета с круглыми покровными стеклами. Инкубируют планшет в течение 24 ч в С02-инкубаторе при температуре 37 °С до образования монослоя фибробластов.
4.2.7.2. Заражение монослоя клеток мышиных фибробластов McCoy культурой С. trachomatis и внесение образцов наноматериалов.
Культуральную среду из лунок, содержащих монослой клеток мышиных фибробластов, удаляют и вносят дозатором в каждую лунку культуру С. trachomatis в дозе 1 ВОЕ (включение образующих единиц) на 1 клетку. Серию 5-кратных разведений образцов наноматериалов в
20
MP 1.2.2566—09Содержание
Введение..........................................................................................................................................4
1. Область применения..................................................................................................................5
2. Нормативные ссылки.................................................................................................................6
3. Общие положения......................................................................................................................7
4. Оценка безопасности наноматериалов в модельных системах in vitro, содержащих
культуры микроорганизмов...................................................................................................II
4.1. Метод оценки безопасности наноматериалов в модельной системе нормальной
микрофлоры кишечника человека в условиях in vitro................................................11
4.2. Метод оценки безопасности наноматериалов на модельной системе патогенной
бактерии Chlamydia trachomatis.....................................................................................16
4.3. Метод оценки безопасности наноматериалов на модельной системе условно
патогенной бактерии Pseudomonas aeruginosa.............................................................23
4.4. Метод оценки безопасности наноматериалов на модельной системе
дрожжеподобных грибов Candida albicans в условиях in vitro...................................26
5. Метод оценки безопасности наноматериалов на модельной системе взаимодействия
с поверхностными рецепторами эукариотических клеток в условиях in vitro 30
5.1. Принцип метода................................................................................................................30
5.2. Характеристика используемых организмов и тест-систем..........................................30
5.3. Приборы и оборудование................................................................................................31
5.4. Материалы и реактивы....................................................................................................32
5.5. Стандартные образцы наноматериалов.........................................................................33
5.6. Методика введения проб.................................................................................................33
5.7. Методика проведения анализа................................................................................. 33
5.8. Обработка полученных данных......................................................................................35
5.9. Статистическая обработка данных.................................................................................35
5.10. Представление результата.............................................................................................35
6. Оценка безопасности наноматериалов in vivo в тестах на гидробионтах 36
6.1. Метод оценки безопасности наноматериалов по гибели ракообразных Daphnia
magna Straus......................................................................................................................37
6.2. Метод тестирования безопасности наноматерилов по гибели ракообразных
Ceriodaphnia affinis Lilljeborg.........................................................................................42
6.3. Метод тестирования безопасности наноматериалов по выживаемости и
плодовитости ракообразных Ceriodaphnia alrtnis Lilljeborg.......................................46
6.4. Метод тестирования безопасности наноматериалов по гибели рыб
Nothobranchius rachovi и Danio rerio..............................................................................48
7. Метод оценки безопасности наноматериалов по их цитокин-моделирующей
активности in vivo 51
7.1. Принцип метода................................................................................................................51
7.2. Характеристика используемых организмов и тест-систем..........................................51
7.3. Приборы и оборудование................................................................................................52
7.4. Материалы и реактивы....................................................................................................53
7.5. Стандартные образцы наноматериапов.........................................................................54
7.6. Животные, их содержание и рацион..............................................................................54
7.7. Методика введения тестируемого образца....................................................................54
7.8. Методика отбора биопроб...............................................................................................55
7.9. Методика проведения анализа............................. 55
7.10. Обработка полученных данных....................................................................................57
7.11. Представление результата.............................................................................................58
Приложение 1. Алгоритм установления характеристик погрешности методик
биотестирования................................................................................................60
Приложение 2. Алгоритм установления средней эффективной (летальной)
концентрации наноматериала..........................................................................68
Приложение 3. Список использованных сокращений.............................................................71
3
MP 1.2.2566—09
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
10 декабря 2009 г.
Дата введения: 10 декабря 2009 г.
1.2. ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Оценка безопасности наноматериалов in vitro и в модельных системах in vivoМетодические рекомендации _МР 1,2,2566—09_Введение
Использование нанотехнологий и наноматериалов рассматривается в настоящее время как новая промышленная революция, происходящая в XXI веке. Уникальные свойства, которые приобретают вещества традиционного химического состава в форме наночастиц, открывают широкие перспективы в целенаправленном получении материалов с новыми свойствами, такими как уникальная механическая прочность, особые спектральные, электрические, магнитные, химические, биологические характеристики.
В ближайшей перспективе следует ожидать во всём мире и, в частности, в России резкого увеличения объёмов производства ряда приоритетных наноматериалов, таких как наночастицы оксидов кремния, титана, цинка, железа, церия, алюминия, металлические наночастицы железа, меди, кобальта, никеля, алюминия, серебра, золота, углеродные нанотрубки, фуллерены, наночастицы биополимеров и рекомбинантных вирусов. Это с неизбежностью приведёт к поступлению значительных количеств наноматериалов в окружающую среду, их накоплению в компонентах биоты и абиотических средах с последующей возможной передачей человеку.
В настоящее время накоплен значительный экспериментальный материал относительно возможных вредных воздействий некоторых наноматериалов на живые организмы. Однако большинство исследований по
MP 1.2.2566—09
изучению токсического действия наночастиц и наноматериалов выполнено на большом числе разнообразных, недостаточно стандартизированных методик и тест-систем, результаты которых часто не сопоставимы. В связи с этим большое значение приобретает разработка системы стандартных тестов, позволяющих оценивать безопасность новых искусственных наноматериалов по их воздействию на показатели жизнедеятельности избранных биологических систем, в роли которых выступают патогенные, условно-патогенные и симбиотические микроорганизмы, культуры клеток высших животных, репрезентативные компоненты водных биоценозов (ракообразные, рыбы), организмы млекопитающих.
Настоящие методические рекомендации разработаны в рамках реализации Федеральной целевой программы «Развитие инфраструктуры наноиндустрии в Российской Федерации на 2008—2010 гг.» в целях внедрения единого, научно обоснованного подхода к оценке безопасности искусственных наноматериалов.
1. Область применения
1.1. Настоящие методические рекомендации используются при проведении тестирования безопасности наночастиц и наноматериалов искусственного происхождения на модельных биологических объектах, включая культуры симбиотических, условно-патогенных и патогенных микроорганизмов, культуры клеток различных тканей высших животных, гидробионты (ракообразные, рыбы), организмы лабораторных животных.
1.2. Положения, изложенные в настоящих методических рекомендациях, применяются в ходе установления безопасности наноматериалов на стадиях их производства, оборота и использования в Российской Федерации в целях принятия решений по оценке рисков, связанных с данными процессами.
1.3. Методические рекомендации разработаны с целью обеспечения единства измерений и адаптации имеющихся методов и средств измерений в ходе оценки безопасности наноматериалов искусственного происхождения.
1.4. Методические рекомендации предназначены для специалистов учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также научно-исследовательских организаций гигиенического профиля, медицинских учебных заведений и иных организаций и учреждений, занимающихся вопросами оценки безопасности наноматериалов.
5
MP 1.2.2566—09
2. Нормативные ссылки
2.1. Федеральный закон Российской Федерации от 30 марта 1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2.2. Федеральный закон Российской Федерации от 02 января 2000 г. № 29-ФЗ «О качестве и безопасности пищевых продуктов».
2.3. Федеральный закон Российской Федерации от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании».
2.4. Федеральный закон Российской Федерации от 10 января 2002 г. № 7-ФЗ «Об охране окружающей среды».
2.5. Постановление Правительства Российской Федерации от 21 декабря 2000 г. № 987 «О государственном надзоре и контроле в области обеспечения качества и безопасности пищевых продуктов».
2.6. Постановление Правительства Российской Федерации от 21 декабря 2000 г. № 988 «О государственной регистрации новых пищевых продуктов, материалов и изделий».
2.7. Постановление Правительства Российской Федерации от 18 мая 2002 г. № 320 «О подписании Российской Федерацией Стокгольмской конвенции о стойких органических зшрязнителях».
2.8. Постановление Главного государственного санитарного врача Российской Федерации от 23 июля 2007 г. № 54 «О надзоре за продукцией, полученной с использованием нанотехнологий и содержащей наноматериалы».
2.9. Постановление Главного государственного санитарного врача Российской Федерации от 31 октября 2007 г. № 79 «Об утверждении Концепции токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов».
2.10. МУ 1.2.2520—09 «Токсиколого-гигиеническая оценка наноматериалов».
2.11. Приказ Министерства здравоохранения СССР от 12 августа 1977 г. № 755 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных».
2.12. Приказ Министерства здравоохранения Российской Федерации от 19 июня 2003 г. № 267 «Об утверждении Правил лабораторной практики» (зарегистрирован Минюстом России 25.06.03 № 4809).
2.13. Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 19 июля 2007 г. №224 «О санитарно-эпидемиологических экспертизах, обследованиях, исследованиях, испытаниях и токсикологических, гигиенических и иных видах оценок» (зарегистрирован Минюстом России 20.07.07 № 9866).
6
MP 1.2.2566—09
2.14. Методические указания по разработке нормативов предельно допустимых вредных воздействий на водные объекты. Утверждены Первым заместителем Министра природных ресурсов Российской Федерации и Первым заместителем Председателя Государственного Комитета Российской Федерации по охране окружающей среды от 26 февраля 1999 г.
3. Общие положения
3.1. Проведение исследований по определению безопасности наноматериалов на модельных биологических тест-системах определяется правилами надлежащей лабораторной практики.
3.2. Стандартные наноматериалы.
3.2.1. Для верификации, стандартизации и калибровки методов, применяемых при определении безопасности наноматериалов на модельных биологических тест-системах используются стандартные образцы наноматериалов (стандарты).
3.2.2. Каждый стандартный образец наноматериала должен быть охарактеризован по показателям химического состава (включая наличие примесей), размеру и форме частиц, удельной площади поверхности, типу кристаллической структуры. Указанные характеристики определяются с использованием методов масс-спектрометрии с индуктивно связанной плазмой, трансмиссионной электронной микроскопии, определения изотерм адсорбции инертных газов, рентгенофазового (рентгено-дифракционного) анализа. В случае стандартных образцов фуллеренов следует использовать метод обращённофазной ВЭЖХ.
3.2.3. Каждый стандартный образец наноматериала должен быть снабжён «Паспортом безопасности наноматериалов», который должен быть составлен в соответствии с ГОСТ 30333-95 «Паспорт безопасности вещества (материала)».
3.2.4. Стандартные образцы наноматериалов должны быть упакованы для защиты при транспортировке от загрязнения или порчи.
3.2.5. Хранение стандартных образцов наноматериалов осуществляется отдельно от остальных применяемых веществ с соблюдением условий хранения, указанных в «Паспорте безопасности» на протяжении всего срока годности образца.
3.2.6. Хранение и использование стандартных образцов наноматериалов осуществляется в соответствии с утвержденным протоколом исследования.
3.3. Используемое оборудование.
7
MP 1.2.2566—09
3.3.1, Организации, проводящие определение безопасности наноматериалов на модельных биологических тест-системах, должны быть оснащены необходимым оборудованием, прошедшим метрологический контроль и калибровку в установленном порядке,
3.3.2. Эксплуатация оборудования проводится в соответствии с техническим паспортом и инструкцией по применению. Результаты проведения калибровки и текущего ремонта оборудования фиксируются в специальном журнале, доступном в любое время сотрудникам, эксплуатирующим оборудование или обеспечивающим его обслуживание.
3.4. Планирование и проведение исследований.
3.4.1. Определение безопасности наноматериалов на модельных биологических тест-системах проводится по утвержденному плану с ведением протокола и составлением отчета, в который заносятся все результаты исследований.
3.4.2. Тесты по определению безопасности наноматериалов, требующие использования лабораторных животных, проводятся только на здоровых животных, прошедших карантин.
3.4.3. Помещения для лабораторных животных должны обеспечивать изоляцию (карантин) поступающих животных, больных животных и животных, подозреваемых в носительстве инфекций; позволять осуществлять раздельное содержание различных видов животных и животных одного вида; соответствовать санитарно-эпидемиологическим и ветеринарным требованиям.
3.4.4. Корма, оборудование и инвентарь для ухода за животными необходимо хранить в помещениях, изолированных от мест содержания животных.
3.4.5. Исследования безопасности наноматериалов на животных проводятся в соответствии с установленными правилами. Исполнителем должен быть обеспечен контроль за соблюдением правовых и этических норм использования лабораторных животных в соответствии с утверждённым протоколом (п. 3.4.7).
3.4.6. Корма и вода для животных должны обеспечивать пищевые потребности в соответствии с протоколом исследования и действующими нормативными документами.
3.4.7. Данные исследования безопасности наноматериалов на модельных биологических тест-системах заносятся в протокол, в котором отражены цели работы и методы, используемые в работе. Протокол исследования утверждается руководителем организации, проводящей исследования, и включает: цель и задачи исследования, имеющиеся сведения о тестируемом наноматериале (физические, химические, биологические, токсикологические свойства), используемые стандарты, схему про-
MP 1.2.2566—09
ведения тестирования и её обоснование, методы введения наноматериала в биологический объект, применяемые дозы наноматериала, методы исследования, определяемые показатели, результаты исследований, метрологическую характеристику анализа, статистическую обработку результатов исследования, заключение, список используемой литературы.
3.4.8. Вносимые в протокол исследования изменения и отклонения от протокола (незапланированные события, непредвиденные обстоятельства и т. д.) записываются, пронумеровываются, подписываются руководителем исследования, датируются в приложении с указанием причин и утверждаются руководителем организации.
3.5. Оформление отчета.
3.5.1. По окончании проведенных исследований безопасности наноматериалов на модельных биологических тест-системах оформляется отчет, в котором должны быть представлены: название, адрес организации, даты начала и завершения исследований, цель и задачи исследования; характеристика тестируемого наноматериала, включая имеющиеся сведения о физических, химических, биологических, токсикологических свойствах; перечень протестированных образцов наноматериала и применяемых стандартов, метод введения наноматериала в биологический объект, схема проведения исследования, описание методов статистической обработки результатов, результаты исследования, представленные в виде обобщающих таблиц, рисунков с соответствующей статистической обработкой, обсуждение результатов, выводы, список использованной литературы.
3.5.2. Отчет о результатах проведенного исследования составляется ответственным исполнителем, утверждается руководителем организации и скрепляется печатью организации.
3.6. Система обеспечения качества исследований по определению безопасности наноматериалов на модельных биологических тест-системах.
3.6.1. Контроль за качеством проведения исследований по определению безопасности наноматериалов на модельных биологических тест-системах включает в себя оформление перечня исследований, проводимых в организации, с указанием для каждого исследования руководителя и заказчика, названия определяемого наноматериала, даты начала и состояния каждого исследования на текущий момент времени, оценку протоколов и методов исследования на соответствие правилам лабораторной практики, мониторинг текущих исследований, отчет о проведенных проверках и рекомендации по устранению недостатков.
3.6.2. Для осуществления контроля качества руководитель организации, проводящей тестирование безопасности наноматериалов на мо-
9