Методические рекомендации 10-5ФЦ/2557
Качественное и количественное определение генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания и пищевом сырье с использованием "сухих" наборов реагентов серии "RT-ПЦР-ядро"
Купить Методические рекомендации 10-5ФЦ/2557 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации подготовлены для выявления и количественного определения генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания и пищевом сырье методом ПЦР в режиме реального времени с помощью "сухих" наборов реагентов серии "RT-ПЦР-ядро" производства ООО "Компания "Биоком". Методические рекомендации предназначены для применения в лабораторных организаций Роспотребнадзора, осуществляющих контроль за качеством и безопасностью продовольственного сырья и пищевых продуктов, в т.ч. импортируемых в Российскую Федерацию, в лабораториях других организаций, аккредитованных в установленном порядке.
Оглавление
1. Общие положения и область применения
2. Нормативные ссылки
3. Сущность метода
3.1. Качественное определение ГМИ
3.2. Количественное определение ГМИ
4. Получение результатов при проведении ПЦР в режиме реального времени
5. Особенности проведения работ в ПЦР-лаборатории, в которой используется метод ПЦР в режиме реального времени
5.1. Помещение лаборатории
5.2. Оборудование
5.3. Требования к проведению исследований
5.4. Требования к персоналу
6. Аппаратура, материалы и реагенты
6.1. Аппаратура и материалы
6.1. Реагенты
7. Отбор, хранение и подготовка проб пищевых продуктов для анализа
7.1. Отбор и подготовка к анализу жидких и полужидких материалов исследования (соусы, пасты, майонезы и пр.)
7.2. Отбор и подготовка к анализу сухих сыпучих материалов исследования (мука, белковый изолят и пр.)
7.3. Отбор и подготовка к анализу материалов исследования плотной консистенции (колбаса, сыр, растительные ткани, чипсы, поп-корн, соевый шрот, фуражная кукуруза и пр.)
7.4. Условия хранения и транспортирования образцов
8. Порядок проведения исследования
8.1. Выделение ДНК из образцов продуктов и сырья с использованием набора реагентов серии "Silica"
8.2. Качественное определение генетически модифицированной ДНК методом ПЦР в режиме реального времени
8.3. Количественное определение генетически модифицированной ДНК сои линии 40-3-2 методом ПЦР в режиме реального времени
9. Интерпретация результатов анализа
9.1. Качественное определение ГМИ
9.2. Количественное определение ГМИ
Приложение 1. Характеристики амплификатора Smart Cycler II, которые являются существенными при его использовании для проведения массовых исследований
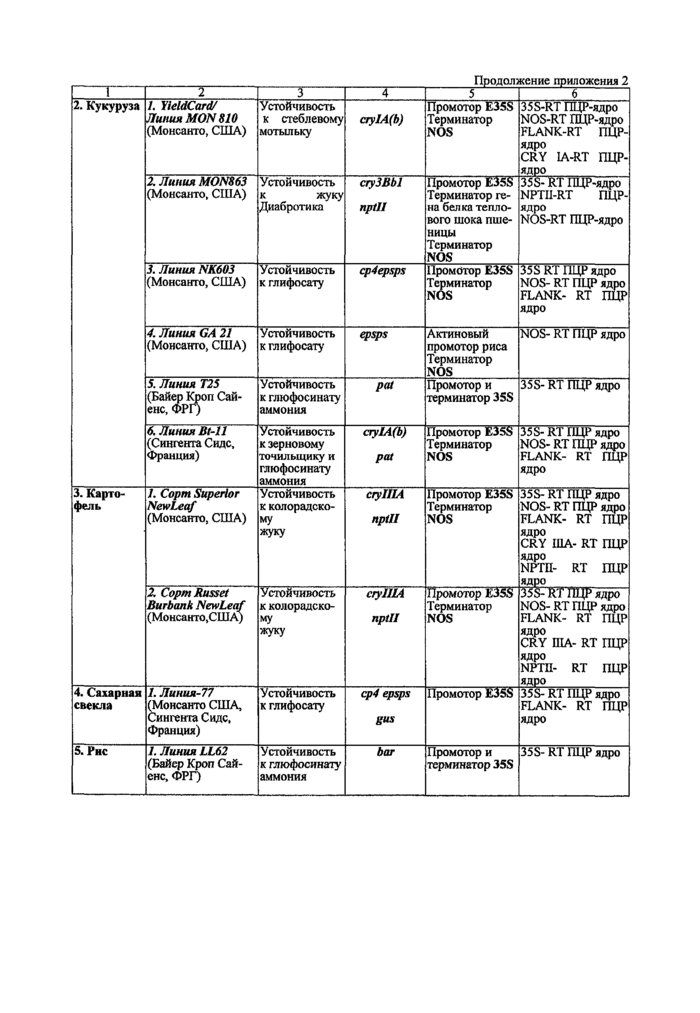
Приложение 2. Характеристики генетически-модифицированных растений, зарегистрированных Минздравом России и разрешенных для применения в пищевой промышленности и реализации населению
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- МУК 4.2.1902-04 Определение генетически модифицированных источников (ГМИ) растительного происхождения методом полимеразной цепной реакции
- СанПиН 2.3.2.1078-01 Гигиенические требования безопасности и пищевой ценности пищевых продуктов
- МУ 1.3.1888-04 Организация работы при исследованиях методом ПЦР материала, инфицированного патогенными биологическими агентами III - IV групп патогенности
- МУК 4.2.1913-04 Методы количественного определения генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания
- Федеральный закон 29-ФЗ О качестве и безопасности пищевых продуктов
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7
стр. 8

стр. 9

стр. 10

стр. 11
стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18
стр. 19
стр. 20
стр. 21

стр. 22
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
Федеральное государственное учреждение здравоохранения «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора
КАЧЕСТВЕННОЕ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ ИСТОЧНИКОВ (ГМИ) РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ В ПРОДУКТАХ ПИТАНИЯ И ПИЩЕВОМ СЫРЬЕ С ИСПОЛЬЗОВАНИЕМ «СУХИХ» НАБОРОВ РЕАГЕНТОВ СЕРИИ «RT-ПЦР-ЯДРО»
Федеральное государственное учреяедение здравоохранения «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора
Качественное и количественное определение генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания и пищевом сырье с использованием «сухих» наборов реагентов серии «RT-ПЦР-ядро»
Методические рекомендации № 10-5ФЦ/2557
ной пробы к другой с целью предотвращения перекрестной контаминации в процессе выделения ДНК и приготовления реакционной смеси.
5.3.3. Использованные наконечники для автоматических пипеток, пробирки и другие загрязненные ДНК материалы необходимо обработать реагентами, вызывающими разрушение ДНК.
5.3.4. Необходимо строго соблюдать условия хранения всех используемых реагентов, указанные в прилагаемой к набору инструкции. Образцы ДНК и анализируемый материал должны храниться отдельно от реагентов. Запрещается использовать реагенты с просроченным сроком годности или хранившиеся в ненадлежащих условиях.
5.3.5. Необходимо постоянно поддерживать чистоту на рабочем месте. Во всех помещениях ПЦР-лаборатории должна регулярно проводиться ежедневная влажная уборка. Рабочие поверхности столов перед началом и по окончании работ должны быть обработаны соответствующими реагентами или ультрафиолетовым излучением для деградации ДНК.
5.4. Требования к персоналу
5.4.1. Персонал, работающий в ПЦР-лаборатории, где используется метод ПЦР в режиме реального времени, должен пройти соответствующее обучение.
6. Аппаратура, материалы и реагенты
6.1. Аппаратура и материалы
6.1.1. Программируемый термостат (амплификатор) с детекцией ПЦР-продукта в реальном времени; Smart-Cycler®Il (Cepheid, USA) с принадлежностями. Характеристики приведены в Таблице 1.
6.1.2. Микроцентрифуга-вортекс ТЭТА-2 (скорость вращения 250— 3 ООО об./мин).
6.1.3. Центрифуга настольная для микропробирок (скорость вращения 10 ООО об./мин /5 ООО g).
6.1.4. Термостат «ТЕРМО 24-15» для микропробирок объемом 0,5 мл/1,5 мл.
6.1.5. Охладитель проб для микропробирок объемом 0,5 мл/1,5 мл.
6.1.6. Холодильник бытовой электрический ГОСТ 26678.
6.1.7. Система получения деионизованной воды.
6.1.8. Облучатель бактерицидный.
6.1.9. Микродозаторы одноканальные переменного объема:
5—50 мкл с шагом 0,5 мкл, с точностью ± 3,0 ± 0,6 %;
20—200 мкл с шагом 1,0 мкл, с точностью ± 3,0 ± 0,6 %;
100—1 000 мкл с шагом 5,0 мкл, с точностью ± 1,5 ± 0,5 %.
6.1.10. Штативы «рабочее место» для микропробирок объемом 1,5 мл/ 0,5 мл/ 0,2 мл.
6.1.11. Штативы-контейнеры для хранения образцов в микропробирках объемом 1,5 мл.
6.1.12. Контейнер для сброса наконечников.
6.1.13. Пробирки полипропиленовые конические объемом 1,5 мл.
10
6.1.14. Пробирки полипропиленовые для Smart-Cycler с герметичными крышками, объемом 25 мкл.
6.1.15. Наконечники для микродозаторов в штативе.
6.1.16. Перчатки резиновые или латексные неопудренные.
6.1.17. Пинцеты медицинские ГОСТ 21241-89.
6.1.18. Скальпели хирургические.
6.1.19. Ступки фарфоровые с пестиками.
6.1.20. Цилиндр стеклянный мерный лабораторный на 100 мл ГОСТ 1770-74.
6.1.21. Пестики-гомогенизаторы для конических пробирок объемом 1,5 мл. Допускается использование аналогичного оборудования с характеристиками
не хуже указанных.
|
Таблица 1 Характеристика программируемого термостата (амплификатора) с детекцией ПЦР-продукта в реальном времени Smart-CyclerCDII (Cepheid, USA) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
6.2. Реагенты
6.2.1. Набор реагентов серии «Silica» для выделения ДНК из образцов продуктов питания или растительного сырья. Набор рассчитан на выделение ДНК из 100 проб, включая контрольные образцы.
6.2.2. Наборы реагентов для ПЦР с детекцией в режиме реального времени:
- «ЗЗБ^Т-ПЦР-ядро» предназначен для выявления 35S промотора,
- «NOS- RT-ПЦР-ядро» предназначен для выявления NOS терминатора,
- «FLANK- RT-ПЦР-ядро» предназначен для одновременного выявления 35S промотора и NOS терминатора,
- «CRY-RT- ПЦР-ядро» предназначен для выявления гена cry Mb,
U
Все наборы рассчитаны на постановку 100 реакций, включая контрольные образцы.
- <<СР4-££С-КТ-ПЦР-ядро>> предназначен для количественного определения ГМ ДНК сои линии 40-3-2, рассчитан на постановку 50 реакций, включая контрольные образцы.
Все наборы хранятся при температуре 4°С .
6.2.3. Реагенты, разрешенные к применению и вызывающие деградацию ДНК(Дезолон ипр.).
6.2.4. Спирт этиловый ректифицированный ГОСТ Р 51652-2000.
6.2.5. Вода дистиллированная ГОСТ 6709-72.
7. Отбор, хранение и подготовка проб пищевых продуктов для анализа
Для исследования пищевых продуктов растительного и смешанного происхождения, растительных кормов и продовольственного сырья на наличие ГМ ДНК (качественный анализ) и определения ее количества (количественный анализ) отбор образцов для исследования производят таким образом, чтобы не происходила перекрестная контаминация (загрязнение одного образца другим). Для этого отбор производят в перчатках, а инструменты, используемые для отбора и измельчения материала, используются однократно или обрабатываются моющими средствами, стерилизуются в пламени спиртовки (газовой горелки) и используются после охлаждения на воздухе до комнатной температуры.
Отбор проб проводят по государственным стандартам, устанавливающим порядок отбора проб для однородных групп пищевой продукции: ГОСТ 5904-82, 9163—90, 12292—2000, 10852—86, 12430—66, 13979—86, 26313—84,
22617.0—77, 27668—88, 26312.1—84, 9792—73, 7631—85.
7.1. Отбор и подготовка к анализу жидких и полужидких материалов исследования (соусы, пасты, майонезы и пр.)
7.1.1. Содержимое каждой из десяти упаковок анализируемого материала, принадлежащих к одной партии, тщательно перемешивают при помощи одноразового шпателя.
7.1.2. Отбирают от каждой упаковки по 1 000 мкл содержимого,
7.1.3. Переносят каждую аликвоту в одноразовую пластиковую пробирку объемом 15 мл и тщательно перемешивают, формируя таким образом объединенную пробу (10 мл).
7.1.4. Из этой пробы отбирают при помощи автоматического дозатора среднюю пробу в 1 мл, которую помещают в одноразовую микропробирку объемом 1,5 мл, опечатывают и отправляют на анализ.
7.1.5. В качестве лабораторной пробы для проведения выделения ДНК используют 100—150 мкл, отобранные из средней пробы в одноразовую микропробирку объемом 1,5 мл при помощи микродозатора.
7.2, Отбор и подготовка к анализу сухих сыпучих материалов исследования (мука, белковый изолят и пр.)
7.2.1. Из исследуемой партии отбирают не менее 10 навесок по 5—10 г каящая, которые помещают в одноразовый полиэтиленовый пакет размером 20 х 30 см и
12
перемешивают при помощи одноразового шпателя, формируя объединенную пробу (50—100 г).
7.2*2. Из этой пробы отбирают среднюю пробу в 10 г, которую помещают в герметично закрывающийся контейнер, опечатывают и отправляют на анализ. Если средняя проба не является гомогенной или мелкоизмельченной, то перед началом проведения анализа ее необходимо поместить в фарфоровую ступку и растереть фарфоровым пестиком до однородного мелкодисперсного гомогенного состояния.
7.2.3. В качестве лабораторной пробы для проведения выделения ДНК используют 75—100 мкл по насыпному объему, отобранные из средней пробы в одноразовую микропробирку объемом 1,5 мл при помощи одноразового шпателя.
7.3. Отбор и подготовка к анализу материалов исследования плотной консистенции (колбаса, сыр, растительные ткани, чипсы, поп-корн, соевый шрот, фуражная кукуруза и пр.)
7.3.1. Из исследуемой партии отбирают не менее 10 навесок по 5—10 г каждая, которые помещают в одноразовый полиэтиленовый пакет размером 20 х 30 см и перемешивают при помощи одноразового шпателя, формируя объединенную пробу (50—100 г).
7.3.2. Из объединенной пробы отбирают среднюю пробу весом 10 г, которую помещают в герметично закрывающийся контейнер, опечатывают и отправляют на анализ.
7.3.3. Перед началом проведения анализа среднюю пробу измельчают при помощи скальпеля (ножниц), помещают в фарфоровую ступку и растирают фарфоровым пестиком до однородного мелкодисперсного гомогенного состояния.
7.3.4. В качестве лабораторной пробы для проведения выделения ДНК используют 100—150 мкл по насыпному объему, отобранные из гомогенной средней пробы в одноразовую микропробирку объемом 1,5 мл при помощи одноразового шпателя.
7.4. Условия хранения и транспортирования образцов
7.4.1. Образцы исследуемого материала хранят в течение 1 месяца (при необходимости повторного анализа) согласно условиям, указанным производителем.
7.4.2. Транспортирование образцов осуществляют при температуре, рекомендованной для их хранения. Длительность транспортирования не должна превышать сроков годности исследуемого материала.
8. Порядок проведения исследования
8.1. Выделение ДНК из образцов продуктов и сырья с использованием набора реагентов серии «Silica»
Ответственным этапом при проведении ПЦР анализа на наличие в пробе ГМ ДНК является выделение ДНК. Использование наборов реагентов для выделения ДНК на сорбентах позволяет исключить из процесса вредные для здоровья
13
человека вещества и стандартизировать выход ДНК. Сущность данной методики заключается в том, что тотальная растительная ДНК, полученная в результате клеточного лизиса, связывается с сорбентом, и в таком состоянии проходит стадии очистки, а затем при помощи элюции переходит в раствор.
8.1.1. Отбирают необходимое количество одноразовых пробирок, включая отрицательный контроль выделения ДНК. В пробирки, предназначенные для исследуемых проб, внести образцы исследуемых проб (см. раздел 7).
8.1.2. Содержимое флаконов из набора для выделения с концентратами буферов ОБ 1 и ОБ 2 доводят до 50 мл 95—96 %-м этиловым спиртом (ректификат) в мерном цилиндре, переливают назад во флакон и перемешивают путем переворачивания плотно закрытых флаконов 5—6 раз. Хранят рабочие растворы ОБ 1 и ОБ 2 в плотно закрытых флаконах при температуре 4 °С.
8.1.3. В каждую пробирку с исследуемой пробой вносят 400 мкл лизирующего буфера ЛБ и гомогенизируют с помощью микрогомогенизатора (в случае кристаллизации буфера ЛБ перед употреблением его необходимо подогреть в термостате при 50—60 °С и перемешать до полного растворения осадка).
8.1.4. Пробу инкубируют в термостате 30 мин при 65°С. Содержимое пробирки перемешивают на микроцентрифуге-вортексе. В случае, когда содержимое пробирки затвердело во время инкубации в термостате, в эту же пробирку добавляют 300 мкл (при необходимости до 1 000 мкл) буфера ЛБ и тщательно перемешивают на микроцентрифуге-вортексе. Затем пробу центрифугируют 10 мин при 10 000 об./мин (5 000—6 000 g.) Надосадочную жидкость, не задевая осадка, полностью отбирают с помощью микродозатора и переносят в чистую пробирку объемом 1,5 мл.
8.1.5. К надосадочной жидкости добавляют 40 мкл суспензии сорбента. Перед использованием сорбент перемешивают на микроцентрифуге-вортексе до получения однородной суспензии. Далее содержимое пробирки перемешивают на микроцентрифуге-вортексе и инкубируют при комнатной температуре 7—10 мин, периодически перемешивая путем переворачивания плотно закрытой пробирки 2—3 раза. Затем содержимое осаждают на микроцентрифуге-вортексе 60 с при максимальных оборотах. Надосадочную жидкость полностью удаляют при помощи автоматического микродозатора.
8.1.6. К осадку добавляют 500 мкл рабочего раствора буфера ОБ 1, содержимое пробирки перемешивают на микроцентрифуге-вортексе до получения однородной суспензии, а затем центрифугируют на микроцентрифуге-вортексе 20 с при максимальных оборотах. Надосадочную жидкость удаляют микродозатором или декантированием.
8.1.7. К осадку добавляют 500 мкл рабочего раствора ОБ 2, содержимое пробирки перемешивают на микроцентрифуге-вортексе до получения однородной суспензии, а затем центрифугируют на микроцентрифуге-вортексе 20 с при при максимальных оборотах. Надосадочную жидкость удаляют микродозатором или декантированием.
8.1.8. Повторяют операции, изложенные в п. 8.1.7. В последний раз надосадочную жидкость удаляют как можно более полно, не задевая при этом осадка.
8.1.9. Пробирку открывают и сушат осадок в термостате 5—7 мин при 65 °С.
14
8.1.10. К высушенному осадку добавляют 75 мкл буфера ТЕ. Перемешивают содержимое пробирки на микроцентрифуге-вортексе до получения однородной суспензии и термостатируют 10 мин при 65 °С. (Если осадок сорбента сразу не суспендируется, пробирку помещают в термостат на 2—3 мин, после чего вновь перемешивают).
8.1.11. Содержимое пробирки еще раз перемешивают на микроцентрифуге-вортексе и центрифугируют в течение 2 мин при 10 ООО об./мин (5 ООО g).
8.1.12. Надосадочную жидкость (экстракт ДНК) переносят в новую пробирку, не задевая при этом осадка, поскольку попадание в нее сорбента может в дальнейшем приводить к ингибированию ПЦР.
8.1.13. Полученный экстракт ДНК хранить при 4°С не более 1 мес. или при минус 18 °С не более 1 года.
8.2, Качественное определение генетически модифицированной ДНК методом ПЦР в режиме реального времени
8.2.1. Размещают в штативе и маркируют необходимое количество пробирок «ПЦР-ядро» по числу анализируемых проб, включая пробирки для положительного и отрицательного контролей. Для повышения достоверности результатов анализа рекомендуется его проведение в трех повторностях для каждого образца.
8.2.2. В каждую пробирку «ПЦР-ядро» добавляют по 10 мкл ПЦР растворителя и по 5 мкл соответствующей проводимому анализу смеси праймеров (если смесь праймеров хранилась в замороженном состоянии, ее необходимо разморозить в охладителе проб при 4°С, и, используя микроцентрифугу-вортекс, перемешать 5—10 с, а затем осадить капли на дно пробирки; при работе с праймерами их необходимо держать при 4°С в охладителе проб).
8.2.3. В пробирки «ПЦР-ядро» с ПЦР смесью добавляют анализируемые и контрольные образцы:
a. в пробирки «ПЦР-ядро» для исследуемых образцов вносят по 10 мкл соответствующего препарата ДНК;
b. в одну из пробирок «ПЦР-ядро» для отрицательного контроля (К-) вносят 10 мкл буфера ТЕ из комплекта используемого набора для выделения ДНК (Silica);
|
Таблица 2 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
|
* включение оптики для детекции ПЦР-продуктов (в реальном времени): канал для красителей FAM и SYBR Green | ||||||||||||||||||||||||
c. в последнюю очередь (!!!) еще в одну пробирку «ПЦР-ядро» для положительного контроля (К+) вносят 10 мкл раствора положительного контроля.
15
8.2.4. Содержимое еще раз аккуратно перемешивают в пробирках путем встряхивания на микроцентрифуге-вортексе. После растворения и перемешивания содержимое пробирок «ПЦР-ядро» полностью переносят в специальные пробирки для Smart-Cycler объемом 25 мл и плотно закрывают крышки.
8.2.5. Центрифугируют пробирки 3—5 с на центрифуге из комплекта принадлежностей для Smart-Cycler.
8.2.6. Пробирки с готовой ПЦР смесью помещают в амплификатор Smart-Cycler и запускают программу амплификации (табл. 2).
8.3. Количественное определение генетически модифицированной ДНК сои линии 40-3-2 методом ПЦР в режиме реального времени
8.3.1. Размещают в штативе и маркируют соответствующим образом необходимое количество пробирок «ПЦР-ядро» (из расчета две пробирки - на анализ одного образца), для повышения достоверности результатов анализа рекомендуется его проведение в трех повторностях для каждого образца.
8.3.2. Для построения калибровочной кривой используют калибровочные растворы ГМ сои линии 40-3-2 с содержанием ГМ ДНК 0,1,1,0, 5,0 % (положительные контроли). Для этого в штативе дополнительно размещают и маркируют 3 пары пробирок «ПЦР-ядро».
8.3.3. В каждую пробирку «ПЦР-ядро» добавляют 10 мкл ПЦР растворителя.
8.3.4. В одну из пробирок от каждой пары вносят по 10 мкл смеси праймеров, специфичных для гена-вставки ср4 и зонда, меченого FAM.
8.3.5. Во вторую пробирку от каждой пары вносят по 10 мкл смеси праймеров, специфичных для гена лектина сои 1ес и зонда, меченого ROX.
Таблица 3
| |||||||||||||||||||||||
|
Примечание. Из имеющихся в используемом амплификаторе оптических каналов необходимо выбрать два канала, волновые характеристики которых соответствуют оптимумам поглощения/излучения красителей FAM и ROX (494/518 нм и 580/605 нм, соответственно) и производить регистрацию величин флуоресценции с обоих каналов в соответствии с инструкцией к прибору. _* оптика включена _ | |||||||||||||||||||||||
8.3.6. В каждую пару пробирок «ПЦР-ядро» с готовой ПЦР смесью добавляют по 5 мкл препарата ДНК каждого из исследуемых образцов. Для построения калибровочных кривых вместо образцов ДНК в каждую пару дополнительных пробирок вносят по 5 мкл калибровочного раствора ДНК (0,1,1,0, 5,0 %).
8.3.7. Содержимое всех пробирок перемешивают на микроцентрифуге-вортексе.
16
8.3.8. Осаждение ПЦР смеси проводят в течение 5—7 с на микроцентрифу-ге-вортексе при максимальных оборотах.
8.3.9. После растворения и перемешивания содержимое пробирок полностью переносят в специальные пробирки для Smart-Cycler объемом 25 мкл и плотно закрывают крышки.
8.3.10. Осаждение смеси проводят в течение 3—5 с на центрифуге из комплекта принадлежностей для Smart-Cyder.
8.3.11. Пробирки с готовой ПЦР смесью помещают в амплификатор Smart-Cycler и запускают программу амплификации (табл. 3).
9. Интерпретация результатов анализа
9.1. Качественное определение ГМИ
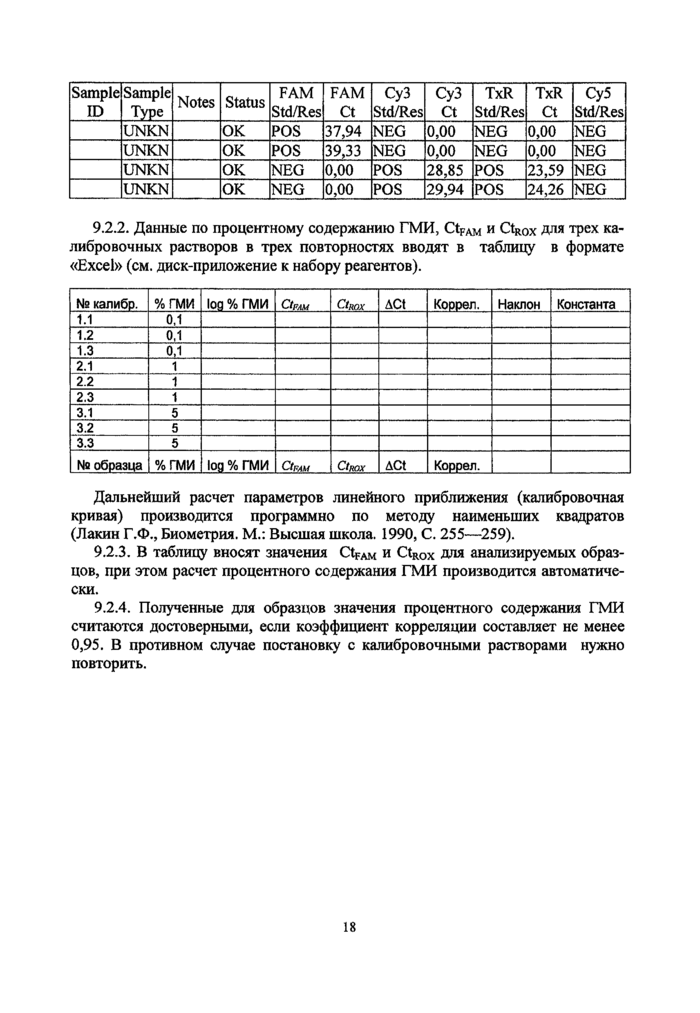
9.1.1. Детекцию продукта ПЦР проводят в соответствии с описанием к ам-плификатору Smart-Cycler. Амплификатор в процессе работы регистрирует величины флуоресценции по каналу для красителя FAM и с помощью программного обеспечения строит кривые. В положительном контроле должно наблюдаться увеличение интенсивности флуоресценции, а построенный прибором график в этом случае должен иметь вид S-образной кривой (см. рис. 1), что свидетельствует о нормальном протекании ПЦР. Подобная картина должна наблюдаться и во всех положительных образцах. В отрицательном контроле не должно происходить накопления продукта ПЦР, поэтому построенный прибором график в этом случае должен иметь вид прямой линии, что подтверждает корректность проводимого анализа. Подобная картина должна наблюдаться и во всех отрицательных образцах.
9.1.2. Результаты качественного анализа отображаются в сводных таблицах (колонка для FAM) и обозначаются POS (positive) для положительных образцов и NEG (negative) для отрицательных образцов.
|
Sample ID |
Sample Type |
Notes |
Status |
FAM Std/Res |
|
UNKN |
OK |
NEG | ||
|
UNKN |
OK |
NEG | ||
|
UNKN |
OK |
POS | ||
|
UNKN |
OK |
POS | ||
|
UNKN |
OK |
POS | ||
|
UNKN |
OK |
POS |
9.2. Количественное определение ГМИ
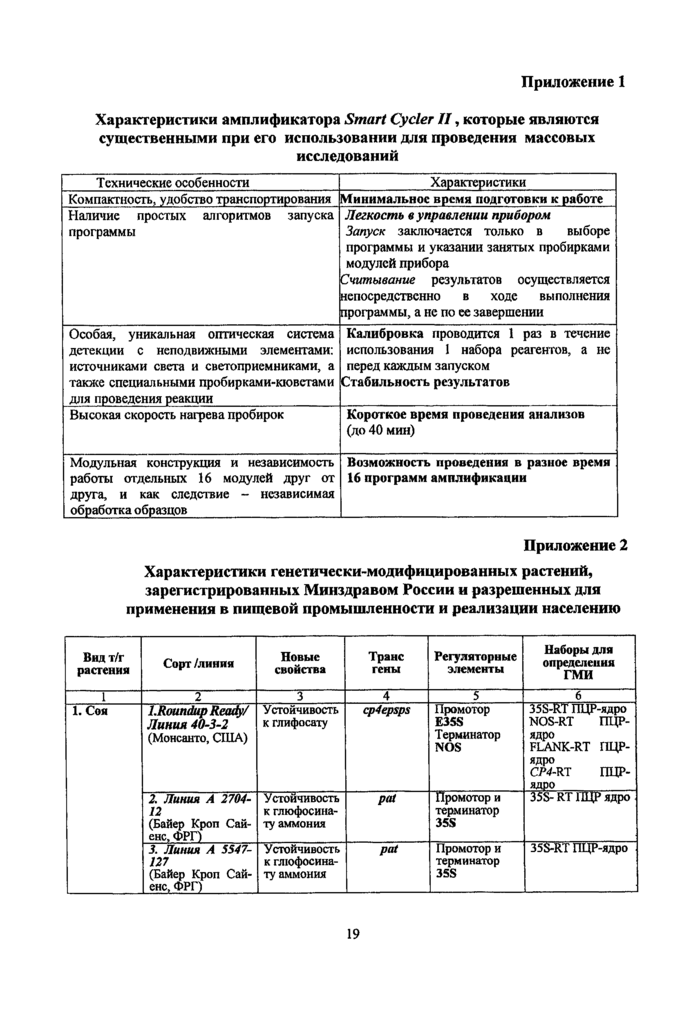
9.2.1. Учет первичных результатов ПЦР в реальном времени проводят путем определения точки начала log-фазы по красителям FAM (CtFAM) и ROX (CtROx), которые выражены в количестве выполненных циклов амплификации (данные выводятся в сводную таблицу результатов в соответствующем окне компьютерной программы - см. инструкцию к прибору Smart-Cycler).
17
|
Sample ID |
Sample Type |
Notes |
Status |
FAM Std/Res |
FAM Ct |
Cy3 Std/Res |
Cy3 Ct |
TxR Std/Res |
TxR Ct |
Cy5 Std/Res |
|
UNKN |
OK |
POS |
37,94 |
NEG |
0,00 |
NEG |
0,00 |
NEG | ||
|
UNKN |
OK |
POS |
39,33 |
NEG |
0,00 |
NEG |
0,00 |
NEG | ||
|
UNKN |
OK |
NEG |
0,00 |
POS |
28,85 |
POS |
23,59 |
NEG | ||
|
UNKN |
OK |
NEG |
0,00 |
POS |
29,94 |
POS |
24,26 |
NEG |
9.2.2. Данные по процентному содержанию ГМИ, CtFAM и CtROx для трех калибровочных растворов в трех повторностях вводят в таблицу в формате «Excel» (см. диск-приложение к набору реагентов).
|
Ns калибр. |
% ГМИ |
log % ГМИ |
CtpAM |
Ctnox |
ACt |
Коррел. |
Наклон |
Константа |
|
1.1 |
0,1 | |||||||
|
1.2 |
0,1 | |||||||
|
1.3 |
0,1 | |||||||
|
2.1 |
1 | |||||||
|
2.2 |
1 | |||||||
|
2.3 |
1 | |||||||
|
3.1 |
5 | |||||||
|
3.2 |
5 | |||||||
|
3.3 |
5 | |||||||
|
Na образца |
%ГМИ |
log % ГМИ |
CtFAM |
CtRox |
ACt |
Коррел. |
Дальнейший расчет параметров линейного приближения (калибровочная кривая) производится программно по методу наименьших квадратов (Лакин Г.Ф., Биометрия. М.: Высшая школа. 1990, С. 255—259).
9.2.3. В таблицу вносят значения CtFAM и CtROx для анализируемых образцов, при этом расчет процентного содержания ГМИ производится автоматически.
9.2.4. Полученные для образцов значения процентного содержания ГМИ считаются достоверными, если коэффициент корреляции составляет не менее 0,95. В противном случае постановку с калибровочными растворами нужно повторить.
18
Приложение 1
Характеристики амплификатора Smart Cycler П, которые являются существенными при его использовании для проведения массовых
исследований
|
Технические особенности |
Характеристики |
|
Компактность, удобство транспортирования |
Минимальное время подготовки к работе |
|
Наличие простых алгоритмов запуска программы |
Легкость в управлении прибором Запуск заключается только в выборе программы и указании занятых пробирками модулей прибора Считывание результатов осуществляется непосредственно в ходе вы полнения программы, а не по ее завершении |
|
Особая, уникальная оптическая система детекции с неподвижными элементами: источниками света и светоприемниками, а также специальными пробирками-кюветами для проведения реакции |
Калибровка проводится 1 раз в течение использования 1 набора реагентов, а не перед каждым запуском Стабильность результатов |
|
Высокая скорость нагрева пробирок |
Короткое время проведения анализов (до 40 мин) |
|
Модульная конструкция и независимость работы отдельных 16 модулей друг от друга, и как следствие - независимая обработка образцов |
Возможность проведения в разное время 16 программ амплификации |
Приложение 2
Характеристики генетически-модифицированных растений, зарегистрированных Минздравом России и разрешенных для применения в пищевой промышленности и реализации населению
| ||||||||||||||||||||||||||||
|
19 |
Качественное и количественное определение генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания и пищевом сырье с использованием «сухих» наборов реагентов серии «RT-ПЦР-ядро»: Методические рекомендации.— М.: ФГУЗ «Федеральный центр гигиены и эпидемиологии Роспотребнадзора», 2006.— 20 с.
1. Разработаны: ООО «Компания «Биском» (Цветков И. Л., Сердобинский Л. А., Комаров А. Б.); ЗАО «Сэйдж» (Гусев В. В, Чабаненко А. А.); ФГУЗ «Федеральный центр гигиены и эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Брагина И. В., Воронцова Т. В., Потапова Т. Н., Авдеенко Т. Ф., Терехова С. Ю.).
2. Введены впервые.
Подписано в печать 29.08.06 Формат 60x88/16 Печ. л. 1,5
Тираж 500 экз.
Оригинал-макет подготовлен к печати и тиражирован Издательским отделом ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора 117105, Москва, Варшавское ш., 19а Отделение реализации, тел. 952-50-89
© ООО «Компания «Биоком», 2006 © ЗАО «Сэйдж», 2006 © Федеральный центр гигиеныи эпидемиологии Роспотребнадзора, 2006
|
Продолжение приложения 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Содержание
1. Общие положения и область применения.....................................................................4
2. Нормативные ссылки.......................................................................................................5
3. Сущность метода..................................................... 5
3.1. Качественное определение ГМИ....................................................................5
3.2. Количественное определение ГМИ...............................................................6
4. Получение результатов при проведении ПЦР в режиме реального времени............7
5. Особенности проведения работ в ПЦР-лаборатории, в которой
используется метод ПЦР в режиме реального времени..................................................8
5.1. Помещение лаборатории.................................................................................8
5.2. Оборудование...................................................................................................9
5.3. Требования к проведению исследований...................... 9
5.4. Требования к персоналу................................................................................10
6. Аппаратура, материалы и реагенты.............................................................................10
6.1. Аппаратура и материалы...............................................................................10
6.2. Реагенты..........................................................................................................11
7. Отбор, хранение и подготовка проб пищевых продуктов для анализа....................12
7.1. Отбор и подготовка к анализу жидких и полужидких
материалов исследования.....................................................................................12
7.2. Отбор и подготовка к анализу сухих сыпучих материалов
исследования.........................................................................................................12
7.3. Отбор и подготовка к анализу материалов исследования
плотной консистенции.........................................................................................13
7.4. Условия хранения и транспортирования образцов....................................13
8. Порядок проведения исследования..............................................................................13
8.1. Выделение ДНК из образцов продуктов и сырья
с использованием набора реагентов серии «Silica».........................................13
8.2. Качественное определение генетически модифицированной
ДНК методом ПЦР в режиме реального времени.............................................15
8.3. Количественное определение генетически модифицированной
ДНК сои линии 40-3-2 методом ПЦР в режиме реального времени...............15
9. Интерпретация результатов анализа............................................................................16
9.1. Качественное определение ГМИ..................................................................16
9.2. Количественное определение ГМИ.............................................................17
Приложение L Характеристики амплификагора Smart Cycler 11, которые являются существенными при его использовании
для проведения массовых исследований.......................................................................19
Приложение 2. Характеристики генетически-модифицированных
растений, зарегистрированных Минздравом России и разрешенных
для применения в пищевой промышленности и реализации населению.....................29
3
УТВЕРЖДАЮ Главный врач ФГУЗ «Федеральный центр гигиены и эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
_А.И. Верещагин
9 сентября 2005 г.
№ Ю-5ФЦ/2557
Качественное и количественное определение генетически модифицированных источников (ГМИ) растительного происхоиздения в продуктах питания и пищевом сырье с использованием «сухих» наборов реагентов серии «RT-ПЦР-ядро»
Методические рекомендации № Ю-5ФЦ/25571. Общие положения и область применения
1.1. Настоящие методические рекомендации подготовлены для выявления и количественного определения генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания и пищевом сырье методом ПЦР в режиме реального времени с помощью «сухих» наборов реагентов серии «RT-ПЦР-ядро» производства ООО «Компания «Биоком».
1.2. Методические рекомендации разработаны в соответствии с Федеральным законом от 30 марта 1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения», Федеральным законом от 9 января 1996 г. №2-ФЗ «О защите прав потребителей».
1.3. Методические рекомендации предназначены для применения в лабораториях организаций Роспотребнадзора, осуществляющих контроль за качеством и безопасностью продовольственного сырья и пищевых продуктов, в т. ч. импортируемых в Российскую Федерацию, в лабораториях других организаций, аккредитованных в установленном порядке .
1.4. Методические рекомендации могут применяться при контроле растительного сырья и продуктов питания на наличие генетически модифицированных источников на этапах постановки на производство, санитарно-эпидемиологической экспертизы, государственной регистрации, закупки, ввоза в Российскую Федерацию и реализации.
4
2. Нормативные ссылки
2.1. Федеральный закон от 30 марта 1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2.2. Федеральный закон от 9 января 1996 г. № 2-ФЗ «О внесении изменений и дополнений в Закон Российской Федерации «О защите прав потребителей» и Кодекс РСФСР об административных правонарушениях».
2.3. Федеральный закон от 02 января 2000 г. № 29-ФЗ «О качестве и безопасности пищевых продуктов».
2.4. Федеральный закон от 05 июня 1996 г. № 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности».
2.5. Федеральный закон от 21 июня 2000 г. № 96-ФЗ «О внесении изменений и дополнений в Федеральный закон о государственном регулировании в области генно-инженерной деятельности».
2.6. Постановление Главного государственного санитарного врача Российской Федерации от 6 апреля 1999 г. №7 «О порядке гигиенической оценки и регистрации пищевой продукции, полученной из генетически модифицированных источников».
2.7. Постановление Главного государственного санитарного врача Российской Федерации от 16 сентября 2003 г. № 149 «О проведении микробиологической и молекулярно-генетической экспертизы генетически модифицированных микроорганизмов, используемых в производстве пищевых продуктов».
2.8. Постановление Главного государственного санитарного врача Российской Федерации от 08 ноября 2000 г. № 14 «О порядке проведения санитарно-эпидемиологической экспертизы пищевой продукции, подученной из генетически модифицированных источников».
2.9. Постановление Главного государственного санитарного врача Российской Федерации от 31 декабря 2004 г. № 13 «Об усилении надзора за пищевыми продуктами, полученными из генетически модифицированных источников».
2.10. Гигиенические требования к безопасности и пищевой ценности пищевых продуктов. СанПиН 2.3.2.1078—01.
2.11. Организация работы лабораторий, проводящих исследования с патогенными биологическими агентами III—IV групп патогенности методом полимеразной цепной реакции. МУ 1,3.1888—04.
2.12. Методы количественного определения генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания. МУК 4.2.1913—04.
2.13. Методы идентификации модифицированных источников ГМИ растительного происхождения. МУК 4.2.1902—04.
3. Сущность метода3.1. Качественное определение ГМИ
Метод выявления генетически модифицированных источников в продуктах питания и пищевом сырье растительного происхождения с помощью «сухих» наборов реагентов «35 S-RT-ПЦР-ядро», «NOS-RT-ПЦР-ядро», «FLANK-RT-
5
ПЦР-ядро», «CRY-RT-ПЦР-ядро» основан на использовании полимеразной цепной реакции (ГТЦР) с детекцией в режиме реального времени (Real Time PCR).
Метод направлен на одновременное или раздельное выявление универсальных маркеров генетически модифицированной (ГМ) ДНК-358 промотора виру-са мозаики цветной капусты и терминатора NOS из Agrobacterium tumefaciens, а также специфического маркера - фрагмента гена-вставки: crylAb, используемого для получения растений кукурузы с повышенной устойчивостью к стеблевому мотыльку.
Процедура определения ГМИ включает следующие этапы: отбор образцов, пробоподготовка, выделение ДНК из исследуемого образца, проведение амплификации с детекцией в режиме реального времени, анализ результатов амплификации.
Выделение ДНК из исследуемого материала проводят на сорбенте с помощью набора реагентов серии Silica (ООО «Компания «Биоком», г. Москва), что позволяет выделять высокомолекулярную ДНК без примеси ингибиторов ПЦР практически из всего разнообразия растительного сырья, готовых пищевых продуктов и полуфабрикатов. Получаемые препараты ДНК непосредственно используются для ПЦР. Определение концентрации ДНК в них и дополнительное разбавление не требуется.
Для проведения амплификации используют наборы готовых к использованию реагентов для ПЦР («ЗЗБ-КТ-ПЦР ядро», «NOS- RT-ПЦР-ядро», «FLANK-RT-ПЦР-ядро», «CRY-RT- ПЦР-ядро»), которые включают в себя: 1) пробирки с сухой амплификационной смесью «RT-ПЦР-ядро», 2) жидкие реагенты - ПЦР растворитель, смесь праймеров, краситель SYBR Green, 3) ДНК для положительного контроля.
3.2. Количественное определение ГМИ
Метод количественного определения генетически модифицированной ДНК трансгенной сои линии 40-3-2 в продуктах питания и пищевом сырье растительного происхождения с помощью «сухого» набора реагентов «СР4~ЬЕС-КТ-ПЦР-ядро» основан на использовании полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени (Real Time PCR).
Метод позволяет определить процентное содержание генетически модифицированной ДНК в анализируемом образце путем определения отношения концентраций ДНК генно-инженерной вставки (ген устойчивости к гербициду Ра-ундап ср4) к тотальной ДНК соевого компонента (по гену лектина сои 1ес). Это позволяет выявлять и количественно характеризовать ДНК ГМ сои вне зависимости от наличия других компонентов растительного и животного происхождения в составе анализируемого образца.
Необходимо отметить, что использование универсальных маркеров ГМИ (например, 35S промотора ВМЦК) для количественного определения многокомпонентных образцов непригодно. Такие образцы могут содержать более 1 копии вышеназванных генно-инженерных элементов в гено-
в
ме, что будет приводить к ошибке. Также существуют линии изначально содержащие более 1 копии регуляторных элементов (например, два 35S промотора ВМЦК у линии ВЫ1 кукурузы («Сингента Сиде», Франция).
Процедура количественного определения ГМИ включает все стадии качественного определения ГМИ по п. 3.1, а также - использование специальной компьютерной программы для определения процентного содержания ГМИ в анализируемых образцах.
Выделение ДНК из исследуемого материала проводят на сорбенте с помощью набора реагентов серии Silica (ООО «Компания «Биоком», г. Москва).
Дли проведения амплификации используют набор готовых к использованию реагентов «CP4-LEC-RT-ПЦР-ядро», который включает в себя:
1) пробирки с сухой амплификационной смесью «RT-ПЦР-ядро»,
2) жидкие реагенты - ПЦР растворитель, смесь олигонуклеотидов (праймеры и зонд с меткой FAM) для генно-инженерной вставки - гена ср4, смесь олигонуклеотидов (праймеры и зонд с меткой ROX) для гена лектина сои /ес,
3) 3 калибровочных раствора ДНК трансгенной сои линии 40-3-2 с известной концентрацией ГМИ (0,1,1,0 и 5,0 %) для проведения калибровки прибора.
4. Получение результатов при проведении ПЦР в режиме реального времени
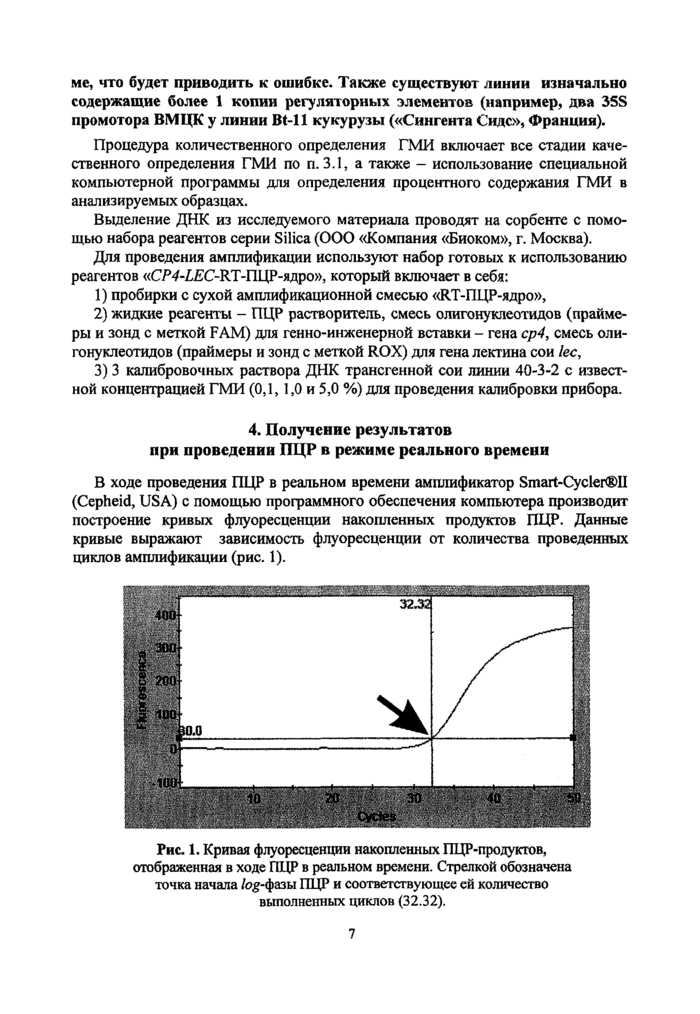
В ходе проведения ПЦР в реальном времени амплификатор Smart~Cycler®II (Cepheid, USA) с помощью программного обеспечения компьютера производит построение кривых флуоресценции накопленных продуктов ПЦР. Данные кривые выражают зависимость флуоресценции от количества проведенных циклов амплификации (рис. 1).
|
Рис. 1. Кривая флуоресценции накопленных ПЦР-продуктов, отображенная в ходе ПЦР в реальном времени. Стрелкой обозначена точка начала /og-фазы ПЦР и соответствующее ей количество выполненных циклов (32.32). |
7
2.1
Рис. 2. Кривые флуоресценции накопленных продуктов ПЦР образцов А и Б, отображенные в ходе ПЦР в реальном времени (детекция по FAM - рис. 2.1, детекция по ROX - рис. 2.2).
2.2
|
Рис. 2. Кривые флуоресценции накопленных продуктов ПЦР образцов А и Б, отображенные в ходе ПЦР в реальном времени (детекция по FAM - рис. 2.1, детекция по ROX - рис. 2.2). |
При этом, прибор автоматически определяет точку начала log-фазы, выраженную в количестве выполненных циклов. Эта точка характеризует исходное количество ДНК-матрицы в реакционной смеси.
В ходе качественного определения ГМИ накопление продукта ПЦР в реакционной смеси детектируют с помощью интеркалирующего красителя SYBR Green.
Для количественного анализа одного образца необходимо провести две отдельные реакции (в одном температурном режиме): одна - для выявления фрагмента генно-инженерной вставки, другая - для выявления природного гена. В процессе ПЦР в режиме реального времени проводится детекция ампликонов гена-вставки ср4 и природного гена 1ес. Для этого в наборе «CP4-LEC-RT-ПЦР-ядро» используется 2 типа олигонуклеотидов (зондов), флуоресцентно меченых агентами FAM и ROX. Краситель FAM (длина волны максимума поглощения - 494 нм, длина волны максимума испускания (флуоресценции) - 518 нм), предназначен для количественного определения генно-инженерной «вставки», a ROX (или Texas Red; длина волны максимума поглощения - 580 нм, длина волны максимума испускания (флуоресценции) - 605 нм), предназначен для количественного определения природного гена.
8
Амплификатор Smart-Cycler®II проводит построение кривых накопления и определение точек начала log-фазы (Ct) (рис. 2).
Доля ГМИ (%) в анализируемых образцах характеризуется разностью С%ам - CtRox (ACt) и рассчитывается с помощью прилагаемой к набору реагентов «CP4-/JTC-RT-ПЦР-ядро» компьютерной программы в формате Excel.
Минимальное процентное содержание ГМИ, которое позволяет точно определить данная методика, составляет не менее ОД %.
5. Особенности проведения работ в ПЦР“лаборатории, в которой используется метод ПЦР в режиме реального времени
5.1. Помещение лаборатории должно быть разделено на зоны, предназначенные для каждой стадии ПЦР-исследования. В целом следует выделить не менее трех рабочих зон:
5.1.1. Зона регистрации и предобработки образцов предназначена для регистрации поступающего в лабораторию материала, его временного хранения и подготовки анализируемых образцов для выделения ДНК.
5.1.2. Зона выделения ДНК предназначена для выделения ДНК из исследуемого материала, прошедшего предобработку в предыдущей зоне, а также временного хранения проб выделенной ДНК.
5.1.3. Зона проведения ПЦР предназначена для приготовления реакционной смеси (внесение растворителя и олигонуклеотидов в готовую «сухую» ампли-фикационную смесь), проведения ПЦР-анализа и детекции результатов в режиме реального времени.
5.2. Оборудование
Каждая зона должна иметь свои комплекты реагентов, автоматических пипеток, расходных материалов, пластиковой и стеклянной посуды, халатов, перчаток и соответствующего лабораторного оборудования, используемых только в данном помещении и не выносящихся за его пределы. Для термостатирования пробирок при выделении ДНК из биологического материала, а также при размораживании олигонуклеотидов перед их добавлением в амплификационную смесь необходимо использовать термостаты и охладители проб с твердотельным термоблоком, чтобы избежать перекрестной контаминации и появления ложноположительных результатов.
5.3. Требования к проведению исследований
5.3.1. Весь материал, поступающий в ПЦР-лабораторию для исследования, должен быть промаркирован и обязательно зарегистрирован в специальном журнале постоянным сотрудником, который несет персональную ответственность за сохранность исследуемого материала в течение требуемого срока, а также утилизацию этого материала.
5.3.2. Необходимо использовать одноразовые пробирки и наконечники для автоматических пипеток. Обязательно менять наконечники при переходе от од-
9