Государственное санитарно-эпидемиологическое нормирование Российской Федерации
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение химических элементов в биологических средах и препаратах методами атомно-эмиссионной спектрометрии с индуктивно связанной плазмой и масс-спектрометрии с индуктивно связанной плазмой
Методические указания МУК 4.1.1482—03 МУК 4.1.1483—03
Издание официальное
Минздрав России Москва • 2003
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение химических элементов в биологических средах и препаратах методами атомно-эмиссионной спектрометрии с индуктивно связанной плазмой и масс-спектрометрии с индуктивно связанной плазмой
Методические указания МУК 4.1.1482—03 МУК 4.1.1483—03
Аквадистиллятор электрический одноступенчатый или двухступенчатый ГОСТ 28165
Мембранная комбинированная установка для получения деионизованной воды типа ДВС-М/1 НА-1 (2)-L
Пипетки автоматические, дозаторы любого типа, вместимостью 0,2—1,0 мл ± 1 %
Стаканы химические термостойкие, вместимостью 100—150 мл
Пробирки тефлоновые градуированные на 10 мл Одноразовые полипропиленовые градуированные центрифужные пробирки без крышек, емкостью 15 мл, для хранения растворенных образцов Одноразовые полипропиленовые градуированные центрифужные пробирки с винтовыми крышками, емкостью 50 мл, для хранения рабочих стандартов Цилиндр мерный, вместимостью 100 мл Стаканчики для взвешивания Ультразвуковая ванна УЗВ-9,5 л или подобная
Реактивы и материалы
Азотная кислота концентрированная, ос. ч. или очищенная методом перегонки в кварцевой или в термостойкой полипропиленовой посуде Аргон газообразный высокой чистоты Вода дистиллированная или деионизованная Ацетон, ос. ч.
Стандартные образцы состава растворов одно-и многоэлементные для атомно-эмиссионной спектрометрии, производства Perkin-Elmer или аналогичные, сертифицированные Скальпель хирургический Фильтровальная бумага Защитная лабораторная пленка Parafilm «М»® или подобная
5. Требования к безопасности проведения работ
При работе с химическими веществами и реактивами необходимо соблюдать требования техники безопасности, установленные для работ
МУК 4.1.1482—03
с токсичными, едкими и легковоспламеняющимися веществами по ГОСТ 12.4.021. При работе необходимо соблюдать «Правила по технике безопасности и производственной санитарии при работе в химических лабораториях», утвержденные М3 СССР 20.12.82 (М., 1981).
Рабочие столы и поверхности должны содержаться в чистоте. В конце рабочего дня после отключения всех приборов производится влажная уборка рабочих поверхностей.
Безопасность при работе с электроустановками обеспечивается по ГОСТ 12.1.019 и осуществляется соблюдением «Правил технической эксплуатации электроустановок потребителей», утвержденных Госэнергонадзором 21.12.84.
Безопасность при работе с баллонами с аргоном обеспечивается соблюдением «Правил устройства и безопасной эксплуатации сосудов, работающих под давлением», утвержденных Госгортехнадзором СССР 27.11.87 (М.: Недра, 1989).
Помещение для проведения измерений должно соответствовать требованиям «Пожарных норм проектирования зданий и сооружений» (СНиП ПА-5-700), «Санитарных норм проектирования промышленных предприятий» (СН-245-71) и СниП-74, ГОСТ 12.1.004.
При выполнении работ должны быть соблюдены меры противопожарной безопасности в соответствии с требованиями ГОСТ 12.1.004-87. В лаборатории должны иметься средства пожаротушения по ГОСТ 12.4.009.
Требования безопасности соответствуют правилам и рекомендациям, изложенным в техническом описании на приборы.
6. Требования к квалификации лиц, работающих на спектрометре
К выполнению измерений на спектрометре допускаются лица, имеющие опыт работы с оптическими средствами измерений типа атомно-эмиссионного спектрометра с индуктивно связанной плазмой, подтвержденный аттестатом фирмы, выпустившей прибор; изучившие техническое описание измерительного прибора и методику выполнения измерений; обученные в соответствии с ГОСТ 12.0.004-79 и имеющие квалификационную группу не ниже 1 согласно «Правилам технической эксплуатации электроустановок потребителей», утвержденных Госэнергонадзором от 21.12.84; прошедшие инструктаж по технике безопасности на рабочем месте и ознакомленные с правилами обслуживания спектрометра.
И
К проведению пробоподготовки допускаются операторы с квалификацией лаборант, имеющие опыт работы в химической лаборатории.
7. Условия выполнения измерений
Выполнение измерений проводят при нормальных климатических условиях испытаний в соответствии с ГОСТ 15150. Помещение не должно содержать токсичных паров и газов. Температура окружающего воздуха в лаборатории 18—25 °С. Атмосферное давление 84—106 кПа (630—800 мм рт. ст.). Влажность воздуха 80 ± 5 % при температуре 25 °С. При использовании электроприборов частота переменного тока 50 ± 1 Гц, напряжение сети 220 ± 10 В. Освещение помещения естественное или искусственное, не ограничивается особыми требованиями.
8. Подготовка к проведению измерений
Все процедуры подготовки проб к анализу должны исключать возможность внесения в них загрязнений. Используемую для пробоподготовки фторопластовую посуду тщательно промывают в ультразвуковой ванне в разбавленной 1 : 1 азотной кислоте и трижды ополаскивают деионизованной водой.
9. Отбор, хранение и подготовка проб
Волосы состригают с затылочной части головы на всю длину в количестве не менее 0,1 г. Для снятия поверхностного загрязнения и обезжиривания волос применяется способ подготовки проб волос, рекомендованный МАГАТЭ. Для этого волосы обрабатываются ацетоном в течение 10—15 мин, а затем три раза промываются деионизованной водой. Сушка волос производится при комнатной температуре в течение 10—15 мин. Для длительного хранения используют обычные бумажные конверты.
Для проведения анализа ногтей необходимо срезать ногти с обеих рук. Полученное количество ногтей обрабатывают ацетоном в течение 10—15 мин, а затем три раза промывают дистиллированной водой. Сушка ногтей производится при комнатной температуре в течение 10— 15 мин. Для длительного хранения используют обычные бумажные конверты.
Кровь может быть получена из локтевой вены (венозная, в условиях стационара) или из пальцев рук (капиллярная). Объем отобранной крови должен составлять не менее 1 мл. Образцы крови хранятся в обычном холодильнике до 3—5 суток (от 0 до 4 °С) либо заморажива-
МУК 4.1.1482—03
ются (до -18 °С), либо лиофилизуются, или высушиваются в сушильном шкафу (для длительного хранения). Для длительного хранения образцы помещаются в одноразовые полипропиленовые пробирки с герметичными крышками.
Забор и подготовка крови для получения препаратов эритроцитарной массы, плазмы и сыворотки, а также забор молока, спермальной жидкости, лаважа и слюны проводится по общепринятым методикам. Полученная масса указанных препаратов должна составлять не менее 1 г. Для длительного хранения препараты помещают в герметичные одноразовые пробирки и замораживают до -18 °С либо лиофилизируют.
Моча (утренняя или суточная) для проведения анализа забирается в объеме не менее 5 мл. Для хранения мочу помещают в герметичную посуду (из лабораторного пластика), и хранят в холодильнике до 3 суток при температуре (от 0 до 4 °С).
Биоптаты мягких тканей (мышцы, кожа, эпителий, печень и др.) сразу же после забора, препарирования, удаления крови взвешиваются с точностью до 5 мг и помещаются в лабораторную пластиковую или стеклянную посуду, обеспечивающую герметичность хранения. Масса образца ткани от 0,1 г (минимальная, определение макроэлементов -железо, цинк, медь), до 3—5 г (определение содержания более 20 химических элементов). Допускается хранение в холодильнике при температуре 0—4 °С до 7 суток или в морозильной камере при температуре -18 °С, или высушивание и лиофилизация образцов для длительного хранения.
Пробы конкрементов - зубов, фрагментов костной ткани - особых условий хранения не требуют, помещаются в герметичную упаковку из лабораторного пластика.
Препараты аминокислот, поливитаминных препаратов с микроэлементами, биологически активные добавки к пище и сырье для их изготовления поступают для исследования в упаковке производителя. Необходимая для исследования минимальная масса твердых препаратов составляет 10 г, жидких - 100 г.
10. Разложение проб бносубстратов
Волосы. Ногти. Другие твердые образцы. Открытое разложение. На аналитических весах берут навеску образца массой 0,01—0,10 г. Навеску помещают во фторопластовый цилиндр (PTFE, Viton™, Teflon™, PFA), приливают 0,2—1,0 мл концентрированной азотной кислоты, накрывают защитной лабораторной пленкой и помещают в термоблок.
разогретый до 115 °С, выдерживают в течение 0,5—1,0 ч до полного растворения пробы. Растворенный образец количественно переносят в мерную полипропиленовую пробирку, троекратно смывая со стенок цилиндра, и доводят деионизованной водой до 10мл. Герметично закрывают защитной лабораторной пленкой, перемешивают и передают на анализ.
Жидкие образцы. Открытое разложение. Навеску анализируемого объекта 0,1—0,5 г (0,1—0,5 мл) берут на аналитических весах во фторопластовые цилиндры (PTFE, Viton™, Teflon™, PFA), определяя массу навески по разнице массы пробирки до и после взятия навески. В цилиндр приливают 0,3—1,0 мл концентрированной азотной кислоты, накрывают лабораторной пленкой и помещают в термоблок, разогретый до 115 °С. Выдерживают в термоблоке в течение 0,5—1,0 ч до гомогенизации пробы и далее действуют, как описано в п. 10.
При работе с гомогенными водными средами, такими как моча (не содержащая осадка), лимфа, плазма и даже цельная кровь, допускается простое разбавление образца 2—3 %-ной азотной кислотой, непосредственно перед анализом. Для этого к навеске образца в мерной пробирке приливается 5—7 мл деионизованной воды, затем 0,3—0,5 мл концентрированной азотной кислоты и проба доводится до 10—15 мл деионизованной водой. В этом случае не рекомендуется уменьшать фактор разбавления пробы ниже чем 1 : 100 во избежание осаждения белков, а также для компенсации высокой вязкости образцов и склонности к ценообразованию. Пробы, растворенные таким способом, не рекомендуется хранить до анализа долгое время (свыше суток).
Микроволновая пробоподготовка. Навеску образца по п.п. 10, 11 помещают во фторопластовый вкладыш и добавляют 5 мл азотной кислоты. Автоклав с пробой во вкладыше помещают в микроволновую печь и разлагают пробу, используя программу разложения, рекомендованную производителем печи. В общем случае для мягких тканей, волос и жидкостей можно применять следующий режим нагрева: подъем температуры до 200 °С в течение 5 мин, выдерживание в течение 5 мин при 200 °С, охлаждение до 45 °С. Охлажденный автоклав встряхивают для перемешивания содержимого и приоткрывают крышку для уравновешивания давления. Качественно разложенная проба после отгона окислов азота должна представлять собой бесцветный или желтоватый прозрачный раствор, без нерастворившихся частиц на дне и на стенках вкладыша. Растворенную пробу количественно переносят в пробирку объемом 15 мл, троекратно встряхивая вкладыш с крышкой с 1 мл деи-
МУК 4.1.1482—03
онизованной воды и перенося каждый смыв в пробирку, доводят объем до 10 мл деионизованной водой, закрывают и перемешивают. Автоматическим дозатором со сменным наконечником отбирают аликвотную часть 1 мл и доводят до 10 мл 0,5 %-ной азотной кислотой, закрывают защитной лабораторной пленкой, передают на анализ. Данные об объеме аликвотной части и объеме разведения вводят в программное обеспечение спектрометра вместе с названием и навеской образца.
Допускается непосредственный отбор аликвотной части объемом 0,1—0,5 мл из разложенной пробы в автоклаве. Чтобы скомпенсировать при этом погрешность разбавления, перед разложением в пробу нужно добавить раствор внутреннего стандарта (In или Rh), чтобы концентрация внутреннего стандарта в конечном растворе, направляемом на анализ, составляла примерно 10 мкг/л (например, добавить в пробу 100 мкл раствора, содержащего 10 мг/л Rh, затем из 5 мл разложенной пробы взять аликвотную часть 0,5 мл и довести до 10 мл). Раствор внутреннего стандарта необходимо добавлять во все холостые пробы и в калибровочные растворы. Заданную концентрацию внутреннего стандарта (10 мкг/л) в холостых и стандартных растворах необходимо точно соблюдать.
Раствор холостой пробы готовят с выполнением всех указанных выше операций, за исключением операции взятия навески.
11. Разложение проб аминокислот, поливитаминных препаратов с микроэлементами, биологически активных добавок к пище и сырья для их изготовления
Навеску измельченной пробы 0,1—0,2 г помещают во фторопластовый цилиндр, приливают 1 мл концентрированной азотной кислоты, встряхивают, накрывают лабораторной пленкой и помещают на 0,5— 1,0 ч в термоблок с температурой 115 °С до полного растворения пробы. Получившийся прозрачный раствор количественно переносят в мерную полипропиленовую пробирку, троекратно смывая со стенок фторопластового цилиндра, доводят деионизованной водой до 10 мл. Герметично закрывают защитной лабораторной пленкой, перемешивают и передают на анализ. При использовании микроволновой пробоподготовки действуют по п. 10.
Раствор холостой пробы готовят с выполнением всех указанных выше операций, за исключением операции взятия навески.
15
ББК51.2
060
060 Определение химических элементов в биологических средах и препаратах методами атомно-эмиссионной спектрометрии с индуктивно связанной плазмой и масс-спектрометрии с индуктивно связанной плазмой: Методические указания.—М.: Федеральный центр госсанэпиднадзора Минздрава России, 2003.— 56 с.
ISBN 5—7508—0462—3
1. Разработаны Минздравом Российской Федерации (д. м. н., проф.
С. И. Иванов), Федеральным центром госсанэпиднадзора Минздрава России (д. м. н., проф. Л. Г. Подунова, д. м. н. В. Б. Скачков), Институтом питания РАМН (д. м. н., проф., акад. РАМН В. А. Тутельян), АНО Центр биотической медицины (д. м. н. А. В. Скальный, к. б. н. В. А. Демидов, к. м. н. М. Г. Скальная, Е. П. Серебрянский, А. Р. Грабеклис), Российским химико-технологическим университетом им. Д. И. Менделеева (д. х. н., проф., акад. MAH ВШ В. В. Кузнецов).
2. Утверждены 29.06.03 и введены в действие 30.06.03 Главным государственным санитарным врачом Российской Федерации - Первым заместителем Министра здравоохранения Российской Федерации Г. Г. Онищенко.
3. Введены впервые.
ББК51.2
Редакторы Барабанова Т. Л., Акопова Н. Е., Максакова Е. И. Технический редактор Ломанова Е. В.
Подписано в печать 29.09.03 Формат 60x88/16 Печ. л. 3,5
Тираж 1000 экз. Заказ 42
Министерство здравоохранения Российской Федерации 101431, Москва, Рахмановский пер., д. 3
Оригинал-макет подготовлен к печати и тиражирован Издательским отделом Федерального центра госсанэпиднадзора Минздрава России 125167, Москва, проезд Аэропорта, 11 Отделение реализации, тел. 198-61-01
ISBN 5—7508—0462—3
© Минздрав России, 2003 © Федеральный центр госсанэпиднадзора Минздрава России, 2003
МУК 4.1.1482—4.1.1483—03
Содержание
Предисловие................................................................................................................5
Определение содержания химических элементов в диагностируемых биосубстратах, поливитаминных препаратах с микроэлементами, в биологически активных добавках к пище и в сырье для их изготовления методом атомной эмиссионной спектрометрии с индуктивно связанной аргоновой плазмой...........................7
1. Погрешность измерений..................................................................................8
2. Сущность метода..............................................................................................8
3. Характеристика спектрометра с индуктивно связанной плазмой................8
4. Оборудование, материалы, реактивы.............................................................9
5. Требования к безопасности проведения работ............................................10
6. Требования к квалификации лиц, работающих на спектрометре..............11
7. Условия выполнения измерений...................................................................12
8. Подготовка к проведению измерений..........................................................12
9. Отбор, хранение и подготовка проб..............................................................12
10. Разложение проб биосубстратов...................................................................13
11. Разложение проб аминокислот, поливитаминных препаратов с микроэлементами, биологически активных добавок к пище и
сырья для их изготовления............................................................................15
12. Приготовление стандартных градуировочных растворов..........................16
13. Подготовка прибора.......................................................................................16
14. Устранение мешающих влияний..................................................................16
15. Градуировка спектрометра............................................................................17
16. Выполнение измерений.................................................................................17
17. Обработка результатов измерений...............................................................17
18. Внутренний оперативный контроль.............................................................18
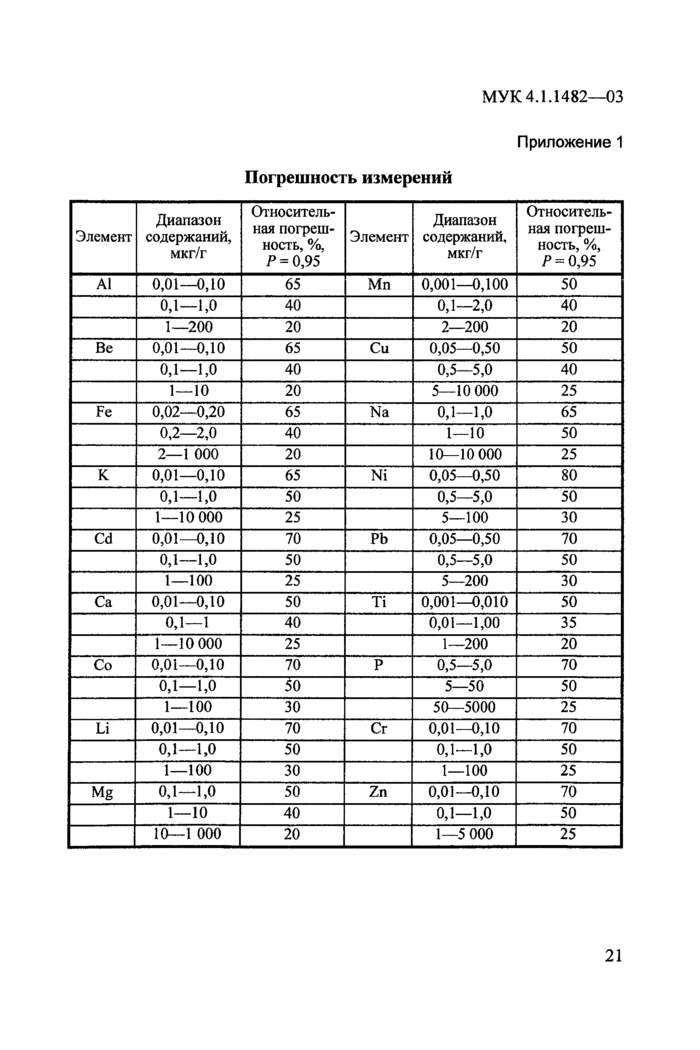
Приложение 1. Погрешность измерений................................................................21
Приложение 2. Пример состава рабочих стандартных растворов.......................22
Приложение 3. Условия выполнения анализа на спектрометре...........................23
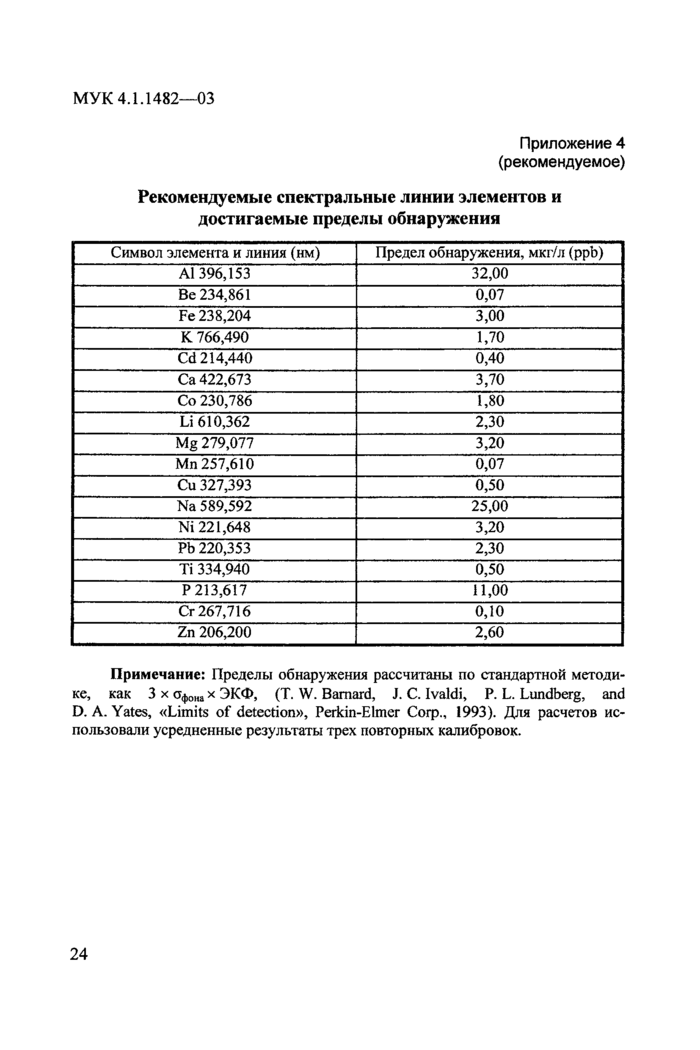
Приложение 4. Рекомендуемые спектральные линии элементов и
достигаемые пределы обнаружения..............................................24
Приложение 5. Форма протокола оформления результатов анализа...................25
Библиографический список.....................................................................................26
Определение содержания химических элементов в диагностируемых биосубстратах, препаратах и биологически активных добавках методом масс-спектрометрии с индуктивно связанной аргоновой плазмой..............................................................................28
1. Погрешность измерений................................................................................28
2. Сущность метода............................................................................................29
3. Характеристика масс-спектрометра с индуктивно связанной
плазмой..........................................................................................................30
4. Оборудование, материалы, реактивы...........................................................31
3
МУ К 4.1.1482—4.1.1483—03
5. Требования к безопасности проведения работ............................................33
6. Требования к квалификации лиц, работающих на масс-
спектрометре.................................................................................................34
7. Условия выполнения измерений...................................................................34
8. Подготовка к проведению измерений..........................................................35
9. Отбор, хранение и подготовка проб..............................................................35
10. Разложение проб биосубстратов...................................................................36
11. Разложение проб аминокислот, поливитаминных препаратов с микроэлементами, биологически активных добавок к пище и
сырья для их изготовления............................................................................38
12. Приготовление стандартных градуировочных растворов..........................38
13. Подготовка прибора.......................................................................................39
14. Коррекция спектральных изобарных наложений, коррекция полиатомных наложений, вызванных матрицами образцов,
реагентов и газами плазмы, коррекция транспортных помех....................39
15. Градуировка масс-спектрометра...................................................................43
16. Выполнение измерений.................................................................................43
17. Обработка результатов измерений...............................................................44
18. Внутренний оперативный контроль.............................................................44
Приложение 1. Погрешность измерений................................................................48
Приложение 2. Пример состава рабочих стандартных растворов.......................50
Приложение 3. Условия выполнения анализа на масс-спектромстрс
ELAN 9000......................................................................................51
Приложение 4. Рекомендуемые массы изотопов элементов и достигаемые
пределы обнаружения, прибор ELAN 9000..................................52
Приложение 5. Форма протокола оформления результатов анализа...................54
Библиографический список.....................................................................................55
4
МУК 4.1.1482—4.1.1483—03
Предисловие
Методические указания по определению концентраций химических элементов в диагностируемых биосубстратах, препаратах аминокислот, поливитаминных препаратах с микроэлементами, в биологически активных добавках к пище и в сырье для их изготовления предназначены для учреждений Государственной санитарно-эпидемиологической службы Российской Федерации, специальных служб федеральных органов исполнительной власти, осуществляющих ведомственный санитарно-эпидемиологический надзор, учреждений Минздрава России, лабораторий санитарно-гигиенического, клинического, экологического, скринингового и исследовательского профилей.
Результаты оценки элементного статуса человека используют при решении актуальных задач современной медицины по оценке состояния здоровья человека на индивидуальном и популяционном уровнях и в современной медико-биологической экспертизе. Их целесообразно учитывать при оценке эффективности санитарно-экологических мероприятий и текущего санитарного контроля над объектами, воздействующими на окружающую среду населенного пункта и региона, при решении задач предварительной популяционной эколого-эпидемиологической диагностики массовых заболеваний неизвестной этиологии, при мониторинге состояния здоровья, уровня работоспособности и эффективности лечения, при формировании групп риска по гипо- и гиперэлементозам, профессиональным заболеваниям, связанным с интоксикацией химическими элементами, при скрининг-диагностических исследованиях больших групп населения, при составлении карт экологического природного и техногенного неблагополучия регионов, при экспертнокриминалистических исследованиях. В сборнике представлены методики количественного определения методами атомно-эмиссионной спектрометрии (ИСП-АЭС) и масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС) 38 элементов (серебра, алюминия, мышьяка, золота, бария, бериллия, висмута, бора, кальция, кадмия, кобальта, хрома, меди, железа, галлия, германия, ртути, калия, лития, магния, марганца, молибдена, натрия, никеля, свинца, платины, рубидия, фосфора, сурьмы, селена, олова, стронция, титана, таллия, ванадия, вольфрама, цинка, циркония) в диагностируемых биосубстратах: волосы, ногти, кровь, плазма, грудное молоко, моча, аутопсийные материалы (печень, почки, миокард, плацента), слюна, зубы, в препаратах аминокислот, поливита-
МУК 4.1.1482—4.1.1483—03
минных препаратах с микроэлементами, в биологически активных добавках к пище и в сырье для их изготовления.
Методические указания разработаны с учетом ГОСТ 8.563-96 «Методики выполнения измерений», ГОСТ Р 1.5-92 «Общие требования к построению, изложению, оформлению и содержанию стандартов», ГОСТ Р ИСО 5725—(1—6)—2002 «Точность (правильность и прецизионность) методов и результатов измерений».
Методические указания одобрены и рекомендованы комиссией по государственному санитарно-эпидемиологическому нормированию при Минздраве Российской Федерации.
6
МУК 4.1.1482—03
УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации,
Первый заместитель Министра здравоохранения Российской Федерации
Г. Г. Онищенко
29 июня 2003 г.
Дата введения: 30 июня 2003 г.
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение содержания химических элементов в диагностируемых биосубстратах, поливитаминных препаратах с микроэлементами, в биологически активных добавках к пище и в сырье для их изготовления методом атомной эмиссионной спектрометрии с индуктивно связанной аргоновой плазмой
Методические указания МУК 4.1.1482—03
Настоящие методические указания устанавливают методику определения микроэлементов (алюминия, бария, бериллия, ванадия, железа, калия, кадмия, кальция, кобальта, лития, магния, марганца, меди, молибдена, натрия, никеля, олова, ртути, серебра, свинца, стронция, титана, фосфора, хрома, цинка, циркония) в диагностирующих биосубстратах, в качестве которых выступают волосы, ногти, кровь, плазма, грудное молоко, моча, аутопсийные материалы (печень, почки, миокард, плацента), слюна, зубы, а также в препаратах аминокислот, поливитаминных препаратах с микроэлементами, в биологически активных добавках к пище и в сырье для их изготовления с использованием метода атомной эмиссионной спектрометрии с индуктивно связанной плазмой на основе приборов фирмы Perkin-Elmer или аналогов.
7
МУК 4.1.1482—03
1. Погрешность измерений
Методика выполнения измерений обеспечивает получение результатов измерений с погрешностью, не превышающей значений, приведенных в прилож. 1.
2. Сущность метода
Методика основана на окислительно-кислотной «мокрой» минерализации проб исследуемых биосубстратов и препаратов и на последующем анализе ее на требуемые химические элементы методом атомноэмиссионной спектрометрии с использованием в качестве источника возбуждения высокочастотной индуктивно связанной аргоновой плазмы. Цель пробоподготовки состоит в переведении пробы в растворенную форму, удобную для ввода в спектрометр. Переведение в раствор достигается обработкой проб концентрированной азотной кислотой при открытом и автоклавном разложении. Полного предварительного разрушения органической матрицы не требуется, поскольку это не сказывается на протекающей в плазме при высокой температуре атомизации пробы и на процессах возбуждения эмиссионных спектров атомов определяемых элементов. Применение схемы последовательного сканирования позволяет задавать необходимый список требуемых спектральных линий, отвечающих определяемым элементам.
Интенсивность спектральной линии элемента определенным образом связана с его концентрацией в пробе, что позволяет с использованием сопровождающего спектрометр программного обеспечения получать надежные градуировочные характеристики, прямо пропорциональные в интервале пяти—шести порядков. Гарантируемая величина пределов обнаружения, достигаемых на спектрометрах такого класса, составляет доли мкг/л. Сочетание высокой избирательности и последовательного по длинам волн способа измерений позволяет определять до 20—30 элементов из одной подготовленной пробы в течение 4—5 мин.
3. Характеристика спектрометра с индуктивно связанной плазмой
Последовательный атомно-эмиссионный спектрометр типа Optima 2000™ DV и его параллельные аналоги серии Optima 4X00 DV представляют собой оптические спектрометры с полупроводниковыми детекторами типа CCD (charge-coupled device) и с индуктивно связанной плазмой в качестве источника возбуждения спектров. Рабочий диапазон длин волн Optima 2000™ DV 165—800 нм при спектральном разрешении 0,007 (при 193 нм). Спектральная полоса пропускания частот:
8
МУК 4.1.1482—03
0,009 нм на 200 нм, 0,027 нм на 700 нм, монохроматор типа Эшелле. Экспозиция спектров осуществляется автоматически в интервале 0,01— 500 с, количество реплик - произвольное. В спектрометре реализуется спектральная коррекция фона с помощью алгоритма мультиспектраль-ной фильтрации (MSF).
Работа спектрометра полностью управляется и контролируется программным обеспечением WinLab32 в операционной системе Windows 2000. Программное обеспечение позволяет осуществлять полную автоматизацию измерений и управление вспомогательными системами для ввода проб, сохраняет результаты измерений, включая спектры, и дает возможность повторной обработки информации без проведения дополнительных измерений. Результаты анализа выводятся на монитор в требуемом формате, сохраняются в виде файла на жестком диске компьютера и могут быть перенесены на другие носители для дальнейшей обработки.
4. Оборудование, материалы, реактивы
Оборудование Атомно-эмиссионный спектрометр с радиочастотным электромагнитным генератором для возбуждения индуктивно связанной аргоновой плазмы, оборудованный устройством для контроля скоростей потока аргона, компьютером для обработки выходных сигналов спектрометра с возможностью коррекции фоновых сигналов (типа Optima 2000 DV фирмы Perkin-Elmer или подобный, имеющий сертификат Госстандарта России, зарегистрированный в Государственном реестре средств измерений)
Весы аналитические электронные с пределом допускаемой погрешности ± 0,0005 г, отвечающие требованиям весы лабораторные общего назначения ГОСТ 24104 Термоблок фирмы Экрос (мод. 4020) или подобный с 30 или более гнездами для фторопластовых цилиндров, вместимостью 20 мл.
(Возможно использование установок для микроволновой пробоподготовки со фторопластовыми вкладышами в автоклавы.)
9