ГОСТ Р МЭК 60601-2-49-2018
Изделия медицинские электрические. Часть 2-49. Частные требования безопасности с учетом основных функциональных характеристик к многофункциональным мониторам пациента
Купить ГОСТ Р МЭК 60601-2-49-2018 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на требования к основной безопасности и основным функциональным характеристикам многофункциональных мониторов пациента, как определено в 201.3.63, именуемых в дальнейшем МЕ изделия. Стандарт распространяется на МЕ изделия, используемые как в больничных условиях, так и вне больницы, в машинах скорой помощи и в воздушных транспортных средствах.
Оглавление
201.1 Область распространения, цель и соответствующие стандарты
201.2 Нормативные ссылки
201.3 Термины и определения
201.4 Общие требования
201.5 Общие требования к испытаниям МЕ ИЗДЕЛИЯ
201.6 Классификация МЕ ИЗДЕЛИЙ и МЕ СИСТЕМ
201.7 Идентификация, маркировка и документация МЕ ИЗДЕЛИЙ
201.8 Защита от ОПАСНОСТЕЙ поражения электрическим током от МЕ ИЗДЕЛИЯ
201.9 Защита от механических ОПАСНОСТЕЙ, создаваемых МЕ ИЗДЕЛИЯМИ и МЕ СИСТЕМАМИ
201.10 Защита от ОПАСНОСТЕЙ воздействия нежелательного или чрезмерного излучения
201.11 Защита от чрезмерных температур и других ОПАСНОСТЕЙ
201.12 Точность органов управления и измерительных приборов и защита от опасных значений выходных характеристик
201.13 ОПАСНЫЕ СИТУАЦИИ и условия нарушения
201.14 ПРОГРАММИРУЕМЫЕ ЭЛЕКТРИЧЕСКИЕ МЕДИЦИНСКИЕ СИСТЕМЫ (PEMS)
201.15 Конструкция МЕ ИЗДЕЛИЯ
201.16 МЕ СИСТЕМЫ
201.17 Электромагнитная совместимость МЕ ИЗДЕЛИЙ и МЕ СИСТЕМ
202 Электромагнитная совместимость. Требования и испытания
208 Общие требования, испытания и руководящие указания по применению систем сигнализации медицинских электрических изделий и медицинских электрических систем
Приложение АА (справочное) Общие положения и обоснование
Приложение ВВ (справочное) Диаграммы сигнализации по пункту 208 МЭК 60601-1-8:2006
Приложение СС (справочное) Примеры соединения измерительного устройства MD для измерения ТОКА УТЕЧКИ НА ПАЦИЕНТА и ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам
Алфавитный указатель терминов на русском языке
Библиография
| Дата введения | 01.02.2019 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 14.08.2018 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 500-ст |
|---|---|---|---|
| Разработан | ООО Медтехстандарт | ||
| Издан | Стандартинформ | 2018 г. |
Medical electrical equipment. Part 2-49. Particular requirements for the basic safety and essential performance of multifunction patient monitoring equipment
ГОСТ Р ИСО 15223-1-2010Изделия медицинские. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации. Часть 1. Общие требования. Заменен на ГОСТ Р ИСО 15223-1-2014.- ГОСТ Р МЭК 60601-2-2-2013 Изделия медицинские электрические. Часть 2-2. Частные требования безопасности с учетом основных функциональных характеристик к высокочастотным электрохирургическим аппаратам и высокочастотным электрохирургическим принадлежностям
- ГОСТ Р МЭК 60601-1-2-2014 Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания
- ГОСТ Р МЭК 60601-2-27-2013 Изделия медицинские электрические. Часть 2-27. Частные требования безопасности с учетом основных функциональных характеристик к электрокардиографическим мониторам
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14
стр. 15

стр. 16

стр. 17
стр. 18

стр. 19
стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26
стр. 27

стр. 28

стр. 29

стр. 30
|
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ |
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСТРМЭК 60601-2-49— 2018ИЗДЕЛИЯ МЕДИЦИНСКИЕ ЭЛЕКТРИЧЕСКИЕ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ЭЛЕКТРИЧЕСКИЕ
Часть 2-49
Частные требования безопасности с учетом основных функциональных характеристик к многофункциональным мониторам пациента
(IEC 60601-2-49:2011, ЮТ)
Издание официальное
Москва
Стандартинформ
2018
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Медтехстандарт» (ООО «Мед-техстандарт») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 011 «Медицинские приборы, аппараты и оборудование»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 14 августа 2018 г. № 500-ст
4 Настоящий стандарт идентичен международному стандарту МЭК 60601-2-49:2011 «Изделия медицинские электрические. Часть 2-49. Частные требования безопасности с учетом основных функциональных характеристик к многофункциональным мониторам пациента» (IEC 60601-2-49:2011 «Medical electrical equipment — Part 2-49: Particular requirements for the basic safety and essential performance of multifunction patient monitoring equipment», IDT).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВЗАМЕН ГОСТ Р МЭК 60601-2-49-2015
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ, оформление, 2018
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ Р МЭК 60601-2-49-2018201.8.5 Разделение частей
201.8.5.2.3* Отведения ПАЦИЕНТА
Дополнение:
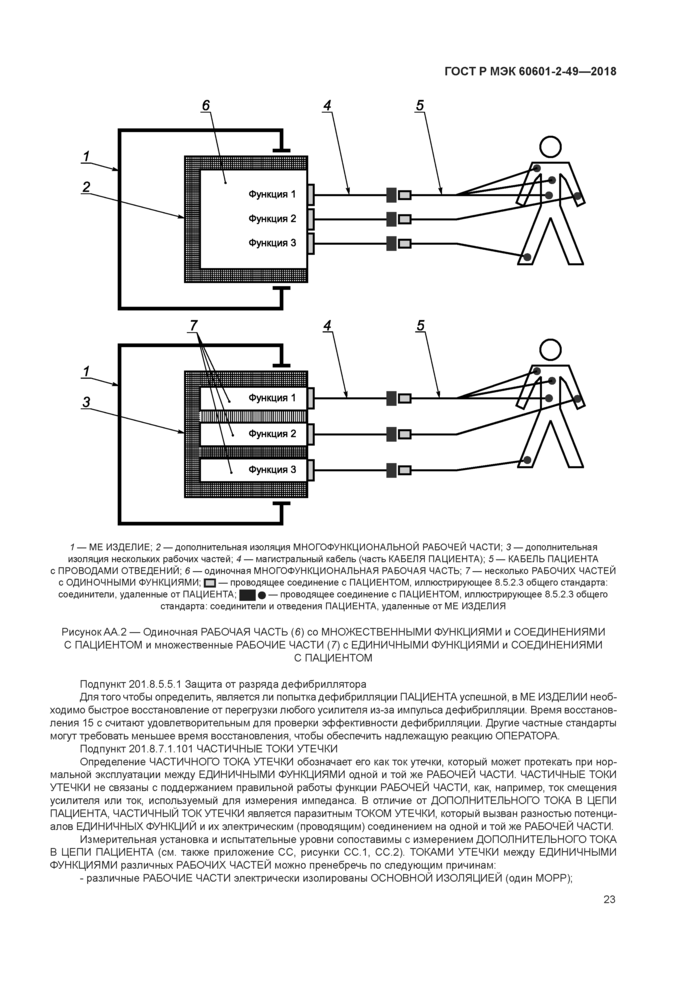
Любой соединитель, предназначенный для электрических соединений с отведением ПАЦИЕНТА, который находится на конце отведения, удаленном от ME ИЗДЕЛИЯ, должен быть сконструирован таким образом, чтобы указанная часть не могла приходить в контакт с землей или опасным напряжением, когда другие СОЕДИНЕНИЯ С ПАЦИЕНТОМ той же ЕДИНИЧНОЙ ФУНКЦИИ или МНОЖЕСТВЕННОЙ ФУНКЦИИ этой же РАБОЧЕЙ ЧАСТИ находятся в контакте с ПАЦИЕНТОМ. Для РАБОЧИХ ЧАСТЕЙ, имеющих несколько СОЕДИНЕНИЙ С ПАЦИЕНТОМ, любой соединитель отведения, имеющий электрические соединения с ME ИЗДЕЛИЕМ, должен соответствовать одному из следующих требований:
- воздушный зазор между контактами соединителя и плоской поверхностью должен быть не менее 0,5 мм; или
- должны быть соблюдены пределы полного ТОКА УТЕЧКИ НА ПАЦИЕНТА ME ИЗДЕЛИЯ, вызванные внешним напряжением на СОЕДИНЕНИИ С ПАЦИЕНТОМ (см. 8.7 и таблицу 4 общего стандарта), при измерении между различными ЕДИНИЧНЫМИ ФУНКЦИЯМИ (см. рисунок СС.З).
201.8.5.5 РАБОЧИЕ ЧАСТИ С ЗАЩИТОЙ ОТ РАЗРЯДА ДЕФИБРИЛЛЯТОРА
201.8.5.5.1* Защита от разряда дефибриллятора
Дополнение к перечислению а):
- неиспользуемых СОЕДИНЕНИЯХ С ПАЦИЕНТОМ любых других МНОЖЕСТВЕННЫХ ФУНКЦИЙ той же РАБОЧЕЙ ЧАСТИ.
Замена перечисления Ь)
После воздействия напряжения дефибриллятора ME ИЗДЕЛИЕ должно возобновить нормальную работу за время, не превышающее 15 с, без вмешательства ОПЕРАТОРА, за исключением случая, когда другое время восстановления предусмотрено другими частными стандартами. ME ИЗДЕЛИЕ должно возобновить нормальную работу в предыдущем режиме, без потери установок ОПЕРАТОРА или сохраненных данных, и соответствовать требованиям ОСНОВНОЙ БЕЗОПАСНОСТИ и ОСНОВНЫХ ФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК.
Дополнение:
аа) ME ИЗДЕЛИЕ должно быть под напряжением при испытаниях в синфазном и дифференциальном режимах.
201.8.7 ТОКИ УТЕЧКИ и ДОПОЛНИТЕЛЬНЫЕ ТОКИ В ЦЕПИ ПАЦИЕНТА
201.8.7.1 Общие требования
Дополнение:
201.8.7.1.101* ЧАСТИЧНЫЕ ТОКИ УТЕЧКИ
ЧАСТИЧНЫЕ ТОКИ УТЕЧКИ РАБОЧИХ ЧАСТЕЙ должны соответствовать следующим требованиям:
a) ЧАСТИЧНЫЙ ТОК УТЕЧКИ РАБОЧИХ ЧАСТЕЙ ТИПА BF
В НОРМАЛЬНОМ СОСТОЯНИИ ЧАСТИЧНЫЙ ТОК УТЕЧКИ не должен превышать значений ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА, указанных в таблице 3 общего стандарта для РАБОЧИХ ЧАСТЕЙ ТИПА BF. УСЛОВИЯ ЕДИНИЧНОГО НАРУШЕНИЯ, указанные в 8.7.2 общего стандарта, не применяют при этом испытании.
ЧАСТИЧНЫЙ ТОК УТЕЧКИ РАБОЧЕЙ ЧАСТИ ТИПА BF должен быть измерен между любой ОДИНОЧНОЙ ФУНКЦИЕЙ и остальными ОДИНОЧНЫМИ ФУНКЦИЯМИ той же РАБОЧЕЙ ЧАСТИ поочередно. Все СОЕДИНЕНИЯ С ПАЦИЕНТОМ должны быть соединены вместе.
Соответствие подтверждается тем, что измеренные токи ниже значений, указанных в таблице 3 общего стандарта для ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА РАБОЧИХ ЧАСТЕЙ ТИПА BF в НОРМАЛЬНОМ СОСТОЯНИИ. УСЛОВИЯ ЕДИНИЧНОГО НАРУШЕНИЯ, указанные в 8.7.2 общего стандарта, не применяют при этом испытании.
b) ЧАСТИЧНЫЙ ТОК УТЕЧКИ РАБОЧИХ ЧАСТЕЙ ТИПА CF
В НОРМАЛЬНОМ СОСТОЯНИИ ЧАСТИЧНЫЙ ТОК УТЕЧКИ не должен превышать значений ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА, указанных в таблице 3 общего стандарта для РАБОЧИХ ЧАСТЕЙ ТИПА CF.
Для РАБОЧИХ ЧАСТЕЙ ТИПА CF ЧАСТИЧНЫЕ ТОКИ УТЕЧКИ должны быть поочередно измерены между каждым СОЕДИНЕНИЕМ С ПАЦИЕНТОМ ОДИНОЧНОЙ ФУНКЦИИ и остальными ОДИНОЧНЫМИ ФУНКЦИЯМИ, соединенными вместе.
7
Соответствие подтверждается тем, что измеренные токи ниже значений, указанных в таблице 3 общего стандарта для ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА РАБОЧИХ ЧАСТЕЙ ТИПА CF в НОРМАЛЬНОМ СОСТОЯНИИ. УСЛОВИЯ ЕДИНИЧНОГО НАРУШЕНИЯ, указанные в 8.7.2 общего стандарта, не применяют при этом испытании.
Примечание — См. примеры конфигураций в приложении СС.
201.9 Защита от механических ОПАСНОСТЕЙ, создаваемых ME ИЗДЕЛИЯМИ и ME СИСТЕМАМИ
Применяют пункт 9 общего стандарта.
201.10 Защита от ОПАСНОСТЕЙ воздействия нежелательного или чрезмерного излучения
Применяют пункт 10 общего стандарта.
201.11 Защита от чрезмерных температур и других ОПАСНОСТЕЙ
Применяют пункт 11 общего стандарта, за исключением следующего:
201.11.6.5* Проникание воды или твердых частиц в ME ИЗДЕЛИЯ и ME СИСТЕМЫ
Дополнение:
ПЕРЕНОСНЫЕ/ТРАНСПОРТИРУЕМЫЕ ME ИЗДЕЛИЯ или части ME ИЗДЕЛИЯ, которые продолжают функционировать после отделения, должны быть сконструированы таким образом, чтобы в случае утечки жидкости (случайные смачивания) не возникало ОПАСНЫХ СИТУАЦИЙ от проникновения жидкости внутрь.
ME ИЗДЕЛИЕ должно соответствовать требованиям электрической прочности изоляции, указанным в 8.8.3 общего стандарта, и требованиям настоящего стандарта.
Соответствие требованию проверяют следующим испытанием:
Помещают ПЕРЕНОСНОЕ/ТРАНСПОРТИРУЕМОЕ ME ИЗДЕЛИЕ или часть ME ИЗДЕЛИЯ в наименее выгодное положение НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ. Подвергают ME ИЗДЕЛИЕ искусственным осадкам с расходом 3 мм/мин, падающим вертикально с высоты 0,5 м на верхнюю часть ME ИЗДЕЛИЯ, в течение 30 с.
Испытательное устройство показано на рисунке 3 МЭК 60529.
Может быть использовано заграждающее устройство для обеспечения продолжительности испытания.
Сразу после 30-секундного воздействия удаляют видимую влагу на КОРПУСЕ.
Непосредственно после описанных выше испытаний проверяют (путем осмотра), что любая вода, которая попала в ME ИЗДЕЛИЕ, не может отрицательно влиять на ОСНОВНУЮ БЕЗОПАСНОСТЬ ME ИЗДЕЛИЯ. Проверяют, что ME ИЗДЕЛИЕ выдерживает соответствующие испытания электрической прочности изоляции (см. 8.8.3 общего стандарта) и не возникает ОПАСНЫХ СИТУАЦИЙ.
После проведения этого испытания удостоверяют, что ME ИЗДЕЛИЕ соответствует требованиям настоящего стандарта.
201.11.8* Прерывание питания/ПИТАЮЩЕЙ СЕТИ ME ИЗДЕЛИЯ
Дополнение:
Если напряжение ПИТАЮЩЕЙ СЕТИ ME ИЗДЕЛИЯ было прервано на 30 с или менее, настройки ОПЕРАТОРА не должны измениться и все сохраненные данные ПАЦИЕНТА должны быть доступны.
Примечание — ME ИЗДЕЛИЕ может не работать при прерывании напряжения ПИТАЮЩЕЙ СЕТИ.
Соответствие проверяют проверкой режима работы ME ИЗДЕЛИЯ, настроек ОПЕРАТОРА и сохраненных данных при прерывании напряжения ПИТАЮЩЕЙ СЕТИ на время от 25 до 30 с отключением ШНУРА ПИТАНИЯ.
Если напряжение ПИТАЮЩЕЙ СЕТИ прерывается более чем на 30 с, последующее функционирование должно быть одним из следующих:
8
- возврат к настройкам ИЗГОТОВИТЕЛЯ по умолчанию;
- возврат к прежним настройкам по умолчанию, сделанным ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИЕЙ; или
- возврат к последним использованным настройкам.
Примечание — Для ОПЕРАТОРА могут быть предусмотрены средства для выбора одного или более из вышеперечисленных вариантов.
Соответствие проверяют функциональными испытаниями.
Если ME ИЗДЕЛИЕ содержит ВНУТРЕННИЙ ИСТОЧНИК ПИТАНИЯ и напряжение ПИТАЮЩЕЙ СЕТИ прервано, то ME ИЗДЕЛИЕ должно продолжать функционировать в обычном режиме путем автоматического переключения на работу от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ, при этом режим работы, все настройки ОПЕРАТОРА и сохраненные данные не должны изменяться. Энергосберегающие меры могут быть применены при условии, что ME ИЗДЕЛИЕ продолжает соответствовать настоящему стандарту.
ME ИЗДЕЛИЕ должно визуально индицировать работу от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ.
Соответствие проверяют путем прерывания напряжения ПИТАЮЩЕЙ СЕТИ и наблюдения того, что настройки ОПЕРАТОРА и сохраненные данные не изменились, что нормальная работа продолжается и что имеется визуальная индикация работы ME ИЗДЕЛИЯ от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ. Переключатель on-off должен оставаться в положении on (включено).
Дополнение:
201.11.8.101 Защита от разрядки батареи
ME ИЗДЕЛИЕ при питании от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ не должно создавать ОПАСНЫХ СИТУАЦИЙ для ПАЦИЕНТА, когда уровень заряда больше не может поддерживать НОРМАЛЬНУЮ ЭКСПЛУАТАЦИЮ ME ИЗДЕЛИЯ (см. 201.15.4.4.101). При этом ME ИЗДЕЛИЕ должно формировать ТЕХНИЧЕСКУЮ ТРЕВОЖНУЮ СИТУАЦИЮ, информирующую ОПЕРАТОРА о состоянии разрядки, и выключаться контролируемым образом, как описано далее:
a) ME ИЗДЕЛИЕ должно формировать ТЕХНИЧЕСКУЮ ТРЕВОЖНУЮ СИТУАЦИЮ не менее чем за 5 мин до того, как ME ИЗДЕЛИЕ больше не сможет функционировать в соответствии со спецификацией ИЗГОТОВИТЕЛЯ при питании от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ.
Соответствие проверяют функциональными испытаниями.
b) * Когда уровень заряда ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ таков, что ME ИЗДЕЛИЕ больше не может функционировать в соответствии со спецификацией ИЗГОТОВИТЕЛЯ, ME ИЗДЕЛИЕ должно выключиться таким образом, чтобы не создавать ОПАСНЫХ СИТУАЦИЙ для ПАЦИЕНТА.
Соответствие проверяют при работе ME ИЗДЕЛИЯ от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ и функциональными испытаниями.
201.12 Точность органов управления и измерительных приборов и защита от опасных значений выходных характеристик
Применяют пункт 12 общего стандарта, за исключением следующего:
201.12.3 Системы сигнализации
Дополнение:
ME ИЗДЕЛИЕ должно быть оборудовано СИСТЕМОЙ СИГНАЛИЗАЦИИ, как указано в пункте 208.
201.13 ОПАСНЫЕ СИТУАЦИИ и условия нарушения
Применяют пункт 13 общего стандарта.
201.14 ПРОГРАММИРУЕМЫЕ ЭЛЕКТРИЧЕСКИЕ МЕДИЦИНСКИЕ СИСТЕМЫ (PEMS)
Применяют пункт 14 общего стандарта.
9
201.15 Конструкция ME ИЗДЕЛИЯ
Применяют пункт 15 общего стандарта, за исключением следующего:
201.15.4.4 Индикаторы Дополнение:
201.15.4.4.101 Индикатор работы батареи и состояния заряда батареи
ME ИЗДЕЛИЕ должно визуально отображать свое функционирование от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ, за исключением случая, когда оно функционирует исключительно от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ.
ME ИЗДЕЛИЕ с ВНУТРЕННИМ ИСТОЧНИКОМ ПИТАНИЯ должно визуально отображать оставшийся заряд при функционировании от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ.
Соответствие проверяют осмотром и измерениями.
201.16 ME СИСТЕМЫ
Пункт 16 общего стандарта не применим.
201.17 Электромагнитная совместимость ME ИЗДЕЛИЙ и ME СИСТЕМ
Применяют пункт 17 общего стандарта, за исключением следующего:
См. пункт 202.
202 Электромагнитная совместимость. Требования и испытания
Применяют МЭК 60601-1-2:2007, за исключением следующего:
202.5.2.2.2 Требования к ME ИЗДЕЛИЯМ и ME СИСТЕМАМ, отличным от тех, которые предназначены для использования только в экранированном помещении
Дополнение:
МНОГОФУНКЦИОНАЛЬНЫЕ МОНИТОРЫ ПАЦИЕНТА и их ПРИНАДЛЕЖНОСТИ не должны считаться ME ИЗДЕЛИЯМИ ЖИЗНЕОБЕСПЕЧЕНИЯ.
202.6 ЭЛЕКТРОМАГНИТНАЯ СОВМЕСТИМОСТЬ
202.6.1 ЭЛЕКТРОМАГНИТНАЯ ЭМИССИЯ
202.6.1.1.1* Требования Дополнение:
Модульные и предварительно сконфигурированные ME ИЗДЕЛИЯ должны быть испытаны с максимальным числом ФИЗИОЛОГИЧЕСКИХ МОНИТОРНЫХ БЛОКОВ. Все указанные ФИЗИОЛОГИЧЕСКИЕ МОНИТОРНЫЕ БЛОКИ должны быть испытаны. Представительные образцы каждого семейства КАБЕЛЕЙ ПАЦИЕНТА и/или ПРЕОБРАЗОВАТЕЛЕЙ с аналогичной конструкцией, перечисленные в ЭКСПЛУАТАЦИОННЫХ ДОКУМЕНТАХ, должны быть испытаны вместе с соответствующим ФИЗИОЛОГИЧЕСКИМ МОНИТОРНЫМ БЛОКОМ.
202.6.1.1.2 Испытания
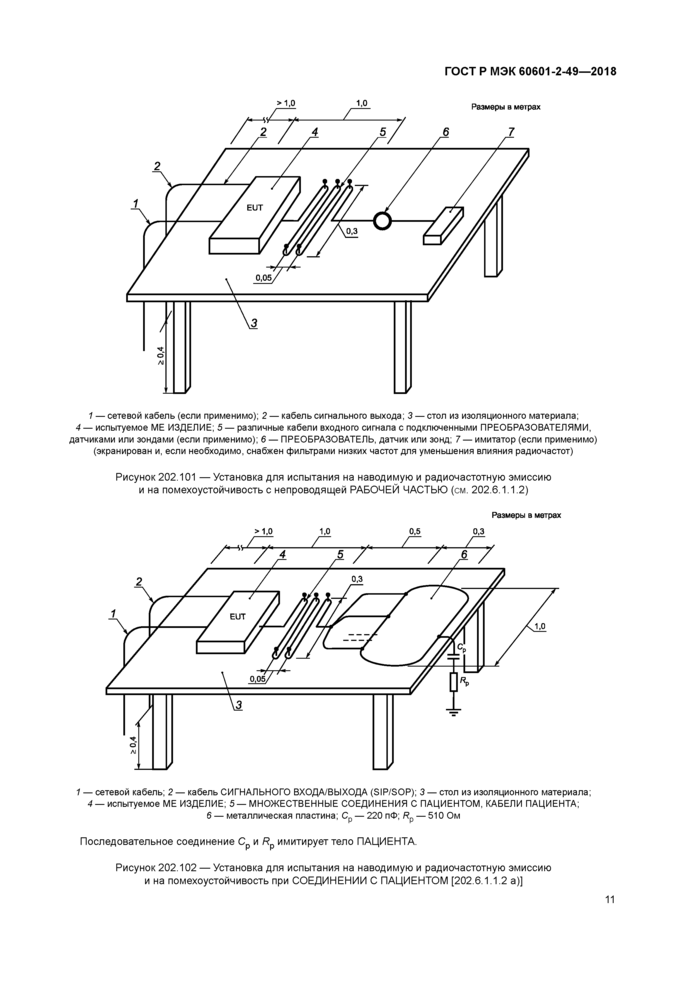
а)* Кабели ПАЦИЕНТА Замена:
ME ИЗДЕЛИЯ должны быть испытаны с кабелями ПРЕОБРАЗОВАТЕЛЕЙ и КАБЕЛЯМИ ПАЦИЕНТА, указанными ИЗГОТОВИТЕЛЕМ, со всеми кабелями СИГНАЛЬНЫХ ВХОДОВ/ВЫХОДОВ (SIP/ SOP), подключенными к ME ИЗДЕЛИЮ (см. рисунки 202.101 и 202.102). При этом расстояния между свободным концом SIP/SOP-кабелей и полом (заземленной поверхностью) должны быть > 40 см. Если ИЗГОТОВИТЕЛЬ указывает КАБЕЛИ ПАЦИЕНТА или кабели для ПРЕОБРАЗОВАТЕЛЕЙ различной длины, только один представительный образец должен быть испытан.
RC-цепочку (Ср, R^) и металлическую пластину (6), представленные на рисунке 202.102, не используют при испытаниях на электромагнитную эмиссию.
ГОСТ Р МЭК 60601-2-49-2018
1 — сетевой кабель (если применимо); 2 — кабель сигнального выхода; 3 — стол из изоляционного материала;
4 — испытуемое ME ИЗДЕЛИЕ; 5 — различные кабели входного сигнала с подключенными ПРЕОБРАЗОВАТЕЛЯМИ, датчиками или зондами (если применимо); 6 — ПРЕОБРАЗОВАТЕЛЬ, датчик или зонд; 7 — имитатор (если применимо) (экранирован и, если необходимо, снабжен фильтрами низких частот для уменьшения влияния радиочастот)
|
Рисунок 202.101 — Установка для испытания на наводимую и радиочастотную эмиссию и на помехоустойчивость с непроводящей РАБОЧЕЙ ЧАСТЬЮ (см. 202.6.1.1.2) Размеры в метрах >1,0 1,0 0,5 0,3 |
1 — сетевой кабель; 2 — кабель СИГНАЛЬНОГО ВХОДА/ВЫХОДА (SIP/SOP); 3 — стол из изоляционного материала; 4 —испытуемое ME ИЗДЕЛИЕ; 5 — МНОЖЕСТВЕННЫЕ СОЕДИНЕНИЯ С ПАЦИЕНТОМ, КАБЕЛИ ПАЦИЕНТА;
6 — металлическая пластина; Ср — 220 пФ; Рр — 510 Ом
Последовательное соединение С и R имитирует тело ПАЦИЕНТА.
г г
Рисунок 202.102 — Установка для испытания на наводимую и радиочастотную эмиссию и на помехоустойчивость при СОЕДИНЕНИИ С ПАЦИЕНТОМ [202.6.1.1.2 а)]
11
202.6.2 ПОМЕХОУСТОЙЧИВОСТЬ
202.6.2.1.1 Испытательные уровни при испытаниях на ПОМЕХОУСТОЙЧИВОСТЬ Дополнение:
Модульные и предварительно сконфигурированные ME ИЗДЕЛИЯ должны быть испытаны с максимальным числом ФИЗИОЛОГИЧЕСКИХ МОНИТОРНЫХ БЛОКОВ. Все указанные ФИЗИОЛОГИЧЕСКИЕ МОНИТОРНЫЕ БЛОКИ должны быть испытаны. Представительные образцы каждого семейства КАБЕЛЕЙ ПАЦИЕНТА и/или ПРЕОБРАЗОВАТЕЛЕЙ с аналогичной конструкцией, перечисленные в ЭКСПЛУАТАЦИОННЫХ ДОКУМЕНТАХ, должны быть испытаны вместе с соответствующим ФИЗИОЛОГИЧЕСКИМ МОНИТОРНЫМ БЛОКОМ.
202.6.2.1.10 Критерии соответствия Дополнение:
ME ИЗДЕЛИЕ должно соответствовать требованиям МЭК 60601 -1 -2:2007, за исключением случая, когда в других частных стандартах указаны конкретные критерии соответствия для данного подпункта. Рисунок 202.101 применяют.
202.6.2.2 ЭЛЕКТРОСТАТИЧЕСКИЕ РАЗРЯДЫ
202.6.2.2.1 Требования Дополнение:
ME ИЗДЕЛИЕ может показать временное УХУДШЕНИЕ (КАЧЕСТВА ФУНКЦИОНИРОВАНИЯ) в процессе разряда. В течение 10 с ME ИЗДЕЛИЕ должно восстановить нормальную работу в предыдущем рабочем режиме без потери настроек ОПЕРАТОРА или сохраненных данных и продолжать выполнять свою предусмотренную функцию, как изложено в ЭКСПЛУАТАЦИОННЫХ ДОКУМЕНТАХ.
202.6.2.3 Излучаемые радиочастотные электромагнитные поля
202.6.2.3.2 Испытания Дополнение:
аа) любой кабель SIP/SOP и ШНУР ПИТАНИЯ располагают, как показано на рисунке 202.101. Между кабелями SIP/SOP и полом (заземленной поверхностью) соблюдают расстояния > 40 см.
202.6.2.4 Наносекундные импульсные помехи
202.6.2.4.1 Требования Дополнение:
При воздействии наносекундных импульсных помех (EFT/B) по ШНУРУ ПИТАНИЯ ME ИЗДЕЛИЕ должно продолжать выполнять свою предусмотренную функцию, как изложено в ЭКСПЛУАТАЦИОННЫХ ДОКУМЕНТАХ.
Испытание КАБЕЛЕЙ ПАЦИЕНТА, кабелей ПРЕОБРАЗОВАТЕЛЕЙ и соединительных кабелей длиной более 3 м может показать временное УХУДШЕНИЕ (КАЧЕСТВА ФУНКЦИОНИРОВАНИЯ) при воздействии наносекундных импульсных помех. В течение 10 с ME ИЗДЕЛИЕ должно восстановить нормальную работу в предыдущем рабочем режиме без потери настроек ОПЕРАТОРА или сохраненных данных и продолжать выполнять свою предусмотренную функцию, как изложено в ЭКСПЛУАТАЦИОННЫХ ДОКУМЕНТАХ.
202.6.2.4.2 Испытания Дополнение:
аа) ME ИЗДЕЛИЕ должно быть расположено на высоте (0,8 ± 0,08) м над опорной заземленной поверхностью;
bb) шнур питания, поставляемый с ME ИЗДЕЛИЕМ, должен быть использован для подключения ME ИЗДЕЛИЯ к выходу EFT/B генератора.
202.6.2.6 Кондуктивные помехи, наведенные радиочастотными электромагнитными полями
202.6.2.6.1 Требования Дополнение:
аа) при воздействии кондуктивных помех, наведенных радиочастотными электромагнитными полями, через ШНУР ПИТАНИЯ ME ИЗДЕЛИЕ должно продолжать выполнять свою предусмотренную функцию и поддерживать ОСНОВНЫЕ ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ.
bb) КАБЕЛИ ПАЦИЕНТА и кабели ПРЕОБРАЗОВАТЕЛЕЙ освобождены от этого требования.
202.6.2.6.2 Испытания Дополнение:
аа) перечисления с) и е) подпункта 6.2.6.2 МЭК 60601-1-2:2007 не применяют.
ГОСТ Р МЭК 60601-2-49-2018
Дополнение:
202.6.2.101* Влияние электрохирургического оборудования
Для МНОГОФУНКЦИОНАЛЬНЫХ МОНИТОРОВ ПАЦИЕНТА, предназначенных для применения в присутствии ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА, должны быть предусмотрены средства для защиты от неисправности, вызванной электрохирургией. Применяют испытание, описанное ниже, с использованием любых КАБЕЛЕЙ ПАЦИЕНТА, ПРОВОДОВ ОТВЕДЕНИЙ, ПРЕОБРАЗОВАТЕЛЕЙ, принадлежностей или настроек, рекомендуемых ИЗГОТОВИТЕЛЕМ.
Когда ME ИЗДЕЛИЕ используют совместно с ВЧ ЭЛЕКТРОХИРУРГИЧЕСКИМ АППАРАТОМ, оно должно восстановить предыдущий режим работы в течение 10 с после воздействия поля, создаваемого ВЧ ЭЛЕКТРОХИРУРГИЧЕСКИМ АППАРАТОМ, без потери сохраненных данных.
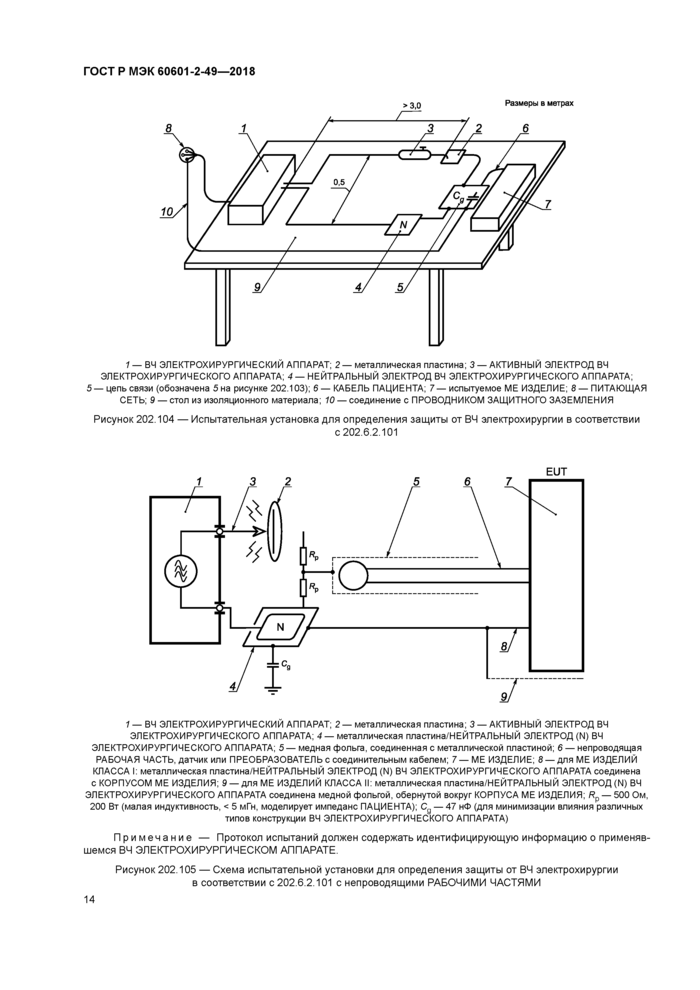
Соответствие проверяют испытаниями на установках согласно рисункам 202.103, 202.104 и/или 202.105. Рисунки 202.103 и 202.104 представляют испытательные установки, которые используют для СОЕДИНЕНИЙ С ПАЦИЕНТОМ, в то время как на рисунке 202.105 показана испытательная установка, которую используют для непроводящих РАБОЧИХ ЧАСТЕЙ ME ИЗДЕЛИЙ КЛАССА I или КЛАССА II.
Используют ВЧ ЭЛЕКТРОХИРУРГИЧЕСКИЙ АППАРАТ, который соответствует требованиям МЭК 60601-2-2, имеет минимальную мощность в режиме резания 300 Вт, минимальную мощность в режиме коагуляции 100 Вт и рабочую частоту 400 кГц ± 10 %.
a) Испытание в режиме резания
Устанавливают выходную мощность ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА на уровне 300 Вт.
Прикасаются АКТИВНЫМ ЭЛЕКТРОДОМ к металлической пластине испытательной установки (см. рисунки 202.103—202.105) и медленно удаляют электрод для получения дуги.
Проверяют, что ME ИЗДЕЛИЕ в течение 10 с восстанавливает предыдущий режим работы без потери сохраненных данных.
Повторяют процедуру пять раз.
b) Испытание в режиме коагуляции
Повторяют испытание, описанное в перечислении а), но с выходной мощностью 100 Вт.
Испытания в режиме спрей-коагуляции не проводят.
|
1 — ВЧ ЭЛЕКТРОХИРУРГИЧЕСКИИ АППАРАТ; 2 — металлическая пластина; 3 — АКТИВНЫМ ЭЛЕКТРОД ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА; 4 — металлическая пластина/НЕЙТРАЛЬНЫЙ ЭЛЕКТРОД (N) ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА; 5 — цепь связи; 6 — СОЕДИНЕНИЕ С ПАЦИЕНТОМ, КАБЕЛЬ ПАЦИЕНТА; 7 — ME ИЗДЕЛИЕ; Rp — 500 Ом, 200 Вт (малая индуктивность, < 5 мГн, моделирует импеданс ПАЦИЕНТА); Сд — 47 нФ (для минимизации влияния разных типов конструкции ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА); Rs — 51 кОм (Rs, соединенное параллельно с Cs, моделирует импеданс кожи); Cs — 47 нФ; R, L, F, С, N — СОЕДИНЕНИЯ С ПАЦИЕНТОМ |
Примечание — Протокол испытаний должен содержать идентифицирующую информацию о применявшемся ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОМ АППАРАТЕ.
Рисунок 202.103 — Схема испытательной установки для определения защиты от ВЧ электрохирургии в соответствии с 202.6.2.101 при СОЕДИНЕНИИ С ПАЦИЕНТОМ
13
ГОСТ Р МЭК 60601-2-49-2018
Размеры в метрах
|
Размеры в метрах |
1 — ВЧ ЭЛЕКТРОХИРУРГИЧЕСКИИ АППАРАТ; 2 — металлическая пластина; 3 — АКТИВНЫМ ЭЛЕКТРОД ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА; 4 — НЕЙТРАЛЬНЫЙ ЭЛЕКТРОД ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА;
|
Рисунок 202.104 — Испытательная установка для определения защиты от ВЧ электрохирургии в соответствии с 202.6.2.101 |
5 — цепь связи (обозначена 5 на рисунке 202.103); 6 — КАБЕЛЬ ПАЦИЕНТА; 7 — испытуемое ME ИЗДЕЛИЕ; 8 — ПИТАЮЩАЯ СЕТЬ; 9 — стол из изоляционного материала; 10 — соединение с ПРОВОДНИКОМ ЗАЩИТНОГО ЗАЗЕМЛЕНИЯ
EUT
1 — ВЧ ЭЛЕКТРОХИРУРГИЧЕСКИИ АППАРАТ; 2 — металлическая пластина; 3 — АКТИВНЫМ ЭЛЕКТРОД ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА; 4 — металлическая пластина/НЕЙТРАЛЬНЫЙ ЭЛЕКТРОД (N) ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА; 5 — медная фольга, соединенная с металлической пластиной; 6 — непроводящая РАБОЧАЯ ЧАСТЬ, датчик или ПРЕОБРАЗОВАТЕЛЬ с соединительным кабелем; 7 — ME ИЗДЕЛИЕ; 8 — для ME ИЗДЕЛИЙ КЛАССА I: металлическая пластина/НЕЙТРАЛЬНЫЙ ЭЛЕКТРОД (N) ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА соединена с КОРПУСОМ ME ИЗДЕЛИЯ; 9 — для ME ИЗДЕЛИЙ КЛАССА II: металлическая пластина/НЕЙТРАЛЬНЫЙ ЭЛЕКТРОД (N) ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА соединена медной фольгой, обернутой вокруг КОРПУСА ME ИЗДЕЛИЯ; Рр — 500 Ом, 200 Вт (малая индуктивность, < 5 мГн, моделирует импеданс ПАЦИЕНТА); Сд — 47 нФ (для минимизации влияния различных
типов конструкции ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОГО АППАРАТА)
Примечание — Протокол испытаний должен содержать идентифицирующую информацию о применявшемся ВЧ ЭЛЕКТРОХИРУРГИЧЕСКОМ АППАРАТЕ.
Рисунок 202.105 — Схема испытательной установки для определения защиты от ВЧ электрохирургии в соответствии с 202.6.2.101 с непроводящими РАБОЧИМИ ЧАСТЯМИ
208 Общие требования, испытания и руководящие указания по применению систем сигнализации медицинских электрических изделий и медицинских электрических систем
Применяют МЭК 60601-1-8:2006, за исключением следующего (см. также диаграммы сигнализации в приложении ВВ):
208.6 СИСТЕМЫ СИГНАЛИЗАЦИИ
208.6.1 ТРЕВОЖНАЯ СИТУАЦИЯ
208.6.1.2* Приоритет ТРЕВОЖНЫХ СИТУАЦИЙ
Дополнение:
ME ИЗДЕЛИЕ, ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ которого включает в себя мониторинг ПАЦИЕНТОВ, при котором в условиях НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ не требуется непрерывное присутствие ОПЕРАТОРА, должно относить ТРЕВОЖНУЮ СИТУАЦИЮ, результатом которой могут быть незначительные травмы и отложенное наступление возможного ВРЕДА, к ТРЕВОЖНЫМ СИТУАЦИЯМ НИЗКОГО ПРИОРИТЕТА (см. таблицу 208.101).
ЭКСПЛУАТАЦИОННЫЕ ДОКУМЕНТЫ должны описывать, как ОТВЕТСТВЕННАЯ ОРГАНИЗАЦИЯ может включить или отключить звуковые СИГНАЛЫ ОПАСНОСТИ в ТРЕВОЖНЫХ СИТУАЦИЯХ НИЗКОГО ПРИОРИТЕТА. Применяют требования 6.7 МЭК 60601 -1 -8:2006.
Примечание — Такая адаптация требует дополнительных возможностей конфигурации для данного ME ИЗДЕЛИЯ. Эта возможность необходима, когда в ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ нужны звуковые СИГНАЛЫ ОПАСНОСТИ в ТРЕВОЖНЫХ СИТУАЦИЯХ НИЗКОГО ПРИОРИТЕТА, например для отделений интенсивной терапии в отсутствие центрального мониторинга.
а Появлением потенциального ВРЕДА считается момент, когда происходит травма, а не когда она проявляется.
ь Существует возможность развития события в период времени, обычно недостаточный для того, чтобы вручную проводить коррекцию.
с Существует возможность развития события в период времени, обычно достаточный для того, чтобы вручную проводить коррекцию.
d Существует возможность развития события в неопределенный период времени, больший, чем указано в графе «Быстро».
е При возможности ME ИЗДЕЛИЕ с терапевтической функцией включает автоматические защитные механизмы для предотвращения немедленной смерти или необратимых повреждений, вызванных ME ИЗДЕЛИЕМ (см. также соответствующие частные стандарты).
Таблица 208.101 изменяет таблицу 1 — Приоритеты ТРЕВОЖНЫХ СИТУАЦИЙ для ME ИЗДЕЛИЙ, ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ которых включает в себя мониторинг ПАЦИЕНТОВ, при котором в условиях НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ не требуется непрерывного присутствия ОПЕРАТОРА.
|
Таблица 208.101 — Приоритеты ТРЕВОЖНЫХ СИТУАЦИЙ для ME ИЗДЕЛИЙ, ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ которых включает в себя мониторинг ПАЦИЕНТОВ, при котором в условиях НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ не требуется непрерывное присутствие ОПЕРАТОРА | ||||||||||||||||||||
| ||||||||||||||||||||
15
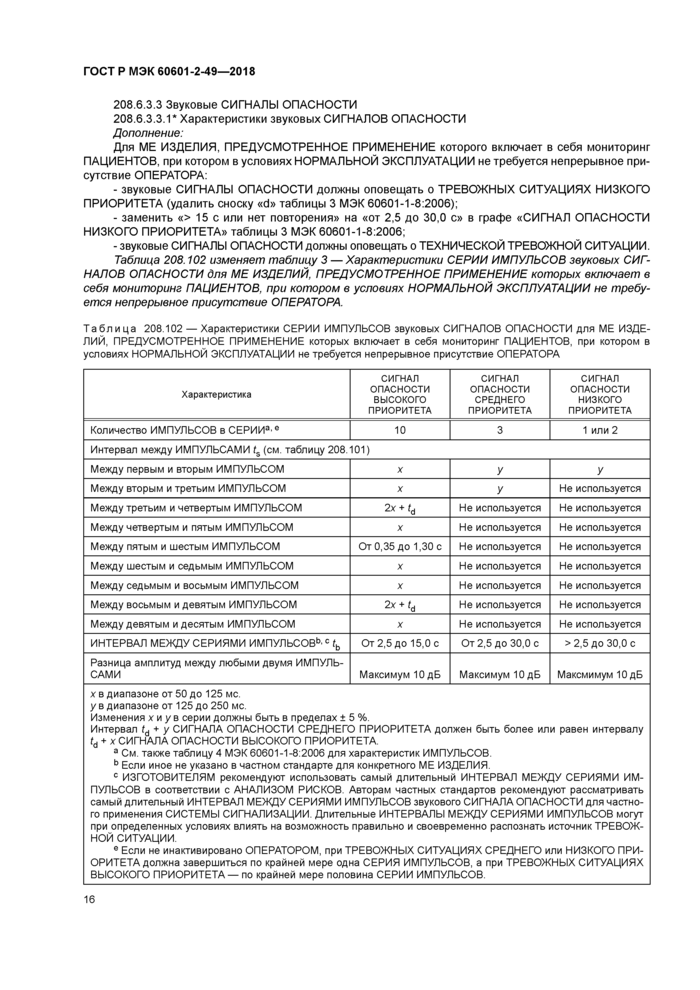
208.6.3.3 Звуковые СИГНАЛЫ ОПАСНОСТИ
208.6.3.3.1* Характеристики звуковых СИГНАЛОВ ОПАСНОСТИ
Дополнение:
Для ME ИЗДЕЛИЯ, ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ которого включает в себя мониторинг ПАЦИЕНТОВ, при котором в условиях НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ не требуется непрерывное присутствие ОПЕРАТОРА:
- звуковые СИГНАЛЫ ОПАСНОСТИ должны оповещать о ТРЕВОЖНЫХ СИТУАЦИЯХ НИЗКОГО ПРИОРИТЕТА (удалить сноску «б» таблицы 3 МЭК 60601-1-8:2006);
- заменить «> 15 с или нет повторения» на «от 2,5 до 30,0 с» в графе «СИГНАЛ ОПАСНОСТИ НИЗКОГО ПРИОРИТЕТА» таблицы 3 МЭК 60601-1-8:2006;
- звуковые СИГНАЛЫ ОПАСНОСТИ должны оповещать о ТЕХНИЧЕСКОЙ ТРЕВОЖНОЙ СИТУАЦИИ. Таблица 208.102 изменяет таблицу 3 — Характеристики СЕРИИ ИМПУЛЬСОВ звуковых СИГ-
НАЛОВ ОПАСНОСТИ для ME ИЗДЕЛИЙ, ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ которых включает в себя мониторинг ПАЦИЕНТОВ, при котором в условиях НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ не требуется непрерывное присутствие ОПЕРАТОРА.
|
Таблица 208.102 — Характеристики СЕРИИ ИМПУЛЬСОВ звуковых СИГНАЛОВ ОПАСНОСТИ для ME ИЗДЕЛИЙ, ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ которых включает в себя мониторинг ПАЦИЕНТОВ, при котором в условиях НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ не требуется непрерывное присутствие ОПЕРАТОРА | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ГОСТ Р МЭК 60601-2-49-2018Содержание
201.1 Область распространения, цель и соответствующие стандарты...........................1
201.2 Нормативные ссылки..............................................................2
201.3 Термины и определения............................................................3
201.4 Общие требования................................................................4
201.5 Общие требования к испытаниям ME ИЗДЕЛИЯ........................................4
201.6 Классификация ME ИЗДЕЛИЙ и ME СИСТЕМ..........................................5
201.7 Идентификация, маркировка и документация ME ИЗДЕЛИЙ..............................5
201.8 Защита от ОПАСНОСТЕЙ поражения электрическим током от ME ИЗДЕЛИЯ................6
201.9 Защита от механических ОПАСНОСТЕЙ, создаваемых ME ИЗДЕЛИЯМИ и ME СИСТЕМАМИ . . 8
201.10 Защита от ОПАСНОСТЕЙ воздействия нежелательного или чрезмерного излучения........8
201.11 Защита от чрезмерных температур и других ОПАСНОСТЕЙ.............................8
201.12 Точность органов управления и измерительных приборов и защита от опасных значений
выходных характеристик..........................................................9
201.13 ОПАСНЫЕ СИТУАЦИИ и условия нарушения.........................................9
201.14 ПРОГРАММИРУЕМЫЕ ЭЛЕКТРИЧЕСКИЕ МЕДИЦИНСКИЕ СИСТЕМЫ (PEMS).............9
201.15 Конструкция ME ИЗДЕЛИЯ........................................................9
201.16 ME СИСТЕМЫ..................................................................10
201.17 Электромагнитная совместимость ME ИЗДЕЛИЙ и ME СИСТЕМ........................10
202 Электромагнитная совместимость. Требования и испытания..............................10
208 Общие требования, испытания и руководящие указания по применению систем сигнализации
медицинских электрических изделий и медицинских электрических систем .................15
Приложение АА (справочное) Общие положения и обоснование..............................20
Приложение СС (справочное) Примеры соединения измерительного устройства MD для измерения
ТОКА УТЕЧКИ НА ПАЦИЕНТА и ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА... 30 Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
Приложение ВВ (справочное) Диаграммы сигнализации по пункту 208 МЭК 60601-1-8:2006........ 28
национальным стандартам...............................................33
Алфавитный указатель терминов на русском языке.........................................34
Библиография........................................................................36
ЭКСПЛУАТАЦИОННЫЕ ДОКУМЕНТЫ должны описывать, как ОТВЕТСТВЕННАЯ ОРГАНИЗАЦИЯ может включить или отключить звуковые СИГНАЛЫ ОПАСНОСТИ при ТРЕВОЖНОЙ СИТУАЦИИ НИЗКОГО ПРИОРИТЕТА и может ограничить доступ к управлению СЕРИЯМИ ИМПУЛЬСОВ всех звуковых СИГНАЛОВ ОПАСНОСТИ. Применяют требования 6.7 МЭК 60601-1-8:2006.
Примечание — Такая адаптация требует дополнительных возможностей конфигурации для данного ME ИЗДЕЛИЯ. Эта возможность необходима, когда в ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ нужны звуковые СИГНАЛЫ ТРЕВОГИ в ТРЕВОЖНЫХ СИТУАЦИЯХ НИЗКОГО ПРИОРИТЕТА, например для отделений интенсивной терапии в отсутствие центрального мониторинга.
Для определения максимального ИНТЕРВАЛА МЕЖДУ СЕРИЯМИ ИМПУЛЬСОВ звуковых СИГНАЛОВ ОПАСНОСТИ, связанных с ВЫСОКИМ, СРЕДНИМ и НИЗКИМ ПРИОРИТЕТОМ ТРЕВОЖНОЙ СИТУАЦИИ, должен быть применен МЕНЕДЖМЕНТ РИСКА.
Соответствие проверяют рассмотрением ФАЙЛА МЕНЕДЖМЕНТА РИСКА.
208.6.3.3.2 Громкость звуковых СИГНАЛОВ ОПАСНОСТИ и ИНФОРМАЦИОННЫХ СИГНАЛОВ Дополнение:
208.6.3.3.2.101* Громкость звуковых СИГНАЛОВ ОПАСНОСТИ, уменьшаемая до нуля Если ОПЕРАТОР уменьшает уровень звуковых СИГНАЛОВ ОПАСНОСТИ до нуля (звук отсутствует), должно быть индицировано состояние ЗВУКОВАЯ СИГНАЛИЗАЦИЯ ОТКЛЮЧЕНА, за исключением случая, когда ME ИЗДЕЛИЕ является частью РАСПРЕДЕЛЕННОЙ СИСТЕМЫ СИГНАЛИЗАЦИИ, в которой СИГНАЛЫ ОПАСНОСТИ повторяются удаленными компонентами РАСПРЕДЕЛЕННОЙ СИСТЕМЫ СИГНАЛИЗАЦИИ.
Соответствие проверяют функциональными испытаниями.
208.6.4.2* Задержки взаимодействия в обоих направлениях в РАСПРЕДЕЛЕННОЙ СИСТЕМЕ СИГНАЛИЗАЦИИ Дополнение:
ЗАДЕРЖКА ФОРМИРОВАНИЯ СИГНАЛА ОПАСНОСТИ при ФИЗИОЛОГИЧЕСКОЙ ТРЕВОЖНОЙ СИТУАЦИИ и при ТЕХНИЧЕСКОЙ ТРЕВОЖНОЙ СИТУАЦИИ на удаленном оборудовании должна быть ограничена таким образом, чтобы в процессе лечения ПАЦИЕНТА не возникало недопустимой задержки. Для определения максимального времени ЗАДЕРЖКИ СИГНАЛА ОПАСНОСТИ, которое является приемлемым до подачи СИГНАЛОВ ОПАСНОСТИ удаленными компонентами РАСПРЕДЕЛЕННОЙ СИСТЕМЫ СИГНАЛИЗАЦИИ, должен быть применен МЕНЕДЖМЕНТ РИСКА.
Соответствие проверяют рассмотрением ФАЙЛА МЕНЕДЖМЕНТА РИСКА.
208.6.6 ПРЕДЕЛЫ СИГНАЛИЗАЦИИ
208.6.6.1 Общие требования Дополнение:
208.6.6.1.101 ФИЗИОЛОГИЧЕСКИЕ ТРЕВОЖНЫЕ СИТУАЦИИ, ПРЕДЕЛЫ СИГНАЛИЗАЦИИ и время задержки физиологических СИГНАЛОВ ОПАСНОСТИ
ЗАДЕРЖКА ФОРМИРОВАНИЯ СИГНАЛА ОПАСНОСТИ физиологических СИГНАЛОВ ОПАСНОСТИ может быть настраиваемой.
Для ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ настройка ЗАДЕРЖКИ ФОРМИРОВАНИЯ СИГНАЛА ОПАСНОСТИ физиологических СИГНАЛОВ ОПАСНОСТИ должна быть ограничена (см. 6.7 МЭК 60601-1-8:2006). Соответствие проверяют осмотром.
Диапазоны изменения ПРЕДЕЛОВ СИГНАЛИЗАЦИИ и разрешающая способность настройки ПРЕДЕЛОВ СИГНАЛИЗАЦИИ должны быть указаны в ЭКСПЛУАТАЦИОННЫХ ДОКУМЕНТАХ [см. 201.7.9.2.9.101 j)].
Соответствие проверяют осмотром.
208.6.8 Состояния инактивации СИГНАЛОВ ОПАСНОСТИ
208.6.8.3 Глобальные бессрочные состояния инактивации СИГНАЛОВ ОПАСНОСТИ Дополнение:
208.6.8.3.101* Глобальные временные состояния инактивации СИГНАЛОВ ОПАСНОСТИ. Продолжительность глобальных состояний СИГНАЛИЗАЦИЯ ПРИОСТАНОВЛЕНА и ЗВУКОВАЯ СИГНАЛИЗАЦИЯ ПРИОСТАНОВЛЕНА
Максимальная глобальная продолжительность состояний СИГНАЛИЗАЦИЯ ПРИОСТАНОВЛЕНА и ЗВУКОВАЯ СИГНАЛИЗАЦИЯ ПРИОСТАНОВЛЕНА может быть настраиваемой. Указанные средства
17
Введение
Настоящий стандарт затрагивает ОСНОВНЫЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ С УЧЕТОМ ОСНОВНЫХ ФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК МНОГОФУНКЦИОНАЛЬНОГО МОНИТОРА ПАЦИЕНТА. Он вносит изменения в МЭК 60601-1 (третью редакцию 2005 г.): «Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик», именуемый в дальнейшем общим стандартом.
Целью второго издания является актуализация МЭК 60601-2-49 со ссылкой на третью редакцию общего стандарта путем переформатирования и технических корректировок.
Требования настоящего стандарта имеют преимущества перед общим стандартом.
Общие положения и обоснования для требований настоящего стандарта содержатся в приложении АА. Принято считать, что знание причин этих требований будет не только способствовать правильному применению настоящего стандарта, но и со временем ускорять любой пересмотр, обусловленный изменениями в клинической практике или развитием технологии. Однако приложение АА не является частью требований настоящего стандарта.
Настоящий стандарт является прямым применением МЭК 60601-2-49, подготовленного подкомитетом 62D МЭК «Медицинская электроаппаратура» Технического комитета ТК 62 «Электрооборудование в медицинской практике».
Второе издание отменяет и заменяет первое издание МЭК 60601-2-49, опубликованное в 2001 г. Второе издание представляет собой технический пересмотр в целях соответствия с третьим изданием МЭК 60601-1:2005.
Текст МЭК 60601-2-49:2011 основан на следующих документах:
|
Окончательный проект международного стандарта |
Отчет о голосовании |
|
62D/886/FDIS |
62D/908/RVD |
Полная информация о голосовании по утверждению МЭК 60601-2-49:2011 представлена в отчете о голосовании, который указан в приведенной выше таблице.
Редакция МЭК 60601-2-49 подготовлена в соответствии с Директивами ИСО/МЭК, часть 2.
В настоящем стандарте приняты следующие шрифтовые выделения:
-требования и определения: прямой шрифт;
- методы испытаний: курсив;
- информативный материал, приведенный вне таблиц (примечания, примеры и справочная информация), а также нормативный текст таблиц: шрифт уменьшенного размера;
- ТЕРМИНЫ, ОПРЕДЕЛЕННЫЕ В ПУНКТЕ 3 ОБЩЕГО СТАНДАРТА И В НАСТОЯЩЕМ СТАНДАРТЕ: ЗАГЛАВНЫЕ БУКВЫ.
В настоящем стандарте термины означают:
- «пункт» — одна из 17 частей стандарта, указанных в содержании, включая все подпункты (например, пункт 7, включая его подпункты 7.1,7.2 и т. д.);
- «подпункт» — пронумерованная последовательность подпунктов пункта (например, подпункты
7.1,7.2 и 7.2.1 являются подпунктами пункта 7).
Перед ссылкой на пункт и перед его номером в настоящем стандарте стоит слово «пункт», а ссылка на подпункт ограничена лишь его номером.
В настоящем стандарте союз «или» будет использован как включающий, т. е. утверждение будет истинным при любой комбинации условий.
Глагольные формы, используемые в настоящем стандарте, совпадают по форме с описанными в приложении Н Директив ИСО/МЭК (часть 2).
Значение вспомогательных глаголов:
- «должен» — соответствие требованиям или испытаниям обязательно для соответствия настоящему стандарту;
- «следует» — соответствие требованиям или испытаниям рекомендовано, но не обязательно для соответствия настоящему стандарту;
- «может» — описание допустимых путей достижения соответствия требованиям или испытаниям.
Знак звездочки (*) у номера пункта или подпункта указывает на то, что в приложении АА приведены соответствующие пояснения.
IV
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИИЗДЕЛИЯ МЕДИЦИНСКИЕ ЭЛЕКТРИЧЕСКИЕ Часть 2-49Частные требования безопасности с учетом основных функциональных характеристик к многофункциональным мониторам пациента
Частные требования безопасности с учетом основных функциональных характеристик к многофункциональным мониторам пациента
Medical electrical equipment. Part 2-49. Particular requirements for the basic safety and essential performance
of multifunction patient monitoring equipment
Дата введения — 2019—02—01
201.1 Область распространения, цель и соответствующие стандарты
Применяют пункт 1 общего стандарта1), за исключением:
201.1.1* Область распространения
Замена:
Настоящий стандарт распространяется на требования к ОСНОВНОЙ БЕЗОПАСНОСТИ и ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ МНОГОФУНКЦИОНАЛЬНЫХ МОНИТОРОВ ПАЦИЕНТА, как определено в 201.3.63, именуемых в дальнейшем ME ИЗДЕЛИЯ. Настоящий стандарт распространяется на ME ИЗДЕЛИЯ, используемые как в больничных условиях, так и вне больницы, в машинах скорой помощи и в воздушных транспортных средствах.
ME ИЗДЕЛИЯ, предназначенные для использования в экстремальных или неконтролируемых условиях окружающей среды вне больничных условий, таких как машины скорой помощи и воздушные транспортные средства, должны соответствовать требованиям настоящего стандарта. Дополнительные стандарты могут быть применены к ME ИЗДЕЛИЯМ с учетом условий окружающей среды при их применении.
Область применения настоящего стандарта ограничена ME ИЗДЕЛИЯМИ, предназначенными для подключения к одному пациенту, имеющими две или более РАБОЧИХ ЧАСТЕЙ или выполняющими несколько ФУНКЦИЙ на одной РАБОЧЕЙ ЧАСТИ.
Настоящий стандарт не определяет требования к отдельным функциям наблюдения, таким как ЭКГ, инвазивное давление и пульсоксиметрия. Частные стандарты, связанные с этими физиологическими параметрами, определяют требования сточки зрения отдельного ME ИЗДЕЛИЯ. Настоящий стандарт рассматривает различия, связанные с МНОГОФУНКЦИОНАЛЬНЫМ МОНИТОРОМ ПАЦИЕНТА, так как такое изделие имеет более широкое ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ, чем отдельное ME ИЗДЕЛИЕ.
201.1.2 Цель
Замена:
Цель настоящего стандарта — установить требования к ОСНОВНОЙ БЕЗОПАСНОСТИ и ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ МНОГОФУНКЦИОНАЛЬНЫХ МОНИТОРОВ ПАЦИЕНТА, как определено в 201.3.63.
11 Заменен на ИСО 15223-1:2016 «Изделия медицинские. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации. Часть 1. Общие требования». Однако для однозначного соблюдения требований настоящего стандарта, выраженного в датированной ссылке, рекомендуется использовать только указанное в этой ссылке издание.
201.1.3 Дополнительные стандарты
Дополнение:
Настоящий стандарт использует ссылки на применяемые дополнительные стандарты, которые перечислены в пункте 2 общего стандарта и в пункте 201.2 МЭК 60601-1-2, и МЭК 60601-1-8 применяют с изменениями в пунктах 202 и 208 соответственно. МЭК 60601-1-3 не применяют. Все остальные дополнительные стандарты, перечисленные в МЭК 60601-1, применяют в том виде, в каком они опубликованы.
201.1.4 Частные стандарты
Замена:
Частные стандарты серии МЭК 60601 могут изменять, заменять или отменять требования, содержащиеся в общем стандарте и дополнительных стандартах, имеющих прямое отношение к конкретному ME ИЗДЕЛИЮ, а также добавлять другие требования к ОСНОВНОЙ БЕЗОПАСНОСТИ и ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ.
Требования настоящего стандарта являются приоритетными по отношению к соответствующим требованиям общего стандарта.
Для краткости изложения в настоящем стандарте в качестве общего стандарта указан МЭК 60601-1. Дополнительные стандарты обозначены по их номерам.
Нумерация пунктов и подпунктов настоящего стандарта соответствует общему стандарту с приставкой «201» (например, пункт 201.1 соответствует содержанию пункта 1 общего стандарта) или дополнительному стандарту с приставкой «20х», где «х» — это последняя(ие) цифра(ы) номера дополнительного стандарта (например, пункт 202.4 соответствует содержанию пункта 4 дополнительного стандарта МЭК 60601-1-2, пункт 203.4 — содержанию пункта 4 дополнительного стандарта МЭК 60601-1-3 и т. д.). Изменения текста общего стандарта обозначены следующими словами:
- «замена» означает, что пункт или подпункт общего стандарта или соответствующего дополнительного стандарта полностью заменены текстом настоящего стандарта;
- «дополнение» — текст настоящего стандарта является дополнением к требованиям общего стандарта или соответствующего дополнительного стандарта;
- «изменение» — пункт или подпункт общего стандарта или соответствующего дополнительного стандарта изменен в соответствии с текстом настоящего стандарта.
Подпункты, рисунки или таблицы, которые являются дополнительными к элементам общего стандарта, пронумерованы начиная с 201.101. Однако вследствие того, что определения в общем стандарте пронумерованы начиная с 3.1 по 3.139, дополнительные определения в настоящем стандарте пронумерованы начиная с 201.3.201. Дополнительные приложения обозначены буквами АА, ВВ и т. д., дополнительные пункты — аа), Ыэ) и т. д.
Подпункты, рисунки или таблицы, которые являются дополнительными к элементам из дополнительного стандарта, пронумерованы начиная с «20х», где «х» — номер дополнительного стандарта, например 202 для МЭК 60601-1-2, 203 для МЭК 60601-1-3 и т. д.
Термин «настоящие стандарты» использован для совместной ссылки на общий стандарт, любые применимые дополнительные стандарты и настоящий стандарт, вместе взятые.
В случае отсутствия соответствующего пункта или подпункта в настоящем стандарте применяют без изменений соответствующий пункт или подпункт общего стандарта или применимого дополнительно стандарта, даже если он не релевантен; в настоящем стандарте указаны условия неприменимости любого пункта или подпункта общего стандарта или применимого дополнительного стандарта.
201.2 Нормативные ссылки
Применяют пункт 2 общего стандарта, за исключением следующего:
Замена:
IEC 60601-1-2:2007, Medical electrical equipment — Part 1-2: General requirements for basic safety and essential performance — Collateral standard: Electromagnetic compatibility — Requirements and tests2)
ГОСТ Р МЭК 60601-2-49-2018
(Электроаппаратура медицинская. Часть 1-2. Общие требования к базовой безопасности и основной эксплуатационной характеристике. Дополняющий стандарт. Электромагнитная совместимость. Требования и испытания)
IEC 60601-1-8:2006, Medical electrical equipment — Part 1-8: General requirements for basic safety and essential performance — Collateral standard: General requirements, tests and guidance for alarm systems in medical electrical equipment and medical electrical systems (Изделия медицинские электрические. Часть 1-8. Общие требования безопасности сучетом основныхфункциональныххарактеристик. Дополнительный стандарт. Общие требования, испытания и руководящие указания по применению систем сигнализации медицинских электрических изделий и медицинских электрических систем)
ISO 15223-1:2007, Medical devices — Symbols to be used with medical device labels, labelling and information to be supplied — Part 1: General requirements3) (Устройства медицинские. Символы, используемые на ярлыках медицинских устройств, при маркировке и в предоставляемой информации. Часть 1. Общие требования)
Дополнение:
IEC 60601-2-2:2009, Medical electrical equipment — Part 2-2: Particular requirements for the basic safety and essential performance of high frequency surgical equipment and high frequency surgical accessories4) (Аппаратура электрическая медицинская. Часть 2-2. Частные требования к базовой безопасности и существенным характеристикам высокочастотной хирургической аппаратуры и высокочастотным хирургическим приспособлениям)
IEC 60601-2-27:2011, Medical electrical equipment — Part 2-27: Particular requirements for the basic safety and essential performance of electrocardiographic monitoring equipment (Аппаратура электрическая медицинская. Часть 2-27. Частные требования к основам безопасности и важным рабочим характеристикам электрокардиографической контрольной аппаратуры)
IEC 60601-2-34:2011, Medical electrical equipment — Part 2-34: Particular requirements for the basic safety and essential performance of invasive blood pressure monitoring equipment (Аппаратура медицинская электрическая. Часть 2-34. Частные требования к безопасности аппаратуры для инвазивного контроля кровяного давления, включая ее основные рабочие характеристики)
201.3 Термины и определения
Примечание — Алфавитный указатель терминов приведен в конце настоящего стандарта.
В настоящем стандарте использованы термины и определения, приведенные в МЭК 60601 -1:2005, за исключением следующих:
Замена:
201.3.63 МНОГОФУНКЦИОНАЛЬНЫЙ МОНИТОР ПАЦИЕНТА; ME ИЗДЕЛИЕ (MULTIFUNCTION PATIENT MONITORING EQUIPMENT, ME EQUIPMENT): Модульное или предварительно сконфигурированное изделие, предназначенное для наблюдения за состоянием пациента, имеющее не более одного подключения к ПИТАЮЩЕЙ СЕТИ, включающее более одного ФИЗИОЛОГИЧЕСКОГО МОНИТОРНОГО БЛОКА, предназначенного для получения физиологических сигналов одного ПАЦИЕНТА, обработки этих сигналов для отображения результатов и формирования СИГНАЛОВ ОПАСНОСТИ.
Дополнительные определения:
201.3.201 МНОЖЕСТВЕННАЯ ФУНКЦИЯ (MULTIPLE FUNCTION): Измерение более одного физиологического параметра одной РАБОЧЕЙ ЧАСТЬЮ.
201.3.202 ЧАСТИЧНЫЙ ТОК УТЕЧКИ (PART LEAKAGE CURRENT): Ток, протекающий от всех СОЕДИНЕНИЙ С ПАЦИЕНТОМ ЕДИНИЧНОЙ ФУНКЦИИ РАБОЧЕЙ ЧАСТИ к остальным СОЕДИНЕНИЯМ С ПАЦИЕНТОМ других ЕДИНИЧНЫХ ФУНКЦИЙ той же РАБОЧЕЙ ЧАСТИ и не предназначенный для физиологического воздействия.
201.3.203 ФИЗИОЛОГИЧЕСКИЙ МОНИТОРНЫЙ БЛОК (PHYSIOLOGICAL MONITORING UNIT): Часть ME ИЗДЕЛИЯ, предназначенная для сбора информации о физиологической(их) функции(ях) и ее обработки с целью мониторинга и, возможно, диагностических целей.
201.3.204 ЕДИНИЧНАЯ ФУНКЦИЯ (SINGLE FUNCTION): Измерение одного физиологического параметра одной РАБОЧЕЙ ЧАСТЬЮ.
Примечание — Физиологическими параметрами являются температура тела, ЭКГ, ЭКГ/дыхание (импе-дансный метод), инвазивное и неинвазивное давление крови и т. д.
201.4 Общие требования
Применяют пункт 4 общего стандарта, за исключением следующего:
201.4.3 ОСНОВНЫЕ ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ
201.4.3.101 Дополнительные требования к ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ Дополнительные требования к ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ МНОГОФУНКЦИОНАЛЬНЫХ МОНИТОРОВ ПАЦИЕНТА приведены в подпунктах, указанных в таблице 201.101.
|
Таблица 201.101 — Требования к ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ | ||||||||
|
201.4.5* Эквивалентная безопасность ME ИЗДЕЛИЯ или ME СИСТЕМЫ
Дополнение:
Когда несколько частных стандартов одновременно применяют к МНОГОФУНКЦИОНАЛЬНЫМ МОНИТОРАМ ПАЦИЕНТА, все соответствующие требования этих стандартов должны быть соблюдены. Если требования частных стандартов противоречат друг другу, должен быть применен ПРОЦЕСС МЕНЕДЖМЕНТА РИСКА для определения стандарта, требования которого применимы. При этом ИЗГОТОВИТЕЛЯМ настоятельно рекомендовано по мере возможности отдавать предпочтение требованиям настоящего стандарта.
Если требования к сигнализации, установленные в других частных стандартах к МНОГОФУНКЦИОНАЛЬНЫМ МОНИТОРАМ ПАЦИЕНТА, противоречат требованиям настоящего стандарта, то требования к сигнализации, установленные в настоящем стандарте, должны иметь приоритет по отношению к требованиям других стандартов.
201.5 Общие требования к испытаниям ME ИЗДЕЛИЯ
Применяют пункт 5 общего стандарта, за исключением следующего:
201.5.4 Прочие условия испытаний
Дополнение:
Если не указано иное, то испытание должно быть проведено с ПРИНАДЛЕЖНОСТЯМИ, перечисленными в инструкции по применению.
Для ME ИЗДЕЛИЯ с ВНУТРЕННИМ ИСТОЧНИКОМ ПИТАНИЯ в том случае, если результат испытаний зависит от напряжения ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ, испытание должно быть выполнено с применением наименее благоприятного напряжения ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ, указанного ИЗГОТОВИТЕЛЕМ. При необходимости для проведения испытаний могут быть использованы внешний аккумулятор или источник питания постоянного тока для обеспечения необходимого испытательного напряжения (см. 201.11.8.101).
4
ГОСТ Р МЭК 60601-2-49-2018
Значения величин, используемые в испытательных схемах, если не указано иное, должны иметь погрешность, пределы которой приведены ниже:
- сопротивления — ±1 %;
- емкости — ±10 %;
- индукторов — ±10 %;
- испытательных напряжений — ±1 %.
201.6 Классификация ME ИЗДЕЛИЙ и ME СИСТЕМ
Применяют пункт 6 общего стандарта, за исключением следующего:
201.6.2* Защита от поражения электрическим током
Замена последнего параграфа:
РАБОЧИЕ ЧАСТИ должны быть классифицированы как РАБОЧИЕ ЧАСТИ ТИПА BF или РАБОЧИЕ ЧАСТИ ТИПА CF (см. 7.2.10 и 8.3 общего стандарта). РАБОЧИЕ ЧАСТИ должны быть классифицированы как РАБОЧИЕ ЧАСТИ С ЗАЩИТОЙ ОТ РАЗРЯДА ДЕФИБРИЛЛЯТОРА (см. 8.5.5 общего стандарта), за исключением случая, когда другой частный стандарт допускает РАБОЧИЕ ЧАСТИ без ЗАЩИТЫ ОТ РАЗРЯДА ДЕФИБРИЛЛЯТОРА или технические ограничения препятствуют разработке РАБОЧИХ ЧАСТЕЙ С ЗАЩИТОЙ ОТ РАЗРЯДА ДЕФИБРИЛЛЯТОРА.
201.6.6 Режим работы
Замена:
ME ИЗДЕЛИЕ должно быть классифицировано как изделие для ПРОДОЛЖИТЕЛЬНОГО РЕЖИМА РАБОТЫ (см. 7.2.11 общего стандарта).
201.7 Идентификация, маркировка и документация ME ИЗДЕЛИЙ
Применяют пункт 7 общего стандарта, за исключением следующего дополнения:
201.7.2 Маркировка на наружных поверхностях ME ИЗДЕЛИЯ или частях ME ИЗДЕЛИЯ
201.7.2.2 Идентификация
Дополнение:
Каждый ФИЗИОЛОГИЧЕСКИЙ МОНИТОРНЫЙ БЛОК, если он съемный, должен быть идентифицирован следующими маркировкой и информацией:
a) наименование ИЗГОТОВИТЕЛЯ или его товарный знак;
b) обозначение модели посредством наименования модели, или номера, или буквенного обозначения;
c) серийный номер;
d) для принадлежностей ФИЗИОЛОГИЧЕСКОГО МОНИТОРНОГО БЛОКА: код партии, символы 5.14, 5.15 и 5.16 по ИСО 15223-1, если применимо.
201.7.2.10 РАБОЧИЕ ЧАСТИ
Дополнение:
Для входных соединителей с ПАЦИЕНТОМ и для ПРИНАДЛЕЖНОСТЕЙ МНОГОФУНКЦИОНАЛЬНЫХ МОНИТОРОВ ПАЦИЕНТА должны быть применены следующие дополнительные требования к маркировке:
a) каждый соединитель СОЕДИНЕНИЯ С ПАЦИЕНТОМ на РАБОЧЕЙ ЧАСТИ должен иметь маркировку для идентификации соответствующей функции.
Примечание — Например, такими функциями могут быть ЭКГ, ЭКГ/дыхание или температура;
b) * ПРИНАДЛЕЖНОСТИ ME ИЗДЕЛИЯ (например, КАБЕЛИ ПАЦИЕНТА, ПРЕОБРАЗОВАТЕЛИ или датчики), не защищенные от разряда дефибриллятора, должны быть маркированы символом 10 таблицы D.1 приложения D общего стандарта [см. также 201.7.9.2.9.101 е)].
201.7.9.2.9 Инструкции по эксплуатации
Дополнение:
201.7.9.2.9.101 Дополнительные инструкции по использованию
Инструкции по эксплуатации должны включать следующее:
5
a) ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ ME ИЗДЕЛИЯ, включая условия эксплуатации;
b) применение ME ИЗДЕЛИЯ для одного пациента;
c) инструкции по подключению ПРОВОДА ВЫРАВНИВАНИЯ ПОТЕНЦИАЛА, если это применимо;
d) достаточную информацию (и номер типа, если это необходимо) для идентификации ПРИНАДЛЕЖНОСТЕЙ, таких как КАБЕЛИ ПАЦИЕНТА или ПРЕОБРАЗОВАТЕЛИ, которые должны быть использованы для обеспечения защиты от разряда дефибриллятора и от ожогов;
e) меры предосторожности при использовании дефибриллятора на ПАЦИЕНТЕ; описание того, как разряд дефибриллятора влияет на ME ИЗДЕЛИЕ; предупреждение о том, что для обеспечения защиты от разряда дефибриллятора необходимо использовать указанные ИЗГОТОВИТЕЛЕМ ПРИНАДЛЕЖНОСТИ, включая КАБЕЛИ ПАЦИЕНТА и ПРЕОБРАЗОВАТЕЛИ. Должны быть предоставлены спецификации (или номер типа) таких ПРИНАДЛЕЖНОСТЕЙ. Меры предосторожности, которые необходимо принять, если использованы ПРИНАДЛЕЖНОСТИ, маркированные по 201.7.2.10 (как не защищенные от разряда дефибриллятора);
f) уведомление ОПЕРАТОРА относительно того, имеет ли ME ИЗДЕЛИЕ встроенные средства, необходимые для защиты ПАЦИЕНТА от ожогов при использовании ВЫСОКОЧАСТОТНОГО (ВЧ) ХИРУРГИЧЕСКОГО АППАРАТА. Должны быть даны рекомендации относительно расположения ЭЛЕКТРОДОВ и ПРЕОБРАЗОВАТЕЛЕЙ и т. д. с целью уменьшения опасности ожогов в случае дефекта НЕЙТРАЛЬНОГО ЭЛЕКТРОДА ВЧ ХИРУРГИЧЕСКОГО АППАРАТА.
Примечание — «НЕЙТРАЛЬНЫЙ ЭЛЕКТРОД» в данном случае термин, определенный в МЭК 60601-2-2;
д) выбор и применение определенных ПРИНАДЛЕЖНОСТЕЙ;
h) * рекомендации и описание процедур проверок работоспособности ME ИЗДЕЛИЯ и ПРИНАДЛЕЖНОСТЕЙ, проводимых ежедневно (ОПЕРАТОРОМ) и по расписанию (как часть технического обслуживания). Акцент должен быть сделан на том, как ОПЕРАТОР может проверить визуальные и звуковые СИГНАЛЫ ОПАСНОСТИ;
i) идентификацию других ФИЗИОЛОГИЧЕСКИХ МОНИТОРНЫХ БЛОКОВ ME ИЗДЕЛИЯ, предназначенных для использования;
j) настройки по умолчанию (например, УСТАНОВКИ СИГНАЛИЗАЦИИ, ПРЕДВАРИТЕЛЬНЫЕ УСТАНОВКИ СИГНАЛИЗАЦИИ, режимы работы и настройки фильтра);
k) простые методы решения проблем, с помощью которых ОПЕРАТОР может найти причину, из-за которой ME ИЗДЕЛИЕ функционирует неправильно.
Примечание — Это относится к сложностям в эксплуатации, но не к техническим неполадкам;
l) дальнейшую эксплуатацию ME ИЗДЕЛИЯ после пропадания НАПРЯЖЕНИЯ ПИТАЮЩЕЙ СЕТИ более чем на 30 с (см. 201.11.8);
т) рекомендации по предпочтительным УСТАНОВКАМ СИГНАЛИЗАЦИИ и конфигурациям СИСТЕМЫ СИГНАЛИЗАЦИИ, когда ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ подразумевает мониторинг состояния ПАЦИЕНТА без постоянного присутствия ОПЕРАТОРА;
п) процедуру настройки, которая позволяет переводить СИГНАЛ ОПАСНОСТИ в инактивированные состояния (СИГНАЛИЗАЦИЯ ПРИОСТАНОВЛЕНА, ЗВУКОВАЯ СИГНАЛИЗАЦИЯ ПРИОСТАНОВЛЕНА, СИГНАЛИЗАЦИЯ ОТКЛЮЧЕНА, ЗВУКОВАЯ СИГНАЛИЗАЦИЯ ОТКЛЮЧЕНА), и функцию СБРОСА СИГНАЛИЗАЦИИ в режим дистанционно управления (см. 208.6.11.101), если это предусмотрено;
о)* описание того, как отключить СИГНАЛЫ ОПАСНОСТИ из-за возникновения ТЕХНИЧЕСКИХ ТРЕВОЖНЫХ СИТУАЦИЙ, когда датчики, зонды или модули отключены ОПЕРАТОРОМ намеренно.
201.8 Защита от ОПАСНОСТЕЙ поражения электрическим током от ME ИЗДЕЛИЯ
Применяют пункт 8 общего стандарта, за исключением следующего:
201.8.3 Классификация РАБОЧИХ ЧАСТЕЙ
Замена перечисления с):
с) РАБОЧАЯ ЧАСТЬ, не подпадающая под определение перечисления а) или Ь), должна быть РАБОЧЕЙ ЧАСТЬЮ ТИПА BF или РАБОЧЕЙ ЧАСТЬЮ ТИПА CF.
6
1
Издание официальное
2
) Заменен на МЭК 60601-2-2:2017 «Изделия медицинские электрические. Часть 2-2. Частные требования безопасности с учетом основных функциональных характеристик к высокочастотным электрохирургическим аппаратам и высокочастотным электрохирургическим принадлежностям». Однако для однозначного соблюдения требований настоящего стандарта, выраженного в датированной ссылке, рекомендуется использовать только указанное в этой ссылке издание.
3
) Заменен на ИСО 15223-1:2016 «Изделия медицинские. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации. Часть 1. Общие требования». Однако для однозначного соблюдения требований настоящего стандарта, выраженного в датированной ссылке, рекомендуется использовать только указанное в этой ссылке издание.
4
) Заменен на МЭК 60601-2-2:2017 «Изделия медицинские электрические. Часть 2-2. Частные требования безопасности с учетом основных функциональных характеристик к высокочастотным электрохирургическим аппаратам и высокочастотным электрохирургическим принадлежностям». Однако для однозначного соблюдения требований настоящего стандарта, выраженного в датированной ссылке, рекомендуется использовать только указанное в этой ссылке издание.
3