ГОСТ Р 59293-2021
Чистота воздуха в производстве медицинских изделий
Купить ГОСТ Р 59293-2021 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
| Дата введения | 01.12.2021 |
|---|---|
| Актуализация | 01.01.2022 |
Этот ГОСТ находится в:
Air cleanliness in the manufacture of medical devices
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСТР
59293—
2021
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ЧИСТОТА ВОЗДУХА В ПРОИЗВОДСТВЕ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Издание официальное
ц,„
ИкИЖЖЛ.
Сшцдажферм
2021
Издание официальное
|
ц,„ ИкИЖЖЛ. Сшцдажферм 2021 |
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Чистые технологии» (ООО «Чистые технологии»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 184 «Обеспечение промышленной чистоты»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 15 января 2021 г. No 7-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ожегод1Юм (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официалы<ый текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ. оформление. 2021
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии II
5.3.5 Необходимость в чистом помещении определяется для каждого этапа технологического процесса индивидуально исходя из риска загрязнения изделия и переноса загрязнения в последующем в лекарственное средство или пациенту. При этом определяются критические операции, требующие выполнения в условиях классифицируемого по чистоте воздуха.
6 Параметры чистых помещений
6.1 Классы чистоты
Классификационным параметром чистого помещения является класс чистоты. Методика подтверждения класса чистоты приведена в ГОСТ Р ИСО 14644-1.
6.2 Дополнительные параметры
Дополнительными параметрами чистого помещения являются:
- скорость и направление однонаправленного потока воздуха (зона А);
- расход воздуха (кратность воздухообмена) для неоднонаправленного потока воздуха (зоны В. СиО);
- перепад давления воздуха между чистыми помещениями разных классов или одного класса чистоты (чистыми помещениями с разной степенью ответственности),
- скорость потока воздуха на границе разделения зон различных классов;
- время восстановления;
- температура и относительная влажность воздуха;
- предельно допустимое микробное загрязнение воздуха, поверхностей, рук и одежды персонала.
6.3 Требования к зонам А (однонаправленный поток воздуха)
Зона А — чистая зона для проведения операций, представляющих высокий риск для качества и безопасности продукции. В таких зонах предусматривается однонаправленный поток воздуха со скоростью 0.30-0.48 м/с (рекомендуемое значение). Скорость и направление однонаправленного потока воздуха должны быть подтверждены при аттестации (испытаниях).
Требования к потоку воздуха в изоляторах устанавливаются ГОСТ Р ИСО 14664-7 и ГОСТ Р ИСО 13408-6.
6.4 Расход воздуха и кратность воздухообмена
Характеристикой чистого помещения с неоднонаправленным потоком воздуха является расход воздуха. Вспомогательным параметром является кратность воздухообмена, представляющая собой удельный расход воздуха на единицу объема помещения, ч'1.
Следует избегать необоснованно высоких кратностей воздухообмена, поскольку они ведут к резкому повышению расхода энергии из-за нелинейной зависимости между расходом воздуха и расходом энергии.
Кратность воздухообмена, достаточная для установившейся работы чистого помещения, может не обеспечить выполнение требований к времени восстановления, которое требует существенно более высоких расходов воздуха (6.7).
6.5 Перопад давления
Перепад давления воздуха между соседними помещениями различных классов должен составлять не менее 10—15 Па (рекомендуемое значение). Не следует устанавливать перепады давления между такими помещениями более 20 Па. если не обосновано иное.
6.6 Скорость потока воздуха на границе разделения зон
На границе разделения зон (например, открытая зона с однонаправленным потоком воздуха, ламинарный шкаф) следует предусматривать жесткое или гибкое ограждение с проемом, скорость потока воздуха в котором должна быть не менее 0.4 м/с.
Примечание — В исключительных случаях по условиям ограничений технологии допускается организация зон с однонаправленным потоком без указанных требований. При этом должен быть подтвержден класс 5 ИСО
в эксплуатация и выполнена проверка направления потока воздуха, подтверждающая отсутствие внесения частиц в рабочую зону.
6.7 Время восстановления
Время восстановления чистого помещения представляет собой время стократного снижения концентрации частиц в воздухе (100:1) после искусственного введения загрязнений в чистое помещение или при его переходе из эксплуатируемого состояния в оснащенное.
Время восстановления следует задавать по решению заказчика (исполнителя) для асептических процессов. Рекомендуемое значение времени восстановления 20 мин. Могут устанавливаться требования к времени восстановления и в других случаях при наличии обоснования.
Примечание — Не допускается задание времени восстановления для зон А и D.
6.8 Томпература и влажность воздуха
Следует поддерживать температуру и влажность воздуха в соответствии с действующими нормами и требованиями технологического процесса.
При этом следует учитывать повышенное тепловое сопротивление одежды для чистых помещений. Температура выше +(22—23) °С может привести к тепловому дискомфорту, выделению пота и повышенному выделению частиц персоналом.
Не рекомендуется устанавливать неоправданно жесткие требования к температуре и влажности, поскольку это приводит к лишним затратам и перерасходу энергии.
7 Изоляторы
7.1 В изоляторах и передаточных устройствах должны выполняться установленные требования к качеству воздуха. При этом следует учитывать, в какой степени возможны утечки (повреждения), вызванные особенностями конструкции или материалов изолятора.
7.2 Процесс передачи материалов в изолятор и из него является одним из наиболее сильных потенциальных источников загрязнений. Изолятор предназначен для проведения операций, представляющих высокий риск для качества и безопасности продукции. Допускается организация рабочих зон внутри изолятора без однонаправленного потока воздуха.
7.3 Требования к чистоте воздуха в среде, окружающей изолятор, зависят от конструкции изолятора и его назначения. Эту среду следует контролировать, и для асептического производства она должна соответствовать зоне С.
7.4 Изоляторы могут быть введены в эксплуатацию только после завершения аттестации (испытаний), которая должна учитывать все критические факторы, например такие, как качество воздуха внутри и снаружи изолятора, порядок обработки изолятора, технологию передачи материалов и целостность изолятора.
7.5 Следует установить порядок текущего контроля, включающий в себя достаточно частое проведение испытаний на герметичность изолятора по ГОСТ Р ИСО 14644-7-2007 (пункт 9.5).
8 Аттестация (испытания) чистых помещений
8.1 Классы чистоты
Классы чистоты чистых помещений и чистых зон устанавливаются (контролируются) по ГОСТ Р ИСО 14644-1.
8.2 Другие параметры
Проверка других параметров выполняется по ГОСТ Р ИСО 14644-3.
8.3 Проверка однонаправленного потока воздуха
При испытаниях должны быть четко обоснованы точки измерения скорости потока воздуха с документальным оформлением.
Типовая методика испытаний приведена в ГОСТ Р ИСО 14644-3.
8.4 Характеристики однонаправленного потока воздуха
Однонаправленный поток воздуха характеризуется двумя параметрами.
- поперечным сечением потока воздуха;
- скоростью потока воздуха.
Дополнительным параметром служит направление потока воздуха.
Термин «кратность воздухообмена» к однонаправленному потоку воздуха неприменим.
9 Текущий контроль чистых помещений и чистых зон
9.1 Следует проводить текущий контроль чистых помещений и чистых зон в период их эксплуатации с заданной периодичностью.
9.2 Контроль концентрации частиц в воздухе
Точки отбора проб для текущего контроля выбирают по ГОСТ Р ИСО 14644-1 с учетом оценки риска (при необходимости) и результатов, полученных при аттестации (испытаниях) чистых помещений.
9.3 При необходимости может быть предусмотрен непрерывный контроль концентрации частиц в зонах А асептического производства. Следует обосновать эффективность такого контроля.
9.4 Следует достаточно часто проводить микробиологический контроль воздуха и поверхностей (например, методы мазков, смывов и контактных пластин). Методы отбора проб, используемые в эксплуатируемом состоянии, не должны вносить помехи в защиту зоны. После выполнения критических операций в асептических условиях следует проводить микробиологический контроль поверхностей и персонала.
Следует проводить микробиологический контроль вне технологического процесса, например, после аттестации (испытаний) оборудования, выполнения очистки и дезинфекции, проведения технического обслуживания и ремонта.
Рекомендуемые предельные значения допустимого микробного загрязнения чистых зон в эксплуатируемом состоянии приведены в таблице 3 и ГОСТ Р 52249.
|
Таблица 3 — Рекомендуемые предельные значения допустимого микробного загрязнения чистых помещений и чистых зон в эксплуатируемом состоянии | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
|
а) Указаны средние значения. 51 Допускается экспонирование отдельных седиментационных пластин менее 4 ч. | |||||||||||||||||||||||||||||
9.5 В зависимости от результатов проводимого контроля следует установить предельные значения для предупреждения и/или действия (уровни предупреждения и/или действия) для показателей загрязнения частицами, микроорганизмами и для других параметров по ГОСТ Р ИСО 14644-2. Следует предусмотреть в инструкциях или методиках порядок выполнения корректирующих действий в случае превышения этих предельных значений.
9.6 Эксплуатацию чистых помещений следует организовать по ГОСТ Р ИСО 14644-5.
10 Персонал, занятый в чистых помещениях
10.1 Персонал, занятый в производстве медицинских изделий, должен иметь требуемую квалификацию и опыт работы, в том числе в любой специальной технологии, используемой на данном производстве.
10.2 В чистых помещениях допускается нахождение только минимально необходимого персонала. что особенно важно для асептического производства и ручных операций. Это требование следует учесть при разработке технологического процесса.
Не допускается вход в чистые помещения лиц. не имеющих права доступа в них. Контроль за работой следует, по возможности, проводить, находясь за пределами чистых зон. через окна или с помощью средств видеонаблюдения. Такое же требование предъявляется к посетителям.
К персоналу, занятому уборкой, техническим обслуживанием и другими работами в чистых помещениях предъявляются те же требования, что и к производственному персоналу.
10.3 Весь персонал (в т. ч. персонал, занятый уборкой и техническим обслуживанием), работающий в таких чистых помещениях, должен проходить систематическое обучение, включая требования к гигиене и основы технологии чистоты. Следует проводить инструктаж и контроль за работниками, не прошедшими обучение, но которым необходимо входить в чистое помещение (например, лицам, занятым при монтаже или техническом обслуживании).
10.4 Необходимо выполнять требования к личной гигиене и чистоте. Не допускается вход в чистые помещения лиц, страдающих себореей, инфекционными и другими заболеваниями, которые могут привести к повышенному выделению загрязнений.
Персонал должен знать порядок оповещения руководства о любых факторах, которые могут привести к повышению уровня загрязнения сверх допустимого уровня. Следует организовать контроль состояния здоровья персонала и определить меры по пресечению нарушений правил гигиены.
10.5 В чистых помещениях персоналу запрещается носить наручные часы и ювелирные украшения. а также применять косметику. Не допускается проносить кольца, браслеты, булавки, иглы и другие посторонние предметы.
В чистые помещения не допускаются лица, имеющие накладные/наращенные ногти и ресницы и применяющие лак для ногтей.
10.6 Переодевание и мытье рук следует выполнять в соответствии с инструкциями, чтобы свести к минимуму риск загрязнения одежды, предназначенной для чистых зон. и внесения загрязнений в чистые помещения.
10.7 Одежда и ее качество должны соответствовать технологическому процессу и типу зоны (классу чистоты). Ее нужно носить так. чтобы обеспечить защиту продукта от загрязнений.
10.8 К одежде для чистых помещений предъявляются следующие требования по аналогии с производством лекарственных средств (ГОСТ Р 52249):
- Зона D и С: головной убор должен закрывать волосы полностью. Борода и усы (при их наличии) также должны быть полностью закрыты. Следует носить костюм (комбинезон или куртка-брюки), плотно облегающий запястья и застегнутый по всей длине, с воротником-стойкой и соответствующую обувь или бахилы.
- Зоны А и В: головной убор должен закрывать волосы полностью. Борода и усы (при их наличии) также должны быть полностью закрыты. Следует носить комбинезон, плотно облегающий запястья и застегнутый по всей длине. Края головного убора должны быть убраны под воротник костюма. Следует носить маску, чтобы предотвратить распространение капель, стерильные, неопудренные резиновые или полимерные перчатки и стерильные (или дезинфицированные) бахилы. Нижняя часть штанин должна быть заправлена внутрь бахил, а рукава одехщы — в перчатки.
Одежда и обувь для чистых помещений чистых зон любых классов не должны выделять волокон или частиц и должны служить барьером, предотвращающим попадание в воздух частиц, выделяемых человеком.
10.9 Верхняя одежда не должна попадать в комнаты для переодевания, ведущие в зоны В и С. Каждый работник в зонах А и В должен быть обеспечен чистой стерильной одеждой на каждую смену. Во время работы перчатки следует регулярно дезинфицировать. Маски и перчатки следует менять при каждом входе в чистое помещение.
10.10 При подготовке (стирке, стерилизации) и обращении с одеждой следует исключить накопление загрязнений, которые могут от нее впоследствии отделиться. Эти операции следует выполнять
в соответствии с инструкциями. При неправильной подготовке одежды могут повреждаться волокна ткани и увеличиться риск отделения частиц.
Подготовка одежды может выполняться как на участках (прачечных) в самом лредприятии-поль-зователе, так и по контракту в специализированных прачечных для чистых помещений. Эти прачечные должны отвечать установленным требованиям, в том числе к чистым помещениям, соответствие которым следует проверять при аттестации.
10.11 Персонал, работающий в чистых помещениях, должен пройти обучение процедуре переодевания. Следует проверить правильность переодевания, подтвердить это (аттестовать персонал) и проводить периодическую проверку не реже одного раза в год. Следует предусматривать периодический контроль микробиологической чистоты персонала, работающего в зонах А и В.
Ко входу в зоны А и В. в которых выполняются или будут выполняться асептические операции, допускается только обученный персонал, прошедший проверку правильности переодевания и участвовавший в успешной имитации асептического процесса, в ходе которой он выполняет свои обычные обязанности (без наблюдения и контроля). Следует предусматривать периодический микробиологический контроль персонала в зонах А. В и С (рук в перчатках и одежды). Точки контроля определяются производителем с учетом фактора риска.
10.12 Следует предусмотреть систему дисквалификации персонала с лишением допуска на вход в чистые помещения на основе периодического контроля выполнения им инструкций. В случае дисквалификации сотрудника он может быть допущен к работе только после прохождения повторного обучения и повторной аттестации.
Персонал, занятый в асептических процессах, должен успешно пройти проверку при имитации асептического процесса.
10.13 Производитель должен утвердить письменные инструкции, определяющие порядок доступа в чистые помещения посторонних лиц. не прошедших обучение (например, лиц. выполняющих монтажные работы или техническое обслуживание, в том числе по контракту).
Эти лица должны носить ту же одежду, что и производственный персонал.
Доступ этих лиц допускается только в исключительных случаях и должен выполняться под контролем с регистрацией в журнале.
10.14 Наряду с указанными требованиями следует выполнять требования по ГОСТ Р ИСО 14664-5.
11 Помещения
11.1 Требования к чистым помещениям и инженерным системам приведены в ГОСТ Р ИСО 14644-4. ГОСТ Р 56638. ГОСТ Р 56640.
11.2. Требования к потокам воздуха и фильтрам очистки воздуха даны в таблице 4.
|
Таблица 4 — Виды потоков воздуха и классы фильтров | ||||||||||||||||||||
| ||||||||||||||||||||
|
Примечания 1 При повышенной запыленности атмосферного воздуха рекомендуется предусматривать дополнительно фильтр М5 на входе воздуха в кондиционер перед фильтром F7. 2 Допускается применение фильтров с более высокой эффективностью с целью унификации. |
11.3 Финишные фильтры устанавливаются в потолке чистого помещения или другом элементе его конструкции так. чтобы лицевая поверхность фильтра находилась как можно ближе к диффузору, с минимальным промежутком, а диффузор был в одной плоскости с потолком или другой поверхностью, в которую монтируется фильтр.
11.4 Секцию увлажнения следует предусматривать в составе кондиционера до фильтра F9. Не допускается установка увлажнителя воздуха в воздуховод без специальных мер защиты от роста микроорганизмов.
11.5 Применение фальшполов (двойных полов) в производстве медицинских изделий не допускается.
11.6 Для того чтобы свести к минимуму отделение частиц или микроорганизмов или их накопление. обеспечить возможность многократной обработки моющими и дезинфицирующими средствами, все открытые поверхности в чистых зонах должны быть гладкими, непроницаемыми, без трещин, изломов. отслоений и шелушений.
11.7 Находящиеся в чистом помещении трубопроводы, воздуховоды и другие системы не должны иметь труднодоступных для очистки зон и поверхностей, а также негерметичных мест.
11.8 Не допускается устанавливать раковины и сливы в зонах А и В. В других зонах слив должен быть выполнен так, чтобы исключить возможность обратного потока.
11.9 Комнаты (помещения) для переодевания должны быть выполнены по принципу воздушных шлюзов и обеспечивать физическое разделение различных этапов переодевания, чтобы свести к минимуму загрязнение технологической одежды частицами и микроорганизмами. Зона перед выходом из комнаты (помещения) для переодевания в оснащенном состоянии должна иметь тот же класс чистоты, что и зона, в которую она ведет. При необходимости могут быть организованы отдельные помещения для входа в чистые зоны и выхода из них. Устройства для мытья рук следует, как правило, устанавливать только в передней части комнаты для переодевания.
11.10 Обе двери воздушного шлюза не должны быть одновременно открыты. Для предотвращения открывания более чем одной двери одновременно следует предусмотреть систему оповещения (визуальную и/или звуковую).
Примечание — Не рекомендуется устанавливать блокировку дверей, поскольку в случае неисправности возможен случай, когда при пожаре или другой опасной ситуации человек будет заблокирован в помещении.
12 Оборудование
12.1 Конструкция, установка и расположение оборудования, мест соединения и планировочные решения, включая зоны обслуживания, должны предусматривать возможность и удобство работы с ними, проведение технического обслуживания и ремонта.
12.2 Следует, по возможности, устанавливать оборудование так, чтобы в чистое помещение выходила только его лицевая часть, а само оборудование находилось за пределами чистого помещения или в чистом помещении более низкого класса (например, стерилизаторы).
12.3 Ленты конвейеров не должны пересекать разделительный барьер между зонами А или В и производственной зоной с менее чистым воздухом (более низким классом чистоты), если только сама лента не подвергается непрерывной стерилизации (например, в туннеле стерилизации).
12.4 Если при проведении технического обслуживания или ремонта оборудования, находящегося в чистом помещении, был нарушен уровень чистоты (стерильности), то перед возобновлением производства следует выполнить уборку, дезинфекцию и/или стерилизацию этого оборудования (зоны).
13 Уборка и дезинфекция
13.1 Уборку и дезинфекцию чистых помещений следует выполнять в соответствии с письменными инструкциями.
13.2 Растворы для уборки и дезинфекции должны находиться в предварительно обработанных дезинфицирующими средствами контейнерах с соответствующей маркировкой. Хранение растворов, для которых не предусмотрена последующая стерилизация, допускается только в течение определенного периода времени. В зонах А и В следует применять только стерильные моющие и дезинфицирующие средства.
Приложение А (обязательное)
Общие требования к обеспечению чистоты в производство медицинских изделий
А.1 Проектирование и строительство зданий и помещений
А. 1.1 Здание для производства, технологического процесса, упаковки, хранения и транспортирования медицинских изделий должно иметь необходимые размеры, конструкцию и располагаться так. чтобы обеспечить выполнение предусмотренных операций, очистку и техническое обслуживание.
А. 1.2 Здание должно иметь достаточную площадь для размещения оборудования и материалов в порядке, предотвращающем перепутывание различных исходных материалов, первичных упаковочных материалов, материалов для маркировки, внутрипроизводственных материалов или готовой продукции и не допускать их загрязнения. Проектом должна быть предусмотрена такая организация потоков (маршрутов) этих материалов и продукции внутри здания, которая не допустила бы их загрязнения. Возможно разделение потоков (маршрутов) во времени при условии исключения перепутывания и перекрестных загрязнений организационными или другими мерами.
А. 1.3 Работа должна выполняться внутри специальных зон (помещений) требуемых размеров. При необходимости следует предусматривать обособленные или выделенные зоны или другие меры контроля для защиты от загрязнений или перепутывания.
А.2 Освещение
Во всех помещениях должен быть обеспечен требуемый уровень освещенности.
А.З Вентиляция, кондиционирование и фильтрация воздуха
А.3.1 Следует обеспечить вентиляцию и. если требуется, кондиционирование воздуха.
А.3.2 При производстве, выполнении технологического процесса, упаковке и хранении, где требуется, следует предусмотреть необходимый перепад давления воздуха, обеспечить защиту от пыли и микроорганизмов и регулирование температуры и влажности.
А.3.3 Системы подготовки приточного воздуха для производственных зон должны предусматривать, где требуется. фильтрацию воздуха с использованием предварительных фильтров и фильтров очистки воздуха от частиц. При использовании рециркуляции воздуха в производственных зонах следует принять меры, предотвращающие распространение загрязнений из рабочих зон. В зонах, где возможно загрязнение воздуха в процессе производства. должны предусматриваться необходимые вытяжные системы или другие системы, необходимые для защиты от загрязнений.
А.4 Водопровод и канализация
Сливы должны иметь необходимые размеры, и там. где они подсоединяются к канализационным трубам, следует предусматривать разрыв струи или другие средства защиты от обратного тока.
А.5 Стоки и отходы
Следует предусмотреть безопасное обращение оо стоками, твердыми и другими отходами в зданиях, помещениях и пр. в соответствии с санитарными нормами.
А.6 Места для умывания и туалеты
Должны быть предусмотрены места для умывания, включая снабжение холодной и горячей водой, моющими средствами, воздушными фенами для сушки рук или одноразовыми полотенцами. Туалеты должны содержаться в чистоте.
А.7 Уборка и санитария
А.7.1 Все здания, используемые для производства, технологического процесса, упаковки или обращения с медицинскими изделиями, должны содержаться в чистоте с соблюдением санитарных правил. В зданиях не должно быть насекомых, птиц, грызунов и других животных. Отходы и другие загрязнения следует своевременно удалять.
А.7.2 Порядок уборки и дезинфекции зданий и помещений должен быть установлен письменными инструкциями с указанием ответственности, графиков и технологии уборки, применяемого инвентаря и материалов. Выполнение инструкций следует контролировать.
А.7.3 Порядок использования средств против грызунов, насекомых и микроорганизмов (включая дрожжи, плесени и грибы), в т. ч. средств для фумигации (обработки газом), моющих и дезинфицирующих средств, должен быть установлен инструкциями. Целью этих инсфукций является предупреждение загрязнения оборудования, исходных материалов, первичных упаковочных материалов, материалов для маркировки, упаковочных материалов (вторичных). Выполнение инструкций следует контролировать.
Следует использовать только допущенные к применению средства против грызунов, насекомых и микроорганизмов (включая дрожжи, плесени и грибы).
А.7.4 Лица, работающие по контракту, или временные работники, должны применять те же методы уборки, что и работники, занятые полный рабочий день.
А.8 Техническое обслуживание и ремонт
Следует выполнять техническое обслуживание, ремонт и поддерживать в надлежащем состоянии здания и помещения для производства, технологического процесса, упаковки и хранения медицинских изделий.
Как правило, техническое обслуживание и ремонт выполняются при выключенном оборудовании, если инструкциями изготовителя не предусмотрено иное.
Техническое обслуживание и ремонт должны выполняться в плановом порядке по графикам и инструкциям с регистрацией фактического выполнения работ. Следует предусмотреть порядок действий при отказах оборудования.
Следует предусмотреть предохранение (защиту) оборудования, находящегося в непосредственной близости от места выполнения работ.
А.9 Оборудование
А.9.1 Конструкция, размеры и расположение оборудования
А.9.1.1 Конструкция, размеры и расположение оборудования для производства, упаковки и транспортирования медицинских изделий должно соответствовать его назначению и быть приспособленными для эксплуатации, технического обслуживания и ремонта.
А.9.1.2 Конструкция оборудования должна предусматривать такое исполнение поверхностей, имеющих контакт с исходными материалами, внутрипроизводственными материалами и готовой продукцией, чтобы они не вступали в реакцию, не выделяли и не абсорбировали вещества и не допускали отклонений показателей безопасности, идентичности, эффективности, качества и чистоты от установленных требований.
А.9.1.3 Любые вещества, используемые в работе (включая смазочные или охлаждающие материалы), не должны вступать в контакт с исходными материалами, первичными упаковочными материалами, внутрипроизводственными материалами или готовой продукцией и не должны допускать отклонений от заданных требований. Допускается применять только заранее одобренные физиологически безопасные материалы.
А.9.1.4 Не рекомендуется использовать в производственных помещениях скотч, прозрачные липкие материалы. которые могут попасть на изделие и остаться незамеченными, если их применение не обусловлено необходимостью.
А.9.2 Очистка, дезинфекция и стерилизация оборудования
А.9.2.1 Оборудование и съемные части подлежат очистке и. в зависимости от вида материалов или медицинских изделий, дезинфекции и/или стерилизации, которые выполняются через определенные интервалы времени с целью предотвращения неправильного функционирования или загрязнения.
А.9.2.2 Очистка, дезинфекция и стерилизация оборудования, в том числе сьемных частей, используемых при производстве, технологическом процессе, упаковке, хранении и транспортировании медицинских изделий, должны выполняться в соответствии с письменными инструкциями. Эти инструкции должны включать, как минимум, следующее:
- определение ответственности за проведение очистки, дезинфекции и стерилизации:
- графики выполнения работ;
- подробное описание методов, оборудования, инструментов и материалов, используемых при очистке, дезинфекции и стерилизации, включая, порядок разборки и сборки оборудования, необходимых для проведения этих работ:
- удаление этикеток или другой маркировки с оборудования;
- предохранение (защиту) чистого оборудования от загрязнения до его использования:
- порядок проверки чистоты и/или стерильности оборудования непосредственно перед его использованием.
Следует вести журналы регистрации работ по очистке, дезинфекции и стерилизации оборудования.
А.10 Персонал
А.10.1 Квалификация персонала
А.10.1.1 Каждое лицо, занятое в производстве, технологическом процессе, упаковке, хранении или транспортировании медицинских изделий, должно иметь образование, практическую подготовку и опыт или любую их комбинацию, позволяющую этому лицу выполнять возложенные на него функции.
А.10.1.2 Практическое обучение должно включать конкретные операции, которые выполняет работник, и письменные инструкции, требуемые этими правилами, в части, относящейся к обязанностям работника. Обучение должно выполняться квалифицированными лицами на непрерывной основе и с достаточной периодичностью, чтобы обеспечить поддержку работником знаний по относящимся к нему требованиям.
Следует проверять полученные знания и навыки по результатам обучения с документальным оформлением.
А.10.2 Обязанности персонала
А. 10.2.1 Персонал, занятый в производстве, технологическом процессе, упаковке или обращении медицинских изделий, должен носить чистую одежду, соответствующую выполняемой работе. Защитную одежду, например. 14
для головы, лица и кислей рук. следует носить надлежащим образом для предотвращения загрязнения материалов и продукции.
А.10.2.2 Персонал должен выполнять требования гигиены и быть допущен к работе по состоянию здоровья.
А. 10.2.3 В зоны зданий и помещений с ограниченным доступом может входить только персонал, имеющий право доступа в них.
А.10.2.4 Любое лицо, имеющее (поданным медицинского осмотра или наблюдения контролирующим лицом) явные признаки болезни или открытые раны, которые могут отрицательно влиять на безопасность или качество медицинского изделия, должно быть отстранено от прямого контакта с исходными материалами, первичными упаковочными материалами, внутрипроизводственными материалами и готовой продукцией до тех пор. пока состояние здоровья не улучшится или будет подтверждено компетентным медицинским персоналом, что оно не окажет вредного влияния на продукцию.
Библиография
[11 ПР 64-05-001—2002 Правила организации чистых производств и контроля качества изделий меди
цинского назначения из полимеров, тканых и нетканых материалов, имеющих контакт с кровью
УДК 543.275:628.511:006.354 ОКС 13.040.35
11.080.01
Ключевые слова: чистые помещения, контролируемые среды, медицинские изделия, классификация чистоты, счетчик частиц
Редактор В.Н. Шмельков Технический редактор И.Е. Черепкова Корректор М.С. Кабашова Компьютерная верстка Е.А. Кондрашовой
Сдано в набор 18 01.2021 Подписано в печать 26.01.2021. Формат 60*84'Л. Гарнитура Ариал.
Уея. печ. л. 2.32 Уч.-мзд. л. 2,10.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении во ФГУП «СТАНДАРТИНФОРМ» для комплектования Федерального информационного фонда стандартов,
117416 Москва. Нахимовский лр-т, д. 31. к. 2. wvvw.goslinIo.ru info@goslinfo.ru
Содержание
1 Область применения.................................................................1
2 Нормативные ссылки.................................................................1
3 Термины и определения...................................... 2
4 Общие требования...................................................................4
5 Классификация чистых помещений (чистых зон) в производстве медицинских изделий..........4
6 Параметры чистых помещений.................. 7
7 Изоляторы............................................. 8
8 Аттестация (испытания) чистых помещений..............................................8
9 Текущий контроль чистых помещений и чистых зон........................................9
10 Персонал, занятый в чистых помещениях..............................................10
11 Помещения.......................................................................11
12 Оборудование.....................................................................12
13 Уборка и дезинфекция..............................................................12
Приложение А (обязательное) Общие требования к обеспечению чистоты в производстве
медицинских изделий.................................................................13
Библиография.......................................................................16
Введение
Промышленность выпускает два основных вида продукции для нужд здравоохранения: лекарственные средства и медицинские изделия.
Нормативная база по организации и технологии производства этих двух видов продукции существенно различается. Производство лекарственных средств регулируется правилами GMP (Good Manufacturing Practice) — правилами производства и контроля качества лекарственных средств, изложенными в ГОСТ Р 52249. являющемся прямым переводом правил GMP ЕС. и другими аналогичными документами, которые дают полный и четкий свод требований к обеспечению качества, технологии и организации производства, оборудованию, процессам, помещениям, персоналу и др. Цель этих документов — обеспечение соответствия заявленным требованиям безопасности, идентичности, эффективности и параметрам качества и чистоты лекарственных средств на стадии производства.
Эти документы предъявляют количественные требования к чистоте воздуха. Требования к чистоте воздуха действуют и для помещений лечебно-профилактических учреждений (ГОСТ Р 52539 и другие нормы).
Для производства медицинских изделий действует ряд стандартов общего характера без конкретизации требований к таким важным факторам, как чистота воздуха (чистые помещения), инженерные системы и др. За рубежом имеет место сходная картина. В Российской Федерации действует отраслевой методический документ ПР 64-05-001—2002 «Правила организации чистых производств и контроля качества изделий медицинского назначения из полимеров, тканых и нетканых материалов, имеющих контакт с кровью» [1]. Этот документ не учитывает современные стандарты ИСО по чистым помещениям и не разделяет требования к производству медицинских изделий, подлежащих финишной стерилизации. и асептическому производству.
Количественные требования к чистоте воздуха в производствах медицинских изделий в зарубежной практике отсутствуют несмотря на то, что применение чистых помещений в этих производствах является установившейся практикой.
Чистота воздуха в помещениях является одним из решающих факторов в обеспечении качества и безопасности стерильных медицинских изделий, т. е. их соответствия требованиям чистоты и стерильности. Частицы оседают на поверхностях изделий, загрязняют их и служат укрытием для микроорганизмов. снижая эффективность стерилизации. Частицы являются носителями микроорганизмов.
Требования к организации производства, в т. ч. чистоте воздуха, принципиально различаются для двух видов стерильных изделий:
- допускающих стерилизацию в окончательной герметичной (первичной) упаковке, т. е. финишную стерилизацию;
- не допускающих такую стерилизацию ввиду чувствительности изделия к воздействию стерилизующего агента (тепла, этиленоксида. радиации и др.) и требующих асептических условий в производстве.
Для процессов с финишной стерилизацией устанавливается предельно допустимое значение бионагрузки или числа колониеобразующих единиц. КОЕ (микроорганизмов), на одном изделии при разработке и аттестации процесса стерилизации.
Поскольку стерилизация не является абсолютным процессом и имеет ограниченную эффективность. то существует некоторая вероятность выживания микроорганизмов после стерилизации. Как правило, при стерилизации уровень обеспечения стерильности составляет 10'в. При эффективности процесса стерилизации, равной 10 е. допустимая бионагрузка на единицу продукции составляет 1 КОЕ (колониеобразующую единицу). Если бионагрузка больше, то возрастает риск выпуска нестерильной продукции и следует применять более эффективный метод стерилизации. Таким образом, существует зависимость между чистотой воздуха и стерильностью медицинского изделия. Снижение бионагрузки и обеспечение стерильности требует применения чистых помещений.
В асептических процессах стадия финишной стерилизации отсутствует. Микроорганизмы, попавшие на изделие при производстве, останутся на нем и будут при благоприятных условиях размножаться в нарушение требований к стерильности. В связи с этим попадание микроорганизмов (частиц, несущих микроорганизмы) на изделие должно быть исключено. Это достигается за счет применения чистых помещений и чистых зон высоких классов и выполнения асептических требований.
Чистые помещения могут применяться и в производстве нестерильных изделий, если для них установлены требований к микробиологической чистоте, а также в других производствах по решению заказчика или разработчика как средство обеспечения общей культуры и чистоты в производстве.
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЧИСТОТА ВОЗДУХА В ПРОИЗВОДСТВЕ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Air cleanliness in the manufacture of medical devices
Дата введения — 2021—12—01
1 Область применения
Настоящий стандарт устанавливает требования к чистоте воздуха в производстве стерильных медицинских изделий. Отдельные требования настоящего стандарта (например, к классам чистоты, персоналу и др.) могут быть использованы в производстве нестерильных медицинских изделий, в первую очередь тех, к которым предъявляются требования микробиологической чистоты.
Настоящий стандарт не устанавливает требований к пожарной, эпидемиологической, радиационной и другим видам безопасности, а также к чистоте и безопасности самих медицинских изделий, которые регламентируются другими нормативными документами.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р 52249 Правила производства и контроля качества лекарственных средств ГОСТ Р 52539 Чистота воздуха в лечебных учреждениях. Общие требования ГОСТ Р 56638 Чистые помещения. Вентиляция и кондиционирование воздуха. Общие требования ГОСТ Р 56640 Чистые помещения. Проектирование и монтаж. Общие требования ГОСТ Р ИСО 13408-6 Асептическое производство медицинской продукции. Часть 6. Изолирующие системы
ГОСТ Р ИСО 14644-1 Чистые помещения и связанные с ними контролируемые среды. Часть 1. Классификация чистоты воздуха по концентрации частиц
ГОСТ Р ИСО 14644-2 Чистые помещения и связанные с ними контролируемые среды. Часть 2. Текущий контроль для подтверждения постоянного соответствия чистоты воздуха по концентрации частиц ГОСТ Р ИСО 14644-3 Чистые помещения и связанные с ними контролируемые среды. Часть 3. Методы испытаний
ГОСТ Р ИСО 14644-4 Чистые помещения и связанные с ними контролируемые среды. Часть 4. Проектирование, строительство и ввод в эксплуатацию
ГОСТ Р ИСО 14644-5 Чистые помещения и связанные с ними контролируемые среды. Часть 5. Эксплуатация
ГОСТ Р ИСО 14644-7-2007 Чистые помещения и связанные с ними контролируемые среды. Часть 7. Изолирующие устройства (укрытия с чистым воздухом, боксы перчаточные, изоляторы и миниокружения)
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты*, который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана дати-
Издание официальное
роеанная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 асоптический процесс (aseptic process): Процесс производства стерильной продукции, в котором отсутствует финишная стерилизация продукции (стерилизация в окончательной герметичной упаковке).
Примечание — Может использоваться термин «асептические операции», имеющий сходный смысл.
3.2 асептические условия (aseptic conditions): Условия выполнения технологического процесса, после которых не стерилизации продукции или материалов не допустима.
3.3 аттестация чистого помещения (cleanroom qualification): Подтверждение соответствия чистого помещения заданным требованиям.
3.4 барьерная система для стерилизации (sterile barrier system): Минимальная упаковка, которая препятствует проникновению микроорганизмов и позволяет продемонстрировать асептические свойства продукта в месте его применения.
[ГОСТ ISO 11607-1-2018. пункт 3.22)
3.5 бионагрузка (bioburden): Популяция жизнеспособных микроорганизмов на продукте и/или упаковке.
[ГОСТ EN 556-1—2011, пункт 3.1)
3.6 воздушный шлюз (air-lock): Ограниченное пространство с двумя или несколькими дверями между двумя или несколькими помещениями (например, различных классов чистоты), предназначенное для разделения воздушных сред помещений при входе в них. Воздушный шлюз служит для перехода персонала или перемещения материалов.
[ГОСТ Р 52249. общие термины и определения, пункт 8]
3.7 изолятор (isolator): Герметизированная конструкция, способная предотвратить попадание загрязнений внутрь путем полного физического разделения внутренней и наружной сред, позволяющая проводить дезинфекцию внутренней среды.
Примечания
1 Размеры изолятора могут быть от небольшого бокса до большой комнаты.
2 Физическое разделение может обеспечиваться сплошной оболочкой, полностью окружающей внутреннее пространство, в котором исключаются любые нарушения целостности и проникание загрязнений внутрь предотвращается с помощью физических средств. Примером таких физических средств могут служить воздушные шлюзы для передачи стерильных и дезинфицированных предметов, поток прошедшего через НЕРА фильтры или стерильного воздуха, высокая скорость воздуха, удаляемого через отверстия с минимальным размером. Абсолютный физический барьер должен постоянно отделять операторов от внутреннего пространства изолятора.
[ГОСТ Р ИСО 13408-6-2009. пункт 3.3]
3.8 критическая операция (operation): операция, отклонение от требований выполнения которой может произойти недопустимое изменение характеристик медицинского изделия, например, стерильности.
3.9 неоднонаправлонный поток воздуха (non-unidirectronal airflow): Распределение воздуха, при котором поступающий в чистое помещение или чистую зону воздух смешивается с внутренним воздухом посредством подачи струи приточного воздуха.
[ГОСТ Р ИСО 14644-1. пункт 3.2.8]
3.10 однонаправленный поток воздуха (unidirectional airflosv): Контролируемый поток воздуха с постоянной скоростью и примерно параллельными линиями тока по всему поперечному сечению чистого помещения или чистой зоны.
[ГОСТ Р ИСО 14644-1. пункт 3.2.7]
3.11 Состояния чистого помещения
3.11.1 оснащенное (at-rest): Состояние, в котором чистое помещение или чистая зона укомплектовано оборудованием и действует по соглашению между заказчиком и исполнителем, но персонал отсутствует.
[ГОСТ Р ИСО 14644-1, пункт 3.3.2)
3.11.2 эксплуатируемое (operational): Состояние, в котором чистое помещение или чистая зона функционирует установленным образом с работающим оборудованием и заданным числом персонала.
[ГОСТ Р ИСО 14644-1, пункт 3.3.3]
3.12 стерилизация (sterilization): Валидированный процесс, используемый для получения продукта. не содержащего жизнеспособных микроорганизмов.
[ГОСТ Р ИСО 14937-2012, пункт 3.28]
3.13 стерильность (sterility): Состояние, при котором отсутствуют жизнеспособные микроорганизмы.
[ГОСТ EN 556-1—2011, пункт 3.3]
3.14 текущий контроль (мониторинг) (monitoring): Наблюдения, выполненные путем проверки в соответствии с установленным методом или программой для подтверждения соответствия чистого помещения.
Примечания
1 Текущий контроль гложет быть непрерывным, последовательным или периодическим; в последнем случав должна быть указана периодичность контроля.
2 Полученные данные могут использоваться для обнаружения тенденций в эксплуатируемом состоянии и поддержания требуемых характеристик процесса.
[ГОСТ Р ИСО 14644-2, пункт 3.2]
3.15 уровень обеспечения стерильности; SAL (Sterility Assurance Level, SAL): Вероятность наличия жизнеспособного микроорганизма на продукте после стерилизации.
[ГОСТ ISO 11135-2017, пункт 3.46]
3.16 чистое помещение' (deanroom): Помещение, в котором контролируется концентрация аэрозольных частиц и которое спроектировано, построено и эксплуатируется так, чтобы свести к минимуму поступление, выделение и удержание частиц в нем.
Примечания
1 Следует задать класс чистоты по концентрации аэрозольных частиц.
2 Могут также задаваться и контролироваться другие параметры, например, концентрации химических, биологических загрязнений и загрязнений с размерами в нанодиапазоне в воздухе, а также чистота поверхностей по частицам, химическим, биологическим загрязнениям и загрязнениям с размерами в нанодиапазоне.
3 При необходимости могут задаваться и другие физические параметры, например, температура, влажность. давление, уровень вибрации и электростатические характеристики.
[ГОСТ Р ИСО 14644-1, пункт 3.1.1]
3.17 чистая зона" (clean zone): Определенное пространство, в котором контролируется концентрация аэрозольных частиц и которое построено и эксплуатируется так, чтобы свести к минимуму поступление, выделение и удержание частиц в нем.
Примечания
1 Следует задать класс чистоты по концентрации аэрозольных частиц.
2 Могут также задаваться и контролироваться другие параметры, например концентрации химических, биологических загрязнений и загрязнений с размерами в нанодиапаэоне в воздухе, а также чистота поверхностей по частицам, химическим, биологическим загрязнениям и загрязнениям с размерами в нанодиапазоне.
3 Чистая зона может находиться внутри чистого помещения или представлять собой изолирующее устройство. Такое устройство может быть установлено как в чистом помещении, так и вне его.
4 При необходимости могут задаваться и другие физические параметры, например температура, влажность, давление, уровень вибрации и электростатические характеристики.
[ГОСТ Р ИСО 14644-1. пункт 3.1.2]
' Если требования относятся как к чистым помещениям, так и к чистым зонам, то в тексте стандарта указывается «чистое помещение». Если требование относится только к чистым зонам, то применяется термин «чистая зона». Если требование относится только к чистым помещениям, то дается пояснение.
4 Общие требования
4.1 Стандарт устанавливает классы чистоты воздуха в производстве стерильных медицинских изделий.
В производстве нестерильных медицинских изделий могут устанавливаться отдельные требования. применяемые для производства стерильных изделий (например, зоны D или С. НЕРА фильтры и ДР-)-
Для обеспечения чистоты воздуха и общей чистоты в производстве устанавливаются требования к зданиям, оборудованию, персоналу и др. Эти общие требования к производству любых медицинских изделий, как стерильных, так и нестерильных, даны в приложении А.
Требования к производству стерильных изделий даны в основной части стандарта.
4.2 Производства стерильных изделий принципиально различаются в зависимости от их чувствительности к стерилизации и возможности стерилизации:
- изделия, подлежащие финишной стерилизации (стерилизации в окончательной герметичной упаковке);
- изделия, не выдерживающие стерилизацию в окончательной герметичной упаковке и требующие особых (асептических) условий с целью обеспечения их стерильности.
Асептические условия могут потребоваться на промежуточных и начальных стадиях технологического процесса, если за операциями с материалами не следуют стадии стерилизации.
Асептические процессы могут быть закрытыми и открытыми.
При открытых процессах рабочая зона не имеет герметичного ограждения от окружающей среды.
Закрытые процессы выполняются в изоляторах.
4.3 Эффективность процесса стерилизации оценивается показателем «уровень обеспечения стерильности».
Уровень обеспечения стерильности не должен превышать;
- для процессов с финишной стерилизацией — значения 10 е,
- для открытых асептических процессов — значения 10~3 — 10-4;
- для закрытых асептических процессов (в изоляторах) — значения 10'в.
Эти величины подтверждаются:
- для процессов с финишной стерилизацией — расчетом эффективности процесса стерилизации и его аттестацией;
- для открытых асептических процессов — испытаниями процесса;
- для закрытых асептических процессов — оценкой эффективности процесса стерилизации парами перекиси водорода или другим стерилизующим средством.
4.4 Требования к классам чистых помещений и чистых зон в производстве медицинских изделий, подлежащих финишной стерилизации, указаны в 5.2, для требующих асептических условий — в 5.3.
5 Классификация чистых помещений (чистых зон) в производстве медицинских изделий
5.1 Общие положения
5.1.1 Стандарт устанавливает предельно допустимые концентрации частиц в воздухе (классы чистоты) по ГОСТ Р ИСО 14644-1 (класс чистоты 5 ИСО и др.) и специализированную классификацию, аналогичную правилам GMP по ГОСТ Р 52249 (зоны А. В. С и D).
Применяемые в производстве медицинских изделий зоны и классы чистоты приведены в таблице 1. которая дает общую схему классификации.
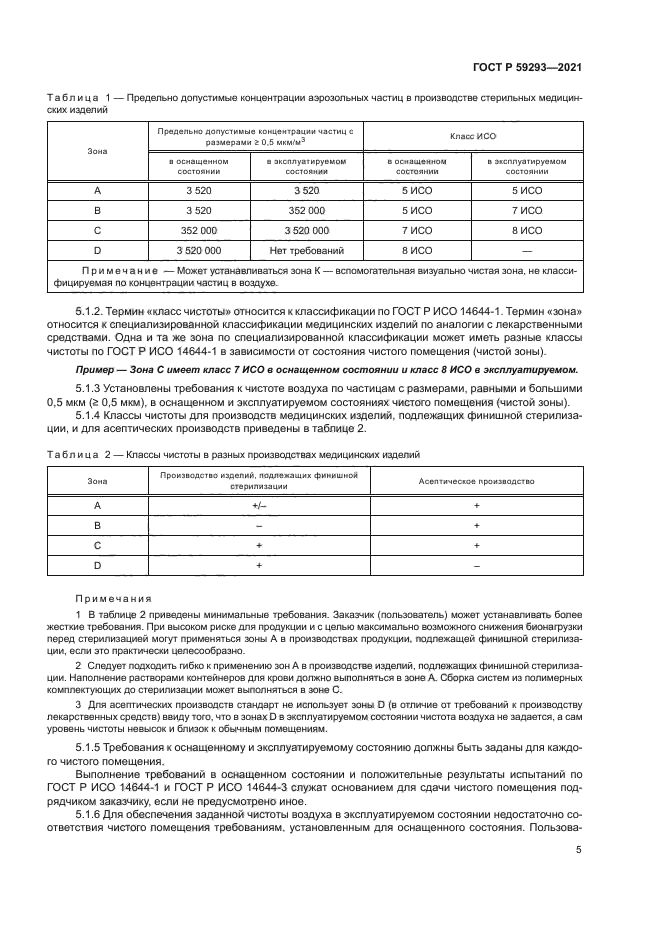
Зоны (классы чистоты) для конкретных производств устанавливаются индивидуально для каждого производства и различаются для производств продукции, подлежащей финишной стерилизации (стерилизации в окончательной герметичной упаковке) по 5.2 и не допускающей такой стерилизации (асептическое производство) по 5.3.
|
Таблица 1 — Предельно допустимые концентрации аэрозольных частиц в производстве стерильных медицинских изделий | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
|
Примечание — Может устанавливаться зона К — вспомогательная визуально чистая зона, не классифицируемая по концентрации частиц в воздухе. | |||||||||||||||||||||||||||||
5.1.2. Термин «класс чистоты» относится к классификации по ГОСТ Р ИСО 14644-1. Термин «зона» относится к специализированной классификации медицинских изделий по аналогии с лекарственными средствами. Одна и та же зона по специализированной классификации может иметь разные классы чистоты по ГОСТ Р ИСО 14644-1 в зависимости от состояния чистого помещения (чистой зоны).
Пример — Зона С имеет класс 7 ИСО в оснащенном состоянии и класс 8 ИСО е эксплуатируемом.
5.1.3 Установлены требования к чистоте воздуха по частицам с размерами, равными и большими 0,5 мкм (г 0.5 мкм), в оснащенном и эксплуатируемом состояниях чистого помещения (чистой зоны).
5.1.4 Классы чистоты для производств медицинских изделий, подлежащих финишной стерилизации. и для асептических производств приведены в таблице 2.
|
Таблица 2 — Классы чистоты в разных производствах медицинских изделий | |||||||||||||||
|
Примечания
1 В таблице 2 приведены минимальные требования. Заказчик (пользователь) может устанавливать более жесткие требования. При высоком риске для продукции и с целью максимально возможного снижения бионагрузки перед стерилизацией могут применяться зоны А в производствах продукции, подлежащей финишной стерилизации. если это практически целесообразно.
2 Следует подходить гибко к применению зон А в производстве изделий, подлежащих финишной стерилизации. Наполнение растворами контейнеров для крови должно выполняться в зоне А. Сборка систем из полимерных комплектующих до стерилизации может выполняться в зоне С.
3 Для асептических производств стандарт не использует зоны D (в отличие от требований к производству лекарственных средств) ввиду того, что в зонах D в эксплуатируемом состоянии чистота воздуха не задается, а сам уровень чистоты невысок и близок к обычным помещениям.
5.1.5 Требования к оснащенному и эксплуатируемому состоянию должны быть заданы для каждого чистого помещения.
Выполнение требований в оснащенном состоянии и положительные результаты испытаний по ГОСТ Р ИСО 14644-1 и ГОСТ Р ИСО 14644-3 служат основанием для сдачи чистого помещения подрядчиком заказчику, если не предусмотрено иное.
5.1.6 Для обеспечения заданной чистоты воздуха в эксплуатируемом состоянии недостаточно соответствия чистого помещения требованиям, установленным для оснащенного состояния. Пользова-
тель должен выполнить требования к эксплуатации (персоналу, одежде, уборке и др.) по ГОСТ Р ИСО 14644-5.
5.2 Производство изделий, подлежащих финишной стерилизации
5.2.1 Целью создания чистой воздушной среды в производстве изделий, подлежащих финишной стерилизации, является снижение бионагрузки на изделии или в нем и обеспечение чистоты по частицам. что повышает эффективность стерилизации (инактивации микроорганизмов, которые могли бы находиться под защитой загрязнения).
5.2.2 К критическим операциям относятся операции после окончательной мойки изделий (или формования термическим способом), включая сборку и помещение в первичную упаковку, являющуюся барьерной системой для стерилизации.
По решению заказчика (пользователя) отдельные операции могут выполняться в зонах А исходя из риска для продукции и пациента, объемов производства и др.
Пример — К критическим операциям могут относиться:
1) Зоны А в окружении С:
• наполнение контейнеров перед стерилизацией (например, консервантами в производстве наборов для крови).
2) Зоны С:
• сборка изделий перед стерилизацией (сборка инфузионных систем, наборов для крови и др.);
- приготовление растворов для последующего наполнения в контейнеры, подлежащие стерилизации (для наборов крови, сборка фильтров для компонентов крови, изготовление капельниц и др.);
• выгрузка пластмассовых изделий (трубок, контейнеров и др.) из литьевого оборудования;
- зоны, непосредственно окружающие зону А.
3) Зоны D — вспомогательные операции с низким риском:
• размещение линии экструзии трубок (за исключением зоны выгрузки);
- изготовление деталей литьем под давлением (за исключением зоны выгрузки).
При нецелесообразности или невозможности разграничения зоны, где находится указанное оборудование и зоны выгрузки, все оборудование размещается в зоне С.
Примечание — Данный перечень не является исчерпывающим и служит в качестве примера.
5.3 Чистота воздуха в асептическом производстве
5.3.1 Целью создания среды с чистым воздухом в асептическом производстве является предотвращение попадания частиц на изделие, насколько это возможно обеспечить техническими и организационными мерами.
5.3.2 К критическим операциям в асептическом производстве относятся операции, после которых стерилизация материалов или продукции не выполняется.
Открытый асептический процесс (критические операции) выполняется в зонах А в окружении зоны
В.
Закрытый асептический процесс (критические операции) выполняется в изоляторе, находящемся в зоне С.
5.3.3 К критическим операциям в асептическом производстве относятся:
- сборка и упаковка изделий, не подлежащих стерилизации;
- упаковывание стерильных изделий в первичную стерильную упаковку и ее герметизация;
- операции с культурами клеток и тканей (роговицей глаза и др.);
- передача и обращение со стерильными первичными упаковочными материалами, после которых их стерилизация не выполняется.
Примечание — Данный перечень не является исчерпывающим и служит в качестве примера.
5.3.4 Операции по подготовке материалов и комплектующих, включая сборку, перед стерилизацией выполняются в зонах С.
Решение по применению чистых помещений в этих случаях принимается разработчиком технологического процесса (разработчиком проекта или заказчиком) для каждой операции с учетом факторов риска.