ГОСТ ISO 10993-16-2016
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 16. Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ
Устанавливает принципы, в соответствии с которыми планируют и осуществляют исследования токсикокинетики, обусловленной применением медицинских изделий.
Идентичен ISO 10993-16:2010
Переиздание. Декабрь 2018 г.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Принципы планирования токсикокинетических исследований
5 Руководство по методам исследований
5.1 Общие положения
5.2 Руководство по конкретным методам исследований
Приложение А (обязательное) Обстоятельства, при которых проведение токсикокинетических исследований необходимо
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Библиография
19 страниц
| Дата введения | 01.10.2017 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 25.10.2016 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 92-П |
|---|---|---|---|
| 31.10.2016 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1534-ст |
| Разработан | АНО ИМБИИТ | ||
| Издан | Стандартинформ | 2016 г. | |
| Издан | Стандартинформ | 2018 г. |
Medical devices. Biological evaluation of medical devices. Part 16. Toxicokinetic study design for degradation products and leachables
- ГОСТ Р ИСО 10993-12-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы
- ГОСТ ISO 14971-2011 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
- ГОСТ ISO 10993-17-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ
- ГОСТ ISO 10993-18-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов
- ГОСТ ISO 10993-1-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
- ГОСТ ISO 10993-12-2015 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13
стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТ
ISO 10993-16-2016
ИЗДЕЛИЯ МЕДИЦИНСКИЕ.
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 16
Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ
(ISO 10993-16:2010, Biological evaluation of medical devices — Part 16. Toxicokinetic study design for degradation products and leachables, IDT)
Издание официальное
|
Москва Стаидартииформ 2016 |
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-2015 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Институт медико-биологических исследований и технологий (АНО «ИМБИИТ») на основе собственного перевода на русский язык англоязычной версии международного стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 25 октября 2016 г. № 92-П)
|
За принятие проголосовали: | |||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 31 октября 2016 г. № 1534-ст межгосударственный стандарт ГОСТ ISO 10993-16-2016 введен в действие в качестве национального стандарта Российской Федерации с 1 октября 2017 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10993-16:2010 «Оценка биологического действия медицинских изделий. Часть 16. Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ» («Biological evaluation of medical devices — Part 16: Toxicokinetic study design for degradation products and leachables», IDT).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для увязки с наименованиями, принятыми в существующем комплексе межгосударственных стандартов.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА.
6 ВЗАМЕН ГОСТ ISO 10993-16-2011
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе « Национальные стандарты». а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ, 2016
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
матографических методов анализа (например, методы высокоэффективной жидкостной хроматографии. тонкослойной хроматографии, газожидкостной хроматографии), а полученные вещества характеризуют посредством ряда химических и физико-химических методов (например, масс-спектро-метрический метод, спектроскопический метод, метод ядерно-магнитного резонанса).
Использование тканей, клеток, гомогенатов и изолированных ферментов для изучения процессов метаболизма in vitro хорошо описаны. Эти методы, в отличие от методов in vivo, позволяют прогнозировать пути метаболизма, когда вещество локализуется в недоступном для исследований месте. Следует отметить, что степени и скорости метаболизма при определении методами in vitro и in vivo часто отличаются.
6
ГОСТ ISO 10993-1 е—2016
Приложение А (обязательное)
Обстоятельства, при которых проведение токсикокинетических исследований необходимо
А.1 Использование большинства медицинских изделий связано с потенциальной опасностью. Характеристика химических свойств определяет химические опасности (потенциальные риски)(см. IS0 10993-18и IS014971 )и должна предшествовать токсикокинетическим исследованиям. Однако проведение токсикокинетических исследований всех идентифицируемых ожидаемых и случайных продуктов деградации и выщелачивания для всех медицинских изделий не является необходимым или целесообразным.
А.2 Рассматривая необходимость токсикокинетических исследований как части биологической оценки медицинских изделий, принимают во внимание конечный продукт, составляющие его химические вещества, ожидаемые и случайные продукты деструкции и выщелачивании, а также назначение изделия.
Необходимо также учитывать возможное токсикокинетическое взаимодействие между активными ингредиентами и продуктами деструкции и/или выщелачивания.
А.З Методы in vitro, которые тщательно проверены, обоснованные и практически доступные, надежные и воспроизводимые, должны быть рассмотрены к применению вместо исследований in vivo (см. ISO 10993-1). При возможности, исследования in vitro (например, тканей, гомогенатов или клеток) следует проводить для изучения вероятных, а не возможных продуктов деградации. IS010993-2 применим ко всем рассматриваемым исследованиям in vivo.
А.4 Необходимость проведения токсикокинетических исследований рассматривается, если:
a) изделие при применении по назначению должно резорбировать под влиянием биологических факторов;
b) изделие имеет дли тельный контакт с организмом человека при имплантации, известна или предполагается его биоде! радация или существенная коррозия (для изделий из металлов) и (или) из изделия происходит миграция вымываемых веществ;
c) есть сведения или существует возможность образования значительных количеств потенциально токсичных или реакционно-способных продуктов деструкции и выщелачивании, мигрирующих из медицинского изделия в организм человека при клиническом применении;
d) известно или вероятно, что медицинское изделие будет выделять значительные количества активных ингредиентов.
Примечание — Значение термина «значительные количества» зависит от химических свойств вещества. о котором идет речь.
А.5 Проведение токсикокинетических исследований не требуется, если:
a) уже накоплены значительные токсикологические или токсикокинетические данные, относящиеся к продуктам продуктов деструкции и выщелачивания;
b) уже накоплены значительные токсикологические или токсикокинетические данные, относящиеся к активным ингредиентам;
c) достигаемая или предполагаемая скорость выхода продуктов деструкции и выщелачивания из конкретного изделия признана (см. ISO 10993-17) безопасной и демонстрирует безопасные уровни клинического воздействия;
d) многолетний опыт документально подтверждает, что клиническое воздействие продуктов деградации и вымывания является безопасным.
А.6 Миграция продуктов деградации и вымывания из металлов, сплавов и керамики обычно очень незначительна и не является основанием для проведения токсикокинетических исследований.
А.7 Если материалы являются сложными и содержат продукты, которые являются эндогенными или настолько схожи с эндогенными продуктами, что их нельзя аналитически отличить, то проведение токсикокинетических исследований, как правило, невозможно.
7
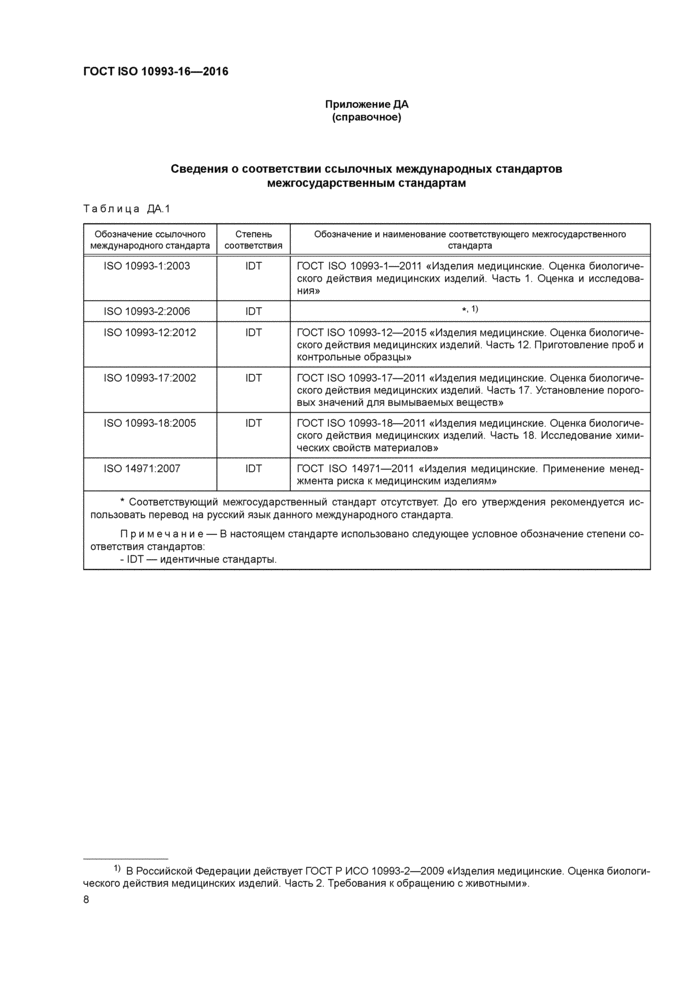
Приложение ДА (справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
|
Обозначение ссылочного международного стандарта |
Степень соответствия |
Обозначение и наименование соответствующего межгосударственного стандарта |
|
ISO 10993-1:2009 |
ЮТ |
ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологи-ческого действия медицинских изделий. Часть 1. Оценка и исследованиям |
|
ISO 10993-2:2006 |
ЮТ |
ГОСТ Р10993-2—2009 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 2.Требования к обращению с животными» |
|
ISO 10993-12:2012 |
ЮТ |
Г ОСТ IS0 10993-12—2009 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы» |
|
ISO 10993-17:2002 |
ЮТ |
ГОСТ ISO 10993-17-2011 «Изделия медицинские. Оценка биологическою действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ» |
|
ISO 10993-18:2005 |
ЮТ |
ГОСТ IS010993-18—2011 «Изделия медицинские. Оценка биологическою действия медицинских изделий. Часть 18. Исследование химических свойств материалов» |
|
ISO 14971:2007 |
ЮТ |
ГОСТ ISO 14971 «Изделия медицинские. Применение менеджмента риска к медицинским изделиям» |
|
Примечание — В настоящем стандарте использовано следующее условное обозначение степени соответствия стандартов: - IDT — идентичные стандарты. | ||
8
ГОСТ ISO 10993-1 е—2016
Библиография
[1] AFZELIUS, L.. et al.. State-of-the-art tools for computational site of metabolism predictions: Comparative analysis, mechanistic insights and future applications. Drug. Metab. Revs., 39. pp. 61—86. 2007
[2] BAIL LIE. T.A.. et al.. Contemporary Issues in Toxicology: Drug Metabolites in Safety Testing. Toxicol. Appl. Pharmacol.. 182. pp. 188—196. 2002
[3] WINTER. M E. (ed). Basic clinical pharmacokinetics. 4th edition. Lippincott. Williams & Wilkins. 2003
[4] BEATTY. D.A. and PIEGORSCH. W.W.. Optimal statistical design for toxicokinetic studies. Statist. Meth. Med. Res.. 6. pp. 359—376. 1997
[5] BLAAUBOER. B.J.. BARRATT. M D. and HOUSTON. J.B.. The Integrated Use of Alternative Methods in Toxicological Risk Evaluation. ECVAM Integrated Testing Strategies Task Force Report 1, ATLA. 27. pp. 229—237. 1999
[6] BOKKERS. B.G. and SLOB. W.. Deriving a data-based interspecies assessment factor using the NOAEL and the benchmark dose approach. Crit. Rev. Toxicol.. 37. pp. 355—373. 2007
[7] BOOBIS. A.R.. et al.. Interlaboratory comparison of the asessment of P450 activities in human hepatic microsomal samples. Xenobiotica, 28. pp. 493—506, 1998
[8] CLARK. D.E. (Theme ed). Computational methods for the prediction of ADME and toxicity. Adv. Drug. Deliv. Rev.. 4, pp. 253—451.2002
[9] COSSON. V.F.. FUSEAU. E.. EFTHYMIOPOULOS. C. and BYE. A.. Mixed Effect Modeling of Sumatriptan Pharmacokinetics During Drug Development. I. Interspecies Allometric Scaling. J. Pharmacokin. Pharmacod., 25. pp. 149—167. 1997
[10] CROSS. D M. and BAYLISS. M.K.. A commentary on the use of hepatocytes in drug metabolism studies during drug discovery and drug development. Drug. Metab. Revs.. 32. pp. 219—240. 2000
[11] DIXIT. R.. Toxicokinetics: Fundamentals and applications in drug development and safety assessment, in Biological Concepts and Techniques in Toxicology. Chapter 8. pp. 117—160. Marcel Dekker. 2006
[12] DORNE. J.L.. WALTON. K. and RENWICK. A.G.. Human variability in xenobiotic metabolism and pathwayrelated uncertainty factors for chemical risk assessment: a review. Food Chem. Toxicol.. 43. pp. 203-216, 2005
[13] DORNE. J.L.. WALTON. K.. SLOB. W. and RENWICK. A.G.. Human variability in polymorphic CYP2D6 metabolism, is the kinetic default uncertainty factor adequate? Food Chem. Toxicol., 40. pp. 1633—1656. 2002
[14] DORNE. J.L.. Human variability in hepatic and renal elimination: implications for risk assessmenL J. Appl. Toxicol.. 27. pp. 411—420. 2007
[15] DORNE. J.L.. Impact of inter-individual differences in drug metabolism and pharmacokinetics on safety evaluation. Fundam. Clin. Pharmacol.. 18. pp. 609—620. 2004
[16] Drug discovery and evaluation: safety and pharmacokinetic assays. VOGEL. H.G.. et al. (eds), Springer Verlag. Berlin. 2006
[17] EKINS. S.. et al.. Present and future in vitro approaches for drug metabolism. J. Pharmacol. Toxicol. Methods. 44. pp. 313—324. 2000
[18] ENGLISH. J.C.. DEISINGER. P.J. and GUEST, D.. Metabolism of 2-ethyfhexanoic acid administered orally or dermally to the female Fischer 344 rat. Xenobiotica. 28. pp. 699—714. 1998
[19] FDA guideline for industry. Pharmacokinetics: Guidance for repeated dose tissue distribution studies. Federal Register. 60 (40). pp. 11274—11275. 1995
[20] FORKERT. P.-G.. Mechanisms of 1.1-dichloroethyfene-induced cytotoxicity in lung and liver. Drug Metab. Revs.. 33. pp. 49—80. 2001
[21] FRANTZ. S.W., et al.. Pharmacokinetics of ethylene glycol II. Tissue distribution, dose dependent elimination, and identification of urinary metabolites following single intravenous, peroral or percutaneous doses in female Sprague-Dawley rats and CD-I® mice. Xenobiotica, 26, pp. 1195—1220, 1996
[22] FUHR, U., Induction of Drug Metabolising Enzymes: Pharmacokinetic and Toxicological Consequences in Humans, Clin. Pharmacokin., 38. pp. 493—504. 2000
[23] GOTT. D., Biodegradation and toxicokinetic studies, in BRAY8ROOK. J.H. (ed).. Biocompatibility assessment of medical devices and materials. John WILEY. Chichester. 1997
9
[24] GUNDERT-REMY. U. and SONICH-MULUN. C.. IPCS Uncertainty and Variability Planning Workgroup and Drafting Group (International Program on Chemical Safety). The use of toxicokinetic and toxicodynamic data in risk assessment an international perspective. Sci. Total Environ.. 288. pp. 3—11. 2002
[25] KWON, Y. (ed). Handbook of essential pharmacokinetics, pharmacodynamics and drug metabolism for industrial scientists. Springer Vertag, 2001
[26] HANSCH. C.. MEKAPATI. S B.. KURUP. A. and VERMA. R.P., QSAR of Cytochrome P450. Drug Metab. Revs., 36. pp. 105—156. 2004
[27] Harmonised Tripartite Guideline — Note for Guidance on Toxicokinetics: The Assessment of Systemic Exposure in Toxicity Studies. ICH S3A. 1994
[28] Harmonised Tripartite Guideline — Pharmacokinetics: Guidance for Repeated Dose Tissue Distribution Studies. ICH S3B. 1994
[29] HEDAYA. M.A.. Basic pharmacokinetics. CRC Press pharmacy education series. CRC Press. Boca Raton. FL. 2007
[30] HEINONEN. M.. OILA. O. and NORDSTROM. K., Current issues in the regulation of human tissueengineering products in the European Union. Tissue Eng., 11. pp. 1905—1911. 2005
[31] HENGSTLER. J.G., et al.. Cryopreserved primary hepatocytes as a constantly available in vitro model for the evaluation of human and animal drug metabolism and enzyme induction. Drug Metab. Revs.. 32. pp. 81—118.2000
[32] HOUSTON. J.B. and GALETIN, A., Progress towards prediction of human pharmacokinetic parameters from in vitro technologies. Drug Metab. Revs.. 35. pp. 393—415. 2003
[33] GUENGERICH. F.P. and RENDIC. S. (eds). Human cytochrome P450 enzymes, a status report summarizing their reactions, substrates, inducers and inhibitors — 1st update. Special issue on Human cytochromes P450 (Human CYPs). Drug Metab. Revs.. 34. pp. 1—450. 2002
[34] Human cytochrome P450s: assessment, regulation and genetic polymorphisms. Xenobiotica (special issue). 28. pp. 1093—1291. 1998
[35] ICH S3A Toxicokinetic guidance reference — Note for Guidance on Toxicokinetics: A Guidance for Assessing Systemic Exposure in Toxicity Studies (CPMP/ICH/384/95.)
[36] International Programme On Chemical Safety. Environmental Health Criteria 57: Principles of toxicokinetic studies. World Health Organization. Geneva. 1986
[37] TOZER. T.N. and ROWLAND. M. (eds). Introduction to pharmacokinetics and pharmacodynamics: the quantitative basis of drug therapy. Lippincott. Williams & Wilkins. 2006
[38] KEEGAN. G.M.. LEARMONTH. I.D. and CASE. C.P.. Orthopaedic metals and their potential toxicity in the arthroplasty patient. A review of current knowledge and future strategies. J. Bone Joint Surg. [Br], 89-B, pp. 567—573. 2007
[39] KIRMAN. C.R.. SWEENEY. L.M.. CORLEY. R. and GARGAS. M.L.. Using physiologically-based pharmacokinetic modeling to address nonlinear kinetics and changes in rodent physiology and metabolism due to aging and adaptation in deriving reference values for propylene glycol methyl ether and propylene glycol methyl ether acetate. Risk Anal.. 25. pp. 271—284. 2005
[40] KRISHNAN. K. and JOHANSON. G.. Physiologically-based pharmacokinetic and toxicokinetic models in cancer risk assessment. J. Environ. Sci. Health. Part C: Environ. Carcinogen. Ecotox. Rev.. 23. pp. 31—53. 2005
[41] LEWIS. D.F.V. and DICKINS, M.. Baseline lipophilicity relationships in human cytochromes P450 associated with drug metabolism. Drug Metab. Revs., 35. pp. 1—18. 2003
[42] LINHART. I.. Stereochemistry of styrene biotransformation. Drug Metab. Revs.. 33. pp. 353—368. 2001
[43] LUU. H.M.L., HUTTER. J.C. and BUSHAR, A.. Physiologically based pharmacokinetic model (PBPK) model for 2.4-toluenediamine leached from polyurethane foam-covered breast implants. Envir. Health Perspectives 106(7). pp. 393—400. 1998
[44] MAHMOOD. I.. GREEN. M.D. and FISHER. J.E., Selection of the first-time dose in humans: comparison of different approaches based on interspecies scaling of clearance. J. Clin. Pharmacol.. 43. pp. 692—697. 2003
[45] MEEK. B.. RENWICK. A. and SONICH-MULUN. C.. International Programme on Chemical Safety: Practical application of kinetic data in risk assessment — an IPCS initiative. Toxicol. Lett.. 138. pp. 151—60. 2003
[46] MIZUTANI. T.. PM frequencies of major CYPs in Asians and Caucasians. Drug Metab. Revs.. 35. pp. 99—107.2003
[47] NESTOROV. I.. Whole Body Pharmacokinetic Models: Review Article. Clin. Pharmacokin., 42. pp. 883—908. 2003
[48] OECD Guideline for Testing of Chemicals. 417: Toxicokinetics. Adopted: 4 April 1984
10
[49] ORN. U. and KLASSON-WEHLER. E.. Metabolism of 2. 2'. 4, 4'— tetrabromodiphenylether in rat and mouse. Xenobiotica. 28. pp. 199—211.1998
[50] POULIN. P. and THEIL. F-P.. Prediction of pharmacokinetics prior to In vivo studies. II. Generic physiologically based pharmacokinetic models of drug disposition. J. Pharm. Sd.. 91. pp. 1358—1370. 2002
[51] RENWICK. A.G. and LAZARUS. N.R.. Human variability and noncancer risk assessment — An analysis of the default uncertainty factor.. Regul. Toxicol. Pharmacol.. 27. pp. 3—20, 1998
[52] ROFFEY. S.J.. OBACH. R.S.. GEDGE. J.l. and SMITH. D.A.. What is the objective of the mass balance study? A retrospective analysis of data in animal and human excretion studies employing radiolabelled drugs. Drug Metab. Revs.. 39. pp. 17-44, 2007
[53] ROSSO. F.. MARINO. G.. GIORDANO. A.. BARBARISI. M.. PARMEGGIANI, D. and BARBARISI, A.. Smart materials as scaffolds for tissue engineering. J. Cell Physiol.. 203. pp. 465—470. 2005
[54] SCARFE. G.B.. et al.. 19F-NMR and directly coupled HPLC-NMR-MS investigations into the metabolism of 2-bromo-4-trifluoromethy1aniline in rat: a urinary excretion balance study without the use of radiolabeling. Xenobiotica. 28. pp. 373—388. 1998
[55] SHEINER. L.B. and STEIMER. J-L. Phanmacokinetic/pharmacodynamic modelling in drug development. Ann. Rev. Pharmacol. Toxicol.. 40. pp. 67—95. 2000
[56] SKORDI, E.. WILSON. I D.. LINDON. J.C. and NICKOLSON. J.K., Characterization and quantification of metabolites of racemic ketoprofen excreted in urine following oral administration to man by 1H-NMR spectroscopy, directly coupled HPLC-MS and HPLC-NMR. and circular dichroism. Xenobiotica. 34. pp. 1075—1089. 2004
[57] SLATTER. J.G., et al.. Pharmacokinetics, toxicokinetics, distribution, metabolism and excretion of linezolid in mouse, rat and dog.. Xenobiotica. 32. pp. 907—924. 2002
[58] SMITH. D.A.. WALKER. D.K. and VAN de WATERBEEMD. H.. Pharmacokinetics and metabolism in drug design. Methods and principles in medicinal chemistry. 31. Wiley-VCH. Weinheim. 2006
[59] SMITH. D.A.. HUMPHREY. M.J., and CHARUEL. C.. Design of toxicokinetic studies. Xenobiotica. 20. pp. 1187—1199. 1990
[60] SMITH. D.A.. Pharmacokinetics and pharmacodynamics in toxicology. Xenobiotica. 27. pp. 513—525, 1997
[61] SUN. H.F., MEI. L.. CUNXIAN. S.. CUI. X.. and WANG. P., The in vivo degradation, absorption and excretion of PCL-based-implant. Biomaterials. 27. pp. 1735—1740. 2006
[62] LIPSCOMB. J.C. and OHANIAN. E.V. (eds.).Toxicokinetics and risk assessment. Informa. 2006
[63] CLAYSON. D.B., et al. (eds.). Toxicology. Elsevier. New York. 1996
[64] TOZER. T.N. and ROWLAND. M.. Introduction to Pharmacokinetics and Pharmacodynamics — The Quantitative Basis of Drug Therapy. Lippincott. WILLIAMS & WILKINS. 2006
[65] VENKATAKRISHNAN. K.f VON MOLTE. L.L. and GREENBLATT, D.J.. Human drug metabolism and cytochromes P450: Application and relevance of in vitro models. J. Clin. Pharmacol.. 41. pp. 1149—1179. 2001
[66] WALKER. D.K.. The use of pharmacokinetic and pharmacodynamic data in the assessment of drug safety in early drug development. Br. J. Clin. Pharmacol.. 58. pp. 601—608. 2004
[67] YACOBI. A.. SKELLY. J.P.. and BATRA. V.K.. Toxicokinetics and new drug development. Pergamon Press. 1989
[68] YAN. Z. and CALDWELL, G.W.. Metabolism profiling, and cytochrome P450 inhibition & induction in drug discovery. Curr. Top. Med. Chem.. 1. pp. 403—425. 2001
[69] YANNAS. I.V.. Synthesis of Tissues and Organs. Chem. Bio. Chem.. 5. pp. 26—39. 2004
[70] ZHOU. S.. et al.. Drug bioactivation, covalent binding to target proteins and toxicity relevance. Drug Metab. Rev.. 37. pp. 41—214. 2005
11
Содержание
1 Область применения............................................1
2 Нормативные ссылки............................................1
3 Термины и определения..........................................1
4 Принципы планирования токсикокинетических исследований.....................2
5 Руководство по методам исследований.................................3
5.1 Общие положения...........................................3
5.2 Руководство по конкретным методам исследований........................4
Приложение А (обязательное) Обстоятельства, при которых проведение токсикокинетических
исследований необходимо................................7
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
межгосударственным стандартам............................8
Библиография.................................................9
Введение
ИСО (Международная организация по стандартизации) является Всемирной федерацией национальных органов по стандартизации (органов — членов ИСО). Работу по подготовке международных стандартов проводят через ИСО технические комитеты. Каждый комитет-член, заинтересованный в деятельности, для которой был создан технический комитет, имеет право быть представленным в этом комитете. Международные организации, правительственные и неправительственные, имеющие связи с ISO, также принимают участие в работе. ИСО тесно сотрудничает с Международной электротехнической комиссией (МЭК) по всем вопросам электротехнической стандартизации.
Международные стандарты проектируются в соответствии с правилами, приведенными в Директивах ИСО/МЭК. часть 2.
Основной задачей технических комитетов является подготовка международных стандартов. Проекты международных стандартов, принятые техническими комитетами, рассылаются членам ИСО для голосования. Их опубликование в качестве международных стандартов требует одобрения не менее 75 % комитетов-членов, принимающих участие в голосовании.
ISO 10993-16 был подготовлен Техническим комитетом ISO/TC 194 «Биологическая оценка медицинского оборудования».
В серию ISO 10993 входят следующие части под общим названием «Оценка биологического действия медицинских изделий»:
- часть 1 — Оценка и испытания в рамках процесса менеджмента риска;
- часть 2 — Требования к охране здоровья животных:
- часть 3 — Испытания на генотоксичность. канцерогенность и токсичность, влияющую на репродуктивность:
- часть 4 — Выбор испытаний, относящихся к взаимодействию с кровью;
- часть 5 — Испытания на цитотоксичность in vitro:
- часть 6 — Испытания для определения локальных эффектов после имплантации;
- часть 7 — Остатки при стерилизации этиленоксидом;
- часть 9 — Структура идентификации и квантификации потенциальных продуктов разложения;
- часть 10 — Пробы на раздражение и аллергическую реакцию кожи;
- часть 11 — Испытания на системную токсичность;
- часть 12 — Приготовление проб и стандартные образцы:
-часть 13 — Идентификация и количественная оценка продуктов разложения в полимерных медицинских устройствах;
- часть 14 — Идентификация и количественная оценка продуктов разложения керамики;
-часть 15 — Идентификация и количественная оценка продуктов разложения металлов и сплавов;
-часть 16 — Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ;
- часть 17 — Установление допустимых пределов выщелачиваемых веществ;
- часть 18 — Определение химических характеристик материалов;
- часть 19 — Физико-химическая, морфологическая и топографическая характеристика материалов (технические требования);
- часть 20 — Принципы и методы исследования иммунотоксикологических испытаний медицинских изделий (технические требования).
Токсикокинетика описывает абсорбцию, распределение, метаболизм и выделение чужеродных соединений в живом организме на протяжении времени. Учет стабильности материала(ов) in vivo и определение ожидаемых и случайных продуктов деградации и выщелачивания необходимы для оценки безопасности медицинского изделия. Токсикокинетические исследования могут быть полезны для оценки безопасности материалов, используемых в разработке медицинского изделия, или для выяснения механизма наблюдаемых неблагоприятных реакций. Токсикокинетические исследования также могут быть применимы к медицинским изделиям, содержащим активные ингредиенты. Необходимость и масштаб таких исследований должны быть тщательно рассмотрены, основываясь на характере и длительности контакта изделия с тканями организма (см. приложение А). Существующая научная литература по токсикологии и данные по токсикокинетике могут быть достаточными для этого рассмотрения.
Потенциальная опасность медицинского изделия может быть связана с взаимодействием его компонентов или их метаболитов с биологическими средами. Медицинские изделия могут содержать выще-
IV
лачиваемые вещества (например, остаточные катализаторы, агенты обработки, остаточные мономеры, наполнители, антиоксиданты, пластификаторы) и/или продукты деструкции, которые мигрируют из материала и потенциально могут стать причиной неблагоприятного воздействия на организм.
Опубликовано большое число статей по использованию токсикокинетических методов для изучения поведения химических веществ в организме (см. библиографию). Методология и подходы, использованные в таких исследованиях, составляют основу рекомендаций настоящего стандарта. Обоснования для использования настоящего стандарта приведены в приложении А.
V
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ.
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 16
Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ
Medical devices. Biological evaluation of medical devices. Part 16. Toxicokinetic study design for degradation products
and leachables
Дата введения —2017—10—01
1 Область применения
Настоящий стандарт устанавливает принципы, в соответствии с которыми планируют и осуществляют исследования токсикокинетики, обусловленной применением медицинских изделий.
В приложении А изложены рекомендации по включению токсикокинетических исследований в оценку биологического действия медицинских изделий.
2 Нормативные ссылки
Следующие нормативные документы необходимы для применения данного стандарта. При датированной ссылке применимо только указанное издание. При ссылке без даты применимо последнее издание указанного документа, включая все поправки:
ISO 10993-1 Biological evaluation of medical devices — Part 1: Evaluation and testing within a risk management process (Оценка биологическая медицинских изделий. Часть 1. Оценка и испытания в рамках процесса менеджмента риска)
ISO 10993-2 Biological evaluation of medical devices — Part 2: Animal welfare requirements (Оценка биологическая медицинских изделий. Часть 2. Требования к охране здоровья животных)
ISO 10993-12 Biological evaluation of medical devices — Part 12: Sample preparation and reference materials (Биологическая оценка медицинских изделий. Часть 12. Приготовление проб и стандартные образцы)
ISO 10993-17 Biological evaluation of medical devices — Part 17: Establishment of allowable limits for leachable substances (Оценка биологическая медицинских изделий. Часть 17. Установление допустимых пределов выщелачиваемых веществ)
ISO 10993-18 Biological evaluation of medical devices — Part 18: Chemical characterization of materials (Оценка биологическая медицинских изделий. Часть 18. Определение химических характеристик материалов)
ISO 14971 Medical devices — Application of risk management to medical devices (Изделия медицинские. Применение менеджмента риска к медицинским изделиям)
3 Термины и определения
В настоящем стандарте применены термины по IS0 10993-1. а также следующие термины с соответствующими определениями:
3.1 абсорбция: Процесс, в результате которого вещество поступает в кровеносную и (или) лимфатическую систему.
Издание официальное
3.2 биологическая доступность: Значение общей абсорбции исходного вещества.
3.3 биодеструкция: Разрушение материала под воздействием биологической среды.
Примечание — Процесс биодеструкции может быть смоделирован исследованиями in vitro.
3.4 биорезорбция: Процесс, в результате которого биоматериал разрушается в физиологической среде, а продукт(ы) получающийся(еся) при этом, выводятся и/или абсорбируются.
3.5 клиренс: Скорость выведения исследуемого вещества из организма или его частей в результате метаболизма и/или экскреции.
3.6 концентрация С^: Максимальная концентрация конкретного вещества в плазме, выраженная отношением массы к единице объема.
Примечание — Когда ссылаются на максимальную концентрацию вещества в жидкости или ткани, ей присваивают обозначение (например. С™» печени) и выражают отношением единиц массы к единицам обьема или массы.
3.7 продукт деструкции: Продукт материала, образовавшийся в результате химического распада исходного материала.
3.8 распределение: Процесс, в результате которого абсорбируемое вещество и (или) его метаболиты циркулируют и распределяются внутри организма.
3.9 экскреция: Процесс, посредством которого абсорбируемое вещество и/или его метаболиты удаляются из организма.
3.10 экстракт: Жидкость, которая получается в результате процесса экстракции исследуемого материала или контроль.
3.11 период полувыведения f1/2: Время, необходимое для уменьшения концентрации исследуемого вещества на 50 % от его начального количества в той же жидкости или ткани организма.
3.12 выщелачиваемое (вымываемое) вещество: Химическое вещество, которое может мигрировать из изделия или компонента при условиях хранения или применения.
Примечание — Вымываемые вещества (например, добавки, мономерные или олигомерные сосгавные полимерного материала) могут быть экстрагированы в лабораторных условиях, имитирующих нормальные условия воздействия.
3.13 среднее время пребывания: Параметр, связанный с периодом полувыведения. количественно оценивающий продолжительность присутствия конкретного вещества в организме.
3.14 метаболизм: Процесс, посредством которого абсорбированное вещество структурно изменяется в организме в результате химических и/или ферментативных реакций.
Примечание — Продукты первоначальною взаимодействия могут впоследствии изменяться путем любых ферментативных или неферментативных реакций перед их экскрецией.
3.15 исследуемое вещество: Продукт деструкции или вымывания, являющийся предметом ток-сикокинетических исследований.
3.16 время tmах: Время, при котором достигается максимальная концентрация Сгпах.
3.17 объем распределения Vd: Показатель для однокамерной модели, описывающий предполагаемый объем, который будет содержать все количество исследуемого вещества при условии его однородного распределения в организме.
4 Принципы планирования токсикокинетических исследований
4.1 Токсикокинетические исследования планируют с учетом каждого конкретного изделия или материала.
4.2 Программу исследований составляют и оформляют до начала экспериментов. При этом в программу включают цель и методики исследований. Подробнее это изложено в подразделах 4.3—4.8 и в разделе 5.
4.3 При выборе методов токсикокинетических исследований учитывают результаты изучения процесса вымывания. Кроме того, учитывают информацию о химических и физико-химических свойствах, структуре поверхности материала и биохимических свойствах всех продуктов вымывания.
Примечание — Количество и скорость выделения продуктов, получающихся в результате процесса вымывания. зависят от их концентрации на поверхности материала, скорости их миграции на поверхность в самом материале. их растворимости и скорости движения продуктов в физиологической среде.
4.4 Токсикокинетические исследования рекомендуется проводить с охарактеризованным потенциальнотоксичным продуктом процессов выщелачивания и деструкции. Проведение токсикокинетичес-ких исследований на смесях возможно только при определенных условиях. В отдельных случаях допускается изучение экстрактов в соответствии с IS010993-12, а также гранул или порошков из материала или медицинского изделия, но это должно быть обосновано при планировании исследований.
4.5 Выбранные аналитические методы должны обнаруживать и характеризовать все продукты деструкции, выщелачивания, а также их метаболиты в биологических жидкостях и тканях. Для аналитических методов следует использовать другие части ISO 10993 по применимости. Методы должны быть подробно описаны в исследовательских отчетах в соответствии с л. 5.1.11.
Количественные аналитические методы должны быть конкретными, чувствительными, воспроизводимыми и линейными по всему предполагаемому диапазону концентраций исследуемого материала. В отчете должно быть представлено обоснование выбранного метода исследования.
4.6 В плане исследования должна быть указана физиологическая жидкость, ткань или экскрет, в которых будут определены уровни исследуемого вещества.
Примечание — Кроиь наиболее доступна для исследования, поэтому ее часто используют для изучения кинетического параметра и абсорбции. При этом необходимо указать, на чем проводят анализ — на цельной крови, сыворотке или плазме, и обосновать этот выбор. Связывание с циркулирующими белками крови или эритроцитами можно определять методами in vitro.
4.7 Исследовательский отчет должен содержать информацию о характере связывания определяемого вещества в пробе (например, степень и характер сродства) и показывать, что это не приводит к недооценке концентрации анализируемого вещества.
4.8 Для определения кинетических параметров должно быть представлено достаточное количество данных с допустимым разбросом. Теоретически они должны составлять несколько периодов полувы-ведения вещества, на практике в диапазоне определения накладывает чувствительность аналитических методов.
5 Руководство по методам исследований
5.1 Общие положения
5.1.1 Исследования выполняют на животных соответствующего пола и вида. Здоровые молодые и половозрелые животные проходят акклиматизацию в лабораторных условиях в течение по меньшей мере 7 сут. Если при исследовании метаболизма используют индивидуальные клетки, то животных переводят туда для акклиматизации не менее чем за 24 ч. Окружающие условия должны соответствовать рекомендациям по содержанию и использованию животных (см. ISO 10993-2). В течение всего эксперимента животные получают обычный рацион и питьевую воду, если программа исследований не предусматривает каких-либо изменений в режиме их содержания. Отбор животных в группы для каждого периода исследования носит произвольный характер. Группы должны содержать не менее трех мелких животных и не менее двух животных более крупных видов. В заранее запланированное время животных подвергают эвтаназии.
5.1.2 Возможно использование исследуемого вещества, не меченного радиоактивными изотопами, при наличии подходящих утвержденных методов проб данного вещества в соответствующих образцах и полной характеристикой метаболизма исследуемого вещества.
5.1.3 При необходимости исследуемое вещество метят стабильными изотопами. Предпочтительными являются радиохимически чистые (более 97 %) 14С или 1Н. При использовании изотопа 1Н учитывают возможность замещения трития. Меченное радиоизотопами вещество при необходимости разводят веществом, не содержащим радиоизотопов.
5.1.4 При использовании вещества, меченного радиоизотопами, учитывают его специфическую активность и радиохимическую чистоту.
5.1.5 Исследуемое вещество вводят способом, который определяют в зависимости от назначения медицинского изделия. Исследуемое вещество должно быть приготовлено в подходящей экстрагирующей жидкости, учитывая физико-химические свойства исследуемого вещества (продукт выщелачивания или деструкции) и используя соответствующие способы введения и дозы. Необходимо знать и отразить в отчете стабильность образца при условиях, выбранных для введения.
Примечание — Программа исследований может включать в себя разные пути введения вещества для сравнения процента абсорбции.
5.1.6 Для изучения сбалансированности доз животных помещают только в клетки, предназначенные для исследования метаболизма.
5.1.7 Мочу и фекалии сохраняют при низкой температуре или в емкостях, содержащих консерванты. не мешающие проведению анализов, для предотвращения развития постэкскреционных микробиологических процессов и самопроизвольного изменения. Кровь предназначенную для исследования в виде цельной крови или плазмы крови, сохраняют в присутствии соответствующих антикоагулянтов.
5.1.8 До начала эксперимента, по возможности, у животных отбирают контрольные пробы. В некоторых исследованиях фоновые контрольные пробы (например, ткани) у подопытных животных отобрать невозможно, поэтому их забирают у контрольной группы.
5.1.9 Время отбора проб должно соответствовать типу исследования. Отбор осуществляют по необходимости в течение периодов времени длительностью в несколько минут, часов, суток, недель или даже месяцев. Для исследований включающих изучение продуктов выделения, обычно используют 24-часовые периоды в течение по меньшей мере 96 ч. В исследованиях, требующих взятия проб крови, кровь забирают по конкретному расписанию с интервалами от нескольких минут до нескольких часов в течение периода до 72 ч.
5.1.10 Токсикокинетические исследования следует проводить в соответствии со стандартами надлежащей лабораторной практики.
5.1.11 Отчет об исследованиях должен включать следующую информацию, если применимо:
a) линию и источник поступления животных, условия содержания, их рацион, возраст и пол;
b) исследуемое вещество и образец, их чистоту, стабильность, химический состав и введенное количество:
c) условия исследований, включая путь введения вещества;
d) методы анализа, экстракции, определения и валидации;
e) материальный баланс исследуемого вещества;
f) индивидуальные результаты на каждом этапе исследования в виде таблицы;
д) заявление о соответствии стандартам качества или требованиям надлежащей лабораторной практики:
h) обсуждение полученных результатов:
i) интерпретацию полученных результатов.
5.2 Руководство по конкретным методам исследований
5.2.1 Основные положения
5.2.1.1 Исследование планируют таким образом, чтобы получить необходимую информацию для оценки только степени риска использования медицинских изделий, так что обычно нет необходимости в рассмотрении всех аспектов.
5.2.1.2 Исследования абсорбции, распределения, метаболизма и экскреции проводят по отдельности. изучая один из перечисленных процессов, или одновременно, рассматривая несколько аспектов в одном исследовании.
5.2.1.3 Количество изучаемых кинетических параметров выбирают в зависимости от программы исследований. Среди них: скорость абсорбции, площадь под кривой «концентрация плазмы — время», площадь под кривой «исходная концентрация плазмы время», объем распределения. С^,,. t,^. период полувыведения, среднее время пребывания, скорость выведения и клиренс.
5.2.1.4 Кинетические параметры могут быть определены только для определенных видов молекул, и, следовательно, методы анализа должны быть конкретными и чувствительными к этим видам молекул. Истинные кинетические параметры соответствующего соединения могут быть определены только при его внутривенном введении. Поэтому при необходимости в программу исследований кинетических параметров включают исследования с ограниченным внутривенным введением. Это позволяет вычислить долю абсорбированной дозы для коррекции результатов, ожидаемых в других исследованиях.
5.2.1.5 Для определения кинетических параметров используют соответствующую кинетическую модель. Существуют специальные компьютерные программы для вычисления этих параметров. Программное обеспечение утверждают до момента его использования и подтверждают это документально. Предположения, введенные в программу, и выбор кинетической модели также отражают в отчете.
5.2.2 Абсорбция
Процесс абсорбции зависит от пути введения исследуемого вещества, его физико-химического состояния и экстрагирующей жидкости. Его оценивают по концентрации данного вещества в крови, в сыворотке, в выделениях и в тканях организма. Также рассматривают необходимость проведения 2
полного исследования биологической доступности этого вещества. Выбор подходящего метода исследования зависит от другой требуемой информации, возможности применения материала, меченного радиоизотопами, и используемого метода анализа. При исследовании кинетических параметров константа скорости процесса абсорбции может быть достоверно вычислена при условии, что в фазе абсорбции взято достаточное число проб.
Примечание — Существуют методы in vitro, которые дают важную информацию о желудочно-кишечной и кожной абсорбции химических веществ.
5.2.3 Распределение
5.2.3.1 Для исследования процесса распределения, как правило, используют меченное радиоизотопами вещество. Исследования могут быть:
- количественными, определяющими уровни содержания вещества в срезах тканей:
- качественными, использующими общую ауторадиографию;
- полуколичественными. использующимивыборочнуюауторадиографиюпостандартнымполям.
Обычно при изучении процесса распределения время отбора проб должно быть между fmax = 24 ч и
168 ч или более, в зависимости от времени выведения исследуемого вещества. Отбор проб в промежуточные интервалы времени проводят, когда требуются дополнительные данные. Более частый отбор проб обычно выполняют на ранних фазах абсорбции и выведения. При этом берут как можно больше проб в течение фазы выведения (теоретически три-четыре периода полувыведения) для того, чтобы обеспечить более точные определения кинетических параметров.
Основным решающим фактором часто является чувствительность метода.
5.2.4 Метаболизм и экскреция
5.2.4.1 Клетки для содержания животных при изучении метаболизма должны позволять проводить отдельный сбор мочи и фекалий на всех этапах исследования. При длительности исследований до 14 сут мочу и фекалии собирают отдельно через 24-часовые интервалы до конца эксперимента. Иногда план исследований может предусматривать эвтаназию животных на промежуточных стадиях.
Пробы могут быть отобраны ранее 24 ч. когда есть вероятность быстрого выведения исследуемого вещества или его метаболитов. При длительных исследованиях отбор проб в начальном периоде проводят также, как для кратковременных исследований. Затем пробы отбирают непрерывно в течение 24 ч на период оценки.
Примечание — Использование клеток для изучения метаболизма при длительных исследованиях может быть вредным для здоровья животных. Поэтому при продолжительном эксперименте для получения достоверных результатов собирают репрезентативные выборочные пробы, и эти результаты экстраполируются, как при непрерывном отборе проб.
5.2.4.2 Трупы животных и/или их органы-мишени сохраняют для исследований, а кровь этих животных забирают для определения концентрации веществ в плазме и цельной крови. После отбора проб в момент эвтаназии клетки для исследований метаболизма моче- и калосборники моют специальными растворителями. Возможны накопление полученных смывов и сохранение репрезентативной части для анализов.
5.2.4.3 Когда используют вещество, помеченное радиоизотопами (см. примечание ниже), полное выведение или расчетное полное выведение исследуемого вещества в идеале должно быть (100 = 10) %. Количество исследуемого вещества в каждой фракции анализируют с помощью установленных процедур для каждого меченного или не меченного радиоизотопами соединения в соответствующей среде. При использовании соединений, меченных радиоизотопами, проводят оценку как исходного вещества, так и метаболитов если не используют конкретную пробу. Если вещество, меченное радиоизотопами. не обнаруживают в достаточном количестве в экскрете (фекалиях и/или моче) или в организме подопытного животного, рассматривают необходимость сбора выдыхаемого воздуха.
Примечание — Не во всех случаях достижим указанный диапазон полного выведения вещества. Причины любых отклонений регистрируют и обсуждают в отчете об исследованиях.
5.2.4 4 Уровни радиоактивности в биологической среде определяют, например, методом сцинтилляции жидкости. Однако следует подчеркнуть, что в данном методе используют суммарную концентрацию соединения и его метаболитов, поэтому на ее основе не могут быть определены кинетические параметры. Там. где необходимо отделение метаболитов, используют ряд процедур экстракции и хро-
1
2