ГОСТ ISO 10993-11-2021
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
Распространяется на медицинские изделия (МИ) и материалы, применяемые для их изготовления, и устанавливает требования к процедурам оценки потенциального общетоксического действия (общей токсичности)
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22
стр. 23
стр. 24

стр. 25

стр. 26
стр. 27

стр. 28

стр. 29

стр. 30
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ. МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТISO 10993-11 — 2021Изделия медицинскиеОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 11Исследования общетоксического действия
Изделия медицинскиеОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 11Исследования общетоксического действия
(ISO 10993-11:2017, Biological evaluation of medical devices —
Part 11: Tests for systemic toxicity, IDT)
Издание официальное
Москва
Российский институт стандартизации 2021
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Институт медико-биологических исследований и технологий» (АНО «ИМБИИТ») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 26 августа 2021 г. № 142-П)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004-97 |
Код страны по МК (ИСО 3166) 004-97 |
Сокращенное наименование национального органа по стандартизации |
|
Армения |
AM |
ЗАО «Национальный орган по стандартизации и метрологии» Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
КZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргыэстандарт |
|
Россия |
RU |
Росстандарт |
|
Узбекистан |
UZ |
Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 9 ноября 2021 г. № 1467-ст межгосударственный стандарт ГОСТ ISO 10993-11-2021 введен в действие в качестве национального стандарта Российской Федерации с 1 марта 2022 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10993-11:2017 «Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия» («Biological evaluation of medical devices — Part 11: Tests for systemic toxicity», IDT)
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВЗАМЕН ГОСТ ISO 10993-11-2011
Если ограничение двигательной активности необходимо, то до введения исследуемого образца животные должны привыкнуть к фиксирующему устройству.
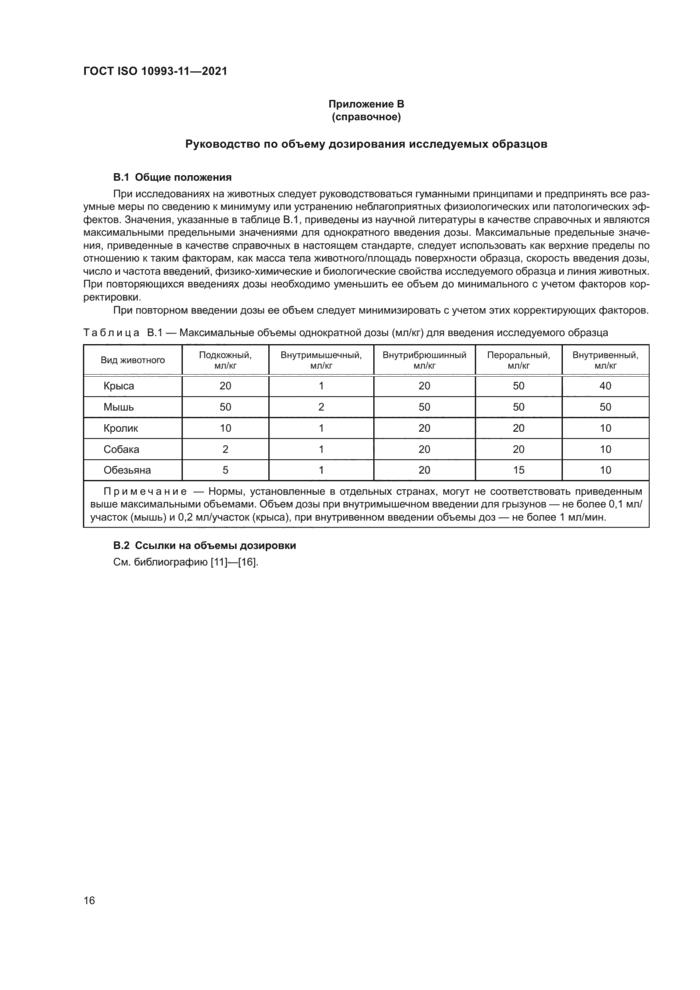
4.8.2 Объемы дозирования
Руководство по объему дозирования исследуемых образцов приведено в приложении В. При использовании нескольких дозовых групп вариантность исследуемого объема может быть сведена к минимуму путем регулирования его концентрации для обеспечения постоянного объема при всех дозах. Применение доз. объемы которых превышают приведенные в приложении В. должно быть обосновано.
Не допускается вводить пероральным путем дозы больших объемов, так как они превышают вместимость желудка и немедленно поступают в тонкий кишечник. Дозы больших объемов также могут вернуться в пищевод.
При внутримышечном введении следует ограничить дозу по объему в зависимости от размеров животного и расположения мышцы. Объемы дозирования при внутримышечном введении по видам животных приведены в приложении В.
Внутривенную болюсную инъекцию дозы, как правило, проводят примерно за 1 мин. Скорость введения дозы является важным фактором. Для грызунов эта скорость должна быть не более 2 мл/мин.
Для введения большого объема дозы может потребоваться медленная или рассчитанная по времени инъекция или внутривенная инфузия. Если животное подает признаки явного изменения клинического состояния, то скорость введения жидкого образца должна быть снижена вне зависимости от рассчитанной скорости или введение должно быть остановлено.
Малорастворимые исследуемые образцы или образцы, обладающие раздражающим действием, следует вводить с медленной скоростью при внутривенном введении.
При клинических показаниях допускается использовать длительную инфузию. Объем и скорость введения зависят от вводимого вещества с учетом практики жидкостной терапии. В качестве руководства единовременно вводимый объем дозы исследуемого образца должен составлять менее 10 % объема циркулирующей крови за 2 ч. При длительной инфузии ключевым фактором исследования является минимально эффективное двигательное ограничение исследуемых животных.
Объемы дозирования исследуемых образцов при подкожном введении приведены в приложении В. Скорость и степень абсорбции зависят от состава исследуемого образца.
4.8.3 Частота введения дозы
Частоту введения доз устанавливают в зависимости от клинической значимости исследуемого материала/МИ. Увеличение частоты введения исследуемого образца должно быть четко обосновано и описано в отчете об исследовании.
При исследованиях острой токсичности животных подвергают воздействию однократной дозы исследуемого образца или ее многократными долями, вводимыми в течение 24 ч.
При исследованиях многократного воздействия животные должны получать дозу исследуемого образца ежедневно в течение всего времени проведения исследования. Допускается применять другие режимы дозирования, при этом необходимо привести соответствующее обоснование.
4.9 Масса тела и потребление пищи/воды
Исследуемый образец может вызвать изменения массы тела животного, потребления им пищи и воды. Следовательно, необходимо определить индивидуальную массу каждого животного незадолго до введения образца (например, как правило, в пределах 24 ч при однократном введении или исследовании острой токсичности, и не более чем 7 сут при длительном многократном воздействии) через регулярные интервалы в течение всего времени исследования и по окончании исследования. При расчете дозы по массе тела необходимо использовать самые последние результаты взвешивания животного.
В продолжительных исследованиях должно быть учтено необходимое количество потребляемой животным пищи и воды.
4.10 Клинические наблюдения
Клинические наблюдения проводят подготовленные специалисты для обеспечения отчетности в течение всего времени исследования. Частоту и длительность наблюдения определяют в соответствии с характером и серьезностью токсических реакций, скоростью проявления симптомов и периода восстановления. Более частое наблюдение может быть необходимо на ранних стадиях исследования, особенно при исследованиях острой токсичности. Время появления и исчезновения негативных признаков, их длительность и время смерти лабораторных животных являются важными параметрами, особенно
если неблагоприятные признаки или смерть проявляются позднее. Во избежание страданий животных необходимо планировать длительность проведения исследования (конечные точки исследования), определенную национальными или международными руководствами по обращению с животными. Общие клинические наблюдения должны учитывать пиковый период ожидаемых реакций после введения доз.
Наблюдения следует постоянно документировать на протяжении всего исследования. Отчет об исследовании необходимо составлять по каждому животному.
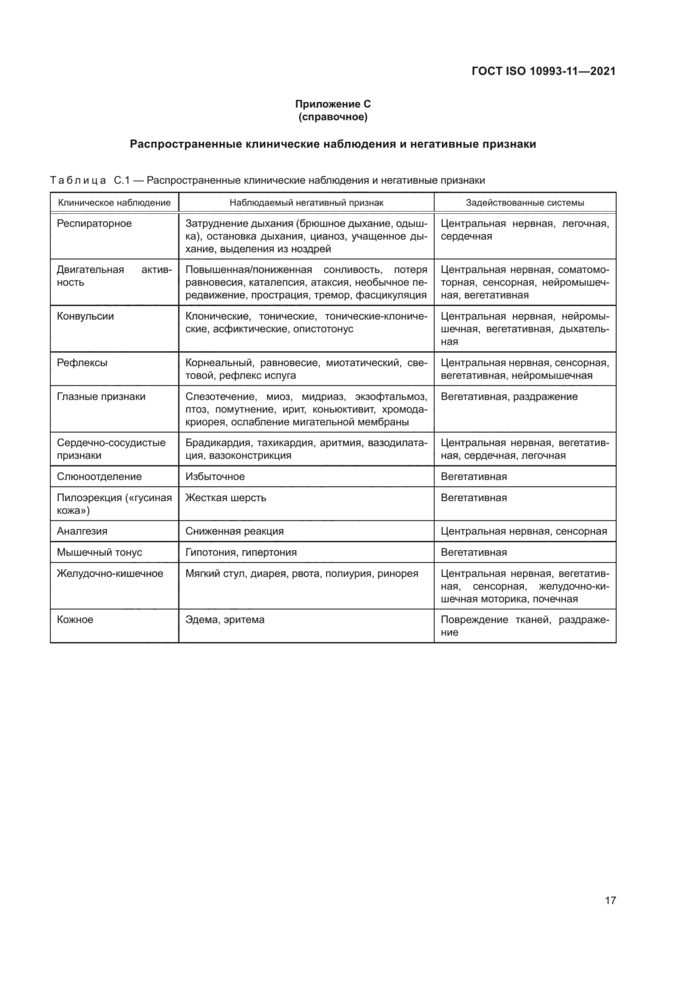
Результаты визуальных клинических наблюдений жизнеспособности или явных негативных признаков должны быть зафиксированы как минимум один раз в день, с использованием общепринятых лабораторных негативных признаков с описанием клинических эффектов (см. приложение С).
Наблюдаемые негативные признаки в состоянии животного или смертность в долгосрочных исследованиях при многократном введении дозы следует документировать не менее двух раз в день. При продолжительных исследованиях повторных воздействий рекомендуется применять более обширный, как минимум еженедельный скрининг негативных признаков.
4.11 Клиническая патология
Для исследования токсических эффектов в тканях, органах и других системах проводят анализы гематологических и биохимических показателей. Анализы следует проводить на образцах крови животных, используемых в исследовании, при многократном введении доз. полученных непосредственно перед запланированной процедурой эвтаназии животных или как одного из этапа такой процедуры. В некоторых случаях может быть необходимо голодание животных перед забором крови. Если требуется. то в течение последней недели долгосрочного исследования при многократном введении дозы может быть проведен анализ мочи с использованием рассчитанного по времени (например от 16 до 24 ч) сбора мочи соответствующего объема. Рекомендуемые показатели гематологии, биохимии и анализа мочи приведены в приложении D.
4.12 Патологоанатомические исследования
Если клинически показано, то по окончании исследований острой токсичности проводят патологоанатомическую оценку.
Все животные в исследованиях с многократным введением дозы должны быть подвергнуты вскрытию с полным и подробным макроскопическим обследованием, включая тщательное обследование внешних покровов тела, всех отверстий, а также черепной, грудной и брюшной полостей и их содержимого. Органы, выбранные для взвешивания, должны быть отделены от прилегающих тканей, и их массу во влажном состоянии измеряют как можно быстрее во избежание высыхания.
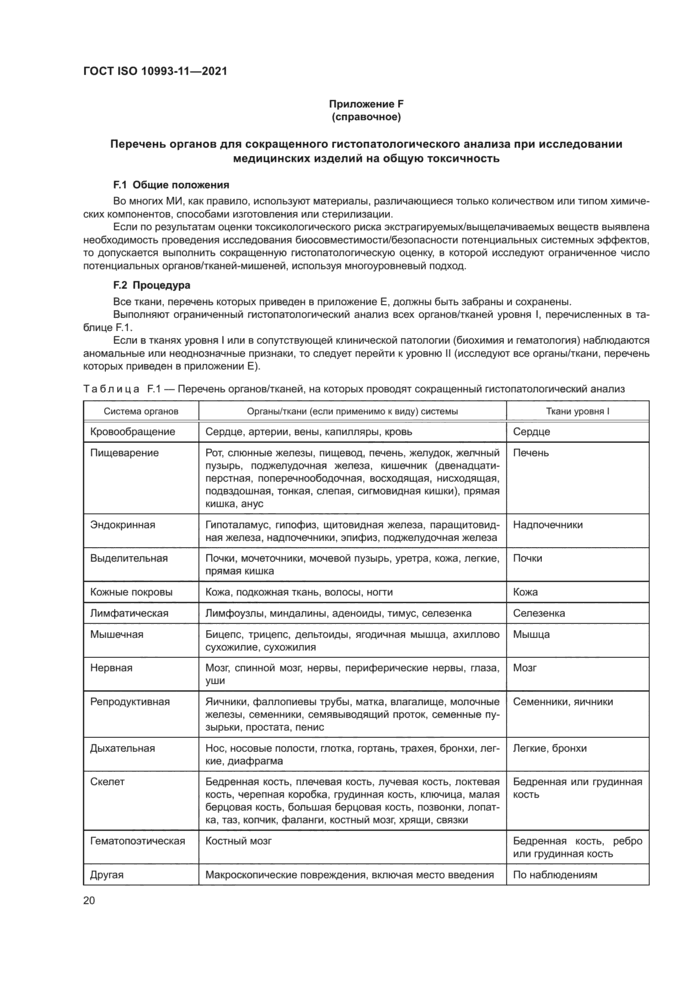
В приложение Е приведен перечень органов/тканей, которые необходимо взвесить и сохранить в соответствующей фиксирующей среде для гистопатологического исследования.
Перечень минимальных наблюдений для исследований каждого типа приведен в таблице 2.
|
Таблица 2 — Перечень минимальных наблюдений для исследований каждого типа | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
4.13 Планирование исследований
Требования к планированию исследований приведены в последующих разделах настоящего стандарта. Для составления плана исследования рекомендуется консультация эксперта.
4.14 Качество исследований
Нормы надлежащей лабораторной практики относятся к организации, процессу и условиям, при которых лабораторные исследования планируют, проводят, контролируют, фиксируют документально и описывают в отчете. Данные нормы применяют для обеспечения качества и значимости исследований. Нормы надлежащей лабораторной практики также поддерживают глобальные усилия по гармонизации путем способствования заключению меморандумов о взаимопонимании между странами — торговыми партнерами. Исследования общей токсичности следует проводить в соответствии с установленными нормами надлежащей лабораторной практики.
5 Исследование острой токсичности
5.1 Общие положения
По результатам исследования острой токсичности получают общую информацию об опасностях для здоровья, которые могут возникнуть в результате острого воздействия материалов/МИ при их предполагаемом клиническом применении. Исследование острой токсичности проводят на первом этапе для установления объема и частоты введения доз в подострых/субхронических и других исследованиях и получения информации о характере токсического действия материала/МИ при его предполагаемом клиническом применении. При исследовании острой токсичности после введения образца ведут наблюдение за возникающими эффектами (например, неблагоприятные клинические признаки, изменение массы тела, обнаружение макроскопической патологии) и смертельными случаями. Животных с серьезными и устойчивыми признаками страданий и боли следует немедленно подвергнуть эвтаназии. Коррозионные или раздражающие материалы, о которых известно, что они вызывают явную боль или страдание, должны быть отмечены в отчете как таковые и исключены из исследования.
Межведомственный координационный комитет по валидации альтернативных методов (ICCVAM) и Европейский центр валидации альтернативных методов (ECVAM) утвердили исследование цитотоксичности методами in vitro как альтернативу пероральным исследованиям острой токсичности. Во избежание ненужных страданий животных следует планировать длительность проведения исследования (конечные точки исследования) в соответствии с национальными или международными требованиями к обращению с животными.
5.2 Планирование исследования
5.2.1 Подготовка животных
Здоровые молодые половозрелые животные акклиматизируются к лабораторным условиям как минимум в течение 5 сут до начала исследования.
Более короткие сроки должны быть обоснованы. Животных рандомизируют и распределяют по экспериментальным группам.
5.2.2 Лабораторные животные
5.2.2.1 Выбор вида
Используют, как правило, грызунов (крыс, мышей). Характеристики модели (возраст, масса и т. д.) установлены в 4.2 и 4.3. Использование животных, не являющихся грызунами, должно быть обосновано.
5.2.2 2 Число и пол
Число и тип групп, количество животных в группе и их пол установлены в 4.5.
5.2.2.3 Условия размещения и кормления
Температура и относительная влажность в помещениях для экспериментальных животных должны соответствовать их виду, например, температура (22 ± 3) *С и влажность от 30 % до 70 % для мышей. Режим искусственного освещения, как правило. — 12 ч освещения и 12 ч темноты.
Для кормления животных допускается использовать стандартные коммерческие лабораторные корма, при этом следует обеспечить животным неограниченный доступ к питьевой воде. Животных размещают в клетках группами по полу или. при необходимости, индивидуально, при групповом размещении допускается помещать не более пяти животных в одну клетку.
5.2.3 Условия исследования
5.2.3.1 Уровни доз
Уровни доз — в соответствии с 4.8.
Обращение с животными контрольной группы должно быть идентично обращению с животными исследуемой группы за исключением введения исследуемого образца.
5.2.3.2 Процедура
Животные получают однократную дозу исследуемого образца или. если необходимо, многократные дозы в течение одного 24-часового периода. Негативные признаки следует регистрировать по мере наблюдения, включая их начало, степень и длительность.
Следует осуществлять регулярное наблюдение за животными для предотвращения случаев их падежа из-за каннибализма, автолиза тканей или побега. По окончании исследования всех выживших животных подвергают эвтаназии. Животных с признаками болезни удаляют из исследования и подвергают эвтаназии (если замечены признаки болезни в поведении животных). Методы, используемые для эвтаназии, должны соответствовать национальным или международным требованиям к обращению с животными.
Следует применять такие график наблюдения и гуманные конечные точки, чтобы предотвратить смертность животных непосредственно из-за токсичности исследуемого образца.
5.2.4 Масса тела
Массу тела животных следует измерять непосредственно перед введением дозы, ежедневно в течение первых трех суток после начала введения, еженедельно после первой дозы, если длительность исследования это позволяет, и по окончании исследования.
5.2.5 Клинические наблюдения
При исследовании острой токсичности период наблюдения должен составлять не менее трех суток или более, если это допустимо. Частота наблюдения и негативные признаки приведены в 4.10 и приложении С. Наблюдения проводят с достаточной частотой, при этом выполняют определенные действия. обеспечивающие минимальные потери среди исследуемых животных, например, вскрытие или заморозка животных, найденных мертвыми, и изоляция или умерщвление слабых или болезненных животных. Визуальные наблюдения включают в себя регистрацию следующих обязательных признаков: изменения кожи и шерсти, глаз и слизистых оболочек, изменения в вегетативной и центральной нервных системах, дыхательной и кровеносной системах, при этом не следует ограничиваться указанными признаками в соматомоторной деятельности и в схемах поведения, которые идентифицируют в соответствии с приложением С.
5.2.6 Патология
5.2.6.1 Клиническая патология
Оценку клинической патологии проводят при наличии клинических показаний, например МИ с ожидаемой или наблюдаемой токсичностью (по результатам предыдущих исследований) или новых материалов/МИ при отсутствии опыта клинического применения. При оценке клинической патологии проводят следующие исследования:
a) гематологию, см. приложение D. проводят по окончании периода исследования;
b) клиническое биохимическое исследование крови, см. приложение D. проводят по окончании периода исследования. Объектами исследований при оценке острой токсичности являются функции печени и почек. При необходимости допускается проводить дополнительное клиническое биохимическое исследование крови для продления наблюдения за отмеченными негативными признаками.
Анализ мочи (см. приложение D) на регулярной основе проводить не требуется. Анализ мочи выполняют только при показаниях, основанных на ожидаемой или наблюдаемой токсичности. Рекомендуемые показатели приведены в приложении D.
5.2.6 2 Патологоанатомические исследования
Проводят патологоанатомические исследования материалов/МИ с ожидаемой или наблюдаемой токсичностью (по предыдущему исследованию) или новых материалов/МИ при отсутствии опыта клинического применения. Патологоанатомические исследования включают в себя осмотр внешних покровов тела, всех отверстий, а также черепной коробки, грудной и брюшной полостей и их содержимого. При необходимости следует учесть массы мозга, печени, почек, надпочечников и семенников, которые взвешивают во влажном состоянии как можно скорее после вскрытия во избежание высыхания и получения ложно низких значений.
5.2.6.3 Гистопатология
При исследованиях острой токсичности, как правило, не проводят полные гистолатологические исследования на органах и тканях животных, если оно не показано необычной картиной при общем вскрытии.
5.3 Критерии оценки
5.3.1 Общие положения
В зависимости от плана исследования применяют следующие критерии оценки:
a) для исследований острой токсичности в соответствии с требованиями фармакопеи:
- если во время исследования острой токсичности ни одно из животных в опытной группе не демонстрирует значимо большую биологическую реактивность по сравнению с животными контрольной группы, то образец отвечает установленным требованиям.
- при наличии пяти животных в группе, если два или более животных умирают, или такое поведение как конвульсии или прострация наблюдается у двух или более животных, либо происходит суммарная (в конце исследования) потеря массы тела более 10 % у трех или более животных, то образец не отвечает установленным требованиям. При оценке острой токсичности следует определять промежуточную массу тела животного наряду с другими клиническими наблюдениями.
- если любое животное после введения образца демонстрирует только легкие признаки биологической реактивности и не более чем одно животное проявляет явные симптомы биологической реактивности или умирает, то исследование следует повторить, используя группы по десять животных.
- если при повторном исследовании после введения образца все десять животных за период наблюдения не проявляют какой-либо значимой биологической реактивности по сравнению с животными после введения экстрагирующей/модельной среды, то образец отвечает установленным требованиям;
b) для исследований острой токсичности не в соответствии с требованиями фармакопеи.
Допускается проводить исследования с использованием других методов, включая клиническую и
анатомическую патологии, по результатам которых можно исключить повторные испытания. При исследовании острой токсичности могут быть выявлены неоднозначные различия у животных в контрольных группах. Выявленные различия должны быть объяснены, а исследование следует продлить с включением пяти животных дополнительно, если применимо.
5.3.2 Оценка результатов
Результаты исследования острой токсичности сопоставляют с результатами предшествующих исследований (при наличии) и оценивают наличие токсических эффектов и признаков при общем вскрытии. если таковые выявлены. Оценка должна включать в себя определение взаимосвязи между дозой исследуемого образца и наличием или отсутствием, а также распространенностью и степенью серьезности различных отклонений, включая поведенческие и клинические отклонения, макроскопические повреждения, изменения массы тела, влияние на смертность и любые другие общие или конкретные негативные признаки.
5.4 Отчет об исследовании острой токсичности
В отчет об исследовании острой токсичности следует включить следующую информацию:
a) сведения об испытательной лаборатории и исследовании, обоснование выбора плана исследования;
b) сведения об исследуемом образце, включая:
- физические характеристики, чистоту и физико-химические свойства, по применимости.
- другие идентифицирующие данные;
c) сведения о экстрагирующей/модельной среде (если применимо), включая:
- обоснование выбора экстрагирующей/модельной среды, если она не включена в перечень, приведенный в ISO 10993-12;
d) сведения о лабораторных животных, включая:
- используемый вид/линию,
- количество, возраст и пол животных.
- источник, включая микробиологический статус (например, с повышенным барьером, обычный), условия содержания (температура, влажность, подстилка, освещение, диета и т. д.).
- массу животного в начале исследования;
e) сведения об условиях исследования, включая:
- обоснование выбора дозы.
- подробности состава/приготовления исследуемого образца, полученные концентрации, стабильность и гомогенность, если применимо,
- подробное описание введения исследуемого образца.
- пересчет из концентрации исследуемого образца (ppm или 1 * 10"^) в реально вводимую дозу (мг/кг массы тела), если применимо,
- описание качества пищи, воды и подстилки;
0 результаты исследования, включая:
- данные, представленные в форме таблицы, в которой приведены число животных в начале исследования. количество животных, проявляющих негативные признаки, и количество животных с изменениями массы тела для каждой контрольной и исследуемой группы,
- массу тела/изменения массы тела животных,
- потребление пищи и воды животными, если применимо.
- данные доза-ответ, распределенные по полу и уровню дозы, включая негативные признаки,
- характер, серьезность и длительность клинических наблюдений (обратимых и необратимых).
- нейроповеденческую оценку, если применимо,
- данные гематологического исследования с соответствующими контрольными данными, если применимо,
- данные клинического биохимического исследования крови с соответствующими контрольными данными, если применимо.
- данные анализов мочи и результаты с соответствующими контрольными данными, если применимо.
- массу тела животного после окончания исследования и данные массы органов, если применимо.
- результаты вскрытия.
- подробное описание всех признаков, выявленных при гистопатологическом исследовании, если применимо,
- статистическую оценку результатов, если использовалась, и обоснование их биологической значимости;
д) описание результатов;
h) заключения;
i) заявление о гарантии качества.
При исследовании острой токсичности получают информацию об эффектах острого воздействия образца. Следует учитывать, что экстраполяция результатов исследования на человека действительна в ограниченной степени. По результатам исследования получают информацию о допустимом воздействии материала/МИ на организм человека.
6 Исследование общей токсичности при многократном воздействии (подострая, субхроническая и хроническая токсичность)
6.1 Общие положения
Острая токсичность связана с неблагоприятными эффектами однократных доз (или ограниченного воздействия). Более распространенной формой воздействия материалов/МИ на человека является повторяющееся или продолжительное их воздействие. Эффект от повторяющегося или многократного воздействия потенциально может возникнуть по причине накопления химических веществ в тканях или под воздействием других механизмов, поэтому следует определить все потенциальные факторы путем проведения долгосрочных исследований (подострой, субхронической и хронической токсичности).
По результатам исследования общей токсичности при многократном введении получают информацию об опасности для здоровья человека, которая может возникнуть после длительного воздействия материалом/МИ при его клиническом применении. Также можно получить информацию о способе токсического действия материала/МИ при предназначенном клиническом пути введения.
При исследовании общей токсичности повторяющегося воздействия (многократного введения) получают информацию о токсических эффектах, органах-мишенях, обратимости эффектов воздействия или других эффектах, которую можно использовать в качестве основы для оценки безопасности МИ. Важность информации, полученной по результатам таких исследований, подтверждается наличием подробных инструкций по проведению клинических и анатомических исследований патологии.
В исследованиях при многократном введении образцов, как правило, не проводят повторных испытаний. Рекомендуется рассчитывать количество животных в группах с учетом статистической оценки зафиксированных наблюдений (см. таблицу 1).
В связи с различной продолжительностью исследований многократного введения исследуемые образцы следует готовить по мере необходимости для обеспечения их стабильности.
6.2 Планирование исследования
6.2.1 Подготовка животных
Здоровые молодые половозрелые животные должны быть акклиматизированы к лабораторным условиям как минимум в течение 5 сут до исследования. Животные должны быть рандомизированы и распределены по экспериментальным группам.
6.2.2 Лабораторные животные
6.2.2.1 Выбор вида
Используют, как правило, грызунов (крыс, мышей). Характеристики модели (возраст, масса и т. д.) приведены в 4.2 и 4.3. Использование животных, не являющихся грызунами, должно быть обосновано.
6.2.2.2 Количество и пол животных
Количество и тип групп, число животных в группе и их пол приведены в 4.5. Рекомендуется использовать дополнительную группу животных с увеличенной дозой введения, наряду с дополнительными контрольными группами на заранее обозначенный период времени после эвтаназии основной группы. Данную дополнительную группу и ее контроль используют для изучения эффекта введения, включая восстановительный период, устойчивость к воздействию или замедленное проявление негативных признаков. Для субхронических исследований необходимо содержать дополнительную группу животных сроком не менее чем 28 сут.
6.2.2.3 Условия размещения и кормления
Температура и относительная влажность в помещениях для экспериментальных животных должны соответствовать их виду, например, температура (22 ±3) "Си влажность от 30 % до 70 % для крыс. Режим искусственного освещения, как правило, — 12 ч освещения и 12 ч темноты.
Для кормления животных допускается использовать стандартные коммерческие лабораторные корма, при этом следует обеспечить животным неограниченный доступ к питьевой воде. Животных следует размещать в клетках группами по полу или индивидуально с обоснованием необходимости. При групповом размещении допустимо помещать не более пяти животных в одну клетку.
6.2.3 Условия исследования
6.2.3.1 Уровни доз
Используемую дозу при исследовании токсичности МИ следует определять в соответствии с результатами оценки риска, уравновешивая дозу клинического введения с использованием факторов безопасности по применимости. Для более длительных исследований следует применять не менее трех уровней дозы и соответствующие контрольные группы животных. За исключением процедуры введения исследуемого образца обращение с животными контрольной группы должно быть идентично обращению с животными исследуемой группы.
В отличие от классических исследований общей токсичности химических веществ при многократном введении, в исследованиях при многократном воздействии с использованием МИ, как правило, не получают эффект доза-ответ, поэтому выявление токсического эффекта при наивысшем уровне дозы не требуется.
6.2.3.2 Процедура
Животным вводят дозу образца ежедневно в течение недели на весь период исследования. Для более длительных исследований многократного воздействия допускается вводить дозы в течение пяти суток в неделю, при этом данную информацию следует задокументировать с соответствующим обоснованием.
6.2.4 Масса тела
Массу тела животного измеряют непосредственно перед расчетом дозы, еженедельно после первой дозы, если это позволяет длительность исследования, и по окончании исследования.
6.2.5 Клинические наблюдения
Период наблюдения в исследовании общей токсичности при многократном воздействии доз должен соответствовать длительности исследования. Частота и тип наблюдений установлены в 4.10 и приложении С. Наблюдение следует проводить с достаточной частотой, при этом выполняют определенные
действия, обеспечивающие минимальные потери среди исследуемых животных, например, вскрытие или заморозка животных, найденных мертвыми, и изоляция или эвтаназия слабых или болезненных животных. Визуальные наблюдения должны включать в себя следующие признаки, но не ограничиваться таковыми: изменения кожи и шерсти, глаз и слизистых оболочек, изменения в вегетативной и центральной нервных системах, дыхательной и кровеносной системах, в соматомоторной деятельности и в схемах поведения, которые идентифицируют в соответствии с приложением С.
Как правило, перед введением исследуемого образца и по окончании исследования необходимо провести офтальмологический осмотр с использованием офтальмоскопа или эквивалентного приемлемого оборудования, предпочтительно для всех животных, но как минимум, животных групп высокой дозы и контроля. При обнаружении изменений в глазах следует осмотреть всех животных. Решение не проводить осмотр должно быть задокументировано с соответствующим обоснованием.
6.2.6 Патология
6.2.6.1 Клиническая патология
Проводят следующие исследования:
a) гематологию, см. приложение D. проводят по окончании периода исследования. В зависимости от длительности исследования необходимо выполнять более частый забор образцов крови;
b) биохимическое исследование крови проводят по окончании периода исследования. В зависимости от длительности исследования необходимо выполнять более частый забор образцов. Объектами исследования являются электролитный баланс, метаболизм углеводов и функция печени и почек. Выбор конкретных объектов исследования зависит от наблюдений за характером действия образца. Список рекомендуемых анализов приведен в приложении D. При необходимости допускается дополнительно провести клиническое биохимическое исследование крови для продления наблюдения за отмеченными негативными признаками.
Анализ мочи (см. приложение D) на регулярной основе необязателен и его следует проводить только при показаниях, основанных на ожидаемой или наблюдаемой токсичности.
Полученные ранее нормальные значения пригодны для установления базовых уровней и для сравнения со значениями, полученными в контрольных группах животных. Если ранее полученные значения признаны неадекватными, то необходимо осуществить сбор соответствующей информации для животных того же возраста, пола, линии и источника, предпочтительно в той же лаборатории.
6.2.6.2 Патологоанатомические исследования
Всех животных подвергают полному общему вскрытию, включающему в себя осмотр внешних покровов тела, всех отверстий, а также черепной коробки, грудной и брюшной полостей и их содержимого. Надпочечники, мозг, эпидидимисы, сердце, почки, печень, яичники, селезенка, семенники, тимус и матка должны быть взвешены во влажном состоянии как можно скорее после вскрытия во избежание высыхания и получения ложно низких значений. Органы и ткани, перечисленные в приложении Е. следует сохранять в приемлемой среде для будущего гистопатологического анализа.
6.2.6.3 Гистопатологические исследования:
a) проводят полную гистопатологию на органах и тканях животных контрольной группы и группы высокой дозы:
b) осматривают все макроскопические повреждения;
c) у животных в группах с низкой и средней дозами, если таковые использовались, проводят ги-стопатологическое исследование легких на наличие инфекции, так как это позволяет легко оценить состояние здоровья животных. Также, у данных животных проводят гистопатологические исследования печени и почек. Дальнейшее гистопатологическое исследование животных этих групп допускается не проводить. Гистопатологическое исследование проводят обязательно на животных группы высокой дозы, у которых выявлены органы с макроскопическими повреждениями;
d) при наличии дополнительной группы животных гистопатологию проводят на их тканях и органах. в которых выявлены проявившиеся ранее токсические эффекты;
e) в исследованиях хронической токсичности необходимо использовать животных-индикаторов для контроля возможного наличия инфекционных агентов. По показаниям допускается проводить серологические или гистологические исследования этих животных;
0 при выборе органов для гистопатологии следует учитывать химические характеристики МИ. Например. если МИ покрыто лекарствами/фармацевтическими агентами, то у животных, подвергавшихся их воздействию, необходимо исследовать органы — мишени этих химических веществ на предмет каких-либо неблагоприятных эффектов.
6.3 Критерии оценки
6.3.1 Общие положения
Результаты исследования обобщают и представляют в форме таблицы, в которой для каждой исследуемой группы указывают количество животных в начале испытания, количество животных, проявляющих макроскопические повреждения, типы повреждений и процент животных, проявляющий повреждения каждого типа. Проводят статистическую оценку с учетом биологической значимости МИ. Допускается использовать любые общепринятые статистические методы, которые выбирают при планировании исследования.
6.3.2 Оценка результатов
Результаты исследования многократного воздействия оценивают совместно с результатами предыдущих исследований и анализируют токсические эффекты и выявленные отклонения при вскрытии и гистопатологии. Оценивают взаимосвязь между дозой исследуемого вещества и наблюдаемыми эффектами. Оценивают биологическую значимость наблюдаемых эффектов, включая поведенческие и клинические отклонения, макроскопические повреждения, микроскопические изменения, влияние на смертность и любые другие эффекты. При оценке наблюдаемых эффектов учитывают их значимость для человека.
6.4 Отчет об исследовании общей токсичности при многократном воздействии
В отчете об исследовании общей токсичности при многократном воздействии приводят информацию в соответствии с 5.4 и следующую дополнительную информацию:
- данные гематологических исследований с соответствующими контрольными данными;
- данные клинического биохимического исследования крови с соответствующими контрольными данными:
- результаты гистопатологии;
- статистическую оценку результатов, если использовалась, и обоснование их биологической значимости.
По результатам исследования общей токсичности получают информацию об эффектах долгосрочного многократного воздействия на организм животного исследуемого образца. Следует учитывать, что экстраполяция результатов исследования на человека действительна в ограниченной степени. По результатам исследования получают информацию о допустимом воздействии материала/МИ на организм человека.
Приложение А (справочное)
Пути введения материалов/медицинских изделий
А.1 Общие положения
Некоторые пути введения материалов/МИ приведены в А.2—А. 10. Допускается применять другие пути введения материала/МИ. Необходимо использовать наиболее подходящий путь введения материала/МИ. Использование альтернативного пути введения должно быть обосновано. При планировании исследований рекомендуется консультация эксперта.
А.2 Дермальный путь введения
При исследовании общей токсичности МИ наружного применения используют дермальный путь введения образцов. Следует ограничить доступ животных к исследуемому образцу.
А.З Имплантация
Исследование общей токсичности имплантируемых МИ осуществляют путем имплантации образцов. Исследование проводят путем имплантации материала в любое или в конкретное место. При этом следует учитывать форму и структуру исследуемого образца. Методы имплантации установлены в ISO 10993-6.
А.4 Ингаляция
Исследование общей токсичности МИ. контактирующих со средой, благоприятной для образования паров летучих химических веществ, или в виде аэрозоля/частиц с ингаляционным потенциалом, осуществляют путем ингаляции. Рекомендации по применению данного пути введения МИ приведены в документах по ингаляционной токсикологии.
А.5 Внутрикожныи путь введения
При исследовании общей токсичности МИ. контактирующих с внутрикожной средой, благоприятной для выщелачивания химических веществ, используют внутрикожный путь введения образцов. Исследуемые образцы вводят непосредственно во внутрикожную область путем иньекции. Использование нескольких участков введения образца должно быть четко описано и обосновано.
А.6 Внутримышечный путь введения
При исследовании общей токсичности МИ. контактирующих с мышечной тканью, способствующей выщелачиванию химических веществ, используют внутримышечный путь введения образцов. Исследуемые образцы вводят непосредственно внутримышечно путем иньекции или имплантации. Участки введения следует выбирать с учетом сведения к минимуму потери функции или боли животному по причине повреждения нерва, вызванного напряжением мышечного волокна инъекцией или имплантацией исследуемого образца. При исследованиях повторной дозы участки введения образцов необходимо чередовать, так как. например, твердые соединения могут образовывать накопления в течение более 24 ч. Использование нескольких участков введения образцов должно быть четко описано и обосновано.
А.7 Внутрибрюшинный путь введения
При исследовании общей токсичности МИ. контактирующих с потоком жидкости или брюшной полостью, способствующих выщелачиванию химических веществ, используют внутрибрюшинный путь введения образцов. Данный путь введения материала/МИ применяют, если экстракт не подлежит введению внутривенно, например, при использовании вытяжки неполярных масел или возможном наличии частиц. Такой путь введения предпочтителен внутривенной иньекции. при которой необходима фильтрация образца. Исследуемые образцы, как правило, вводят непосредственно в брюшную полость. При вычислении частоты дозы необходимо учитывать, что образцы, вводимые этим путем, абсорбируются, как правило, системой кровообращения брюшных органов (системой портального кровообращения) и. таким образом, до поступления в общее кровообращение, проходят через печень. Следует исключить иньекции образцов в желудок или в кишечник
А.8 Внутривенный путь введения
При исследовании общей токсичности материалов/МИ, прямо или опосредованно контактирующих с потоком жидкости или кровью, способствующих выщелачиванию химических веществ, используют внутривенный путь введения образцов. Исследуемые образцы помещают или непосредственно вводят в сосудистую систему При наличии в образце частиц необходимо использовать внутрибрюшинный путь введения или выполнить фильтрацию образца. Для оценки наноматериалов при внутривенном введении рекомендуется использовать исследуемые образцы в форме суспензии. Рекомендуемые объемы доз и скорость внутривенного введения при исследованиях на наиболее часто используемых видах лабораторных животных приведены в приложении В.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
©ISO. 2017 © Оформление. ФГБУ «РСТ», 2021
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Следует исключить излишнее введение в сосудистое русло исследуемого образца Для инъекций длительностью введения более 5 мин необходимо использовать иглы «бабочка» или внутривенные катетеры (канюли).
А.9 Пероральный путь введения
При исследовании общей токсичности МИ. прямо или опосредованно контактирующих со слизистой ротовой полости, или другого энтерального применения используют пероральный путь введения образцов. Исследуемые образцы вводят через зонд. До введения исследуемого образца экспериментальные животные, как правило, должны голодать. Продолжительность периода голодания может быть от нескольких часов до одной ночи, для животных с высокой скоростью метаболизма рекомендуется применять более короткие периоды голодания. После периода голодания животное взвешивают, затем исследуемый образец вводят однократной дозой, основываясь на массе тела животного. После введения исследуемого образца прием пищи может быть отложен на 3—4 ч. При введении дозы долями в течение определенного периода времени необходимо предоставлять животным пищу и воду в зависимости от длительности периода введения.
А.10 Подкожный путь введения
При исследовании общей токсичности МИ. контактирующих с подкожной средой, благоприятной для выщелачивания химических веществ, используют подкожный путь введения образцов Исследуемые образцы вводят непосредственно в подкожную область путем иньекции или имплантации. Использование нескольких участков введения образца должно быть обосновано и задокументировано.
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения...............................................................1
4 Основные требования.................................................................2
4.1 Общие положения................................................................2
4.2 Выбор вида животных.............................................................3
4.3 Состояние животных..............................................................3
4.4 Уход и содержание животных.......................................................3
4.5 Количество животных и число групп..................................................3
4.6 Способ воздействия (путь введения).................................................4
4.7 Подготовка образцов..............................................................4
4.8 Дозирование.....................................................................4
4.9 Масса тела и потребление пищи/воды................................................5
4.10 Клинические наблюдения..........................................................5
4.11 Клиническая патология............................................................6
4.12 Патологоанатомические исследования..............................................6
4.13 Планирование исследований......................................................7
4.14 Качество исследований...........................................................7
5 Исследование острой токсичности.......................................................7
5.1 Общие положения................................................................7
5.2 Планирование исследования........................................................7
5.3 Критерии оценки..................................................................9
5.4 Отчет об исследовании острой токсичности...........................................9
6 Исследование общей токсичности при многократном воздействии (подострая, субхроническая
и хроническая токсичность)...........................................................10
6.1 Общие положения...............................................................10
6.2 Планирование исследования.......................................................11
6.3 Критерии оценки.................................................................13
6.4 Отчет об исследовании общей токсичности при многократном воздействии................13
Приложение А (справочное) Пути введения материаловУмедицинских изделий..................14
Приложение В (справочное) Руководство по объему дозирования исследуемых образцов.........16
Приложение С (справочное) Распространенные клинические наблюдения и негативные признаки .. 17 Приложение D (справочное) Рекомендуемые показатели гематологии, биохимии и анализа мочи... 18 Приложение Е (справочное) Рекомендуемый перечень органов/тканей для гистопатологического
исследования............................................................19
Приложение F (справочное) Перечень органов для сокращенного гистопатологического анализа
при исследовании медицинских изделий на общую токсичность...................20
Приложение G (справочное) Пирогенность, опосредованная материалом.......................21
Приложение Н (справочное) Экспериментальная модель на крысе для исследования субхронической токсичности — два пути парентерального введения......................22
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
межгосударственным стандартам..........................................24
Библиография........................................................................25
Введение
ISO (Международная организация по стандартизации) является федерацией национальных органов по стандартизации (органов — членов ISO). Работу по подготовке международных стандартов проводят через технические комитеты ISO. Каждая организация-член, заинтересованная в области деятельности, для которой создан технический комитет, имеет право быть представленной в данном комитете. Международные правительственные и неправительственные организации также принимают участие в работе ISO. ISO сотрудничает с Международной электротехнической комиссией (IEC) по вопросам стандартизации электротехнической продукции.
Процедуры, примененные при разработке настоящего стандарта, а также процедуры, предназначенные для его дальнейшей поддержки, приведены в Директиве ISO/IEC, Часть 1. В частности, следует отметить необходимость различных критериев утверждения для различных типов документов ISO. Настоящий стандарт подготовлен в соответствии с редакционными правилами Директив ISO/IEC. Часть 2 (www.iso.org/direclives).
Следует отметить, что некоторые элементы настоящего стандарта могут быть объектом патентных прав. ISO не несет ответственности за обеспечение таких патентных прав. Сведения о патентных правах при разработке настоящего стандарта будут указаны во Введении и/или в перечне полученных патентных деклараций ISO (см. www.iso.org/patents).
Любая торговая марка, упомянутая в настоящем стандарте, является информацией, приведенной для удобства пользования настоящим стандартом, и не является рекламой.
Для разъяснения добровольного характера применения стандартов, значений конкретных терминов ISO и выражений, относящихся к оценке соответствия, а также информации о соблюдении ISO принципов Всемирной торговой организации (ВТО) по техническим барьерам в торговле (ТВТ) см. следующий URL: www.iso.org/iso/foreword.html.
Международный стандарт разработан Техническим комитетом ISO/TC 194 «Биологическая и клиническая оценка медицинских изделий».
Настоящий стандарт представляет собой третье пересмотренное издание, которое отменяет и заменяет второе издание ISO 10993-11:2006, и содержит следующие изменения:
a) сокращены размеры групп животных для исследования хронической токсичности в таблице 1;
b) добавлено новое приложение F. в котором приведен перечень органов для сокращенного ги-стопатологического анализа при исследовании медицинских изделий на общую токсичность;
c) текст приложения F, приведенный в предыдущей версии международного стандарта, перенесен в приложение G;
d) добавлено новое приложение Н с описанием экспериментальной модели на крысе для исследования субхронической токсичности;
e) актуализирована библиография.
Перечень всех стандартов серии ISO 10993 приведен на сайте ISO.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Изделия медицинские ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 11 Исследования общетоксического действия
Medical devices. Biological evaluation of medical devices. Part 11. Tests for systemic toxicity
Дата введения — 2022—03—01
1 Область применения
Настоящий стандарт распространяется на медицинские изделия (МИ) и материалы, применяемые для их изготовления, и устанавливает требования к процедурам оценки потенциального общетоксического действия (общей токсичности).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных — последнее издание (включая все изменения к нему)]:
ISO 10993-1, Biological evaluation of medical devices — Part 1: Evaluation and testing within a risk management process (Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска)
ISO 10993-2. Biological evaluation of medical devices — Part 2: Animal welfare requirements (Оценка биологического действия медицинских изделий. Часть 2. Требования к обращению с животными)
3 Термины и определения
В настоящем стандарте применены термины по ISO 10993-1, а также следующие термины с соответствующими определениями.
ISO и IEC ведут терминологические базы данных для использования в стандартизации по следующим ссылкам:
- Электропедия IEC: http://www.electropedia.org/;
- онлайн-платформа ISO: http://www.iso.org/obp.
3.1 доза (дозировка) (dose, dosage): Количество вводимого исследуемого образца (т. е. масса, объем), выражаемое отношением к единице массы тела или площади поверхности.
3.2 доза-эффект (dose-effect): Взаимоотношение между дозировкой и масштабами определенного биологического эффекта в организме отдельной особи или в выборке группы.
3.3 доза-ответ (dose-response): Взаимоотношение между дозировкой и спектром эффектов, связанных с воздействием.
Примечание — Существует два типа отношений доза-ответ. Первым типом является реакция особи на диапазон доз. Вторым типом является распределение реакций группы особей на диапазон доз.
Издание официальное
3.4 выщелачиваемое вещество (leachable substance): Химическое вещество, удаляемое из изделия или материала посредством воды или других жидкостей, связанных с применением МИ.
Примечание — Примерами выщелачиваемых веществ являются добавки, остатки стерилизующего агента, остатки продуктов обработки, продукты деградации, растворители, пластификаторы, смазочные вещества, катализаторы, стабилизаторы, антиоксиданты, красители, наполнители и мономеры.
3.5 определяющая доза (limit test): Исследование на одной группе, получающей соответствующую дозу исследуемого образца, для определения наличия или отсутствия токсической опасности.
3.6 общая токсичность (systemic toxicity): Токсичность, не ограничивающаяся неблагоприятными эффектами в месте контакта МИ и организма.
Примечание — В исследованиях общей токсичности требуется определить абсорбцию и распределение токсиканта от его точки введения до отдаленных областей организма, в которых происходит вредное воздействие.
3.7 острая токсичность (acute systemic toxicity): Неблагоприятный эффект, возникающий в любое время в течение 72 ч после однократного, многократного или продолжительного воздействия исследуемого образца в течение 24 ч.
3.8 подострая токсичность (subacute systemic toxicity): Неблагоприятный эффект, возникающий после многократного или продолжительного воздействия исследуемого образца в период от 24 ч до 28 сут.
Примечание — Так как данный термин семантически неверен, неблагоприятный эффект, возникающий в указанный период времени, может также быть описан как исследование общей токсичности краткосрочного повторяющегося воздействия. Выбранный интервал времени от 14 до 28 сут соответствует требованиям большинства международных нормативных руководств, и его считают оптимальным. При исследованиях подострой токсичности с применением внутривенного введения, как правило, введение исследуемого образца выполняют длительностью более 24 ч, но менее 14 сут.
3.9 субхроническая токсичность (subchronic systemic toxicity): Неблагоприятный эффект, возникающий после повторяющегося или продолжительного введения исследуемого образца в течение части общей продолжительности жизни.
Примечание — Исследования субхронической токсичности на грызунах, как правило, длятся 90 сут. но не более 10 % продолжительности жизни на животных других видов. При внутривенном введении образца, как правило, исследования субхронической токсичности проводят длительностью от 14 до 28 сут для грызунов и не грызунов, соответственно
3.10 хроническая токсичность (chronic systemic toxicity): Неблагоприятный эффект, возникающий после повторяющегося или продолжительного введения исследуемого образца в течение большей части жизни.
Примечание — Исследования хронической токсичности, как правило, длятся от 6 до 12 мес.
3.11 исследуемый образец (test sample): Материал. МИ. Часть МИ, компонент, экстракт или его порция, подвергаемые биологическому или химическому исследованию или оценке.
4 Основные требования
4.1 Общие положения
При принятии решения о проведении исследований общей токсичности МИ следует руководствоваться ISO 10993-1. Решение о проведении исследований должно быть обосновано оценкой риска общей токсичности. Выбор приемлемого исследования или исследований для МИ выполняют в соответствии с ISO 10993-1 с учетом характера и длительности контакта.
Исследование проводят на конечном продукте и/или репрезентативных образцах компонентов готового МИ и/или материалов. Для исследования отбирают образцы, являющиеся представителями серийно выпускаемой продукции. Если в образцы требуется внести изменения, то соответствующие данные указывают в отчете об исследовании вместе с обоснованием. В целях получения точных результатов исследования при определении опасности материала/МИ необходимо установить преувеличенное воздействие исследуемых образцов.
При планировании исследования необходимо рассмотреть такие факторы, как физические и химические свойства исследуемого образца, включая pH, стабильность, вязкость, осмоляльность, буферные качества, растворимость и стерильность.
При принятии решения о проведении исследований на животных необходимо определить и применить все возможные варианты их замены в соответствии с ISO 10993-2. При исследовании острой токсичности методами in vivo для определения начальных доз используют данные цитотоксичности, полученные методами in vitro (9).
4.2 Выбор вида животных
Абсолютный критерий выбора определенного вида животных для исследования общей токсичности МИ отсутствует. Выбор видов животных должен быть научно обоснован и соответствовать ISO 10993-2. Рекомендуется применять грызунов (мыши или крысы) для острых пероральных, внутривенных, дермальных и ингаляционных исследований МИ; кроликов (зайцеобразные) — для дермальных и имплантационных исследований. Виды животных, не относящихся к грызунам, используют для исследования при наличии факторов, влияющих на число особей для исследования.
Рекомендуется использовать животных одного вида и линии при проведении серии исследований общей токсичности различной длительности, например, острой, подострой, субхронической и/или хронической токсичности. При таком подходе контролируют межвидовую и межштаммовую изменчивость и обеспечивают оценку токсичности на протяжении всего исследования. При использовании животных разных видов или линий необходимо задокументировать обоснование их выбора.
4.3 Состояние животных
Для исследования следует использовать здоровых, специально выведенных, молодых половозрелых животных известного происхождения, не инфицированных. В начале исследования вариантность массы животных для каждого пола не должна превышать ±20 % средней массы. Выбирают не рожавших и не беременных самок. Выбор животных необходимо обосновать.
4.4 Уход и содержание животных
Уход и обращение с животными должны соответствовать установленным требованиям к содержанию животных. Необходимо акклиматизировать животных к условиям лаборатории до начала исследования и зафиксировать этот период времени документально. Следует осуществлять контроль условий окружающей среды и методов надлежащего ухода за животными для получения значимых результатов исследования. Необходимо должным образом охарактеризовать составляющие диеты и подстилки, которые вызывают токсичность или влияют на нее. а также учитывать их потенциальное влияние на результаты исследования.
4.5 Количество животных и число групп
4.5.1 Количество животных
Точность результатов исследования общей токсичности материала/МИ зависит от количества используемых животных на каждую дозу. Степень необходимой точности результатов и число животных в каждой группе устанавливают в зависимости от цели исследования.
Исходное количество животных в группе увеличивают при продлении времени исследования так, чтобы к концу исследования в каждой группе было достаточное число животных для тщательной биологической оценки. При этом следует использовать минимальное количество животных, требуемое для получения значимых результатов (см. ISO 10993-2). Рекомендуемые минимальные размеры групп с учетом путей введения исследуемых образцов приведены в таблице 1.
|
Таблица 1 — Рекомендуемые минимальные размеры групп с учетом путей введения исследуемых образцов | |||||||||||||||
|
Окончание таблицы 1
а Допускается проводить исследование на особях одного попа. Если МИ предназначено для эксплуатации только одним полом, то исследование следует проводить на животных данного пола.
ь Рекомендация для грызунов относится к исследованию группы уровня одной дозы. При включении дополнительных групп с увеличенными дозами рекомендуемый размер группы животных может быть снижен до 10 особей для каждого пола.
с Рекомендуется консультация эксперта по размеру группы не грызунов с учетом статистической достоверности результатов исследования. Количество животных должно быть сведено к минимуму, необходимому для получения значимых данных. После окончания исследования должно оставаться достаточное количество животных для обеспечения надлежащей статистической оценки результатов.
4.5.2 Число групп животных
На группе животных одной дозы, получающих приемлемую дозировку исследуемого образца, в рамках одного вида определяют наличие или отсутствие токсической опасности (т. е. определяющая доза). Для определения токсического ответа в исследованиях с применением множества доз или исследованиях доза-ответ требуется несколько групп животных.
Число групп животных допускается увеличивать, если планируют охарактеризовать показатель доза-ответ с использованием повышающих доз. Рекомендуемые методы повышения дозы:
- многократное воздействие с учетом площади поверхности МИ при клиническом применении;
- многократное и длительное воздействия;
- многократная доля экстракта или отдельных химических веществ;
- многократные введения в течение 24 ч.
Допускается применять другие методы повышения дозы. Используемый метод повышения дозы должен быть обоснован.
4.5.3 Контрольные группы животных
В зависимости от цели исследования, характеристик материала/МИ и пути воздействия применяют отрицательный контроль, контроль экстрагирующего раствора (модельной среды) и/или группу животных без введения исследуемого образца (ложный контроль). В этих контрольных группах необходимо выполнить идентичную подготовку исследуемого образца и процедуру введения.
4.6 Способ воздействия (путь введения)
МИ или их выщелачиваемые вещества могут поступать в организм различными путями. Исследуемый путь введения, по возможности, должен быть наиболее приближен к использованию МИ в клинической практике. Если необходим альтернативный способ воздействия, то его следует обосновать. Примеры путей введения материала/МИ приведены в приложении А.
4.7 Подготовка образцов
Подготовку образцов выполняют в соответствии с ISO 10993-12.
4.8 Дозирование
4.8.1 Введение исследуемого образца
Процедуры введения материала/МИ следует планировать с учетом физиологических особенностей животных, избегая нанесения ущерба их здоровью, не связанных напрямую с токсичностью исследуемого образца. Если ежедневно вводимая доза достаточного объема или концентрации невозможна, то дозу можно вводить многократными долями в период времени, не превышающий 24 ч.
Исследуемые образцы следует вводить при физиологически приемлемой температуре. В общей практике, как правило, образцы вводят при комнатной температуре или температуре тела животного. Отклонения должны быть обоснованы.
Экстрагирующие растворы/модельные среды, вводимые парэнтерально. должны быть физиологически совместимыми. Допускается выполнить фильтрацию исследуемого образца для удаления частиц. при этом данную информацию необходимо задокументировать. При оценке МИ. содержащих наноматериалы. и/или в форме наноматериалов фильтрацию образца не выполняют (см. ISO/TR 10993-22).
Продолжительность механической фиксации животных при многократном введении образца в исследованиях общей токсичности, как правило, должна быть не более 4—6 ч в сутки. Характер и длительность ограничения двигательной активности животных должны быть минимальными для достижения целей исследования и не наносить ущерб здоровью животных. Отклонения следует обосновать.