ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
(Щ>
НАЦИОНАЛЬНЫ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
СОЛЬ ПОВАРЕННАЯ ПИЩЕВАЯРасчетный метод определения основного вещества по солевому составу
Издание официальное
Москва
Стандартинформ
2013
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 РАЗРАБОТАН Закрытым акционерным обществом «Всероссийский научно-исследовательский институт Галургии» (ЗАО «ВНИИ Галургии»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК154 «Пищевые добавки и ароматизаторы»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 13 декабря 2011 г. №938-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ, 2013
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Редактор Л.В. Коретникова Технический редактор Н.С. Гоишанова Корректор И.А. Королева Компьютерная верстка А.Н. Золотаревой
Сдано в набор 16.01.2013. Подписано в печать 23.01.2013. Формат 60 х 84^. Гарнитура Ариал. Уел. печ. л. 1,40. Уч.-изд. л. 0,70. Тираж 188 экз. Зак. 75.
ФГУП «СТАНДАРТИНФОРМ», 123995 Москва, Гранатный пер., 4. www.gostinfo.ru info@gostinfo.ru
Набрано во ФГУП «СТАНДАРТИНФОРМ» на ПЭВМ.
Отпечатано в филиале ФГУП «СТАНДАРТИНФОРМ» — тип. «Московский печатник», 105062 Москва, Лялин пер., 6.
ГОСТ P 54751—2011
Содержание
1 Область применения...................................................1
2 Нормативные ссылки..................................................1
3 Сущность метода.....................................................1
4 Требования к квалификации оператора.......................................1
5 Определение массовой доли хлористого натрия.................................1
6 Проверка правильности результатов определения................................4
7 Метрологические характеристики...........................................4
Приложение А (справочное) Примеры расчетов...................................6
III
ГОСТ P 54751—2011
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СОЛЬ ПОВАРЕННАЯ ПИЩЕВАЯ Расчетный метод определения основного вещества по солевому составу
Food common salt. Calculation method for determination (measurement) of the principal substance by saline composition
Дата введения — 2013—01—01
1 Область применения
Настоящий стандарт распространяется на пищевую поваренную соль и устанавливает расчетный метод определения массовой доли основного вещества (хлористого натрия) в диапазоне определения от 97,0 % до 99,9 % по солевому составу.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р 51574-2000 Соль поваренная пищевая. Технические условия
ГОСТ Р 54345-2011 Соль поваренная пищевая. Определение массовой доли нерастворимого в воде остатка гравиметрическим методом
ГОСТ Р 54351-2011 Соль поваренная пищевая. Определение массовой доли хлор-иона мерку-риметрическим методом
ГОСТ Р 54352-2011 Соль поваренная пищевая. Определение массовой доли магний-иона и кальций-иона комплексонометрическим методом
ГОСТ Р 54353-2011 Соль поваренная пищевая. Определение массовой доли сульфат-иона гравиметрическим методом
ГОСТ Р 54730-2011 Соль поваренная пищевая. Определение массовой доли калий-иона пламенно-фотометрическим методом
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на первое января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Сущность метода
Метод основан на пересчете химического состава соли, измеренного в массовых долях ионов, в переводе их в определенной последовательности в солевой состав с последующим вычислением массовой доли хлористого натрия. Массовые доли ионов определяются в соответствии с ГОСТ Р 54345, ГОСТ Р 54351, ГОСТ Р 54352, ГОСТ Р 54353, ГОСТ Р 54730.
Издание официальное
4 Требования к квалификации оператора
К выполнению расчетов допускается специалист, имеющий высшее или среднее специальное химическое образование.
5 Определение массовой доли хлористого натрия
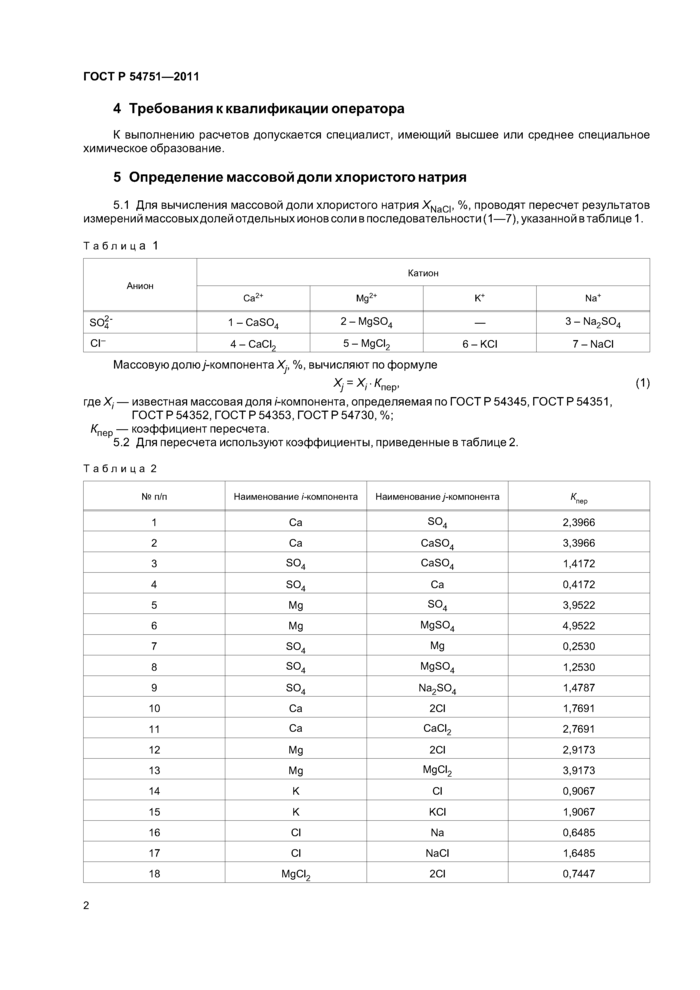
5.1 Для вычисления массовой доли хлористого натрия XNaC!, %, проводят пересчет результатов измерений массовыхдолей отдельных ионов соли в поеледовательности(1—7), указанной в таблице 1.
|
Таблица 1 |
|
Анион |
Катион |
|
Са2+ |
Мд2+ |
к+ |
Na+ |
|
sof |
1 - CaS04 |
2 - MgS04 |
— |
3 - Na2S04 |
|
СГ |
4 - СаС12 |
5 - МдС12 |
6-KCI |
7 - NaCI |
|
Массовую долю/-компонента Xj, %, вычисляют по формуле
Xj = Xj- Кпер, (1)
гдеХ, — известная массовая доля/-компонента, определяемая по ГОСТ Р 54345, ГОСТ Р 54351,
ГОСТ Р 54352, ГОСТ Р 54353, ГОСТ Р 54730, %;
/Спер — коэффициент пересчета.
5.2 Для пересчета используют коэффициенты, приведенные в таблице 2.
|
Таблица 2 |
|
№ п/п |
Наименование /-компонента |
Наименование /-компонента |
^ер |
|
1 |
Са |
со
О |
2,3966 |
|
2 |
Са |
CaS04 |
3,3966 |
|
3 |
со
О |
CaS04 |
1,4172 |
|
4 |
со
о |
Са |
0,4172 |
|
5 |
Мд |
со
О |
3,9522 |
|
6 |
Мд |
MgS04 |
4,9522 |
|
7 |
со
О |
Мд |
0,2530 |
|
8 |
со
о |
MgS04 |
1,2530 |
|
9 |
со
о |
Na2S04 |
1,4787 |
|
10 |
Са |
2CI |
1,7691 |
|
11 |
Са |
CaOI2 |
2,7691 |
|
12 |
Мд |
2CI |
2,9173 |
|
13 |
Мд |
МдС12 |
3,9173 |
|
14 |
К |
CI |
0,9067 |
|
15 |
К |
KCI |
1,9067 |
|
16 |
CI |
Na |
0,6485 |
|
17 |
CI |
NaCI |
1,6485 |
|
18 |
МдС12 |
2CI |
0,7447 |
|
5.3 Схема расчетов массовой доли хлористого натрия в соли
В зависимости от содержания иона S042- в соли используют ту или иную схему расчета.
Все схемы расчетов начинаются с вычисления отношения массовых долей ионов сульфата и каль-
so|
Са2+ '
Примечание — Схема расчетов с целью упрощения приведена без обозначения массовой доли Хи единицы измерения %.
Схема I
Если—— >2,3966, то весь Са2+ связан cSO? в CaS04, а оставшиеся ионы SO? связываются
_ о. ’ ’ 4 4
Са
последовательно с Мд2+ в MgS04, и если SO^ хватает, то и с Na+ в Na2S04.
а) Вычисляют CaS04 в соли:
CaS04 = Са2+ • 3,3966.
б) Вычисляют SO^, связанные с Мд2+ и Na+
в) Находят S04 .связанный с Mg2+ 3
S04 (мд)= Мд2+ • 3,9522
и сравнивают с S04” (Мд, Na)-1 вариант схемы 1
ЕслиЭО^д Na) >304(Мд),товесьМд2+ввидеМд804,аоставшаясячасть804 связана в Na2S04.
а) Вычисляют MgS04 в соли:
MgS04 = Мд2+ • 4,9522;
S04(Na) = S04 - [°а2+ '2,3968 + м92+ • 3,9522].
б) Вычисляют Na2S04 в соли:
Na2S04 = S02-Na)-1,4787.
г) Вычисляют катион Na+
где С1“(к) = К+ • 0,011.
д) Вычисляют массовую долю
Na+ = (Cl- - С|-(к)) 0,6485,
NaCI = (С|--С|-(к)) 1,6485.
2 вариант схемы 1
ЕслиЭО^д N < SO^Mgj, то часть Мд2+ связана SO^ в MgS04, оставшаяся часть Мд2+
С1“ в MgCI2, Na2S04 в соли отсутствует.
а) Вычисляют Мд2+, связанных с S042- в MgS04:
Mg2+(S04) = [SO^ - Са2+ • 2,3966] • 0,2530;
MgS04 в соли
MgS04 = [SOj- - Са2+ • 2,3968] • 1,2531. б) Вычисляют С1“, связанных с Мд2+ в МдС12:
2С1-(Мд) = [Мд2+ - Mg2+(S04)] • 2,9173;
МдС12 в соли
МдС12 = [Мд2+ - (SOj~ - Са2+ • 2,3966) • 0,2530] • 3,9173.
в) Вычисляют С1“, связанных с К+ в KCI
С1"(К) = К+- 0,9067;
KCI в соли
КС1 = К+-1,9067.
г) Вычисляют С1“, связанных с Na+ в NaCI
Na+= Ch/Kiow 0,6485;
NaCI = [Cl" - C!-(Mg) - C|-(K)] • 1,6485.
: 2,3966, то все сульфаты связаны с Са2+ в CaS04, а оставшиеся ионы связаны с С1“ в
СаС12.
а) Вычисляют CaS04 в соли:
Вычисляют С1“(Са) — хлорид-ионов, связанных с Са2+:
С|“(Са) = [Са2+ - S04~ • 0.4172] • 1,7691.
Вычисляют СаС12 в соли:
CaCI2 = [Ca2+-S02“ -0,4172]-2,7691.
б) Вычисляют С1“-ионов, связанных с Мд2+:
2С1-(Мд) = Мд2+-2,9173.
Вычисляют МдС12 в соли:
МдС12 = Мд2+-3,9173.
в) Вычисляют С1“-ионов, связанных с К+
С1-(К) = К+ • 0,9067.
Вычисляют KCI в соли:
KCI = К+ -1,9067.
г) Вычисляют С1“, связанных с Na+:
CI“(Na) = [С1“(общ) “ С1"(Са) “ С1“(Мд) “ С1“(К)1-
Вычисляют NaCI в соли:
NaCI = [С1"(0бщ) - С1-(Са) - С1“(Мд) - С1“(К)] • 1,6485.
Схема III
sof
Если—^— = 2,3966, то все сульфаты связаны сСа2+ BCaS04 без остатка. Са2+
а) Вычисляют CaS04 в соли:
CaS04 = Са2+ • 3,3966 или CaS04 = S042" • 1,4172.
б) Вычисляют С1“, связанных с Мд2+
Вычисляют МдС12 в соли: в) Вычисляют С1“, связанных с К+ Вычисляют KCI в соли:
2С!-(Мд) = Мд2+• 2,9173. МдС12 = Мд2+-3,9165. С|-(К) = К+ • 0,9067.
г) Вычисляют NaCI в соли:
NaCI = [С1“(0бщ) - С1“(Мд) - С1“(К)] • 1,6485.
За результат определения массовой доли хлористого натрия принимают значение, вычисленное до четвертого десятичного знака и округленное до второго десятичного знака.
4
ГОСТ P 54751—2011
6 Проверка правильности результатов определения
Проверку проводят путем сравнения суммы массовых долей ионов Х>еионов и суммы массовых долей солей £Хсолей.
Полученные значения сумм округляют до первого десятичного знака.
Результат проверки признают удовлетворительным, если 2ХИ0Н0В =
7 Метрологические характеристики
Метрологические характеристики метода определений приведены в таблице 3.
|
Таблица 3 — Метрологические характеристики метода определений массовой доли хлористого натрия
В процентах |
|
Диапазон измерения массовой доли хлористого натрия XNaC| |
Показатель точности (границы абсолютной погрешности при Р = 0,95) + А |
|
От 97,0 до 99,9 включ. |
0,6 |
|
|
Примечание — Диапазоны и показатели точности измерения хлористого натрия соответствуют его нормируемым значениям по ГОСТ Р 51574. |
5
Приложение А (справочное)
Пример 1
При анализе пробы соли получены следующие результаты:
Массовая доля: нерастворимый остаток (Н.О.) = 0,21 %; Са2+ = 0,34%; Mg2+ = 0,02%; К+ = 0,011%; S04~ =
CaS04 = 0,34 ■ 3,3966 = 1,15%.
S04(Mg,Na) = 0,94 - 0.34 ■ 2,3966 = 0,125.
SO|(Mg) = 0,02 ■ 3,9522 = 0,079.
2— 2 —
SC>4(Mg,Na) >S04(Mg), поэтому рассчитываем
MgS04 = 0,02 ■ 4,9512 = 0,099 %.
Na2S04 = [0,125- 0,079] ■ 1,4787 = 0,07 %.
KCI = 0,011 -1,9067 = 0,021 %.
Na+ = (Cl-- C|-(K)) ■ 0,6485 = [59,54 -0,011- 0,9067] ■ 0,6485 = 38,61 %.
NaCI = (СГобщ - СГ(К)) ■ 1,6485 = [59,54 -0,011- 0,9067] ■ 1,6485 = 98,14 % = 98,1 %. Проверка:
ЕХионов = °.34 + °.°2 + °.011 + °-94 + 59,54 + 38.61 = ".46 % = ".5 %■
ЕХсолей = 1.15 + 0,099 + 0,07 + 0,021 + 98,14 = 99,48 % = 99,5 %.
ЕХИОНов =^солей’ результат проверки удовлетворительный.
Пример 2
При анализе пробы соли получены следующие результаты:
Массовая доля: И.О. = 0,76 %; Са2+ = 0,43 %; Мд2+ = 0,04 %; К+ = 0,87 %; S042“
= — = 2,4884 > 2,3968.
Са2 0,43
CaS04 = 0,43 ■ 3,3966 = 1,46 %.
S^4(Mg Na) = 1.07 — 0,43'2,3966 = 0,039.
SO2(мд) = 0,04 ■ 3,9522 = 0,158.
2— 2— 2 S04(Mg)>S04(Mg,Na). поэтому рассчитываем MgS04 исходя из содержания оставшегося S04
MgS04 = 0,04 ■ 1,2530 = 0,05 %.
Mg?* . = 0,04 - 0,2530 = 0,010. a(S04)
Mg?* =0,04-0,01 =0,03.
(U)
MgCI2 = 0,03 ■ 3,9173 = 0,12 %.
KCI = 0,87 -1,9067= 1,66%.
Na+ = (СГобщ - СГ(Мд) - Cr(K)) 0,6485 = [58,95 - 0,03 ■ 2,9173 - 0,87 ■ 0,9067] 0,6485 = 37,66 %. NaCI = [58,95 - 0,09 - 0,79] 1,6485 = 95,73 %.
Проверка:
ЕХионов = °.43 + °.°4 + °.87 + 1.07 + 58,95 + 37,66 = 99,02 % = 99,0 %.
ЕХсолей = 1.46 + 0,05 + 0,12 + 1,66 + 95,73 = 99,02 % = 99,0 %.
ЕХИОнов = 2ХСолей' результат проверки удовлетворительный.
УДК 664.41.001.4:006.354 ОКС 67.220.20 Н95 ОКП91 9203
91 9220 91 9230 91 9240
Ключевые слова: соль поваренная пищевая, расчетный метод, определение, массовая доля хлористого натрия, основное вещество
7