ГОСТ Р ИСО 14630-99
Неактивные хирургические имплантаты. Общие технические требования
Устанавливает общие требования к неактивным хирургическим имплантатам, требования к показателям назначения, особенностям конструкции, материалам, оценке конструкции, процессу изготовления, стерилизации, упаковке, испытаниям и информации, поставляемой изготовителем. Стандарт не распространяется на стоматологические имплантаты и восстановительные материалы, трансэндодонтические и трансрадикулярные имплантаты и внутриглазные (контактные) линзы.
Оглавление
1 Область расгiространения
2 Нормативные ссылки
3 Определения
4 Показатели назначения
5 Особенности конструкции
6 Материалы
7 Оценка конструкции
8 Изготовление
9 Стерилизация
10 Упаковка
11 Информация, предоставляемая изготовителем
Приложение А Перечень стандартов (действующих и находящихся в стадии разработки)
12 страниц
| Дата введения | 01.01.2001 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.03.2012 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 29.12.1999 | Утвержден | Госстандарт России | 850-ст |
|---|---|---|---|
| Разработан | ВНИИИМТ | ||
| Издан | ИПК Издательство стандартов | 2000 г. |
Non-active surgical implants. General technical requirements
ГОСТ Р 51536-99Системы качества. Изделия медицинские. Специальные требования по применению ГОСТ Р ИСО 9001-96. Заменен на ГОСТ Р ИСО 13485-2004.ГОСТ Р 51537-99Системы качества. Изделия медицинские. Специальные требования по применению ГОСТ Р ИСО 9002-96. Заменен на ГОСТ Р ИСО 13485-2004.ГОСТ Р ИСО 10993.7-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации. Заменен на ГОСТ Р ИСО 10993-7-2009.ГОСТ Р ИСО 14971.1-99Медицинские изделия. Управление риском. Часть 1. Применение анализа риска к медицинским изделиям. Заменен на ГОСТ Р ИСО 14971-2006.ГОСТ Р ИСО 10993.1-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования. Заменен на ГОСТ Р ИСО 10993-1-2009.- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10
стр. 11

стр. 12
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
НЕАКТИВНЫЕ ХИРУРГИЧЕСКИЕ ИМПЛАНТАТЫОбщие технические требования
БЗ 1 - 2000/789
БЗ 1 - 2000/789
Издание официальное
ГОССТАНДАРТ РОССИИ Москва
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники (ВНИИИМТ)
ВНЕСЕН Техническим комитетом по стандартизации ТК 11 «Медицинские приборы и аппараты»
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. № 850-ст
3 Настоящий стандарт представляет собой аутентичный текст международного стандарта ИСО 14630—97 «Неактивные хирургические имплантаты. Общие требования»
4 ВВЕДЕН ВПЕРВЫЕ
© ИПК Издательство стандартов, 2000
Настоящий стандарт нс может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта России
II
Содержание
1 Область распространения.................................................... 1
2 Нормативные ссылки....................................................... 1
3 Определения.............................................................. 2
4 Показатели назначения...................................................... 2
5 Особенности конструкции.................................................... 2
6 Материалы............................................................... 3
7 Оценка конструкции........................................................ 3
8 Изготовление............................................................. 4
9 Стерилизация............................................................. 4
10 Упаковка................................................................ 4
11 Информация, предоставляемая изготовителем.................................... 5
Приложение А Перечень стандартов (действующих и находящихся в стадии разработки)...... 6
III
Введение
Настоящий стандарт является прямым применением международного стандарта ИСО 14630—97 «Неактивные хирургические имплантаты. Общие требования», подготовленного Европейским комитетом по стандартизации (СЕН) совместно с Техническим комитетом ИСО 150 «Имплантаты для хирургии» в соответствии с соглашением по техническому сотрудничеству между ИСО и СЕН (Венское Соглашение).
Стандарт ЕН ИСО 14630—98 разработан Техническим комитетом СЕН/ТК 285 «Неактивные хирургические имплантаты» (секретариат которого функционирует при Нидерландском институте стандартизации) в сотрудничестве с Техническим комитетом ИСО ТК 150 «Имплантаты для хирургии*.
Европейский стандарт разработан по поручению, данному СЕН Европейской комиссией и Европейской ассоциацией свободной торговли (ЕАСТ), и подтверждает основные требования Директив ЕС.
Европейские стандарты, определяющие требования к неактивным хирургическим имплантатам, подразделяют на три уровня (первый уровень является наивысшим):
первый — общие требования к неактивным хирургическим имплантатам;
второй — частные требования к группам неактивных хирургических имплантатов;
третий — специальные требования к отдельным типам неактивных хирургических имплантатов.
Настоящий стандарт является стандартом первого уровня и содержит требования ко всем неактивным хирургическим имплантатам. В нем также даны ссылки на дополнительные требования, содержащиеся в стандартах второго и третьего уровней.
Стандарты второго уровня применяются к более ограниченным группам или типам имплантатов, например, к устройствам, предназначенным для остеосинтеза, сердечно-сосудистой хирургии или эндопротезированию суставов.
Стандарты третьего уровня применяются к специальным типам имплантатов, например, к протезам тазобедренных суставов или протезам молочной железы.
Ознакомление со всеми требованиями следует начинать с последнего в каждом конкретном случае уровня.
В приложении А перечислены европейские стандарты ЕН, действующие в настоящее время либо находящиеся в стадии разработки.
Примечание — Перечисленные в приложении А европейские стандарты не во всех случаях приняты в качестве международных стандартов (см. также примечание, приведенное ниже, и раздел 2).
Настоящий стандарт устанавливает порядок соблюдения соответствующих основных требований, как они изложены в общем виде в Приложении 1 Директивы Совета 93/42 EEC от 14 июня 1993 г., касающихся медицинских устройств в той мере, в какой они относятся к неактивным хирургическим имплантатам. В нем также нашли отражение основные принципы Технического отчета ИСО 14283, так как они применяются к неактивным хирургическим имплантатам.
Для таких изделий могут применяться частные и специальные требования. Эти дополнительные требования нормированы в стандартах второго и третьего уровня или их частях.
Примечание — Структура настоящего стандарта и имеющиеся в нем нормативные ссылки базируются на использовании стандарта в соответствии с Директивой Совета 93/42 EEC.
Кроме европейских стандартов, перечисленных в разделе «Нормативные ссылки», имеются международные стандарты (см. также раздел 2 и примечание, приведенное выше).
Пользователям международных стандартов следует знать, что они не всегда соответствуют основным требованиям Директивы Совета 93/42 EEC или иным нормативным требованиям других стран и регионов.
ГОСТ Р ИСО 14630-99
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
НЕАКТИВНЫЕ ХИРУРГИЧЕСКИЕ ИМПЛАНТАТЫ
Общие технические требования
Non-active surgical implants.
General technical requirements
Дата введения 2001—01—01
1 Область распространения
Настоящий стандарт устанавливает общие требования к неактивным хирургическим имплантатам, требования к показателям назначения, особенностям конструкции, материалам, оценке конструкции, процессу изготовления, стерилизации, упаковке, испытаниям и информации, поставляемой изготовителем. Испытания, необходимые для выявления соответствия требованиям настоящего стандарта, рассматриваются в стандартах других уровней.
Стандарт не распространяется на стоматологические имплантаты и восстановительные материалы, трансэндодонтическис и трансрадикулярные имплантаты и внутриглазные (контактные) линзы.
Требования настоящего стандарта являются рекомендуемыми.
Настоящий стандарт включает в себя как датированные, так и недатированные ссылки, а также извлечения из других источников. Эти нормативные ссылки приведены в соответствующих местах текста, а в дальнейшем упоминаются как публикации.
Что касается датированных ссылок, то последующие дополнения или изменения, внесенные в эти публикации, применяются к данному стандарту только если они введены в него в форме дополнения или изменения. Применительно к недатированным ссылкам ориентироваться следует на последнее издание данной публикации.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р ИСО 10993.1-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ЕН 540—93* Клинические исследования медицинских устройств, предназначенных для организма человека
ЕН 550—94* Стерилизация медицинских устройств. Подтверждение и текущая проверка газовой стерилизации окисью этилена
ЕН 552-94* Стерилизация медицинских устройств. Подтверждение и текущая проверка стерилизации облучением
ЕН 554—94* Стерилизация медицинских устройств. Подтверждение и текущая проверка стерилизации влажным теплом
ЕН 556—94* Стерилизация медицинских устройств. Требования к медицинским устройствам с этикеткой «стерильно*
ЕН 868-1—97* Упаковочные материалы для стерилизации изделий в обертке. Часть 1. Общие требования и требования по оценке соответствия упаковки для изделий, прошедших окончательную стерилизацию
ЕН 980* Терминология, символы и информация, поставляемая с медицинскими устройствами. Графические символы, используемые на этикетках медицинских изделий
* Международные стандарты — во ВНИИИКИ Госстандарт! России.
Издание официальное
1
Проект ЕН 1041—981 Терминология, символы и информация, поставляемая с медицинскими изделиями. Информация, поставляемая изготовителем
Проект ЕЙ 1441—971 Медицинские изделия. Анализ риска
Примечания
1 С некоторыми из перечисленных европейских стандартов соотносятся аналогичные или технически связанные с ними международные стандарты (приложение А).
2 В приложении А приведены ссылки на стандарты различных уровней и другие европейские стандарты, а также на информационные ссылки в тексте стандарта.
3 Определения
В настоящем стандарте применяют следующие термины с соответствующими определениями:
3.1 неактивный хирургический имплантат: Имплантируемое устройство без активного приведения его в действие.
3.2 имплантируемое устройство: Устройство, предназначенное для полного вживления в организм человека или замены поверхности эпителия или поверхности глаза путем хирургического вмешательства, после завершения которого вживляемое устройство остается в месте его имплантации. К имплантируемым устройствам относят также любые медицинские устройства, предназначенные для частичного введения в организм человека в процессе хирургического вмешательства и нахождения в организме после завершения операции нс менее 30 дней.
3.3 активное медицинское устройство: Медицинское устройство, которое работает от источника электрической или другой энергии, кроме генерируемой непосредственно организмом человека или силой тяжести, и действует в результате преобразования этой энергии. Медицинские устройства, предназначенные для передачи энергии, веществ или иных частиц от активного медицинского устройства к пациенту без внесения сколько-нибудь существенного изменения, нс считаются активными медицинскими устройствами.
3.4 безопасность: Отсутствие риска нанесения ущерба.
3.5 состояние готовности к имплантации: Состояние готовности имплантата для вживления в организм человека.
3.6 утечка: Непредусмотренное попадание жидкости (в том числе и физиологической) в имплантат или выход жидкости из имплантата в результате дефекта в структуре стенки контейнера.
3.7 покрытие: Слой материала, используемый для полной или частичной защиты имплантата.
4 Показатели назначения
В документации на изделие должны быть приведены следующие показатели назначения имплантата:
- функциональные характеристики;
- типовое применение;
- условия эксплуатации с уделением особого внимания вопросам безопасности.
Примечание — Необходимо принимать во внимание опубликованные сгандарты, научную литературу и литературу по клинической практике, а также утвержденные результаты испытаний.
5 Особенности конструкции
При разработке имплантатов должны быть учтены следующие факторы;
a) материалы и их биосовмсстимость (раздел 6);
b) физические, механические и химические свойства материалов, включая их прочность и долговечность (разделы 6, 7);
c) характеристики износа .материалов и влияние износа и его продуктов на имплантат и организм человека;
d) влияние технологических процессов (включая стерилизацию) на характеристики материалов и эксплуатационные свойства (разделы 6—9);
ГОСТ Р ИСО 14630-99
с) взаимодействие материалов имплантата с другими материалами и веществами (разделы
6, 7);
0 распространение и влияние утечки и/или диффузии веществ, используемых для заполнения имплантатов (разделы 6, 7);
g) соединения и их воздействие на нормативные хараюсристики (раздел 7);
h) контактирующие поверхности между имплантатом и биологическими тканями, особенно на участках креплений и соединений; состояние поверхности (раздел 7);
i) форма и размеры имплантата с учетом их возможного влияния на ткани и жидкости организма (раздел 7);
j) биосовместимость имплантата в состоянии имплантации (разделы 6, 7);
k) физические и химические воздействия организма и внешних окружающих факторов на имплантат (раздел 7);
l) влияние радиации (излучений) и магнитных полей на ималантат и их последующие воздействия на организм человека (6.1, раздел 7);
ш) способность имплантата к вживлению, удалению и замещению после имплантации (раздел 7);
п) уровни микробиологического загрязнения и загрязнения макрочастицами (разделы 8—10);
о) пригодность и эффективность упаковки (раздел 10).
Особенности конструкции имплантата должны быть отражены в документации. Если характеристики, содержащиеся в перечисленных пунктах, не применялись, причина этого должна быть обоснована и отражена в документах.
6 Материалы
Материалы для изготовления имплантатов выбирают с учетом функционального назначения имплантата, влияния технологических процессов, способов обращения с имплантатами, типа стерилизации и условий хранения. Должны быть рассмотрены возможные взаимодействия имплантата с живыми тканями и жидкостями, другими материалами, другими имплантатами, веществами, газами, излучениями и электромагнитными полями (раздел 7).
Если составной частью имплантата является лекарственное средство, должно быть проведено его соответствие требованиям, предъявляемым к фармацевтической продукции. Имплантат не должен оказывать воздействия на характеристики лекарственного средства, используемого в комбинации с ним, и наоборот (см. примечание 1).
Материалы, используемые для им ал штатов и их покрытий, включая биологические материалы, полученные методом генной инженерии, в состоянии имплантации должны быть в достаточной степени совместимы. Уровень совместимости продуктов возможного износа и распада должен быть также приемлемым. Приемлемость материалов в том или ином конкретном случае должна бьпъ подтверждена:
a) или документом соответствия с положениями ГОСТ Р ИСО 10993.1;
b) или выбором материалов, которые доказали свою пригодность при аналогичном использовании в клинической практике.
Примечания
1 Для обеспечения соответствия Дирскгивс Совета 93/42 EEC от 14 июня 1993 г. в части медицинских изделий безопасность, качество и пригодность лскарствсшюго средства должны быть проверены с учетом назначения имплантата по аналогии с соответствующими методами, нормированными в Дирскгивс 75/318 EEC.
2 Некоторые из стандартов второго уровня включают перечни материалов, признанных годными для конкретных видов применения.
3 Имплантаты, в которых используют материалы животного происхождения, следует оценивать с точки зрения опасностей, возникающих из-за возможности передачи инфекций, в частности через небакгериалыше и невирусныс агсты. Стандарты на медицинские изделия с использованием тканей животных находятся в сталии разработки (см. А.2).
7 Оценка конструкции
7.1 Общие положения
Оценку имплантатов проводят для демонстрации достижения проектных показателей назначения (раздел 4). В документации должна быть отражена степень соответствия проектным характеристикам. Безопасность должна быть подтверждена прсдклиничсской и клинической оценкой, предусматривающей соответствующей анализ риска согласно проекту ЕН 1441.
3
7.2 Предклиническая оценка
Имплантаты необходимо подвергать предварительной клинической (предклиничсской) оценке следующими способами:
a) сбором и критическим анализом соответствующей научной литературы;
b) анализом результатов испытаний.
Предкиинические испытания имплантатов должны имитировать условия проектного применения имплантата. В настоящем стандарте приведены ссылки на методы испытаний и соответствующие критерии приемки для специальных типов имплантатов.
7.3 Клиническая оценка
Для клинической оценка имплантатов необходимы:
a) сбор и критический анализ соответствующей научной и клинической литературы, в которой рассматривается назначенное применение данного имплантата или подобных имплантатов;
b) анализ результатов клинических исследований.
При проведении клинических исследований необходимо руководствоваться требованиями ЕН 540. Требования к клиническим исследованиям специальных типов изделий включены в другие части настоящего стандарта.
8 Изготовление
Имплантаты должны быть изготовлены таким образом, чтобы были обеспечены нормированные характеристики конструкции. Эти требования рассматривают в других разделах настоящего стандарта.
Примечание — Допускается применять системы качества по ЕН 46001 и ЕН 46002 (А.2).
9 Стерилизация
9.1 Изделия, поставляемые стерильными
Имплантаты с этикеткой «Стерильно* должны соответствовать требованиям ЕН 556.
Примечание — В ЕН 556 уровень гарантии стерильности установлен 10~*.
Процесс стерилизации должен быть обоснован и регулярно проверяться. Стерилизация имплантатов оксидом этилена должна соответствовать требованиям ЕН 550, стерилизация облучением — требованиям ЕН 552, паровая стерилизация — по ЕН 554.
9.2 Изделия, поставляемые нестерильными
Для нестерильных имплантатов изготовитель должен указать не менее одного подходящего метода стерилизации. Этот метод не должен оказывать вредного воздействия на функциональную безопасность имплантата. Если многократная стерилизация запрещена, это должно быть указано в информации, поставляемой изготовителем (раздел 11).
9.3 Остаточные вещества после стерилизации
Испытания на проверку остаточных веществ после стерилизации проводят в соответствии с требованиями ГОСТ Р ИСО 10993.1. Уровни остаточных веществ не должны превышать установленных в соответствующих частях ГОСТ Р ИСО 10993 (А.2).
10 Упаковка
10.1 Защита от повреждений при хранении и транспортировании
Упаковка каждого имплантата должна быть такой, чтобы в указанных изготовителем условиях хранения, транспортирования и обращения с имплантатом (включая контроль за температурой, влажностью и давлением окружающей среды, если он возможен) обеспечивалась защита имплантата от повреждений и ухудшения его свойств при отсутствии вредного воздействия на имплантат.
Примечания
1 В ходе испытаний можно использовать методы, приведенные в ЕН 60068-2-27, ЕН 60068-2-32 и/или ЕН 60068-2-47 (А.2).
2 Перед тем, как принять какой-либо способ упаковки, оценивают его пригодность для данного назначения с помощью испытания типа «опасного перемещения*, имитирующего плохое обращение с упаковкой при случайном столкновении.
10.2 Сохранение стерильности при хранении и транспортировании
Имплантаты с этикеткой «Стерильно» должны быть упакованы так, чтобы обеспечить их стерильность в нормальных условиях хранения, транспортирования и при нормальном обращении, если только упаковка нс повреждена или вскрыта. Упаковка должна соответствовать проекту ЕН 868-1.
11 Информация, предоставляемая изготовителем
11.1 Общие положения
Информация, поставляемая изготовителем имплантата, должна соответствовать проекту ЕН 1041. Используемые символы должны соответствовать ЕН 980.
Запрещение многократной стерилизации должно быть указано в информации, поставляемой изготовителем.
11.2 Ограничения при комбинировании имплантатов
Использование имплантата в сочетании с другими имплантатами или устройствами или ограничения использования таких комбинаций должны быть указаны на этикетке или в инструкции (руководстве) по эксплуатации.
11.3 Маркировка на имплантатах
На имплантатах должна быть следующая маркировка:
- наименование или заводская марка изготовителя;
- код партии (номер партии) или серийный номер;
- «Стерильно* — для изделий, поставляемых стерильным (см. 9.1).
Если маркировка может повлиять на проектные эксплуатационные характеристики, или имплантат слишком мал, или его физические свойства нс позволяют различить маркировку, необходимая информация должна быть приведена на этикетке или должны быть предусмотрены иные средства для отслеживания происхождения продукции.
5
ПРИЛОЖЕНИЕ А (справочное)
Перечень стандартов (действующих и находящихся в стадии разработки)
АЛ. Перечень стандартов различных уровней АЛЛ Стандарты первого уровня
ЕН 12011 Инструмаггарий для использования при работе с неактивными хирургическими имплантатами. Общие требования
АЛ.2 Стандарты второго уровня
Проект ЕН ххххх Неактивные хирургические имплашаты. Имплантаты, повторяющие форму тела. Частные требования (в стадии разработки)
Проект ЕН 12006-1 Неактивные хирургические импланты. Частные требования к сердечно-сосудистым имплантатам. Часть 1. Протезы клапанов сердца
ЕН 12006-2 Неактивные хирургические имплантаты. Частные требования к сердечно-сосудистым имплантатам. Часть 2. Протезы сосудов, включая каналы сердечных клапанов
Проект ЕН 12006-3 Неактивные хирургические имплантаты. Частные требования к сердечно-сосудистым импла1ггатам. Часть 3. Стенты для сосудов и фильтры для полых вен
Проект ЕН 12010 Неактивные хирургические импла>паты. Имплантаты — заменители суставов. Частные требования
ЕН ИСО 14602 (ГОСТ Р ИСО 14602)2 Неактивные хирургические имплантаты. Имплантаты для остеосинтеза. Технические требования А. 1.3 Стандарты третьего уровня
Проект ЕН 12180 Нсактинкые хирургические имплантаты. Имплантаты, повторяющие форму тела. Специальные требования к протезам молочной железы
Проект ЕН 12563 Неактивные хирургические имплантаты. Заменители суставов. Специальные требования к протезам тазобедренных суставов
Проект ЕН 12564 Неактивные хирургические имплантаты. Заменители суставов. Специальные требования к протезам коленных суставов
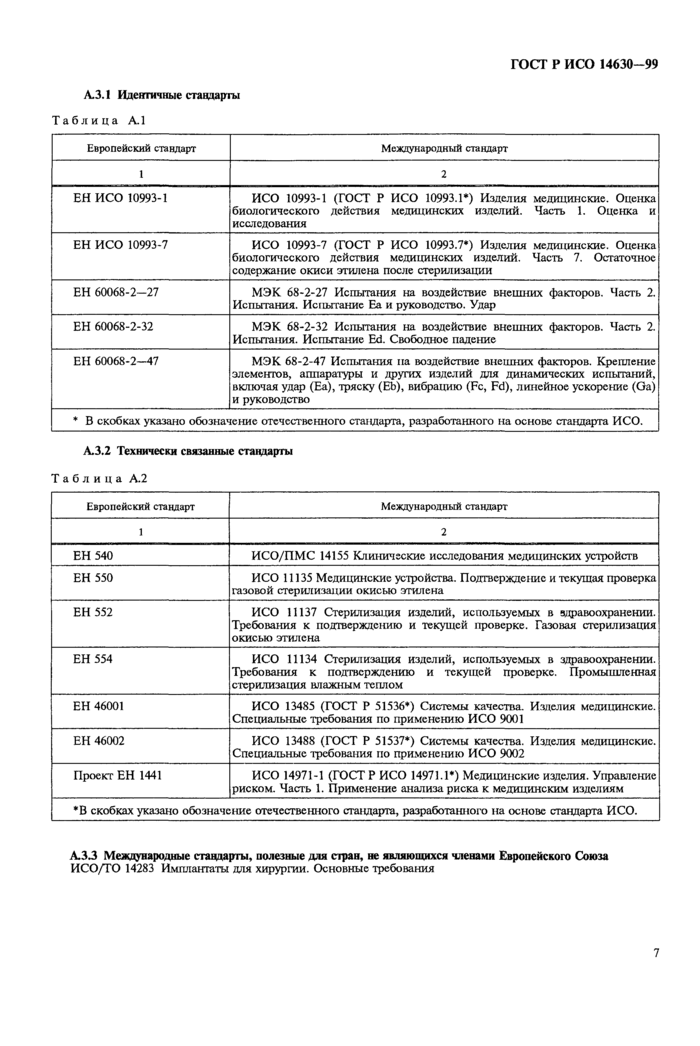
А.2 Европейские стандарты, на которые даны ссылки в настоящем стандарте
ЕН ИСО 10993-7 (ГОСТ Р ИСО 10993.7)2 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание окиси этилена после стерилизации (ИСО 10993-7—95) ЕН 46001 Системы качества. Изделия медицинские. Специальные требования по (гримснснию ЕН 9001 ЕН 46002 Системы качества. Изделия медицинские. Специальные требования по применению ЕН 9002 ЕН 60068-2—27 Испытания на воздействие внешних факторов. Часть 2. Испытания. Испытание Еа и руководство. Удар
ЕН 60068-2—32 Испытания на воздействие внешних факторов. Часть 2. Испытания. Испытание Ed. Свободное падение
ЕН 60068-2—47 Испытания на воздействие внешних факторов. Крепление элементов, аппаратуры и других изделий для динамических испытаний, включая удар (Еа), тряску (ЕЬ), вибрацию (Fc, Fd), линейное ускорение (Оа), а также руководство
Проект ЕН 12442-1 Ткани животных и их производные, используемые при изготовлении медицинских устройств. Часть 1. Анализ и управление риском
Проект ЕН 12442-2 Ткани живопшх и их производные, используемые при изготовлении медицинских устройств. Часть 2. Поиск, проверка, сбор и способы обращения
Проект ЕН 12442-3 Ткани животных и их производные, используемые при изготовлении медицинских устройств. Часть 3. Исключение и/или дезактивация вирусов и других носителей инфекции. Определение нежизнеспособности
А.З Справочные европейские стандарты и соответствующие стандарты ИСО
На время публикации настоящего стандарта перечисленные ниже стандарты ИСО были отнесены к идентичным (А.3.1) или технически связанным с настоящим стандартом (А.3.2).
1
Международные стандарты находятся во ВНИИИКИ Госстандарта России.
2
Обозначение отечественного стандарта, разработанного на основе стандарта ИСО.
6