ГОСТ Р ИСО 10993.7-99
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации
Устанавливает допустимые предельные значения для остаточных количеств этиленоксида (ОЭ) и этиленхлоргидрина (ЭХГ) в медицинских изделиях, стерилизованных ОЭ, методы определения ОЭ и ЭХГ и требования, в соответствии с которыми осуществляется выпуск изделий. Стандарт не распространяется на изделия, стерилизованные ОЭ, но не имеющие контакта с пациентом, (например, диагностические устройства, использующиеся in vitro).
Оглавление
1 Область применения
2 Нормативные ссылки
3 Определения
4 Основные требования
4.1 Общие положения
4.2 Категории изделий по продолжительности контакта
4.3 Допустимые пределы
4.3.1 Изделия постоянного контакта
4.3.2 Изделия длительного контакта
4.3.3 Изделия кратковременного контакта
4.3.4 Особые случаи
4.4 Определение остаточного содержания ЭО и ЭХГ
4.4.1 Вопросы безопасности
4.4.2 Определение остаточного содержания
4.4.3 Отбор образцов
4.4.4 Выбор объема модельной среды
4.4.5 Время и условия экстракции
4.4.6 Экстракция из изделий
4.4.7 Результаты анализа и их интерпретация
5 Выпуск продукции
5.1 Выпуск продукции без использования данных по кривым дегазации
5.2 Методика выпуска продукции с использованием кривых дегазации
Приложение А Оценка хроматограмм, полученных методом газовой хроматографии
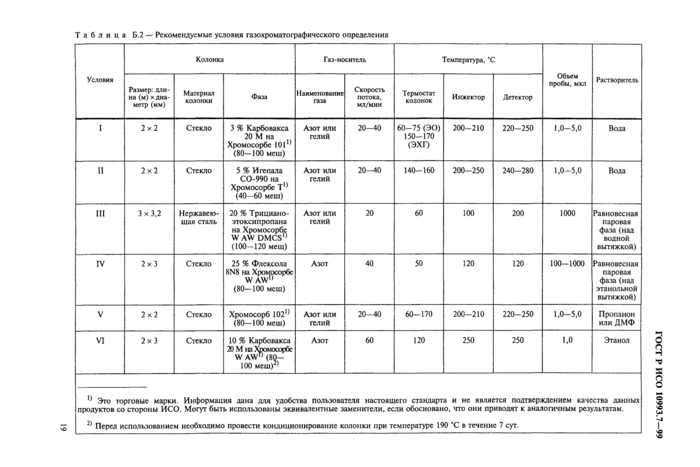
Приложение Б Газохроматографическое определение ЭО и ЭХГ
Приложение В Факторы, влияющие на содержание остаточных веществ в изделии
Приложение Г Условия экстракции для определения остаточного содержания ЭО
Приложение Д Логическое обоснование введения предельных значений
Приложение Е Определение этиленоксида
Приложение Ж Библиография
43 страницы
| Дата введения | 01.01.2002 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.09.2010 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 29.12.1999 | Утвержден | Госстандарт России | 862 |
|---|---|---|---|
| Разработан | ВНИИИМТ | ||
| Издан | ИПК Издательство стандартов | 2000 г. |
Medical devices. Biological evaluation of medical devices. Part 7. Ethylene oxide sterilization residuals
- ГОСТ 17433-80 Промышленная чистота. Сжатый воздух. Классы загрязненности
- ГОСТ 15860-84 Баллоны стальные сварные для сжиженных углеводородных газов на давление до 1,6 МПа. Технические условия
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 3022-80 Водород технический. Технические условия
ГОСТ 7568-88Этилена окись. Технические условия. Заменен на ГОСТ 7568-2018.ГОСТ Р ИСО 10993.3-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию. Заменен на ГОСТ Р ИСО 10993-3-2009.ГОСТ Р ИСО 10993.10-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследование раздражающего и сенсибилизирующего действия. Заменен на ГОСТ Р ИСО 10993-10-2009.ГОСТ Р ИСО 10993.1-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования. Заменен на ГОСТ Р ИСО 10993-1-2009.- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22
стр. 23

стр. 24

стр. 25

стр. 26
стр. 27

стр. 28

стр. 29

стр. 30
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские Оценка биологического действия медицинских изделий Часть 7
ОСТАТОЧНОЕ СОДЕРЖАНИЕ ЭТИЛЕНОКСИДА ПОСЛЕ СТЕРИЛИЗАЦИИ
t-2000/800
t-2000/800
Издание официальное
ГОССТАНДАРТ РОССИИ Москва
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники (ВНИИИМТ)
ВНЕСЕН Техническим комитетом по стандартизации ТК 422 «Оценка биологического действия медицинских изделий»
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. № 862-ст
3 Настоящий стандарт, за исключением приложения Е, представляет собой аутентичный текст международного стандарта ИСО 10993.7—95 «Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации»
4 ВВЕДЕН ВПЕРВЫЕ
© ИПК Издательство стандартов, 2000
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта России
11
Содержание
1 Область применения........................................................ 1
2 Нормативные ссылки....................................................... 1
3 Определения.............................................................. 1
4 Основные требования....................................................... 2
4.1 Общие положения........................................................ 2
4.2 Категории изделий по продолжительности контакта............................... 2
4.3 Допустимые пределы...................................................... 3
4.3.1 Изделия постоянного контакта.......................................... 3
4.3.2 Изделия длительного контакта........................................... 3
4.3.3 Изделия кратковременного контакта...................................... 3
4.3.4 Особые случаи....................................................... 3
4.4 Определение остаточного содержания ЭО и ЭХГ................................. 3
4.4.1 Вопросы безопасности................................................. 3
4.4.2 Определение остаточного содержания..................................... 4
4.4.3 Отбор образцов...................................................... 4
4.4.4 Выбор объема модельной среды.......................................... 5
4.4.5 Время и условия экстракции............................................ 5
4.4.6 Экстракция из изделий................................................ 5
4.4.7 Результаты анализа и их интерпретация.................................... 7
5 Выпуск продукции......................................................... 8
5.1 Выпуск продукции без использования данных по кривым дегазации.................. 8
5.2 Методика выпуска продукции с использованием кривых дегазации................... 8
Приложение А Оценка хроматограмм, полученных методом газовой хроматографии.........10
Приложение Б Газохроматографическое определение ЭО и ЭХГ........................12
Приложение В Факторы, влияющие на содержание остаточных веществ в изделии..........20
Приложение Г Условия экстракции для определения остаточного содержания ЭО...........21
Приложение Д Логическое обоснование введения предельных значений..................22
Приложение Е Определение этиленоксида.........................................33
Приложение Ж Библиография..................................................35
111
Введение
Соблюдение положений стандартов серии ГОСТ Р ИСО 10993 «Оценка биологического действия медицинских изделий* позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов нс является безусловное закрепление конкретных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие специальную подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты этой серии являются руководящими документами для прогнозирования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых образцов.
В стандарты серии ГОСТ Р ИСО 10993, имеющие групповой заголовок «Изделия медицинские. Оценка биологического действия медицинских изделий*, входят следующие части:
- часть 1 — оценка и исследования;
- часть 3 — исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
- часть 4 — исследование изделий, взаимодействующих с кровью;
- часть 5 — исследование на цитотоксичность: методы in vitro;
- часть 6 — исследование местного действия после имплантации;
- часть 7 — остаточное содержание этиленоксида после стерилизации;
- часть 9 — основные принципы идентификации и количественного определения потенциальных продуктов деструкции;
- часть 10 — исследование раздражающего и сенсибилизирующего действия;
- часть 11 — исследование общстоксичсского действия;
- часть 12 — приготовление проб и стандартные образцы;
- часть 13 — идентификация и количественное определение продуктов деструкции полимерных медицинских изделий;
- часть 16 — моделирование и исследование токсикокинстики продуктов деструкции и вымывания.
Перечисленные стандарты, в том числе настоящий стандарт, носят рекомендательный характер.
Настоящий стандарт обосновывает необходимость проведения контроля содержания остаточных количеств этиленоксида (ЭО) и этиленхлоргидрина (ЭХГ) после стерилизации в изделиях медицинского назначения в связи с их токсическим действием в определенных концентрациях. В стандарте обращается особое внимание на биологические реакции, включающие раздражение, повреждение органов, мутагенность и канцсрогенность у человека и животных, влияние на репродуктивную функцию у животных.
Методы исследования, изложенные в настоящем стандарте, взяты из международных, национальных стандартов, директив и нормативов.
Допускается применение других методов, обеспечивающих оценку биологического действия медицинских изделий в соответствии с требованиями международных стандартов.
В приложении Е приведена летодика определения остаточных количеств в вытяжках из изделий методом газовой хроматографии, применяемая в России при оценке биологического действия медицинских изделий.
Приложения В, Г, Д, Е и Ж носят справочный характер.
IV
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские Оценка биологического действия медицинских изделий Часть 7
ОСТАТОЧНОЕ СОДЕРЖАНИЕ ЭТИДЕНОКСИДА ПОСЛЕ СТЕРИЛИЗАЦИИ
Medical devices. Biological evaluation of medical devices.
Part 7. Ethylene oxide sterilization residuals
Дата введения 2002—01—01
1 Область применения
Настоящий стандарт устанавливает допустимые предельные значения для остаточных количеств этиленоксида (ЭО) и этиленхлоргидрина (ЭХГ) в медицинских изделиях (далее — изделия), стерилизованных ЭО, методы определения ЭО и ЭХГ и требования, в соответствии с которыми осуществляется выпуск изделий.
Требования настоящего стандарта являются рекомендуемыми.
Стандарт не распространяется на изделия, стерилизованные ЭО, но не имеющие контакта с пациентом (например, диагностические устройства, использующиеся in vitro).
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты, содержащие положения, которые могут рассматриваться как разделы настоящего стандарта.
ГОСТ 3022-80 Водород технический. Технические условия ГОСТ 6709-72 Вода дистиллированная. Технические условия ГОСТ 7568-88 Этилена окись. Технические условия
ГОСТ 15860-84 Баллоны стальные сварные для сжиженных углеводородных газов на давление до 1,6 МПа. Технические условия
ГОСТ 17433-80 Промышленная чистота. Сжатый воздух. Классы загрязненности ГОСТ Р ИСО 10993.1-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ГОСТ Р ИСО 10993.3-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследование генотоксичности, канцсрогенности и токсического действия на репродуктивную функцию
ГОСТ Р ИСО 10993.10-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследование раздражающего и сенсибилизирующего действия
3 Определения
В настоящем стандарте используют термины, приведенные в ГОСТ Р ИСО 10993.1, а также следующие определения:
3.1 экстракция, моделирующая условия применения: Экстракция с использованием воды в качестве модельной среды, моделирующая реальные условия применения, выполняемая в соответствии с требованиями настоящего стандарта и позволяющая оценить остаточные количества ЭО и ЭХГ, воздействующие на пациента или пользователя изделий в процессе их применения по назначению.
Издание официальное
Примечание — При оценке в аналитической лаборатории основной упор должен быть сделан на то, чтобы данный вид экстракции проводился в условиях, обсспечикающих наибольшее соответствие с предполагаемым способом применения. Моделирование условий применения изделия в медицинской практике должно проводиться с учетом максимально возможного времени воздействия, принимая во внимание температуру воздействия и ткани, контактирующие с данным изделием.
3.2 исчерпывающая экстракция: Экстракция, выполняемая до тех пор, пока количество ЭО и ЭХГ в последующей порции модельной среды нс будет составлять менее 10 % от определенного при первой экстракции или пока не будет аналитически значимого увеличения в определяемых совокупных остаточных уровнях.
Примечание — Если невозможно показать исчерпывающий характер при оценке остаточных количеств, определение исчерпывающей экстракции принимается в указанном выше виде.
4 Основные требования
Примечание — Информация по источникам ограничений в настоящем стандарте гак же, как и другая важная дополнительная информация и руководство к использованию настоящего стандарта содержатся в приложениях.
4.1 Общие положения
В настоящем разделе устанавливают максимально допустимые уровни остаточного содержания ЭО для отдельных изделий, простерилизованных ЭО. Регламентируется также максимальное содержание ЭХГ в случаях, когда его обнаруживают в медицинских изделиях, стерилизованных ЭО.
Для содержания этиленгликоля (ЭГ) никакие ограничения не устанавливают, поскольку оценка степени риска показывает, что, когда остаточные количества ЭО контролируют согласно требованиям настоящего стандарта, маловероятно присутствие биологически значимых остаточных количеств ЭГ (см. Д.1).
Требования, изложенные в настоящем стандарте, являются дополнением к программам биологических исследований, представленным в ГОСТ Р ИСО 10993.1. Для изделий, стерилизованных ОЭ, следует обратить особое внимание на ГОСТ Р ИСО 10993.3 и ГОСТ Р ИСО 10993.10. При выполнении требований ГОСТ Р ИСО 10993.1 следует учитывать остаточные количества ЭО в момент выпуска продукции для каждого конкретного изделия.
Результаты биологической оценки изделия могут обусловить более жесткие, чем приведенные в 4.3 требования, предназначенные для учета обычных реакций. Например, при биологической оценке раздражающее действие должно рассматриваться для всех изделий, в частности для изделий малого размера (см. Д.2). Настоящий стандарт нс учитывает возможности острых локальных реакций, для которых могут быть получены неудовлетворительные данные. Следует обратить внимание на возможность таких реакций особенно для небольших изделий и учитывать концентрацию ЭО на единицу площади поверхности.
4.2 Категории изделий по продолжительности контакта
Для установления максимальной суточной дозы ЭО и ЭХГ, которая может выделяться из изделия и воздействовать на пациента, изделие в зависимости от продолжительности контакта относят к определенной категории.
Согласно ГОСТ Р ИСО 10993.1 изделия однократного, многократного или непрерывного применения по продолжительности контакта относят к одной из трех категорий:
А — изделия кратковременного контакта продолжительностью не более 24 ч;
Б — изделия длительного контакта продолжительностью свыше 24 ч, но не более 30 сут;
В — изделия постоянного контакта продолжительностью свыше 30 сут.
Примечания
1 Если материал или изделие могут быть отнесены более чем к одной категории по продолжительности контакта, следует выбирать более жесткие условия исследований. При многократном применении изделия для принятия решения, к какой категории следует отнести изделие, учитывают возможный кумулятивный эффект, принимая во внимание период времени между повторными применениями.
2 В настоящем стандарте термин «многократное применение* означает применение одного и того же изделия более одного раза.
2
4.3 Допустимые пределы
Для каждого изделия максимально допустимые дозы ЭО и ЭХГ, которые воздействуют на пациента, не должны превышать значений, приведенных ниже для соответствующей категории.
Примечание — Предельные значения для изделий постоянного и длительного контакта выражаются в максимальной среднесуточной дозе. Для изделий, имеющих постоянный контакт, введены ограничения для первых 24 ч и для первых 30 суг, а для изделий длительного контакта — для первых 24 ч. Эти ограничения устанавливают предельные значения ЭО и ЭХГ, которые могут воздействовать на пациента в ранние периоды времени. Методика, которую использовали для установки допустимых предельных значений, описана в Д.2.
4.3.1 Изделия постоянного контакта
Среднесуточная доза ЭО для пациента должна быть не более 0,1 мг. Дополнительные требования: максимальная доза ЭО должна быть не более:
20 мг — в течение первых 24 ч;
60 мг — в течение первых 30 сут;
2,5 г — в течение жизни.
Среднесуточная доза ЭХГ для пациента должна быть нс более 2 мг. Дополнительные требования: максимальная доза ЭХГ должна быть не более:
12 мг — в течение первых 24 ч;
60 мг — в течение первых 30 суг;
50 г — в течение жизни.
4.3.2 Изделия длительного контакта
Среднесуточная доза ЭО для пациента должна быть не более 2 мг. Дополнительные требования: максимальная доза ЭО должна быть не более:
20 мг — в течение первых 24 ч;
60 мг — в течение первых 30 сут.
Среднесуточная доза ЭХГ должна быть не более:
12 мг — в течение первых 24 ч;
60 мг — в течение первых 30 суг.
4.3.3 Изделия кратковременного контакта
Среднесуточная доза ЭО для пациента должна быть нс более 20 мг.
Среднесуточная доза ЭХГ для пациента не должна превышать 12 мг.
Примечание — Одновременное использование нескольких изделий или использование изделий для новорожденных может привести к дополнительному воздействию, как указано в Д.2.1.1.
4.3.4 Особые случаи
Для систем, состоящих из нескольких изделий, предельные дозы должны рассчитываться для каждого отдельного изделия.
Остаточное содержание ЭО в интраокулярных линзах должно быть не более 0,5 мкг ЭО на линзу в сутки и 1,25 мкг на линзу.
Для оксигенаторов и сепараторов крови среднесуточная доза ЭО для пациента не должна превышать 60 мг.
Для изделий, предназначенных для экстракорпоральной очистки крови, используют предельные содержания ЭО и ЭХГ, установленные для изделий длительного и кратковременного контакта, но допустимая доза ЭО в течение всей жизни может быть превышена.
Примечание — Рациональный подход для определения предельного содержания ЭО для некоторых изделий, не соответствующих общим требованиям, представлен в Д.2.1.3.
4.4 Определение остаточного содержания ЭО и ЭХГ
Метод определения остаточного содержания ЭО и ЭХГ для проверки соответствия требованиям, изложенным в 4.3, заключается в экстрагировании остаточных количеств из образцов, количественной оценке, анализе и интерпретации полученных данных.
4.4.1 Вопросы безопасности
Аналитики и другие лица, работающие с образцами, должны выполнять все работы, связанные с использованием химических реагентов и растворителей, необходимых для данных методов, под вытяжным шкафом в соответствующей защитной одежде, а перед использованием каждого химического реактива ознакомиться с информацией по безопасности материалов (Material Safety Data).
3
4.4.1.1 ЭО
Это воспламеняющийся и высокоактивный газ, оказывающий раздражающее действие на поверхности тела. Обладает мутагенным действием, проявляет фстотоксичныс и тератогенные свойства и может повреждать многие органы человеческого организма. При изучении канцерогенных свойств ингаляционное воздействие на животных вызывало несколько типов неопластических изменений, включая лейкемию, опухоли мозга и молочной железы, в то время как прием внутрь и внутрикожнос введение вызывало опухоли лишь в месте контакта.
4.4.1.2 ЭХГ
Это воспламеняющая жидкость, которая оказывает раздражающее действие на поверхность тела, вызывает острую токсичность и легко всасывается в кожу в количествах, оказывающих токсическое действие. Обладает слабым мутагенным действием, может вызывать фстотоксические и тератогенные изменения, может повреждать различные органы, включая легкие, почки и сердечно-сосудистую систему. Исследования канцерогенности на животных дали отрицательные результаты.
4.4.2 Определение остаточного содержания
Для определения остаточных количеств ЭО и, при необходимости, ЭХГ, воздействующих на пациента, необходимо использовать узаконенные методики экстракции и анализа.
Примечание — Если по результатам анализов, проведенных по методикам, представленным в Б.5.2 и Б.5.7, ЭХГ нс обнаружен, в дальнейшем его определение не требуется.
Методики, удовлетворяющие этим требованиям, представлены в приложении Б. Допускается использование любого аналитического метода при условии, что он обоснован, то есть показано, что он удовлетворяет требованиям, изложенным в приложении А, и что он оценен арбитражными методами, представленными в приложении Б.
При выборе пригодных методов экстракции (4.4.6) для количественного определения ЭО или, при необходимости, ЭХГ учитывают дозу, воздействующую на пациента для того, чтобы показать ее соответствие требованиям, приведенным в 4.3.
Если обосновано, что остаточное содержание ЭО и ЭХГ, определяемое методом исчерпывающей экстракции, соответствует требованиям 4.3, экстракцию, моделирующую условия применения в медицинской практике, не проводят. При применении исчерпывающей экстракции обращают особое внимание на предельные значения для первых 24 ч и 30 сут в соответствии с 4.3.
Известно много аналитических методов для определения остаточного содержания ЭО после стерилизации; их обзоры представлены в списке литературы (приложение Ж). Методы, для которых в результате межлабораторного изучения была проведена сравнительная оценка, выполненная высококвалифицированным персоналом с использованием современного оборудования, представлены в приложении Б. Однако большое разнообразие материалов и конструкторских решений при создании медицинских изделий в ряде случаев может вызвать трудности в определении остаточного содержания ЭО и ЭХГ методами, приведенными в приложении Б.
Поэтому любой аналитически значимый метод (т. е. обеспечивающий достоверность, точность, линейность, чувствительность и селективность) может быть использован при условии, что он обоснован. Приложение А содержит общие требования к выполнению методик, а методы, представленные в приложении Б, могут быть использованы как арбитражные для оценки альтернативных методов.
4.4.3 Отбор образцов
4.4.3.1 Представительные образцы
Образцы, которые предназначаются для определения остаточного содержания ЭО и ЭХГ, должны быть отобраны таким образом, чтобы они в достаточной степени отражали свойства изделия в целом. При отборе образцов следует обратить внимание на ряд факторов, указанных в приложении В. Так как многие из этих факторов влияют не только на исходные уровни остаточных веществ во всех компонентах изделия, но и на скорость выделения этих веществ, их также необходимо учесть, начиная с этапа производства и представления в лабораторию для проведения анализа.
Извлечение образцов изделий из обработанной партии сразу после окончания цикла стерилизации и отправка их в лабораторию, находящуюся удаленно от места стерилизации, а также хранение отобранных образцов в лаборатории для последующего анализа могут нарушить корреляцию в содержании остаточных количеств ЭО и ЭХГ в отобранных образцах и в оставшихся в обработанной партии. Более того, если образцы изделий из обработанной партии нс могут быть отобраны и доставлены таким образом, чтобы эффект дегазации был незначительным, проводят исследование
для установления соответствия дегазации анализируемых образцов и изделий из партии в разное время года.
4.4.3.2 Работа с образцами
Следует контролировать или уменьшить влияние лабораторных условий на скорость дегазации образцов, которые отобраны из партии изделий (см. В. 1.5). При проведении анализа соблюдают меры безопасности для оператора и аналитика.
Образцы, предназначенные для анализа, должны оставаться в составе партии вплоть до дня анализа. Время между изъятием образца из зоны контролируемой дегазации и началом экстракции должно быть сведено к минимуму.
Образцы герметично закрывают, перевозят и хранят в замороженном виде, если анализ откладывается. Образцы перевозят обложенными сухим льдом с привлечением службы круглосуточной доставки. Сухой лед оставляют в контейнере для перевозки во время транспортировки и при вскрытии упаковки. В качестве альтернативы образцы для анализа отбирают непосредственно из партии изделий после соответствующей дегазации и сразу помещают в соответствующую жидкость для экстракции или емкость для анализа метолом паровоздушной фазы, герметично закрывают и затем перевозят в лабораторию для анализа.
Образцы готовят в соответствии с инструкцией по предварительной подготовке, указанной на этикетке изделия.
Анализируемые образцы помещают в вытяжной шкаф и освобождают от упаковки. Экстракцию следует начинать по возможности быстро после того, как образец извлечен из упаковки или закончена предварительная подготовка.
4.4.3.3 Контрольный образец
Для того чтобы убедиться в отсутствии в веществе, составляющем основу образца, других компонентов со временем удерживания таким же, как и определяемые остаточные продукты, необходимо оценить контрольный образец, нс подвергавшийся стерилизации, путем экстракции его с использованием тех же процедур, что и для образцов, стерилизованных ЭО. При наличии материалов, экстрагируемых из такого контрольного образца, для которых времена удерживания совпадают или близки к временам удерживания определяемых веществ, изменяют условия хроматографирования таким образом, чтобы отделить мешающие пики от анализируемого пика, или используют другую аналитическую методику.
4.4.4 Выбор объема модельной среды
Объем модельной среды, используемой для извлечения остаточных количеств определяемых всщссгв из изделий или их представительных частей, должен быть таким, чтобы обеспечить максимальную эффективность экстракции при достаточной чувствительности определения анализируемых веществ в вытяжке. Таким образом, материал и размер образца изделия обуславливают оптимальный объем модельной среды. Соотношение масса образца/объем молельной среды для различных изделий обычно варьируется от 1:2 до 1:10 (т. е. 1 г в 2 мл и 1 г в 10 мл). Для изделий, изготовленных из материалов с высокими поглотительными свойствами, или для тех, экстракция остаточных количеств из которых проводится методом заполнения, может потребоваться соотношение масса образца/объем модельной среды с большим содержанием последней составляющей. В любом случае, выбор соотношения масса образца/объем модельной среды не должен приводить к уменьшению чувствительности определения.
4.4.5 Время и условия экстракции
Задача экстракции из изделий состоит в извлечении максимального количества вредных вешеств, которые могут оказать воздействие на пациента в процессе применения изделия: выход за сутки для изделий кратковременного контакта, выход за сутки и за месяц для изделий длительного контакта, выход за сутки, за месяц и на протяжении жизни для изделий постоянного контакта. Как указано в приложении Д, исчерпывающая экстракция, описанная ниже, является полезным альтернативным методом для оценки изделий постоянного контакта, если учтены ограничения для более короткого периода применения.
4.4.6 Экстракция из изделий
Существуют два основных метода экстракции, которые используют для определения остаточного содержания ЭО после стерилизации: экстракция, моделирующая условия применения в медицинской практике, являющаяся эталонным методом, и исчерпывающая экстракция, которая в ряде случаев является приемлемым альтернативным методом. Выбор метода экстракции должен основываться на предполагаемом способе применения изделия.
В приложении Г приведены примеры предложенных методов экстракции.
Чтобы не занизить реальные величины остаточных количеств веществ, выбранный метод
5
экстракции должен учитывать предполагаемый способ применения изделия с учетом максимального воздействия на пациента.
Температуру и время экстракции выбирают с учетом вида и длительности контакта пациента с изделием в соответствии с 4.2 и 4.3.
4.4.6.1 Экстракция, моделирующая условия применения изделия в медицинской практике (эталон-ный метод)
4.4.6.1.1 Водная экстракция, моделирующая условия применения, является эталонным методом в том смысле, что это единственный метод, который дает результаты, напрямую сравнимые с предельными содержаниями остаточных количеств веществ в соответствии с требованиями 4.3. Эти предельные содержания выражены в дозах ЭО и ЭХГ, воздействующих на пациента.
Так как необходимо оценить остаточные количества веществ, воздействующие на пациента или пользователя в процессе применения изделия в нормальных условиях, требуются методы экстракции, моделирующие условия применения в медицинской практике. Экстракция, моделирующая условия применения изделия, должна проводиться с учетом максимального приближения к процессу применения.
Например, для многих парентеральных изделий или изделий, контактирующих с кровью, может быть использована экстракция водой или другими водными средами путем заполнения или пропускания модельной среды через те пути, по которым протекает кровь или жидкость, там, где это возможно. Экстракцию из образцов проводят в течение времени, равного или превышающего максимальное время использования при однократном применении (что обеспечивает полную экстракцию) и при температуре, максимально приближенной к реальным условиям применения. Альтернативным способом является приготовление серии вытяжек (не менее трех), охватывающих более короткие промежутки времени, на основе которых определяют скорость экстракции для расчета влияния более длительного или многократного воздействия.
Для определения дозы ЭО и, где необходимо, ЭХГ, воздействующей на пациента или пользователя в течение времени применения изделия, используют метод водной экстракции, моделирующей условия применения. Метод экстракции, моделирующей условия применения, должен быть оценен с точки зрения того, насколько точно он отражает реальные количества веществ, воздействующих на пациента.
Примечание — Количества ЭО (или ЭХГ), выделенные путем экстракции, моделирующей условия применения, необязательно должны совпадать с их общим содержанием в изделии.
Для извлечения остаточных количеств ЭО и ЭХГ методом экстракции, моделирующей условия применения, в качестве модельной среды используют воду и другие водные среды (52). Эти водные среды используют для извлечения остаточных количеств ЭО, а не для растворения материала самого образца. Если предполагается моделирование применения изделия путем заполнения, его заполняют таким образом, чтобы не было воздушных мешков. Если анализ проводят не сразу, вытяжку сливают в емкость и герметично закрывают крышкой с прокладкой из политетрафторэтилена.
Свободное пространство в емкости с любым раствором или вытяжкой должно составлять менее 10 % общего объема. Вытяжку можно хранить в холодильнике в течение нескольких суток (приложение Д), но, если использовали водную экстракцию, следует соблюдать осторожность, так как ЭО может превратиться в этиленгликоль или ЭХГ (или в оба продукта) в процессе хранения вытяжки (18). Аналитик должен оценить возможность превращения при хранении.
4.4.6.1.2 Исчерпывающая экстракция представляет собой приемлемый альтернативный метод и может дать полезную информацию. Как правило, остаточные количества веществ, полученные этим методом, соответствуют дозе, большей или равной той, которую может получить пациент. Поскольку данный вид экстракции исключает возможность определения дозы в зависимости от времени, он не гарантирует, что масса остаточного количества ЭО не поступит к пациенту в первые 24 ч или 30 сут воздействия. Однако если все допустимые предельные значения согласно 4.3 соблюдаются и показано, что остаточное содержание веществ укладывается в требования для изделий, подвергаемых исчерпывающей экстракции, нет необходимости проводить в дальнейшем экстракцию, моделирующую условия применения. Когда используют исчерпывающую экстракцию, обращают особое внимание на предельные значения, рассчитанные для первых 24 ч и 30 сут согласно 4.3.
4 4.6.2 Исчерпывающая экстракция (приемлемый альтернативный метод)
4.4.6.2.1 Методы исчерпывающей экстракции предназначены для определения полного содержания остаточных веществ в изделии. Для определения ЭО применяют методы экстракции,
6