Инструкция по применению 33-0102
Экспресс-метод определения антибиотиков в пищевых продуктах
Купить Инструкция по применению 33-0102 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Инструкция устанавливает единую методику лабораторного исследования продуктов питания и других субстратов на наличие в них антибиотиков. Инструкция предназначена для персонала микробиологических лабораторий санитарно-эпидемиологических учреждений Республики Беларусь, а также ведомственных лабораторий, осуществляющих контроль качества продуктов питания.
Оглавление
1 Назначение и область применения
2 Введение
3 Этапы исследования
3.1. Подготовка проб к исследованию при качественном и количественном определении
3.2. Получение и хранение взвеси клеток тест-культур
3.3 Определение "рабочей дозы" тест-культур
3.3.1. Методика определения рабочей дозы тест-культур
3.4. Количественное определение концентрации антибиотиков и расчет активности
3.5. Определение концентрации антибиотиков в испытуемом растворе
3.6. Качественное определение антибиотиков
3.7. Растворы, применяемые для разведения стандартов антибиотиков и испытуемых образцов, реактивы
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Организации:
| 11.07.2002 | Утвержден | Главный Государственный санитарный врач Республики Беларусь | 33-0102 |
|---|---|---|---|
| Разработан | Республиканский центр гигиены и эпидемиологии МЗ РБ |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10
стр. 11
стр. 12
стр. 13
|
УТВЕРЖДАЮ |
ЭКСПРЕСС-МЕТОД ОПРЕДЕЛЕНИЯ АНТИБИОТИКОВ В ПИЩЕВЫХ ПРОДУКТАХ
(инструкция по применению)
Учреждения-разработчики:
Республиканский центр гигиены и эпидемиологии
Авторы:
Голуб В.С, к-м.н. Ф ид аров Ф.М., Федоренчик Л.А., Марейш А.М.
Минск 2002
Настоящая инструкция разработана на основании Методических указаний МУЕС 4.2.026-95 ПНШ1 новых антибиотиков и кафедры микробиологии Российской академии последипломного образования, а также институтом питания РАМН - авторы: Шендерович В. А., Пастернак НА., Столярова Л.Г., Соловьева В.Е., Власова И.В., Ведьмина Е.Л., Шевелева С.А. (Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации (Москва - 1995).
2
|
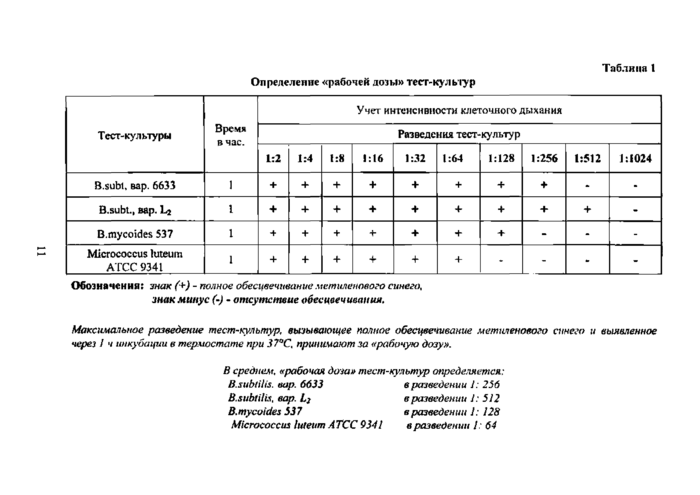
Определение «рабочей дозы» тест-культур Таблица 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Обозначении: знак (+) - полное обесцвечивание метиленового синего, знак минус (-) - отсутствие обесцвечивании.
Максимальное разведение тест-'Культур, вызывающее полное обесцвечивание метиленового синего и выявленное через 1 ч инкубации в терлюстате при 37°С, принимают за «рабочую дозу».
В среднем, «рабочая доза» тест-культур определяется:
B.subtHis. вар. 6633 в разведении 1: 256
B.subtilis, вар. в разведении 1: 512
В, mycoides 337 в разведен и и 1: 128
Micrococcus lufeum АТСС 9341 в разведена и 1: 64
|
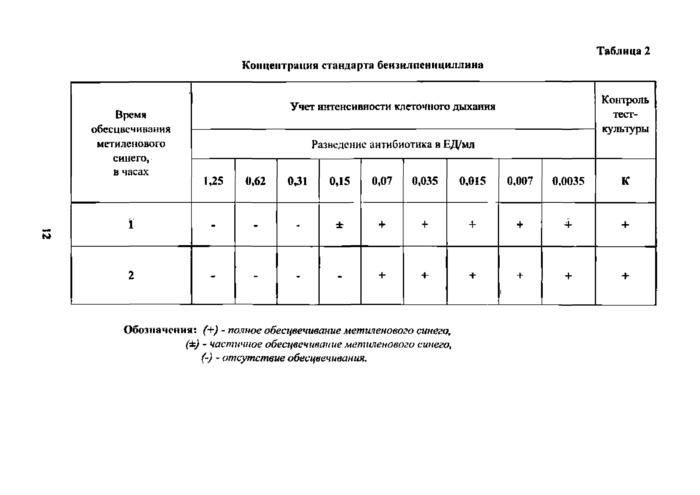
Концентрация стандарта бензнлпсннциллнна Таблица 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Обозначения: (+) - полное обесцвечивание метиленового синего, (±) - частичное обесцвечивание метиленового синего, (-) - отсутствие обесцвечивания.
|
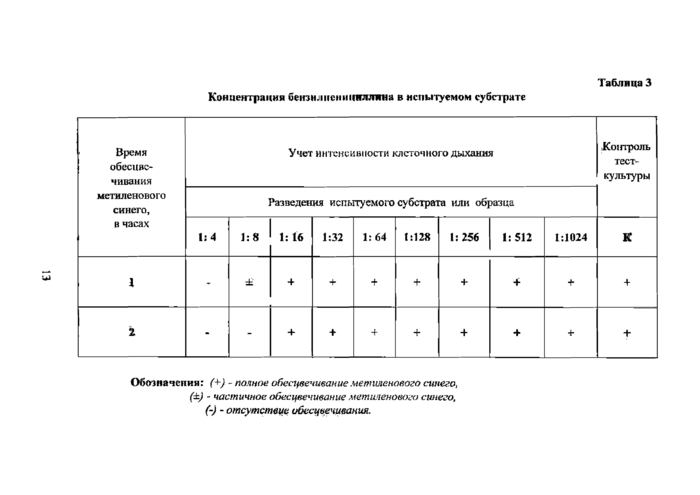
Концентрации бензил иен и кнллина & испытуемом субстрате Таблица 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Обозначении: (+) - полное обесцвечивание метиленового синего, (±) - частичное обесцвечивание метиленового синего, (-) - отсутствие обесцвечивания.
1. НАЗНАЧЕНИЯ И ОБЛАСТЬ ПРИМЕНЕНИЯ
1.1. Настоящая инструкция устанавливает единую методику лабораторного исследования продуктов питания и других субстратов на наличие в них антибиотиков.
1.2. Инструкция предназначена для персонала микробиологических Лабораторий санитарно-эпидемиологических учреждений Республики Беларусь, а также ведомственных лабораторий, осуществляющих контроль качества продуктов питания.
2. ВВЕДЕНИЕ
Данная методика позволяет производить оценку качественного и количественного содержания антибиотиков в пищевых продуктах и других субстратах и основана на подавлении антибиотиком дегидрогеназной активности тест-культур в жидкой питательной среде.
Дегидрогеназы - ферменты, активирующие процессы дыхания в живой клетке, Повреждение дегидрогеназ приводит к нарушению окислительно-восстановительных процессов и гибели клетки.
Высокая чувствительность этих ферментов к неблагоприятным воздействиям использована для выявления повреждающего действия антибиотика на различные тест-кулыуры. В методе используется способность клеток тест-культур восстанавливать метиленовый синий в анаэробных условиях. Если антибиотик оказывает цитотоксическое действие, клетки тест-культур лишаются такой возможности и метиленовый синий не восстанавливается. Метиленовый синий траст в этой системе одновременно роль акцептора водорода и индикатора, позволяющего судить о повреждающем действии антибиотиков на клеточные дегидрогеназы за определенный отрезок времени.
Данные сравнительного изучения экс пресс-метода с общепринятым (диффузии в агар) свидетельствуют о высокой степени корреляции (коэффициент 1М),84—0.93 и значим с вероятностью 99,9 %).
Преимущество экспресс-метода заключается в возможности получения ответа через А—5 ч, относительной простоте и значительной экономии питательной среды.
Методика может быть осуществлена как в качественном, так и в количественном варианте, при этом при подсчете кошентрации выявленного загрязнения использован титрационный принцип, в определенной степени облегчающий постановку анализа в баклабораториях и позволяющий получить достоверные результаты без построения стандартной кривой или расчета по таблицам активности антибиотиков.
Лабораторный контроль, позволяющий выявить непосредственные источники загрязнения и принимать меры, снижающие контаминацию продуктов и, соответственно, риск для потребителей, целесообразно, главным образом, осуществлять в первичном звене получения животноводческой продукции: на молочно-товарных фермах, птицефабриках, в убойных и мясоперерабатывающих цехах хозяйств и т.п., сельскохозяйственных предприятиях, получающих и перерабатывающих продовольственное сырье
3
ж и нот] го го происхождения. Готовая животноводческая продукция также должна контролироваться путем периодического отбора на молочных заводах, мясокомбинатах, птицеперерабатывающих заводах и т. □.
Допустимое содержание антибиотиков в продуктах нс должно превышать: для тетрациклине» 0,01 ЕД, пенициллина 0,01 ЕД, для стрептомицина 0,5 ЕД иа 1 г (мл) продукта.
Метод состоит из нескольких этапов:
1. Подготовка проб к исследованию при качественном и количественном определении
2. Получение и хранение взвеси клеток тест-культур
3. Определение «рабочей дозы» тест-культур
4. Определение концентрации антибиотиков и расчет активности
5. Определение концентрации антибиотиков в испытуемом растворе
6. Качественное определение антибиотиков
3. ЭТАПЫ ИССЛЕДОВАНИЯ
3.1. Подготовка проб к исследованию при качественном и количественном
определении
ЗАЛ. Подготовка проб к исследованию при качественном определении.
Молоко и сливки жидкие (в сыром или пастеризованном виде)
Сырое молоко желательно подвергать исследованию в день отбора, как можно быстрее после получения (отбор на фермах); до начала анализа сохранять в холодильнике ггри температуре (4=1 )°С. Пробу в объеме не менее 10 см3 переносят в пробирку,
Сухие молочные продукты, (сухое молоко, сухие сливки, сухие детские молочные продукты, изготовленные па основе коровьего молока) Непосредственно перед исследованием продукты подвергаются восстановлению в кипяченой воде при температуре не выше (45±1)°С в соответствии с указаниями на этикетке. Образцы тщательно перемешивают, они не должны содержать псрастворенных частиц или комков. Из восстановленного продукта отбирают пробы для анализа в объеме не менее 10
■СВД-
Яица, меланж
Яйца, предназначенные для исследования, предварительно прогревают на водяной бане при температуре (65±1)°С в течение 10—15 мин до коагуляции белка, затем полностью смешивают содержимое яйца, от которого отбирают пробы для анализа в объеме не менее 10 см3.
Мясо и субпродукты Мясо и субпродукты (печень, почки, язык и т. д.) скота и птицы* предназначенные для исследования, измельчают при помощи мясорубки или гомогенизатора, помещают полученный фарш в чашку Петри и дают стечь тканевому соку'. Тканевой сок в объеме не менее 10 см3 переносят в пробирку.
Термическая обработка проб пищевьис продуктов Перед проведением исследования пробирки с отобранными пробами (см. п. 3.1,1) помещают в водяную баню с температурой (60±1)°С. Параллельно с
4
испытуемыми образцами в водяную баню помещают пробирки с аналогичным продуктом и термометром. Время прогревания - 30 мин - отмечают от момента достижения температуры внутри пробирки.
3.1,2, Подготовка проб к исследованию при количественном определении. Молоко, молочные продукты и яйца Для определения концентрации антибиотика в молоке, жидких молочных продуктах, кроме кисломолочных, яйцах, пробы, подготовленные к исследованию (см. п. 3.1.1) в количестве 10 мл или 10 г вносят в колбы емкостью 50 мл и добавляют равное количество (10 мл) буферного раствора соответственно определяемому антибиотику: при определении тетрациклина -цитра жо-солмнокислый буфер № 2; стрептомицина или пенициллина -фосфатный буфер №4и.№ 1, соответственно. Таким образом, получают пробы для исследования, разведенные а 2 раза.
Мясо и мясные продукты Навески по 10 г мышечной ткани, почки, печени, легкого й т. д., вырезанные из средней части образца, измельчают ножницами или микроразмельчителем тканей с последующим растиранием в ступке со стерильным кварцевым песком. Затем в ступку добавляют 10 мл соответствующего буфера, тщательно перемешивают и переносят в центрифужные пробирки.
Экстракцию антибиотика проводят в течение 90 мин в термостате при температуре (37 ±1)°С. Затем пробы npoi-ренают на водяной бане при температуре (65±1)°С 30 мил и центрифугируют при 3000 об/мин в течение 20 мин. Из надосадочной жидкости, являющейся первым разведением ) :2, берут 1 мл и прибавляют 1 мл соответствующего буфера, получают второе разведение 1:4 а т.д. Концентрацию антибиотика определяют п надосадочной жидкости, полученной от каждого образца мяса и мясных продуктов,
3.2. Получение и хранение взвеси клеток тест-культур
Тест-культурами служат вегетативные формы спорообразущих и неспорообразующих культур: Вас. subtilis, вар. 6633; Вас. subtil is, вар.Ь2; Вас. mycoides 537; Micrococcus kit cum АТС С 9341, обладающих высокой чувствительностью к антибиотикам.
Для определения пенициллина и стрептомицина предпочтительно пользоваться спорообразующими тест-культурами: Вас. subtilis, вар. 6633; Вас. mycoides 537; Micrococcus luteum АТСС 9341; для тетрациклина - Вас. subtilis, вар.Ь2.
Музейные штаммы вегетативных форм тест-культур хранят в столбике полужидкого (0,4 %) питательного агара.
Тест-культуру рассевают на чашки с 2 %-ным мясо-пептоыным агаром для получения отдельных колоний. Чашки ставят в термостат при температуре (37±1)°С на 20±3 ч. После этого характерные колонии отсевают в пробирки с 2%-ным мясо-пегггонным скошенным агаром и вновь инкубируют в термостате при температуре (37 ±1)°С в течение 20±3 ч.
Микробную взвесь готовят путем смыва физиологическим раствором суточной культуры со скошенного агара. Важно, чтобы смыв культур был
5
абсолютно гомогенным и не содержал комочков. Полученную взвесь хранят а холодильнике при тем першу ре (4±1)°С нс более 7 дней.
3.3. Определение «рабочей лозы» тест-кулыур
Поскольку количество жизнеспособных клеток тест-культуры от смыва к смыву варьирует, предварительно необходимо определить «рабочую дозу» тест-культуры, т. е. наибольшее разведение суспензии, вызывающее обесцвечивание метиленового синего в определенное время в термостате при температуре (37±1)°С. Следует учитывать, что время обесцвечивания метиленового синего обратно пропорционально количеству клеток в смыве.
Дня постановки реакции выбрано время обесцвечивания, равное 1ч.
Это время, будучи величиной постоянной, выявляет в суспензиях различной плотности одну и ту же клеточную нагрузку для каждой тест-культуры в отдельности. «Рабочую дозу» тест-культур устанавливают по дегидрогеназы ой активности клеток.
3.3.1. Методика определения «рабочей дозы» тест-культур
Полученную взвесь тест-культур титруют путем последовательных двукратных, разведении в объеме 1 мл питательного бульона. Пробирки с тест-кулыурой встряхивают и помещают в термостат при температуре (37±1)°С на 3
ч. Затем для создания условий, близких к анаэробным, в каждую пробирку вносят по 2 мл растопленного и охлажденного до температуры (45±1)°С 1 Ясного питательного агара с метиленовым синим и глюкозой (оба ингредиента асептично вносят в растопленный 1 %-ный питательный агар из расчета: на 100 мл среды 0,4 мл 0,5 %-ного водного раствора метиленового синего и 1 мл 40 %-ного раствора глюкозы. Пробирки встряхивают и вновь инкубируют в термостате при температуре (37 ±1)°С в течение 1—2 ч, после чего учитывают результат (табл. 1). Дыхательные ферменты бактериальных клеток тест-культур восстанавливают метиленовый синий в анаэробных условиях, и содержимое пробирок, имеющее синий цвет, обсс-цвсчивается. Разведение тест-культуры в последней пробирке с обесцвеченным метиленовым синим (+) принимают за «рабочую дозу». Функциональная активность дегидрогеназ тест-культур стабилизируется через сутки после получения смыва, который хранится в холодильнике а течение 1 недели. Поэтому «рабочую дозу» первый раз определяют через сутки, а затем - через 3 дня.
3.4, Количественное определение концентрации антибиотиков и расчет активности
При определении концентрации антибиотика в пищевых продуктах параллельно ставят контрольный ряд с известным содержанием антибиотика в пробирках. Для этого навеску стандарта антибиотика (1 мг) растворяют в 1мл соответствующего буфера, получая, таким образом, основной раствор стандарта 1000 мкг/мл. Затем основной раствор десятикратно разводят до получения 100 мкг/мл и 10 мкг/мл. Далее концентрации, с которых начинается титрование стандарта в контрольном ряду (2,0; 1,0; 0,5 мкг/мл и т, д,), разводят соответствующими буферными растворами.
Титрование стандарта-антибиотика и испытуемых образцов проводят путем двукратных разведении в объеме 0,5 мл мя со-пе птонного бульона. Последняя
б
пробирка в контрольном ряду не содержит антибиотик и служит контролем дегидрогеназ ной активности клеток тест-культуры.
После этого во все пробирки вносят 0,5 мл взвеси, содержащей двойную «рабочую дозу» тест-культуры* т. е. предпоследнее разведение тест-культуры, вызывающее обесцвечивание метиленового синего через 1 ч, В результате микробная нагрузка в пробирках уменьшается вдвое и соответствует «рабочей дозе» тест-культуры.
Пробирки встряхивают и помещают в термостат при температуре (37±1)°С на 3-часовую экспозицию тест-культуры с антибиотиком. Затем в каждую пробирку добавляют по 2 мл 1%-ного мясо-пелтон-ного агара с метиленовым синим и глюкозой. Содержимое пробирок вновь смешивают и инкубируют при температуре (37±1)°С в термостате.
Если в исследуемом объекте содержится антибиотик, то он блокирует дыхательные ферменты бактериальных клеток тесг-культур и вызывает их гибель. В этих пробирках метиленовый синий не обесцвечивается.
О степени активности антибиотика судят по его минимальной концентрации* которая вызывает полное подавление дегидрогеназ клеток тест-культур через 1 или 2 ч инкубации в термостате при температуре (37±1)11С по сравнению с контролем.
3.4J. Определение концентрации ёензтпеницштина, стрептомицина и
тетрац икота.
Приготовление стандарта 6ен:шлпениишглина Во флакон, содержащий 500000 ЕД натриевой соли бензилпсншшллина товарного препарата для инъекций, добавляют 10 мл 0,066 М фосфатного буфера pH 7,0. Концентрация исходного раствора пенициллина составляет 50000 ЕД/мл. Далее получают 5000 ЕД/мл, разводя этот раствор в 10 раз. К 1 мл этого раствора прибавляют 4 мл 0,066 М фосфатного буфера, pH 7,0. Получают основной раствор пенициллина - 1000 ЕД/мл. Затем разводят десятикратно 0,066 М фосфатным буфером pH 7,0 до 100 и 10 ЕД/мл. После этого 0,5 мл последнего разведения, т. е. 5 ЕД/мл, добавляют в 1-ю пробирку с заранее разлитым по 0,5 мд мясо-нептишшм бульоном. Получают разведение пенициллина в 1-й пробирке - 2,5 ЕД/мл. Далее* делают двукратные разведения антибиотика в 0,5 мл мясо-пептонного бульона. Во все пробирки добавляют 0*5. мл взвеси, содержащей двойную «рабочую дозу» тест-культуры. В результате микробная нахрузка во всех пробирках уменьшается вдвое и соответствует «рабочей дозе» тест-культуры, при этом концентрация пенициллина в 1-й пробирке уменьшается еще в 2 раза и соответствует 1,25 ЕД/мл. Таким образом» получают разведения пенициллина:
в 1-й пробирке 1,25 ЕД в 6-й пробирке 0,035 ЕД во 2-й пробирке 0,62 ЕД в 7-й пробирке 0,017 ЕД в 3-й пробирке 0,31 ЕД в 8-й пробирке 0,008 ЕД
в 4-й пробирке 0,15 ЕД в 9-и пробирке 0,004 ЕД
в 5-й пробирке 0,07 ЕД
Последняя 10-я пробирка не содержит антибиотик и служит контролем дегидрогеназной активности тест-кулыуры (табл. 2).
7
Приготовление стандарта стрептомицина Во флакон, содержащий 500000 ЕД стрептомицина сульфата товарного препарата для инъекций, добавляют 10 мл 0,066 М фосфатного буфера pH 6,0— 6,2. Концентрация исходного раствора стрептомицина составляет 50000 ЕД/мл. Далее исходный раствор разводят в 10 раз 0,066 М фосфатным буфером, pH 7,8—8,0. Получают раствор 5000 ЕД/мл.
Последующие разведения готовят на 0,066 М фосфатном буфере, pH 7,8— 8,0, аналогично вышеописанной схеме приготовления бензил пенициллина.
Приготовление стандарта тетрациклина Для приготовления исходных растворов антибиотиков могут быть использованы лекарственные препараты антибиотиков или стандарты препаратов с известной активностью. В первичном растворе каждого антибиотика учитывают его активность в 1 мг (при использовании стандарта препарата) или содержание активного вещества в лекарственной форме (например, 100000 ЕД во флаконе). Основную концентрацию 1000 ЕД/мл или 1000 мкг/мл готовят, разводя препарат во флаконе, содержащем 100000 ЕД тетрациклина, в 100 раз.
При активности стандарта тетрациклина 850 мкг/мл в 10 мг навески содержится 8500 мкг антибиотика.
Для получения первого разведения основного раствора стандарта антибиотика в 1000 мкг устанавливают необходимый объем растворителя: 850 х 10=8500: 1000= 8,5 мл. Таким образом, навеску тетрациклина 10 мг растворяют в 8,5 мл 0,01 Н НС1 и получают концентрацию основного раствора 1000 мкг/мл. Приготовленный основной раствор может храниться в холодильнике в течение 7 дней.
Далее основной раствор 1000 мкг/мл разводят десятикратно щпратно-солянокислым буфером, pH 6,0—6,2, до 100 и 10 мкг/мл. Вес последующие разведения готовят также на цитратно-солянокиелом буфере, pH 6,0—6,2, и проводят расчеты активности стандарта тетрациклина аналогично схеме расчета по пенициллину и стрептомицину,
3,5, Определение концентрации антибиотиков в испытуемом растворе Параллельно ставят второй ряд с двукратными разведениями испытуемого субстрата в пробирках с заранее разлитым мясо-пептонным бульоном в объеме 0,5 мл. Во все пробирки этого ряда также вносят 0,5 мл взвеси, содержащей двойную «рабочую дозу» тест-культуры, т.е. предпоследнее разведение тест-культуры, вызывающее полное обесцвечивание метиленового синего через 1 ч инкубации » термостате). В результате микробная нагрузка уменьшается вдвое и соответствует «рабочей дозе» тест-культуры.
Таким образом, 1-я пробирка каждого ряда, контрольного и испытуемого, начинается с разведения 1:4.
Последняя пробирка не содержит испытуемого субстрата и служит контролем ферментативной активности тест-культуры.
Пробирки встряхивают и помещают в термостат на 3-часовую экспозицию тест-культуры с антибиотиком. Затем для создания условий, близких к анаэробным, в каждую пробирку добавляют по 2 мл 1%-ного мяео-пептонного
агара с метиленовым синим и глюкозой. Содержимое пробирок встряхивают и инкубируют в термостате при температуре (37±1)°С.
Учет результатов производят по тесту подавления антибиотиком дегидрогеназной активности тест-культуры через I или 2 ч инкубации в термостате (табл.З).
Концентрацию антибиотика в исследуемом субстрате с неизвестным его количеством вычисляют путем умножения последнего разведения субстрата, подавляющего дегидрогеназную активность тест-культуры (табл. 3), на минимальную концентрацию антибиотика контрольного ряда стандарта, вызывающего тот же эффект (табл. 2).
Как видно из табл. 2, последнее разведение стандарта бензилпетщшшша вызывает полное подавление активности дыхательных ферментов тест-культуры, по сравнению с контролем, только через 2 ч инкубации в термостате и составляет 0,07 ЕД/мл. Через J ч инкубации антибиотик вызывает лишь частичное подавление дегидрогеназной a ter и в пости клеток. Таким образом, концентрация пенициллина, вызывающая полное подавление дегидрогеназ клеток тест-культуры, соответствует 0,07 ЕД/мл через 2 ч инкубации в термостате при температуре (37 ±1 )°С.
Учесть результат в данном опыте возможно только через 2 ч инкубации по полному подавлению дегидрогеназной активности клеток тест-культуры, которое наблюдается в разведении 1:8, так как через 1ч инкубации испытуемый субстрат вызывает лишь частичное подавление активности дыхательных ферментов тест-культуры по сравнению с контролем (табл. 3).
Содержание пенициллина в исследуемом субстрате вычисляют, умножив последнее разведение субстрата, подавляющее дегидрогеназную активность клеток тест-культуры, на минимальную концентрацию антибиотика контрольного ряда стандарта, вызывающего тот же эффект, т. е, 0,07 х 8 = 0,56 ЕД/мл. Таким образом, в испытуемом субстрате содержится 0*56 ЕД/мл пенициллина.
3.6. Качественное определение антибиотиков
Качественное определение антибиотиков в пищевых продуктах можно проводить по вышеописанной методике. (3.5)
3.6.1. Проведение анализа.
Подготовленные к исследованию испытуемые пробы (см. 3.1.1) в объ-еме 0,5 мл вносят в пробирки с таким же (0,5 мл) количеством мясо-пептонного бульона и тщательно перемешивают. Во все пробирки добавляют 0,5 мл взнеси, содержащей двойную «рабочую дозу» тест-культуры.
Последняя пробирка ис содержит испытуемого субстрата и служит контролем ферментативной активности тест-культуры.
Пробирки встряхивают и помещают в термостат на 3-часовую экспозицию тест-культуры с испытуемым субстратом, после этого в каждую пробирку вносят по 2 мл расплавленного и охлажденного до (45±1)°С мясо-пептонного агара с метиленовым синим и глюкозой. Содержимое пробирок смешивают и вновь инкубируют в термостате при температуре (37±1 )‘*С в течение 1—2 ч.
3.6.2. Учет результатов
1. При отсутствии в испытуемых образцах антибиотика дыхательные ферменты бактериальных клеток тест-культур не нарушаются и восстанавливают (т, е. обесцвечивают) в анаэробных условиях метиленовый синий,
2. В контрольной пробирке, где нет испытуемого образца, также происходит обесцвечивание в течение 1—2 ч наблюдения в термостате при температуре (37±1)°С (контроль ферментативной активности бактериальных клеток тест* культуры).
3. При наличии антибиотика в испытуемом образце дыхательные ферменты бактериальных клеток блокируются, метиленовый синий не восстанавливается и цвет пробирок ие изменяются и остается синим.
4. Параллельно в качестве второго контроля можно использовать субстраты, содержащие определенную концентрацию антибиотика.
3.7. Растворы, применяемые для разведения стандартов антибиотиков и испытуемых образцов, реактивы.
3. 7.1. Бензштетщмитн.
Основной раствор стандарта, рабочие разведения стандарта и испытуемый раствор готовят на буфере № 1 — 0,066 М фосфатный (pH 6,8—7,0).
Состав буфера; Калия фосфат однозамещенный - 3,63 г.
Натрия фосфат двузамещенный - 7,13 г;
Вода дистиллированная - до 1000 мл.
3.7.2 Стрептсшиции сульфат Основной раствор стандарта готовят на буфере № 3 - 0,066 М фосфатный (pH 6,0—6,2),
Состав буфера: Калия фосфат однозамещенный * 7,72 г;
Натрия фосфат дву замещенный -1,78 г;
Вода дистиллированная - до 1000 мл.
Рабочие разведения стандарта и экстракцию испытуемых образцов готовят на буфере № 4 - 0,066 М фосфатный (pH 7,8—8,0).
Состав буфераКалия фосфат однозамещенный - 0,68 г;
Натрия фосфат дву замещенный - 10,99 г;
Вода дистиллированная - до 1 ООО мл,
3.7.3. Тетрациклины.
Основной раствор стандарта растворяют в 0,01 Н соляной кислоте (НС1). Рабочие разведения стандарта и экстракцию испытуемых образцов готовят на буфере № 2 - цитратно-солянокислый (pH 5,8—6,0).
Состав буфера: Натрия цитрат трехзамещенный - 20,6 г;
Соляная кислота концентрированная -1,81 мл;
Вода дистиллированная — до 1 ООО мл.
3.7»-#. Мясо-пептонный бульон (МПБ)и мясо-нетпошшй агар (МПА). Производят согласно ГОСТ 9225-84; ГОСТ 18963-73,
3.7.5. 0+5 %-пый водный раствор метиленового синего.
3.7.6. 40%-ный коммерческий раствор глюкозы
10