Государственное санитарно-эпидемиологическое нормирование
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
ЛАБОРАТОРНАЯ
ДИАГНОСТИКА
ГЕЛЬМИНТОЗОВ
И ПРОТОЗООЗОВ
* -v * - ' Методические указания
МУК 4,2.3145-13
Издание
официальное
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика гельминтозов и протозоозов
Методические указания МУК 4.2.3145-13
2-е издание, исправленное и дополненное
но доставить в лабораторию пробы кала без консерванта, собранные в этот день в чистую сухую посуду. Особенно это касается случаев «диареи путешественников», вернувшихся из стран тропического и субтропического пояса. Рекомендации по сбору и подготовке материала к исследованию следует вручать пациентам вместе с контейнером.
Подготовка к исследованию препаратов кала, собранного в консервант
1) Тщательно перемешать содержимое контейнера, содержащего трехкратную пробу кала в консерванте, встряхиванием или стеклянной палочкой.
2) В центрифужную пробирку поместить воронку, на неё — 2 слоя марли (можно также использовать металлические или пластмассовые ситечки).
3) Профильтровать не менее 8 мл суспензии из контейнера (если объем фильтрата будет меньше, добавить 10 %-й раствор формалина до 8 мл).
4) Долить в пробирку 2 мл эфира и закрыть пробкой.
5) Энергично встряхивать пробирку не менее 30 с.
6) Центрифугировать при 1 500 об./мин в течение 2 мин или при 2 ООО об./мин в течение 1 мин.
7) После центрифугирования образуются 4 слоя: осадок, раствор формалина, коагулированный белок, фекальный детрит—«пробка», а сверху эфир с растворенными в нем жирами.
8) Верхние 3 слоя удалить резким опрокидыванием пробирки (полипропилен легко отделяет «пробку»),
9) Препараты микроскопировать при увеличении: объектив х8 или хЮ, окуляр х7 или хЮ, для уточнения морфологического строения яиц гельминтов — объектив х40.
10) Просмотр препарата производить без добавления раствора Л юголя.
Для продолжения подготовки к исследованию на наличие возбудителей протозойных инфекций необходимо:
1) Осадок суспендировать: одну каплю поместить на предметное стекло, а рядом на вторую каплю нанести 2 %-й раствор Люголя. Препараты накрыть покровными стеклами.
2) Микроскопировать сначала при малом увеличении (окуляр хЮ, объектив хЮ) — обзорная микроскопия; а затем при увеличении окуляр х10, объектив х40.
3) Метод седиментации для исследования нефиксированного кала (пробы кала без консерванта) на наличие возбудителей протозойных инфекций излагается в разделе 2.
Примечание. В методе формалин-эфирной седиментации формалин можно заменить 5 %-м водным раствором уксусной кислоты. Ход исследования остается без изменений.
1.1.1.2.3. Модификация метода седиментации с применением одноразовых концентраторов «PARASEP»
Необходимые реактивы и оборудование
Комплект концентраторов (разборные пластиковые пробирки) 40 шт., содержащие необходимые для работы готовые реактивы Центрифуга Микроскоп Пипетки
Обезжиренные предметные и покровные стекла Подготовка к исследованию
1) В смесительной камере пробирки-концентратора содержится 2,4 мл 10 %-го буферного раствора формалина с 1 каплей тритона-Х-100.
2) Перед взятием пробы добавляют в пробирку 0,9 мл раствора этилацетата (флакон с реактивом прилагается в упаковке с модулями «PARASEP»).
10
МУК 4.2.3145-13
3) Пробу кала массой 1,0 г лопаткой-фильтром опускают в полученный раствор.
4) Камеру с образцом присоединяют к пробирке, закрыв замок (закрутить до щелчка). Тщательно встряхивают систему в течение 30 с до получения однородной взвеси.
5) В таком состоянии образец может храниться в течение 24 ч при комнатной температуре (18—24 °С) и до 30 суток в холодильнике (4 °С).
6) После получения взвеси систему переворачивают и конической стороной помещают в центрифугу и центрифугируют при скорости 2 500—3 000 об./мин в течение 1—3 мин, при скорости 1 500 об./мин — 5 мин.
7) В конической части пробирки остается жидкая часть пробы с выделившимися в нее яйцами гельминтов, цистами простейших.
8) Отсоединяют модуль с фильтром (держать строго вертикально!), избегая перемешивания жидкости с осадком. Фильтровальный модуль утилизируется после обеззараживания (кипячением, автоклавированием). Коническая часть пробирки остается для микроскопирования.
9) При образовании «пробки» из этилацетата и жировых частиц необходимое удалить, обведя стеклянной палочкой.
10) Для микроскопирования с помощью пипетки из нижней пробирки на предметное стекло переносят 2 капли пробы осадка.
11) Осадок суспендировать: одна капля осадка помещается на предметное стекло, а во вторую каплю наносится 2 %-й раствор Люголя. Препараты накрываются покровными стеклами.
12) Микроскопируют при увеличении: окуляр хЮ, объективы х10, х40.
13) При использовании для микроскопии рабочей станции FE-5 из процесса исследования можно исключить предметные и покровные стекла.
Примечание. Если пробы кала доставлены в консерванте (например, Турдыева), то их центрифугируют при 1 000—1 500 об./мин, надосадочную часть сливают. Осадок исследуется согласно пп. 1-12.
Применение. Метод модификации облегчает визуализацию искомых патогенов, обеспечивает их качественное и количественное определение в субстрате; исключает необходимость приобретения дополнительных реактивов.
1.1.1.2.4. Модификация метода седиментации с применением минисистемы «Real»
Необходимые реактивы и оборудование
Комплект «концентратор—минисистема «Real», содержащий готовые реактивы
«Экосаф»
Обезжиренные предметные и покровные стекла
Пипетки
Раствор Люголя 2 %-й
Центрифуга
Микроскоп
Подготовка к исследованию
1) Минисистема «Real» состоит из двух герметически соединенных пробирок. Верхняя пробирка содержит 4,0 мл консервирующей смеси «Экосаф», стеклянные бусы и фильтр, в крышку вмонтирована ложечка для сбора кала.
2) В смеси «Экосаф» минисистемы «Real» содержится: ацетат натрия — 0,9 %; ледяная уксусная кислота — 2,0%; формальдегид 34—38 % — 1,6 %; метанол — 0,4 %; неионный детергент Тритон Х-100 — 0,16 %; дистиллированная вода.
3) Пробу кала объемом одной ложечки минисистемы «Real» помещают в верхнюю пробирку со смесью «Экосаф». Крышка пробирки плотно закручивается.
4) Пробирка минисистемы «Real» с пробой кала энергично встряхивается в течение 30 с до получения однородной взвеси.
11
5) После получения взвеси пробирка переворачивается верх дном, отвинчивается нижняя крышка и к ней плотно закручивается коническая центрифужная пробирка.
6) Герметически соединенные верхняя и нижняя пробирки помешают в центрифугу и центрифугируют в течение 3 мин при скорости 2 ООО об./мин.
7) В процессе центрифугирования происходит фильтрация суспензии.
8) В конической части нижней пробирки остается жидкая часть пробы с выделившимися в нее возбудителями кишечных паразитозов.
9) Отсоединяют верхнюю пробирку с фильтром, которая помещается в дезинфекционный раствор для обеззараживания.
10) Для микроскопирования с помощью пипетки из нижней пробирки на предметное стекло переносят 2 капли пробы осадка.
11) Осадок суспендируется: одна капля осадка помещается на предметное стекло, а во вторую каплю наносится 2 %-й раствор Люголя. Препараты накрываются покровными стеклами.
12) Микроскопируют при увеличении: окуляр хЮ, объективы х10, х40.
Примечание. Если пробы капа доставлены в консерванте (например, Турдыева), то отобранную пробу кала центрифугируют при 1 000—1 500 об./мин, надосадочную часть жидкости сливают. Осадок исследуется согласно пп. 3—11.
Применение. Модифицированный метод седиментации с применением минисистемы «Real» имеет все преимущества методов седиментации. Дополнительным преимуществом метода является отсутствие летучих ингредиентов в составе реактива «Экосаф».
1.1.1.2.5. Методы исследования кала с применением флотационных растворов
В основе методов флотации (всплывания) лежит разность удельного веса флотационного раствора и яиц гельминтов, удельный вес флотационного раствора выше, в результате яйца гельминтов всплывают на поверхность жидкости и обнаруживаются в поверхностной пленке.
Необходимые реактивы и оборудование
Один из флотационных растворов
Ареометр
Предметные стекла (обезжиренные)
Пипетки стеклянные
Химические стаканчики емкостью 30—50 мл
Кюветы эмалированные
Стеклянные или деревянные палочки
Подготовка к исследованию
1) Приготовление флотационного раствора по одной из двух прописей:
а) раствор № 1. Раствор нитрата натрия (NaN03) или азотно-кислого натрия (предложенный Калантарян) с плотностью 1,38—1,40 готовят из расчета 1 000 г вещества на 1 л горячей воды;
б) раствор №2. Насыщенный раствор хлорида натрия (NaCl) с плотностью 1,18—1,20 (предложенный Фюллеборном) готовят из расчета 400—420 г соли на 1 л кипящей воды.
2) Одну из солей растворяют в горячей воде в эмалированной посуде, причем кладут соль в емкость с горячей водой порциями при подогревании на плите и постоянном перемешивании до полного растворения.
3) Удельный вес флотационных растворов измеряется ареометром только после остывания раствора при комнатной температуре.
4) Измерение удельного веса флотационного раствора ареометром строго обязательно, так как приготовление раствора по прописи не гарантирует получение нужного удельного веса (например, когда используемая соль недостаточно химически чистая).
МУК 4.2.3145-13
5) Фильтровать приготовленные растворы необязательно. Если раствор приготовлен в большом количестве, то в последующие дни перед исследованием его подогревают с размешиванием осадка и после остывания раствора снова измеряют ареометром удельный вес.
Подготовка предметных стекол: предметные стекла обязательно обезжирить, например в смеси Никифорова (равные части этилового спирта и эфира).
Подготовка к исследованию
1) В химический стаканчик объемом 30—50 мл налить небольшое количество одного из двух флотационных растворов.
2) Поместить в стаканчик 2,5 г кала.
3) Тщательно размешать палочкой (индивидуальной для каждого обследуемого).
4) Удалить сразу же после размешивания всплывшие крупные частицы палочкой (или ложечкой с дырочками).
5) Добавлять постепенно солевой раствор до образования выпуклого мениска.
6) Накрыть стаканчик обезжиренным стеклом.
7) Оставить взвесь на 30 мин при использовании растворов № 1 и 2.
8) Микроскопировать при увеличении: объектив х8, хЮ, окуляр х7, х10, уточнение морфологического строения — окуляр х40.
9) При невозможности микроскопирования сразу после снятия стекла необходимо добавить несколько капель глицерина и прикрыть покровным стеклом.
10) При использовании раствора № 2 необходимо просматривать не только стекло, но и осадок для выявления тяжелых яиц трематод.
1.1.1.3. Методы исследования кала на личинки гельминтов Метод Бермана
Применяется как специальный метод для диагностики стронгилоидоза и основан на положительном гидротаксисе личинок.
Необходимое оборудование
Штатив
Стеклянная воронка (диаметром 10 см)
Металлическое сито или сетка «мельничный газ»
Резиновая трубка с зажимом
Пред метные стекла
Стеклянные или деревянные палочки
Чашки Петри
Центрифуга
Микроскоп
Подготовка к исследованию
1) Собрать аппарат Бермана, для чего закрепить в штативе стеклянную воронку с металлическим ситом. На нижний конец воронки надеть резиновую трубку с зажимом.
2) Пробу кала весом 20—50 г поместить на металлическое сито или мелкоячеистую металлическую сетку, или сетку «мельничный газ».
3) Сетку с пробой кала приподнять и в воронку7 налить воду7 таким образом, чтобы нижняя часть сетки с калом была погружена в воду.
4) Через 24 ч зажим на резиновой трубке быстро открыть и жидкость спустить в центрифужную пробирку.
5) Полученную жидкость центрифугировать 1—2 мин.
6) Над осадочную жидкость быстро слить.
7) Осадок нанести на предметное стекло или в чашку Петри.
8) Можно спустить жидкость в чашку Петри и исследовать без центрифугирования с использованием стереомикроскопа. При обнаружении личинок для их обездвиживания внести одну каплю раствора Люголя, личинку перенести на предметное стекло и прикрыть покровным.
13
9) Микроскопировать при увеличении: объектив х8 или хЮ, окуляр х7 или х10, уточнение морфологического строения при увеличении: объектив х40, окуляр хЮ.
Метод Бермана в модификации Супряги Необходимые реактивы и оборудование Дистиллированная вода Химические стаканчики Стеклянные палочки Чашки Петри Пробирки центрифужные
Микроскоп бинокулярный стереоскопический (МБС)
Подготовка к исследованию
1) В химический стаканчик положить пробу кала весом 10—15 г.
2) Залить теплой (40 °С) дистиллированной водой, чтобы проба кала была полностью покрыта.
3) Через 20—30 мин слить жидкость в центрифужные пробирки.
4) Отстаивают 10—15 мин или центрифугируют 1 мин при 1 500 об./мин.
5) Слить осторожно надосадочную жидкость, осадок поместить в чашку Петри.
6) Исследовать осадок в чашке Петри под стереомикроскопом (с нижней подсветкой): объектив х2, окуляр х12, х14, обращая внимание на подвижные, слабо-подвижные и неподвижные личинки.
7) Неподвижные личинки микроскопируют с увеличением: объектив х8, хЮ и х40; окуляр хЮ.
Эффективность метода. Эффективен при высокой и средней интенсивности инвазии.
Метод Харады—Мори в модификации Маруашвили (метод культивирования личинок на фильтровальной бумаге) Применяется для диагностики анкилостомидозов.
Необходимые реактивы и оборудование Фильтровальная бумага (размером 16 х 3,5 см)
Стеклянная банка (0,7—0,8 л)
Полиэтиленовая пленка Термостат Центрифуга Водяная баня
Подготовка к исследованию
1) На фильтровальную бумагу нанести свежевыделенные фекалии в виде мазка, оставляя края фильтровальной бумаги свободными.
2) Смочить стенки банки водой, опустить в банку фильтровальную бумагу и поверхностью без фекалий зафиксировать ее на стенках банки.
3) Налить в банку воды так, чтобы в нее был погружен нижний конец бумаги без фекалий.
4) Верх банки закрыть полиэтиленовой пленкой или чашкой Петри.
5) Банку поставить в термостат при температуре 28 °С на 5—6 дней (в теплое время года банку можно оставлять при комнатной температуре, увеличив экспозицию до 8—10 дней).
6) Часть личинок может подняться вверх по фильтровальной бумаге, поэтому работа должна проводиться с соблюдением техники безопасности.
7) Для безопасности можно предварительно убить личинки, поместив пробирку в водяную баню при температуре 50 °С на 15 мин.
Эффективность метода. Эффективен для обнаружения и идентификации личинок анкилостомид.
МУК 4.2.3145-13
1.1.1.4. Методы исследования перианальных отпечатков
Применяются для выявления яиц остриц и онкосфер тениид при индивидуальных и массовых обследованиях.
Необходимые реактивы и оборудование
Кроме микроскопа, необходимое оборудование зависит от способа получения отпечатка: предметные стекла, полоски прозрачной липкой ленты (скотч), глазные палочки со специальным клеевым слоем.
Подготовка к исследованию
При массовых обследованиях населения (в основном детского) заранее подготовить предметные стекла с липкой лентой, флаконы или специальные штативы с глазными палочками, покрытыми клеевым слоем. Промаркировать предметные стекла, флаконы либо маркировать во время забора материала у обследуемых согласно номеру по списку.
Ход исследования зависит от способа отбора материала.
Метод исследования перианального отпечатка с применением липкой ленты по Грэхэму
Подготовка к исследованию
1) Подготовить отрезок липкой ленты длиной 8—10 см, предварительно наклеить его на предметное стекло.
2) Перед взятием анализа отклеить полоску липкой ленты от предметного стекла, держа полоску за концы, плотно прижать всей липкой поверхностью к периа-нальным складкам, стараясь пальцами рук не касаться перианальной области.
3) Отклеить полоску липкой ленты от кожи перианальной области и липким слоем вниз ленту перенести на предметное стекло, приклеить к стеклу равномерно для предотвращения образования воздушных пузырей, мешающих микроскопии.
4) Концы ленты, выходящие за края стекла, отрезать.
5) Микроскопировать при увеличении: объектив х8 или хЮ, окуляр х7 или х10.
Примечание. Для постановки метода пригодна полиэтиленовая прозрачная пленка с липким слоем для детского технического творчества (скотч).
Метод исследования перианального отпечатка с применением стеклянных глазных палочек с клеевым слоем по Рабиновичу
Пропись клея: клеол — 10 мл, касторовое масло — 2,5 мл, этиловый эфир — 5 мл, этиловый спирт 96,5 %-й — 2,5 мл (хранение во флаконе по 20,0 мл с плотно притертой пробкой).
Подготовка к исследованию
1) Подготовить стеклянные глазные палочки (лучше с широкими лопаточками): промыть, обезжирить и простерилизовать (кипячением или автоклавированием), высушить; сухую лопаточку глазной палочки обмакнуть в клей; просушить не менее 2—4 ч (глазная палочка при этом должна находиться лопаточкой вверх для стекания избытка клея и образования равномерной пленки).
2) Клей, обтекая лопаточку, образует прозрачную клейкую пленку, сохраняющуюся после высыхания не менее недели (что позволяет готовить палочки заранее).
3) Установить глазные палочки в специальный штатив, где каждая ячейка имеет свой номер, или использовать пронумерованные пенициллиновые флаконы, предварительно закрепив ручку глазной палочки в резиновой пробке от этого пузырька.
4) Взять отпечаток путем плотного прижатия плоских частей глазной лопаточки к коже перианальных складок.
5) Снова укрепить палочку в штативе или пенициллиновых пузырьках (промаркированных соответственно номеру, присвоенному обследуемому по списку, или регистрационному номеру в журнале) для доставки в лабораторию.
6) Укрепить глазную палочку в специальном держателе для просмотра под микроскопом.
15
7) Микроскопировать непосредственно плоскую поверхность лопаточки поочередно с обеих сторон при увеличении: окуляр х7 или хЮ, объектив х8 или хЮ.
8) Использованные палочки дезинфицировать кипячением в мыльном растворе, тщательно промыть, прополоскать, обезжирить в смеси Никифорова, просушить в сухожаровом шкафу. Штатив и кассеты обработать 70 %-м спиртом и промыть мыльно-содовым раствором. Пенициллиновые пузырьки и резиновые пробки дезинфицировать кипячением или автоклавированием.
Метод перианалъного соскоба по Торгушину
1) Ватный тапмон, накрученный на деревянном или стеклянном шпателе, смочить в растворе глицерина.
2) Обтереть тампоном перианальные складки вокруг ануса.
3) На предметное стекло поместить каплю глицерина.
4) Слегка ударяя по предметному стеклу обмыть тампон в капле глицерина. Препарат микроскопировать без покровного стекла; увеличение: объектив х8
или хЮ, окуляр х7 или хЮ.
1.1.1.5. Методы исследования желчи дуоденального содержимого (желчи, мокроты, лаважной жидкости и мочи)
Применяются для выявления яиц трематод (возбудителей описторхоза, кло-норхоза, фасциолеза, дикроцелиоза), а также возбудителей стронгилоидоза, трихо-стронгилидозов и анкилостомидозов.
Необходимые реактивы и оборудование Этиловый эфир
Обезжиренные предметные и покровные стекла
Палочки стеклянные или деревянные
Пипетки
Чашки Петри
Центрифужные пробирки
Центрифуга
Микроскоп
Методы исследования дуоденального содержимого (желчи) Подготовка к исследованию
1) Выбрать сгустки слизи, волокон, патологические примеси.
2) Палочкой стеклянной или деревянной (можно пипеткой) нанести тонким слоем желчь на предметное стекло (мазок не должен стекать с предметного стекла), прикрыть покровным стеклом.
3) Микроскопировать при увеличении: объектив х8 или хЮ, окуляр хЮ; для уточнения морфологии яиц гельминтов объектив х40.
4) При исследовании в чашке Петри налить желчь тонким слоем на дно чашки.
5) Для обнаружения подвижных личинок стронгилид можно микроскопировать в чашках Петри под стереомикроскопом МБС (окуляр х8; объектив х4—7).
Методы исследования желчи с центрифугированием Подготовка к исследованию
1) При наличии в желчи большого количества слизи или гноя взболтать все порции с равным количеством эфира.
2) Центрифугировать в центрифужных пробирках все порции дуоденального содержимого 10 мин при 1 500—2 ООО об./мин.
3) Надосадочную часть желчи слить в отдельную емкость.
4) Осадок перенести пипеткой или прямо из пробирки на предметное стекло.
5) Микроскопировать при увеличении: объектив х8 или хЮ, окуляр хЮ, для уточнения морфологии яиц гельминтов — объектив х 40.
МУК 4.2.3145-13
Методы исследования мокроты и лаважной жидкости Применяются для выявления возбудителей легочных гельминтозов (параго-нимоза, томинксоза). Иногда, при поражении легких и прорыве пузырей в бронх, можно обнаружить личиночные стадии эхинококков (сколексы эхинококка, аль-веококка).
Необходимые реактивы и оборудование Раствор едкой щелочи (NaOH или КОН) 0,5 %-й Центрифужные пробирки
Предметные и покровные стекла, большие предметные
стекла
Центрифуга
Микроскоп
Методы исследования нативного мазка мокроты Подготовка к исследованию
1) При слизисто-гнойной мокроте для лучшего растворения слизи, гноя необходимо: мокроту смешать с равным объемом 0,5 %-го раствора едкой щелочи; слегка подогреть пробирку на водяной бане; пробирку энергично встряхивать в течение 5 мин.
2) Мокроту из пробирки пипеткой переносят на предметное стекло (лучше использовать широкое предметное стекло).
3) Приготовить мазок путем равномерного растирания между двумя предметными стеклами или нанесения и равномерного растирания палочкой на большом предметном стекле.
4) Микроскопировать при увеличении: объектив х8 или х10, окуляр х10.
Методы исследования нативного мазка мокроты и лаважной жидкости с центрифугированием
Подготовка к исследованию
1) Перелить мокроту (лаважную жидкость) в центрифужные пробирки.
2) Центрифугировать в течение 3—5 мин при 1 500 об./мин.
3) Перенести осадок пипеткой на предметное стекло, прикрыть покровным.
4) Микроскопировать при увеличении: объектив х8 или х10, окуляр хЮ, для уточнения морфологических особенностей — окуляр х 40.
Методы исследования мочи Применяются для выявления возбудителя мочеполового шистосомоза при любой стадии инвазии. Возможно обнаружение яиц диоктомифы {Dioctophyma renale) — редко встречаемого гельминта — паразита почечной лоханки.
Необходимое оборудование Центрифужные пробирки Пипетки
Предметные и покровные стекла
Центрифуга
Микроскоп
Метод концентрации мочи Подготовка к исследованию
1) Всю разовую порцию мочи отстаивать в высоких банках или цилиндрах в течение 30—45 мин.
2) Слить верхнюю часть, оставив 10—15 мл осадка, который перелить в центрифужные пробирки.
3) Оставшуюся часть центрифугировать в течение 5 мин при 1 500 об./мин, или 1—2 мин при 3 000 об./мин.
4) Слить надосадочную жидкость.
17
|
|
13 14 15 16 17 18 19 20
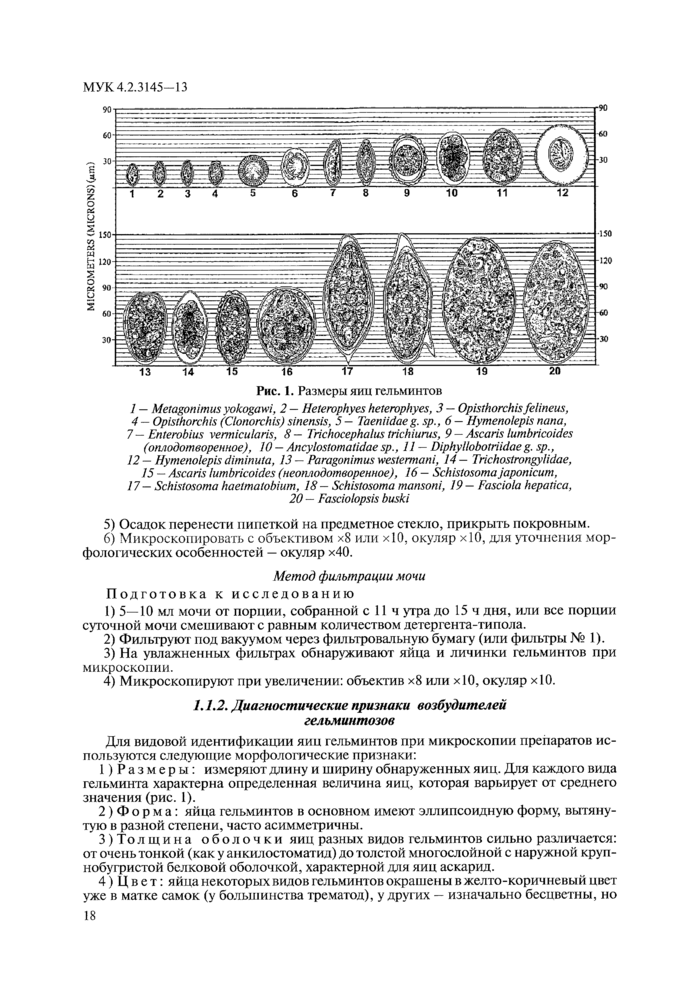
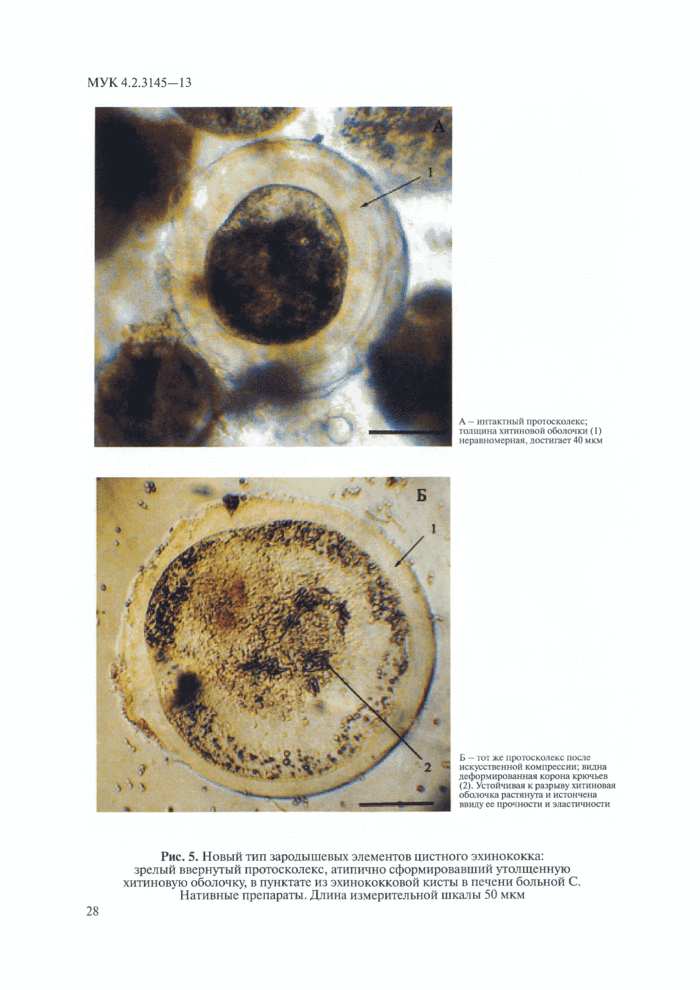
Рис. 1. Размеры яиц гельминтов
1 — Metagonimus yokogawi, 2 — Heterophyes heterophyes, 3 — Opisthorchis felineus,
4 — Opisthorchis (Clonorchis) sinensis, 5 - Taeniidae g. sp.,6 — Hymenolepis папа,
7 — Enterobius vermicularis, 8 — Trichocephalus trichiurus, 9 — Ascaris lumbricoides (оплодотворенное), 10 — Ancylostomatidae sp., 11 — Diphyllobotriidae g. sp.,
12 — Hymenolepis diminuta, 13 — Paragonimus westermani, 14— Trichostrongylidae,
15 — Ascaris lumbricoides (неоплодотворенное), 16 — Schistosoma japonicum,
17— Schistosoma haetmatobium, 18 — Schistosoma mansoni, 19 — Fasciola hepatica,
20 — Fasciolopsis buski |
5) Осадок перенести пипеткой на предметное стекло, прикрыть покровным.
6) Микроскопировать с объективом х8 или х10, окуляр х10, для уточнения морфологических особенностей — окуляр х40.
Метод фильтрации мочи Подготовка к исследованию
1) 5—10 мл мочи от порции, собранной с 11 ч утра до 15 ч дня, или все порции суточной мочи смешивают с равным количеством детергента-типола.
2) Фильтруют под вакуумом через фильтровальную бумагу (или фильтры № 1).
3) На увлажненных фильтрах обнаруживают яйца и личинки гельминтов при
микроскопии.
4) Микроскопируют при увеличении: объектив х8 или хЮ, окуляр хЮ.
1.1.2. Диагностические признаки возбудителей гельминтозов
Для видовой идентификации яиц гельминтов при микроскопии препаратов используются следующие морфологические признаки:
1) Размеры: измеряют длину и ширину обнаруженных яиц. Для каждого вида гельминта характерна определенная величина яиц, которая варьирует от среднего значения (рис. 1).
2) Ф о р м а: яйца гельминтов в основном имеют эллипсоидную форму, вытянутую в разной степени, часто асимметричны.
3) Толщина оболочки яиц разных видов гельминтов сильно различается: от очень тонкой (как у анкилостоматид) до толстой многослойной с наружной крупнобугристой белковой оболочкой, характерной для яиц аскарид.
4) Ц в е т: яйца некоторых видов гельминтов окрашены в желто-коричневый цвет уже в матке самок (у большинства трематод), у других — изначально бесцветны, но
18
МУК 4.2.3145-13
прокрашиваются пигментами испражнений в темно-желтый или коричнево-бурый цвет по мере прохождения по кишечнику (яйца аскарид, власоглава), встречаются и неокрашенные яйца, например, у анкилостоматид, остриц, карликового цепня.
5) Наличие морфологических особенностей, таких как крышечки, шипы, пробки, крючки или фестончатая наружная оболочка.
6) Внутреннее содержимое: яйца выделяются из матки гельминтов на разных стадиях развития: они могут содержать практически неразличимый зародыш, окруженный желточными клетками, один или несколько хорошо заметных бластомеров или сформированную личинку. Если пробы кала исследуют через несколько часов или спустя 1—2 дня после дефекации, яйца некоторых нематод могут развиваться до более взрослых стадий, что следует учитывать при диагностике.
При обнаружении яйца гельминта или похожего на него объекта следует тщательно оценить все перечисленные признаки, чтобы установить видовой диагноз.
Иллюстрация возбудителей глистных инвазий приведены в прилож. 2, 3, 4.
Видовая диагностика трематодозов
Представители класса Trematoda, паразитирующие у человека, локализуются в разных органах, в связи с чем условно разделены на 4 группы: I — трематоды, паразитирующие в гепатобилиарной системе (сем. Opisthorchidae, Fasciolidae, Dicrocoeliidae); II — кишечные трематоды (сем. Heterophyidae, Nanophyetidae и др.); III — легочные трематоды (сем. Paragonimidae) и IV — трематоды кровеносной системы (сем. Schistosomatidae). В соответствии с этим, яйца I группы трематод могут быть выявлены в дуоденальном содержимом и кале; II группы — только в кале (в связи с тем, что продолжительность жизни кишечных трематод невелика, в кале можно обнаружить и самих взрослых паразитов); III группы — в мокроте и кале, так как мокрота часто заглатывается; IV — в кале или моче в зависимости от вида паразита и его локализации в организме хозяина.
Яйца разных видов трематод существенно отличаются по размеру: от самых мелких, присущих кишечным трематодам, до самых крупных, таких как яйца фасциол. Оболочки яиц чаще всего тонкие и ровные, за исключением таковых у D. lanceatum, Sch.japonicum и видов Paragonimus.
Цвет оболочек яиц разных видов трематод варьирует от желтовато-золотистого до буро-коричневого.
Наиболее характерным признаком практически всех яиц трематод — паразитов человека, является наличие крышечки, которая открывается для выхода созревшей личинки — мирацидия во внешнюю среду. Крышечка может быть разной высоты, примыкает к скорлупе яйца плотно, так что становится практически неразличимой. Край крышечки может быть в виде ровной тонкой или волнистой линии. Часто оболочка перед крышечкой образует валик, выраженный в разной степени. При рассматривании яйца под микроскопом этот валик виден в виде выступов с его боков, так называемых «плечиков». Размер их, высота крышечки и способ ее прилегания являются важными систематическими признаками. Яйца шистосом крышечки не имеют, при выходе мирацидия оболочка яйца разрывается.
На противоположном полюсе от крышечки находится в разной степени развитый бугорок: от небольшого утолщения оболочки до выраженного выроста — «шишечки», иногда широкой. Яйца шистосом снабжены шипами, место их расположения и размер является видовым признаком.
Яйца возбудителей описторхоза, шистосомозов и некоторых кишечных трематод выделяются из матки самок полностью зрелыми со сформированной личинкой - мирацидием внутри, которая хорошо видна при микроскопировании. Яйца возбудителей фасциолеза, парагонимоза, нанофиетоза содержат плохо различимый зародыш в центре, окруженный желточными клетками. Развитие этих яиц происходит во внешней среде.
Сравнительная характеристика морфологических признаков яиц трематод представлена в прилож. 2.
При обнаружении в кале яиц D. lanceatum и F. hepatica следует помнить, что они могут быть транзитными. При употреблении в пищу печени крупного и мелкого ро-
19
ББК 51.9 Л12
Л12 Лабораторная диагностика гельминтозов и протозоозов: Методические указания. 2-е изд, испр. и доп., ил.—М.: ФБУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора,— 118 с.
ISBN 978-5-7508-1340-7
1. Разработаны Институтом медицинской паразитологии и тропической медицины им. Е. И. Марпиновского ГБОУ ВПО Первого Московского государственного медицинского университета (МГМУ) им. И. М. Сеченова (В. П. Сергиев, М. Н. Лебедева, В. Е Супряга, Ф. П. Коваленко, Е. Н. Морозов, Е. Н. Понировский, Т. В. Продеус, Л. В. Федянина, А. А. Фролова, Е. Н. Жиренкина, К. Ю. Кузнецова, И. В. Кухалева,
B. М. Ракова, Н. А. Турбабина, Е. А. Черникова, В. Д. Завойкин, О. П. Зеля, Л. Ф. Морозова, Г Л. Плющева, Н. Р. Цаава); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Т. М. Гузеева); ФБУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора (Т. Г. Сыскова); кафедрой факультетской хирургии№ 1 Первого МГМУ им. И. М. Сеченова (Г. X. Мусаев); отделом хирургии печени НИЦ Первого МГМУ им. И. М. Сеченова (Г. Г. Ахаладзе); ФБУН «Ростовский НИИ микробиологии и паразитологии» Роспотребнадзора (Т. И. Твердохлебова, Ю. И. Ва-серин, Е. П. Хроменкова, С. А. Нагорный, Л. Л. Димидова, А. В. Упырев, Л. В. Шиш-канова, Е. Ю. Криворотова, А. С. Кожухина); Военно-медицинской академией им.
C. М. Кирова (С. С. Козлов); НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи (Д. Б. Гончаров); Российским научным центром хирургии им. Б. В. Петровского РАМН (Г. А. Шатверян); кафедрой молекулярной биологии МГУ им. М. В. Ломоносова (А. А. Колесников); кафедрой тропических и паразитарных болезней Российской медицинской академии последипломного образования (А. Е. Беляев); Управлением Роспотребнадзора по городу Москве (Т. Н. Иванова); ФБУЗ «Центр гигиены и эпидемиологии в городе Москве» (Н. И. Тимошенко).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 29 октября 2013 г. № 3).
3. Утверждены врио руководителя Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главного государственного санитарного врача Российской Федерации А. Ю. Поповой 26 ноября 2013 г.
4. Введены взамен МУК 4.2.735—99 «Паразитологические методы диагностики гельминтозов и протозоозов».
ББК 51.9
Редактор Л. С. Кучурова Технический редактор А. А. Григорьев Подписано в печать 21.11.14
Формат 60x84/8 Уел. печ. л. 13,72
Тираж 300 экз. Заказ
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека 127994, Москва, Вадковский пер. д. 18, стр. 5, 7 Оригинал-макет подготовлен к печати отделом издательского обеспечения Федерального центра гигиены и эпидемиологии Роспотребнадзора 117105, Москва, Варшавское ш., 19а Отделение реализации, тел./факс 8 (495) 952-50-89
© Роспотребнадзор, 2014 © Федеральный центр гигиены
и эпидемиологии Роспотребнадзора, 2014
гатого скота, зараженного возбудителями фасциолеза или дикроцелиоза, их яйца при недостаточной термической обработке могут сохраняться и транзитом проходить через желудочно-кишечный тракт человека, обнаруживаясь затем в кале. Необходимо повторное исследование после исключения из пищи указанных продуктов.
Видовая диагностика цестодозов
Класс ленточных гельминтов относится к типу плоских червей и делится на два отряда — лентецов и цепней.
К отряду лентецов относятся 3 вида возбудителей дифиллоботриоза, встречающихся на территории Российской Федерации (Diphyllobothrium latum, D. dendriticum,
D. luxi). В связи с тем, что матка хвостовых члеников Diphyllobothriidae имеет выводное отверстие, в кале обнаруживаются яйца, имеющие характерное строение: они сероватого цвета, овальной формы с тонкой двуконтурной оболочкой. На одном полюсе имеются крышечки, на другом — утолщение оболочки в виде бугорка. Последний виден не всегда, особенно при работе методом Като. В центре яйца находится зародышевая клетка. По яйцам Diphyllobothriidae невозможно определить видовую принадлежность лентеца, в связи с чем при записи результатов анализа указывают «обнаружены яйца Diphyllobothriidaesp.».
Дифференциальная диагностика лентецов
и цепней приведена в прилож. 3.
К отряду цепней относятся Taenia solium, Taeniarhynchus saginatus. Taenia asiatica, Hymenolepis папа, Hymenolepis diminuta, Dipylidium caninum.
Taeniarhynchus saginatus — возбудитель бычьего цепня и Taenia solium — возбудитель свиного цепня локализуются в тонком кишечнике. Строение яиц этих двух видов возбудителей одинаковое. Яйцо имеет тонкую прозрачную оболочку с двумя нитевидными придатками. Внутри яйца находится зародыш (онкосфера) почти правильной круглой формы, окруженной толстой оболочкой желтовато-коричневого цвета и снабженной тремя парами крючьев. Оболочка яйца, как правило, быстро разрушается и при исследовании кала видна только онкосфера. Онкосферы бычьего цепня обнаруживаются при исследованиях перианальных отпечатков, возможно их обнаружить и в кале. При записи результатов исследований указывают «обнаружены онкосферы Taeniidaeg. sp.».
Дифференциальная диагностика Т. solium
и Т. saginatus проводится по концевым членикам
(прилож. 3).
Во внешнюю среду вместе с калом могут выделяться членики Т. saginatus, Т. solium, Diphyllobothriidae sp. и D. caninum. Членики бычьего цепня часто отходят активно, что у свиного цепня наблюдается исключительно редко. При этих инвазиях, а также и при дифиллоботриозе возможно отхождение кусков стробилы. Диагностика проводится по форме членика — соотношение ширины и длины — и особенностям строения матки:
• концевой членик Т. saginatus имеет ширину меньшую, чем длину. Матка замкнутая, имеет центральный ствол с большим числом боковых ответвлений — до 30 и более;
• концевой членик Т. solium также имеет ширину меньшую, чем длину. Матка замкнутая, имеет центральный ствол с небольшим числом боковых ответвлений — до 10-12;
• концевой членик Diphyllobothriidae sp. имеет ширину большую, чем длину. Матка имеет выводной приток, расположена в середине членика в виде розетки, боковые ответвления отсутствуют;
• концевые членики D. caninum имеют формы семечек тыквы.
Hymenolepis папа — возбудитель гименолепидоза (карликовый цепень) паразитирует в нижнем отделе тонкого кишечника. Яйца имеют эллипсоидную форму, не окрашены, слегка ополесцируют. Между оболочкой и зародышем находятся нити (филаменты). Зародыш (онкосфера) имеет три пары крючьев. Яйца Н. папа выяв-
20
МУК 4.2.3145-13
Содержание
Область применения..........................................6
Раздел 1. Лабораторная диагностика кишечных гельминтозов..................6
1.1. Лабораторная диагностика кишечных гельминтов....................6
Отбор проб и условия доставки биологического материалав лабораторию
для паразитологического исследования..........................6
Отбор проб кала........................................7
Отбор дуоденального содержимого (желчь)........................7
Отбор проб мокроты и лаважной жидкости........................7
Отбор проб мочи.......................................7
1.1.1. Методы исследования кала на яйца гельминтов...................7
1.1.1.1. Макроскопические методы.............................7
1.1.1.2. Микроскопические методы.............................8
1.1.1.2.1. Метод толстого мазка под целлофаном по Като и Миура........8
1.1.1.2.2. Методы седиментации............................9
Метод формалин-эфирной или уксусной седиментации............9
1.1.1.2.3. Модификация метода седиментации с применением
одноразовых концентраторов «PARASEP».....................10
1.1.1.2.4. Модификация метода седиментации с применением
минисистемы «Real»...................................11
1.1.1.2.5. Методы исследования кала с применением
флотационных растворов................................12
1.1.1.3. Методы исследования кала на личинки гельминтов.............13
Метод Бермана......................................13
Метод Бермана в модификации Супряги......................14
Метод Харады—Мори в модификации Маруашвили (метод культивирования личинок на фильтроватьной бумаге)..............14
1.1.1.4. Методы исследования перианальных отпечатков...............15
Метод исследования перианального отпечатка с применением
липкой ленты по Грэхэму................................15
Метод исследования перианального отпечатка с применением
стеклянных глазных палочек с клеевым слоем по Рабиновичу.........15
Метод перианального соскоба по Торгушину....................16
1.1.1.5. Методы исследования желчи дуоденального содержимого
(желчи, мокроты, лаважной жидкости и мочи).....................16
Методы исследования дуоденального содержимого (желчи)...........16
Методы исследования желчи с центрифугированием...............16
Методы исследования мокроты и лаважной жидкости..............17
Методы исследования нативного мазка мокроты.................17
Методы исследования нативного мазка мокроты и лаважной жидкости
с центрифугированием.................................17
Методы исследования мочи..............................17
Метод концентрации мочи...............................17
Метод фильтрации мочи................................18
1.1.2. Диагностические признаки возбудителей гельминтозов.............18
1.2. Лабораторная диагностика эхинококкозов........................22
Морфологические методы исследования ларвоцист при цистном и альвеолярном эхинококкозах..............................22
1.2.1. Лабораторная диагностика цистного эхинококкоза................22
Методы исследования нативных и окрашенных мазков...............22
1.2.2. Лабораторная диагностика альвеолярного эхинококкоза.............24
3
1.2.3. Метод исследования жизнеспособности паразита in vivo (биопроба)......32
1.3. Лабораторная диагностика трихинеллеза.........................32
1.3.1. Метод трихинеллоскопии...............................34
Компрессорная трихинеллоскопия...........................35
1.3.2. Методы переваривания в искусственном желудочном соке...........35
Классический метод переваривания по Березанцеву Ю. А..............35
Ускоренный метод переваривания по Владимировой П. А.............36
1.4. Лабораторная диагностика филяриозов..........................36
1.4.1. Лабораторная диагностика онхоцеркоза.......................36
Метод исследования необогашенного нативного препарата.............37
Метод исследования обогащенного препарата.....................37
1.4.2. Лабораторная диагностика филяриатозов лимфатической системы
(вухериоза и бругиоза).....................................38
Метод исследования нативного мазка крови из пальца................38
Микрокапиллярный метод обнаружения живых микрофилярий
по Супряге..........................................38
Методы исследования венозной крови.........................39
Метод концентрации микрофилярий в осадке по Кнотту..............39
Метод мембранной фильтрации микрофилярий по Беллу,
модифицированный Супрягой и Андреенковым...................40
Микроскопическое исследование препаратов крови.................40
1.4.3. Методы диагностики подкожного дирофиляриоза................41
1.4.4. Диагностика сердечно-легочного дирофиляриоза.................42
Раздел 2. Лабораторная диагностика протозоозов (кроме малярии).............43
2.1. Лабораторная диагностика протозойных инфекций кишечника...........43
2.1.1. Микроскопические методы исследования кала на простейшие кишечника. . 43
Основные методы исследования кала на простейшие кишечника.........43
2.1.2. Специальные методы исследования кала на простейшие кишечника......44
Метод приготовления влажного мазка нативного кала с физиологическим раствором, растворами Люголя и метиленового синего...........44
Методы приготовления постоянных окрашенных препаратов кала........45
Метод окрашивания трихромовой краской.......................45
Модифицированный метод окрашивания по Цилю—Нильсену...........46
2.1.3. Диагностические признаки трофозоитов и цист кишечных простейших ... 47
2.1.4. Экспресс-тест для определения антигенов лямблий и криптоспоридий
в пробах кала..........................................52
2.2. Лабораторная диагностика трипаносомозов.......................53
2.2.1. Метод исследования нативных препаратов крови.................53
Метод исследования толстой капли...........................54
2.2.2. Метод исследования неокрашенных мазков из лимфатических узлов.....54
2.2.3. Метод исследования неокрашенных мазков из спинно-мозговой
жидкости.............................................55
2.2.4. Диагностические признаки возбудителей трипаносомоза............55
2.3. Лабораторная диагностика лейшманиозов........................55
Отбор проб биологического материала на наличие возбудителей
кожного лейшманиоза...................................56
Отбор проб биологического материала на наличие возбудителей висцерального лейшманиоза...............................56
2.3.1. Микроскопические методы исследований на лейшманиозы...........57
2.3.2. Посев возбудителей лейшманиозов на питательную среду
с последующим культивированием.............................58
Приготовление питательной среды............................58
4
МУК 4.2.3145-13
2.3.3. Диагностические признаки возбудителей лейшманиозов.............59
Раздел 3. Автоматизированные системы микроскопирования с программным
модулем «Паразитология»......................................59
Раздел 4. Лабораторная диагностика паразитозов методом полимеразной
цепной реакции (ПЦР-диагностика)................................61
Введение...............................................61
Аппаратура, материалы, лабораторная посуда, реактивы..................61
4.1. Подготовка к анализу.....................................63
4.1.1. Проведение анализа. Выделение ДНК. Метод выделения ДНК
с помощью набора Diatom DNA Prep 100/200 ....... 65
Амплификация.......................................66
4.1.2. Проведение электрофореза в агарозном геле....................67
4.2. Полимеразная цепная реакция и рестрикция (ПЦР) на идентификацию
возбудителей лейшманиозов...................................68
Аппаратура, материалы, лабораторная посуда, реактивы
для ПЦР-исследования и рестрикции..........................68
4.2.1. Проведение полимеразной цепной реакции (ПЦР)................71
Выделение ДНК.......................................71
4.2.2. Выделение ДНК коммерческим набором......................72
Амплификация.......................................73
Проведение электрофореза в агарозном геле......................75
Рестрикционный анализ..................................75
Приложение 1. Информативность микроскопических методов исследований........78
Приложение 2. Морфологическое строение яиц гельминтов..................80
Приложение 3. Морфологическое строение зрелых члеников цестод.............89
Приложение 4. Морфологическое строение личинок нематод.................93
Приложение 5. Морфологическое строение кишечных простейших.............95
Приложение 6. Морфологическое строение микрофилярий.................107
Приложение 7. Диагностические признаки взрослых дирофилярий.............112
Приложение 8. Реагенты, растворы и методы их приготовления...............114
5
УТВЕРЖДАЮ
Врио руководителя Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главного государственного санитарного врача Российской Федерации
А. Ю. Попова
26 ноября 2013 г.
Дата введения: с момента утверждения
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика гельминтозов и протозоозов
Методические указания МУК 4.2.3145-13
Область применения
1. Методические указания (далее — МУК) устанавливают порядок применения метода отбора проб и методов лабораторных исследований биологического материала от людей с целью обнаружения возбудителей гельминтозов и протозоозов, определения их видовой принадлежности.
2. Методические указания предназначены для специалистов паразитологических, микробиологических лабораторий санитарно-эпидемиологической службы, медицинских организаций независимо от их организационно-правовых форм, индивидуальных предпринимателей, а также научно-исследовательских институтов, осуществляющих лабораторную диагностику гельминтозов и протозоозов.
3. Методические указания носят рекомендательный характер.
Раздел 1. Лабораторная диагностика кишечных гельминтозов1.1. Лабораторная диагностика кишечных гельминтов
Гельминты человека относятся преимущественно к двум типам червей: типу плоских червей Plathelminthes и типу круглых червей Nemathelminthes. Тип плоских червей, поражающих человека, включают два класса: ленточные черви — Cestoda и сосальщики — Trematoda. Тип круглых червей включает в себя один класс, имеющий медицинское значение, собственно класс Nematoda.
Большинство гельминтозов можно диагностировать прямыми методами, то есть по обнаружению в биологическом материале (кал, моча, мокрота, дуоденальное содержимое и пр.) гельминтов на разных стадиях развития (взрослых особей, яиц или личинок). Для этого используют макроскопические и микроскопические методы диагностики.
Отбор проб и условия доставки биологического материала в лабораторию для паразитологического исследования
Материалом для лабораторных паразитологических исследований на гельмин-тозы служит различный биологический материал: кал, кровь, моча, мокрота, ла-важная жидкость, дуоденальное содержимое, содержимое кист, биопсионный или поетоперационный материал, гистологические препараты внутренних органов и тканей и другой.
6
МУК 4.2.3145-13
Отбор проб кала
Кал после дефекации отбирают из разных участков в количестве не менее 50 г.
Пробу помещают в чистую сухую, стеклянную или пластмассовую посуду с крышками.
Проба кала доставляется в лабораторию и исследуется в день дефекации.
При невозможности исследования пробы кала сразу после дефекации или в день поступления материала в лабораторию, пробу кала хранят при температуре от 0 до 4 °С не более суток или собирают в консервант (прилож. 8).
Отбор дуоденального содержимого (желчь)
Материал доставляется в лабораторию в чистых химических или центрифужных пробирках сразу после зондирования пациента натощак.
Доставляют все три фракции (порции «А», «В», «С») и исследуют сразу после поступления в лабораторию.
Порцию «А» доставляют для исследования на наличие возбудителей стронги-лоидоза, трихостронгилидозов, анкилостомидозов.
Порции «В» и «С» доставляют для исследования на яйца гельминтов, паразитирующих в протоках печени и желчном пузыре.
Отбор проб мокроты и лаважной жидкости
В лабораторию доставляется мокрота, выделенная при откашливании (не слюна и не слизь с носоглотки), в стерильной посуде с крышками. Проба мокроты исследуется сразу после поступления в лабораторию.
Лаважная жидкость в лабораторию доставляется в стерильной посуде и исследуется в день доставки.
Отбор проб мочи
В лабораторию доставляется моча, собранная между 10 ч утра и 14 ч дня, или все порции суточной мочи; желательно собрать мочу после физической нагрузки (например, 20—30 приседаний).
1.1.1. Методы исследования кала на яйца гельминтов
1.1.1.1. Макроскопические методы
Макроскопические методы служат для обнаружения в кале целых половозрелых гельминтов или их фрагментов невооруженным глазом или с помощью ручной лупы и/или стереомикроскопа.
На поверхности кала после дефекации можно видеть активно ползающих остриц; иногда выделяются с калом аскариды; у пациентов с дифиллоботриозом могут выделяться обрывки стробилы лентеца, а у инвазированных свиным цепнем с калом часто отходят членики гельминта. У инвазированных бычьим цепнем также происходит отхождение члеников, однако значительная доля члеников отходит активно вне дефекации. В живом состоянии такие членики пациенты часто сравнивают с лапшой. Пациент может доставить членики в лабораторию, но если они подсохли, то на лапшу они перестают быть похожи, а выглядят скорее как чешуйки размером с ноготь мизинца. Перед исследованием такой членик следует размочить в физиологическом растворе. Кроме того, за отхождением взрослых гельминтов необходимо следить при оценке разультатов лечения.
Необходимые реактивы и оборудование
Чашки Петри
Черная бумага
Пинцеты
Препаровальные иглы
Предметные стекла большие (6х10;8х12 см)
Лупа, микроскоп и бинокулярный стереоскопический микроскоп типа МБС
7
Подготовка к исследованию
1) Извлекать пинцетом или препаровальной иглой все подозрительные частицы и крупные образования на отдельное предметное стекло или чашку Петри.
2) Образования, подозрительные на фрагменты гельминтов, рассматривать под микроскопом МБС или под лупой между двумя предметными стеклами.
3) Мелких гельминтов рассматривать в капле глицерина или физиологического раствора под микроскопом при увеличении: окуляр х7 или х10, объектив х8 или х10.
4) Членики ленточных гельминтов поместить на предметное стекло, подсушить, закрыть другим предметным стеклом, слегка сдавить и рассмотреть строение матки.
5) Микроскопия всех визуально обнаруженных в кале паразитов или фрагментов обязательна для уточнения морфологических особенностей и идентификации паразита.
Применение. Метод применяется при идентификации зрелых паразитов или их фрагментов, например для дифференциальной диагностики члеников цестод (бычьего, свиного цепня и широкого, чаечного лентеиа).
1.1.1.2. Микроскопические методы
1.1.1.2.1. Метод толстого мазка под целлофаном по Като и Миура Толстый мазок представляет собой тонкий слой пробы кала на предметном стекле под гигроскопическим целлофаном, пропитанным смесью глицерина, фенола и малахитового зеленого.
Примечание. Гидрофильный целлофан горит в отличие от полиэтиленовой пленки, которая плавится и непригодна для исследования.
Необходимые реактивы и оборудование Глицерин
Раствор фенола 6 %-й (100 мл дистиллированной воды + 6 г фенола)
Раствор малахитового зеленого 3 %-й (2,5 г малахитовой зелени + 75 мл дистиллированной воды)
Целлофан (гигроскопический)
Обезжиренные предметные стекла Палочки стеклянные или деревянные Валик или резиновая пробка Микроскоп
Подготовка к исследованию
Приготовление рабочего раствора Като: 100мл 6 %-гораствора фенола + 100 мл глицерина + 1,2 мл 3 %-го раствора малахитового зеленого (раствор можно хранить длительное время в склянке из темного стекла с притертой крышкой).
При отсутствии фенола и малахитовой зелени можно использовать раствор глицерина (50 мл глицерина + 50 мл дистиллированной воды).
П одготовка целлофановых полосок. Нарезать полоски из гидрофильного целлофана, чтобы их размер соответствовал размеру предметного стекла.
1) Полоски поместить в рабочий раствор Като не менее, чем на 24 ч до проведения анализа. В 200 мл рабочего раствора можно обрабатывать до 5 тыс. новых целлофановых полосок.
2) На предметное стекло нанести пробу кала размером с горошину. Весь объем пробы кала растереть индивидуальной стеклянной палочкой по стеклу.
3) Мазок кала накрыть целлофановой полоской, обработанной в растворе.
4) Целлофан сверху притереть резиновой пробкой или специальным валиком, ширина которого соответствует или немного больше ширины предметного стекла, до получения тонкого, равномерного, прозрачного слоя.
5) Препарат просветляется при комнатной температуре в течение 20—30 мин.
МУК 4.2.3145-13
6) Микроскопировать при увеличении: объектив х8 или хЮ, окуляр х7 или хЮ (для уточнения морфологического строения яиц гельминтов — объектив х40).
Эффективность метода
1) Позволяет просмотреть в 20—30 раз больше препаратов кала, чем в нативном мазке без применения гигроскопических целлофановых полосок.
2) Выявляет яйца гельминтов желудочно-кишечного тракта при высокой и средней интенсивности инвазии.
Применение метода
1) Рекомендуется при массовых обследованиях населения на кишечные гель-минтозы.
2) При обследованиях населения на анкилостомидозы, трихостронгилидозы и гименолепидоз необходимо учитывать, что применение данного метода имеет ограничения во времени, а именно возбудители указанных инвазий разрушаются в течение 1—2 ч.
1.1.1.2.2. Методы седиментации
Метод формалин-эфирной или уксусной седиментации В основе методов седиментации (осаждения) лежит разность удельного веса используемых химических реактивов и яиц гельминтов: удельный вес яиц высокий, и они концентрируются в осадке.
Необходимые реактивы и оборудование Контейнеры (полистироловые) объемом 30 мл с ложечкой для сбора кала Центрифужные пробирки: пластиковые полипропиленовые или стеклянные объемом 12—15 мл (полипропилен устойчив к воздействию эфира и обладает водоотталкивающими свойствами: легко отделяет детритовую пробку)
Пробки для центрифужных пробирок
Воронки пластиковые или стеклянные диаметром 4 или 5 см
Стеклянные палочки или шпатели
Стаканчики пластиковые или стеклянные, мерные на 50 и 100 мл
Обезжиренные предметные стекла, покровные стекла размером 24 х 24 мм
Пипетки или варипипетки с наконечниками
Штативы для центрифужных пробирок
Центрифуга с горизонтальным ротором на 10—12 пробирок
Марля, бинты или мелкоячеистые ситечки металлические или пластиковые
Микроскоп
Формалин концентрированный Раствор формалина 5—10 %-й Эфир этиловый Физиологический раствор Фиксирующий раствор Турдыева Раствор Люголя 2 %-й
Порядок сбора проб кала в консервант
В полистироловые контейнеры с вмонтированной ложечкой наливают 8—10 мл фиксирующего раствора Турдыева (пропись в прилож. 8). Ежедневно или с интервалом в 1—2 дня в контейнер добавляют небольшую (объемом с горошину) порцию кала. Объем усредненной пробы кала, помещенной в раствор, не должен превышать 2—3 мл. Материал при каждом добавлении тщательно перемешивают с консервантом и хранят в темном прохладном месте (хранить можно до 2—3 недель). Пациенту рекомендуется не употреблять в пищу грибы, печень, большое количество грубой клетчатки, принимать сорбенты. После масляных клизм и приема бария должно пройти несколько суток. В случае лечения антибиотиками широкого спектра действия или антибактериальными препаратами кал для исследования следует начать собирать спустя 7—10 дней после окончания приема препаратов. Жидкий стул следует собрать однократно в консервант в количестве не менее 5 мл и одновремен-
9