МУ 5780-91
Методические указания по контролю в рыбных продуктах парагемолитических вибрионов - возбудителей пищевых токсикоинфекций
Купить МУ 5780-91 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
В документе представлены показатели допустимой обсеменности сырья и готовой продукции из рыбы и морских беспозвоночных, методы отбора проб, методики выявления и подсчета парагемолитических вибрионов, рецептура питательных сред, гигиеническая оценка пищевых рыбных продуктов, рекомендации, литература
Оглавление
Введение
1 Микробиологические нормативы для парагемолитических вибрионов
2 Отбор проб сырья и готовой продукции, подготовка к анализу
3 Методы анализов
4 Рекомендации
5 Питательные среды для определения галофильных вибрионов
Рекомендуемая литература
| Дата введения | 01.11.1991 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 17.11.1990 | Утвержден | Заместитель министра рыбного хозяйства СССР | |
|---|---|---|---|
| 03.04.1991 | Утвержден | Заместитель Главного государственного санитарного врача СССР | 5780-91 |
| Разработан | Институт питания АМН СССР | ||
| Разработан | Институт Гипрорыбфлот |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12
стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР МИНИСТЕРСТВО РЫБНОГО ХОЗЯЙСТВА СССР Государственный ордена "Знак Почета" научно-исследовательский и проектно-конструкторский институт по развитию и эксплуатации флота
(ГИПРОРЫБФЛОТ)
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО КОНТРОЛЮ В РЫБНЫХ ПРОДУКТАХ ПАРАГЕМОЛИТИЧЕСКИХ ВИБРИОНОВ -ВОЗБУДИТЕЛЕЙ ПИЩЕВЫХ ТОКСИКОИНФЕКЦИЙ
Ленинград
1991
бумажка меняет цвет. При отрицательной реакции цвет бумажек на индол не изменяется.
Способность образования - ацетилметилкарбинола (реакция Фогес - Проскауэра)
Способность образования ацетилметилкарбинола определяют путем посева односуточной культуры в бульон Кларка с ЪУ> хлорида натрия (п.5.9). Посев инкубируют 24 ч при температуре 37°С. Затем к I см5 культуры добавляют 0,6 см5 с(-иафтола (6£-ный раствор в абсолютном спирте) и 0,2 мл 40$&-ного раствора едкого калия (КОН). Пробирку встряхивают и скова помещают в термостат па X ч при температуре 37°С. Так как парагемолитическио вибрионы не образуют ацетилметилкарбинола, цвет среды не Изменяется.
Определение интенсивности кислотообразованин (реакция с метиловым красным индикатором)
Для определения интенсивности кислотообразованин односуточную культуру засевают в среду Кларка с 3* хлорида натрия (п.5.9). Посев инкубируют при температуре 37°С в течение 24-48 ч. При наличии роста прибавляют 3-5 капель 0,02^ного раствора индикатора метилового красного (п.5.12). Пробирку встряхивают и снова помещают в термостат на I ч Ари температуре 37°С. При сильном кислото-образовании получается красное окрашивание среды, при слабом -желтое.
Ферментация углеводов
Для определения ферментативной активности односуточную культуру засевают на среды Гисса с 3£ хлорида натрия и с поплавками (п.5.10). Посевы инкубируют 18-24 ч при темпе.1 туре 37°С.
При росте, сопровождающемся расщеплением углеводов с образованием кислых продуктов, цвет среды изменяется. С индикатором бромтимолбляу она приобретает желтый цвет, с индикатором Андре-де - ярко-розовый. Если брожение сопровождается газообразованием, газ собирается в поплавках. Парагемолитические вибрионы ферментируют без образования газа арабиноэу, мальтозу, глюкозу.
Для вибрионов характерно расщепление глюкозы с образованием кислоты без газа на среде Хью-Лейфсона как в аэробных, так и в анаэробных условиях (п.5.11). Определение типа расщеплонйя глюкозы позволяет отличать вибрионы от сходных с ними по морфологии Представителей рода Pseudomonas и Comonomonus.
Для идентификации вибрионов можно использовать СИБ - системы индикаторные бумажные (п.5.15).
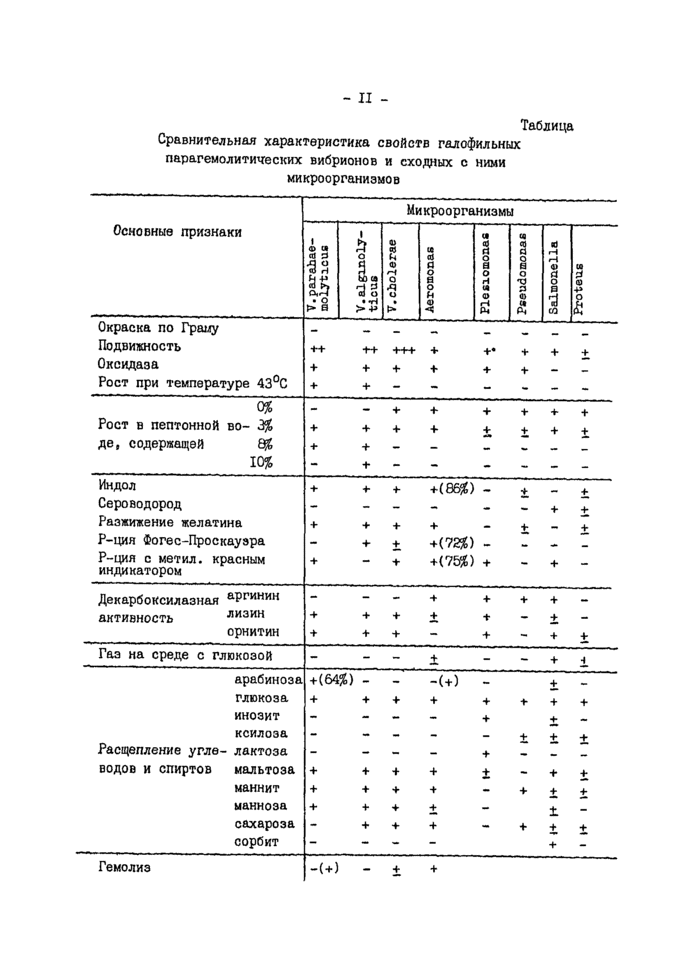
Ниже приведена схема бактериологического исследования на гало-фильные парагемолитические вибрионы. Характеристика свойств гало-фильных парагемолитических вибрионов и сходных с ними микроорганизмов приведена в таблице.
1- й день I.
2- й день I.
3- й день I.
4- й день I.
2.
3.
4.
5.
6.
7.
8. 9. 10.
11.
12.
5- й день I.
2.
Схема бактериологического исследования на гало-фильные парагемолитические вибрионы
Посев на ДДА из разведений или накопительной культуры.
Изучение роста на ДДА, подсчет и отсев подозрительных колоний на 1%-ную пептонную воду с 2% хлорида натрия.
Пересев с 1%-ной пептонной воды с 3% хлорида натрия на ДДА.
Изучение морфологии чистых культур с окраской по Граму Определение подвижности.
Посев на щелочной агар для определения оксидазной активности.
Посев на среду лактозо-сахарозную.
Посев на 1%-ную пептонную воду с различными концентрациями хлорида натрия (тест на галофильность).
Посев на среду ДАГВ для определения декарбоксилаэной активности.
Посев на среды Гисса для определения ферментативной активности.
Посев на 1%-ную пептонную воду с 3% хлорида натрия для определения способности образования индола..
Посев на среду Кларка для определения способности образования ацетилметилкарбинола.
Посев на среду Кларка для определения интенсивности кислотообразования.
Посев на среду Хью-Лейфсона для определения типа расщепления глюкозы.
Постановка теста на оксидазу.
Оценка биохимической активности.
Окончательный ответ (при выделении со среды обогащения - на день позднее).
Таблица
Сравнительная характеристика свойств галофильных парагемолитических вибрионов и сходных с ними микроорганизмов
|
Микроорганизмы | ||||||||
|
Основные признаки |
1 Ф м « Э S3 К |
V.alginoly-' ticue |
V s ф о А о • > |
са а а | о й |
1 о a о н в о й |
<л и § о •о Я Ф ■ Pi |
« гН н § 0 0 1 |
Ш О о & |
|
Окраска по Грану |
- |
- |
- |
- |
- |
- |
- |
_ |
|
Подвижность |
++ |
++ |
+++ |
+ |
+• |
+ |
+ |
+ |
|
Оксидаза |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
|
Рост при температуре 43°С |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
0% |
- |
- |
+ |
+ |
+ |
+ |
+ | |
|
Рост в пептонной во- 3% |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
де, содержащей 8% |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
10% |
- |
+ |
- |
- |
- |
- |
- |
- |
|
Индол |
+ |
+ |
+ |
+(86%) - |
+ |
- |
+ | |
|
Сероводород |
- |
- |
- |
- |
- |
- |
+ |
+ |
|
Разжижение желатина |
+ |
+ |
+ |
+ |
- |
+ |
- |
+ |
|
Р-ция Фогес-Проскаузра |
- |
+ |
+ |
+(72%) - |
- |
- |
- | |
|
Р-ция с метил, красным |
+ |
- |
+ |
+(75%) + |
- |
+ |
- | |
|
индикатором | ||||||||
|
Декарбоксилазная аРгинин |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
активность лизин |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
|
орнитин |
+ |
+ |
+ |
- |
+ |
- |
+ |
+ |
|
Газ на среде с глюкозой |
- |
- |
- |
± |
- |
- |
+ |
i |
|
арабиноза |
+(64%) - |
- |
-(+) |
- |
+ |
- | ||
|
глюкоза |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
инозит |
- |
- |
- |
- |
+ |
+ |
- | |
|
ксилоза |
- |
- |
- |
- |
- |
+ |
+ |
+ |
|
Расщепление угле- лактоза |
- |
- |
- |
- |
+ |
- |
- |
- |
|
водов и спиртов мальтоза |
+ |
+ |
+ |
+ |
± |
- |
+ |
+ |
|
маннит |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
|
манноза |
+ |
+ |
+ |
+ |
- |
1 |
- | |
|
сахароза |
- |
+ |
+ |
+ |
- |
+ |
+ |
+ |
|
сорбит |
- |
- |
- |
- |
+ |
- | ||
|
Гемолиз |
|-(+) - |
+ |
+ | |||||
4. РЕКОМЕНДАЦИИ
Гигиеническая оценка рыбных продуктов и мероприятия, снижающие риск для населения при употреблении продуктов, инфицированных галофильными парагемолитическими вибрионами, приводятся на основе их количественного содержания.
отсутствие роста вибрионов на всех пяти чашках посева из разведения 1.10 свидетельствует о том, что в I г продукта эти вибрионы отсутствуют или содержатся в количестве менее 10 жизнеспособных клеток. Продукт по этому показателю - высокого качества, реализуется без ограничений,
отсутствие роста типичных колоний на обеих чашках с посевом из разведения 1:100, но обнаружение на пяти чашках с посевом из разведения 1:10 10-50 колоний указывает, что в I г продукта содержится от 100 до 500 жизнеспособных клеток парагемолитических вибрионов. Такой продукт может быть рекомендован для использования на пищевые цели только с рядом ограничений (хранение при температуре минус 10-20°С в течение 1-3 мес, реализация этой продукции с рассредоточением и т.п.);
обнаружение значительного роста (50 КОЕ и более) при посеве из разведения 1*100 и наличие роста свыше 5-10 колоний на чашках с посевами из разведения 1*1000 свидетельствуют о массивном заражении продукта парагемолитическими вибрионами (свыше 5хЮ4 КОЕ), что может представлять опасность для здоровья потребителя.
При таком уровне контаминации продукта парагемолитическими вибрионами (Ю4 и выше на I г продукта) использование рыбной продукции непосредственно на пищевые цели не может быть рекомендовано.
В целях профилактики пищевых отравлений гигиенические мероприятия должны быть направлены:
на снижение и подавление размножения вибрионов в сырье и готовой продукции;
на удаление их из продуктов, на предупреждение вторичного обсеменения.
Гидробионты и продукты из них благодаря особенностям строения и состава мышечной ткани являются весьма благоприятной средой для развития микроорганизмов и нестойки в хранении. Особенно это касается свежей, охлажденной рыбы и нерыбных объектов морского поочысла,
икры, кулинарных изделий, продуктов горячего копчения, которые являются особо скоропортящимися.
Необходимо учитывать, что парагемолитические вибрионы уо-тойчивы к низким температурам, хорошо сохраняются и бистро размножаются при повышении температуры. Изменения, происходящие в ткани рыбы при размораживании, благоприятствуют быстрому размножению микроорганизмов, поэтому важно мороженое сырье дефростировать оез задержек.
Охлаждение, замораживание способствуют уменьшению активности тканевых ферментов рыбы и задержке развития микроорганизмов. При замораживании количество вымороженной воды увеличивается, тем самым уменьшение свободной воды тормозит развитие и даже губит банториальные клетки. При замораживании рыбы увеличивается стойкость рыбы в хранении.
Для подавления роста и снижения уровня обсеменеиности пара-гемолитическими вибрионаыи рыбного сырья, особенно морского промысла, следует его охладить (до 0°С), заморозить и хранить при температуре не выше минус 18°С. Замораживание останавливает размножение микроорганизмов, ведет к их отмиранию (в течение 3-х месяцев;.
Губительно действуют на вибрионы крепкий посол (более 10% поваренной соли), маринование, термообработка, в г.ч. сушка, Га-лофильные виорионы выдерживают кипячение в течение I мип, при 80°С погибают по истечении 5 мин.
Можно сочетать тепловую обработку с добавлением консервантов, например, уксусной кислоты (0,3-0,6%), сорбиновой кислоты (0,2%).
Для предупреждения вторичного обсеменения готового продукта нельзя допускать контакта его с сырой рыбой в ходе технологического процесса производства, при транспортировке, хранении.
При неблагоприятной эпидемиологической обстановке оборудование необходимо подвергать тщательной санитарной обработке с обязательным использованием дезинфицирующих средств, таких как хлорамин (J,0-I,2%), мононатриевая соль дихлориэоциануровой кислоты (0,1%), дихлордиметилгидантоин С0|1“0»2%). Время воздействия дезинфицирующих средств должно быть не менее 15 мин. Такие средства, как горчица, кальцинированная сода, ,,Пр9гресси не эффективны для дезинфекции.
Санитарную обработку производят в соответствии о действующей Инструкцией по санитарной обработке технологического оборудования на рыбообрабатывающих предприятиях и судах.
5. ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ ОПРЕДЕЛЕНИЯ ГАЛОФИЛЬНЫХ ВИБРИОНОВ
5.1. Щелочная 0,1%-ная пептонная вода с 3% хлорида натрия (для определения присутствия или отсутствия вибрионов).
Пептон - 1,0 г
Натрия хлорид - 30,0 г
Вода дистиллированная - I дм5.
Все компоненты кипятят до полного их растворения, охлаждают до комнатной температуры и устанавливают PH 7,8-8,2. Среду равли-вают по 223 см5 во флаконы и по 10 см5 в пробирки, затем стерилизуют при температуре 121°С в течение 20 мин.
5.2. Щелочная 1%-ная пептонная вода, содержащая О, 3, 8 и 10% хлорида натрия.
В 1%-ную пептонную воду добавляют требуемое количество хлорида натрия, устанавливают PH 8,0 (10%-ным раствором Л'аОН), фильтруют, разливают в пробирки по 5 см5, стерилизуют при температуре 121°С в течение 30 мин.
Срок хранения в холодильнике - 2 мес.
Щелочная пептонная вода с триптофаном.
Для определения индола к 1%-ной пептонной воде с 3% хлорида натрия добавляют 0,03% триптофана.
5.3. Щелочная пептонная вода с 3% хлорида натрия, жидкостью "Прогресс” и теллуритом калия (жидкая среда обогащения) для накопления голофильных вибрионов.
К 100 см5 стерильной 1%-ной пептонной воды, содержащей 3% хлорида натрия (PH 8,0), добавляют 0,2% жидкости "Прогресс" и 0,75 см5 рабочего разведения (1:1000) теллурита калия.
Срок хранения - 7-10 сут.
Рабочее разведение теллурита калия готовят следующим образом:
I г сухого теллурита калия растворяют в I см5 стерильной дистиллированной воды.* 0,1 см5 полученного раствора помещают в пробирку с 9,9 см5 стерильного физиологического раствора, перемешивают, получают разведение 1:100. К 0,1 см5 раствора (разведение 1:100) добавляют 0,9 см5 стерильного физиологического раствора. Получают рабочее разведение (1:1000) или к 5 см5 2%-ного раствора теллурита калия добавляют до 100 см5 дистиллированной воды.
Срок хранения не более 48 ч.
Непосредственно перед употреблениям или не ранее, чем за 48 ч к 100 см5 стерильной пептонной воды добавляют 0,75 см5 рабочего раз-
ведения (1:1000) теллурита калия до конечной концентрации 1:150000. Серии теллурита калия долины быть предварительно проверены и оттитрованы на культуре v.pttrahaemoiyticua на отсутствие ингибиторного действия по отношению к вибриону.
|
5.4. Среда ДНА (дифференциально-диагностический агар) для | ||||||||||||||||
|
Примечание. Можно использовать ореду обогащения без добавления теллурита калия, бромтимолового синего индикатора, жидкости "Прогресс", пенициллина.
В расплавленном стерильном рыбо- или мясопептонном агарр (PH 8,0), охлажденном до 50°С, растворяют все необходимые ингредиенты. Не стерилизуя, разливают в чашки Потри. Среда имеет темный сине-зеленый цвет. Срок хранения в холодильнике - 7-10 сут.
5.5. Щелочной агар с 3,% хлорида натрия (ЩРПА).
К I дм3 рыбо- или мнсилептонного агара добавляют 30 г хлорида натрия и 30 см3 Южного раствора карбоната натрия, кипятят 45 мин, фильтруют через ватно-марлевый фильтр. Стерилизуют при температуре 121°С в точение 20 мин. Среда должна иметь РП 7,8-8,0. Срок хранения - 3 мес в холодильнике.
Щелочной агар из сухого препарата. Способ приготовления дается на этикетке.
|
5.6. Среда ДЛГВ | ||||||||||||||
|
Готовят среду, устанавливают PH 7,8 и разливают во флаконы.
В один добавляют 1$6 L-лизина. Среда - без аминокислот служит контролем. Готовую среду разливают в пробирки по 2 см5 и стерилизуют при температуре Х21°С в течение 15 мин.
Пептон 5,0 г
нюрм М Г
{@|9 Р 1\'6 ?
Индикатор Андрее пё нд
ДИёШ*ирев§НШ I ЯР*
5.7. Лакгово-сахарозная среда.
Готош ррвдяувтшмдо и р§ш*т tro н/i
Я РТврШНиЗ ПррбйрНЙ Ч ЖРШЧвДО ПрН РтШВДЙ Ш|693 -£9 МИН, брад ПП§Л§ HtWMWOftf вМШЮ* Ш: ДОЙ1 кблучн¥э
етси0ш й ттг Орнда Ь8й?«1 ш мшгмвдатш - придал*Si8t брели Шрярра. й$е№ (чв дарр чремрш), впивай вгфвденнип на эадиадпе»
ШШ
1,6 *
Глдоеаа
М г
Калий Ф0верномвяаН щ* вамвмнний (KgKPty)
м *
Z
Вода дистиллированная
I дм3
Нитрил хлорид PH 7,5-7,8
30,0 г
8«й| брела Нларка
|
ШШ |
1,6 * |
|
Глдоеаа |
М г |
|
Калий Ф0верномвяаН щ* вамвмнний (KgKPty) |
м * Z |
|
Вода дистиллированная |
I дм3 |
|
Нитрил хлорид PH 7,5-7,8 |
30,0 г |
8«й| брела Нларка
Раотворяют вое ингредиент в РОО ом* дистиллированной водь», доводят обгом до I дм3, фильтруют. Устанавливают Frt и разливают но 5 ом3 в пробирки. Стерилизуют при температуре П2,5°С л течение 15 мин.
5.10. Сроды Гисса (для определения ферментативной активнооти). В ХОО см3 XJS-ной поптонной воды раотворяют 3 г хлорида натрия и I г испытуемого углевода. Устанавливают PH 7,4-7,6, добавляют I см3 индикатора Андреде, Среду разливают по 5 см3 в пробирки с поплавками. Стерилизуют при температуре 112°С в течоние 20 мин.
.3
Индикатор Андреде
В 100 от дистиллированной воды растворяют 0,5 г кислого фук-оина, прибавляют 16,4 см3 1 /\/ раствора гидроокиои натрия. Кипя*
тят при температуре ЮО°С в течение 5 мин. Хранят во (рлаконах ив темного стекла с притертой пробкой. Индикатор должен иметь соло-йенно-желтый цвет.
Среды Тисса (из сухих препаратов с индикатором ВР) Способ приготовления дается на этикетке.
В приготовленную среду добавляют необходимое количество хлорида натрия.
|
5.11. СреДа Хью-Лейфсона, | ||||||||||||
| ||||||||||||
|
Готовят среду, устанавливают PH 8,0, разливают в пробирки ль 3 и 10 См3, стерилизуют при температуре Н2,5°С в течение 20 мин. |
5.12. Раствор индикатора метилового красного.
0,04 г метилового красного индикатора растворяют в 40 см* 96/&-ного этилового спирта, добавляют 60 ом-* дистиллированной воды.
5.13* Реактив для определения цитохромоксидазы.
Реактив готовят согласно ГОСТ 18963-73. Вода питьевая. Методы санитарно-бактериологического анализа.
5.14. Приготовление индикаторных бумажек на индол. Парадиматиламинобензальдагид 3-5 г
Этиловый спирт 96^-ный 50 см5
Фосфорная кислота (Н3Р0^), очищен- 10 см3
ная концентрированная
Вое ингредиенты смеаквают й растворяют в фарфоровой ступке. Полученной тепловатой жидкоотью смачивают полоски фильтровальной бумаги, высушивают и нарезают узкими полосками. Бумажки имеют желтый цвет. При наличии индола цвет бумажки меняется от сиренево-ро-вового до интенсивного малинового.
По Морелю.
Полоски фильтровальной бумаги пропитывают в насыщенном водном
ftacTuope щавелевой кислоты и высушивают в термостате.
Бумажки, имеют белый цвет. При наличии индола бумажки приобретают сиреневый или малиновый цвет. Хранят до I года в склянке с притертой крышкой.
5.Г5. Системы индикаторные бумажные (СИБ) для идентификации вибрионов Способ приготовления указан в прилагоомом наставлении.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Временные методические рекомендации по контролю за содержанием v perahocmoi/ticue в рыбе и рыбопродуктах. Методы исследования и нормативы. М., 1985.
2. Григорьев Ю.И. Распространение v.parabaenolyticue - возбудителя пищевых токсикоинфекций в морской воде и морепродуктах. М., 1975, канд. дисс.
3. Григорьев Г.И., Пивоваров С.II. Распространение галофильных вибрионов а морской воде и характеристика их свойств. - В сб.: "Гигиенические аспекты охраны окружающей среды". Выл.2. М., 1У74, с.103-156.
4. ГОСТ 2566U-B5. Пищевые и вкусовые продукты. Методы отбора проб для микробиологических анализов.
5. ГОСТ 26669-05. Пищевые и екусооые продукты. Подготовка проб для микробиологических анализов.
6. Инструкция о порядке расследования, учета и проведения лабораторных исследований в учреждениях санитарно-эпидемиологической службы при пищевых отравлениях, Минздрав CCCF, М Ц35-73. М., 1975.
7. Инструкция по санитарно-микробиологическому контролю производства пищевой продукции и рыбы и морских беспозвоночных, Минздрав СССР, * 5319. Л., 1991.
U. Инструкция по санитарной обработке технологического оборудования на рыбообрабатывающих предприятиях и судах. Л., Транспорт, 19U6.
9. Карцев В.В., Смирнова С.П., Лавровская Т.Г. и др. Частота обнаружения галофильных вибрионов в рыбе и рыбных продуктах на рыбообрабатывающих предприятиях Ленинграда и из магазинов фирмы "Океан". -Ь сб. научных трудов* "Методы индикации биоценоза потенциально-патогенных микроорганизмов в объектах окружающей среды". М., 1985.
IG. Либинэон А.Е., Павлова И.В., Нагорная А.5. и др. Галофиль-ные вибрионы - возбудители острых кишечных инфекций, вечречаюшихся на побережье Черного, Азовского морей. - В кн. "Тееисы областной
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР МИНИСТЕРСТВО РЫБНОГО ХОЗЯЙСТВА СССР Государственный ордена "Знак Почета" научно-исследовательский и проектно-конструкторский институт по развитию и эксплуатации
флота
УТВЕРЖДАЮ
Заместитель министра рыбного хозяйства СССР Е.Д.Ширяев 17.II.1990 г.
(ГИЛРОРЫБФЛОТ)
УТВЕРЖДАЮ
Заместитель главного Государственного санитарного врача СССР А.М.Скляров 03.04.1991 г.
№ 5780-91
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО КОНТРОЛЮ
В РЫБНЫХ ПРОДУКТАХ ПАРАГЕМОЛИТИЧЕСКИХ ВИБРИОНОВ - ВОЗБУДИТЕЛЕЙ ПИЩЕВЫХ ТОКСИКОИНФЕКЦИЙ
Дата введения 01.II.91 г.
Ленинград
1991
научно-практической конференции по проблеме "холера". Ростов-на-Дону, 1984, с.107.
11. Либинэон Л.Ё. Перспективы медико-географического картографирования ареалов парагемолитичвских вибрионов. - В кн.: ’'Проблемы медико-географических исследований”. М., I9B4, с Ш.
12. Медико-биологические требования и санитарные нормы качества продовольственного сырья и пищевых Продуктов, Минздрав СССР, * 5061-09. М., 1990.
13. Методические рекомендации: " Пищевые токсикоинфекции, вызываемые V.para^oemolyticua и их-диагностика", М., 1975.
14. Методические рекомендации по лабораторной диагностике, эпидемиологии, лечению и профилактике заболеваний, вызываемых парагемолити-ческими и другими условно-патогенными морскими вибрионами, Ростов-на-Дону, 1985.
15. Пивоварс-з Ю.П., Григорьев D.H., Зиневич Л.С. Обнаружение
V.pbraheemoiyticue 0 гидробионтах прибрежных заливов Японского
моря, - В сб,: "Гигиенические аспекты охраны,окружающей среды". Вып.З. М., 1976, с,III.
Методические указания разработаны
институтом ,,Гиnpapыбфлoт,,:
А.С.Сазонова, И.И.Призренова, канд»биол.наук Р.М.Курдина, Н.А.Щедрина
Институтом питания АМН СССР: д-р биол.наук, зав. лабораторией санитарно-пищевой микробиологии и микроэкологии, профессор И.Б.Куваева, ведущий научный сотрудник, канд. мед. наук С.А.Шевелева
ВВЕДЕНИЕ
Галсфильные парагемолитические вибрионы широко распространены в морских бассейнах многих стран мира. Они обнаруживаются в морской воде, рыбе, беспозвоночных и планктоне. Встречаемость указанных микроорганизмов в гидробионтах зависит от сезона года, районов лова, загрязненности, температуры, солености воды и других (ректоров. Эпидемиологическая обстановка по парагемолитическим вибрионам в районах лова ухудшается чаще в теплый период года.
Галофильные вибрионы активно размножаются при концентрации хлорида натрип в среде от 3 до 8%. Количество их в воде, морепродуктах может колебаться от единиц до сотен тысяч клеток в I г и более.
Галофильные парагемолитические вибрионы относятся к группе потенциально патогенных микроорганизмов.
При попадании в организм человека с продуктами моря, особенно не подвергнутыми термической обработке, парагемолитические вибрионы способны вызывать пищевые токсикоинфекции, протекающие по типу острых гастроинтеритов, в отдельных случаях носящих холероподобный характер. Доза инфскта - I06 и более жизнеспособных клеток в I г продукта вызывает заболевание.
При наличии эпидемиологической ситуации настоящие указания предусматривают выявление парагемолитических вибрионов в сырье: свежем, охлажденном, мороженом; в готовой продукции из рыбы и морских беспозвоночных: кулинарной, холодного и горячего копчения, соленой, пряной, маринованной, вяленой, сушеной, белковых продуктах, икре, пресервах. Периодически сырье необходимо контролировать при экологическом неблагополучии водного бассейна региона лова.
Анализы по выявлению в рыбопродукции парагемолитических вибрионов осуществляют учреждения государственного санитарного надэора, лаборатории научно-производственных рыбопромыпленных объединений, лаборатории научно-исследовательских институтов рыбной промышленности на договорных нзчалах.
В Методических указаниях представлены показатели допустимой обсемененности сырья и готовой продукции из рыбы и морских беспозвоночных, методы отбора проб, методики выявления и подсчета пара-гемолигических вибрионов, рецептура питательных сред, гигиеническая оценка, пищевых рыбных продуктов, рекомендации, литература.
С изданием настоящих Методических указаний утрачивают силу Временные методические рекомендации по контролю за содержанием V.parahaemolytxcua в рыбе и рыбопродуктах. Методы исследования и нормативы, № 3933-85, утв. Минздравом СССР 20.09.85.
I. МИКРОБИОЛОГИЧЕСКИЕ НОРМАТИВЫ ДЛЯ ПАРАШОЛИТИЧВСКИХ ВИБРИОНОВ
Допустимое количество парагемолигичоских вибрионов в сырье (свежем, охлажденном, мороженом) не должно превышать 10 КОЕ/г.
Допускается присутствие вибрионов др £00 Ш/г прн ушш
Нанр&^лРНИп йьфвЯ ПН *Ш0Л&Гт!еёпУга fl§lJ«pd86flty! ййМПВйЛЧйШо* НрОпАНП пнеол» ШЧР&бРЗб9?№
Ifep?Wdfl1TO9Sl«ifl ШМШл ДММ 8*б£?6?Ша®2 2 Й * 9ЬЩ
(miw, уьщш и дн*ь в шу в ьырон адь с
5 Й * Щиз
ё ЫртМ MPmWHM г*б9ПрЬДЯНкй едОДМ1М« тбЗДНвЮ й аддон дзпчадя, вдоэдЮ) ввшой; пдаи, юйт§8Бш)бой ДО* mmh доиоч wbaykhphi вмцеввс wgpw и юявтод о»« рвтеяятявт вибрионов, и? кювадюэд яа *мшь «фадш* jo m/ft
if якр ш ч шт аттк, цншш в лада?
Отбор про? н pewarouf й $чадн§у ЙЯО20ЯЙР еишем Г69Т 1бв№8$ и 2MMS# itoww и знуеовые вводун*ы и Инсурутат до сднн?арне=м»мф0Сиодогичвиному контроле мронэмояст продушит
ЙЙ рыОУ А «Орет О0СПО9РОИОЧШЛС, 19$>1.
Отбор проб для микробиологических исследований производится о соблюдением правил асептики оторидышм нояом« скальпелем или лин-иотом в стерильные банки или бумагу общей доимой рыбы или продукции около 200 г (икры - 25 г).
Пробы от крупной рыбы* свежей, охлажденной» морожеирп, соляной, пряной, маринованно!!, оуменой, вяленой, копченой и крупных экземпляров морских беспозвоночных отбирают но Со лее З-х штук# От каждого экземпляра ив нескольких меот выровают кусочки о кожей и мышцами, у нопогрошеных 'экземпляров - дополнительно часть яабер и кишечника. Мелкую рыбу (3 - 10 шт.) ив равных мест исследуемой партии берут целиком.
Пробу измельчают, берут навеску массой 25 г, гомогенизируют в размельчитале тканой или стерильной ступке о 2-3 г стерильного кварцевого песка.
При количественном определении парагемолитических вибрионов подготовленную навеску массой 25 г переносят в стерильную колбу, добавляют 225 сч5 0,1%-ного раствора попгонней лодц с 3% хлорида
- б -
натрия. Полученное разведение тщательно взбалтывают, не допуская намокания пробки, и готовят последующие десятикратные разведения (1:100 и 1:1000), определенные объемы которых засевают на плотную среду.
Для выявления отсутствия-присутствия парагемолитических вибрионов отбирают подготовленную навеску массой 25 г и Переносят в 100 см3 жидкой среди обогащения (п.5.3).
3. МЕТОДЫ АНАЛИЗОВ
Методы основаны на выявлении типичных колонии, вырастающих на дифференциально-диагностическом агаре при посеве разведений продукта и установлении принадлежности бактерий к парагемолитическим вибрионам по морфологическим и биохимическим свойствам.
При количественном учете парагемолитических вибрионов из первого разведения производят посев по 0,2 см3 на 5 чашек с плотной дифференциально-диагностической средой - ДДЛ (п.5.4), т.е. высевают 0,1 г продукта; из разведения 1:100 высевают по 0,1 см3 на две параллельные чаики (0,001 г продукта на I чашку). Аналогично производят посев из разведения 1:1000 (0,0001 г продукта на I чашку). Посевной материал втирают досуха. Чашки инкубируют при температуре 37°С в течение 24 ч.
Для выявления отсутствия-присутствия парагемолитических вибрионов пробу массой 25 г в 100 см3 среды обогащения термостатируют при температуре 37°С 18-24 ч. Затем производят г.ересев на ДДА таким образом, чтобы получить рост изолированных колоний. Чашки инкубируют при температуре 37°С в течение 24 ч.
Учитывают рост типичных колоний: плосковыпуклые полупрозрачные колонии правильной округлой формы с ровными краями, влажной блестящей поверхностью, голубовато-зеленоватого цвета на аналогичном фоне среды.
Для подтверждения принадлежности выделенных на дифференциально-диагностических средах микроорганизмов к парагемолитическим вибрионам проводят изучение их морфологических свойств, биохимическое тестирование при использовании специальных питательных сред или систем индикаторных бумажных (СИБ) для идентификации вибрионов.
С этой целью из изолированных колоний, характерных.или подозрительных на парагемолитические вибрионы, делают препараты, окрашивая по Граму, и микроскопируют.
Парагемолитические вибрионы - грамотрицательные палочки, пря-
ьше или слегка изогнутые (0,8-5,О мк), не образующие спор, активно подвижные содержат цитохромоксидазу, не расщепляют лактозу и сахарозу, хорошо растут на питательных средах с содержанием хлорида натрия от 3 до 8#, декарбоксилируют лизин, образуют индол, ферментируют (без газообразования) арабиноэу, глюкозу, мальтозу. При контроле сырья и рыбных продуктов достаточным будет перечень вышеуказанных специфичных тестов для идентификации вибрионов.
В целях клинической диагностики или эпидемиологического расследования перечень тестов для идентификации выделенных парагемоли-тических вибрионов будет намного расширен. В этих случаях исследования проводятся в соответствии с действующей Инструкцией о порядке расследования, учета и проведения лабораторных исследований в учреждениях санитарно-эпидемиологической службы при пищевых отравлениях,
№ 1135-73, Минздрав СССР.
Для идентификации выбранных бактерий делают пересев с ДДА на 1£-ную пептонную воду с 3/4 хлорида натрия (п.5.2). На пептонной воде парагемолитические вибрионы дают помутнение с образованием нежной голубой пленки.
Тест подвижности
Подвижность определяют при микроскопировании с помощью фазовоконтрастного иикроскопа в раздавленной капле или при посеве уколом односуточной бульонной культуры в полужидкий агар (0,25# агара), содержащий 3# хлорида натрия. Посевы инкубируют при температуре 3?°С в течение 2*» ч. Подвижные формы образуют диффузное помутнение, слабоподвижные вырастают по ходу укола.
Тест на оксидаэную активность
Для определения наличия цитохромоксидазы исолодуеыую односуточную культуру засевают на поверхность щелочного агара (PH 8,0), содержащего 3# хлорида натрия (п.5.5), термостатируюг при температуре 37°С в течение 18 ч. Затем на выросшую в чашке культуру наносят I каплю реактива для определения цитохромок-сидазы или делают штрих из колонии на фильтровальной бумаге, смоченной реактивои (п.5.13). Если оксидаэный тест положительный, через 1-3 мин наблюдается окрашивание в ярко-синий цвет.
Наличие цитохромоксидазы является отличительным признаком от семейства кишечных палочек Enterobacteriaceae, которые не обладают оксидазной активностью.
Рост на лактозо-сахарозной среде
Отношение к лактозе и сахарозе определяют путем засева куль-
туры штрихом по скошенной поверхности и уколом в столбик среди, содержащей 3% хлорида натрия, лактозу, сахарозу и индикатор (п.5.7). Инкубируют при температуре 37°С в течение 18 ч. Параге-молитические вибрионы цвет среды не изменяют, газа не образуют.
Можно использовать среды Ресселя, Клигера. Парагемолитичес-кие вибрионы ферментируют глюкозу, не ферментируют лактозу, не образуют сероводород (наклонная поверхность столбика красная, столбик - желтый, газ и сероводород отсутствуют).
Галофильные свойства
Для определения гвлофильных свойств культуру засевают в 5 см3 ЦИгой пептонной воды (PH 7,8) без содержания и с содержанием 3, 8 и 10% хлорида натрия (п. 5.2). Посевы термостатируют при температуре 37°С в течение 24 ч. Парагемолитические вибрионы хорошо развиваются в средах, содержащих от 3 до 0% хлорида натрия, и не дают роста в средах, не содержащих хлорида натрия или содержащих 10% хлорида натрия.
Тест декарбоксилазной активности
Декарбоксилаэную активность микроорганизмов определяют на среде ДАГВ с добавлением аминокислоты лизина (п.5.6). Для этого в две пробирки с этой средой засевают по 0,1-0,2 см5 односуточной бульонной культуры или по 2 петли агаровой культуры (одна пробирка с аминокислотой - лизином и вторая - контрольная).
После посева в каждую пробирку добавляют 0,5 см5 стерильного вазелинового масла и териостатируют 24 ч при температуре 37°С.
Если микроорганизмы вырабатывают декарбоксилазу к аминокислоте, то после окисления глюкозы происходит подщелачивание среды, и она приобретает фиолетовый оттенок. Если реакция отрицательная, среда становится желтой.
Для вибрионов характерно декарбоксилирование лизина.
Образование декарбоксилавы к лизину является отличительным признаком от образующих газ представителей рода Aeromonae, среди которых есть галофильные микроорганизмы.
Тест на образование индола
Для определения способности микроорганизмов образовывать индол в 5 см3 питательной среды (п.5.2) засевают I петлю односуточной бульонной культуры. Под пробку вставляют специально приготовленные бумажки на индол (п.5.14). Термостатируют 24 ч при 37°С. При росте парагемолитических вибрионов образуется индол, при этом