Федеральная служба по напору в сфере защиты прав потребителей н благополучия человека
1.2. ГИГИЕНА. ТОКСИКОЛОГИЯ. САНИТАРИЯ
Медико-биологическая оценка безопасности наноматериалов
Методические указания МУ 1.2.2635—10
ББК51.2
M42
M42 Медико-биологическая оценка безопасности наноматериалов: Методические указания.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора. 2010.—122 с.
1. Лвюрский коллектив: Федеральная служба но надзору в сфере защиты нрав потребителей и благополучия человека (Г. Г. Онищенко). Учреждение Российской академии медицинских наук научно-исследовательский институт питания РЛМН (В. А. Тутельян, И. В. Гмошинский. С. А. Хотимченко. И. В. Аксенов. Е. А. Арианова. В. В. Бессонов. В. М. Верников. М. М. Гаи-паров. Р. В. Распопов. В. В. Смирнова. А. А. Шумакова. О. Н. Та на нова. О. И. 11ередеряев); Федеральное государственное учреждение науки «Государственный научный центр прикладной микробиолог ии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (И. А. Дятлов, В. П. Холоденко, В. А. Чугу нов. Е. Н. Кобзев. В. Д. Потапов. Т. И. Рудницкая. Н. С. Грищенко. II. А. Шрамко. В.В. Фирстова. Г. М. Тшарсва. И. В. Бахтесва. А. С. Бутыркина. О. В. Полежаева. Е. В. Зы-рина. А. И. Борзилов. Т. И. КомбароваХ Учреждение Российской академии медицинских наук научно-исследова1ельский институт эпидемиологии и микробиологии им. Почетного академика Н. Ф. Гамалеи РАМН (А. Л. Гинцбург, Б. С. Народицкий. М. М. Шмаров. Д. Ю. Логунов. Л. Н. Нестеренко. Н. А. Зи-гангирова. К). М. Романова. А. Ф. Мороз. М. В. Мезенцева. Д. В. Щебляков. И. Л. Гутыхина. Л. В. Черепова, А. И. Тухватулин. И. К). Грибова); Государственное учебно-научное учреждение Биологический факультет Московского государственного университета им. М. В. Ломоносова (М. П. Кирпичников. К. В. Шайтан. А. П. Бонарцев. А. В. Феофанов. Т. Г. Сазонтова. Ю. В. Архипенко. Д. В. Ба1ров); Учреждение Российской академии наук «Цсшр «Биоинженерия» РАН (К. Г. Скрябин. О. А. Зейналов, Н. В. Равин, С. И. Комбарова); Учреждение Российской Академии наук Институт биохимии им. А. Н. Баха РАН (В. О. Попов. Б. Б. Дзантиев. А. В. Жердев. Н. В. Голуб); Федеральное государственное унитарное предприятие «Всероссийский научно-исследовательский институт метрологической службы» (ФГУП ВНИЙМС) (С. А Ко-ноногов. С. С. Голубев); ООО «Интсрлаб» (А. Н. Веденин. Г. В. Казыдуб).
2. Разработаны в рамках реализации Федеральной целевой программы «Развитие инфраструктуры наноиндустрии в Российской Федерации на 2008 2010 гг.».
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации Г. Г. Онищенко 24 мая 2010 г.
4. Введены в действие с 24 мая 2010 г.
5. Введены впервые.
ББК51.2
© Роспотребнадзор, 2010 © Федора. 1Ы1МЙ центр гигиены н
ипмемно. ни нн Роспотребнадзора, 2010
МУ 1.2.2635—10
3.5.2. Медико-биологическое тестирование наноматериалов, требующее исполь'ювания лабораторных животных, поводится только на здоровых животных, прошедших карантин.
3.5.3. Животные, используемые в экспериментах, должны иметь ветеринарный сертификат. Преимущественно должны использоваться свободные от патогенной микрофлоры SPF линейные виды.
3.5.4. Для обеспечения индивидуального наблюдения в процессе выполнения исследования животные должны быть идентифицированы. Способ идентификации животного документируется. Все клетки, вольеры. контейнеры, предназначенные для содержания животных, также подлежат маркировке.
3.5.5. Помещения для лабораторных животных должны обеспечивать изоляцию (карантин) поступающих животных, больных животных и животных, подозреваемых в носитсльстве инфекций: позволять осуществлять раздельное содержание различных видов животных и животных одного вида, соответствовать санитарно-эпидемиологическим и ветеринарным требованиям. Животные, предназначенные для исследования различных наноматериалов, пространственно изолируются друг от друга.
3.5.6. Корма, оборудование и инвентарь для ухода за животными необходимо хранить в помещениях, изолированных от мест содержания животных.
3.5.7. Исследования безопасности наноматсриалов на животных проводятся в соответствии с установленными правилами. Исполнителем должен быть обеспечен контроль за соблюдением правовых и этических норм использования лабораторных животных в соответствии с утверждённым протоколом.
3.5.8. Корма и вода для животных должны обеспечивать пищевые потребности в соответствии с протоколом исследования и действующими нормативными документами.
3.5.9. Результаты медико-биологического тестирования безопасности наноматсриалов заносятся в протокол, в котором отражены цели работы и методы, используемые в работе. Протокол исследования утверждается руководителем организации, проводящей исследования, и включает: цель и задачи исследования, имеющиеся сведения о тестируемом наноматериале (физические, химические, биологические, токсикологические свойства), используемые стандарты, схему проведения медико-биологического тестирования и се обоснование, методы введения наноматериала в биологические объекты, применяемые дозы наноматс-
риала, методы исследования, определяемые показатели, результаты исследований. метрологическую характеристику анализа, статистическую обработку результатов исследования, заключение, список используемой литературы.
3.5.10. Вносимые изменения в протокол исследования и отклонения от протокола (незапланированные события, непредвиденные обстоятельства и т. д.) записываются, пронумеровываются, подписываются руководителем исследования, датируются в приложении с указанием причин и утверждаются руководителем организации.
3.6. Требования к оформлению отчета.
3.6.1. По окончании медико-биологического тестирования безопасности наноматериалов на модельных биологических тест-системах оформляется отчет, в котором должны быть представлены: название, адрес организации, даты начала и завершения исследований, цель и задачи исследования: характеристика тестируемого нано материала, включая имеющиеся сведения о физических, химических, биологических, токсикологических свойствах: перечень протестированных образцов наноматериала и применяемых стандартов, метод введения наноматериала в биологические объекты, схема проведения исследования, описание методов статистической обработки результатов, результаты исследования. представленные в виде обобщающих таблиц, рисунков с соответствующей статистической обработкой, обсуждение результатов, выводы. список использованной литературы.
3.6.2. Отчет о результатах проведенного исследования составляется ответственным исполнителем, утверждается руководителем организации и скрепляется печатью организации.
3.7. Система обеспечения качества медико-биологического тестирования безопасности наноматериалов.
3.7.1. Контроль за качеством проведения медико-биологического тестирования безопасности наноматериалов включает в себя оформление перечня исследований, проводимых в организации, с указанием для каждого исследования руководителя и заказчика, названия определяемого наноматериала, даты начала и состояния каждого исследования на текущий момент времени, оценку протоколов и методов исследования на соответствие правилам лабораторной практики, мониторинг текущих исследований, отчет о проведенных проверках и рекомендации по устранению недостатков.
3.7.2. Для осуществления контроля качества руководитель организации. проводящей меди ко-биологическое тестирование безопасности
МУ 1.2.2635—10
наноматериалов, назначает в соответствии с правилами надлежащей лабораторной практики ответственных лиц за мониторинг исследования из числа сотрудников, нс участвующих в исследовании.
3.8. Стандартные операционные процедуры (СОП).
3.8.1. СОП разрабатываются организацией, проводящей медико-биологическую оценку безопасности на но материалов, на вес производственные операции, включая: поступление, идентификацию, маркировку. отбор, обработку проб, использование и хранение исследуемых проб, хранение и аттестацию стандартов: обслуживание и калибровку измерительных приборов и оборудования: ведение биологических тест-систем и их поддержание в функциональном состоянии: приготовление реактивов. ведение записей, отчетов и их хранение: обслуживание помещений: обезвреживание или утилизацию нано материалов, содержащих образцы и использованные компоненты биологических тест-систем (если это необходимо): осуществление программы по обеспечению качества, и утверждаются руководителем организации.
3.8.2. Соблюдение СОП осуществляется в целях обеспечения качества. достоверности и воспроизводимости результатов исследования.
3.8.3. Отклонения от СОП должны быть документально оформлены. подписаны руководителем исследования и утверждены руководителем организации.
3.8.4. Организация, проводящая исследование по медикобиологической оценке безопасности наноматериалов, обязана:
• иметь утвержденный порядок приема и учета поступления анализируемых проб и стандартов наноматериалов:
• проводить учет анализируемых проб и стандартов наноматсриа-лов при поступлении, расходовании, возврате заказчику или их утилизации:
• принимать меры по обеспечению идентификации исследуемых веществ (название, химическая <|юрмула. номер серии, дата выпуска, условия хранения и срок годности) и их стабильности на протяжении всего исследования. Для образцов наноматериалов на этикетке дополнительно должны указываться размер, форма частиц, при необходимости удельная площадь поверхности и кристаллическая структура.
3.9. Меры конфиденциальности.
3.9.1. Сотрудники, принимающие участие в проведении медико-биологического тестирования безопасности наноматериалов, обязаны соблюдать конфиденциальность в отношении любых данных, получен-
13
ны.\ в ходе исследования, в соответствии с законодательством Российской Федерации.
3.9.2. Организация, проводящая исследования по медико-биологической оценке безопасности наноматериалов, должна обеспечить конфиденциальность результатов исследований в рамках принятых сю обязательств и в соответствии с законодательством Российской Федерации.
4. Медико-биологическое тестирование безопасности наноматериалов на культурах клеток высших животных
7. /. Требования к используемым культурам клеток
Используемые в экспериментах перевиваемые культуры клеток должны быть получены из организаций, сертифицированных по соответствующему профилю. На хранение и ведение культур клеток и тканей должны составляться инструкции или СОП. гарантирующие качество клеточных и тканевых культур. Перед использованием культу ры клеток должны быть протестированы на жизнеспособность и функциональную активность и иметь соответствующий стандарт, указанный в методике.
Работы по исследованию токсичности и биологической активности нано материалов на первичных и перевиваемых культурах тканей in vitro. а также на первичных культурах макрофагов в системе ex vivo должны проводиться по утвержденным инструкциям и СОП. Эти документы должны регламентировать каждый этап эксперимента, соответствовать требованиям проведения безопасных работ с данным видом материалов.
4.2. Схема введения наноматериалов животным и сроки наблюдения
Группы мышей обрабатывают исследуемым наноматериалом для определения острой токсичности аэрозольно. подкожно, внутривенно, псритонсально. внутрижслудочно (в зависимости от предполагаемого пути попадания наноматериала). Исследования проводят на 1. 10 и 30-е сутки после введения наноматериалов на животных.
Для изучения хронической иммунотоксичности животных подвергают воздействию наноматсриала ежедневно на протяжении 21 дня. Исследования проводят на 1. 30 и 60-е сутки после окончания введения наноматериалов.
МУ 1.2.2635—10
4.3. Подготовка аэразолъно обработанных ианоматершишми
животных
В экспериментах по воздействию наночастиц в аэрозольном состоянии используются морские свинки, линейные белые мыши для последующего получения и изучения in vitro их альвеолярных макрофагов. Животные обрабатываются аэрозольно в затравочной камере. Затравочная камера должна иметь объем не менее 100 дм3 и позволять одновременно обработать до 10 морских свинок или до 60 мышей, которых предварительно помещают в специальную корзину. Аэрозоль генерируется из водной или водно-органической дисперсии наноматериала калиброванным стеклянным распылителем, представляющем конструктивно трубку Вентури с объемом распыляемой жидкости до 7 см3. Система снабжается НЕРА-фильтра.ми на входе воздушного потока, на выходе воздух фильтруется через НЕРА-фильтр с термообработкой выходящего воздуха при температу ре 840 °С. Камера имеет возможность регулирования времени ингаляции аэрозоля, времени распада облака. Работает по заранее выбранной программе в автоматическом режиме.
Перед экспериментом необходимо провести подбор рецептур жидкости для распыления предлагаемого для исследования наноматериала, исходя из его физико-химических свойств и токсичности самой жидкости. После обработки животные выдерживаются в условиях вивария необходимое количество времени и далее поступают либо на гистологические эксперименты, либо из них получают альвеолярные макрофаги с целью изучения их функций в условиях in vitro в культуре тканей. Последним исследованиям придается особое значение, т. к. на макрофагах одного и того же животного возможно исследовать действие различных веществ в разных концентрациях и оценить различные функции (фагоцитоз. бактерицидную активность, цитотоксичность, окислительный взрыв).
4.4. Приборы и оборудование
4.4.1. Средства измерения:
Весы лабораторные электронные, погрешность при измерении нс более 0.001 г. Sartorius Германия или аналогичные:
Весы лабораторные общего назначения по ГОСТ 24104-2001
pH-метр лабораторный МР220
Mettlcr-Tolcdo GmbH. Швейцария или аналогичный
15
4.4.2. Оборудование:
Цитофлюориметр FACSCalibur. BD - 2 - лазерный с возможностью одновременной детекции 4 различных флюорохромов или аналогичный Плашсчный термостатируемый универсальный сканер (|)люорссцснтных сигналов. Victor. Perkin Elmer или аналогичный
Планшетный спектрофотометр Titcrtck Multiscan Plus или аналогичный
Планшетный сцинтилляционно-лю.минесцентный счетчик Top Count. Packard. США или аналогичный Термостат, поддерживающий рабочую температуру +28—15 °С с отклонением
от заданной ± 1 °С ТУ 64-1 -1382—72
Ламинарный шкаф марки ЛШ1 фирмы Biokom
или аналогичный отечественный ламинарный
шкаф БОВ-001-АМС (вариант СПШ). Россия
Центрифуга со скоростью вращения ротора до
3 ООО об./мин для пробирок вместимостью 15 см1
СМ 6.03 ELMI (Латвия) или аналогичная
Встряхиватсль вибрационный типа «Вортскс»
со скоростью вращения до 3 ООО об./мин
Шейкер планшетный термостатируемый
Холодильник бытовой электрический ГОСТ 26678-85
Мембранные установки для получения
деионизованной воды ОСТ 11-029.003—80
Облучатель бактерицидный настенный ОБН-150 Автоклав ВК-75. завод медоборудования. г. Тюмень. Россия
Аппарат для приготовления деионизованной воды Dircct-Q 5. Milliporc. США или аналогичный Баня водяная с электрическим подогревом.
ГСП-2, завод РЭМО. г. Львов. Украина или аналогичная
Дистиллятор ДЭ-4-2. завод медоборудования. г. Саранск. Россия
Морозильная камера бытовая, обеспечивающая температу ру - 18 °С. Stinol. Россия Шкаф сушильный ШС-80-01 СПУ. ОАО «Смоленское СКТБ СПУ» или аналогичный
МУ 1.2.2635—10
С 'одержание
1. Область применения...............................................................................................6
2. Введение..................................................................................................................7
3. Общие положения...................................................................................................8
4. Медико-биологическое тестирование безопасности наноматериалов на
культурах клеток высших животных................................................................14
4.1. Требования к используемым культурам клеток.........................................14
4.2. Схема введения наноматериалов животным и сроки наблюдения...........14
4.3.11одготовка аэрозольно обработанных наноматериалами животных......15
4.4. Приборы и оборудование.............................................................................15
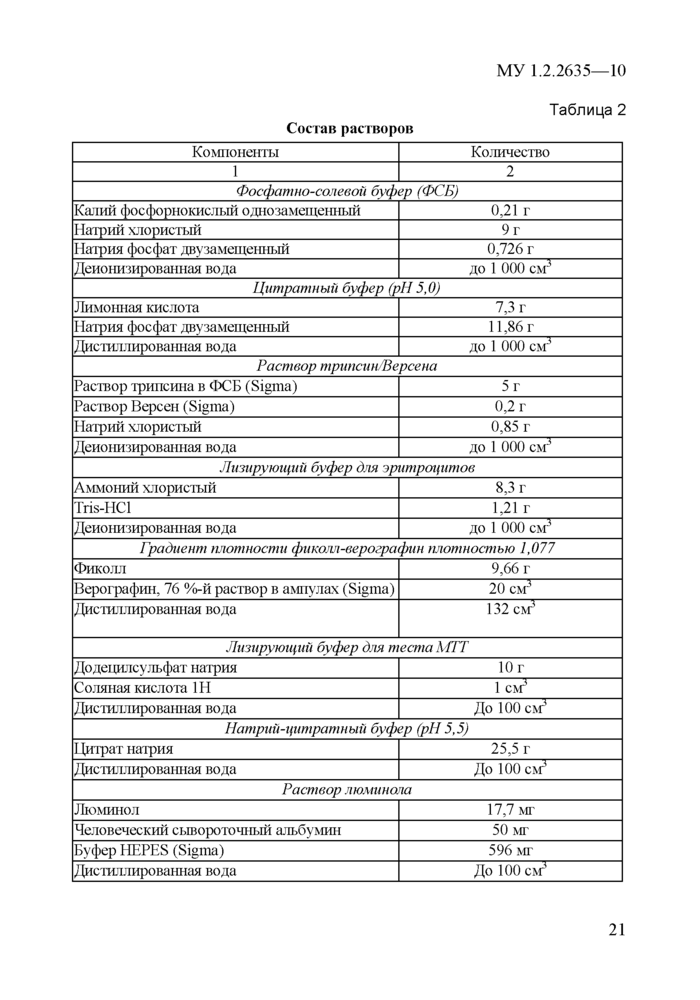
4.5. Материалы и реактивы.................................................................................17
4.6.11риготовление растворов и сред................................................................20
4.7. Получение и культивирование клеточных культур...................................22
4.7.1. Получение первичных клеточных культур........................................22
4.7.2. Ведение и подготовка перевиваемых клеточных культур к
тестированию.........................................................................................24
4.8. Проведение тестирования безопасности нано материалов in vitro с
использованием клеточных культур...........................................................24
4.8.1.11одготовка клеточных культур и образцов наноматериалов к
тестированию и внесение образца наноматериала в культуру.........24
4.8.2. Ход тестирования.................................................................................26
4.9. Оценка цитотоксических свойств наноматериалов..............................26
4.9.1. Оценка цитотоксичности с помощью МТТ.......................................26
4.9.2. Оценка цитотоксичности путем определения активности
лактатдегидрогеназы............................................................................28
4.9.3. Оценка цитотоксичности путем определения
концентрации АТФ в лейкоцитах.......................................................29
4.9.4. Оценка влияния наноматериалов на функциональную
активность макрофагов........................................................................31
4.9.5. Определение активности ферментов, участвующих в
«респираторном взрыве»......................................................................34
дифференцировку моноцитарных клеточных культур в макрофаги. 36
4.9.6. Оценка влияния нано материалов на ФМА-индуцированную
4.9.7. Оценка влияния нано материалов на продукцию макрофагами
фактора некроза опухоли-альфа.........................................................37
4.10. Оценка иммунотропного действия наноматериалов...............................40
4.10.1. Оценка влияния наноматериалов на поликлональную
активацию лимфоцитов в реакции бластлрансформации лимфоцитов........................................................................................40
4.10.2. Оценка влияния наноматериалов на продукцию лимфоцитами
интерферона-гамма (И11Ф-у) методом ИФА...................................42 1
МУ 1.2.2635—10
4.11. Оценка безопасности нано материалов методом проточной цито фл кюри метрик но качественным и количественным изменениям в клетках высших животных................................................43
4.11.1. Определение содержания Т- и В-лимфоцитов и
соотношения Т-хелперов и цитотоксических Т-лимфоцитов........44
4.11.2. Выявление маркера ранней активации лимфоцитов.......................45
4.11.3. Оценка апоптотической и пролиферативной активности
лейкоцитов.........................................................................................48
4.11.4. Оценка цитотоксического действия нано материалов на
лейкоциты периферической крови человека...................................49
4.11.5. Определение цитолитической активности лимфоцитов................50
4.11.6. Оценка фагоцитарной активности перитонеальных
макрофагов животных.......................................................................51
5. Оценка безопасности наноматериалов с использованием
в качестве тест-объекта семян высших растений...............................................53
5.1.11ринцип биотестирования на проростках высших растений...................53
5.2. Оборудование, материалы, реактивы.........................................................54
5.3. Характеристика тест-систем........................................................................55
5.4. Условия тестирования..................................................................................55
5.5. Подготовка к проведению тестов................................................................55
5.5.1. Подготовка посуда для биотестирования..........................................55
5.5.2. Подготовка субстрата для проращивания семян
высших растений..................................................................................56
5.5.3. Приготовление исследуемых проб наноматериалов.........................56
5.5.4. Подготовка семян.................................................................................57
5.6. Процедура биотестирования........................................................................57
5.7. Оценка и интерпретация результатов биотестирования...........................57
6. Оценка безопасности нано материалов с использованием интегральных
тестов на лабораторных животных......................................................................58
6.1. Предварительные замечания.......................................................................58
6.2. Методики измерения легочной функции....................................................60
6.2.1. Методика измерения легочной функции /// vivo -
электроплетизмография........................................................................60
6.3. Методики измерения функций сердечно-сосудистой системы................63
6.3.1. Тестирование безопасности нано материалов
на инвазивной модели тромбогенеза...................................................63
6.3.2. Методика электроплетизмографического измерения
артериального давления в хвостовой артерии....................................67
6.3.3. Методика регистрации АД с использованием
имплантируемых катетеров..................................................................71
4
МУ 1.2.2635—10
6.3.4. Методика регистрации ЭКГ у бодрствующих крыс
в покое и при стрессирующем воздействии.......................................87
6.4. Тестирование безопасности наноматериалов на основе
определения гематологических показателей лабораторш>1Х животных......................................................................................................93
6.4.1. Определение кинетики агрегации и дезагрегации
эритроцитов...........................................................................................93
6.4.2. Оценка деформационных свойств эритроцитов
и вязкости крови...................................................................................97
6.5. Оценка безопасности наноматериалов по интегральным
показателям системы детоксикации ксенобиотиков................................100
6.5.1. Метод гексеналовой пробы...............................................................100
6.5.2. Метод пробы с бромсульфалеином..................................................102
6.6. Оценка безопасности наноматериатов но интенсивности
местных воспалительных реакций............................................................104
6.6.1. Методика накожных аппликаций.....................................................104
6.6.2. Методика конъюнктивальной пробы................................................106
6.7. Тестирование безопасности наноматериатов но
поведенческим реакциям животных.........................................................108
6.7.1. Методика теста «открытое поле»......................................................108
6.7.2. Методика теста «приподнятый крестообразный лабиринт»..........111
6.7.3. Методика условного рефлекса пассивного избегания....................114
6.8. Тестирование безопасности наноматериатов на основе определения
физической выносливости животных.......................................................116
6.8.1. Метод истощающего плавания.........................................................116
6.8.2. Методика динамометрического измерения произвольной
силы скелетных мышц передних конечностей.................................118
Приложение 1. Нормативные ссылки..........................................................121
5
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в с(|)срс защиты прав потребителей и благополучия человека. Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
24 мая 2010 г.
Дата введения: 24 мая 2010 г.
1.2. ГИГИЕНА. ТОКСИКОЛОГИЯ. САНИТАРИЯ
Медико-биологическая оценка безопасности наноматериалов
Методические указания _МУ 1.2.2635—10_
1. Область применения
1.1. Настоящие методические указания устанавливают требования к медико-биологической оценке безопасности наночастиц и наноматсриа-лов искусственного происхождения на основе тестов на культурах клеток. семенах высших растений и лабораторных животных
1.2. Требования, изложенные в настоящих методических указаниях, применяются в ходе установления безопасности наноматериалов на стадиях их производства, оборота, использования и утилизации в Российской Федерации в целях принятия решений по оценке рисков, связанных с данными процессами.
1.3. Методические указания разработаны с целью обеспечения единства измерений и адаптации имеющихся методов и средств измерений в ходе оценки безопасности наноматериалов искусственного происхождения.
1.4. Методические указания предназначены для специалистов органов Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут быть использованы научно-исследовательскими организациями гигиенического профиля, медицинскими учебными заведениями и иными организациями и учреждениями, проводящими исследования по оценке безопасности наноматериалов.
2. Введение
Наноматериалы и наночастицы, являющиеся продуктом современных нанотехнологий, обладают комплексом уникальных свойств, которые открывают широкие перспективы их промышленного применения. Одновременно это создаёт риск возможных неблагоприятных воздействий наноматсриалов на организм человека, сельскохозяйственных животных и растения, компоненты природных биоценозов. В ближайшей перспективе следует ожидать резкого увеличения объёмов производства во веем мире и в России ряда приоритетных наноматериалов, в частности таких, как наночастицы оксидов, нитридов и карбидов кремния, титана. цинка, железа, церия, алюминия, вольфрама, металлические наночастицы железа, меди, кобальта, никеля, алюминия, серебра, золота, металлов платиновой группы, кремния, селена, квантовые точки, углеродные нанотрубки, фуллсрсны. наночастицы биополимеров и рекомбинантных вирусов. Это с неизбежностью приведёт к посту плению значительных количеств наноматериалов в окружающую среду, их накоплению в компонентах биоты и абиотических средах с последующей возможной передачей человеку.
В настоящее время накоплен значительный экспериментальный материал относительно токсичности некоторых наноматсриалов для живых организмов. Однако большинство исследований по изучению биологических эффектов наночастиц и наноматсриалов выполнено с помощью разнообразных, недостаточно стандартизированных методик и тест систем, причём полученные при этом результаты часто нс сопоставимы. В связи с этим большое значение приобретает разработка единой системы стандартных тестов, позволяющих оценивать безопасность новых искусственных наноматсриалов по их воздействию на показатели жизнедеятельности стандартизированных биологических систем.
Биологические системы, применение которых возможно для выявления вредных воздействий антропогенных веществ, к числу которых относятся искусственные наноматериалы, весьма разнообразны. В настоящее время их подразделяют на семь подгрупп в соответствии с основными биологическими дисциплинами: микроорганизмы, растения, простейшие организмы, клеточные и субклеточные элементы, различные гидробионты. организмы высших животных. Биотестирование -один из приемов исследования в области токсикологии, используемый с целью установления степени токсического действия химических, физических и биологически неблагоприятных факторов среды, потенциально опасных для человека и компонентов экосистем. Биотсстированис нс
7
отменяет систему аналитических и аппаратурных методов контроля за содержанием наноматериалов в природной среде, а дополняет се качественно новыми биологическими показателями, т. к. с точки зрения оценки рисков сами по себе определения концентраций токсикантов имеют относительную ценность. Важно знать нс только уровни экспонирования. но и вызываемые ими биологические эффекты. Кроме того, в отличие от физико-химического анализа, биологические методы позволяют оценить обобщенную, или интегральную, реакцию на действие неблагоприятных факторов, характеризуя направленность и скорость происходящих в организмах изменений.
Не существует универсальной тест-системы, способной обнаружить все возможные эффекты искусственных наноматариалов одинаково хорошо. Поэтом}’ на практике все более широкое применение находят наборы тестов, включающих использование различных тест-организмов (бактерий, водорослей, простейших, ракообразных, рыб. растений и ряд других). В настоящее время наибольшее внимание с точки зрения оценки интегральной токсичности почв и вод привлекают биотссты с использованием культу р микробных клеток и клеток высших животных, растений, ракообразных, физиологических и поведенческих реакций у высших животных.
В связи с вышеизложенным в качестве биотсстов для оценки потенциального вредного воздействия искусственных наноматериалов на живые организмы, входящие в состав природных экосистем, предлагаются микроорганизмы: биолюминссцснтный тест на фотобактериях, почвенные микроорганизмы: бактерии Pseudomonas Jluorescens и Bacillus subtilis. дрожжи Candida lipolvtica, семена высших растений.
Настоящие методические указания разработаны в целях внедрения единого, научно обоснованного, стандартизированного количественного подхода к оценке безопасности искусственных наноматериалов. Разработка методических указаний осу ществлена в рамках Федеральной целевой программы «Развитие инфраструктуры наноиндустрии в Российской Федерации на период 2008—2010 гг.»
3. Общие положения
3.1. Проведение исследований по медико-биологической оценке безопасности наноматериалов определяется правилами надлежащей лабораторной практики.
3.2. Требования к стандартным и исследуемым на но материалам.
МУ 1.2.2635—10
3.2.1. Для верификации, стандартизации и калибровки методов, применяемых при медико-биологической оценке безопасности наноматериалов, используются стандартные образцы наноматериалов (стандарты).
3.2.2. Каждый стандартный образец наноматериала должен быть охарактеризован по показателям химического состава (включая наличие примесей), размеру и форме частиц, удельной площади поверхности, типу кристаллической структуры. Указанные характеристики определяются с использованием методов масс-спектрометрии с индуктивно связанной плазмой, трансмиссионной электронной микроскопии, определения изотерм адсорбции инертных газов, рентгенофазового (рентгенодифракционного) анализа. В случае стандартных образцов фуллеренов следует использовать метод обращеннофазовой ВЭЖХ.
3.2.3. Каждый стандартный образец наноматериала должен быть снабжен «Паспортом безопасности наноматериалов», который должен быть составлен в соответствии с ГОСТ 30333-2007.
3.2.4. Стандартные образцы наноматсриалов должны быть упакованы для защиты при транспортировании от загрязнения или порчи.
3.2.5. Хранение стандартных образцов наноматериалов осуществляется отдельно от остальных применяемых веществ с соблюдением условий хранения, указанных в «Паспорте безопасности», на протяжении всего срока годности образца.
3.2.6. Хранение и использование стандартных образцов наноматсриалов осуществляется в соответствии с утвержденным протоколом исследования.
3.2.7. Перед проведением тестирования наноматсриалов необходимо получить основные физико-химические характеристики наноматериалов. которые включают:
• химический состав наноматериалов (содержание основного вещества. содержание примесей и токсичных компонентов);
• содержание растворителей или носителей (если они использовались);
• рекомендуемый состав среды для получения дисперсий наночастиц;
• размеры и форма наночастиц;
• стабильность наночастиц при хранении.
3.3. Требования к используемому оборудованию.
3.3.1. Организации, проводящие исследования по мед и ко-био логической оценке безопасности наноматсриалов. должны быть оснащены
9
необходимым оборудованием, прошедшим метрологический контроль и калибровку в установленном порядке.
3.3.2. Эксплуатация оборудования проводится в соответствии с техническим паспортом и инструкцией по применению. Результаты проведения калибровки и текущего ремонта оборудования фиксируются в специальном журнале, доступном в любое время сотрудникам, эксплуатирующим оборудование или обеспечивающим его обслуживание.
3.3.3. Для каждого прибора, используемого в исследованиях, в журнале фиксируются следующие сведения: наименование прибора, наименование производителя, страна происхождения, модель прибора, серийный (заводской) номер, дата получения и постановки на учет в лаборатории, дата запуска в эксплуатацию, инвентарный номер, место расположения прибора.
3.3.4. Сотрудник, ответственный за использование и за техническое обслуживание прибора, должен делать записи о плановом обслуживании оборудования, датированные и заверенные подписью ответственного лица, записи о любых повреждениях, отказах, ремонте прибора, датированные и заверенные подписью сотрудника.
3.3.5. Лаборатории, проводящие исследования по медико-биоло-гическому тестированию безопасности наноматериалов методами, связанными с использованием радиоактивных изотопов, должны быть аккредитованы и иметь санитарный паспорт для работы с источниками ионизирующего излучения. Хранение, использование радиоизотопов и утилизация контаминированных ими материалов осуществляется в соответствии с СанПиН 2.6.1.2523—09 «Нормы радиационной безопасности (НРБ-99/2009)».
3.4. Требования к используемым тест-системам:
3.4.1. Характеристики тест-систем, используемых в экспериментах, должны быть паспортизованы и иметь документированный сертификат гарантированного срока использования. Условия проведения исследований на тест-системах должны выполняться строго по инструкции производителя или специально разработанного СОПа и исключать воздействие внешних факторов, способных повлиять на качество получаемых данных.
3.5. Планирование и проведение исследований.
3.5.1. Медико-биологическая оценка безопасности наноматсриалов проводится по утвержденному плану с ведением протокола и составлением отчета, в который заносятся все результаты исследований.
1