МР ФЦ/2174
Выявление генетически модифицированных источников (ГМИ) в пищевых продуктах растительного происхождения тест-системой "АмплиСенс Плант-скрин"
Купить МР ФЦ/2174 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации предназначены для применения в лабораториях учреждений санитарно-эпидемиологической службы Российской Федерации, осуществляющей контроль за качеством продовольственного сырья и пищевых продуктов, в т.ч. импортируемых в Российскую Федерацию, гигиеническую оценку и выдачу санитарно-эпидемиологических заключений, в лабораториях других организаций, аккредитованных в установленном порядке на право проведения контроля безопасности пищевой продукции и продовольственного сырья. Методические рекомендации предназначены для применения при контроле растительного сырья и пищевых продуктов на наличие генетически модифицированных источников на этапах поставки на производство, гигиенической экспертизы, государственной регистрации, закупки, ввоза в страну и реализации
Оглавление
1. Общие положения и область применения
2. Нормативные ссылки
3. Сущность метода
4. Требования к помещениям и техника безопасности
5. Оборудование, материалы и реактивы
6. Отбор, хранение и подготовка проб пищевых продуктов для анализа
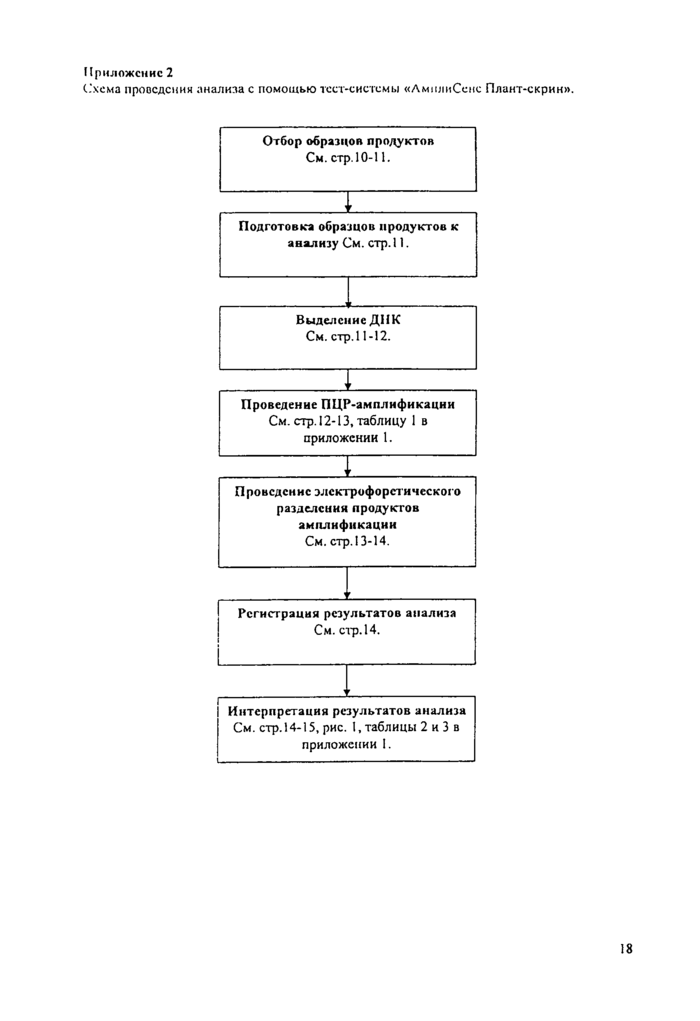
7. Порядок проведения исследования
8. Интерпретация результатов анализа
9. Утилизация отходов
10. Источники появления ложных положительных сигналов при проведении ПЦР диагностики и их предотвращение
Приложение 1. Программа для амплификации
Приложение 2. Схема проведения анализа с помощью тест-системы "АмплиСенс Плант-скрин"
| Дата введения | 23.06.2004 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 23.06.2004 | Утвержден | Зам. Главного Государственного санитарного врача РФ | |
|---|---|---|---|
| Разработан | Федеральный центр госсанэпиднадзора Минздрава России | ||
| Разработан | ГУ ЦНИИ эпидемиологии Минздрава России | ||
| Издан | Минздрав России | 2004 г. |
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- Постановление 554 Об утверждении Положения о государственной санитарно-эпидемиологической службе Российской Федерации и Положения о государственном санитарно-эпидемиологическом нормировании
- Приказ 325 О санитарно-эпидемиологической экспертизе продукции
- ГОСТ Р 52173-2003 Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения
- СанПиН 2.3.2.1078-01 Гигиенические требования безопасности и пищевой ценности пищевых продуктов
- МУ 4.2.1902-04 Определение генетически модифицированных источников (ГМИ) растительного происхождения методом полимеразной цепной реакции
- МУ 1.3.1888-04 Организация работы при исследованиях методом ПЦР материала, инфицированного патогенными биологическими агентами III - IV групп патогенности
- СП 1.3.1285-03 Безопасность работы с микроорганизмами I - II групп патогенности (опасности)
- Федеральный закон 29-ФЗ О качестве и безопасности пищевых продуктов
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
стр. 16
стр. 17
стр. 18
Государственное санитарно-эпидемиологическое нормирование Российской Федерации
Выявление генетически модифицированных источников (ГМИ) в пищевых продуктах растительного происхождения тест-системой «АмплиСенс Плант-скрин»
Методические рекомендации
Издание официальное
Минздрав России Москва 2004
Выявление генетически модифицированных источников (ГМИ) в пищевых продуктах растительного происхождения тест-системой«АмплиСенс Плант-скрин»
Методические рекомендации
(выдержанные в 96% этаноле и обожженные в пламени газовой горелки) инструменты, опечатывают и отправляют на анализ.
6,1.3. Пробы жидких продуктов отбирают в чистые емкости из стекла или пластика с герметично закрывающимися крышками объемом не более 50 мл, опечатывают и отправляют на анализ.
6.2. Подготовка образцов продуктов к анализу
6.2.1. Для подготовки проб необходимо использовать одноразовые полипропиленовые пробирки, ступки и пестики, предварительно обработанные хромовой смесью и фламбированные инструменты - пинцеты, скальпели, ножницы.
6.2.2. Пробы сухих гранулированных и сыпучих продуктов отбирают в ступку по 5-10 г и растирают пестиком до гомогенного состояния.
6.2.3. Пробы плотных продуктов (сырых или подвергшихся кулинарной обработке) весом 5-10 г помещают в ступку, измельчают ножницами, затем растирают пестиком до гомогенного состояния.
6.2.4. Пробы продуктов консистенции крахмала весом 100-300 мг помещают в
одноразовые пластиковые пробирки и добавляют 1,0 мл физиологического раствора. Для анализа необходимо 50 мкя образца.
6.2.5. Пробы жидкой консистенции отбирают автоматическими пипетками с
одноразовыми наконечниками в одноразовые пробирки из полипропилена. Для анализа необходимо 100 мкл образца.
6.2.6. Из полученных гомогенатов и суспензий проводят выделение ДНК.
6.3. Условия хранения и транспортирования
6.3.1. Образцы сырья и продуктов рекомендуется хранить в течение 1 месяца (при
необходимости повторного анализа) согласно условиям, указанным производителем продукта питания.
6.3.2. Образцы скоропортящихся продуктов рекомендуется хранить в замороженном состоянии (при температуре минус 20°С) в течение 1 месяца (при необходимости повторного анализа).
6.3.3. Транспортирование образцов осуществляют при температуре, рекомендованной для хранения сырья или пищевого продукта. Длительность транспортирования не должна превышать сроков годности продукта.
7. Порядок проведения исследования
7.1. Выделение ДНК из образцов продуктов, предварительно подготовленных к
исследованию.
(проводится в ЗОНЕ 1 - помещении для обработки исследуемого материала).
7.1.1. Буфер для лизирующего реагента и раствор для отмывки 1 (если они хранились при 2-8°С) прогреть при 64°С до полного растворения кристаллов.
7.1.2. Отобрать необходимое количество одноразовых пробирок, включая отрицательный контроль выделения ДНК. В пробирки, предназначенные для исследуемых проб, внести образцы исследуемых проб (см. раздел 6.2. «Подготовка образцов продуктов к анализу»), В пробирку отрицательного контроля выделения ДНК (ОК) внести 100 мкл отрицательного контрольного образца (ОКО).
7.1.3. Отдельными наконечниками с аэрозольным барьером внести в каждую пробирку по 400 мкл буфера для лизирующего реагента и по 17 мкл лизирующего реагента. Тщательно перемешать содержимое пробирок.
7.1.4. Инкубировать пробирки при 64°С в течение 1 часа, периодически встряхивая на вортексе (5 раз через каждые 10-12 мин).
11
7.1.5. Осадить нерастворенные частицы образцов центрифугированием при (12-14)х103 об/мин в течение 5 минут.
7.1.6. Надосадочную жидкость в объеме 200 - 350 мкл очень аккуратно (так, чтобы не попали взвешенные частицы и капли жира) отобрать отдельными наконечниками с аэрозольными барьерами и перенести в новые пробирки.
7.1.7. Пробы центрифугировать в течение 5 сек при 5х103 об/мин на микроцентрифуге для сброса капель с крышки пробирок.
7.1.8. Тщательно ресуспендировать сорбент на вортексе. В каждую пробирку отдельным наконечником добавить по 25 мкл ресуспендированного сорбента. Перемешать на вортексе, оставить в штативе на 10-15 минут, перемешивая через каждые 2 мин.
7.1.9. Осадить сорбент в пробирках центрифугированием при 5x103 об/мин в течение 1 мин. Удалить супернатант, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
7.1.10. Добавить в пробы по 300 мкл раствора для отмывки 1, перемешать на вортексе до полного ресуспендирования сорбента. Осадить сорбент центрифугированием при 5x103 об/мин на микроцентрифуге в течение 1 мин. Удалить супернатант, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
7.1 Л1. Добавить в пробы по 500 мкл раствора для отмывки 2, перемешать на вортексе до полного ресуспендирования сорбента, процентрифугировать 1 мин при (10-12)х 103 об/мин на микроцентрифуге. Отобрать супернатант, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
7.1.12. Повторить процедуру отмывки, следуя пункту 7.1.11., отобрать супернатант полностью.
7.1.13. Поместить пробирки в термостат 64°С на 5-10 мин для подсушивания сорбента. При этом крышки пробирок должны быть открыты.
7.1.14. В пробирки добавить по 50 мкл ТЕ-буфера для элюции ДНК. Перемешать на вортексе. Поместить в термостат 64°С на 5-8 мин, периодически (1 раз в минуту) встряхивая на вортексе.
7.1.15. Процентрифугировать пробирки при (12-14)х103 об/мин в течение 1 мин. на микроцентрифуге. Супернатант содержит очищенную ДНК, Пробы готовы к постановке ПЦР. Очищенную ДНК можно хранить в течение 1 недели при температуре от 2 до 8 °С и в течение 1 года - при температуре минус 20 °С.
7.2. Амплификация участка ДНК.
Проводится в ЗОНЕ 2 - комнате для подготовки и проведения ПЦР-амплификации. Общий объем реакции - 25 мкл, объем ДНК-пробы - 10 мкл.
Обязательно применение «горячего старта», который обеспечивается разделением нуклеотидов и Taq-полимеразы прослойкой воска. Плавление воска и перемешивание реакционных компонентов происходит только при 95 °С, что значительно снижает количество неспецифически затравленных реакций.
7.2.1. Подготовка пробирок для проведения амплификации.
7.2.1.1. Отобрать необходимое количество пробирок с ПЦР-смесью-1 и воском для амплификации ДНК исследуемых и контрольных проб.
7.2.1.2. На поверхность воска внести по 10 мкл ПЦР-смеси-2 («верхней»), при этом ПЦР-смесь-2 не должна проваливаться под воск и смешиваться с ПЦР-смесью-1.
7.2.1.3. Сверху добавить по 1 капле масла для ПЦР (примерно 25 мкл).
7.2.2. Порядок работы.
7.2.2.1. Использовать подготовленные для ПЦР пробирки. Под масло или непосредственно на масло, используя наконечники с аэрозольными барьерами, внести по 10 мкл ДНК, выделенной из исследуемых или контрольных проб этапа выделения ДНК.
12
7.2 2.2. Поставить контроля этапа амплификации;
а) отрицательный контроль (К-) - вместо ДНК-пробы внести в подготовленную пробирку 10 мкл ТЕ-буфера;
б) положительный контроль (К+ соя) - в подготовленную для ПТ ТР пробирку внести 10 мкл ПКО ДНК соя;
г) положительный контроль (К+ кукуруза) - в подготовленную для ПЦР пробирку внести 10 мкл ПКО ДНК кукуруза.
1.2.23. Запустить на амплификаторе нужную программу (см. табл. 1 в приложении 1). 7.2.2A Когда температура в ячейке амплификатора достигнет 95°С (93°С - при использовании амплификатора «GeneAmp PCR System 2700», Perkin Elmer) поместить пробирки в ячейки амплификатора, закрыть крышку прибора и снять программу с паузы. При работе с амплификаторами «GeneAmp PCR System 2400» и «GeneAmp PCR System 2700», Perkin Elmer, пауза устанавливается вручную. Время амплификации на амплификаторе с регулированием температур по матрице примерно 2 ч 30 мин, на амплификаторе с активным регулированием - 1
4 50 мин.
7.2.2,5. После окончания реакции собрать пробирки в специальный штатив и отправить в комнату для анализа продуктов ПЦР (ЗОНУ 3). Пробы после амплификации можно хранить 16 часов при комнатной температуре, в течение недели при температуре от 2 до 8 °С (однако, перед проведением электрофореза необходимо нагреть пробирки до комнатной температуры для размягчения воска). Анализ продуктов амплификации проводится разделением фрагментов ДНК в агарозном геле.
7.3. Электрофоретический анализ продуктов амплификации.
(Проводится в ЗОНЕ 3 - помещении для анализа продуктов амплификации).
7.3.1. Приготовление рабочих растворов и агарозного геля.
7.3.1.1. Приготовить рабочий раствор электрофорезного буфера. В мерный цилиндр влить 50 мл концентрированного ТБЕ, довести дистиллированной водой до 1000
мл, закрыть цилиндр парафильмом и перемешать.
7.3.1.2. Агарозу из одного флакона пересыпать в стеклянную колбу из термостойкого стекла на 250 мл. Налить 100 мл готового рабочего раствора электрофорезного буфера, перемешать вращением колбы и плавить в микроволновой печи до полного растворения агарозы. Время плавления агарозы в микроволновой печи мощностью 800 Вт при ее загруженности 1 колбой - 1,5 минуты. Вынуть колбу с расплавленной агарозой из микроволновой печи, аккуратно перемешать, вращая колбу. После этого вновь поместить колбу с агарозой в микроволновую печь на 1,5 минуты (при мощности 800 Вт), довести агарозу до кипения. Вынуть колбу из микроволновой печи и остудить агарозу, вращая колбу, до температуры 65-70 °С.
7.3.1.3. Выровнять столик для заливки гелей, залить расплавленный гель в форму камеры, установив гребенки на расстоянии не менее 3 см друг от друга таким образом, чтобы их зубцы не касались дна гелевой рамки. Толщина геля должна быть около 6 мм.
7.3Л.4. После полного застывания геля (30 минут при комнатной температуре), осторожно вынуть из него гребенки, не повредив лунки. Поместить подложку с готовым гелем в камеру, лунки должны располагаться ближе к отрицательному электроду. Залить в камеру готового буфера столько, чтобы он покрывал гель на
5 мм сверху,
7.3.2. Порядок работы.
7.З.2.1. Пробирки с продуктами амплификации последовательно выставить в штатив, отобрать из-под слоя масла по 10-15 мкл пробы и внести в лунки геля (если для
13
нанесения разных проб используется один и тот же наконечник, то его необходимо промывать буфером из камеры после нанесения каждой пробы). В каждом ряду лунок геля должен быть обязательно представлен К+ соя и К+ кукуруза и, желательно, маркер молекулярных масс для электрофореза.
7.3.2.2. Подключить камеру к источнику тока, соблюдая полярность (ДНК движется к положительному электроду), и включить источник. Если нет нарушения контактов, то при прохождении тока от электродов должны подниматься пузырьки. Оптимальная напряженность электрического поля 10 В/см. При использовании камеры SE-2 («Хеликон») и источника питания «Эльф-4» («ДНК-технология») параметры следующие: напряжение 250 В, стабилизация по напряжению, время электрофореза - 18-20 минут.
7.3.2.3. Когда краситель пройдет примерно половину длины геля (не менее 1 см), выключить источник тока, перенести гель на трансиллюминатор, расположив пластину геля лунками вверх.
7.3.2.4. Получить изображение геля на компьютере с помощью видеосистемы, отмечая порядок нанесения проб, занести в базу данных.
8. Интерпретация результатов анализа
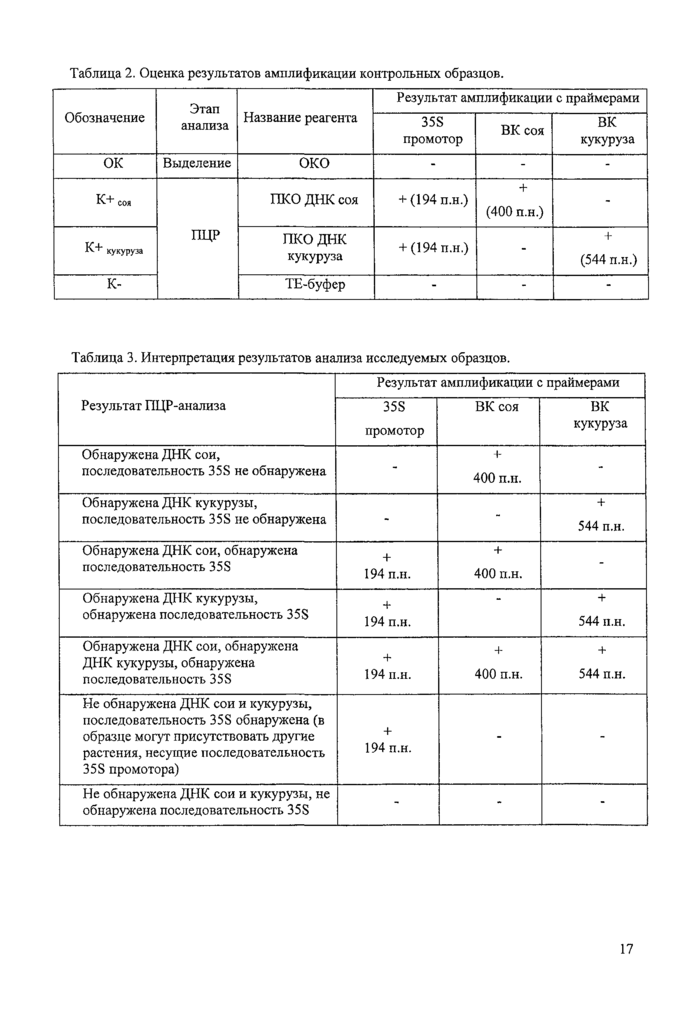
8.1. Учёт результатов ПЦР-анализа проводится по наличию или отсутствию на электрофореграмме специфических полос амплифицированной ДНК (см. табл. 2, табл. 3 и рис.1 в приложений 1.). Длина амплифицированных специфических фрагментов ДНК: - ДНК 35S промотор - 194 п.н., ДНК ВК соя - 400 п.н., ДНК ВК кукуруза - 544 п.н.
8.2. Далее учитывают результаты амплификации исследуемых образцов. Для проб, содержащих только ДНК сои (или только ДНК кукурузы) и не содержащих последовательности 35S промотора, в дорожке геля должна быть отчетливо видна полоса амплифицировапного участка ДНК, располагающаяся в геле на том же расстоянии от линии лунок, что и верхняя полоса положительного контрольного образца ПЦР (ПКО соя или ПКО кукуруза). Пробы, содержащие ДНК сои (или кукурузы) с последовательностью 35S промотора, должны содержать две полосы - полосу 35S промотора и ВК сои (или ВК кукурузы), располагающиеся в геле на том же расстоянии от линии лунок, что и обе полосы положительного контрольного образца ПЦР,
8.3. Кроме полос 194 п.н., 400 п.н., 544 п.н. в дорожках могут наблюдаться нечеткие размытые полосы праймер-димеров, которые располагаются ниже уровня 100 н.п. (в нижней части дорожки).
8.4. Следует провести повторную ПЦР, если специфическая полоса очень низкой интенсивности (гораздо ниже интенсивности положительных контролей). Если такой результат повторяется, то его считают сомнительным. Для уточнения результата необходимо повторное исследование.
8.6.
8.5. При работе с материалом, содержащим большое количество ДНК, например, продукты животного происхождения, в ПЦР участвует большое количество неспецифической геномной ДНК. При этом в геле появляются характерные шмеры, располагающиеся по дорожке равномерно или концентрирующиеся около лунки. На фоне шмера в положительном образце видна специфическая полоса. Большое количество геномной ДНК может ингибировать ПЦР (в дорожке отсутствует ожидаемая специфическая полоса), в этом случае рекомендуется переставить амплификацию данной ДНК-пробы, разведя ее в 5 раз буфером для элюции.
Результаты анализа не учитываются, если:
14
8.6.1. В дорожке любого отрицательного контроля выявляется специфическая полоса -результат анализа всех проб нельзя считать достоверным. Возможно, произошла контаминация реактивов и проб. В этом случае результаты анализа считают недействительными. Требуется повторить анализ проб и предпринять меры по выявлению источника контаминации.
8.6.2. В дорожках появляются неспецифические полосы на разных уровнях. Возможные причины: неправильное проведение «горячего старта» или неверный температурный режим в ячейках амплификатора. Рекомендуется переставить ПЦР (этап 2).
9. Утилизация отходов
9.1. Использованные буфер для электрофореза и агарозные гели подвергаются дезактивации.
9.1.1. Отработанные гели и буфер из камеры помещают в пластиковую емкость на 5 литров с плотно завинчивающейся крышкой.
9.1.2. На 1 л обезвреживаемых реагентов добавляют 1 л 0,5 М раствора калия перманганата и затем 1 л 2,5 М соляной кислоты. Аккуратно перемешивают и оставляют при комнатной температуре на 4-6 часов.
9.1.3. Для нейтрализации добавляют 1 л 2,5 М натрия гидроксида, аккуратно перемешивают,
9.1.4. Нейтрализованные реактивы сбрасывают в канализацию.
9.1.5. Отработанный буфер также можно дезактивировать с помощью стеклянной колонки емкостью на 1-2 л, заполненной активированным углем. Отработанный буфер пропускают через нее небольшими порциями.
9.1.6. Дезактивированный раствор сливают в канализацию.
9.2. Пробирки с продуктами ПЦР и использованные наконечники к микродозаторам подвергаются первичной обработке растворами, вызывающими деградацию ДНК.
9.3. Остатки реагентов, образцов, смываются избытком воды.
9.4. Пробирки после выделения ДНК утилизируются, как обычные твердые отходы.
10.Источники появления ложных положительных сигналов при проведении ПЦР - диагностики и их предотвращение
10. 1. Наиболее мощные источники загрязнений (в порядке вклада): загрязнение продуктами предыдущих реакций;
- перекрестное загрязнение образцов при экстракции ДНК;
- загрязнение из других источников при взятии образцов.
10.2. Для предотвращения появления ложно положительных сигналов необходимо соблюдать требования по организации лаборатории и правила работы персонала с оборудованием и реактивами.
10.3. Необходимо предотвращать возможность загрязнений, происходящих вне лаборатории - во время сбора образцов и их первичной обработки (фасовка, упаковка, транспортировка),
10.4. На этапах выделения ДНК и постановки ПЦР необходимо использовать в работе отрицательные контроли.
10.5. Целесообразно исследовать по две пробы от каждого образца продукта.
10.6. В случае получения постоянных положительных сигналов на отрицательных контролях все исходные реактивы подлежат немедленной замене и провести мероприятия по деконтаминации в соответствии с МУ 1.3.1888-04
15
Приложение 1
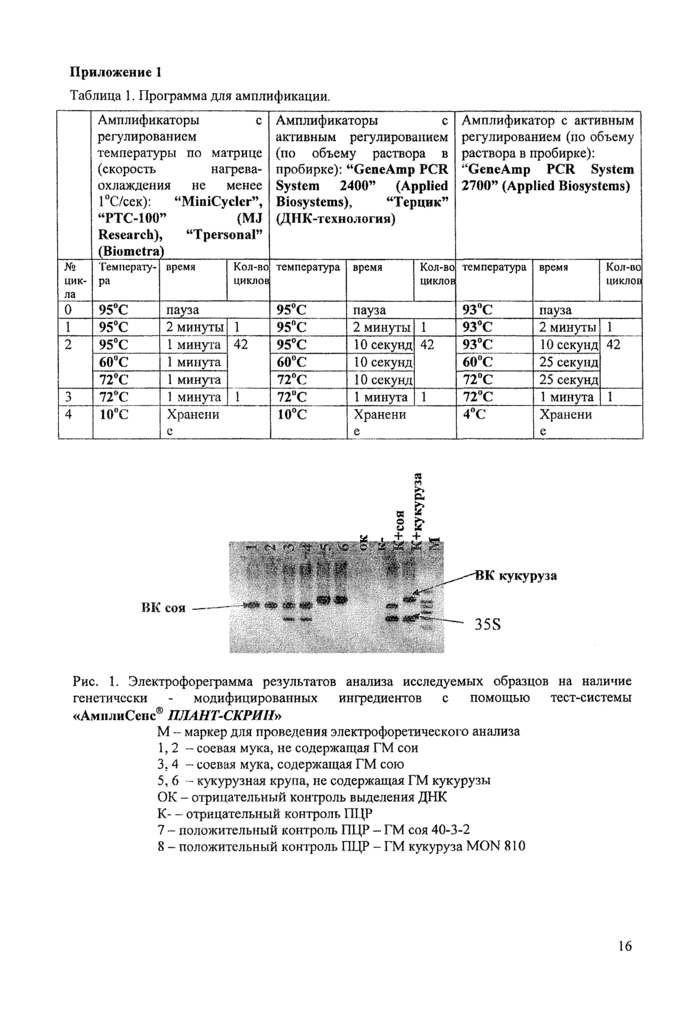
Таблица 1. Программа для амплификации.
Амплификаторы с регулированием температуры по матрице (скорость нагрева-охлаждения не менее 1 °С/сек): “MiniCycler”, “РТС-100” (MJ Research), “Tpersonal” (Biometra)
Амплификаторы с активным регулированием (по объему раствора в пробирке): “GeaeAmp PCR System 2400” (Applied Biosystems), “T ерцик” (ДНК-технология)
Амплификатор с активным регулированием (по объему раствора в пробирке): “GeaeAmp PCR System 2700” (Applied Biosysteras)
№
цик
ла
Температу
ра
время
Кол-во
циклов
температура
время
Кол-во
ЦИКЛОВ
температура
время
Кол-во
циклов
0
95°С
пауза
95°С
пауза
93°C
пауза
1
95°С
2 минуты
1
95°С
2 минуты
1
93°C
2 минуты
1
2
95°С
1 минута
42
95°С
10 секунд
42
93°C
10 секунд
42
60°С
1 минута
60“С
10 секунд
60°C
25 секунд
72°С
1 минута
72°С
Ю секунд
72°C
25 секунд
3
72°С
1 минута
1
72“С
1 минута
1
72°C
1 минута
1
4
10°С
Хранеии
е
10°С
Хранени
е
4°C
Хранени
е
‘Ъ W \с-
кукуруза
ВК соя
У*'* (#£'
|
Таблица 1. Программа для амплификации. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
‘Ъ W \с- |
кукуруза |
ВК соя
У*'* (#£'
Рис. 1. Электрофореграмма результатов анализа исследуемых образцов на наличие генетически - модифицированных ингредиентов с помощью тест-системы «АмплиСеис® ПЛАНТ-СКРИН»
М - маркер для проведения электрофоретического анализа
1,2- соевая мука, не содержащая ГМ сои
3. 4 - соевая мука, содержащая ГМ сою
5,6- кукурузная крупа, не содержащая ГМ кукурузы
GK - отрицательный контроль выделения ДНК
К- - отрицательный контроль ПНР
7 - положительный контроль ПЦР - ГМ соя 40-3-2
8 - положительный контроль ПЦР - ГМ кукуруза MON 810
16
|
Таблица 2. Оценка результатов амплификации контрольных образцов. | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
|
Таблица 3. Интерпретация результатов анализа исследуемых образцов. | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
17
Приложение 2
Схема проведения анализа с помощью тест-системы «ЛмплиСенс Плант-скрин».
18
1. Разработаны: ГУ ЦНИИ эпидемиологии Минздрава России (Шипулин Г.А., Яцышина С.Б.) при участии Федерального центра госсанэпиднадзора Минздрава России (Беляев Е.Н., Брагина И.В., Воронцова Т.В., Потапова Т.Н., Авдеенко Т.Ф Терехова С.Ю.)
2. Утверждены и введены в действие Заместителем Главного государственного санитарного врача Российской Федерации - Главным врачом Федерального центра Госсанэпиднадзора Минздрава России Е.Н. Беляевым 23.06.2004г.
3. Введены впервые.
3
1. Общие положения и область применения. 5
2. Нормативные ссылки. 6
3. Сущность метода. 7
4. Требования к помещениям и технике безопасности. 7
5. Аппаратура, материалы и реактивы. 8
6. Отбор, хранение и подготовка проб пищевых продуктов для ] О
анализа.
7. Порядок проведения исследования. 11
8. Интерпретация результатов анализа. 14
9. Утилизация отходов. 15
10. Источники появления ложных положительных сигналов при 15
проведении ПЦР диагностики и их предотвращение.
Приложение 1 1 б
Приложение 2 18
4
УТВЕРЖДАЮ 1^еститсль Главного гоеударст венного того врача Российской
|
2004 г. |
|
едения: |
-Глав1шй нрач (Федерального цстра ^лдЗора^^здрава России / Е.Н. Беляев
Выявление генетически модифицированных источников (ГМИ) в пищевых продуктах растительного происхождения тест-системой «АмплнСеис Плант-скрин»
Методические рекомендации
1. Общие положения и область применения
1.1. Настоящие методические рекомендации подготовлены для выявления генетически модифицированных источников (ГМИ) растительного происхождения в пищевых продуктах с помощью тест-системы «АмплиСенс Плант-скрин» производства ЦНИИ Эпидемиологии М3 РФ.
1.2. Методические рекомендации разработаны в соответствии с Федеральным законом «О санитарно-эпидемиологическом благополучии населения». Федеральным законом «О внесении изменений и дополнений в Закон Российской Федерации «О защите прав потребителей». Положением о государственном санитарно-эпидемиологическом нормировании, Положением о Государственной санитарно-эпидемиологической службе Российской Федерации.
1.3. Методические рекомендации предназначены для применения в лабораториях учреждений санитарно-эпидемиологической службы Российской Федерации, осуществляющей контроль за качеством продовольственного сырья и пищевых продуктов, в т.ч. импортируемых в Российскую Федерацию, гигиеническую оценку и выдачу санитарно-эпидемиологических заключений, в лабораториях других организаций, аккредитованных в установленном порядке на право проведения контроля безопасности пищевой продукции и продовольственного сырья.
1.4. Методические рекомендации предназначены для применения при контроле
5
растительного сырья и пищевых продуктов на наличие генетически модифицированных источников на этапах поставки на производство, гигиенической экспертизы, государственной регистрации, закупки, ввоза в страну и реализации,
2. Нормативные ссылки
2.1. Федеральный закон № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» от 30 марта 1999 г.
2.2. Федеральный закон № 2-ФЗ «О внесении изменений и дополнений в Закон Российской Федерации «О защите прав потребителей» и Кодекс РСФСР об административных правонарушениях» от 9 января 1996 г. (ред.от 30.12.2001 г.).
2.3. Федеральный закон № 29-ФЗ «О качестве и безопасности пищевых продуктов» от
02.01.2000.
2.4. Федеральный закон № 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» от 05.06.1996 г, (ред. От 12.07.2000).
2.5. Федеральный закон № 96-ФЗ «О внесении изменений и дополнений в Федеральный закон о государственном регулировании в области генно-инженерной деятельности» от 21.06.2000 г.
2.6. «Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июля 1993 г. № 5487-1 (ред. От 30.06.2003 г.).
2.7. Положение о государственном санитарно-эпидемиологическом нормировании, утвержденное Постановлением Правительства Российской Федерации № 554 от
24.07.2000 г.
2.8. Положение о Государственной санитарно-эпидемиологической службе Российской Федерации, утвержденное Постановлением Правительства Российской Федерации № 554 от 24.07.2000 г.
2.9. Постановление Главного государственного санитарного врача Российской
Федерации № 7 от 6 апреля 1999 г. «О порядке гигиенической оценки и регистрации пищевой продукции, полученной из генетически модифицированных источников».
2.10. Постановление Главного государственного санитарного врача Российской
Федерации № 149 от 16.09.2003 г. «О проведении микробиологической и молекулярно-генетической экспертизы генетически модифицированных микроорганизмов, используемых в производстве пищевых продуктов».
2.11. Гигиенические требования к безопасности и пищевой ценности пищевых
продуктов. Сан ПиН 2.3.2.1078-01.
2.12. Постановление Главного государственного санитарного врача Российской
Федерации от 08.11.2000 г. № 14 «О порядке проведения санитарно-эпидемиологической экспертизы пищевой продукции, полученной из генетически модифицированных источников».
2.13. Приказ № 325 М3 РФ от 15.08.2001 г. (ред. От 18.03.2002 г.) «О санитарно-эпидемиологической экспертизе продукции» (зарегистрированным в МЮ РФ
19.10.2001 г. №2978).
2.14. Методические указания. Организация работы лабораторий, проводящих исследования с патогенными биологическими агентами 111-У1 групп патогенности методом полимеразной цепной реакции. МУ 1.3.1888-04.
2.15. Методические указания. Методы идентификации модифицированных источников ГМИ растительного происхождения. МУК 4.2.1902-04.
2.16. ГОСТ Р 52173-2003.Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения.
6
3. Сущность метода
Метод выявления генетически модифицированных источников в сырье и пищевых продуктах растительного происхождения с помощью тест-системы
«АмплиСепсФ ПЛАНТ-СКРИН» основан на использовании полимеразной цепной реакции (ПЦР). В процессе ПЦР происходит амплификация последовательности промотора 35S, присутствие которой свидетельствует о наличии в образце генетически модифицированных источников и амплификация специфических генов сои и кукурузы (мультиплексный формат ПЦР из трех пар праймеров), что позволяет контролировать наличие в образце как промотора 35S, так и ДНК этих растений. Анализ продуктов амплификации проводится разделением фрагментов ДНК в агарозном геле.
Тест-система состоит из трех комплектов реагентов - набора для выделения ДНК, набора для постановки амплификации, набора для проведения
электрофоретического разделения продуктов амплификации и рассчитана на 50 постановок, включая контрольные образцы.
Схема проведения анализа приведена в приложении 2.
4. Требования к помещениям и техника безопасности
4.1. Общие требования
2.17. 4.1.1. Общее расположение лаборатории, а также ее инфраструктура должны
соответствовать «Санитарным правилам» СП 1.3. 1285-03 и «Методическими указаниями. Организация работы лабораторий, проводящих исследования с патогенными биологическими агентами 111-У1 групп патогенности методом полимеразной цепной реакции.» МУ 1.3.1888-04.
4.1.2. Исследования по идентификации I'МИ растительного происхождения могут проводиться на базе лабораторий, проводящих исследования методом ПЦР с патогенными биологическими агентами. В таком случае должно быть предусмотрено лишь разграничение проведения исследований во времени.
4.2. Правила работы для персонала
4.2.1. На каждом этапе ПЦР исследования необходимо использовать индивидуальный набор соответствующе го лабораторного оборудования, расходных материалов и одежды.
4.2.2. Одноразовые перчатки подлежат смене при каждой новой операции. Работа без перчаток запрещена.
4.2.3. Запрещается перемещать личные вещи, лабораторные журналы, лабораторную одежду и канцелярские принадлежности между зонами лаборатории.
4.3. Правила работы е оборудованием
4.3.1. Все лабораторное оборудование, в том числе пипетки, штативы, лабораторная посуда, а также все рабочие растворы должны быть строго стационарными. Запрещается их перенос из одного помещения в другое.
4.3.2. Перед началом работы рабочую поверхность столов обрабатывают 70 % этиловым спиртом и облучают ультрафиолетовым излучением не менее 10 минут.
4.3.3. Для того, чтобы избежать аэрозольного загрязнения пипеток, использовать только наконечники с антиаэрозольиыми барьерами.
7
4.3.4. Во время проведения манипуляций на вортексе штативы для наконечников должны быть закрыты крышками.
4.3.5. По окончании работ рабочие поверхности, дозаторы, вортекс, термостат, центрифуга обрабатывают растворами, вызывающими деградацию ДНК (например, 0,1% раствор ДП-2Т , 3% раствором хлорамина с экспозицией 30 минут, с последующим протиранием влажными тампонами для снятия остатков дезсредства) и облучают ультрафиолетовым излучением не менее 10 минут.
4.3.6. Пробирки с продуктами ПЦР и использованные наконечники к микродозаторам подвергаются первичной обработке растворами, вызывающими деградацию ДНК.
4.3.7. Ежемесячно проводят профилактическую обработку рабочей поверхности столов и штативов 1 N соляной кислотой.
4.4. Правила работы с реактивами
4.4.1. Перед работой с ДНК все исходные реагенты должны быть убраны в холодильник, предназначенный для хранения реактивов.
4.5. Техника Безопасности
4.5.1. ВНИМАНИЕ! Этидия бромид - канцерогенное соединение, поэтому при работе с ним следует соблюдать правила безопасности: работать только в перчатках, избегать попадания на кожу и слизистые, при попадании на кожу или слизистые тщательно промыть соответствующий участок водой.
4.5.2. Все реагенты, содержащие этидия бромид, перед утилизацией следует подвергать специальной обработке (см. раздел Утилизация отходов).
4.5.3. При работе с включенным трансиллюминатором необходимо пользоваться защитным экраном или специальной защитной маской для предотвращения ожогов слизистой глаз ультрафиолетовым светом.
5. Оборудование, материалы и реактивы
5.1. Оборудование
5.1.1. ЗОНА 1. Этап выделения ДНК из исследуемого материала:
5.1 Л Л.Настольный бокс с бактерицидной лампой (например, «Циклотемп», фирмы СП «РТС», Россия) или стерильный ламинарный шкаф (БОВ-ОО1-АМС, г, Миасс, Россия).
5 Л Л.2. Термостат для пробирок типа «Эппендорф» на 25-100 °С (например, «ТЕРМО-24», фирмы «Биоком», Россия).
5.1.1.3. Микроцентрифуга для пробирок типа «Эппендорф» до 16000 g (например, фирмы «Elmi», Латвия, фирмы «Hettish», Германия).
5 Л Л.4. Центрифуга/вортекс (например «Micro-Spin», Германия, «ТЭТА-2», фирмы «Биоком», Россия).
5 Л Л .5. Вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости (например, ОМ-1, г.Ульяновск, Россия).
5 Л Л .6. Отдельный набор автоматических пипеток переменного объема (например, фирмы «Ленгшпет», Россия).
5 Л Л.7. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки на 1,5 мл (например, фирмы «Axygen», США).
5.1Л.8. Штативы для микропробирок на 1,5 мл (например, фирмы «Хеликон», Россия) и наконечников (например, фирмы «Ленпипет», Россия).
5 Л Л.9. Одноразовые наконечники для пипеток переменного объема до 200 мкл и до 1000 мкл (например, фирмы «Ленпипет», Россия),
8
5.1.1.10. Одноразовые наконечники для пипеток переменного объема с аэрозольным барьером до 200 мкл и до 1000 мкл (например, фирмы «Axygen», США).
5.1.1.11. Холодильник с отделениями на 2- 8 °С и от минус18 до минус 20 °С. ГОСТ 26678.
5.1.1.12. Весы лабораторные общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г. ГОСТ 24104.
5.1.1.13. Пинцеты медицинские.
5.1.1.14. Ножницы медицинские.
5.1.1.15. Скальпели хирургические.
5.1.1.16. Ступки фарфоровые с пестиками.
5.1.2. ЗОНА 2. Этап амплификации ДНК (метод ПЦР):
5.1.2.1. Амплификатор (например «Терцик», фирмы «ДНК-технология», Россия, «Tpersonal», фирмы «Biometra», Германия, «РТС-100», фирмы «MJ Research», «GeneAmp PCR System 2700» и «GeneAmp PCR System 2400», фирмы Perkin Elmer, США).
5.1.2.2. ПЦР-бокс или отдельный стол, освещаемый УФ-лампой (например, «Циклотемп», фирмы СП «РТС», Россия).
5.1.2.3. Отдельный набор автоматических пипеток переменного объема (например, фирмы «Ленпипет», Россия).
5.1.2.4. Штативы для микропробирок на 0,5 мл (например, фирмы «Хеликон», Россия).
5Л.2.5. Одноразовые наконечники для микропипеток в штативах (например, фирмы «Хеликон», Россия).
5.1.2.6. Одноразовые наконечники с аэрозольным барьером до 200 мкл (например, фирмы «Axygen», США).
5.1.2.7. Холодильник на 2- 8 °С; морозильник на минус 20 °С для хранения выделенной ДНК. ГОСТ 26678.
5.1.3. ЗОНА 3. Электрофоретический анализ продуктов амплификации:
5.1.3Л. Камера для горизонтального электрофореза объёмом не более 600 мл (например, SE-2, фирмы «Хеликон», Россия).
5Л.3.2. Источник постоянного тока с напряжением 150 — 460 В (например, «Эльф-4», фирмы «ДНК-технология», Россия).
5Л.3.3. Ультрафиолетовый трансиллюминатор с кабинетом для просмотра гелей (например, фирмы «Биоком», Россия).
5Л.3.4. Видеосистема с цифровой камерой для регистрации и передачи изображения (например, «Биотест-1», ЦНИИ Эпидемиологии, Россия, фирмы «Biorad», США).
5.1.3.5. Аквадистиллятор, обеспечивающий качество дистиллированной воды в соответствии с ГОСТ 6709-72,
5 Л .3.6. Холодильник на 2-8 °С для хранения продуктов амплификации. ГОСТ 26678.
5.1.3.7. Микроволновая печь для плавления агарозы.
5.1.3.8. Колба коническая из термостойкого стекла для плавления агарозы на 250 мл. ГОСТ 12738 -77.
5.1.3.9. Мерный цилиндр на 1 литр. ГОСТ 1770-74.
5.1.3.10. Воронка стеклянная. ГОСТ 25336 - 82.
5.1.3.11. Штатив для микропробирок на 0,5 мл и на 0,2 мл (например, фирмы «Хеликон», Россия).
5.1.3.12. Отдельная автоматическая пипетка объема 10-40 мкл (например, «Ленпипет», Россия).
5.1.3.13. Одноразовые наконечники до 200 мкл в штативе (например, «Ленпипет», Россия).
9
5.1.3.14, Пластиковая ёмкость из химически-стойкого материала не менее 5 л для дезактивации буфера и гелей, содержащих бромид этидия.
5.Z Реактивы
5.2.1. Тест-система «АмплиСенс Плант-скрин» (ЦНИИ Эпидемиологии М3 РФ) имеет
следующий состав:
Комплект № 1: «ДНК-сорб-С» для выделения ДНК из образцов продуктов питания или растительного сырья. Включает буфер для лизирующего реагента - 1 флакон 20 мл, лизирующий реагент - 1 пробирка 0,85 мл, раствор для отмывки №1 - 1 флакон 15 мл, раствор для отмывки №2 - 1 флакон 50 мл, сорбент универсальный - 1 пробирка 1,25 мл, ТЕ-буфер для элюции ДНК - 1 пробирка 5 мл, ОКО (отрицательный контрольный образец) - 1 пробирка 1,6 мл. Все реагенты готовы к использованию. Комплект рассчитан на выделение ДНК из 50 проб, включая контрольные образцы.
- Комплект № 2: «АмплиСенс-50-R» для амплификации участка
последовательности промотора 35S, а также для амплификации генов сои и кукурузы. Включает ПЦР-смесь-1 ПЛАНТ-СКРИН - 55 пробирок по 0,005 мл, ПЦР-смесь-2 red - 1 пробирка 0,6 мл, минеральное масло - 1 пробирка 2 мл, ПКО ДНК соя - положительный контроль ПЦР - 1 пробирка 0,2 мл, ПКО ДНК кукуруза ~ положительный контроль ПЦР - 1 пробирка 0,2 мл, ТЕ-буфер - 1 пробирка 0,5 мл. Все реагенты готовы к использованию. Комплект рассчитан на постановку 55 реакций, включая контрольные образцы.
- Комплект № 3: «ЭФ-200» для электрофоретического анализа
амплифицированной ДНК. Включает 20-ти кратный концентрат трис-боратного буфера (ТБЕ) с бромидом этидия - 1 флакон 50 мл и навески агарозы для электрофореза - 2 пробирки по 1,8 г., готовых к использованию.
5.2.2. Вода дистиллированная по ГОСТ 6709-72.
5.2.3. Калия перманганат (КМп04), х.ч. ГОСТ 20490-75.
5.2.4. Соляная кислота, х.ч, ГОСТ 3118-77.
5.2.5. Натрия годроокись, х.ч. ГОСТ 4328-77.
6. Отбор, хранение и подготовка проб пищевых продуктов для анализа
Отбор проб проводят по государственным стандартам, устанавливающим
порядок отбора проб для однородных групп пищевой продукции: ГОСТ 5904-82, 9163-90,
12292-2000, 10852-86, 12430-66, 13979-86, 26313-84, 22617.0-77, 27668-88, 26312.1-84,
9792-73, 7631-85.
б. L Отбор образцов продуктов
6.1.1. От партии сырья или сыпучих продуктов отбирают общую пробу следующим образом:
от исследуемой партии сырья или сыпучих продуктов отбирают не менее 10 образцов проб (по 5 - 10 г) в одноразовый плотный полиэтиленовый пакет размером 20x30 см с использованием одноразовых хирургических перчаток и перемешивают, формируя общую пробу (50-100 г);
из общей пробы отбирают среднюю пробу в 10-20 г, помещают в полиэтиленовый пакет с застежкой-молнией размером не более 10x15 см, который, в свою очередь, помещают в одноразовый плотный полиэтиленовый пакет размером 20x30 см, опечатывают и отправляют на анализ.
6.1.2. От партии продуктов плотной консистенции отбирают общую пробу весом 10-50 г в одноразовый плотный полиэтиленовый пакет с застежкой-молнией размером не более 10x15 см, используя одноразовые перчатки и фламбированные
10