Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
Государственная система санитарно- эпидемиологического нормирования Российской Федерации
НОРМАТИВНЫХ И МЕТОДИЧЕСКИХ ДОКУМЕНТОВ
ФФИШАЛьт.ФЕ
l■■■■■■ll■■llllllllllllllllllllllllllllllllllllllllllllllllllllllllll
м@@к1м=8®да
БЮЛЛЕТЕНЬ
УЧРЕДИТЕЛЬ
Федеральное бюджетное учреждение ирааоохранения •Федеральный центр гигиены н эпидемиологии* Федеральной службы по надзору в сфере дошиты прав потребителей н благополучия человека
РЕДАКЦИОННАЯ КОЛЛЕГИЯ Главный редактор Г. Г. Онищенко Е. Н. Беляев.
А. И. Верещагин.
Л. П. Гульченко.
С. И. Иванов.
Г. Ф.Лазикова.
С. С Перель.
Г. С. Перминова.
МП. Шевырева.
Н. В. Шестопалов
РЕДАКЦИОННЫЙ СОВЕТ
A. X Агиров (Майкоп),
Г. В. Айдинов (Ростов-на-Дону).
B. А. Алешкин (Москва).
А. А. Баранов (Москва).
Н. Н. Верещагин (Оренбург).
A. Л. Гинибург (Москва).
B. В. Губернаторова (Иваново).
B. И. Евдокимов (Белгород),
Н. А. Забродин (Ижевск).
A. И. Зайченко (Москва).
Н. Ф. И змеров (Москва).
О. Л. Гавриленко (Московская область). И В. Корабельников (Сыктывкар).
C. В. Куркатов (Красноярск),
Г. И. Куценко (Москва).
B. Р. Кучма (Москва).
Б. В. Лимин (Вологда).
Г. Д. Минин (Уфа).
Б. И. Никонов (Екатеринбург),
B. И. Покровский (Москва).
A. И. Потапов (Москва),
Ю.А. Рахманин (Москва).
C. И. Савельев (Липецк),
И. П. Салдан (Барнаул).
B. Р. Саухат (Магадан),
В. П. Сергиев (Москва),
В. А. Тутельян (Москва).
Н. Н. Филатов (Москва).
В. П. Чашин (Санкт-Петербург).
М. И. Чубирко (Воронеж).
М.Г. Шандала (Москва)
НОРМАТИВНЫХ И МЕТОДИЧЕСКИХ ДОКУМЕНТОВ
ГОССАНЭПИДНАДЗОРА
Выпуск 2 (60), июнь 2015
Издается с 2000 г.
НОРМАТИВНЫЕ
ПРАВОВЫЕ
АКТЫ
МЕТОДИЧЕСКИЕ
ДОКУМЕНТЫ
Зарсгнсгрирован Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскочнадюр)
Свидетельство о регистрации средства массовой информации от 24 января 2012 г. ПИ М ФС77-48297
Подписано в печать 11.06.15
Формат 60x84/8. уел. печ. л. 16.74, заказ N& 1486. тираж 500 экз.
Федеральная служба по надзору в сфере зашиты прав потребителей
Подписка на Ькшетень нормативных и методических документов гоесан тиднадюра принимается во всех почтовых отделениях России. Подписной индекс в каталоге агентства «Роспечать» •Ганты. Журна-ш* 79682
и благополучия человека
127994, Москва, Вадковский пер., д. 18. стр. 5.7
Оригинал-макет подготовлен к печати отделом издательского обеспечения
Федерального центра гигиены и эпидемиологии Роспотребнадзора 117105. Москва. Варшавское ш., 19а
.Адрес редакции:
117105. Москва. Варшавское ш.. 19а Федеральный центр гигиены и эпидемиологии Роспотребнадзора
Отделение реализации, тел./факс 8 (495) 952-5089 E-mail: edit^fcgie.rv
© Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2015
СОДЕРЖАНИЕ
НОРМАТИВНЫЕ ПРАВОВЫЕ АКТЫ
Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев):
СП 2.2.1.3218-14...............................................
Санитарно-эпидемиологические требования к размещению, устройству оборудованию, содержанию и режиму работы бань и саун:
СанПиН 2.1.2.3150-13...........................................
Предельно допустимые концентрации (ПДК) 0-(1,2,2-триметилпропил)-метилфторфосфоната (зомана) и О-изопропилметилфторфосфоната (зарина) в отходах после печей (золе) объектов по уничтожению химического оружия: ГН 2.1.7.3199—14.....................................
Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест: Изм. в ГН 2.1.6.1338—03. Утверждены постановлением Главного государственного санитарного врача от 12.01.2015 № 3...........................................
Предельно допустимая концентрация (ПДК) 0-изобутил-Р-1М-диэтил-аминоэтшггиолового эфира метилфосфоновой кислоты (вещества типа Vx) в воздухе рабочей зоны (включая аэрозоль дезинтеграции строительных материалов) при выводе объектов по уничтожению химического оружия из эксплуатации: ГН 2.2.5.3224—14.................................
Ориентировочный допустимый уровень (ОДУ) метилфосфоновой кислоты в воле водных объектов хозяйственно-питьевого и культурно-бытового водопользования: ГН 2.1.5.3225-14 .................................
Предельно допустимый уровень (ПДУ) загрязнения О-изобутил-р-М-ди-этиламиноэтилтиоловым эфиром метилфосфоновой кислоты (веществом типа Vx) впитывающих и невпитываюших поверхностей технологического оборудования, подлежащего персмсщению/транспортировке за пределы объекта по уничтожению химического оружия, и строительных конструкций: ГН 2.2.5.3226-14 ............................................
Предельно допустимая концентрация (ПДК) метилфосфоновой кислоты в отходах строительных конструкций, включая отходы после термического обезвреживания: ГН 2.1.7.3227—14..............................
Предельно допустимый уровень (ПДУ) загрязнения 0-изобутил-Р-?^-ди-этила.миноэтилтиотовым эфиром метилфосфоновой кислоты (веществом типа Vx) поверхности металоотходов. прошедших термообезвреживание: ГН 2.1.7.3228-14........................................
Предельно допустимый уровень (ПДУ) загрязнения поверхности технологического оборудования О-изобутил-р-К-диэтиламиноэтил-тиоловым эфиром метилфосфоновой кислоты (веществом типа Vx):
ГН 2.2.5.3229-14................................................
Использование метода времяпролетной масс-спектрометрии с матричноактивированной лазерной десорбцией/ионизацией (MALDl-ToF MS) для индикации и идентификации возбудителей 1—II групп патогенности: МР 4.2.0089-14.................................................
Использование методов полиморфизма длин рестрикционных фрагментов (рибопринтинг, электрофорез в пульсирующем поле) для идентификации
возбудителей I—II групп патогенности: МР 4.2.0090—14................
Расчет фактических и предотвращенных в результате контрольнонадзорной деятельности экономических потерь от смертности, заболеваемости и инвалндизаини населения, ассоциированных с негативным воздействием факторов среды обитания: МР 5.1.0095—14...............
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Использование методов полиморфизма длин рестрикционных фрагментов (рибопринтинг, электрофорез в пульсирующем поле) для идентификации возбудителей I—II групп патогенности
Методические рекомендации МР 4.2.0090—14
МЕТОДИЧЕСКИЕ ДОКУМЕНТЫ
1. Разработаны Федеральной службой по надзору в сфере зашиты прав потреби гелей и благополучия человека (Ю. В. Демина, Н. В. Шеенков): ФКУЗ «Российский научно-исследовательский противочумный институт «Микроб» Роспотребнадзора (В. Е. Куклсв, Н. А. Осина. А. В. Осин, И. Н. Шарова. А. С. Абдрашитова. Н. С. Червякова, С. А. Щербакова); ФКУЗ «Иркутский научно-исследовательский противочумный институт» Роспотребнадзора (С. В. Балахонов, М. В. Чеснокова, М. В. Афанасьев. Л. В. Миронова, С. А. Татарников. Е. Г. Токмакова, Г. В. Вдовиченко, А. С. Остяк, М. Б. Ярыгина. Е. А. Басов); ФКУЗ «Волгоградский научно-исследовательский противочумный институт» Роспотребнадзора (В. А. Антонов. Г. А. Ткаченко, С. С. Савченко. В. В. Алексеева. О. В. Зинченко, И. М. Шпак. М. А. Гришина. Н. В. Вьючнова. О. С. Ульянова, Д. В. Викторов).
2. Утверждены руководителем Федеральной службы но надзору в сфере зашиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации А. Ю. Поповой 13 мая 2014 г.
3. Введены впервые
Содержание
1. Область применения.................................................................................................................73
2. Общие положения.....................................................................................................................73
3. Основные этапы исследования................................................................................................74
3.1. Электрофорез в пульсирующем поле........................................................................74
3.2. Рибопринтинг...............................................................................................................74
4. Основные требования к организации исследований.............................................................75
5. Проведение PFGE.....................................................................................................................75
5.1. Культивирование микроорганизмов..........................................................................75
5.2. Приготовление агарозных блоков..............................................................................76
5.3. Лизис клеток в агарозных блоках..............................................................................77
5.4. Отмывка агарозных блоков........................................................................................78
5.5. Рестрикция ДНК в агарозных блоках........................................................................79
5.6. Электрофорез в пульсирующем поле........................................................................81
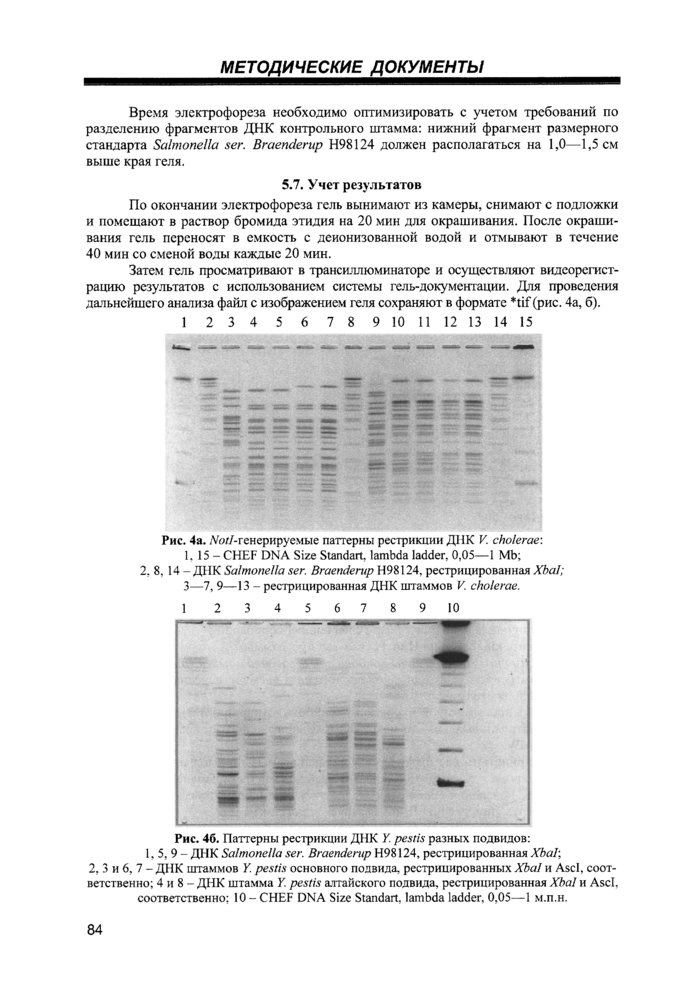
5.7. Учет результатов.........................................................................................................84
5.8. Интерпретация результатов........................................................................................85
6. Проведение рибопринтинга.....................................................................................................86
6.1. Культивирование микроорганизмов..........................................................................86
6.2. Подготовка проб..........................................................................................................86
6.3. Проведение автоматического риботипирования......................................................86
6.4. Учет и интерпретация результатов............................................................................86
Библиография................................................................................................................................86
Приложение I. Используемое оборудование.............................................................................88
Приложение 2. Реактивы, ферменты, наборы............................................................................90
Приложение 3. Приготовление реактивов.................................................................................91
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главный государственный санитарный врач Российской Федерации
А. Ю. Попова
13 мая 2014 г.
Дата введения: с момента утверждения
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Использование методов полиморфизма длин рестрикционных фрагментов (рибопринтинг, электрофорез в пульсирующем поле) для идентификации возбудителей I—II групп патогенности
Методические рекомендации МР 4.2.0090—14
1. Область применения
1.1. Настоящие методические рекомендации (далее по тексту - рекомендации) предназначены для специалистов лабораторий, осуществляющих диагностические, мониторинговые и научные исследования с возбудителями опасных инфекционных болезней.
1.2. Рекомендации определяют проведение молекулярного типирования с помощью методов полиморфизма длин рестрикционных фрагментов (рибопринтинг, электрофорез в пульсирующем поле): методические основы, рекомендации к организации и оснащению лабораторий, основные этапы осуществления анализа, способы учета и интерпретации результатов.
2. Общие положения
2.1. Процедура молекулярного типирования возбудителей бактериальных инфекций с использованием электрофореза в пульсирующем поле (PFGE) заключается в рестрикции тотальной ДНК исследуемого изолята редкощепящими эндонуклеазами и последующем разделении полученных фрагментов в агарозном геле в гомогенном электрическом поле с периодическим изменением направления его приложения. Полученные в результате электрофореза специфический для каждого изолята набор фрагментов ДНК (PFGE-профиль) подвергаются математической обработке с использованием пакетов специальных программ и сравнительному анализу с формированием дендрограмм.
2.2. Процедура молекулярного типирования возбудителей бактериальных инфекций с использованием рибопринтинга (автоматическое риботипированис) заключается в рестрикции тотальной ДНК микроорганизма рсстриктазами с последующим электрофоретическим разделением полученных фрагментов и переносом их на мембрану, где происходит гибридизация с зондами, комплементарными нуклеотидным последовательностям генов 5S, 16S и 23S рибосомальной ДНК. Результатом анализа является выявление на мембране набора специфических фрагментов ДНК различно-
73
МЕТОДИЧЕСКИЕ ДОКУМЕНТЫ
го размера (от 1 до 50 т.п.н.), т.н. «рибопринт», который является уникальным для каждого вида бактерий.
3. Основные этапы исследования
3.1. Электрофорез в пульсирующем поле
Проведение электрофореза в пульсирующем поле включает в себя 8 этапов.
3.1.1. Культивирование микроорганизмов.
Назначение: получение достаточного количества исследуемой культуры на соответствующих плотных питательных средах.
3.1.2. Приготовление агарозных блоков.
Назначение: получение агарозных блоков, содержащих определенное количество бактериальных суспензий исследуемых штаммов микроорганизмов и протси-назы К.
3.1.3. Лизис клеток в агарозных блоках.
Назначение: обработка подготовленных по п. 3.1.2 блоков в лизирующем растворе с протсиназой К для разрушения клеточных стенок бактерий.
3.1.4. Отмывка агарозных блоков.
Назначение: очистка агарозных блоков после обработки по п. 3.1.3 от остатков лизирующего раствора и иротеиназы К.
3.1.5. Рестрикция ДНК в агарозных блоках.
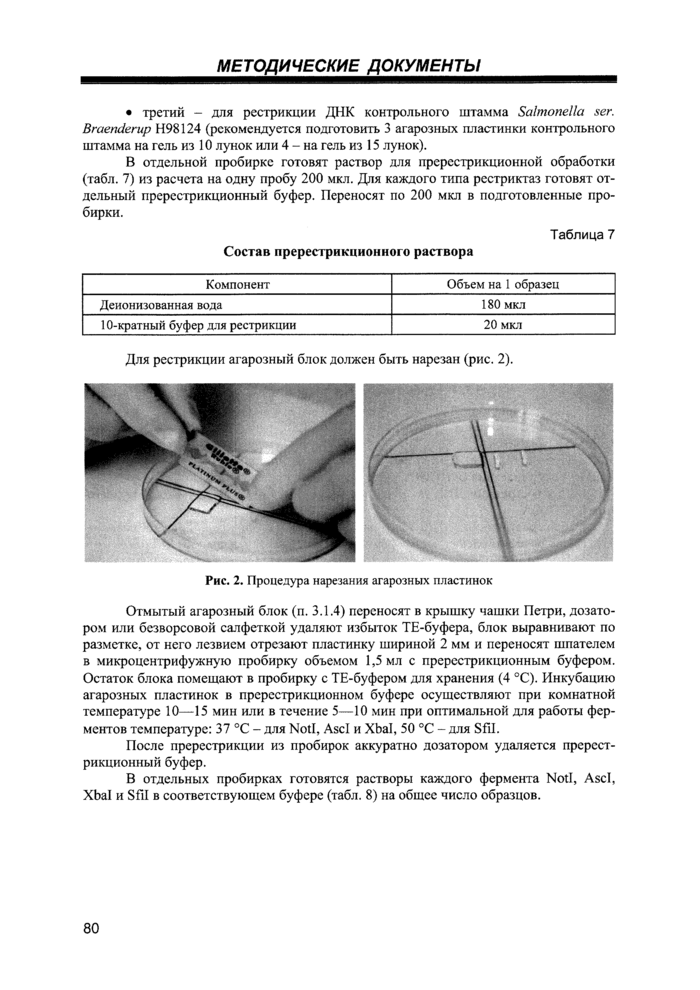
Назначение: рестрикция тотальной ДНК, полученной в агарозных блоках после обработки по пп. 3.1.3 и 3.1.4.
3.1.6. Электрофорез в пульсирующем поле.
Назначение: разделение полученных после обработки по п. 3.1.5 фрагментов ДНК в агарозном геле при использовании пульсирующего электрического поля.
3.1.7. Учет результатов.
Назначение: визуализация фрагментов ДНК в агарозном геле с помощью бромида этидия.
3.1.8. Интерпретация результатов.
Назначение: математическая обработка полученных данных с целью сравнения полученных PFGE-профилсй и определения степени родства между изученными в данном эксперименте или ранее изученными изолятами.
3.2. Рибопринтинг
Проведение рибопринтинга включает в себя 4 этапа.
3.2.1. Культивирование микроорганизмов.
Назначение: получение достаточного количества исследуемой культуры на соответствующих плотных питательных средах.
3.2.2. Подготовка проб для исследования.
Назначение: приготовление бактериальной суспензии, прогревание при различных температурах и обработка лизирующим раствором для получения полногеномной ДНК.
3.2.3. Проведение автоматического риботипирования.
Назначение: проведение рестрикции тотальной ДНК в подготовленных по п. 3.2.2 пробах, разделение фрагментов в агарозном геле и их перенос на мембрану, гибридизация фрагментов с зондами, меченными флуоресцентной меткой.
3.2.4. Учет и интерпретация результатов.
МЕТОДИЧЕСКИЕ ДОКУМЕНТЫ
Назначение: математическая обработка результатов исследования с целью сравнения полученных рибопринтов с имеющимися в базе данных и определения видовой принадлежности изученных штаммов микроорганизмов.
4. Основные требования к организации исследований
4.1. Лаборатории должны быть оснащены оборудованием для проведения исследований с использованием методов полиморфизма длин рестрикционных фрагментов (рибопринтинг, электрофорез в пульсирующем поле) (прилож. 1).
4.2. Лаборатории должны быть оснащены расходными материалами и реактивами для проведения исследований с использованием методов полиморфизма длин рестрикционных фрагментов (рибопринтинг, электрофорез в пульсирующем поле) (прилож. 2).
4.3. Подготовку реактивов для осуществления рибопринтинга и электрофореза в пульсирующем поле проводят с использованием реактивов с классом чистоты нс ниже чд.а. по схемам, прсдстаалснным в прилож. 3.
4.4. Материалом для исследования при осущесталснии молекулярного типи-рования с использованием рибопринтинга и электрофореза в пульсирующем поле являются чистые культуры возбудителей особо опасных инфекционных болезней, предварительно идентифицированные для каждой нозологии до вида, рода либо семейства.
4.5. Исследование осущесталяют в боксированных помещениях и боксах биологической безопасности II В класса. Тип дезинфицирующего вещества определяется видом патогена, с которым проводится работа.
4.6. Культивирование микроорганизмов осуществляют на нссслсктивных плотных питательных средах, предназначенных для накопления культур. Недопустимо использование сред, содержащих индикаторы, антибактериальные вещества.
5. Проведение PFGE
5.1. Культивирование микроорганизмов
Культивирование штаммов У. pestis осуществляется на казеиново-дрожжевом агаре (pH 7,6) в течение 2 суток при температуре 28 °С. Посев производят таким образом, чтобы получить изолированные колонии. Из 2-суточной агаровой культуры исследуемого штамма отбирают одну типичную изолированную колонию и пересеивают на пластинку агара Хоттингера pH 7,2 (для получения бактериальной массы, необходимой для постановки пульс-электрофореза), а также одновременно на скошенный столбик казеиново-дрожжевого агара (для обеспечения возможности исследования той же колонии в случае необходимости).
Культивирование штаммов V. cholerue осуществляют на щелочном казеиново-дрожжевом агаре (pH 7,6) в течение 18—24 ч при температуре 37 °С. Из 18-часовой агаровой культуры исследуемого штамма отбирают одну типичную изолированную колонию и пересеивают на пластинку щелочного агара (для получения бактериальной массы, необходимой для постановки пульс-электрофореза), а также одновременно в столбик полужидкого агара (для обеспечения возможности исследования той же колонии в случае необходимости).
Культивирование В. mallei осуществляют на сердечно-мозговом агаре BHI (pH 7,2) в течение 24 ч при температуре 37 °С. После инкубации отбирают одну типичную изолированную колонию и пересеивают на пластинку с сердечно-мозговым агаром (pH 7,2) (для получения бактериальной массы, необходимой для постановки пульс-электрофореза).
75
Дополнительно производится посев на чашку с триптиказо-сосвым агаром штамма Salmonella ser. Braenderup Н9812, используемого в качестве контрольного при проведении PFGE.
5.2. Приготовление агарозных блоков
Подготовку оборудования, расходных материалов и реактивов осуществляют в соответствии с данными табл. 1.
В предварительно промаркированные стеклянные пробирки с охлажденным CSB-буфсром стерильным ватным тампоном вносят культуру исследуемых штаммов Y. pesis, V. cholerae, В. Mallei и осторожно растирают. Затем переносят 2 мл полученной суспензии в пробирки для денситометра или кювету для спектрофотометра и измеряют оптическую плотность, доводят показатель до требуемого добавлением CSB или культуры (табл. 2).
Таблица 1
Перечень оборудования, расходных материалов и реактивов, необходимых для приготовления агарозных блоков
|
Водяная баня-шейкер |
Устанавливают температуру 54 °С |
|
Твердотельный термостат |
Установить температуру 57 °С |
|
Форма для заливки агарозных блоков |
Обрабатывают 70°-м этиловым спиртом, собирают. помещают в металлический поддон, застеленный марлевой салфеткой, смоченной дезраствором. Лунки формы маркируют с обеих сторон в соответствии с номерами исследуемых штаммов |
|
Стеклянные пробирки |
Внести по 3 мл охлажденного CSB-буфера |
|
Буфер для суспендирования клеток (например: CSB - Cell Suspension Buffer или эквивалент) |
В соответствии с прилож. 3, затем охлаждают |
|
1 % агароза для приготовления блоков (например: SeaKemGold или эквивалент) |
В соответствии с прилож. 3 |
|
Стоковый раствор протеиназы К (20 мг/мл) |
В соответствии с прилож. 3 |
|
Микроцснтрнфужные пробирки объемом 1,5 мл |
|
|
Пробирки для денситометра или кюветы для спектрофотометра |
|
|
Стерильные ватные тампоны |
|
|
|
Таблица 2 |
Показатели оптической плотности микробной взвеси
|
Прибор для измерения |
Единицы |
Показатель |
|
оптической плотности |
измерения |
|
Спектрофотометр (длина волны |
Оптическая плотность |
0.8—1.0 |
|
610 нм) |
(OD) |
|
Денситометр |
Единицы МакФарланда (McF) |
3,7—3,8 (для V cholerae)
3.6— 3.7 (для Y. pest is)
3.6— 3,7 (для В. mallei) |
МЕТОДИЧЕСКИЕ ДОКУМЕНТЫ
Полученную суспензию В. mallei инактивируют в присутствии мертиолята натрия при температуре 56 °С в течение 1 ч. Далее взвесь концентрируют до плотности 2,4- 109—3,0- 109 м.к./мл при помощи трехкратного центрифугирования (центрифугируют 1 мл бактериальной взвеси в микроцентрифужной пробирке объемом 1,5 мл в течение 10—15 мин при 12 ООО об./мин, удаляют надосадочную жидкость, к осадку добавляют 1 мл бактериальной взвеси, осадок рссуспсндируют и т. д.). К полученному осадку добавляют 0,5 мл CSB-буфера, после чего подогревают до температуры 50 °С.
Приготовленную бактериальную суспензию каждого штамма в объеме 300 мкл переносят в предварительно маркированные микроцентрифужные пробирки объемом 1,5 мл. В каждую пробирку со взвесью добавляют по 12 мкл стокового раствора протсиназы К (20 мг/мл), перемешивают осторожно пилотированием. Затем 300 мкл полученной смеси добавляют к 300 мкл предварительно расплавленной и разлитой в микроцентрифужные пробирки объемом 1,5 мл 1 %-й SKG-агарозы, аккуратно, тщательно перемешивают пипстированисм. Пробирки помещают в твердотельный термостат, нагретый до 57 °С, и заливают в ячейку формы для заливки блоков (табл. 3, рис. 1).
Для каждого исследуемого штамма заливают по две ячейки формы (при использовании многоразовой формы) или по четыре ячейки (при использовании одноразовой формы). Агарозные блоки оставляют для застывания в форме при комнатной температуре на 10—15 мин.
Компоненты для приготовления агарозных блоков
|
Таблица 3 |
|
Компонент |
Объем на один образец |
|
Бактериальная суспензия |
300 мкл |
|
Протеиназа К (20 мг/мл) |
12 мкл |
|
1 %-я SKG-агароза |
300 мкл |
|
и-ши
5.3. Лизис клеток в агарозных блоках
Подготовку оборудования, расходных материалов и реактивов осуществляют в соответствии с данными табл. 4.
77