Инструкция по применению 81-0904
Организация контроля и методы выявления бактерий Listeria monocytogenes в пищевых продуктах
Купить Инструкция по применению 81-0904 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Инструкция предназначена для персонала микробиологических лабораторий санитарно-эпидемиологических учреждений Республики Беларусь, осуществляющих контроль качества продовольственного сырья и пищевых продуктов, также импортируемых в Республику Беларусь; гигиеническую оценку и выдачу санитарно-эпидемиологических заключений, а также бактериологическую диагностику заболеваний с пищевым путем передачи в лабораториях других организаций, аккредитованных в установленном порядке на право проведения контроля безопасности пищевой продукции и продовольственного сырья; в организациях, независимо от форм собственности, осуществляющих производственный контроль продовольственного сырья и пищевых продуктов в процессе их изготовления. Данная инструкция является обязательной при контроле пищевых продуктов в ходе проведения противоэпидемических мероприятий при возникновении вспышек, а также в порядке осуществления санитарно-эпидемиологического надзора.
Оглавление
1 Общие положения и область применения
2 Сущность метода
3 Аппаратура, материалы, лабораторная посуда, реактивы и питательные среды
3.1. Аппаратура и инструментарий
3.2. Лабораторная посуда и материалы
3.3. Реактивы и питательные среды
4 Подготовка к анализу
4.1. Приготовление растворов и реактивов
4.2. Приготовление питательных сред
5 Отбор и подготовка проб пищевых продуктов для анализа
5.1. Общие положения по отбору и подготовке проб
5.2. Отбор и подготовка проб молока, молочных продуктов, сыров, мороженого
5.3. Отбор и подготовка проб мяса, мясных полуфабрикатов, мяса птицы и птицепродуктов, колбасных изделий и других мясопродуктов
5.4. Отбор и подготовка проб плодоовощной продукции
5.5. Отбор и подготовка проб рыбы, нерыбных объектов промысла и продуктов, вырабатываемых из них
5.6. Продукты детского, лечебного питания и их компоненты
6 Проведение анализа
7 Проведение исследования с использованием кондуктометрического анализатора "Бак Трак"
7.1. Предварительное обогащение — 1 этап
7.2. Обогащение — 2 этап
8 Выявление Listeria monocytogenes в реакции нарастания титра фага (РНФ)
9 Биологические исследования
10 Требования безопасности
11 Библиографический список
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Организации:
| 13.10.2004 | Утвержден | Главный Государственный санитарный врач Республики Беларусь | 81-0904 |
|---|---|---|---|
| Разработан | Республиканский центр гигиены эпидемиологии и общественного здоровья |
- ГОСТ 24778-81 Пластмассы. Метод определения прочности при сдвиге в плоскости листа
- ГОСТ 23932-90 Посуда и оборудование лабораторные стеклянные. Общие технические условия
- ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
- ГОСТ 24104-2001 Весы лабораторные. Общие технические требования
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10444.8-88Продукты пищевые. Метод определения Bacillus cereus. Заменен на ГОСТ 10444.8-2013.- ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
- ГОСТ 13646-68 Термометры стеклянные ртутные для точных измерений. Технические условия
- ГОСТ 13805-76 Пептон сухой ферментативный для бактериологических целей. Технические условия
- ГОСТ 17206-96 Агар микробиологический. Технические условия
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
- ГОСТ 19569-89 Стерилизаторы паровые медицинские. Общие технические требования и методы испытаний
- ГОСТ 19881-74 Анализаторы потенциометрические для контроля рН молока и молочных продуктов. Общие технические условия
- ГОСТ 21237-75 Мясо. Методы бактериологического анализа
- ГОСТ 21239-93 Инструменты хирургические. Ножницы. Общие требования и методы испытаний
- ГОСТ 21240-89 Скальпели и ножи медицинские. Общие технические требования и методы испытаний
- ГОСТ 21241-89 Пинцеты медицинские. Общие технические требования и методы испытаний
- ГОСТ 22280-76 Реактивы. Натрий лимоннокислый 5,5-водный. Технические условия
- ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
- ГОСТ 2493-75 Реактивы. Калий фосфорнокислый двузамещенный 3-водный. Технические условия
- ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
- ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
- ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
- ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
- ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
- ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
- ГОСТ 3145-84 Часы механические с сигнальным устройством. Общие технические условия
- ГОСТ 3622-68 Молоко и молочные продукты. Отбор проб и подготовка их к испытанию
- ГОСТ 3640-94 Цинк. Технические условия
- ГОСТ 4170-78 Реактивы. Натрий-аммоний фосфорнокислый двузамещенный 4-водный. Технические условия
- ГОСТ 4198-75 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
- ГОСТ 4288-76 Изделия кулинарные и полуфабрикаты из рубленого мяса. Правила приемки и методы испытаний
- ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
- ГОСТ 5556-81 Вата медицинская гигроскопическая. Технические условия
- ГОСТ 5962-67 Спирт этиловый ректификованный. Технические условия
- ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
- ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
- ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
- ГОСТ 7631-85 Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний
ГОСТ 7702.2.0-95Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим исследованиям. Заменен на ГОСТ 7702.2.0-2016.- ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
- ГОСТ 9225-84 Молоко и молочные продукты. Методы микробиологического анализа
- ГОСТ 9412-93 Марля медицинская. Общие технические условия
- ГОСТ 9958-81 Колбасные изделия и продукты из мяса. Методы бактериологического анализа
- СанПиН 42-123-4940-88 Микробиологические нормативы и методы анализа продуктов детского, лечебного и диетического питания и их компонентов
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17

стр. 18
УТВЕРЖДАЮ Главный государственный
Организация контроля и методы выявления бактерий Listeria monocytogenes в пищевых продуктах
(инструкция по применению)
Учреждения-разработчики: Республиканский центр гигиены, эпидемиологии и общественного здоровья
Авторы: к.м.н. Фидаров Ф.М., Федоренчик Л.А., д.м.н. Филонов В.П., д.м.н. Коломиец Н.Д., Марейко А.М., Пашкович В.В., Турков Н.А.
Минск 2004
2Содержание
1. Общие положения и область применения...................................................... 5
2. Сущность метода..................................................................................... 6
3. Аппаратура, материалы, лабораторная посуда, реактивы и питательные среды....... 7
3.1. Аппаратура и инструментарий............................................................... 7
3.2. Лабораторная посуда и материалы......................................................... 7
3.3. Реактивы и питательные среды.............................................................. 8
4. Подготовка к анализу............................................................................... 9
4.1. Приготовление растворов и реактивов..................................................... 9
4.2. Приготовление питательных сред........................................................... 10
5. Отбор и подготовка проб пищевых продуктов для анализа................................. 11
5.1. Общие положения по отбору и подготовке проб........................................ 11
5.2. Отбор и подготовка проб молока, молочных продуктов, сыров, мороженого..... 12
5.3. Отбор и подготовка проб мяса, мясных полуфабрикатов, мяса птицы
и птице продуктов, колбасных изделий и других мясопродуктов......................... 12
5.4. Отбор и подготовка проб плодоовощной продукции................................... 12
5.5. Отбор и подготовка проб рыбы, нерыбных объектов промысла
и продуктов, вырабатываемых из них........................................................... 12
5.6. Продукты детского, лечебного питания и их компоненты............................ 13
6. Проведение анализа................................................................................. 13
7. Проведение исследования с использованием кондуктометрического
анализатора «Бак Трак».............................................................................. 16
7.1. Предварительное обогащение - 1 этап..................................................... 16
7.2. Обогащение - 2 этап........................................................................... 16
8. Выявление Listeria monocytogenes в реакции нарастания титра фага (РНФ)............ 17
9. Биологические исследования...................................................................... 18
10. Требования безопасности......................................................................... 18
11. Библиографический список...................................................................... 20
115.6. Продукты детского, лечебного питания и их компоненты
Отбор и подготовку проб продуктов детского, лечебного питания и их компонентов проводят согласно СанПиН42-123-4940-88 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов».
Отобранные пробы продуктов перед исследованием тщательно перемешивают, кисломолочные продукты нейтрализуют (на 10 см3/г исследуемого продукта или первого разведения для сухих кисломолочных продуктов, напитка или закваски добавляют 1,0 см3 стерильного раствора двууглекислого натрия с массовой концентрацией 100 г/дм3). Сыр, творог, творожные изделия и пастообразные продукты тщательно измельчают и нейтрализуют. Топленое масло или молочный жир расплавляют при температуре 40-45 °С и перемешивают до получения однородной эмульсии.
6. Проведение анализа
6.1. Подготовленную в соответствии с п. 5 навеску исследуемого продукта (гомогената, смыва с поверхности) в количестве 25 г (см3) вносят в одну из сред для первичного обогащения в количестве 225 см3 (по п.п. 3.3.2.2., 4.2.З.1.). При необходимости анализа других масс продукта их посев проводят в среду также в соотношении 1:9 по объему.
Посевы термостатируют при 37 °С в течение (24+2) ч. При росте листерий на средах предобогащения, содержащих эскулин и цитрат железа аммонийного, наблюдается почернение среды за счет гидролиза гликозида эскулина до глюкозы и эскулетина. Эскулетин реагирует с ионами железа, образуя комплекс черного или оливкового цвета. На других средах почернения не отмечается
6.2. После термостатирования продукта в среде для первичного обогащения 0,1 см3 суспензии пересевают в 10 см3 одной из жидких сред для вторичного обогащения. Посевы термостатируют при температуре (37+1) °С в течение 48 ч. В средах с эскулином отмечают почернение как признак возможного присутствия бактерий рода Listeria.
6.3. Из пробирок после термостатирования, независимо от наличия или отсутствия признаков роста, и в т.ч. почернения, делают пересев по 0,1 см3 на поверхность двух чашек Петри с одной из агаризованных дифференциально-диагностических сред по п.п. 3.3.2.3., 4.2.4., 4.2.5. Посевной материал растирают стерильным шпателем. Допускается проводить пересев петлей штрихом. Чашки со средами предварительно подсушивают.
Посевы термостатируют при температуре (37+1) °С в течение 24-48 ч.
6.4. Проведение анализа без этапа вторичного обогащения.
При посеве продуктов с низким исходным уровнем микробной контаминации и при отсутствии признаков роста в жидкой среде (помутнение, почернение и др.) допускается проводить пересев на чашки с агаризованными дифференциально-диагностическими средами сразу после этапа первичного обогащения по и. 6.2.
6.5. При отсутствии роста на чашках с дифференциально-диагностическими средами типа Оксфордского агара и PALCAM-arapa анализ прекращают и дают заключение об отсутствии L. Monocytogenes в исследованной пробе продукта.
6.6. При обнаружении характерного роста на чашках отбирают 3-5 колоний для дальнейшего изучения.
На средах типа PALCAM-arapa через 24 ч инкубирования листерии формируют мелкие, серовато-зеленые или оливково-зеленые колонии с черным ореолом, диаметром 0,5-1,0 мм, иногда с черным центром. Через 48 ч колонии диаметром 1,0-2,0 мм приобретают зеленую окраску с углубленными центрами, окруженными черным ореолом. Кокковая микрофлора (бактерии рода Staphylococcus, Enterococcus) образует желтые колонии за счет ферментации маннита.
На Оксфордском агаре (Oxford agar) листерии, выращенные в течение 24 ч, мелкие (1мм), сероватые, окруженные черным ореолом. Через 48 ч - более темные, около 2 мм в диаметре, с черным ореолом и углубленным центром.
При появлении сплошного роста листерий производят пересев бактериологической петлей из зон наибольшего почернения среды штрихами на 2-3 чашки Петри с селективной
12
дифференциально-диагностической средой (Оксфордский или PALCAM-arap) для получения изолированных колоний. Посевы термостатируют аналогично и. 6.3.
6.7. Отобранные характерные колонии, подозрительные на принадлежность к Listeria monocytogenes, пересевают на среды: МПА с 1% глюкозы (п. 4.2.1.), триптон-соевый агар с дрожжевым экстрактом (TSYEA) по п. 3.3.2.1. или 4.2.2. для получения изолированных колоний, которые подвергают дальнейшему изучению. Посевы термостатируют при температуре 30 °С в течение 24 ч.
6.8. Идентификация выделенных культур
Для определения принадлежности выделенных микроорганизмов к роду Listeria полученные на средах культивирования чистые культуры микроскопируют по Граму, определяют наличие у них каталазы, подвижность при двух температурах инкубирования - 22 и 37 °С, способность к ферментации маннита и ставят реакцию нитрат-редукции.
6.8.1. Окраска по Граму. Бактерии рода Listeria являются грам-положительными тонкими короткими палочками, спор не образуют.
6.8.2. Каталазную активность культур определяют по способности каталазы разлагать перекись водорода с выделением пузырьков газа. Реакцию ставят с охлажденной до комнатной температуры суточной культурой на стерильном предметном стекле. Изолированную колонию, взятую с поверхности питательной среды, растирают на стекле и пипеткой наносят каплю 3%-ного раствора перекиси водорода. Если через 30-60 с на стекле появляются пузырьки газа, то считают результаты реакции положительными. Параллельно ставят контрольную пробу.Бактерии рода Listeria являются каталазоположительными.
6.8.3. Подвижность культур определяют посевом уколом в среды по и. 3.3.2.3. и 4.2.8. и инкубированием при двух температурах - 25 и 37 °С в течение 48-72 ч.
Бактерии рода Listeria подвижны при 20-25 °С (образуют характерный рост вокруг линии укола, похожий на зонтик) и неподвижны (или слабоподвижны) при 35-37 °С.
6.8.4. Для определения способности сбраживать углеводы культуры пересевают на пестрый ряд в среды Гисса по и.и. 3.3.2.3. или 4.2.9. Посевы термостатируют 7 дней при 37 °С, наличие ферментативной активности в отношении углеводов определяют по изменению окраски сред за счет образования кислоты.Болыпинство бактерии рода Listeria не утилизируют маннит (за исключением L. greyi и L. grayi subsp. murrayi).
6.8.5. Постановку реакции нитрат-редукции проводят по ГОСТ 10444.8-88. Бактерии рода Listeria не восстанавливают нитраты до нитритов (за исключением L. greyi и L. grayi subsp. murrayi).Обнаружение в посевах грамположительных коротких тонких палочек, каталазоположительных, не восстанавливающих нитраты до нитритов, не утилизирующих маннит, подвижных при 25 °С и неподвижных при 37 °С, указывает на принадлежность выделенных на дифференциально-диагностических средах культур с характерной морфологией к роду Listeria.
Для подтверждения принадлежности выделенных листерий к виду L. monocytogenes определяют способность к ферментации рамнозы, ксилозы, наличие лецитиназной и бета-гемолитической активности и проводят постановку КАМП-теста (CAMP-test). Дифференцирующие признаки видов рода Listeria указаны в табл. 1.
Для видовой дифференциации выделенных культур листерий допускается использовать биохимические тест-системы API Listeria фирмы «BioMerieux». При их применении следует руководствоваться рекомендациями изготовителя.
6.8.6. Способность ферментировать рамнозу и кислозу - определяют аналогично и.
6.8.4. Бактерии L. monocytogenes утилизируют рамнозу с образованием кислоты и не утилизируют ксилозу.
6.8.7. Бета-гемолитическую активность исследуемых культур определяют по образованию зон просветления за счет растворения эритроцитов вокруг колоний при посеве на поверхности кровяного агара, приготовленного с добавлением стерильной дефибринированной крови барана или кролика. Посевы на кровяном агаре (и.и. 3.3.2.3., 4.2.6.) термостатируют при 37°С в течение 24 ч.
13
|
Таблица 1. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Listeria monocytogenes обладают бета-гемолитической активностью (образуют узкие четкие зоны просветления вокруг колоний).
6.8.8. Постановку КАМП-теста проводят для дифференциации L. monocytogenes от других видов листерий, обладающих гемолитической активностью.
Для проведения теста 2 - 3-суточные культуры гемолитических штаммов Staphylococcus aureus и Rhodococcus equi засевают на кровяной агар с эритроцитами барана двумя параллельными штрихами на расстоянии 5,0-5,5 см, как показано на рис. 1.
|
S - посев Staphylococcus aureus; R - посев Rhodococcus equi. |
Между вертикальными штрихами St. aureus и Rh. equi засевают параллельными штрихами исследуемые культуры листерий на расстоянии друг от друга не менее 1 см и от вертикальных штрихов - 0,5 см. В качестве контрольных используют тест-штаммы L. monocytogenes и L. Ivanovii. Инкубацию проводят 24 ч при 37 °С. Отмечают форму и размеры зон гемолиза около вертикальных штрихов роста стафилококка и родококка.
Listeria monocytogenes дает расширение зоны гемолиза около штриха Staphylococcus aureus (положительный КАМП-тест) и имеет отсутствие изменений зоны гемолиза рядом со штрихом Rhodococcus equi (отрицательный КАМП-тест).
6.8.9. Для определения лецитиназной активности дно двух чашек Петри со средой ГРМ №1, содержащих: 1 чашка - желток куриного яйца и активированный уголь, 2 чашка - желток куриного яйца без активированного угля - делят на несколько секторов или квадратов, исследуемые культуры и контрольные штаммы листерий пересевают параллельно короткими штрихами на соответствующие секторы чашек, содержащих и не содержащих уголь. Инкубируют 48 ч при 37 °С. Чашки просматривают в проходящем свете и определяют наличие активности в присутствии и в отсутсвии активированного угля, сравнивая с контрольными
14
высевами музейных штаммов. Listeria ivanovii дает плотную зону помутнения шириной 3-6 мм независимо от присутствия активированного угля. Listeria monocytogenes дает аналогичную зону помутнения в присутствии активированного угля и не дает при отсутствии угля. Другие виды листерий не дают зоны помутнения.
6.9. Учет результатов.
В образце продукта констатируют присутствие Listeria monocytogenes, если при посеве на селективные среды выделены короткие неспорообразующие грамположительные палочки, каталазоположительные, подвижные при 25 °С и неподвижные при 37 °С, утилизирующие эскулин, сбраживающие с образованием кислоты рамнозу и не сбраживающие маннит и ксилозу, не восстанавливающие нитраты до нитритов, обладающие бета-гемолитической активностью, дающие положительную реакцию в КАМП-тесте со Staphylococcus aureus и отрицательную - с Rhodococcus equi, проявляющие лецитиназную активность на среде ГРМ № 1 с добавлением желтка куриного яйца в присутствии активированного угля.
Результаты выделения Listeria monocytogenes в определенной навеске продукта записывают: «Listeria monocytogenes обнаружены в 25 г (см3) (в 50-100 - для продуктов детского, лечебного и специализированного питания) продукта» или «Listeria monocytogenes не обнаружены в 25 г (см3) (в 50-100 - для продуктов детского, лечебного и специализированного питания) продукта».
Результат оценивают по каждой пробе отдельно.
7. Проведение исследования с использованием экспресс-анализатора «Бак Трак»7.1. Предварительное обогащение - 1 этап
Для предварительного обогащения используется среда Pre-Media 403 А.
Необходимое количество продукта, в котором регламентируется отсутствие Listeria monocytogenes, смешивают со средой Pre-Media 403 А в соотношении 1/10, затем образец го-могенезируют и инкубируют в течение 24 ч.
7.2. Обогащение - 2 этап
Для обогащения используют одну из сред BiMedia 401А, BiMedia 402А, BiMedia 403А.
Среду BiMedia 403 А (401 А, 402А) оставляют уравновеситься при комнатной температуре в течение 12 ч. Устанавливают температуру 37 °С на приборе «Бак Трак».
В основном меню программы «Бак Трак» устанавливают следующие параметры:
Время исследования (Duration) 36 ч
Масштаб измерений (Scale)
М-параметр 0-20%
Е-параметр 0-80%
Время задержки (Delay) 1 ч
Пороговые значения (Thresholds)
М-параметр 5%
Е-параметр 15%
Проводить учет результатов по Е-параметру Пороговое значение по времени (Time limit) 30 ч
Параметры для инкубаторного блока (Adjust parameters):
Добавляют в каждую измерительную ячейку по 10 см3 среды BiMedia и вносят по 0,1см3 пред обогащенного образца, тщательно перемешивают содержимое, вращая ячейку между ладонями (не переворачивая).
Для контроля среды используют одну измерительную ячейку с 10 см3 среды BiMedia (без инокулята).
Выбирают в основном меню программы ЗАПУСК ИЗМЕРЕНИИ (Start Measurement) и начинают измерения.
После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, измерительные ячейки помещают в прибор «Бак Трак». Измерение начинается ав-
15
томатически через 1 ч после загрузки ячеек в прибор. Рост микроорганизмов и время определения изменения импеданса (IDT) записываются автоматически.
Учет результатов:
Образец загрязнен листериями, если изменение импеданса превышает 15%-ное пороговое значение по Е-параметру в течение 30 ч.
Подтверждение Listeria-позитивных образцов.
В случае положительного ответа на листерии проводится подтверждение роста и идентификация до Listeria monocytogenes с высевом на селективные питательные среды в соответствии с п.п. 6.3-6.8. Высев производится непосредственно из измерительной ячейки.
Выросшие культуры подвергают идентификации по п. 6.8.
Учет результатов и выдача ответа по п. 6.9.
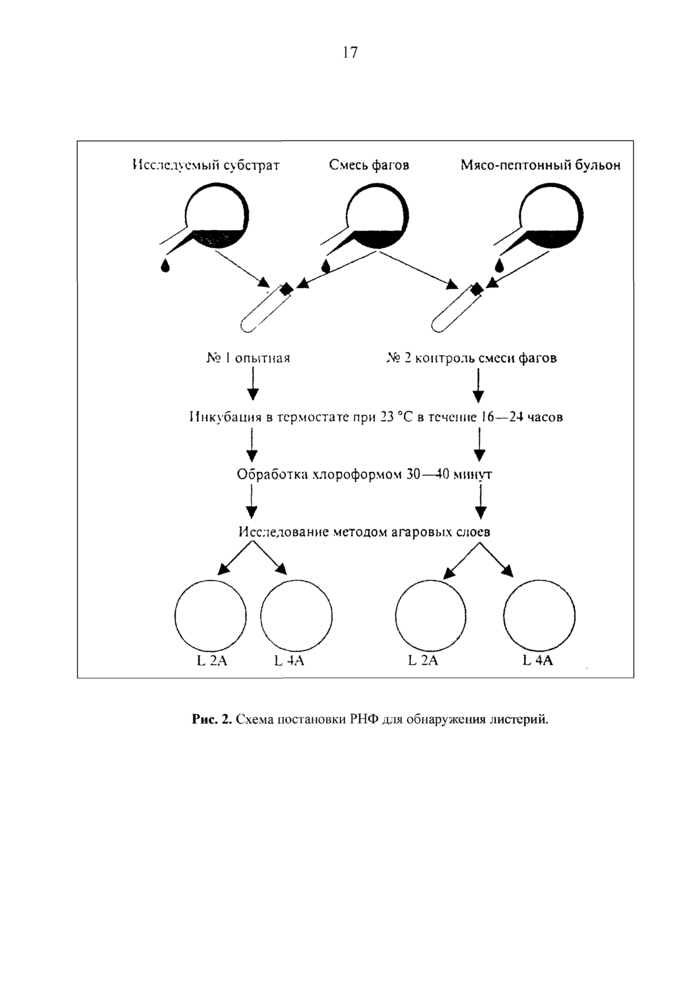
8. Выявление Listeria monocytogenes в реакции нарастания титра фага (РНФ)
РНФ может быть использована в качестве дополнительного метода для обнаружения Listeria monocytogenes в пищевых продуктах (при проведении противоэпидемических мероприятий или эпидрасследовании). Реакция нарастания титра фага - быстрый специфический метод обнаружения листерий, обеспечивающий выявление возбудителя в исследуемом материале без выделения культуры.
РНФ основана на свойстве индикаторного бактериофага строго специфично размножаться в клетках гомологичного микроба. Размножение бактериофага сопровождается увеличением количества его частиц и повышением титра.
8.1. В реакции применяют листериозные бактериофаги L2A и L4A. Штаммы Listeria monocytogenes I (9-127) и II (9-72) серогрупп. Питательные среды, содержащие 0,5% глюкозы: мясопептонный бульон, 1,5%-ный и 0,7%-ный мясопептонный агар.
8.2. При постановке РНФ с пробами пищевых продуктов отвешивают 25 г исследуемого материала, измельчают, помещают в колбу емкостью 1 ООО см3 и добавляют 250 см3МПБ. Смесь в течение 5-10 минут встряхивают, а затем переносят в бактериологическую пробирку № 1(опыт).
8.3. Бактериофаги используют в рабочем разведении (10 000 фаговых корпускул в 1 см3). Для этого их растворяют в МПБ до исходного объема, указанного на этикетке ампулы, а затем на МПБ отдельными пипетками делают пять последовательных десятикратных раз-ведений (в последнем разведении титр бактериофага составит 1x104).
Смесь фагов готовят путем смешивания равных объемов фага L2A и L4A в рабочем разведении.
8.4. Для контроля титра бактериофага, который ставят один на группу анализов, проводимых одновременно, в пробирку № 2 (контроль) вносят 9 см3 МПБ.
8.5. В пробирки № 1 и 2 вносят по 1 см3 смеси фага в рабочем разведении (рис. 2) и выдерживают их в течение 16-24 ч при комнатной температуре, после чего в пробирки добавляют по 1 см3 хлороформа. Содержимое тщательно встряхивают и оставляют при комнатной температуре на 30-40 мин. Хлороформ оседает на дно, над осад очную жидкость подвергают дальнейшим исследованиям.
8.6. При использовании смеси фагов из опытной и контрольной пробирок (№ 1 и 2) берут по 0,2 см3 и переносят по 0,1 см3 в две пробирки, содержащие по 0,9 см3 МПБ (один ряд для обнаружения фага L2A, а другой - L4A), а затем из каждой пробирки готовят еще одно десяти кратное разведение.
8.7. Еотовят взвесь штаммов I и II серогруппы по стандарту мутности 10 ед. путем разведения суточной агаровой культуры в физиологическом растворе. Во все пробирки с разведенным материалом добавляют по 0,1 см3 взвеси, штамма I серогруппы для выявления фага L2A или штамма II серогруппы для обнаружения фага L4A.
Содержимое пробирок засевают методом агаровых слоев по Ерациа. Для этого накануне дня исследования в бактериологические чашки Петри разливают по 10 см3 1,5%-ного МПА; МПА можно разлить в чашки Петри в день исследования, но в этом случае поверх-
16
ность агара необходимо предварительно подсушить в течение 40-50 мин при 37 °С или 2 ч при комнатной температуре. Для второго слоя используют расплавленный и охлажденный до 48-50 °С 0,7%-ный МПА, который следует использовать в течение часа, так как позже он приобретает гелеобразную консистенцию и не пригоден для исследования.
Затем в пробирки пипеткой вносят по 2,5-3 см3 расплавленного и охлажденного до 48-50 °С 0,7%-ного МПА. Содержимое быстро и тщательно перемешивают вращением пробирки между ладонями и выливают в чашку Петри. Смесь легким покачиванием чашки равномерно распределяют вторым слоем на поверхности 1,5%-ного МПА. Чашки оставляют на ровном месте на 20-30 мин (до застывания 0,7%-ного МПА), затем переворачивают и инкубируют при комнатной температуре.
8.8. Учет реакции проводят через 16-24 ч инкубирования посевов.
В опытных пробах и контроле титра фага подсчитывают число негативных колоний во всех чашках. Негативные колонии - округлые, хорошо заметные на фоне бактериального роста, прозрачные участки, образующиеся в результате лизиса бактерий.
При учете результата сравнивают количество негативных колоний на чашках соответствующих разведений.
8.9. Результаты реакции оценивают по увеличению титра бактериофага (количества негативных колоний):
- увеличение количества негативных колоний в опытной пробе по отношению к контролю в 5 и более раз (хотя бы по одному из разведений) оценивается как положительный результат, менее чем в 5 раз - отрицательный;
- сплошной лизис или лизис с островками оценивается как положительный результат.
8.10. При получении положительного результата РНФ дают заключение, что в исследуемом материале (пробе) обнаружены бактерии рода Listeria.
9. Биологические исследования
Биологические исследования (постановку биопроб на мышцах) выделенных культур и их серологическую диагностику в реакции агглютинации проводят в ходе противоэпидемических мероприятий и при эпидрасследовании заболеваний в соответствии с методическими рекомендациями «Лабораторная диагностика листериоза животных и людей, меры борьбы и профилактики», М., 1987 (утв. 04.09.86) [16].
10. Требования безопасности
Исследования пищевых продуктов на наличие Listeria monocytogenes проводят в соответствии с СП 17-129 РБ 2000 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами».
17
|
Исследуемый субстрат Смесь фагов Мясо-пептонный бульон |
JV° I опытная
2 контроль смеси фагов
1 I
Инктбация в термостате при 23 °С в течение 16—24 часов
' 1 i
Обработка хлороформом 30—40 минут
i i
Исследование методом агаровых слоев
L 2А L 4А L 2А L 4А
Рис. 2. Схема постановки РНФ для обнаружения листерий.
1811. Библиографический список
1. Закон Республики Беларусь «О санитарно-эпидемическом благополучии населения» от 23 мая 2000г.
2. СанПин 11 63 РБ 98 «Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов».
3. Постановление № 117 «О внесении изменений в санитарные правила и нормы СанПин 11 63 РБ 98».
4. ГОСТ 26668-85 «Продукты пищевые и вкусовые. Методы отбора проб для микробиологических исследований».
5. ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов».
6. ГОСТ 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов».
7. ГОСТ 10444.1-84 «Консервы. Приготовление растворов, красок, индикаторов, питательных сред, применяемых в микробиологическом анализе».
8. ГОСТ 9225-84 «Молоко и молочные продукты. Методы микробиологического анализа».
9. ГОСТ 9792-73 «Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб».
10. ГОСТ 9958-81 «Изделия колбасные и продукты из мяса. Методы бактериологического анализа».
11. ГОСТ 21237-75 «Мясо. Методы микробиологического анализа».
12. ГОСТ 4288-76 «Изделия кулинарные и полуфабрикаты из рубленного мясаю правила приемки и методы испытания».
13. ГОСТ 7631-85 «Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний».
14. МУК 11-13-7 РБ 99 «Бактериологические исследования с использованием микробиологического экспресс-анализатора «Бак Трак 4100». Минздрав РБ, Минск,1999.
15. Методические рекомендации «Лабораторная диагностика листериоза животных и людей, меры борьбы и профилактики» (утв. Минздравом СССР 04.09.86).
16. СанПин 17-129 РБ 2000 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами».
17. «Инструкция по санитарно-бактериологическому контролю производства маргарина и майонеза на предприятиях маргариновой промышленности» (утв. Госаграпром СССР 21.11.88).
18. СанПиН 420123-4940-88 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов».
3
1.Общие положения и область применения
Настоящая инструкция устанавливает единую методику лабораторного исследования качества продовольственного сырья и пищевых продуктов по выявлению в них бактерий Listeria monocytogenes.
Инструкция предназначена для персонала микробиологических лабораторий санитарно-эпидемиологических учреждений Республики Беларусь, осуществляющих контроль качества продовольственного сырья и пищевых продуктов, в т.ч. импортируемых в Республику Беларусь; гигиеническую оценку и выдачу санитарно-эпидемиологических заключений, а также бактериологическую диагностику заболеваний с пищевым путем передачи в лабораториях других организаций, аккредитованных в установленном порядке на право проведения контроля безопасности пищевой продукции и продовольственного сырья; в организациях, независимо от форм собственности, осуществляющих производственный контроль продовольственного сырья и пищевых продуктов в процессе их изготовления. Данная инструкция является обязательной при контроле пищевых продуктов в ходе проведения противоэпидемических мероприятий при возникновении вспышек, а также в порядке осуществления санитарно-эпидемиологического надзора.
Проведение контроля на Listeria monocytogenes позволит получить реальную картину ситуации в Республике Беларусь, оценить степень загрязненности пищевой продукции и дать оценку эффективности принимаемых мер в целях обеспечения ее безопасности в плане новых и вновь возникающих возбудителей инфекций с алиментарным путем передачи для здоровья и жизни человека.
При контроле пищевых продуктов на загрязненность патогенными микрооганизмами в СанПиНе 11 63 РБ 98 "Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов" предусматривается новый микробиологический показатель «Listeria monocytogenes - не допускаются» в 25г продуктов массового назначения и в 50-100г для продуктов детского и специального питания.
Лабораторный контроль за отсутствием Listeria monocytogenes в пищевых продуктах, где нормируется этот показатель, проводится:
- в порядке надзора за соблюдением установленных требований в области обеспечения качества и безопасности пищевых продуктов в ходе проверок изготовления и оборота пищевой продукции, оказания услуг в сфере торговли и общественного питания;
- при экспертизе продукции и подтверждении соответствия требованиям нормативных документов для целей гигиенической оценки и выдачи санэпидзаключений;
- при контроле за безопасностью продукции изготовителем (производственный контроль);
- в ходе проведения противоэпидемических мероприятий и при эпидрасследовании заболеваний.
При проведении контроля безопасности по показателю Listeria monocytogenes должен осуществляться периодический отбор образцов пищевой продукции.
Порядок контроля и кратность исследований должны устанавливаться в соответствии с методическими и инструктивными документами, утвержденными или согласованными в установленном порядке органами государственной санитарно-эпидемиологической службы Республики Беларусь, при этом необходимо учитывать специфику производства, степень его эпидзначимости, материально-техническое оснащение и т.п.
Особого внимания должны заслуживать предприятия, вырабатывающие продукты детского питания, детские молочные кухни, пищеблоки детских лечебно-профилактических учреждений, стационаров для онкологических, гематологических больных, домов ребенка, родильных домов, домов престарелых и инвалидов и т.п.
При проведении текущего надзора рекомендуемая минимальная периодичность выборочного лабораторного контроля пищевой продукции массового потребления - 1 раз в квартал; для детского и диетического питания - 2 раза.
4
При производственном контроле организация и периодичность лабораторных исследований продукции по показателю Listeria monocytogenes должна устанавливаться изготовителем продукции в соответствии с действующими санитарными правилами и согласовываться с учреждениями государственной санитарно-эпидемиологической службы по месту расположения предприятия-изготовителя.
Контроль пищевых продуктов по показателю Listeria monocytogenes с целью гигиенической оценки для выдачи санитарно-эпидемиологических заключений и подтверждения соответствия установленным требованиям при проведении экспертизы осуществляется в уполномоченных лабораториях центров гигиены и эпидемиологии или других организаций, аккредитованных в установленном порядке.
В пищевых продуктах, предназначенных для непосредственного употребления в пищу, в отношении которых отсутствуют микробиологические нормативы или данные о возможности выделения Listeria monocytogenes, контроль Listeria monocytogenes не проводится, однако в случае заболеваний людей и/или нарушений в области обеспечения качества и безопасности пищевых продуктов образцы таких продуктов должны быть направлены на лабораторное исследование.
Допускается организация лабораторных исследований путем их поэтапного выполнения в лабораториях учреждений санэпидслужбы различных уровней. При отсутствии возможности идентификации выделенных культур последние могут быть переданы в лаборатории, располагающие соответствующей материально-технической базой и квалифицированным персоналом, для выдачи окончательного результата.
2.Сущность метода
Инструкция содержит описание метода выявления бактерий Listeria monocytogenes, основанного на высеве определенного количества продукта в жидкие селективные среды, инкубировании посевов, выявлении в этих посевах бактерий, способных расти и образовывать типичные колонии на агаризованных дифференциально-диагностических средах. Принадлежность выделенных культур к Listeria monocytogenes определяется по биохимическим, морфологическим и другим свойствам.
Метод выявления L. monocytogenes в пищевых продуктах основан на применении специальных селективных и дифференциально-диагностических сред. Селективность сред по отношению к сопутствующей микрофлоре обеспечивается включением в их состав хлорида лития, акрифлавина, циклогексимида, налидиксиновой кислоты, полимиксина или других антибиотиков. Внесение эскулина и цитрата аммония железа позволяет подтверждать наличие листерий по почернению среды за счет гидролиза эскулина в присутствии ионов Fe+. Подтверждающие тесты родовой и видовой идентификации включают окраску по Г раму, определение подвижности выделенных на агаризованных средах типичных по физиологическим и морфологическим признакам культур, их способности восстанавливать нитраты до нитритов, сбраживать рамнозу, ксилозу и маннит, способности к гидролизу лецитина на ГРМ-среде с активированным углем, а также определение наличия [3-гемолиза на кровяном агаре и дифференциацию L. monocytogenes от других гемолизирующих листерий в КАМП-тесте с контрольными штаммами Staphylococcus aureus и Rhodococcus equi.
При необходимости для выявления L. monocytogenes в пищевых продуктах проводится постановка реакции нарастания титра фага (РНФ).
Предлагаемый метод обнаружения L. monocytogenes, гармонизированный с Международным стандартом ISO 11290-111996, предусматривает определение наличия или отсутствия L. monocytogenes в нормируемой массе продукта в соответствии с нормативами СанПин 11 63 РБ 98 "Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов" и Постановлением № 117 от 2.09.2003 г. "О внесении изменений в санитарные правила и нормы 11 63 РБ 98", выраженными в альтернативной форме и основанной на существующей системе отбора образцов и оценке результатов анализа.
Инструкция также содержит описание методики кондуктометрического определения L. monocytogenes в пищевых продуктах с использованием микробиологического анализатора «Бак Трак». Метод кондуктометрического анализа основан на регистрации изменений импеданса - сопротивления питательной среды, которые происходят в процессе роста и метаболической активности микроорганизмов.
3.
Аппаратура, материалы, лабораторная посуда, реактивы и питательные среды.3.1. Аппаратура и инструментарий.
|
НД (ГОСТ, ТУ) | ||||||||||||||||||||||||
|
|
3.2. Лабораторная посуда и материалы | |
|
Бумага фильтровальная лабораторная | |
|
Бутылки стеклянные для химических реактивов | |
|
Кастрюли эмалированные | |
|
Марля медицинская | |
|
Колбы плоскодонные конические или круглые разной вместимости | |
|
Воронки стеклянные | |
|
Вата медицинская гигроскопическая | |
|
Пипетки вместимостью 1,2,5 и 10 см3 | |
|
Полистироловые планшеты U-образные | |
|
Пробирки Уленгута (поплавки) | |
|
Пробирки типов П1, П2 | |
|
Стекла предметные для микропрепаратов | |
|
Спиртовки лабораторные стеклянные | |
|
Ступка фарфоровая с пестиком | |
|
Термометр ртутный с диапазоном измерения | |
|
от 0 до 100°С (цена деления шкалы 1°С) | |
|
Чашки биологические (Петри) |
3.3. Реактивы и питательные среды
, ТУ), фирма-изготовитель
ГОСТ 17206-96 ГОСТ 6709-72 ГОСТ 6038-79 ТУ 6-09-22-98-79
, ТУ), фирма-изготовитель
ГОСТ 17206-96 ГОСТ 6709-72 ГОСТ 6038-79 ТУ 6-09-22-98-79
нд (ФС
3.3.1. Реактивы, компоненты сред
Агар микробиологический Вода дистиллированная D-глюкоза, ч.
D-лактоза, 1-водная Маннит Ксилоза Рамноза
Калия гидроокись
Калий фосфорнокислый однозамещенный, ч.
Калий фосфорнокислый двузамегценный 3-водный Кислота соляная, х.ч.
Литий хлористый, ч. или х.ч.
Набор реактивов для окраски по Г раму Натрий-аммоний фосфорнокислый двузамегценний,
4-водный, ч. или х.ч.
Натрия гидроокись, ч.д.а.
Натрий лимоннокислый, 5,5-водный, ч.д.а.
Натрий хлористый, ч. или х.ч., или ч.д.а.
Пептон сухой ферментативный для бактериологических целей
Полимиксин «М» или «В» сульфат по 500 ООО ед. (медпрепарат)
Спирт этиловый ректифицированный технический
Спирт этиловый ректифицированный
Железа аммонийного цитрат
Уксусная кислота
Сульфаниловая кислота
ГОСТ 3640 - 94
А-нафтол
Цинк порошкообразный Эскулин
Lab М, HiMedia Lab М, HiMedia
Экстракт дрожжевой сухой Лития хлорид Желток куриного яйца Крахмал
Налидиксовая кислота
Акрифлавина гидрохлорид (трипафлавин)
Цефтазидим
Циклогексимид
Тест-штаммы Listeria monocytogenes, Listeria ivanovii,
Listeria innocua, Staphylococcus aureus, Rhodococcus equi, типичные по культуральным, морфологическим и биохимическим свойствам
3.3.2. Среды питательные
ФС 42-3377-97 (ГНЦПМ)
ВФС 42-2988-97 (ГНЦПН)
ТУ 10-02-02-789-176-94 HiMedia М1214 HiMedia Ml263
ФС 42-3377-97 (ГНЦПМ)
ВФС 42-2988-97 (ГНЦПН)
ТУ 10-02-02-789-176-94 HiMedia М1214 HiMedia Ml263
3.3.2.1. Для культивирования изолятов Триптозный ГРМ-агар и ГРМ-бульон
Среда ГРМ № 1
Питательный бульон и питательный агар Триптоно-соевый агар с дрожжевым экстрактом (TSYEA) Триптоно-соевый агар с дрожжевым экстрактом (TSYEB)
7
BioMerieux 42046 BioMerieux 42048 HiMedia M1327, FD 141, FE 1251 Merck 1.10549, HiMedia M569
HiMedia Ml 083 HiMedia M889 Lab M
BioMerieux 42046 BioMerieux 42048 HiMedia M1327, FD 141, FE 1251 Merck 1.10549, HiMedia M569
HiMedia Ml 083 HiMedia M889 Lab M
3.3.2.2. Среды селективного обогащения Бульон Фрейзера (Fraser Broth)
Бульон Фрейзера половинной концентрации (Half Fraser Broth) Fraser Broth Base, Fraser Supplement, Fraser Selective Supplement
Бульон для обогащения Listeria Enrichment Broth
Бульон вторичного обогащения для листерий - Fraser Secondary Enrichment Broth Base
Селективный бульон для листерий - Listeria Selective Broth Base Среды Pre-Media 403A и BiMedia 401 A, 402A, 403A
Merck 1.1 1755 BioMerieux 43559
HiMedia Ml 064 BioMerieux 43 560 HiMedia Ml 145,
FD 071
ФС (ЦНИИВС им.И.И.Мечникова, НИИ питательных сред)
3.3.2.3. Дифференциально-диагностические селективные среды PALCAM - Listeria Selective Agar Base с селективной добавкой 1.12122
PALCAM-агар - селективная среда для выделения листерий Агар для идентификации листерий - Listeria Identification Agar Base (PALCAM)
Oxford-агар - селективная среда для выделения листерий Listeria Oxford Medium Base и Oxford Listeria Supplement
HiMedia М 1215 Difco
HiMedia M073 BioMerieux
Среды Fисса с маннитом, ксилозой, рамнозой
Среда для определения подвижности листерий (Listeria motility medium)
SIM-агар (сероводород-индол-подвижность) Blood Agar Base - основа кровяного агара Тест-системы биохимические для видовой идентификации API Listeria
Допускается использование других коммерческих питательных сред и диагностических препаратов аналогичного назначения для проведения исследований в соответствии с данным документом. При их применении следует руководствоваться рекомендациями изготовителя. Питательные среды и биологические препараты импортного производства должны иметь международный сертификат качества ИСО 9000 или EN 29 000. Питательные среды и препараты отечественного производства должны вырабатываться по нормативной документации, утвержденной в установленном порядке.
По FOCT 26669 По FOCT 26669 ПоЕОСТ 10444.8-99
По FOCT 10444.1 или в соответствии с инструкцией по применению По FOCT 30425
4. Подготовка к анализу4.1. Приготовление растворов и реактивов
4.1.1. Пептонно-солевой раствор
4.1.2. Изотонический (0,85%-ный водный) раствор хлорида натрия
4.1.3. Растворы и реактивы для постановки реакции нитратредукции
4.1.4. Приготовление растворов и реактивов для окраски препаратов по Fраму
4.1.5. Раствор перекиси водорода для определения каталазы 3%-ный
84.2. Приготовление питательных сред
Среды промышленного изготовления, указанные в п. 3.3.2., готовятся согласно прописям на этикетке или в соответствии с рекомендациями фирмы.
Допускается применение сред лабораторного приготовления по п.п. 4.2.1. - 4.2.10. Приготовление питательных сред Pre-Media 403А и BiMedia 401А, 402А,403А для определения листерий проводят в соответствии с МУК 11-13-7 РБ99 «Бактериологические исследования с использованием микробиологического экспресс-анализатора «Бак Трак 4100».
4.2.1. Питательный агар с 1% глюкозы и питательный бульон с 1% глюкозы (МПА с 1% глюкозы, МПБ с 1% глюкозы) готовят в соответствии с ГОСТ 10444.1.
4.2.2. Триптоно-соевый бульон с дрожжевым экстрактом (TSYEB) / Триптон-соевый агар с дрожжевым экстрактом (TSYEA).
Состав среды (г/л): ферментативный гидролизат казеина - 17,0; пептон соевый - 3,0; натрий хлористый - 5,0; фосфат калия однозамещенный - 2,5; глюкоза - 2,5; дрожжевой экстракт - 6,0; агар микробиологический (для TSYEA) - 15,0.
Компоненты растворяют в 1 000 см3 дистилированной воды, тщательно перемешивают, устанавливают pH 7,3+0,2 и автоклавируют при 121 °С в течение 15 мин.
4.2.3. Среды селективного обогащения типа бульона Фрейзера.
Приготовление основы среды (г/л): ферментативный гидролизат казеина - 5,0; пептон -
5,0; мясной экстракт - 5,0; дрожжевой экстракт - 5,0; натрий хлористый - 20,0; калия дигидрофосфат - 1,35; натрия гидрофосфат - 12,0; эскулин - 1,0; литий хлористый - 3,0; железа аммонийного цитрат - 0,25 - растворяют в 1 000 см3 дистиллированной воды, тщательно перемешивают, устанавливают pH 7,2+0,2 и автоклавируют при 121 °С 15 мин.
Перед употреблением в основу среды вносят асептически раствор селективных компонентов следующего состава:
Для приготовления среды типа бульона Фрейзера первичного обогащения: налидиксо-вой кислоты - 10 мг, акрифлавина гидрохлорид -12,5 мг растворить в10 см3 стерильного 0,2 N гидроксида натрия.
Для приготовления среды типа бульона Фрейзера вторичного обогащения: налидиксо-вой кислоты - 20 мг, акрифлавина гидрохлорид - 25 мг растворить в 10 см3 стерильного 0,2 N гидроксида натрия. Готовые среды разливают в стерильные колбы или пробирки и хранят в защищенных от света условиях при температуре не выше 8 °С.
4.2.4. PALCAM-arap (полимиксин-акрифлавин-лития хлоридцефтазидим-эску-лин-маннитол - агар) - селективная дифференциально-диагностическая среда для выделения листерий.
Приготовление основы среды (г/л): пептон мясной ферментативный - 23,0; дрожжевой экстракт - 3,0; крахмал - 1,0; натрия хлорид - 5,0; эскулин - 0,8; лития хлорид - 15,0; железа аммония цитрат - 0,5; глюкоза - 0,5; маннит - 10,0; феноловый красный - 0,08; агар - 15,0 -растворяют в 1 000 см3 дистиллированной воды, тщательно перемешивают, устанавливают pH 7,0+0,2 и автоклавируют при 121 °С 15 мин.
К стерильной расплавленной основе среды добавляют асептически раствор селективных компонентов следующего состава: акрифлавин - 0,005; полимиксин «В» - 100 000 ед.; цефтазидим - 0,02 в 10 см3 стерильной дистиллированной воды.
Готовую среду разливают в стерильные чашки Петри и хранят в защищенных от света условиях при температуре не выше 8 °С.
4.2.5. Селективная дифференциально-диагностическая среда для выделения листерий типа Оксфорд-агара.
Приготовление основы среды (г/л): пептон мясной ферментативный - 23,0; крахмал кукурузный - 1,0; натрия хлорид - 15,0; эскулин - 1,0; лития хлорид - 15,0; железа аммония цитрат - 0,5; глюкоза - 0,5; агар - 15,0 - растворяют в 1 000 см3 дистиллированной воды, тщательно перемешивают, устанавливают pH 7,0+0,2 и автоклавируют при 121 °С 15 мин.
К стерильной расплавленной основе среды добавляют асептически раствор селективных компонентов следующего состава: акрифлавина гидрохлорид - 0,005; циклогексимид -
9
0,4; колистина сульфат1 - 0,02; цефатетан1 - 0,002; фосфомицин1 - 0,01 мг в 10 см3 50%-ного этилового спирта.
Готовую среду разливают в стерильные чашки Петри и хранят в защищенных от света условиях при температуре не выше 8 °С.
4.2.6. Кровяной агар.
К растопленному и охлажденному до 45-50 °С питательному агару с 1% глюкозы (п.
4.2.1.) добавляют 5% по объему дефибринированной крови животных. Разливают в чашки Петри диаметром 90 мм по 15 см3 среды и подсушивают при 37 °С.
Засев производят в теплые чашки.
4.2.7. Питательный агар с эритроцитами барана.
Дефибринированную или стабилизированную цитратом кровь барана центрифугируют в асептических условиях 30 мин при 900 об/мин. Надосадочную жидкость сливают. Осадок суспендируют в стерильном физиологическом растворе до первоначального объема, добавляют в количестве 5% по объему к растопленному и охлажденному до 45-50 °С питательному агару (п.4.2.1.).Разливают в чашки Петри поЮ см3,подсушивают при 37 °С. Чашки используют для посева теплые.
4.2.8. Среда для определения подвижности.
20 г гидролизата казеина ферментативного, 6 г пептона мясного ферментативного и 5 г агара растворяют в 1 000 см3 дистиллированной воды, устанавливают pH 7,3+0,2, разливают в пробирки по 5-7 см3 и автоклавируют при 121 °С 15 мин.
4.2.9. Среды Гисса по ГОСТ 10444.1. с маннитом, рамнозой, ксилозой.
10 г ферментативного пептона и 5 г натрия хлористого растворяют в 1 000 см3 дистиллированной воды и добавляют 10 г соответствующего углевода. Устанавливают pH 7,1+0,1, вносят 10 мл индикатора Андреде (возможно использование бромкрезолового пурпурного, «ВР» и др.), разливают в пробирки и стерилизуют при 112 °С в течение 20 мин.
4.2.10. Среда для определения лецитиназной активности листерий.
К среде ГРМ № 1 перед стерилизацией добавляют активированный уголь, растертый до порошкообразного состояния, до концентрации 0,5% (вес/объем). Желток куриного яйца разводят в 150 мл физиологического раствора и добавляют 5% по объему к стерилизованному и охлажденному до 40-50 °С питательному агару. Разливают в чашки Петри по 20 см3 и подсушивают при 37 °С. Аналогично готовят среду с добавлением желтка, но без добавления активированного угля.
5. Отбор и подготовка проб пищевых продуктов для анализа5.1. Общие положения по отбору и подготовке проб.
Отбор и подготовку проб продукции производят в соответствии с ГОСТ 26668-85 «Методы отбора проб для микробиологических анализов», ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов», СанПиН 42-123-4940-88 «Микробиологические нормативы и методы анализа продуктов детского, лечебного и диетического питания и их компонентов», а также в соответствии с действующими ГОСТ и НД на конкретные виды продуктов.
Масса или объем отбираемых проб должны быть достаточными для проведения исследования и минимально вдвое превышать аналитический образец. Из точечных проб составляют навеску массой 25+0,1 г (50-100 г - для продуктов детского, лечебного и специализированного питания).
От продукции в потребительской таре в мелкой фасовке пробы отбирают в количестве одной или нескольких единиц в зависимости от массы или объема потребительской тары, с тем, чтобы количество было достаточным для проведения анализа.
От продукции в транспортной или потребительской таре больших размеров или неупакованной пробы отбирают из разных мест с различной глубины, включая поверхность.
10
Для микробиологических анализов пробы отбирают до взятия проб на физикохимические и органолептические анализы стерильным инструментом в стерильную посуду. При этом от образца отбирают несколько точечных проб из разных мест, которые измельчают и перемешивают, из них составляют навеску 25 г.
Замороженные продукты предварительно размораживают до температуры внутри продукта 0 - (-1) °С; продукты, содержащие жиры (сливочное масло, мороженное) нагревают до температуры 40-45 °С и перемешивают.
Отобранные образцы перемешивают и измельчают или доводят до однородной консистенции по ГОСТ 26669, из измельченной суспензии готовят навеску необходимой массы.
При посевах высоко кислотных или щелочных (с рН<6 или >7,5) жидких и твердых продуктов для предотвращения снижения pH питательных сред на 0,5 и более, pH продукта перед посевом доводят до (7,0+0,2).
5.2. Отбор и подготовка проб молока, молочных продуктов, сыров, мороженного
Отбор и подготовку проб продуктов проводят согласно ГОСТ 3622-68 «Молоко и молочные продукты. Отбор и подготовка их к испытанию» и 9225-84 «Молоко и молочные продукты. Методы микробиологического анализа».
Кисломолочные продукты, сыр, творог, творожные изделия и пастообразные продукты тщательно измельчают с помощью гомогенизаторов перистальтического типа или ножевых и подвергают нейтрализации, масло сливочное и мороженное растапливают до сметанообразной консистенции.
5.3. Отбор и подготовка проб мяса, мясных полуфабрикатов, мяса птицы и птицепродуктов, колбасных изделий и других мясопродуктов
Отбор и подготовку проб мяса, субпродуктов, мясных полуфабрикатов, колбасных изделий и других мясных продуктов проводят по ГОСТ 21237 «Мясо. Методы бактериологического анализа», ГОСТ 4288 «Изделия кулинарные и полуфабрикаты из рубленого мяса», ГОСТ 9958, ГОСТ 9792 «Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц».
Массу навески отбирают в соответствии си. 6.1.
Отбор и подготовку проб мяса птиц, субпродуктов и птичьих полуфабрикатов проводят по ГОСТ Р 7702.0-95 «Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим исследованиям».
5.4,Отбор и подготовка проб плодоовощной продукции
Отбор и подготовку к анализу проб плодоовощной продукции проводят согласно ГОСТ 26668, ГОСТ 26669. Для анализа поверхностно-контаминированной продукции готовят суспензию добавлением к навеске массой (100+30) г, отобранной из трех единиц тары или фасовки, 0,1%-ного пептонно-солевого раствора в количестве, равном массе навески. При этом 1 см3 полученной суспензии оценивают как 1 г (см3) продукта.
Из измельченных плодов, овощей, полуфабрикатов и пюреобразных и жидких отбирают раздельно навески массой по (100+30) г из трех единиц тары или фасовки и готовят объединенную пробу массой в соответствии си. 6.1.
5.5,Отбор и подготовка проб рыбы, нерыбных объектов промысла и продуктов, вырабатываемых из них
Отбор и подготовку проб проводят согласно «Инструкции по санитарномикробиологическому контролю производства пищевой продукции из рыбы и морских беспозвоночных» № 5319-91 от 22.02.91 и ГОСТ 7631-85 «Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний».
Отбор проб свежей, охлажденной и мороженой рыбы проводят от 2 точечных образцов, мышечная ткань в которых составляет не менее 25 г по ГОСТ 7631-85. Из каждой точечной пробы стерильным инструментом вырезают спинные мышцы с кожей, перемешивают и отвешивают 25 г, затем измельчают с помощью гомогенизаторов перистальтического типа или ножевых и гомогенизируют в 225 см3 среды накопления.
1
допускается замена комплекса перечисленных антибиотиков на полимиксин в количестве 500 000 ед/л.