ГОСТ Р МЭК 60601-2-24-2017
Изделия медицинские электрические. Часть 2-24. Частные требования безопасности с учетом основных функциональных характеристик к насосам и контроллерам инфузионным
Купить ГОСТ Р МЭК 60601-2-24-2017 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на ОБЩИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ С УЧЕТОМ ОСНОВНЫХ ФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК к инфузионным насосам и волюметрическим инфузионным контроллерам, в дальнейшем именуемым как «ME ИЗДЕЛИЯ». Стандарт распространяется на ИНФУЗИОННЫЕ МАГИСТРАЛИ, если их характеристики влияют на ОБЩИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ С УЧЕТОМ ОСНОВНЫХ ФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК к ИНФУЗИОННЫМ НАСОСАМ и ВОЛЮМЕТРИЧЕСКИМ ИНФУЗИОННЫМ КОНТРОЛЛЕРАМ. Однако стандарт не устанавливает требования или методы испытаний к другим аспектам, связанным с ИНФУЗИОННЫМИ МАГИСТРАЛЯМИ. Если какой-либо пункт или подпункт стандарта применим исключительно к ME ИЗДЕЛИЮ или же исключительно к ME СИСТЕМАМ, то об этом будут свидетельствовать название и содержание этого пункта или подпункта, в противном случае данный пункт или подпункт применим и к ME ИЗДЕЛИЮ, и к ME СИСТЕМАМ. ОПАСНОСТИ, связанные с физиологическими эффектами, вызванными воздействием ME ИЗДЕЛИЯ или ME СИСТЕМЫ, не рассматриваются в настоящем стандарте, за исключением 7.2.13 и 8.4.1 общего стандарта. Стандарт может также применяться к НАСОСАМ ДЛЯ ЭНТЕРАЛЬНОГО ПИТАНИЯ, ИНФУЗИОННЫМ НАСОСАМ, ИНФУЗИОННЫМ НАСОСАМ ДЛЯ АМБУЛАТОРНОГО ИСПОЛЬЗОВАНИЯ, ШПРИЦЕВЫМ или КОНТЕЙНЕРНЫМ НАСОСАМ, ВОЛЮМЕТРИЧЕСКИМ ИНФУЗИОННЫМ КОНТРОЛЛЕРАМ и ВОЛЮМЕТРИЧЕСКИМ ИНФУЗИОННЫМ НАСОСАМ, которые определены в 201.3.204, 201.3.206, 201.3.207, 201.3.220, 201.3.222 и 201.3.223.
Идентичен IEC 60601-2-24(2012)
Оглавление
201.1 Область распространения, цель и дополнительные стандарты
201.2 Нормативные ссылки
201.3 Термины и определения
201.4 Общие требования
201.5 Общие требования к испытаниям МЕ ИЗДЕЛИЯ
201.6 Классификация МЕ ИЗДЕЛИЙ и МЕ СИСТЕМ
201.7 Идентификация, маркировка и документация МЕ ИЗДЕЛИЙ
201.8 Защита от ОПАСНОСТЕЙ поражения электрическим током от МЕ ИЗДЕЛИЯ
201.9 Защита от МЕХАНИЧЕСКИХ ОПАСНОСТЕЙ, создаваемых МЕ ИЗДЕЛИЯМИ и МЕ СИСТЕМАМИ
201.10 Защита от ОПАСНОСТЕЙ воздействия нежелательного или чрезмерного излучения
201.11 Защита от чрезмерных температур и других ОПАСНОСТЕЙ
201.12* Точность органов управления и измерительных приборов и защита от опасных значений выходных характеристик
201.13 ОПАСНЫЕ СИТУАЦИИ и условия нарушения
201.14 ПРОГРАММИРУЕМЫЕ ЭЛЕКТРИЧЕСКИЕ МЕДИЦИНСКИЕ СИСТЕМЫ (PEMS)
201.15 Конструкция МЕ ИЗДЕЛИЯ
201.16 МЕ СИСТЕМЫ
201.17 Электромагнитная совместимость МЕ ИЗДЕЛИЙ и МЕ СИСТЕМ
202 Электромагнитная совместимость. Требования и испытания
206 Эксплуатационная пригодность
208 Общие требования, испытания и руководящие указания по применению систем сигнализации медицинских электрических изделий и медицинских электрических систем
Приложения
Приложение АА (справочное) Руководство и объяснения к специальным подпунктам
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным и межгосударственным стандартам
Библиография
Указатель определений терминов, применяемых в настоящем стандарте
| Дата введения | 01.07.2018 |
|---|---|
| Добавлен в базу | 01.01.2018 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 29.08.2017 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 974-ст |
|---|---|---|---|
| Разработан | ООО НТЦ МЕДИТЭКС | ||
| Издан | Стандартинформ | 2017 г. |
Medical electrical equipment. Part 2-24. Particular requirements for the basic safety and essential performance of infusion pumps and controllers
- ГОСТ Р 52501-2005 Вода для лабораторного анализа. Технические условия
- ГОСТ ISO 7864-2011 Иглы инъекционные однократного применения стерильные
- ГОСТ Р МЭК 60601-1-2-2014 Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания
- ГОСТ Р МЭК 60601-1-6-2014 Изделия медицинские электрические. Часть 1-6. Общие требования безопасности с учетом основных функциональных характеристик. Дополнительный стандарт. Эксплуатационная пригодность
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17
стр. 18
стр. 19
стр. 20
стр. 21
стр. 22

стр. 23

стр. 24
стр. 25
стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
|
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ |
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСТРМЭК 60601-2-24— 2017ИЗДЕЛИЯ МЕДИЦИНСКИЕ ЭЛЕКТРИЧЕСКИЕ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ЭЛЕКТРИЧЕСКИЕ
Часть 2-24
Частные требования безопасности с учетом основных функциональных характеристик к насосам и контроллерам инфузионным
(IEC 60601-2-24:2012, ЮТ)
Издание официальное
Москва
Стандартинформ
2017
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Научно-технический центр «МЕДИТЭКС» (ООО «НТЦ «МЕДИТЭКС») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 011 «Медицинские приборы, аппараты и оборудование»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 29 августа 2017 г. № 974-ст
4 Настоящий стандарт идентичен международному стандарту МЭК 60601-2-24:2012 «Изделия медицинские электрические. Часть 2-24. Частные требования безопасности с учетом основных функциональных характеристик к насосам и контроллерам инфузионным» (IEC 60601-2-24:2012 «Medical electrical equipment — Part 2-24: Particular requirements for the basic safety and essential performance of infusion pumps and controllers». IDT).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные и межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N9 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены наспюящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
©Стандартинформ. 2017
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
креплена или нанесена на видном месте ME ИЗДЕЛИЯ, чтобы или обозначить эти условия, или указать место расположения данной информации.
Соответствие проверяют осмотром
201.7.9.2 Инструкция по эксплуатации
Дополнительный подпункт:
201.7.9.2.101 Дополнительные инструкции по эксплуатации
Инструкция по эксплуатации должна также включать следующую информацию:
- ПРЕДУСМОТРЕННОЕ ПРИМЕНЕНИЕ, включая условия эксплуатации;
- предупреждения о последствиях применения неподходящих ИНФУЗИОННЫХ МАГИСТРАЛЕЙ;
- допустимые способы ориентирования ME ИЗДЕЛИЯ и методы и меры предосторожности при его установке, например, если это применимо, устойчивость при креплении к стойке;
- * инструкции по поддержанию эксплуатационных характеристик, касающиеся ИНТЕРВАЛА ЗАМЕНЫ ИНФУЗИОННОЙ МАГИСТРАЛИ;
- инструкции, касающиеся использования зажимов на ИНФУЗИОННЫЕ МАГИСТРАЛИ для исключения условий возникновения СВОБОДНОГО ПОТОКА и поддержания установленного порядка при смене контейнеров с жидкостью;
- при необходимости учитывать воздействие силы тяжести указывается допустимый диапазон высот расположения контейнера с жидкостью над ПАЦИЕНТОМ и/или насосом;
- меры предосторожности для защиты ПАЦИЕНТА от попадания воздуха при инфузии;
- сведения о МАКСИМАЛЬНОМ ДАВЛЕНИИ ИНФУЗИИ, обеспечиваемом ME ИЗДЕЛИЕМ;
- сведения о ПОРОГЕ ДАВЛЕНИЯ ОККЛЮЗИИ ME ИЗДЕЛИЯ;
- сведения о максимальном времени активации тревожной сигнализации при окклюзии, когда ME ИЗДЕЛИЕ работает на МИНИМАЛЬНОЙ СКОРОСТИ. СРЕДНЕЙ СКОРОСТИ и МИНИМАЛЬНО ВОЗМОЖНОЙ СКОРОСТИ и при установленных минимально и максимально возможных ПОРОГАХ ДАВЛЕНИЯ ОККЛЮЗИИ (см. 201.12.4.4.104). Если применимо. ИЗГОТОВИТЕЛЬ также должен указывать сведения о возникающих с течением времени эффектах нагрева и изменения длины ИНФУЗИОННОЙ МАГИСТРАЛИ;
- сведения о величине НЕПРЕДНАМЕРЕННОГО БОЛЮСА на СРЕДНЕЙ СКОРОСТИ при установке минимального и максимального ПОРОГА ДАВЛЕНИЯ ОККЛЮЗИИ (см. также 201.12.4 4.104);
- указания о действиях в случае возникновения НЕПРЕДНАМЕРЕННОГО БОЛЮСА перед снятием окклюзии;
- меры предосторожности в отношении датчиков капель, например в отношении их установки, чистоты, уровня жидкости, общей освещенности;
- * среднее время работы ME ИЗДЕЛИЯ от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ на СРЕДНЕЙ СКОРОСТИ, а для ВОЛЮМЕТРИЧЕСКИХ ИНФУЗИОННЫХ НАСОСОВ и ВОЛЮМЕТРИЧЕСКИХ ИНФУЗИОННЫХ КОНТРОЛЛЕРОВ также на МАКСИМАЛЬНО ВОЗМОЖНОЙ СКОРОСТИ от новой и полностью заряженной батареи;
- сведения о СКОРОСТИ В РЕЖИМЕ ОТКРЫТОЙ ВЕНЫ и о том. когда срабатывает данный режим;
- перечень тревожных сигналов и условий их возникновения;
- * если применимо, предупреждение, что при определенных условиях заявленная погрешность не может быть обеспечена, и описание этих условий;
- * ссылка на перечень ОПАСНОСТЕЙ, связанных с подсоединением других инфузионных систем или ПРИНАДЛЕЖНОСТЕЙ к ЛИНИИ ПАЦИЕНТА;
- скорость, достигаемая при заправке/очистке магистрали или в режиме БОЛЮСА, а также сообщения об отключенной сигнализации;
- диапазон и шаг установки скорости инфузии;
- если применимо, руководство по проверке ОПЕРАТОРОМ правильного функционирования системы сигнализации и эксплуатационной безопасности ME ИЗДЕЛИЯ;
- информация, полученная в результате испытаний по подпунктам с 201.12.1.102 по 201.12.1.109 при скоростях, указанных в таблице 201.102. включая пояснения для ОПЕРАТОРА по представленным данным;
- * максимальный объем жидкости, который может быть введен в УСЛОВИЯХ ЕДИНИЧНОГО НАРУШЕНИЯ;
- список разрешенных к применению ИНФУЗИОННЫХ МАГИСТРАЛЕЙ с их установленными погрешностями в соответствии с методами испытаний, указанными в 201.12.1;
7
- если переход между разрешенными к применению ИНФУЗИОННЫМИ МАГИСТРАЛЯМИ может привести к недопустимому РИСКУ при отсутствии изменений в ME ИЗДЕЛИИ, должно быть приведено указание о порядке действий для обеспечения заявленной погрешности;
- диапазон скоростей инфузии и условия (например, температура), при которых обеспечивается заявленная допустимая погрешность;
- список ПРИНАДЛЕЖНОСТЕЙ (например, датчик капель) для ME ИЗДЕЛИЯ, которые необходимы для обеспечения безопасного использования и допустимой погрешности, определенной в соответствии с методами испытаний по 201.12.1;
- если применимо, описание работы ME ИЗДЕЛИЯ при потере связи с пультом дистанционного управления.
Примечание — Если ME ИЗДЕЛИЕ является частью ME СИСТЕМЫ, то описание может быть частью инструкции по эксплуатации ME СИСТЕМЫ;
- * для ПРОФИЛИРУЕМЫХ НАСОСОВ — запрограммированная последовательность скоростей введения.
201.7.9.3 Техническое описание Допопнитепьный подпункт:
201.7.9.3.101 Дополнительное техническое описание Техническое описание должно включать следующую информацию:
- * чувствительность датчика воздуха, если он входит в комплектацию в целях обеспечения соответствия требованиям, для одиночного пузырька воздуха в указанном диапазоне номинальных скоростей. Для ИНФУЗИОННЫХ НАСОСОВ ДЛЯ АМБУЛАТОРНОГО ИСПОЛЬЗОВАНИЯ, применяемых для введения инсулина, чувствительность детектора воздуха может быть выражена, например, в терминах максимальной недостаточной инфузии до срабатывания датчика воздуха (или аналогичного устройства) при включенной функции обнаружения воздуха;
- если применимо, процесс калибровки ME ИЗДЕЛИЯ;
- описание любой системы зарядки аккумуляторных батарей;
- функциональное описание средств, предназначенных для защиты ПАЦИЕНТА от избыточной инфузии и, если применимо, от недостаточной инфузии в результате сбоя ME ИЗДЕЛИЯ или частичного или полного перекрытия ИНФУЗИОННОЙ МАГИСТРАЛИ;
- ИЗГОТОВИТЕЛЬ должен приводить сведения, позволяющие идентифицировать ИНФУЗИОННЫЕ МАГИСТРАЛИ, использованные в ходе всех испытаний по методикам настоящего стандарта;
- если в ME ИЗДЕЛИИ скорость не может быть запрограммирована и отображена в единицах объема за единицу времени, то должна быть приведена формула для пересчета скорости в единицы объема за единицу времени.
Соответствие проверяют рассмотрением технического описания.
201.8 Защита от ОПАСНОСТЕЙ поражения электрическим током от ME ИЗДЕЛИЯ
Применяют раздел 8 общего стандарта, за исключением следующего:
201.8.3 Классификация РАБОЧИХ ЧАСТЕЙ
Дополнительный подпункт:
201.8.3.101 Дополнительные требования к классификации РАБОЧИХ ЧАСТЕЙ
Тип РАБОЧИХ ЧАСТЕЙ ИНФУЗИОННЫХ НАСОСОВ должен классифицироваться как BF или CF. Соответствие проверяют осмотром
201.9 Защита от МЕХАНИЧЕСКИХ ОПАСНОСТЕЙ, создаваемых ME ИЗДЕЛИЯМИ и ME СИСТЕМАМИ
Применяют раздел 9 общего стандарта.
201.10 Защита от ОПАСНОСТЕЙ воздействия нежелательного или чрезмерного излучения
Применяют раздел 10 общего стандарта.
8
201.11 Защита от чрезмерных температур и других ОПАСНОСТЕЙ
Применяют раздел 11 общего стандарта, за исключением следующего:
201.11.6.3 * Расплескивание жидкостей на ME ИЗДЕЛИЕ или ME СИСТЕМУ
Замена:
ME ИЗДЕЛИЕ и ME СИСТЕМА, требующие работы С жидкостями при НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ. должны иметь такую конструкцию, чтобы расплескивание жидкости на устройство не приводило к увлажнению таких частей, в результате повреждения которых могла бы возникнуть ОПАСНАЯ СИТУАЦИЯ.
Соответствие проверякмп с помощью испытания согласно МЭК 60529 на стандарт защиты IPX1 или лучше:
после данных ПРОЦЕДУР проводят испытания на электрическую прочность изоляции и ТОК УТЕЧКИ, а также проверяют отсутствие признаков увлажнения неизолированных электрических частей или электрической изоляции частей, что могло бы привести к ОПАСНОЙ СИТУАЦИИ.
201.11 6.5 Проникание воды или твердых частиц в ME ИЗДЕЛИЯ и ME СИСТЕМЫ
Дополнение:
Крышки и другие части, например крышки батарейных отсеков, которые могут сниматься без применения специального ИНСТРУМЕНТА, должны быть установлены на места при проведении испытания. Там. где ИЗГОТОВИТЕЛЬ указывает чехлы в составе защиты от попадания жидкости, испытания ME ИЗДЕЛИЯ проводят в чехле. Если нет подобных указаний, то чехол снимают до начала испытаний.
ME ИЗДЕЛИЕ должно быть пригодным к условиям эксплуатации и стандарту защиты не хуже IPX2.
Замена указаний о соответствии:
После данных ПРОЦЕДУР проводят визуальный осмотр, по результатам которого в ME ИЗДЕЛИИ не должно быть выявлено никаких признаков замыкания изоляции (или электронных компонентов). что могло бы приводить к возникновению ОПАСНОЙ СИТУАЦИИ в НОРМАЛЬНОМ СОСТОЯНИИ или при УСЛОВИИ ЕДИНИЧНОГО НАРУШЕНИЯ, а затем проводят испытания на электрическую прочность изоляции и ТОК УТЕЧКИ
Соответствие проверяют осмотром и с помощью испытаний согласно МЭК 60529. Необходимо убедиться, что сохранены ОСНОВНАЯ БЕЗОПАСНОСТЬ и ОСНОВНЫЕ ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ.
201.11.8 Прерывание питания/ПИТАЮЩЕЙ СЕТИ ME ИЗДЕЛИЯ
Дополнение:
Дополнительные подпункты:
201.11 8.101 ТЕХНИЧЕСКОЕ УСЛОВИЕ ВОЗНИКНОВЕНИЯ СИГНАЛА ОПАСНОСТИ при прерывании литания/ПИТАЮЩЕЙ СЕТИ
201.11 8.101.1 ТЕХНИЧЕСКОЕ УСЛОВИЕ ВОЗНИКНОВЕНИЯ СИГНАЛА ОПАСНОСТИ при отключении от ПИТАЮЩЕЙ СЕТИ
ME ИЗДЕЛИЕ, работающее только от ПИТАЮЩЕЙ СЕТИ, в условиях возникновения при эксплуатации случайного отключения или сбоя ПИТАЮЩЕЙ СЕТИ должно выдавать СИГНАЛ ОПАСНОСТИ НИЗКОГО ПРИОРИТЕТА. В этой ситуации СИГНАЛ ОПАСНОСТИ должен работать в течение не менее 3 мин или до восстановления питания, если оно происходит быстрее.
Примечание — ME ИЗДЕЛИЕ может остановить инфузию
Соответствие проверяют осмотром и функциональными испытаниями.
201.11 8 101.2 ТЕХНИЧЕСКОЕ УСЛОВИЕ ВОЗНИКНОВЕНИЯ СИГНАЛА ОПАСНОСТИ при истощении ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ
ME ИЗДЕЛИЕ, использующее ВНУТРЕННИЙ ИСТОЧНИК ПИТАНИЯ в качестве основного или резервного источника питания, должно выдавать СИГНАЛ ОПАСНОСТИ НИЗКОГО ПРИОРИТЕТА не менее чем за 30 мин до прекращения работы вследствие разрядки батареи.
Требование наличия визуальной индикации СИГНАЛА ОПАСНОСТИ не распространяется на ИНФУЗИОННЫЙ НАСОС ДЛЯ АМБУЛАТОРНОГО ИСПОЛЬЗОВАНИЯ, например С инсулином.
Соответствие проверяют осмотром и функциональными испытаниями ME ИЗДЕЛИЯ с новой полностью заряженной батареей, работающего на СРЕДНЕЙ СКОРОСТИ.
Если одновременно происходит прекращение питания от ПИТАЮЩЕЙ СЕТИ и ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ, то ME ИЗДЕЛИЕ должно выдавать СИГНАЛ ОПАСНОСТИ ВЫСОКОГО ПРИОРИТЕТА и останавливать работу. Сигнал тревоги должен работать не менее 3 мин.
9
Данное требование не распространяется на ИНФУЗИОННЫЙ НАСОС ДЛЯ АМБУЛАТОРНОГО ИСПОЛЬЗОВАНИЯ. например с инсулином.
Соответствие проверяют осмотром и функциональными испытаниями.
201.12 * Точность органов управления и измерительных приборов и защита от опасных значений выходных характеристик
Применяют раздел 12 общего стандарта, за исключением следующего:
201.12.1 Точность органов управления и измерительных приборов
Дополнительные подпункты:
201.12.1.101 *Общее правило
ME ИЗДЕЛИЕ должно работать с погрешностью, заявленной ИЗГОТОВИТЕЛЕМ или меньшей, в течение всего рекомендованного ИНТЕРВАЛА ЗАМЕНЫ ИНФУЗИОННОЙ МАГИСТРАЛИ
Соответствие погрешности работы ME ИЗДЕЛИЯ заявленному типу и данным ИЗГОТОВИТЕЛЯ проверяют с использованием методов испытаний, приведенных в подпунктах с 201.12.1.102 по 201.12.1.108. Если ME ИЗДЕЛИЕ не попадает ни в одну из описанных категорий, то используют методы испытаний, приведенные в подпунктах с 201.12.1.102 по 201.12.1.108.
номинальная скорость г объемная скорость потока БОЛЮС
интервал выборки S
тестовый период Т аналитический период 70 аналитический период Г, аналитический период Т2 аналитический период Тх W
Щ
Wi
W*
А
В
Р
Ер( max)
Ep(m in)
последовательность впрысков
цикл впрыскивания / плотность d
Определения терминов и величин, приведенных в подпунктах с 201.12.1.102 по 201.12.1.108:
заданная ОПЕРАТОРОМ скорость введения; измеренный на выходе объем жидкости в единицу времени; дискретное количество жидкости, вводимое за короткий промежуток времени во время инфузии (не во время заполнения магистрали); время между последовательными измерениями массы или числа капель;
полное время проведения испытания от начала до конца; определяется как первые 2 ч периода испытаний; определяется как 2-й час периода испытаний; определяется как последний час периода испытаний; аналитический период, определенный как Т0, 7, или Т2; полная масса;
/-й замер массы в течение определенного аналитического периода; замер массы в конце определенного аналитического периода или периода испытаний;
замер массы в начале определенного аналитического периода; общая средняя относительная погрешность объемной скорости потока. измеренная в течение аналитического периода 7,; общая средняя относительная погрешность объемной скорости потока. измеренная в течение аналитического периода 72; длительность окна наблюдения;
максимальная измеренная погрешность объемной скорости потока в течение определенной длительности окна наблюдения; минимальная измеренная погрешность объемной скорости потока в течение определенной длительности окна наблюдения; последовательность ввода БОЛЮСОВ, которая может происходить с регулярными или нерегулярными интервалами; минимальное время между последовательными впрысками или сериями впрысков (от начала 1-й серии впрысков до начала 2-й серии); плотность воды (0.998 г/мл при температуре 20 °С).
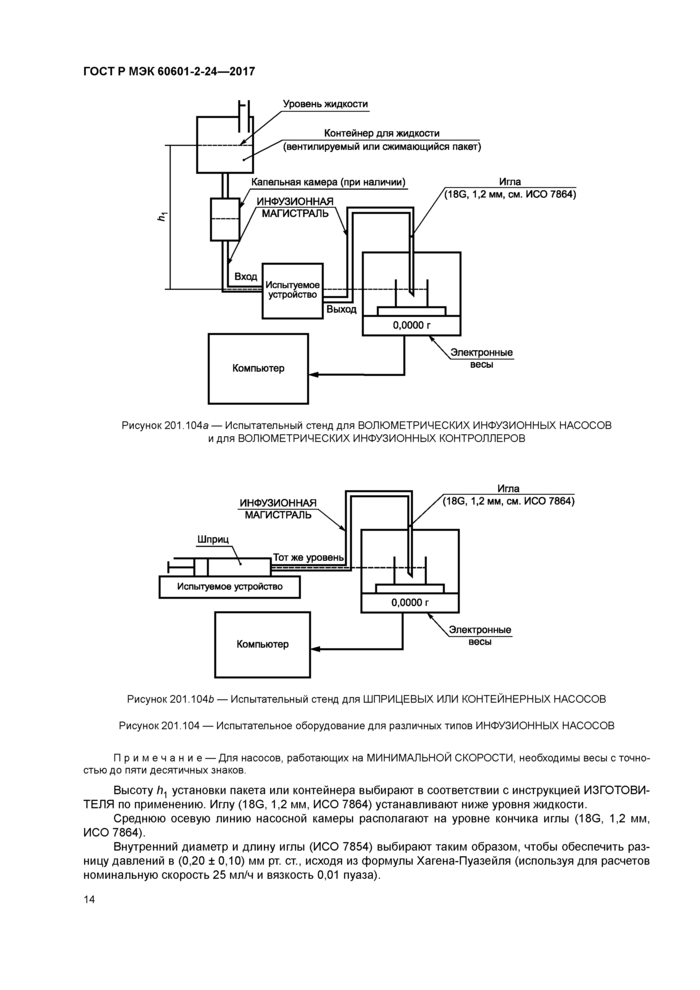
201.12.1.102 * Испытания с целью определения погрешности ВОЛЮМЕТРИЧЕСКИХ ИНФУЗИОННЫХ КОНТРОЛЛЕРОВ. ВОЛЮМЕТРИЧЕСКИХ ИНФУЗИОННЫХ НАСОСОВ и ШПРИЦЕВЫХ ИЛИ КОНТЕЙНЕРНЫХ НАСОСОВ
Используют испытательные стенды, показанные на рисунках 201.104а и 201.1040. Испытания проводят с использованием растворов, соответствующих классу III по ИСО 3696:1987. и с установкой не использованной ранее ИНФУЗИОННОЙ МАГИСТРАЛИ. ME ИЗДЕЛИЕ устанавливают на испытательный стенд в соответствии с инструкцией по эксплуатации, предоставленной ИЗГОТОВИТЕЛЕМ.
Если в рабочем цикле ME ИЗДЕЛИЯ есть период с неактивным (отсутствующим) потоком, то этот период также включают в испытания.
Устанавливают требуемую номинальную скорость согласно таблице 201.102. Устанавливают интервал выборки S. Начинают тестовый период одновременно с запуском ME ИЗДЕЛИЯ
Определяют период испытаний Т. Этот период испытаний должен равняться рекомендованному ИНТЕРВАЛУ ЗАМЕНЫ ИНФУЗИОННОЙ МАГИСТРАЛИ, если в контейнере достаточно жидкости. В противном случае период испытаний рассчитывают, разделив полный объем жидкости на номинальную скорость ее введения. Обеспечивают работу ME ИЗДЕЛИЯ в течение тестового периода Т.
Для ВОЛЮМЕТРИЧЕСКИХ ИНФУЗИОННЫХ НАСОСОВ и ШПРИЦЕВЫХ ИЛИ КОНТЕЙНЕРНЫХ НАСОСОВ повторяют испытания на СРЕДНЕЙ СКОРОСТИ в течение 120 мин при противодавлениях ± 13,33 кПа (± 100 мм рт. ст.).
Для ВОЛЮМЕТРИЧЕСКИХ ИНФУЗИОННЫХ КОНТРОЛЛЕРОВ повторяют испытания на СРЕДНЕЙ СКОРОСТИ в течение 120 мин при противодавлении минус 13,33 кПа (минус 100 мм рт. ст.).
Если применимо, ИЗГОТОВИТЕЛЬ должен предоставить информацию о максимальном отклонении результатов в нормальных условиях работы и в условиях противодавления.
Для ВОЛЮМЕТРИЧЕСКИХ ИНФУЗИОННЫХ НАСОСОВ повторяют испытания в течение 120 мин с установкой контейнера ниже насоса на расстоянии 0,5 м с использованием той же ИНФУЗИОННОЙ МАГИСТРАЛИ.
Если применимо. ИЗГОТОВИТЕЛЬ должен предоставить информацию о максимальном отклонении результатов в нормальных условиях работы и при условии установки контейнера ниже насоса.
Если ME ИЗДЕЛИЕ обладает функцией введения БОЛЮСА, то проводят испытания, указанные в 201.12.1.106.
Если испытания по 201.12.1.102 не могут быть проведены из-за особенностей конструкции ME ИЗДЕЛИЯ, проводят наиболее подходящие испытания из подпунктов с 201.12.1.103 по 201.12.1.108.
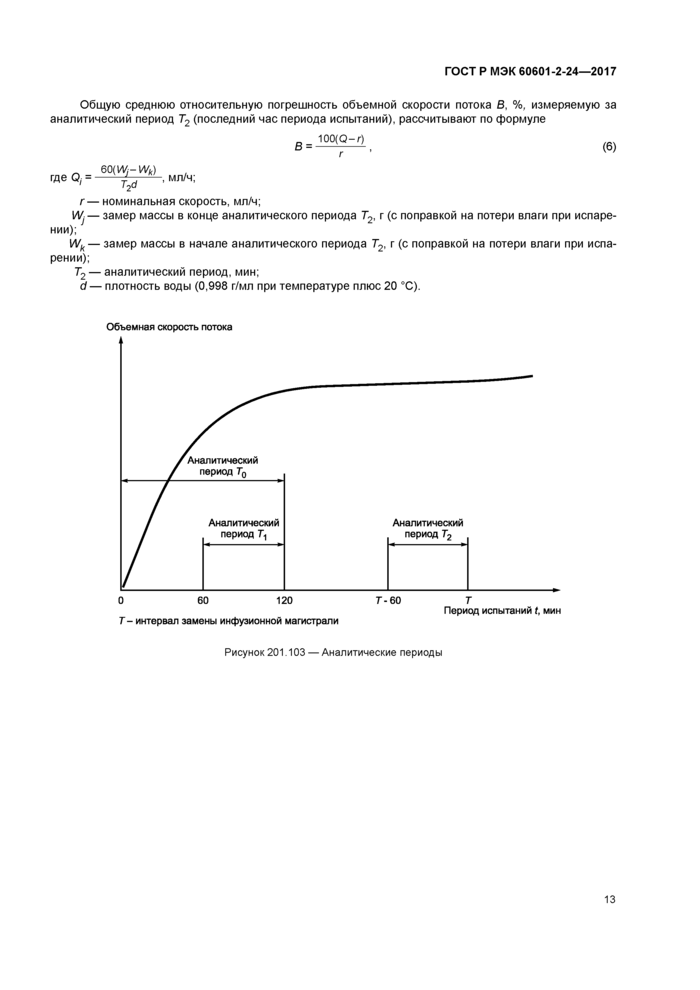
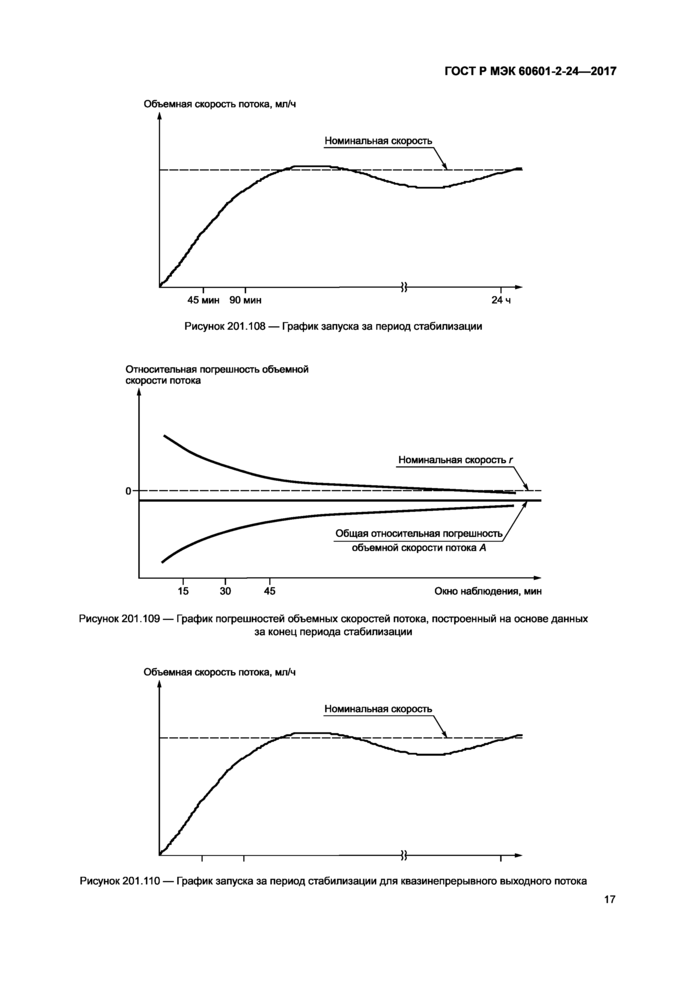
По формуле (1) рассчитывают фактическую объемную скорость потока О, для каждого интервала выборки за аналитический период Г0. мин (см. рисунок 201.103).
По формулам (3) и (4) рассчитывают Ер(тах) и Ep(min) для окон наблюдения длительностью 2. 5. 11. 19 и 31 мин за аналитический период Tv мин. в течение 2-го часа периода испытаний.
Также по формулам (3) и (4). за исключением ШПРИЦЕВЫХ ИЛИ КОНТЕЙНЕРНЫХ НАСОСОВ, рассчитывают ЕЛ max) и Ep(min) для окон наблюдения длительностью 2. 5, 11,19 и 31 мин за аналитический период 7^, мин, в течение последнего часа периода испытаний.
Строят приведенные ниже графики, используя линейные шкалы в указанных далее масштабах (см. обоснование), где г— это установленная номинальная скорость инфузии (см. рисунки АА.3.1 и АА.3.3).
График запуска строят с учетом следующего масштаба:
- максимум шкалы объемной скорости потока = 2г,
- минимум шкалы объемной скорости потока = —0,2г,
- цена деления шкалы объемной скорости потока = 0,2г,
- шкала времени от 0 до 120 мин (десятиминутные интервалы).
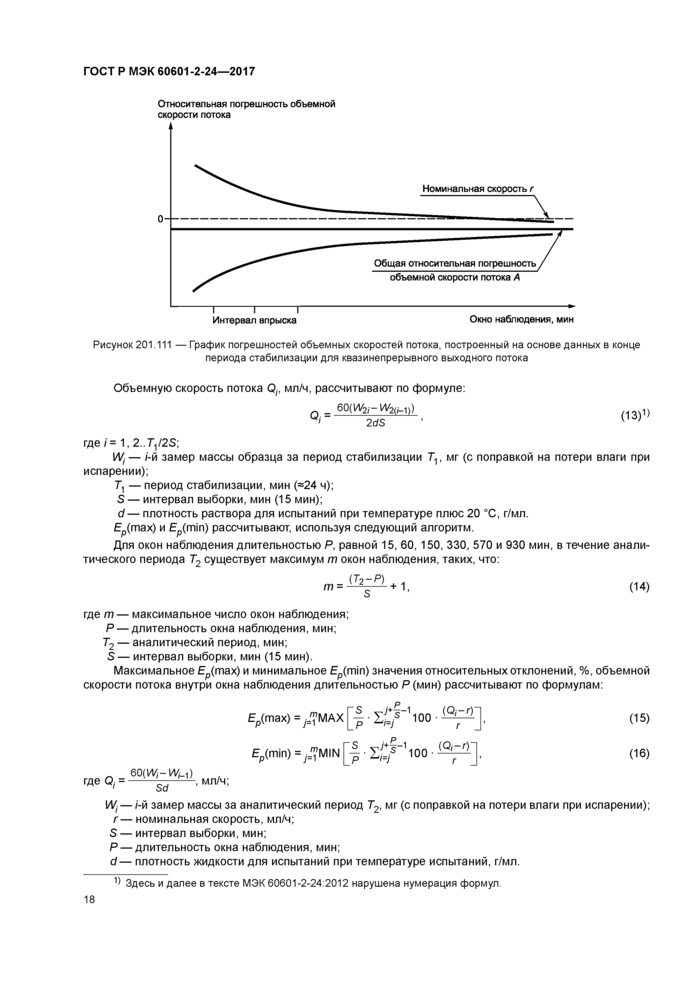
График погрешностей объемных скоростей потока строят с учетом следующего масштаба:
- максимум шкалы объемной скорости потока = 15 %;
- минимум шкалы объемной скорости потока = —15 %;
- цена деления шкалы объемной скорости потока = 5 %:
- шкала времени от 0 до 31 мин (одноминутные интервалы).
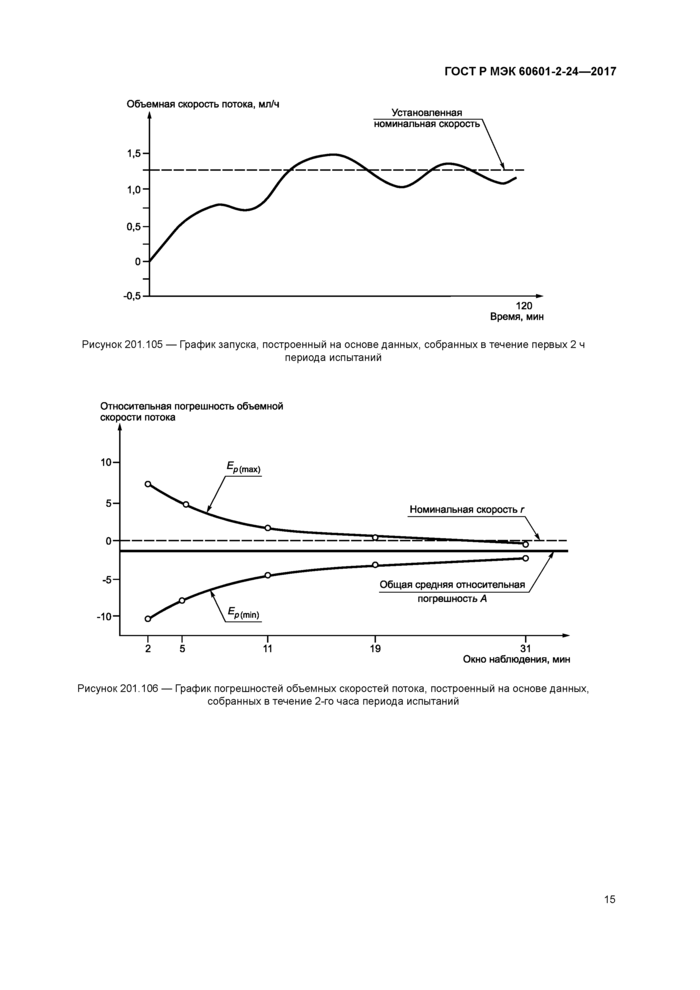
Строят график объемной скорости потока Q,, мл/ч. в зависимости от времени Tq. мин, за первые 2 ч периода испытаний (см. пример на рисунке 201.105). Номинальную скорость отмечают пунктирной линией. Объемную скорость потока Q, отмечают сплошной линией.
Строят график относительных отклонений Ер(тах) и Ep(min) и рассчитанной по формуле (5) общей средней относительной погрешности А в зависимости от длительности Р. мин. окна наблюдения, измеренных за аналитический период Т,. мин. в течение 2-го часа периода испытания. Пример графика приведен на рисунке 201.106.
11
Относительные отклонения £р(тах) и Ep(min) и общую среднюю относительную погрешность А отмечают сплошной линией. Нулевую погрешность отмечают пунктирной линией.
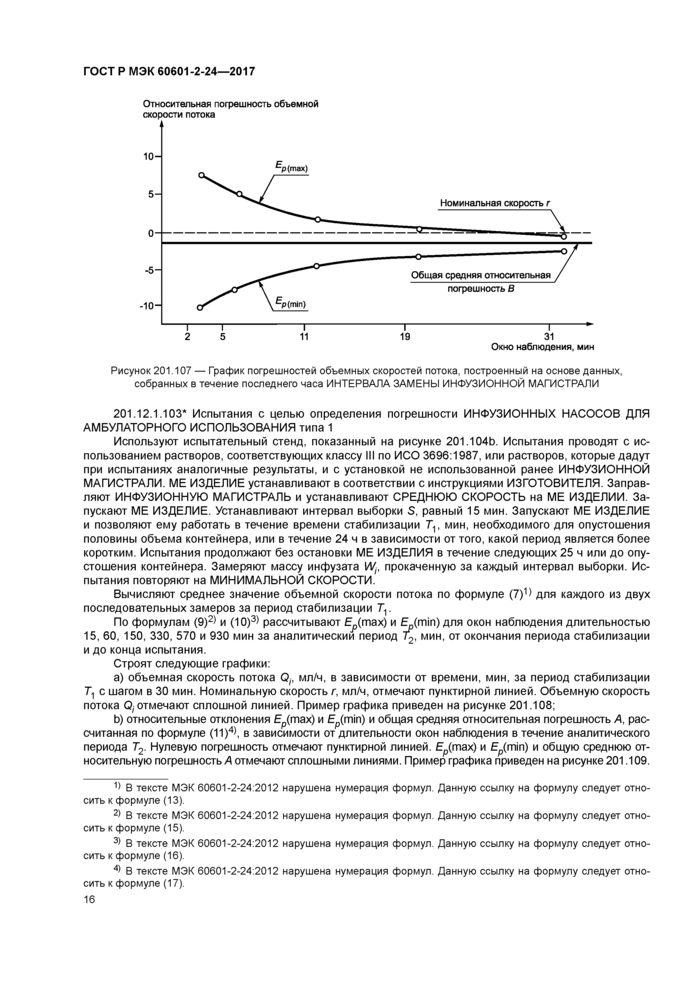
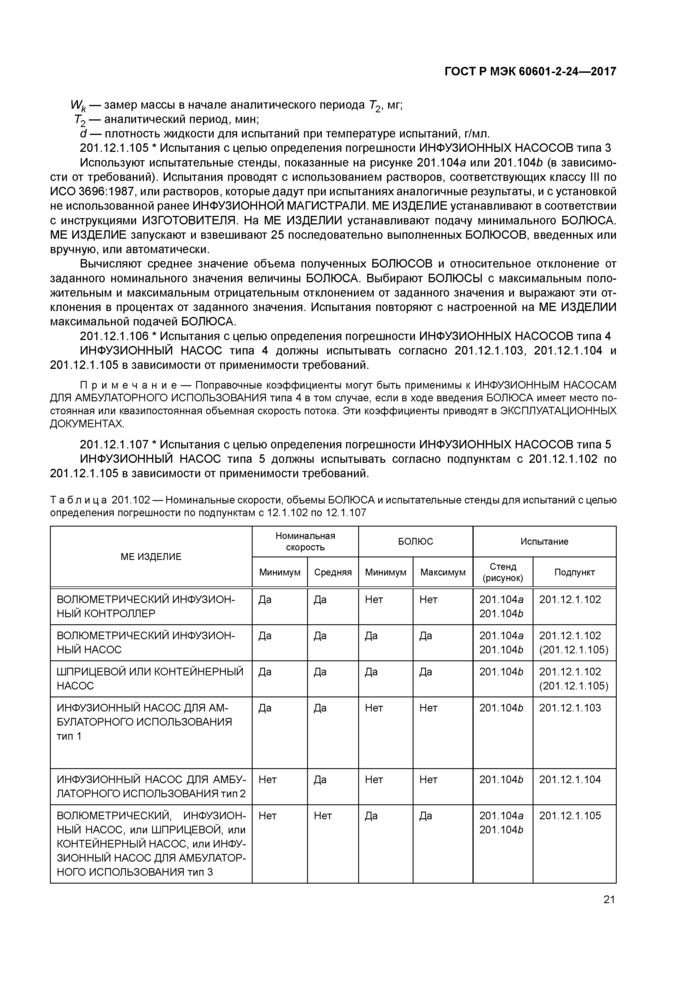
Строят график относительных отклонений £р(тах) и £p(min) и рассчитанной по формуле (6) общей средней относительной погрешности В в зависимости от длительности Р. мин. окна наблюдения, измеренных за аналитический период Т2, мин. в течение последнего часа периода испытания. Пример графика приведен на рисунке 201.107.
Относительные отклонения Ер(тах) и £p(min) и общую среднюю относительную погрешность В отмечают сплошной линией. Нулевую погрешность отмечают пунктирной линией. Этот график не применим для ШПРИЦЕВЫХ или КОНТЕЙНЕРНЫХ НАСОСОВ
Объемную скорость потока О,, мл/ч, рассчитывают, используя следующее выражение:
_ 60(W,-Wm) Sd
(1)
где /' = 1.2.. Tq/S-,
— /-й замер массы образца за аналитический период Г0. г (с поправкой на потери влаги при испарении);
Т0 — аналитический период, мин;
S — интервал выборки, мин;
d— плотность воды (0,998 г/мл при температуре плюс 20 еС).
Ер(тах) и Ep(min) рассчитывают, используя следующий алгоритм.
Для окон наблюдения длительностью Р. равной 2. 5. 11. 19 и 31 мин. в течение аналитического периода Тх существует максимум m окон наблюдения, таких, что:
где m — максимальное число окон наблюдения;
Р — длительность окна наблюдения;
S — интервал выборки, мин;
Тх — аналитический период, мин.
Максимальное £р(тах) и минимальное £p(min) значения относительных отклонений. %, объемной скорости потока внутри окна наблюдения длительностью Р. мин. рассчитывают по формулам:
где Qt
Sd
. мл/ч;
Ep(max) =;=7МАХ • I^IOO
£p(min) = ,=7MIN [- • 100
(3)
(4)
W, — /-й замер массы за аналитический период Тх, г (с поправкой на потери влаги при испарении); г— номинальная скорость, мл/ч;
S — интервал выборки, мин;
Р—длительность окна наблюдения, мин;
d— плотность воды (0.998 г/мл при температуре плюс 20 °С).
Общую среднюю относительную погрешность объемной скорости потока А. %. измеряемую за аналитический период Г, (2-й час периода испытаний), рассчитывают по формуле
А _ 100(Q-г) г
(5)
л 60№-Wk)
где О =-±--. мл/ч;
7,d
г— номинальная скорость, мл/ч;
WJ — замер массы в конце аналитического периода Г,. г (/' = 240); IV„ — замер массы в начале аналитического периода 7",. г (к = 120);
Г, — аналитический период, мин;
d— плотность воды (0.998 г/мл при температуре плюс 20 X).
Содержание
201.1 Область распространения, цель и дополнительные стандарты.......................... 1
201.2 Нормативные ссылки............................................................ 3
201.3 Термины и определения.......................................................... 3
201.4 Общие требования.............................................................. 5
201.5 Общие требования к испытаниям ME ИЗДЕЛИЯ...................................... 6
201.6 Классификация ME ИЗДЕЛИЙ и ME СИСТЕМ........... “ 6
201.7 Идентификация, маркировка и документация ME ИЗДЕЛИЙ............................ 6
201.8 Защита от ОПАСНОСТЕЙ поражения электрическим током от ME ИЗДЕЛИЯ.............. 8
201.9 Защита от МЕХАНИЧЕСКИХ ОПАСНОСТЕЙ, создаваемых ME ИЗДЕЛИЯМИ
и ME СИСТЕМАМИ.............................................................. 8
201.10 Защита от ОПАСНОСТЕЙ воздействия нежелательного или чрезмерного излучения....... 8
201.11 Защита от чрезмерных температур и других ОПАСНОСТЕЙ........................... 9
201.12* Точность органов управления и измерительных приборов и защита от опасных значений
выходных характеристик........................................................ 10
201.13 ОПАСНЫЕ СИТУАЦИИ и условия нарушения.......................................24
201.14 ПРОГРАММИРУЕМЫЕ ЭЛЕКТРИЧЕСКИЕ МЕДИЦИНСКИЕ СИСТЕМЫ (PEMS)...........25
201.15 Конструкция ME ИЗДЕЛИЯ......................................................25
201.16 ME СИСТЕМЫ..................................................................26
201.17 Электромагнитная совместимость ME ИЗДЕЛИЙ и ME СИСТЕМ.......................26
202 Электромагнитная совместимость. Требования и испытания.............................26
206 Эксплуатационная пригодность.....................................................27
208 Общие требования, испытания и руководящие указания по применению систем сигнализации
медицинских электрических изделий и медицинских электрических систем.................27
Приложения.........................................................................29
Приложение АА (справочное) Руководство и обьяснения к специальным подпунктам............30
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
национальным и межгосударственным стандартам..........................42
Библиография.......................................................................43
Указатель определений терминов, применяемых в настоящем стандарте......................44
Введение
Настоящий стандарт устанавливает основные требования к безопасности ИНФУЗИОННЫХ НАСОСОВ и ИНФУЗИОННЫХ КОНТРОЛЛЕРОВ. Взаимосвязь настоящего стандарта с МЭК 60601-1:2005 с изменением МЭК 60601-1(2005)/Amd. 1(2012) (далее — МЭК 60601-1:2005+А1:2012) и дополнительными стандартами пояснена в 1.3.
Ответственность за правильное использование инфузионных насосов и контроллеров лежит в первую очередь на ОПЕРАТОРЕ. Отмечается, что ОПЕРАТОРЫ должны быть обучены управлению МЕДИЦИНСКИМИ ЭЛЕКТРИЧЕСКИМИ ИЗДЕЛИЯМИ и что безопасность использования МЕДИЦИНСКИХ ЭЛЕКТРИЧЕСКИХ ИЗДЕЛИЙ может быть достигнута только при условии, что они эксплуатируются в соответствии с инструкциями ИЗГОТОВИТЕЛЯ. Указанный минимальный набор требований по безопасности. как считается, обеспечивает практическую степень безопасности при эксплуатации. За обеспечение соответствия требованиям настоящего стандарта ответственность несет ИЗГОТОВИТЕЛЬ. Настоящий стандарт разработан в соответствии с вышеуказанными принципами.
Настоящий стандарт является прямым применением международного стандарта МЭК 60601-2-24, подготовленного подкомитетом 62D МЭК «Медицинская электроаппаратура» Технического комитета ТК 62 «Электрооборудование в медицинской практике».
Второе издание международного стандарта отменяет и заменяет первое издание МЭК 60601-2-24. опубликованное в 1998 г. Настоящая редакция представляет собой технический пересмотр в целях соответствия МЭК 60601-1:2005+А1:2012. включая новую нумерацию пунктов и требования к эксплуатационной пригодности и сигнализации.
Текст международного стандарта основан на следующих документах:
|
Окончательный проект международного стандарта |
Отчет о голосовании |
|
62D/1026/FDIS |
62D/1039/RVD |
Полную информацию о голосовании по утверждению международного стандарта можно найти в отчете о голосовании, который указан в приведенной выше таблице.
Редакция международного стандарта подготовлена в соответствии с Директивами ИСО/МЭК. часть 2.
В настоящем стандарте приняты следующие шрифтовые выделения:
- требования и определения: прямой шрифт:
- методы испытаний: курсив:
- информативный материал, приведенный вне таблиц (примечания, примеры и справочная информация). а также нормативный текст таблиц: шрифт уменьшенного размера;
- ТЕРМИНЫ. ОПРЕДЕЛЕННЫЕ В РАЗДЕЛЕ 3 ОБЩЕГО СТАНДАРТА И В НАСТОЯЩЕМ ЧАСТНОМ СТАНДАРТЕ: ЗАГЛАВНЫЕ БУКВЫ.
В настоящем стандарте термины означают:
- «пункт» — одна из 17 частей стандарта, указанных в содержании, включая все ее подпункты (например. пункт 7. включая его подпункты 7.1, 7.2 и т. д.);
- «подпункт» — пронумерованная последовательность подпунктов пункта (например, подпункты 7.1, 7.2 и 7.2.1 являются подпунктами пункта 7).
Перед ссылкой на пункт и перед его номером в настоящем стандарте будет стоять слово «пункт», а ссылка на подпункт будет ограничиваться лишь его номером
В настоящем стандарте союз «или» будет использован как включающее «или», т. е. утверждение будет истинным при любой комбинации условий.
Глагольные формы, используемые в настоящем стандарте, совпадают по форме с описанными в приложении Н Директив ИСО/МЭК (часть 2).
Вспомогательные глаголы:
- «должен» означает, что соответствие требованиям или испытаниям обязательно для соответствия настоящему стандарту:
- «следует» означает, что соответствие требованиям или испытаниям рекомендовано, но не обязательно для соответствия настоящему стандарту;
- «может» используется для описания допустимых путей достижения соответствия требованиям или испытаниям.
Требования настоящего частного стандарта имеют приоритет перед требованиями общего стандарта.
Знак звездочки (*) у номера пункта или подпункта раздела указывает, что в приложении АА приведены соответствующие пояснения.
IV
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ЭЛЕКТРИЧЕСКИЕ Часть 2-24
Частные требования безопасности с учетом основных функциональных характеристик к насосам и контроллерам инфузионным
Medical electrical equipment Part 2-24 Particular requirements for the basic safety and essential performance
of infusion pumps and controllers
Дата введения — 2018—07—01
201.1 Область распространения, цель и дополнительные стандарты
Применяют раздел 1 общего стандарта1 \ за исключением следующего:
201.1.1 Область распространения
Замена:
Настоящий стандарт распространяется на ОБЩИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ С УЧЕТОМ ОСНОВНЫХ ФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК к инфузионным насосам и волюметрическим инфузионным контроллерам, в дальнейшем именуемым как «МЕ ИЗДЕЛИЯ».
Настоящий стандарт распространяется на ИНФУЗИОННЫЕ МАГИСТРАЛИ, если их характеристики влияют на ОБЩИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ С УЧЕТОМ ОСНОВНЫХ ФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК к ИНФУЗИОННЫМ НАСОСАМ и ВОЛЮМЕТРИЧЕСКИМ ИНФУЗИОННЫМ КОНТРОЛЛЕРАМ Однако настоящий стандарт не устанавливает требования или методы испытаний к другим аспектам, связанным с ИНФУЗИОННЫМИ МАГИСТРАЛЯМИ.
Если какой-либо пункт или подпункт настоящего стандарта применим исключительно к МЕ ИЗДЕЛИЮ или же исключительно к МЕ СИСТЕМАМ, то об этом будут свидетельствовать название и содержание этого пункта или подпункта, в противном случае данный пункт или подпункт применим и к МЕ ИЗДЕЛИЮ, и к МЕ СИСТЕМАМ.
ОПАСНОСТИ, связанные с физиологическими эффектами, вызванными воздействием МЕ ИЗДЕЛИЯ или МЕ СИСТЕМЫ, не рассматриваются в настоящем стандарте, за исключением 7.2.13 и 8.4.1 общего стандарта.
Примечание — См также пункт 4 2 общего стандарта
Настоящий стандарт может также применяться к НАСОСАМ ДЛЯ ЭНТЕРАЛЬНОГО ПИТАНИЯ, ИНФУЗИОННЫМ НАСОСАМ. ИНФУЗИОННЫМ НАСОСАМ ДЛЯ АМБУЛАТОРНОГО ИСПОЛЬЗОВАНИЯ. ШПРИЦЕВЫМ или КОНТЕЙНЕРНЫМ НАСОСАМ. ВОЛЮМЕТРИЧЕСКИМ ИНФУЗИОННЫМ КОНТРОЛЛЕРАМ и ВОЛЮМЕТРИЧЕСКИМ ИНФУЗИОННЫМ НАСОСАМ, которые определены в 201.3 204.
201.3 206. 201.3.207. 201.3.220. 201.3.222 и 201.3.223.
Настоящий стандарт не распространяется на следующее:
a) оборудование, предназначенное для диагностического или схожего с ним назначения (например. оборудование для ангиографии или другие насосы, постоянно контролируемые или управляемые ОПЕРАТОРОМ);
b) устройства для экстракорпорального кровообращения;
c) имплантируемые устройства;
Общий стандарт МЭК 60601-1 2005+А1 2012 «Электроаппаратура медицинская Часть 1 Общие требования к основной безопасности и существенным характеристикам»
d) ME ИЗДЕЛИЯ, предназначенные для диагностического применения в уродинамике (измерение отношения давления-объема мочевого пузыря при заполнении через катетер с водой);
e) ME ИЗДЕЛИЯ, предназначенные для диагностического применения при испытаниях мужской потенции (измерение объема вливаемой жидкости, необходимого для обеспечения заданного уровня давления для поддержания пенильной эрекции: кавернозометрии. кавернозографии);
0 устройства, на которые распространяется ИСО 28620.
201.1.2 Цель
Замена
Целью настоящего стандарта является установление ОБЩИХ ТРЕБОВАНИЙ БЕЗОПАСНОСТИ С УЧЕТОМ ОСНОВНЫХ ФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК к НАСОСАМ ДЛЯ ЭНТЕРАЛЬНОГО ПИТАНИЯ. ИНФУЗИОННЫМ НАСОСАМ. ИНФУЗИОННЫМ НАСОСАМ ДЛЯ АМБУЛАТОРНОГО ИСПОЛЬЗОВАНИЯ. ШПРИЦЕВЫМ или КОНТЕЙНЕРНЫМ НАСОСАМ. ВОЛЮМЕТРИЧЕСКИМ ИНФУЗИОННЫМ КОНТРОЛЛЕРАМ и ВОЛЮМЕТРИЧЕСКИМ ИНФУЗИОННЫМ НАСОСАМ, которые определены в 201.3 204. 201.3 206, 201.3.207. 201.3 220. 201.3.222 и 201.3 223.
201.1.3 Дополнительные стандарты
Дополнение:
Настоящий стандарт использует ссылки, указанные в разделе 2 общего стандарта и пункте 201.2.
МЭК 60601-1-2:2007. МЭК 60601-1-6:2010 и МЭК 60601-1-8:2006 применяют с изменениями, внесенными в пункты 202.206 и 208 соответственно. МЭК 60601-1-3 не применяют. Все остальные дополнительные стандарты, перечисленные в МЭК 60601-1. применяют в том виде, в каком они опубликованы.
201.1.4 Частные стандарты
Замена:
Частные стандарты серии МЭК 60601 могут изменять, заменять или отменять требования, содержащиеся в общем стандарте и дополнительных стандартах, имеющих прямое отношение к конкретному ME ИЗДЕЛИЮ, а также могут добавлять другие требования к ОСНОВНОЙ БЕЗОПАСНОСТИ и ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ.
Требования настоящего стандарта являются приоритетными по отношению к соответствующим требованиям общего стандарта.
Для краткости изложения в настоящем стандарте в качестве общего стандарта указан МЭК 60601-1. Дополнительные стандарты обозначены по их номерам.
Нумерация пунктов и подпунктов настоящего стандарта соответствует общему стандарту с приставкой «201»(например, пункт 201.1 настоящего стандарта соответствует содержанию пункта 1 общего стандарта) или дополнительному стандарту с приставкой «20х», где «х» — это последняя(ие) цифра(ы) номера дополнительного стандарта (например, пункт 202.4 настоящего стандарта соответствует содержанию пункта 4 дополнительного стандарта МЭК 60601-1-2. пункт 203 4 настоящего стандарта соответствует содержанию пункта 4 дополнительного стандарта МЭК 60601-1-3 и т. д ). Изменения текста общего стандарта обозначены следующими словами:
- «замена» означает, что пункт или подпункт общего стандарта или соответствующего дополнительного стандарта полностью заменен текстом настоящего частного стандарта;
- «дополнение» — текст настоящего частного стандарта является дополнением к требованиям общего стандарта или соответствующего дополнительного стандарта;
- «изменение» — пункт ипи подпункт общего стандарта или соответствующего дополнительного стандарта изменен в соответствии с текстом настоящего частного стандарта.
Подпункты, рисунки или таблицы, которые являются дополнительными к элементам общего стандарта, пронумерованы начиная с 201.101. Однако вследствие того, что определения в общем стандарте пронумерованы от 3.1 до 3.139. дополнительные определения в настоящем стандарте пронумерованы начиная с 201.3.201. Дополнитепьные приложения обозначены буквами АА, ВВ и т. д., дополнительные пункты — аа), bb) и т. д.
Подпункты, рисунки или таблицы, которые являются дополнительными к элементам из дополнительного стандарта, пронумерованы начиная с «20х», где «х» — номер дополнительного стандарта, например 202 для МЭК 60601-1-2. 203 для МЭК 60601-1-3 и т. д.
Термин «настоящие стандарты» использован для совместной ссылки на общий стандарт, любые применимые дополнительные стандарты и настоящий частный стандарт, вместе взятые.
2
В случае отсутствия соответствующего пункта или подпункта в настоящем частном стандарте применяют без изменений соответствующий пункт или подпункт общего стандарта или применимого дополнительно стандарта, даже если он не релевантен; в настоящем частном стандарте указаны условия неприменимости любого пункта или подпункта общего стандарта или применимого дополнительного стандарта.
201.2 Нормативные ссылки
Применяют пункт 2 общего стандарта, за исключением следующего:
Замена:
IEC 60601-1-2:2007. Medical electrical equipment — Part 1-2: General requirements for basic safety and essential performance — Collateral standard: Electromagnetic compatibility — Requirements and tests2 (Электроаппаратура медицинская. Часть 1-2. Общие требования к базовой безопасности и основной эксплуатационной характеристике. Дополняющий стандарт. Электромагнитная совместимость. Требования и испытания)
IEC 60601-1-6:2010, Medical electrical equipment — Part 1-6: General requirements for basic safety and essential performance — Collateral standard: Usability (Электрооборудование медицинское. Часть 1 -6. Общие требования безопасности и основные рабочие характеристики. Дополняющий стандарт. Возможность использования)
IEC 60601-1-8:2006, Medical electrical equipment — Part 1-8: General requirements for basic safety and essential performance — Collateral standard: General requirements, tests and guidance for alami systems in medical electrical equipment and medical electrical systems (Аппаратура электрическая медицинская. Часть 1-8. Общие требования к базовой безопасности и существенным характеристикам. Дополняющий стандарт. Общие требования, испытания и руководство по системам тревожной сигнализации в электрической медицинской аппаратуре и системах)
Дополнение:
IEC 60601-1:2005. Medical electrical equipment — Part 1: General requirements for basic safety and essential performance. Amendment 1:2012 (Электроаппаратура медицинская. Часть 1. Общие требования к базовой безопасности и существенные рабочие характеристики. Изменение 1)
ISO 3696:1987, Water for analytical laboratory use — Specification and test methods (Вода для лабораторного анализа. Технические требования и методы испытаний)
ISO 7864. Sterile hypodemiic needles for single use (Иглы стерильные для подкожных инъекций одноразового применения)
ISO 8536-4. Infusion equipment for medical use — Part 4: Infusion sets for single use. gravity feed (Оборудование медицинское для вливаний. Часть 4 Одноразовые комплекты для вливания с гравитационной подачей)
201.3 Термины и определения
В настоящем стандарте использованы термины и определения, приведенные в МЭК 60601-1:2005+А1:2012, за исключением следующих:
Примечание — Алфавитный указатель определений терминов приведен в конце настоящего частного стандарта
Замена:
201.3.8 РАБОЧАЯ ЧАСТЬ (APPLIED PART): Часть ME ИЗДЕЛИЯ, в том числе магистраль для инфузионного раствора, которая при НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ ME ИЗДЕЛИЯ обязательно должна входить в непосредственный контакт с ПАЦИЕНТОМ для выполнения требуемых функций.
Дополнение:
201.3.201 ИНФУЗИОННАЯ МАГИСТРАЛЬ (ADMINISTRATION SET): Устройство, предназначенное для внутривенного введения ПАЦИЕНТУ инфузионных растворов из соответствующей емкости посредством ME ИЗДЕЛИЯ
201.3.202 ИНТЕРВАЛ ЗАМЕНЫ ИНФУЗИОННОЙ МАГИСТРАЛИ (ADMINISTRATION SET CHANGE INTERVAL): Допустимое время использования ИНФУЗИОННОЙ МАГИСТРАЛИ, рекомендованное ИЗГОТОВИТЕЛЕМ ME ИЗДЕЛИЯ.
201.3.203 НАЗНАЧЕННЫЙ БОЛЮС (INTENDED BOLUS): Дискретный объем инфузионного раствора. предназначенный для введения ПАЦИЕНТУ с помощью ME ИЗДЕЛИЯ.
201.3.204 НАСОС ДЛЯ ЭНТЕРАЛЬНОГО ПИТАНИЯ (ENTERAL NUTRITION PUMP): ИНФУЗИОННЫЙ НАСОС, предназначенный для введения жидких смесей для энтерального питания.
201.3.205 СВОБОДНЫЙ ПОТОК (FREE FLOW): Непреднамеренное неконтролируемое ИНФУЗИОННЫМ НАСОСОМ введение ПАЦИЕНТУ инфузионного раствора через ИНФУЗИОННУЮ МАГИСТРАЛЬ. например вследствие неучтенного воздействия силы тяжести или давления при извлечении ИНФУЗИОННОЙ МАГИСТРАЛИ из ИНФУЗИОННОГО НАСОСА.
201.3.206 ИНФУЗИОННЫЙ НАСОС (INFUSION PUMP): ME ИЗДЕЛИЕ, предназначенное для контролируемого введения ПАЦИЕНТУ инфузионных растворов под давлением, создаваемым насосом.
Примечание — ИНФУЗИОННЫЙ НАСОС может обеспечивать один или несколько следующих типов инфузии
-тип 1: непрерывная инфузия,
- тип 2 инфузия прерывистым потоком.
-тип 3: дискретное введение болюса;
- тип 4 инфузия по заданному профилю, осуществляемая ПРОФИЛИРУЕМЫМ НАСОСОМ
201.3.207 ИНФУЗИОННЫЙ НАСОС ДЛЯ АМБУЛАТОРНОГО ИСПОЛЬЗОВАНИЯ (INFUSION PUMP FOR AMBULATORY USE): ИНФУЗИОННЫЙ НАСОС, предназначенный для постоянного ношения ПАЦИЕНТОМ.
201.3.208 СРЕДНЯЯ СКОРОСТЬ (INTERMEDIATE RATE): Значение скорости инфузии, используемое в ходе испытаний в целях сравнения характеристик различных типов насосов.
Примечание — Конкретные значения СРЕДНЕЙ СКОРОСТИ отличаются в зависимости от типа инфузионного оборудования
- для ВОЛЮМЕТРИЧЕСКИХ ИНФУЗИОННЫХ НАСОСОВ и ВОЛЮМЕТРИЧЕСКИХ ИНФУЗИОННЫХ КОНТРОЛЛЕРОВ устанавливают значение 25 мл/ч.
- ШПРИЦЕВЫХ ИЛИ КОНТЕЙНЕРНЫХ НАСОСОВ — значение 5 мл/ч.
- ИНФУЗИОННЫХ НАСОСОВ ДЛЯ АМБУЛАТОРНОГО ИСПОЛЬЗОВАНИЯ — значение, указанное ИЗГОТОВИТЕЛЕМ в качестве типового для данного ME ИЗДЕЛИЯ
201.3.209 СКОРОСТЬ В РЕЖИМЕ ОТКРЫТОЙ ВЕНЫ (KEEP OPEN RATE. KOR): Заранее заданное низкое значение скорости инфузии, которое устанавливается ИНФУЗИОННЫМ НАСОСОМ при определенных условиях с целью поддержания проходимости ЛИНИИ ПАЦИЕНТА.
Примечание — В качестве синонима KOR также используют аббревиатуру KVO (Keep-Vein-Open, режим открытой вены).
201.3.210 МАКСИМАЛЬНОЕ ДАВЛЕНИЕ ИНФУЗИИ (MAXIMUM INFUSION PRESSURE): Максимальное значение давления, которое может быть достигнуто в ходе работы ИНФУЗИОННОГО НАСОСА при условии возникновения окклюзии на конце ЛИНИИ ПАЦИЕНТА.
201.3.211 МИНИМАЛЬНАЯ СКОРОСТЬ (MINIMUM RATE): Самое низкое значение скорости инфузии. которое может быть установлено ОПЕРАТОРОМ, но не менее 1 мл/ч.
* 201.3.212 МАКСИМАЛЬНО ВОЗМОЖНАЯ СКОРОСТЬ (MAXIMUM SELECTABLE RATE): Самое высокое значение скорости инфузии, которое может быть установлено ОПЕРАТОРОМ, если оно выше СРЕДНЕЙ СКОРОСТИ.
* 201.3.213 МИНИМАЛЬНО ВОЗМОЖНАЯ СКОРОСТЬ (MINIMUM SELECTABLE RATE): Самое низкое значение скорости инфузии, которое может быть установлено ОПЕРАТОРОМ, если оно ниже МИНИМАЛЬНОЙ СКОРОСТИ
201.3.214 ПОРОГ ДАВЛЕНИЯ ОККЛЮЗИИ (OCCLUSION ALARM THRESHOLD): Значение величины давления, при котором срабатывает тревожная сигнализация о возникновении окклюзии.
201.3.215 СТОРОНА ПАЦИЕНТА (PATIENT END): Подсоединяемый к ПАЦИЕНТУ конец ЛИНИИ ПАЦИЕНТА.
201.3.216 ЛИНИЯ ПАЦИЕНТА (PATIENT LINE): Часть ИНФУЗИОННОЙ МАГИСТРАЛИ между ME ИЗДЕЛИЕМ и ПАЦИЕНТОМ
201.3.217 ОБЛАСТЬ КОНТРОЛЯ (REGION OF CONTROL): Часть ME ИЗДЕЛИЯ внутри самого ME ИЗДЕЛИЯ или за его пределами, в которой осуществляется регулирование скорости инфузии, прерывание потока инфузионного раствора или детектирование наличия воздуха в ИНФУЗИОННОЙ МАГИСТРАЛИ.
201.3.218 ПРОФИЛИРУЕМЫЙ НАСОС (PROFILE PUMP): ИНФУЗИОННЫЙ НАСОС, предназначенный для контролируемого введения ПАЦИЕНТУ инфузионных растворов с использованием запрограммированной последовательности различных значений скорости инфузии.
201.3.219 ЛИНИЯ ПОДАЧИ (SUPPLY LINE): Часть ИНФУЗИОННОЙ МАГИСТРАЛИ мехщу емкостью с инфузионным раствором и ME ИЗДЕЛИЕМ
201.3.220 ШПРИЦЕВОЙ ИЛИ КОНТЕЙНЕРНЫЙ НАСОС (SYRINGE OR CONTAINER PUMP): ИНФУЗИОННЫЙ НАСОС, предназначенный для контролируемого введения ПАЦИЕНТУ инфузионных растворов с использованием одного или нескольких одноразовых шприцев или аналогичных опустошаемых под воздействием создаваемого в них положительного давления контейнеров (пакетов, кассет, картриджей и т. д.) и скорость инфузии в котором задается как объем препарата в единицу времени или в единицах дозы препарата.
201.3.221 НЕПРЕДНАМЕРЕННЫЙ БОЛЮС (UNINTENDED BOLUS): Неконтролируемый нежелательный дискретный объем инфузионного раствора, вводимый ИНФУЗИОННЫМ НАСОСОМ после устранения окклюзии.
201.3.222 ВОЛЮМЕТРИЧЕСКИЙ ИНФУЗИОННЫЙ КОНТРОЛЛЕР (VOLUMETRIC INFUSION CONTROLLER): ME ИЗДЕЛИЕ, предназначенное для регулирования скорости инфузии, осуществляемой под положительным давлением вследствие воздействия силы тяжести, в котором скорость инфузии задается как обьем препарата в единицу времени.
201.3 223 ВОЛЮМЕТРИЧЕСКИЙ ИНФУЗИОННЫЙ НАСОС (VOLUMETRIC INFUSION PUMP): ИНФУЗИОННЫЙ НАСОС, в котором скорость инфузии задается как обьем препарата в единицу времени или в единицах дозы препарата, за исключением ШПРИЦЕВЫХ ИЛИ КОНТЕЙНЕРНЫХ НАСОСОВ.
201.4 Общие требования
Применяют раздел 4 общего стандарта, за исключением следующего:
201.4.3 ОСНОВНЫЕ ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ
Допопнитепьный подпункт:
201.4.3.101 Дополнительные требования к ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ
Дополнительные требования к ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ представлены в таблице 201.101.
|
Таблица 201 101 — Требования к ОСНОВНЫМ ФУНКЦИОНАЛЬНЫМ ХАРАКТЕРИСТИКАМ | ||||||||||||||||||
|
201.4.7 * УСЛОВИЕ ЕДИНИЧНОГО НАРУШЕНИЯ для ME ИЗДЕЛИЯ
Допопнение:
УСЛОВИЯ ЕДИНИЧНЫХ НАРУШЕНИЙ, случающихся в защитных системах, определенных в 201.12 4 4.101, 201.12 4 4 102, 201.12 4 4.105 и 201.12 4 4 107, в случае возникновения должны быть очевидны для ОПЕРАТОРА в течение всего ИНТЕРВАЛА ЗАМЕНЫ ИНФУЗИОННОЙ МАГИСТРАЛИ.
Примечание — Возможные методы выполнения этого требования, например следующие
1) проверку системы безопасности запускает и контролирует ME ИЗДЕЛИЕ в начале ИНТЕРВАЛА ЗАМЕНЫ ИНФУЗИОННОЙ МАГИСТРАЛИ и далее постоянно при необходимости.
2) одну или более проверок защитных систем запускает ОПЕРАТОР и контролирует ME ИЗДЕЛИЕ в течение ИНТЕРВАЛА ЗАМЕНЫ ИНФУЗИОННОЙ МАГИСТРАЛИ, при этом оператор запускает проверки перед началом и в ходе инфузии,
3) проверку системы безопасности проводит ОПЕРАТОР не реже одного раза в течение ИНТЕРВАЛА ЗАМЕНЫ ИНФУЗИОННОЙ МАГИСТРАЛИ (см 21-е перечисление в 201 7 9.2.101).
Следующие события не рассматриваются в качестве УСЛОВИЙ ЕДИНИЧНЫХ НАРУШЕНИЙ, но рассматриваются как НОРМАЛЬНЫЕ СОСТОЯНИЯ:
- утечки из ИНФУЗИОННОЙ МАГИСТРАЛИ и/или системы подачи жидкости:
- истощение ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ:
- неправильная установка и/или заполнение капельной камеры:
- воздух в ЛИНИИ ПОДАЧИ или в части ME ИЗДЕЛИЯ, где происходит регулировка потока, остановка потока или детекция наличия воздуха;
- выдергивание ЛИНИИ ПАЦИЕНТА (см. ИСО 8536-4).
201.5 Общие требования к испытаниям ME ИЗДЕЛИЯ
Применяют раздел 5 общего стандарта, за исключением следующего:
201.5.2 Число образцов
Дополнение:
ИЗГОТОВИТЕЛЬ должен определить число образцов ИНФУЗИОННЫХ НАСОСОВ/ ИНФУЗИОННЫХ КОНТРОЛЛЕРОВ и ИНФУЗИОННЫХ МАГИСТРАЛЕЙ для испытаний, необходимое для оценки погрешности, указанной в технической документации.
Соответствие проверяют путем рассмотрения технической документации.
201.6 Классификация ME ИЗДЕЛИЙ и ME СИСТЕМ
Применяют раздел 6 общего стандарта, за исключением следующего:
201.6.6 Режим работы
Замена:
ME ИЗДЕЛИЕ должны классифицировать как имеющее ПРОДОЛЖИТЕЛЬНЫЙ РЕЖИМ РАБОТЫ.
201.7 Идентификация, маркировка и документация ME ИЗДЕЛИЙ
Применяют раздел 7 общего стандарта, за исключением следующего:
201.7.2.1 Минимальные требования к маркировке ME ИЗДЕЛИЯ и его взаимозаменяемых частей
Дополнение:
ME ИЗДЕЛИЕ должно быть промаркировано стрелкой или другим соответствующим символом, указывающим правильное направление течения потока жидкости, для исключения возможности неправильной установки ИНФУЗИОННОЙ МАГИСТРАЛИ.
Соответствие проверяют осмотром
201.7.2 4 Маркировка ПРИНАДЛЕЖНОСТЕЙ
Дополнение:
Если для безопасной НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ ME ИЗДЕЛИЯ требуется использование сьемных. специфичных по размерам и маркам или содержащих особенную концентрацию препаратов резервуаров для жидкости или ЛИНИЙ ПАЦИЕНТА, то соответствующая маркировка должна быть за-
6
1
Издание официальное
2
Заменен на IEC 60601-1-2:2014 «Аппаратура электрическая медицинская Часть 1-2 Общие требования к базовой безопасности и существенным рабочим характеристикам Дополнительный стандарт Электромагнитные помехи Требования и испытания» Однако для однозначного соблюдения требований настоящего стандарта, выраженного в датированной ссылке, рекомендуется использовать только указанное в этой ссылке издание
3