ГОСТ Р ИСО 20857-2016
Стерилизация медицинской продукции. Горячий воздух. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
Определяет требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий горячим воздухом. Несмотря на то, что область применения стандарта ограничивается медицинскими изделиями, описанные в нем требования и приведенные рекомендации могут применяться к иной медицинской продукции. Несмотря на то, что в стандарте речь идет, прежде всего, о стерилизации горячим воздухом, в нем также приведены требования и руководство в отношении процессов депирогенизации с применением горячего воздуха.
Идентичен ISO 20857:2010
Оглавление
1 Область применения
1.1 Включения
1.2 Исключения
2 Нормативные ссылки
3 Термины и определения
4 Элементы системы менеджмента качества
4.1 Документирование
4.2 Ответственность руководства
4.3 Реализация продукции
4.4 Измерения, анализ и улучшение - Контроль несоответствующей продукции
5 Описание стерилизующего агента
5.1 Стерилизующий агент
5.2 Микробоцидная эффективность
5.3 Воздействие на материалы
5.4 Воздействие на окружающую среду
6 Описание процесса и оборудования
6.1 Описание процесса
6.2 Описание оборудования
7 Определение продукта
7.1 Общая информация
7.2 Безопасность и рабочие характеристики продукта
7.3 Требования к упаковке
7.4 Микробиологическое качество
7.5 Семейство продуктов
7.6 Биологическая безопасность
8 Определение процесса
9 Валидация
9.1 Общая информация
9.2 Аттестация монтажа
9.3 Аттестация функционирования
9.4 Аттестация эксплуатируемого оборудования
9.5 Дополнительные стерилизационные системы
9.6 Анализ и утверждение валидации
10 Текущий мониторинг и контроль
10.1 Текущий контроль
10.2 Текущий мониторинг
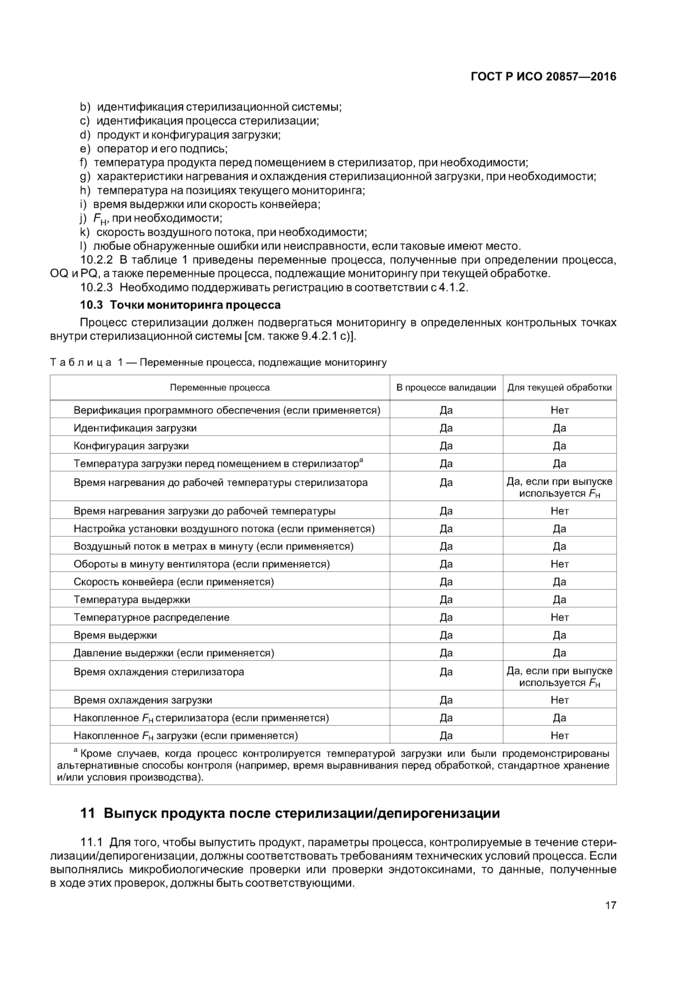
10.3 Точки мониторинга процесса
11 Выпуск продукта после стерилизации/депирогенизации
12 Поддержание эффективности процесса
12.1 Общая информация
12.2 Повторная калибровка
12.3 Обслуживание оборудования
12.4 Переаттестация
12.5 Оценка изменений
Приложение А (справочное) Руководство по применению настоящего стандарта
Приложение В (справочное) Определение процесса, основанное на инактивации микробной популяции в ее естественном состоянии (метод/подход, основанный на бионагрузке)
Приложение С (нормативное) Определение процесса, основанное на инактивации контрольных микроорганизмов и знании бионагрузки (комбинированный метод бионагрузки/биологического индикатора)
Приложение D (справочное) Консервативное определение процесса, основанное на инактивации контрольных микроорганизмов (метод полной гибели)
Приложение Е (справочное) Разработка процесса
Приложение DA (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Библиография
54 страницы
| Дата введения | 01.03.2017 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 17.03.2016 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 161-ст |
|---|---|---|---|
| Разработан | ООО ФАРМСТЕР | ||
| Разработан | ООО НПФ Винар | ||
| Издан | Стандартинформ | 2016 г. |
Sterilization of medical devices. Dry heat. Requirements for development, validation and routine control of a sterilization process for medical devices
- ГОСТ Р ИСО 10012-2008 Менеджмент организации. Системы менеджмента измерений. Требования к процессам измерений и измерительному оборудованию
ГОСТ ISO 13485-2011Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования. Заменен на ГОСТ ISO 13485-2017.- ГОСТ ISO 11140-1-2011 Стерилизация медицинской продукции. Химические индикаторы. Часть 1. Общие требования
- ГОСТ ISO 10993-17-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ
- ГОСТ ISO 10993-1-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
- ГОСТ 12.2.091-2012 Безопасность электрического оборудования для измерения, управления и лабораторного применения. Часть 1. Общие требования
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12
стр. 13

стр. 14
стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ГОСТ Р исо
20857-
2016
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
Стерилизация медицинской продукции ГОРЯЧИЙ ВОЗДУХТребования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
ISO 20857:2010
Sterilization of health care products — Dry heat — Requirements for the development, validation and routine control of a sterilization process for medical devices (IDT)
Издание официальное
Москва
Стандартинформ
2016
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Фармстер» (ООО «Фармстер») на основе перевода на русский язык стандарта, указанного в пункте 4, который выполнен Обществом с ограниченной ответственностью «Научно-производственная фирма «ВИНАР» (ООО «НПФ«ВИНАР»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 383 «Стерилизация изделий медицинского назначения»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 17 марта 2016 г. № 161-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 20857:2010 «Стерилизация медицинской продукции. Сухой жар. Требования к разработке, валидации и текущему контролю производственного процесса стерилизации медицинских изделий» (ISO 20857:2010 «Sterilization of health care products — Dry heat — Requirements for the development, validation and routine control of a sterilization process for medical devices»).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения которых приведены в дополнительном приложении DA
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ, 2016
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
3.8
корректирующее действие (corrective action): Действие, предпринятое для устранения причины обнаруженного несоответствия или другой нежелательной ситуации.
Примечание 1 — У несоответствия может быть несколько причин.
Примечание 2 — Корректирующее действие предпринимается для предотвращения повторного события, тогда как предупреждающее действие (3.27) — для предотвращения события.
Примечание 3 — Существует различие между коррекцией (3.7) и корректирующим действием.
[ИСО 9000, статья 3.6.5]
3.9 величина D, величина D10 (D-value, D10 va!ue): Время или доза облучения, необходимая для достижения инактивации 90 % популяции тест-микроорганизма при установленных условиях.
Примечание 1 — В рамках настоящего стандарта величина D относится ко времени выдержки, необходимому для достижения сокращения популяции тест-микроорганизма на 90 %.
Примечание 2 —Данные адаптированы из ИСО/ТС 11139:2006.
3.10 депирогенизация (depyrogention): Валидированный процесс, предназначенный для удаления или инактивации пирогенного материала в установленных количествах, контролируемых с помощью инактивации эндотоксина.
Примечание — В рамках процесса депирогенизации, термин «инактивация» относится к потере способности биологического материала вызывать пирогенную реакцию.
3.11 процесс депирогенизации (depyrogentaion process): Последовательность действий или операций, необходимых для достижения установленных требований к удалению или инактивации пирогенов.
установить, устанавливать (establish): Определить по теоретической оценке и подтвердить экспериментом.
[ИСО/ТС 11139:2006, статья 2.17]
3.12
время выдержки (exposure time): Период времени, в течение которого параметры процесса поддерживаются в пределах их установленных допусков.
[ИСО/ТС 11139:2006, статья 2.18]
3.13
3.14
величина F (F-value): Микробиологическая летальность в процессе стерилизации, представленная в терминах эквивалентного времени, в минутах, при температуре 160 °С по отношению к микроорганизмам с величиной z, равной 20 °С.
Примечание 1 — В рамках воздушной стерилизации величина F при определенных температурных значениях стерилизации, Т, и z, упоминается как FH. Как правило, FH является соответствующим временем в минутах при 160 °С, воздействующих на продукт при температуре, Г, основываясь на предположении, что величина z равна 20 °С. FH определяется при помощи биологических (FBjo) или физических (Fphys) методов.
Примечание 2 — Fhb процессе при температуре Г, где Т имеет любое другое значение кроме 160 °С, определяется при помощи перемножения степени летальности и времени при температуре Т
FH = At х L,
гдеГн — соответствующее время в минутах при 160 °С, которые воздействовали на продукт в течение процесса за период времени f;
At — время в минутах при температуре 7;
L — степень летальности при температуре Т.
ошибка, сбой (fault): Один или несколько параметров процесса, выходящих за пределы своего установленного допуска.
[ИСО/ТС 11139:2006, статья 2.19]
3.15
3.16 доля положительных результатов (fraction positive): Коэффициент, в котором числитель показывает число положительных испытаний, а знаменатель — число проведенных испытаний.
медицинская продукция (health care product(s)): Медицинские изделия, включая медицинские изделия для in vitro диагностики, или лекарственные средства, включая биофармацевтические. [ИСО/ТС 11139:2006, статья 2.20]
3.17
3.18
инактивация (inactivation): Потеря микроорганизмами способности к росту и/или размножению. [ИСО/ТС 11139:2006, статья 2.21]
Примечание — В рамках процессов депирогенизации, термин «инактивация» означает потерю биологическим материалом способности вызывать пирогенную реакцию.
3.19 инокулированный носитель (inoculated carrier): Поддерживающий материал, на который или внутрь которого нанесено определенное количество тест-микроорганизма.
аттестация монтажа (installation qualification; IQ): Получение и документирование доказательств, что оборудование поставлено, смонтировано в соответствии с его спецификацией.
[ИСО/ТС 11139:2006, статья 2.22]
3.20
3.21 степень летальности (lethal rate), L: Выражение значения инактивации микроорганизмов в единицу времени при температуре Г, при значении ссылочной температуры — Tref.
Примечание 1 — L выражается в минутах при контрольной температуре, Гтеf, в минуту при Т.
Примечание 2 — Степень летальности при любой температуре может быть рассчитана при помощи уравнения:
L= loilzbrl,
z
где Т — рабочая температура;
7"ref — ссылочная температура; z — температурное изменение, необходимое для уменьшения величины D в 10 раз, выраженное в градусах Цельсия.
медицинское изделие (medical device): Любой прибор, аппарат, принадлежность, устройство, имплантат, реагент in vitro или калибратор, программное обеспечение, материал или иное подобное или имеющее к этому отношение изделие, предназначенное его изготовителем для использования как автономно, таки в сочетании с другими изделиями, для людей в (определенных) целях:
- диагностики, профилактики, мониторинга, лечения или облегчения заболевания;
- диагностики, мониторинга, лечения, облегчения или компенсации травмы;
- изучения, замены, поддержки или модификации анатомии или физиологического процесса;
- поддержания жизни;
- контроля зачатия;
- дезинфекции медицинских изделий;
- получения нужной для медицинских целей информации путем исследований in vitro образцов, взятых из тела человека, которые не оказывают своего основного действия внутри или на теле человека с помощью фармакологических, иммунологических или метаболических средств, но функционированию которых такие средства могут способствовать.
[ИСО 13485—2004, статья 3.7]
3.22
5
ГОСТ Р ИСО 20857-2016
микроорганизм (microorganism): Объект микроскопического размера, охватывающий бактерии, грибы, простейшие и вирусы.
[ИСО/ТС 11139:2006, статья 2.26]
микроорганизм (microorganism): Объект микроскопического размера, охватывающий бактерии, грибы, простейшие и вирусы.
[ИСО/ТС 11139:2006, статья 2.26]
3.23
Примечание — Конкретный стандарт может не требовать доказательства эффективности процесса стерилизации в отношении инактивации всех типов микроорганизмов, установленных в данном определении, для разработки, валидации и текущего контроля процесса стерилизации.
аттестация функционирования (operational qualification; OQ): Процесс получения и документирования доказательств того, что установленное оборудование работает внутри заданных пределов параметров при его использовании в соответствии с инструкциями по эксплуатации.
[ИСО/ТС 11139:2006, статья 2.27]
3.24
параметрический выпуск (parametric release): Утверждение, что продукт стерилен, основанное на записях, подтверждающих нахождение параметров процесса в пределах заданных допусков. [ИСО/ТС 11139:2006, статья 2.29]
3.25
аттестация эксплуатируемого оборудования (performance qualification; PQ): Процесс получения и документирования доказательств того, что оборудование, установленное и эксплуатируемое согласно инструкциям по эксплуатации, постоянно работает в соответствии с заданными критериями и, следовательно, выпускает продукцию, отвечающую своим техническим спецификациям (требованиям).
[ИСО/ТС 11139:2006, статья 2.30]
3.26
3.27
предупреждающее действие (preventive action): Действие, предпринятое для устранения причины потенциального несоответствия или другой потенциально нежелательной ситуации.
Примечание 1 — Причин потенциального несоответствия может быть несколько.
Примечание 2 — Предупреждающее действие применяется для предотвращения события, тогда как корректирующее действие (3.8) — для предотвращения повторного события.
[ИСО 9000, статья 3.6.4]
устройство контроля процесса, УКП (process challenge device, PCD): Устройство, предназначенное для создания заданной сопротивляемости (резистентности) процессу стерилизации и используемое для оценки эффективности процесса.
[ИСО/ТС 11139:2006, статья 2.33]
3.28
параметр процесса (process parameter): Установленное значение переменной процесса. [ИСО/ТС 11139:2006, статья 2.34]
3.29
Примечание — Спецификация (технические требования) к процессу стерилизации включает (включают) параметры процесса и их допуски.
3.30
переменная процесса (process variable): Условие процесса стерилизации, изменение которого влияет на микробоцидную эффективность.
Пример — Время, температура, давление, концентрация, влажность, длина волны.
[ИСО/ТС 11139:2006, статья 2.35]
продукция (product): Результат процесса. [ИСО 9000:2005, статья 3.4.2]
3.31
Примечание — В рамках стандартов стерилизации продукция — это нечто материальное и может являться сырьем, промежуточным продуктом, сборочным узлом и медицинским изделием.
3.32 семейство продуктов (productfamily): Группа или подгруппа продукции со схожими характеристиками по массе, материалу, конструкции (строению), формам, полостям и/или упаковке и которая представляет схожую сопротивляемость процессу стерилизации.
переаттестация (requalification): Повторение валидации или ее части с целью подтверждения надежности процесса.
[ИСО/ТС 11139:2006, статья 2.40]
3.33
3.34
определять, специфицировать (specify): Подробно описывать в утвержденном документе. [ИСО/ТС 11139:2006, статья 2.42]
3.35 логарифмическое сокращение спор ЛСС (spore log reduction, SLR): фактор, выраженный как десятичный логарифм, характеризующий сокращение численности спор на биологическом индикаторе в результате выдержки в установленных условиях.
Примечание — ЛСС рассчитывается как разница логарифма от начальной популяции спор и логарифма от конечной популяции спор на биологическом индикаторе следующим образом:
SLR = log N0 - log A/u,
где N0 — начальная популяция;
A/u — конечная популяция.
Если A/u равна нулю, то настоящее ЛСС невозможно вычислить. Если А/и предположительно равна 1 в рамках расчетов, ЛСС будет больше, чем log N0.
Стерильный (sterile): Не содержащий жизнеспособных микроорганизмов. [ИСО/ТС 11139:2006, статья 2.43]
3.36
система стерилизационного барьера (sterile barrier system): Минимальная упаковка, препятствующая прониканию микроорганизмов и позволяющая сохранять асептические условия внутри упаковки до момента использования продукции по назначению.
[ИСО/ТС 11139:2006, статья 2.44]
3.37
7
3.38
стерильность (sterility): Состояние, характеризующееся отсутствием жизнеспособных микроорганизмов.
Примечание — На практике невозможно доказать абсолютное отсутствие микроорганизмов. См. термин «стерилизация» (3.40).
[ИСО/ТС 11139:2006, статья 2.45]
уровень обеспечения стерильности, УОС (sterility assurance level, SAL): Вероятность возникновения жизнеспособного микроорганизма на единице продукции после стерилизации.
Примечание — Термин УОС имеет количественное значение, как правило, 10-6 или 10-3. При применении данного количественного значения к обеспечению стерильности, УОС, равный 10-6, имеет более низкое значение, но обеспечивает более высокий уровень стерильности, чем УОС, равный 10“3.
[ИСО/ТС 11139:2006, статья 2.46]
3.39
стерилизация (sterilization): Валидированный процесс, применяемый для освобождения продукта от всех жизнеспособных микроорганизмов.
Примечание — В процессе стерилизации природа гибели микроорганизмов описывается экспоненциальной функцией и, следовательно, выживание микроорганизма на отдельном изделии может быть выражено с помощью вероятности. Несмотря на то, что вероятность может быть снижена до очень малых чисел, она никогда не может быть доведена до нуля. См. термин «уровень обеспечения стерильности» (3.39).
[ИСО/ТС 11139:2006, статья 2.47]
3.40
3.41
стерилизационная загрузка (sterilization load): Продукция, которая должна подвергнуться (или уже подверглась) совместной стерилизации в определенном стерилизационном процессе.
Примечание — В процессах обработки горячим воздухом, стерилизационная загрузка может подвергаться депирогенизации (см. 3.10) в конкретной стерилизационной системе (см. 3.43).
[ИСО/ТС 11139:2006, статья 2.48]
процесс стерилизации (sterilization process): Последовательность действий или операций для достижения установленных требований к стерильности.
Примечание — Данная последовательность действий включает предварительную обработку изделия (при необходимости), выдержку в установленных условиях в стерилизующем агенте и любую необходимую последующую обработку. Процесс стерилизации не включает такие операции, как очистка, дезинфекция или упаковка, предшествующие стерилизации.
[ИСО/TS 11139:2006, статья 2.49]
3.42
3.43 стерилизационная система (sterilization system): Стерилизатор и вспомогательное (сопутствующее) оборудование, предназначенное для проведения процесса стерилизации.
Примечание — В рамках процессов обработки горячим воздухом, стерилизационная система может применяться для проведения депирогенизации (3.10).
3.44
стерилизующий агент (sterilizing agent): Физическое или химическое вещество или комбинация таких веществ, обладающие достаточной микробоцидной активностью для достижения стерильности в заданных условиях.
[ИСО/ТС 11139:2006, статья 2.50]
ГОСТ Р ИСО 20857-2016
кривая выживания (survivor curve): Графическое изображение инактивации популяции микроорганизмов с увеличением воздействия микробоцидного агента при установленных условиях. [ИСО/ТС 11139:2006, статья 2.51]
кривая выживания (survivor curve): Графическое изображение инактивации популяции микроорганизмов с увеличением воздействия микробоцидного агента при установленных условиях. [ИСО/ТС 11139:2006, статья 2.51]
3.45
финишная стерилизация (terminal sterilization): Процесс, в котором продукт подлежит стерилизации внутри своей системы стерилизационного барьера.
[ИСО/ТС 11139:2006, статья 2.52]
3.46
валидация (validation): Документированная процедура получения, регистрации и интерпретации результатов, необходимая для подтверждения того, что по завершении процесса будет воспроизводимо получаться продукция, соответствующая заранее определенным техническим требованиям. [ИСО/ТС 11139:2006, статья 2.55]
3.47
3.48 величина z (z-value): температурное изменение, необходимое для уменьшения величины D
в 10 раз, выраженное в градусах Цельсия.
Примечание — Величина z является мерой того, как меняется реакция микроорганизма на обработку теплом при температурных изменениях. Величина z может быть рассчитана с помощью следующего уравнения:
1°9ю 1°9ю
где — наиболее низкая из температур;
Т2 — наиболее высокая из температур;
D1 — величина D, полученная при Т1;
D2 — величина D, полученная при Т2.
4 Элементы системы менеджмента качества4.1 Документирование
4.1.1 Устанавливаются процедуры для каждого этапа разработки, валидации, текущего контроля и выпуска продукта после стерилизации.
4.1.2 Документация и записи, требуемые настоящим стандартом, анализируются и утверждаются специально назначенным персоналом (см. 4.2.1). Документация и записи контролируются согласно соответствующим разделам ИСО 13485.
4.2 Ответственность руководства
4.2.1 Должны быть определены полномочия и ответственность за осуществление и соответствие требованиям, описанным в настоящем стандарте. Ответственность должна быть возложена на компетентный персонал, согласно соответствующим разделам ИСО 13485.
4.2.2 Если требования настоящего стандарта выполняются разными организациями с независимыми системами менеджмента качества, ответственность и полномочия каждой из данных организаций должны быть определены.
4.3 Реализация продукции
4.3.1 Должны быть определены процедуры закупок. Эти процедуры должны быть выполнены согласно соответствующим разделам ИСО 13485.
4.3.2 Должны быть определены процедуры идентификации и отслеживания продукции. Эти процедуры должны быть выполнены согласно соответствующим разделам ИСО 13485.
4.3.3 Должны быть определена система, отвечающая требованиям соответствующих разделов ИСО 13485 или ИСО 10012, для калибровки всего оборудования, включая контрольно-измерительную аппаратуру для проведения испытаний, используемую для определения соответствия требованиям настоящего стандарта.
9
4.4 Измерения, анализ и улучшение — Контроль несоответствующей продукции
Должны быть определены процедуры контроля продукции, признанной несоответствующей, а также процедуры для коррекции, корректирующих и предупреждающих действий. Такие процедуры должны отвечать требованиям соответствующих разделов ИСО 13485.
5 Описание стерилизующего агента
5.1 Стерилизующий агент
В качестве стерилизующего агента в настоящем стандарте применяется горячий воздух.
5.2 Микробоцидная эффективность
Данные о микробоцидной эффективности горячего воздуха и о его применении в процессах стерилизации документированы и доступны в научных литературных источниках. См., например, Пфлюг и Холкомб. Если горячий воздух применяется за пределами общепринятых условий, то его микробоцидная эффективность должна быть доказана.
5.3 Воздействие на материалы
Влияние выдержки в горячем воздухе на физические и химические свойства материалов и на их биологическую безопасность оценивается в соответствии с требованиями разделов 6 и 7. Во время данного исследования выявляется влияние скорости и диапазона изменения температуры.
5.4 Воздействие на окружающую среду
Считается, что горячий воздух не имеет существенного воздействия на окружающую среду; тем не менее, оценивается возможное влияние процесса стерилизации на окружающую среду и определяются меры, необходимые для обеспечения защиты окружающей среды. Такая оценка, включающая возможные последствия (если они могут возникнуть) и средства контроля (если они определены), должна быть документирована.
6 Описание процесса и оборудования
6.1 Описание процесса
Определяется процесс воздушной стерилизации. Требования к процессу должны включать:
a) параметры процесса и их допуски;
b) требования к обработке продукции перед стерилизацией, если такая обработка необходима с целью обеспечения эффективности процесса стерилизации;
c) расположение контрольной точки для измерения температуры.
6.2 Описание оборудования
6.2.1 Требования к оборудованию
Определяется стерилизационная система.
6.2.2 Идентификация
Стерилизационная система должна быть промаркирована несмываемой краской и содержать следующий минимум информации на языке потребителя:
a) наименование и адрес производителя;
b) серийный номер или другой идентификационный номер;
c) минимальное и максимальное значение рабочей температуры;
d) штамп контролирующего органа и опознавательный знак сосуда (если требуется).
6.2.3 Безопасность
Соответствие стерилизационной системы требованиям по безопасности, установленным в IEC 61010-1, IEC 61010-2-040 и любых других стандартах или нормативных требованиях, действующих в стране использования, должно быть документировано.
6.2.4 Руководства и инструкции
Должен быть доступен следующий минимум информации о каждой определенной стерилизационной системе:
a) инструкции, облегчающие безопасный и эффективный монтаж;
b) перечень материалов изготовления;
c) инструкции по эксплуатации, включая температурные пределы и меры предосторожности;
d) инструкции и графики текущего профилактического обслуживания;
e) инструкции и руководства по ремонту;
f) рисунки с изображением конфигурации и аппаратуры, трубопроводов и систем контроля;
д) перечень запасных частей с учетом всех значимых компонентов;
h) схема контроля процесса и/или документация на программное обеспечение, необходимые для эксплуатации и обслуживания.
6.2.5 Энергоисточники
6.2.5.1 Газы должны быть определены и установленные требования должны обеспечивать должный уровень степени безопасности и качества продукции и функционирование стерилизационной системы согласно предназначению.
6.2.5.2 Устанавливаются требования к подаче электропитания.
Примечание — Как правило, требования к подаче электропитания устанавливаются производителем стерилизатора или сопутствующего оборудования. Соответствие данным требованиям подтверждается при аттестации монтажа (см. 9.2).
6.2.6 Компоненты
Материалы и компоненты стерилизационной системы не должны способствовать микробиологической или химической контаминации стерилизационной системы.
6.2.7 Вспомогательное оборудование
6.2.7.1 Носитель, поддерживающий продукт внутри стерилизационной системы, должен быть разработан так, чтобы способствовать равномерному прониканию тепла и/или теплопередаче. Он также должен поддерживать целостность стерилизационной загрузки.
6.2.7.2 Должны быть определены способы охлаждения стерилизационной системы и удаления отработанных газов.
6.2.7.3 Если стерилизационная система связана с или расположена внутри контролируемой среды, то должна быть установлена соответствующая фильтрация поступающих и/или отработанных газов.
6.2.7.4 Если стерилизационная система оборудована системой принудительной циркуляции воздуха, то должны быть определены методы циркуляции.
6.2.8 Системы контроля и регистрации (данных)
6.2.8.1 Стерилизационная система должна быть снабжена аппаратурой для контроля, мониторинга и регистрации следующих переменных процесса:
a) температуры (в воздушном стерилизаторе и/или стерилизационной загрузке, соответственно);
b) времени выдержки;
c) скорости конвейерной системы, если имеется;
d) давления и воздушного потока, если имеется;
е) скорости/степени изменения температуры, если это влияет на целостность продукции.
6.2.8.2 Система контроля процесса и система регистрации данных должны быть либо независимыми, либо разработаны так, чтобы появлялся предупреждающий сигнал, если разница между измеренным параметром процесса и зарегистрированным параметром процесса превышает установленный предел.
6.2.8.3 Система контроля и система регистрации данных должны включать способ определения несрабатывания датчика.
6.2.8.4 Должны быть предусмотрены методы для предотвращения внесения неправомерных изменений в установленные режимы процесса и для выбора корректного режима процесса стерилизации.
6.2.8.5 Программное обеспечение должно быть определено с помощью целевой проверки и должно сопровождаться документацией, подтверждающей его валидацию.
6.2.8.6 Точность инструментов, применяемых в процессах разработки, валидации и текущего мониторинга и контроля, должна быть установлена так, чтобы можно было доказать достижение контролируемых параметров процесса.
6.2.8.7 Датчики температуры и там, где это применимо, воздушного потока или давления, должны быть выбраны, установлены и использоваться таким образом, чтобы гарантированно поддерживать заявленную (установленную) точность.
6.2.9 Программы контроля
6.2.9.1 Если для выполнения и контроля процесса стерилизации используются микропроцессоры или электромеханические программы, то они должны быть документированы и валидированы. Корректность программной схемы как при моделировании использования, так и при фактическом использовании, должна быть доказана.
11
6.2.9.2 Изменения, вносимые в подобные программы, должны быть оценены, и результаты оценки зарегистрированы (см. 4.1.2 и 12.5).
7 Определение продукта7.1 Общая информация
Примечание — Цель определения продукта — выявить продукт, подлежащий стерилизации/депироге-низации, а также качество продукта до стерилизации/депирогенизации и способ его упаковки и подготовки к стери-лизации/депирогенизации.
Определяется продукт, подлежащий стерилизации/депирогенизации. Изменения продукта, упаковки или конфигурации продукции внутри упаковки, должны быть указаны (см. 12.5.2).
7.2 Безопасность и рабочие характеристики продукта
7.2.1 Должны быть определены любые необходимые виды обработки продукта перед процессом стерилизации/депирогенизации, такие как очистка, мойка, смазка или дезинфекция.
7.2.2 Должно быть доказано соответствие продукта и его упаковки требованиям безопасности, качества и эксплуатации после применения определенного процесса стерилизации/депирогенизации с наиболее трудно достижимыми для продукта параметрами процесса. Если допускается многократная выдержка в процессах стерилизации/депирогенизации, то влияние таких обработок, оказываемое на продукт и его упаковку, должно быть проанализировано, чтобы убедиться вотсутствии неблагоприятных последствий.
Это может достигаться с помощью применения системы менеджмента качества, соответствующей требованиям ИСО 13485 в процессе производства медицинского изделия или с помощью применения определенного и контролируемого процесса очистки с доказанной эффективностью, совместно с процессом дезинфекции (если требуется) перед стерилизацией, а затем, предотвращая реконтаминацию данного медицинского изделия.
Примечание 1 — Существуют опубликованные стандарты на оборудование, используемое при очистке и дезинфекции медицинских изделий (ИСО 15883), включающие методы доказательства эффективности процессов очистки и дезинфекции.
Примечание 2 — В сфере здравоохранения пользователи многоразовых медицинских изделий должны следовать инструкциям производителя по их обработке, если они независимо не валидировали альтернативный подход.
7.3 Требования купаковке
7.3.1 Должны быть определены упаковочные материалы и способы упаковки.
7.3.2 Если упаковочные материалы используются в процессе стерилизации/депирогенизации, то они должны быть совместимы с условиями данных процессов стерилизации/депирогенизации.
7.3.3 Упаковка должна защищать продукт от физических повреждений и поддерживать стерильность продукта до его использования.
7.3.4 Упаковка должна соответствовать требованиям ИСО 11607-1 и ИСО 11607-2.
7.3.5 Упаковка для продукции с пометкой «стерильно» должна состоять, как минимум, из системы стерилизационного барьера.
7.4 Микробиологическое качество
7.4.1 Должна быть определена и далее поддерживаться система, доказывающая, что биологическое качество и чистота продукта, подлежащего стерилизации/депирогенизации, находятся под контролем и не ставят под угрозу эффективность процесса стерилизации/депирогенизации.
7.4.2 Должна быть доказана эффективность системы, определенная п. 7.4.1. Для медицинских изделий, поставляемых для однократного использования, подобное доказательство должно включать оценку бионагрузки в определенном интервале в соответствии с ИСО 11737-1. Для многоразовых медицинских изделий, подобное доказательство должно включать оценку эффективности определенного процесса очистки и, при необходимости, дезинфекции. Оно также должно включать оценку (анализ) органической и неорганической контаминации.
Примечание — Требования к информации, которая должна быть предоставлена о повторной обработке многоразовых изделий, приведены в ИСО 17664. Цель заключается в том, чтобы бионагрузка была стабильно низкой, принимая во внимание свойства сырья, продукта и процедур производства и обработки перед стерилизацией.
ГОСТ Р ИСО 20857-20167.5 Семейство продуктов
При необходимости должны быть определены критерии отнесения продукта к определенному семейству продуктов. Семейство продуктов, к которому был отнесен продукт, а также его упаковочная система, должны быть зарегистрированы (см. 4.1.2).
7.6 Биологическая безопасность
Биологическая безопасность продукта после выдержки в процессе стерилизации должна быть доказана в соответствии с требованиями ИСО 10993-1.
Примечание — Оценка биологической совместимости или биологической безопасности медицинского изделия, как правило, выполняется производителем продукта перед его выпуском.
8 Определение процесса
Примечание — Целью определения процесса является получение детальных технических условий процесса стерилизации/депирогенизации, применяемого к определенному продукту (см. раздел 7) без угрозы для безопасности, качества и рабочих характеристик данного продукта.
8.1 Должен быть определен метод, который будет использоваться для утверждения процесса стерилизации. Данный метод должен быть одним из описанных в приложениях В, С или D, или альтернативный метод эквивалентной эффективности. Использование данного метода должно обеспечить доказательства того, что при применении указанного процесса стерилизации, установленный заранее уровень обеспечения стерильности (SAL) будет достигнут.
Должен быть определен метод, который будет использоваться для утверждения процесса депирогенизации. Использование данного метода должно обеспечить доказательства того, что при применении указанного процесса депирогенизации требуемый уровень депирогенизации будет достигнут.
8.2 Должны быть установлены параметры процесса и их допуски для процессов стерилизации/ депирогенизации. Наиболее низкий допуск основан на минимальных эффективных параметрах процесса, установленных при определении процесса. Верхние допуски должны быть выбраны с целью обеспечения поддержания безопасности, качества и рабочих характеристик продукта.
Примечание — некоторые продукты могут быть изготовлены из материалов, обладающих высокой стойкостью к температурам процессов воздушной стерилизации (например, стекло, металл). Следовательно, допуски к параметрам процесса для изделий из таких материалов могут иметь широкий диапазон.
8.3 Должен быть установлен требуемый уровень обеспечения стерильности (SAL), необходимый для достижения в процессе стерилизации конкретного продукта.
8.4 Для процессов стерилизации, основанных на бионагрузке, бионагрузка должна быть определена в соответствии с требованиями ИСО 11737-1, а также должно проводится исследование резистентности микроорганизмов, из которых состоит бионагрузка. Должна быть установлена частота определений бионагрузки с целью выявления существенных изменений в бионагрузке. При исследовании резистентности микроорганизмов, из которых состоит бионагрузка, должно проводится испытание на стерильность в соответствии с требованиями ИСО 11737-2.
8.5 Если для определения процесса стерилизации используются биологические индикаторы, то они должны соответствовать требованиям ИСО 11138-1 и ИСО 11138-4.
8.6 Если для определения процесса стерилизации используются химические индикаторы, то они должны соответствовать требованиям ИСО 11140-1.
8.7 Если для определения процесса стерилизации используется устройство контроля процесса (УКП), то приемлемость УКП должна быть доказана и зарегистрирована (см. 4.1.2).
8.8 Если тесты на стерильность выполняются как часть утверждения процесса стерилизации, то они должны соответствовать требованиям ИСО 11737-2.
8.9 Должна быть проведена оценка рисков для здоровья в соответствии с ИСО 10993-17, с целью определения и установления пороговых значений отдельных субстанций, связанных с процессом стерилизации.
8.10 Если применение процесса воздушной стерилизации также предполагает достижение депирогенизации, то должно быть доказано сокращение эндотоксинов до соответствующего установленного уровня. Уместность уровня сопротивляемости эндотоксинов, применимого для разработки или валидации процесса депирогенизации, должна быть доказана.
Примечание — Следует принимать во внимание национальные или международные требования к сокращению эндотоксинов (см. А.8.10 и А.9.4.4 для дополнительных справок).
13
Содержание
1 Область применения...................................................1
1.1 Включения......................................................1
1.2 Исключения.....................................................1
2 Нормативные ссылки..................................................2
3 Термины и определения................................................3
4 Элементы системы менеджмента качества....................................9
4.1 Документирование.................................................9
4.2 Ответственность руководства..........................................9
4.3 Реализация продукции..............................................9
4.4 Измерения, анализ и улучшение-Контроль несоответствующей продукции...........10
5 Описание стерилизующего агента.........................................10
5.1 Стерилизующий агент..............................................10
5.2 Микробоцидная эффективность.......................................10
5.3 Воздействие на материалы..........................................10
5.4 Воздействие на окружающую среду.....................................10
6 Описание процесса и оборудования........................................10
6.1 Описание процесса...............................................10
6.2 Описание оборудования............................................10
7 Определение продукта.................................................12
7.1 Общая информация...............................................12
7.2 Безопасность и рабочие характеристики продукта............................12
7.3 Требования к упаковке.............................................12
7.4 Микробиологическое качество........................................12
7.5 Семейство продуктов..............................................13
7.6 Биологическая безопасность.........................................13
8 Определение процесса................................................13
9 Валидация........................................................14
9.1 Общая информация...............................................14
9.2 Аттестация монтажа...............................................14
9.3 Аттестация функционирования........................................14
9.4 Аттестация эксплуатируемого оборудования...............................14
9.5 Дополнительные стерилизационные системы...............................16
9.6 Анализ и утверждение валидации......................................16
10 Текущий мониторинг и контроль..........................................16
10.1 Текущий контроль................................................16
10.2 Текущий мониторинг..............................................16
10.3 Точки мониторинга процесса.........................................17
11 Выпуск продукта после стерилизации/депирогенизации...........................17
12 Поддержание эффективности процесса.....................................18
12.1 Общая информация..............................................18
9 Валидация9.1 Общая информация
9.1.1 Должны быть определены процедуры процесса валидации. Должна быть выполнена аттестация монтажа, аттестация функционирования и аттестация эксплуатируемого оборудования.
9.1.2 Оборудование, применяемое для измерений и/или регистрации параметров процесса, должно быть откалибровано (см. 4.3.3).
9.2 Аттестация монтажа
9.2.1 IQ должна показать, что стерилизационная система была установлена в соответствии с техническими требованиями. Доказательствами данного факта являются:
a) соответствие оборудования техническим условиям после монтажа;
b) соответствие коммунальных услуг и сервисного обслуживания установленным требованиям (см. 6.2.5).
9.2.2 Кроме того, следующие позиции анализируются, утверждаются и документируются:
a) конструкция оборудования;
b) печати, рисунки и руководства;
c) программное обеспечение, если оно применяется;
d) программы калибровки, профилактического обслуживания и очистки.
9.3 Аттестация функционирования
9.3.1 OQ должна показывать, что установленная стерилизационная система, включая системы контроля и регистрации и программы контроля, эксплуатируется согласно инструкциям.
9.3.2 OQ должна проводится при пустой стерилизационной системе или при системе, содержащей подходящий для испытаний материал. OQ включает:
a) доказательство того, что параметры процесса (например, температура, время, воздушный поток, давление) находятся внутри пределов, установленных для определенного используемого пространства;
b) доказательство того, что запрограммированные стерилизационные циклы работают согласно установкам;
c) доказательство того, что оборудование, такое как сигнализация, контроллеры установленных параметров, устройства безопасности, системы мониторинга и дверные блокировки, эксплуатируется согласно инструкциям (техническим условиям);
d) подтверждение взаимосвязи между установленными контрольными значениями и измеренными параметрами процесса;
e) проверка документации по учету выполняемых процедур стерилизационной системы.
9.4 Аттестация эксплуатируемого оборудования9.4.1 Общая информация
9.4.1.1 PQ должна проводиться при наличии стерилизационной загрузки в стерилизационной системе.
PQ должна проводиться при внедрении нового или измененного продукта, упаковки, конфигурации загрузки, оборудования или параметров процесса, если предварительно не была доказана их эквивалентность ранее валидированному продукту, упаковке, конфигурации загрузки или оборудованию. Доказательство эквивалентности должно документироваться (см. 4.1.2).
9.4.1.2 PQ должна показывать, что в процессе стерилизации (и, при необходимости, процесс депирогенизации) постоянно оказывается воздействие на продукт.
9.4.1.3 Стерилизационная загрузка, используемая при PQ, должна представлять наиболее трудно стерилизуемую конфигурацию загрузки, которая подлежит текущей стерилизации.
9.4.1.4 Продукт, используемый для PQ, должен быть упакован также, как продукт, подлежащий текущей стерилизации.
9.4.1.5 PQ должна включать не менее трех последовательных успешных фактов выдержки продукта в процессе стерилизации/депирогенизации, внутри определенных допусков, с целью доказательства воспроизводимости процесса. Результаты PQ, выходящие за пределы определенных допусков, должны быть проанализированы, а корректирующие действия должны быть определены и предприняты перед началом новой последовательности выдержек.
Должно быть обязательно проведены три успешных выдержки подряд, за исключением случаев, когда результаты исследований, выходящие за пределы установленных допусков, являются следствием факторов, не имеющих отношения к эффективности валидируемого процесса. Такие результаты
12.2 Повторная калибровка.............................................18
12.3 Обслуживание оборудования........................................18
12.4 Переаттестация.................................................18
12.5 Оценка изменений...............................................18
Приложение А (справочное) Руководство по применению настоящего стандарта.............19
Приложение В (справочное) Определение процесса, основанное на инактивации микробной
популяции в ее естественном состоянии (метод/подход, основанный на бионагрузке) 36
Приложение С (нормативное) Определение процесса, основанное на инактивации контрольных микроорганизмов и знании бионагрузки (комбинированный метод бионагрузки/
биологического индикатора).....................................37
Приложение D (справочное) Консервативное определение процесса, основанное на инактивации
контрольных микроорганизмов (метод полной гибели)....................39
Приложение Е (справочное) Разработка процесса................................41
Приложение DA (справочное) Сведения о соответствии ссылочных международных стандартов
национальным стандартам Российской Федерации......................43
Библиография........................................................44
IV
Введение
Стерильное медицинское изделие — это медицинское изделие, которое не содержит жизнеспособных микроорганизмов. Стандарты, определяющие требования к разработке, валидации и текущему контролю процессов стерилизации требуют, чтобы при необходимости поставки стерильного медицинского изделия, вероятность его случайной микробиологической контаминации до процесса стерилизации была сведена к минимуму. Несмотря на то, что медицинские изделия изготавливаются в производственных условиях, соответствующих требованиям систем менеджмента качества (см., например ИСО 13485), они могут быть обсеменены микроорганизмами. Такие медицинские изделия не являются стерильными. Целью стерилизации является инактивация микробиологических контаминантов и, таким образом, преобразование нестерильных медицинских изделий в стерильные.
Кинетика инактивации чистой культуры микроорганизмов физическими и/или химическими методами, применяемыми для стерилизации медицинских изделий, обычно описывается экспоненциальным соотношением между числом выживших микроорганизмов и степенью их обработки стерилизующим агентом; неизбежно, это означает постоянное наличие определенной вероятности выживания микроорганизмов вне зависимости от степени проведенной обработки. Для каждой конкретной обработки вероятность выживания определяется количеством и резистентностью микроорганизмов, а также условиями среды, в которой организмы находятся во время обработки. Отсюда следует, что невозможно гарантировать стерильность любого единичного медицинского изделия из совокупности изделий, подвергнутых стерилизационной обработке, а стерильность совокупности обработанных изделий выражается как вероятность присутствия на изделии жизнеспособного микроорганизма.
Настоящий стандарт устанавливает требования, следуя которым может быть осуществлен процесс воздушной стерилизации, при котором достигается стерильность медицинских изделий за счет достаточной микробоцидной активности. Настоящий стандарт также устанавливает требования, следуя которым, может быть осуществлен процесс депирогенизации за счет разрушения пирогенного бактериального материала. Кроме того, соответствие требованиям данного стандарта позволяет с достаточной степенью достоверности заявлять о низкой вероятности присутствия жизнеспособных организмов на поверхности продукта после его обработки. Условия такой вероятности устанавливаются управляющими органами и могут варьировать, в зависимости от страны (см. ЕН 556-1 и ANSI/AAMIST67).Также, вероятность присутствия пирогенного материала на поверхности продукта после его обработки в процессе депирогенизации, будет незначительна.
Общие требования к системам менеджмента качества для проектирования, разработки, производства, монтажа и обслуживания медицинских изделий даны в ИСО 9001, а также некоторые требования к системам менеджмента качества производства медицинских изделий даны в ИСО 13485. Стандарты систем менеджмента качества признают, что эффективность некоторых процессов, применяемых при производстве или повторной обработке, не может быть полностью проверена последующим осмотром и испытанием изделия. Стерилизация и депирогенизация являются примерами таких процессов. По этой причине процессы стерилизации и депирогенизации валидируются с целью их дальнейшего применения, подлежат регулярному текущему мониторингу, а применяемое в процессах оборудование надлежащим образом обслуживается.
Выдержка изделия в валидированном и четко контролируемом процессе стерилизации не является гарантией стерильности обработанного медицинского изделия и, как следствие, гарантией его безопасного использования по назначению. Таким образом, следует уделить внимание еще нескольким факторам, включающим:
a) микробиологический статус получаемых сырьевых материалов и/или компонентов;
b) валидацию и текущий контроль любых процедур очистки и дезинфекции продукта;
c) контроль среды, в которой продукт производится, собирается и упаковывается;
d) контроль оборудования и технологических процессов;
e) контроль персонала и его гигиены;
f) способы упаковки и материалы, в которые продукт упаковывается;
д) условия хранения продукта.
Данные факторы также должны учитываться для обеспечения гарантии депирогенизации.
Типы контаминации продуктов, подлежащих стерилизации, могут различаться, что оказывает влияние на эффективность процесса стерилизации или депирогенизации. Изделие, использованное в учреждениях здравоохранения и направляемое на повторную стерилизацию согласно инструкциями производителя (см. ИСО 17664), должно рассматриваться как особый случай. Существует вероятность наличия на таком изделии большого количества контаминирующих микроорганизмов и остаточных неорганических и/или органических загрязнений, несмотря на предварительное проведение очистки.
Следовательно, необходимо уделять особое внимание валидации и контролю процессов очистки и дезинфекции, проводимых при повторной обработке.
Требования составляют нормативные части настоящего стандарта, соответствие которому должно подтверждаться. Руководство, представленное в справочных приложениях, не является нормативным и не должно использоваться в качестве контрольного списка для аудиторов. Руководство содержит разъяснения и описания методов, которые являются приемлемыми средствами достижения соответствия требованиям. Возможно применение методов, не представленных в руководстве, если они эффективны для достижения соответствия требованиям данного международного стандарта.
Разработка, валидация и текущий контроль процесса стерилизации и/или депирогенизации включают ряд отдельных, но взаимосвязанных действий, таких, например, как калибровка, техническое обслуживание, определение продукта, определение процесса, аттестация монтажа (IQ), аттестация функционирования (OQ) и аттестация эксплуатируемого оборудования (PQ). Несмотря на то, что действия, требуемые настоящим стандартом, были сгруппированы и представлены в определенном порядке, данный стандарт не требует, чтобы эти действия выполнялись именно в том порядке, в котором они представлены. Требуемые действия не обязательно должны выполняться последовательно, так как программы разработки и валидации могут быть итеративными (повторяющимися). Возможно, выполнение данных действий вовлечет несколько лиц и/или организаций, которые будут самостоятельно выполнять одно или несколько конкретныхдействий. В настоящем стандарте не уточняются конкретные лица или организации, которые должны выполнять данные действия.
VI
Поправка к ГОСТ Р ИСО 20857-2016 Стерилизация медицинской продукции. Горячий воздух. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
|
В каком месте |
Напечатано |
Должно быть |
|
С. 1. Область примене- |
юбкомендации |
рекомендации |
|
ния. Пункт 1.1.1. Примечание | ||
|
(ИУС № 9 2016 г.) |
1
ГОСТ Р ИСО 20857-2016
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Стерилизация медицинской продукции
ГОРЯЧИЙ ВОЗДУХ
Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
Sterilization of medical devices. Dry heat.
Requirements for development, validation and routine control of a sterilization process for medical devices
Дата введения — 2017—03—01
1 Область применения
1.1 Включения
1.1.1 Настоящий стандарт определяет требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий горячим воздухом.
Примечание — Несмотря на то, что область применения настоящего стандарта ограничивается медицинскими изделиями, описанные в нем требования и приведенные юбкомендации могут применяться к иной медицинской продукции.
1.1.2 Несмотря на то, что в настоящем стандарте речь идет, прежде всего, о стерилизации горячим воздухом, в нем также приведены требования и руководство в отношении процессов депирогенизации с применением горячего воздуха.
Примечание — Горячий воздух часто применяется для депирогенизации оборудования, изделий и медицинской продукции, и его эффективность в данном процессе была доказана. Параметрами процесса стерилизации и/или депирогенизации являются время и температура. Поскольку требования к условиям для эффективной депирогенизации гораздо более строгие, чем к условиям стерилизации, процесс, валидированный для депирогенизации продукции, по умолчанию обеспечивает стерильность продукции, и его дополнительная валидация не требуется.
1.2 Исключения
1.2.1 Настоящий стандарт не определяет требования к разработке, валидации и текущему контролю процесса инактивации болезнетворных агентов, вызывающих спонгиформные энцефалопатии, такие как скрепи, спонгиформная энцефалопатия крупного рогатого скота и болезнь Крейцфель-да Якоба.
Примечание — См. также ИСО 22442-1, ИСО 22442-2 и ИСО 22442-3.
1.2.2 Настоящий стандарт не применяется к процессам с использованием инфракрасного излучения или микроволн в качестве нагревателей.
1.2.3 Настоящий стандарт не содержит детальных описаний установленных требований для определения медицинского изделия как «стерильное».
Примечание — Необходимо учитывать национальные или региональные требования для определения медицинского изделия как «стерильное». См., например, ЕН 556-1 или ANSI/AAMIST67.
1.2.4 Настоящий стандарт не определяет систему менеджмента качества, применяемую для контроля на всех стадиях производства медицинских изделий.
Издание официальное
Примечание — Наличие полноценной системы менеджмента качества в процессе производства изделий не является требованием настоящего стандарта, но нормативные ссылки на минимальные, необходимые для контроля процесса стерилизации элементы системы менеджмента качества, приводятся в соответствующих частях текста (см., в частности, раздел 4).Следует принимать во внимание стандарты, содержащие требования к системам менеджмента качества (см. ИСО 13485), которые контролируют все этапы производства медицинских изделий, включая процессы стерилизации. Региональные и национальные положения о поставках медицинских изделий могут требовать внедрения полноценной системы менеджмента качества и ее оценку третьими лицами.
1.2.5 Настоящий стандарт не определяет требования к охране труда, связанные с конструкцией и эксплуатацией помещений, в которых проводятся процессы воздушной стерилизации и/или депирогенизации.
Примечание — Требования к производственной безопасности приведены в МЭК 61010-2-040. В некоторых странах существуют дополнительные внутренние правила по безопасности.
2 Нормативные ссылки
Ниже приведены ссылки на документы, обязательные для применения данного стандарта. Если ссылка датирована, используется только указанная в ссылке редакция. Если ссылка не датирована, используется последняя редакция документа, на который дана ссылка (включая любые изменения и поправки).
ИСО 10012 Менеджмент организации. Системы менеджмента измерений. Требования к процессам измерений и измерительному оборудованию (ISO 10012, Measurement management systems — Requirements for measurement processes and measuring equipment)
ИСО 10993-1 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования (ISO 10993-1, Biological evaluation of medical devices — Part 1: Evaluation and testing within a risk management process)
ИСО 10993-17 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ (ISO 10993-17, Biological evaluation of medical devices — Part 17: Establishment of allowable limits for leachable substances)
ИСО 11138-1:2006 Стерилизация медицинской продукции. Биологические индикаторы. Часть 1.Общие требования (ISO 11138-1:2006, Sterilization of health care products — Biological indicators — Part 1: General requirements)
ИСО 11138-4:2006 Стерилизация медицинской продукции. Биологические индикаторы. Часть 4. Биологические индикаторы для стерилизации горячим воздухом (ISO 11138-4:2006, Sterilization of health care products — Biological indicators — Part 4: Biological indicators for dry heat sterilization processes)
ИСО 11140-1 Стерилизация медицинской продукции. Химические индикаторы. Часть 1. Общие требования (ISO 11140-1, Sterilization of health care products — Chemical indicators — Part 1: General requirements)
ИСО 11607-1 Упаковка медицинских изделий, подлежащих финишной стерилизации. Часть 1. Требования к материалам, барьерным системам для стерилизации и упаковочным системам (ISO 11607-1, Packaging for terminally sterilized medical devices — Part 1: Requirements for materials, sterile barrier systems and packaging systems)
ИСО 11607-2 Упаковка медицинских изделий, подлежащих финишной стерилизации. Часть 2. Требования к валидации процессов формирования, герметизации и сборки (ISO 11607-2, Packaging for terminally sterilized medical devices — Part 2, Validation requirements for forming, sealing and assembly processes)
ИСО 11737-1:2006 Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукте. (ISO 11737-1:2006, Sterilization of medical devices — Microbiological methods — Part 1: Determination of a population of microorganisms on products) ИСО 11737-2:2009 Стерилизация медицинских изделий. Микробиологические методы. Часть 2. Испытания на стерильность, проводимые при валидации процесса стерилизации (ISO 11737-2:2009, Sterilization of medical devices — Microbiological methods — Part 2: Tests of sterility performed in the validation of a sterilization process)
ИСО 13485 Изделия медицинские. Система менеджмента качества. Требования для регулирующих целей (ISO 13485, Medical devices — Quality management systems — Requirements for regulatory purposes)
МЭК 61010-1 Безопасность электрического оборудования для измерения, управления и лабораторного применения. Часть 1. Общие требования (IEC 61010-1, Safety requirements for electrical equipment for measurement, control, and laboratory use — Part 1: General requirements)
2
МЭК 61010-2-040 Безопасность электрического оборудования для измерения, управления и лабораторного применения. Часть 2-040. Дополнительные требования к стерилизаторам и моечным дезинфекторам, применяемым для обработки медицинских материалов (IEC 61010-2-040, Safety requirements for electrical equipment for measurement, control and laboratory use — Part 2-040: Particular requirements for sterilizers and washer-disinfectors used to treat medical materials)
3 Термины и определения
В настоящем стандарте применяются нижеследующие термины с соответствующими определениями:
3.1
партия (batch): Определенное количество изделий, являющихся или предполагаемых единообразными по характеру и качеству, которые были изготовлены в определенном цикле производства. [ИСО/ТС 11139:2006, статья 2.1]
3.2
бионагрузка (bioburden): Популяция жизнеспособных микроорганизмов на изделии или внутри изделия, и/или на системе стерилизационного барьера.
[ИСО/ТС 11139:2006, статья 2.2]
3.3
биологический индикатор; БИ (biological indicator, BI): Испытательная система, содержащая жизнеспособные микроорганизмы с определенной резистентностью (устойчивостью) к указанному процессу стерилизации.
[ИСО/ТС 11139:2006, статья 2.3]
3.4
калибровка (calibration): Последовательность операций, которые при определенных условиях устанавливают взаимосвязь между количественными значениями, показываемыми измерительным прибором или измерительной системой, или значениями, предоставляемыми измерениями материала или контрольным материалом, и соответствующими значениями, определяемыми стандартами. [ИСО/ТС 11139:2006, статья 2.4]
3.5
контроль (оценка) изменений (change control): Оценка и определение пригодности предложенного изменения к изделию (продукту) или процедуре.
[ИСО/ТС 11139:2006, статья 2.5]
3.6
химический индикатор, небиологический индикатор (chemical indicator, non-biological indicator): Испытательная система, обнаруживающая изменения в одной или нескольких предопределенных переменных процесса, основываясь на химических или физических изменениях, вызванных воздействием на нее процесса.
[ИСО/ТС 11139:2006, статья 2.6]
3.7
коррекция (correction): Действие, предпринятое для устранения обнаруженного несоответствия.
Примечание — Коррекция может предприниматься совместно с корректирующим действием (3.8). [ИСО 9000, статья 3.6.6]
3