ГОСТ Р ИСО 16256-2015
Клинические лабораторные исследования и диагностические тест-системы in vitro. Референтный метод для тестирования активности in vitro антимикробных препаратов в отношении дрожжевых грибов, вызывающих инфекционные заболевания
Описывает метод испытания чувствительности к антимикотическим препаратам дрожжевых культур, вызывающих инфекции, включая Candida spp. и Cryptococcus neoformans.
Идентичен ISO 16256:2012
Оглавление
1 Область применения
2 Термины и определения
3 Процедуры испытания
3.1 Общие положения
3.2 Питательная среда
3.3 Антимикотические препараты
3.4 Хранение планшетов для микроразведения
3.5 Приготовление инокулюма
3.6 Инокулирование планшетов для микроразведения
3.7 Инкубирование планшетов для микроразведения
3.8 Чтение результатов МПК
3.9 Интерпретация МПК
4 Контроль качества
Приложение А (справочное) Среда RPMI-1640
Приложение В (справочное) Стандарт мутности МакФарланда 0,5 (сульфат бария)
Приложение С (справочное) Допустимые сроки визуальной оценки для интерпретации МПК
Библиография
20 страниц
| Дата введения | 01.06.2016 |
|---|---|
| Добавлен в базу | 12.02.2016 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 27.04.2015 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 300-ст |
|---|---|---|---|
| Разработан | ООО Медтехстандарт | ||
| Издан | Стандартинформ | 2015 г. |
Clinical laboratory testing and in vitro diagnostic test systems. Reference method testing the in vitro activity of antimicrobial agents against yeast fungi involved in infectious diseases
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9
стр. 10

стр. 11

стр. 12
стр. 13
стр. 14
стр. 15
стр. 16
стр. 17
стр. 18

стр. 19

стр. 20
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ | |
|
НАЦИОНАЛЬНЫЙ |
ГОСТ Р исо |
|
(стандарт |
16256- |
|
V J РОССИЙСКОЙ |
2015 |
|
ФЕДЕРАЦИИ | |
КЛИНИЧЕСКИЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ И ДИАГНОСТИЧЕСКИЕ ТЕСТ-СИСТЕМЫ IN VITRO
Референтный метод для тестирования активности in vitro антимикробных препаратов в отношении дрожжевых грибов, вызывающих инфекционные заболевания
ISO 16256:2012 Clinical laboratory testing and in vitro diagnostic test systems — Reference method for testing the in vitro activity of antimicrobial agents against yeast fungi involved in infectious diseases
(IDT)
Издание официальное
Москва
Стандартинформ
2015
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Медтехстандарт» (ООО «Мед-техстандарт») на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 «Клинические лабораторные исследования и диагностические тест-системы in vitro»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 27 апреля 2015 г. № 300-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 16256:2012 «Клинические лабораторные исследования и диагностические тест-системы in vitro. Референтный метод для тестирования активности in vitro антимикробных препаратов в отношении дрожжевых грибов, вызывающих инфекционные заболевания» (ISO 16256:2012 «Clinical laboratory testing and in vitro diagnostic test systems — Reference method for testing the in vitro activity of antimicrobial agents against yeast fungi involved in infectious diseases»)
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ, 2015
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ Р ИСО 16256-20153.3.5 Приготовление тестовых планшетов для микроразведения в бульоне для прочтения с помощью спектрофотометра
3.3.5.1 Путь спектрофотометрического чтения
Рабочие растворы распределяют в 96-луночные плоскодонные одноразовые пластиковые планшеты для микроразведения по 100 мкп на лунку с двойной конечной концентрацией антимикотического препарата в растворе двойной концентрации.
При испытании каждого штамма для контроля роста должна быть включена как минимум одна лунка в каждом ряду, содержащая 100 мкп среды без антимикотического препарата. Также, для каждого испытуемого штамма, должна быть использована неинокулированная лунка, содержащая 200 мкл среды без антимикотического препарата, как лунка отрицательного контроля.
3.4 Хранение планшетов для микроразведения
Заполненные планшеты можно использовать сразу же, либо незамедлительно поместить в морозильную камеру в запечатанных пластиковых пакетах (CLSI метод, визуальное чтение: при температуре минус 70 °С до 6 мес; EUCAST метод, спектрофотометрическое чтение: при — 70 °С и ниже до 6 мес или при температуре минус 20 °С не более чем на один месяц). Допустимый срокхранения устанавливают на основании предписаний изготовителя лекарственного средства для отдельных соединений и в соответствии с допустимыми пределами КК (контроля качества). Планшеты не следует хранить в саморазмора-живающихся морозильных камерах и допускать их таяния. Антимиотические препараты не должны повторно замораживаться, так как повторные циклы замораживания — оттаивания ускоряют инактивацию некоторых антимикотических препаратов.
3.5 Приготовление инокулюма3.5.1 Общие положения
Стандартизация инокулюма необходима для точных и воспроизводимых тестов чувствительности методом разведения в бульоне.
Все изоляты должны быть пересеяны на неингибированную агаризованную среду в целях обеспечения чистоты и жизнеспособности.
3.5.2 Приготовление инокулюма для визуального чтения тестов
Инокулюм должен быть приготовлен путем отбора пяти колоний диаметром приблизительно 1 мм из 20-часовых (+2 ч) культур Candida spp. либо 46-часовых (+2 ч) культур С. neoformans. Колонии должны быть суспендированы в 5 мл стерильного 0,85 % физиологического раствора либо стерильной воды. Следует учесть, что у С. neoformans низкая скорость роста. Оптимальная температура для роста С. Neoformans составляет 30 °С.
Полученную суспензию перемешивают в течение 15 с, плотность клеток устанавливают спектрофотометрически путем добавления достаточного количества стерильного физиологического раствора либо стерильной воды до достижения оптической плотности, эквивалентной производственному стандарту 0,5 по МакФарланду (см. приложение В) при длине волны 530 нм. Эта процедура даст дрожжевую суспензию от 106 до 5 • 106 КОЕ/мл.
Заданную суспензию дрожжей перемешивают на вортексе, разбавляют 1 : 50 соответствующим вариантом среды бульона RPMI-1640 и повторно разбавляют 1 : 20 средой для получения конечного инокулюма двойной концентрации (103 до 5 -103 КОЕ/мл). Инокулюм (двойной концентрации) разводят 1:1, если лунки засеяны 100 мкл инокулюма, что приведет кжелаемому конечному количеству инокулюма от 0,5 • 103 до 2,5 • 103 КОЕ/мл.
3.5.3 Приготовление инокулюма для спектрофотометрического чтения тестов
Инокулюм должен быть приготовлен путем отбора пяти колоний диаметром приблизительно 1 мм из 18 — 24-часовых культур Candida spp. либо 46-часовых (+2 ч) культур С. neoformans. Колонии должны быть суспендированы в 5 мл стерильной дистиллированной воды.
Полученную суспензию перемешивают в течение 15 с, плотность клеток устанавливают спектрофотометрически путем добавления достаточного количества стерильного физиологического раствора либо стерильной воды до достижения оптической плотности, эквивалентной производственному стандарту 0,5 по МакФарланду (см. приложение В) при длине волны 530 нм. Эта процедура даст дрожжевую суспензию от 106до5 • 106 КОЕ/мл.
Заданную дрожжевую суспензию перемешивают на вортексе, разбавляют 1:10 стерильной дистиллированной водой для получения тестового инокулюма двойной концентрации (от 105 до 5 • 105 КОЕ/мл). Инокулюм (двойной концентрации) разводят 1:1, если лунки засеяны 100 мкл инокулюма, что приведет кжелаемой конечной концентрации инокулюма от 0,5 • 105 до 2,5 • 105 КОЕ/мл.
3.6 Инокулирование планшетов для микроразведения
Планшеты должны быть инокулированы втечение 30 мин стандартизованной суспензией инокулю-ма в целях сохранения концентрации жизнеспособных клеток. В каждую лунку, содержащую 100 мкл разведенного в бульоне антимикотического препарата (см. 3.5.2 и 3.5.3), добавляют дрожжевую суспензию объемом 100 мкл.
Для гарантии того, что тестовые лунки содержат соответствующее КОЕ, в лунке позитивного контроля в планшетах для микроразведения периодически следует проводить подсчет жизнеспособных клеток, основанный на методе, используемом для чтения МПК. Для этого берут 10 мкл из лунки контроля роста непосредственно после инокулирования и разводят в 1 мл бульона или физиологического раствора (для метода визуального чтения), или в 2 мл стерильной дистиллированной воды (для метода спектрофотометрического чтения). 100 мкл разведенной суспензии распределяют по поверхности подходящей агаровой пластины (агаризованной среды), которая затем инкубируется в течение ночи. Приемлемая тестовая суспензия даст в результате от 5 до 125 колоний.
3.7 Инкубирование планшетов для микроразведения3.7.1 Общие положения
Планшеты для микроразведения перед инкубированием должны быть запечатаны в полиэтиленовые пакеты или зафиксированы плотной крышкой либо любым другим способом для предотвращения высушивания. В целях предотвращения неравномерности нагревания планшеты для микроразведения не следует укладывать в стопки более чем по пять штук.
Планшеты для микроразведения инкубируются при температуре (35 ± 2) °С в течение (22 + 2) ч для большинства антимикотических противодрожжевых соединений. Некоторые изоляты Cryptococcus не могут расти в достаточной мере, если температура не снижена до 30 °С.
3.7.2 Визуальный путь
Время инкубации будет варьироваться в зависимости от испытуемых видов дрожжей и антимикотических препаратов. Многие тесты можно прочитать после 24 ч инкубации. Конкретные периоды инкубации см. в приложении С. Для обновления данной информации — см. текущее издание CLSI — документ М27 [1].
3.7.3 Спектрофотометрический путь
Определение МПК следует проводить после (24 + 2) ч, если спектральное поглощение лунки позитивного контроля > 0,2. Если абсорбция менее 0,2, тесты могут быть повторно инкубированы на 12—24 ч. В случае отсутствия значения абсорбции 0,2 через 48 ч, испытание считается неудавшимся.
3.8 Чтение результатов МПК3.8.1 Общие положения
Результаты следует читать только в случае достаточного роста испытуемых организмов (т. е. при явном пятне или приемлемой мутности/ абсорбции) в положительном контроле роста, при отсутствии роста в неинокулированном или негативном контроле (при наличии) и при установленной чистоте инокулята.
3.8.2 Метод визуального чтения
С некоторыми антимикотическими лекарственными препаратами и некоторыми изолятами может иметь место следовый рост (частичное ингибирование роста в расширенном диапазоне антимикотических концентраций). Предполагается, что это случается с флуконазолом примерно с 5 % изолятов [11]. Данный следовый рост может быть у изолята, который проявляет чувствительность через 24 ч, становится полностью резистентным, если чтение выполняется через 48 ч. По этой причине предпочтительно чтение через 24 ч.
Для визуального определения МПК лунки планшета исследуют с нижней стороны с помощью зеркального прибора для чтения. Может оказаться полезным осторожное перемешивание содержимого планшетов перед чтением конечных точек. Для препаратов флуцитозин, азолов и эхинокандинов степень роста в каждой лунке сравнивают с положительным контролем роста, а значения МПК определяют по наименьшей концентрации препарата, который ингибирует рост в значительной степени (по крайней мере 50 %) по сравнению с контролем.
Для амфотерицина МПК — это концентрация, обеспечивающая полное подавление роста.
3.8.3 Метод спектрофотометрического чтения
Для спектрофотометрического определения МПК панели для микроразведения читаются с помощью микропланшетного ридера при длине волны между 405 и 530 нм. Чтение фоновой лунки кон-
ГОСТ Р ИСО 16256-2015
троля среды должно быть отделено от чтения других лунок. Для препаратов флуцитозин, азолов и эхино-кандинов степень роста в каждой лунке сравнивают с положительным контролем роста, а значения МПК определяют по наименьшей концентрации препарата, который ингибирует рост в значительной степени (по крайней мере 50 %) по сравнению с контролем.
Для амфотерицина МПК — это концентрация, обеспечивающая подавление > 90 % роста в сравнении с контролем.
3.9 Интерпретация МПК
Клиническая интерпретация МПК, осуществленная любым из методов настоящего стандарта, должна быть основана на утвержденных соответствующим органом по стандартизации пограничных значениях, которые легли в основу метода тестирования. Таким образом, интерпретация МПК антимикотических препаратов, установленных путем визуального чтения конечных точек, должна быть основана на последних опубликованных рекомендациях CLSI (www.CLSI.orci) [11. [7], а МПК, установленные путем спектрофотометрического чтения, следует интерпретировать с использованием последних контрольных точек, имеющихся в наличии у EUCAST.
4 Контроль качества
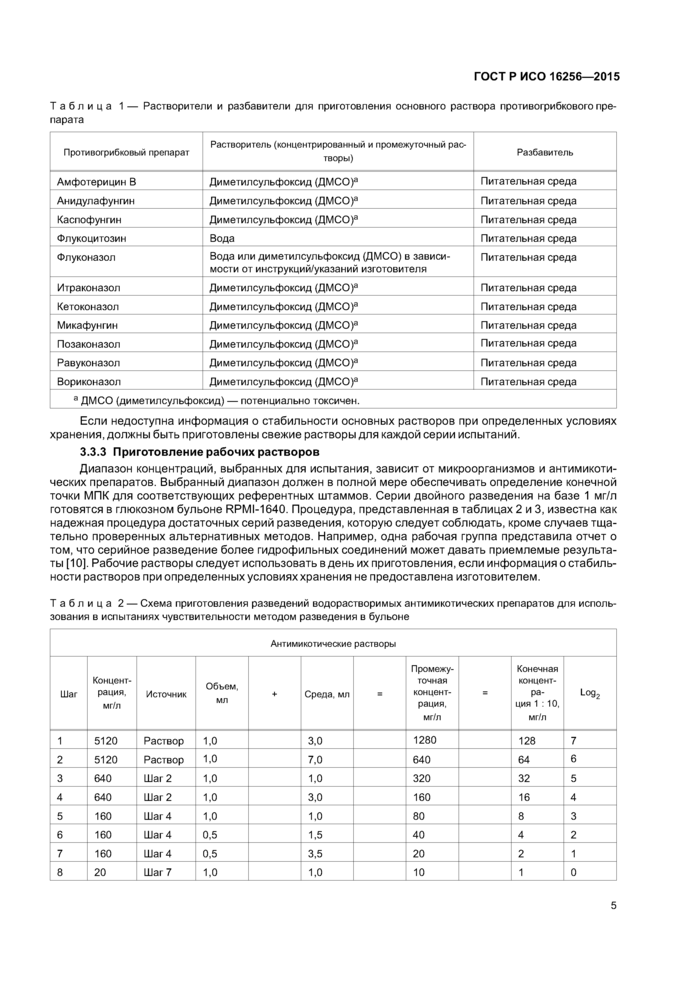
Качество результатов испытания контролируют путем одновременного применения контрольных штаммов (см. таблицы 4 и 5). Запас контрольных штаммов следует хранить в лиофилизированном либо замороженном виде (при температуре минус 70 °С — для визуального метода чтения; минус 60 °С— для спектрофотометрического метода). Рабочие культуры готовят путем пересева из запаса штаммов на неингибированную агаризованную среду. Дальнейшие субкультуры могут быть приготовлены только из первой рабочей культуры. Их регулярно заменяют новыми, приготовленными на скошенном агаре из замороженных запасов, как минимум каждые две недели. Когда возможно, следует проверять как минимум два соответствующих контрольных штамма каждый раз вдень проведения испытания.! естовые колонии контрольных культур обрабатываются тем же способом, что и обычные культуры. МПК противогрибковых препаратов для контрольных организмов должны находиться в пределах значений, приведенных в таблицах4 и 5 [2], [7].
|
Таблица 4 — Рекомендуемые 24-часовые и 48-часовые диапазоны МПК для двух штаммов контроля качества (QC strains), с применением разбавления в бульоне, для визуального чтения [12], [13] Диапазон МПК (мг/л) для визуального чтения тестов микроразведения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
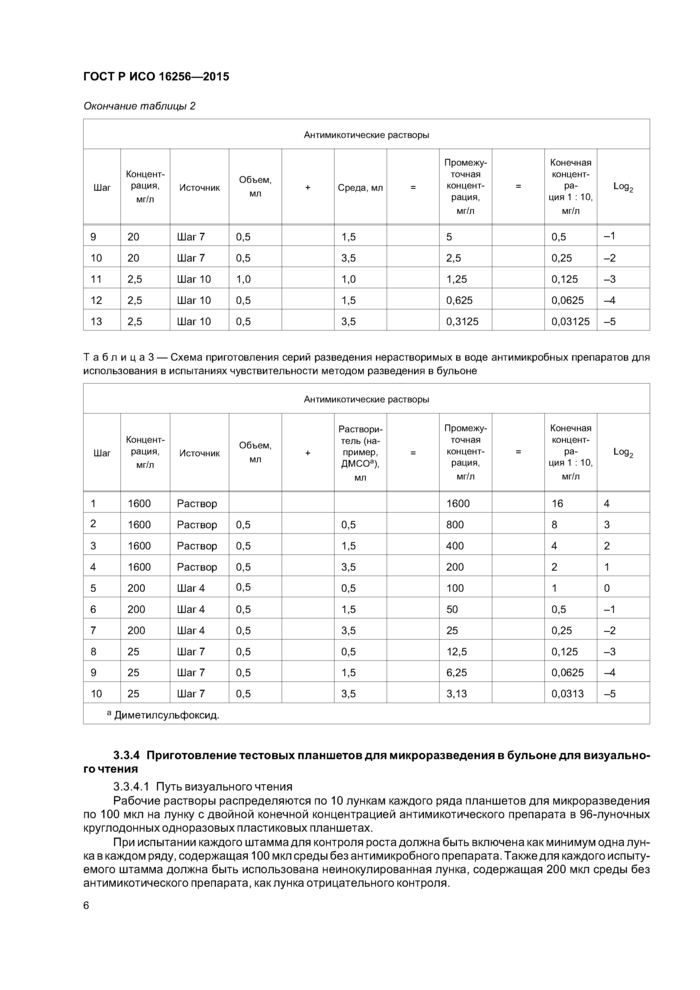
Окончание таблицы 4
|
Диапазон МПК (мг/л) для визуального чтения тестов микроразведения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Примечания
1 АТСС® — зарегистрированная торговая марка Американской коллекции клеточных культур.
2 Данные перепечатаны с разрешения Американского Общества Микробиологии и авторов.
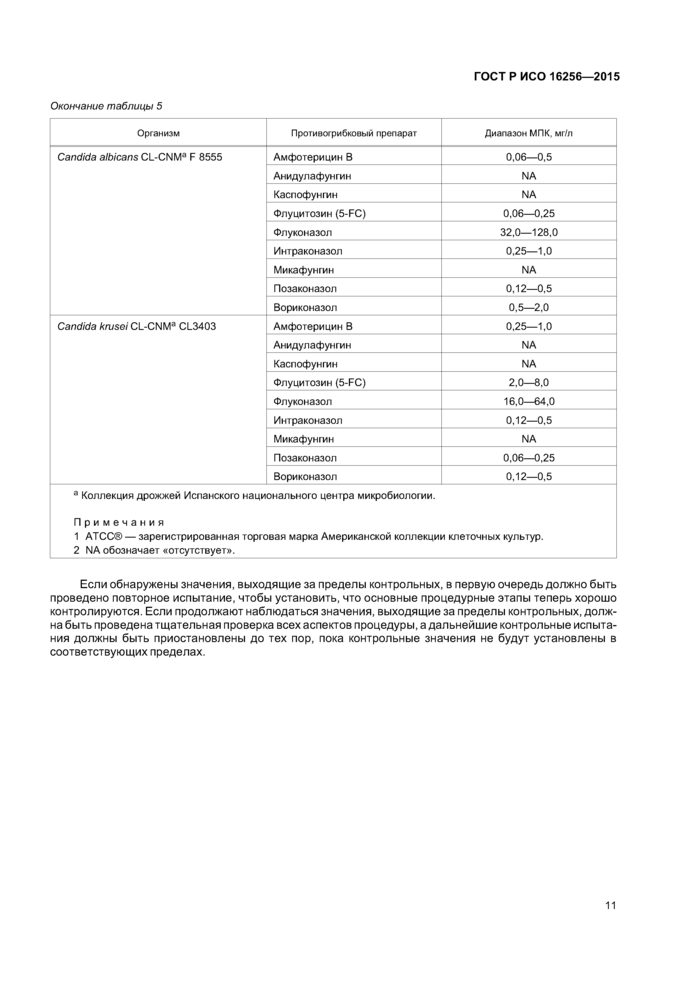
Табл и ца 5 — Рекомендуемые диапазоны МПК для контрольных штаммов, методом разведения в бульоне, для спектрофотометрического чтения [2], [14]
|
Организм |
Противогрибковый препарат |
Диапазон МПК, мг/л |
|
Candida parapsilosis АТСС® 22019 |
Амфотерицин В |
0,12—1,0 |
|
Анидулафунгин |
0,25—1,0 | |
|
Каспофунгин |
NA | |
|
Флуцитозин (5-FC) |
0,12—0,5 | |
|
Флуконазол |
0,5—2,0 | |
|
Итраконазол |
0,03—0,12 | |
|
Микафунгин |
NA | |
|
Позаконазол |
0,015—0,06 | |
|
Вориконазол |
0,015—0,06 | |
|
Candida krusei АТСС® 6258 |
Амфотерицин В |
0,12—1,0 |
|
Анидулафунгин |
<0,06 | |
|
Каспофунгин |
NA | |
|
Флуцитозин(б-РС) |
1,0—4,0 | |
|
Флуконазол |
16,0—64,0 | |
|
Итраконазол |
0,03—0,12 | |
|
Микафунгин |
NA | |
|
Позаконазол |
0,015—0,06 | |
|
Вориконазол |
0,03—0,25 |
|
Окончание таблицы 5 | ||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||
Если обнаружены значения, выходящие за пределы контрольных, в первую очередь должно быть проведено повторное испытание, чтобы установить, что основные процедурные этапы теперь хорошо контролируются. Если продолжают наблюдаться значения, выходящие за пределы контрольных, должна быть проведена тщательная проверка всех аспектов процедуры, а дальнейшие контрольные испытания должны быть приостановлены до тех пор, пока контрольные значения не будут установлены в соответствующих пределах.
11
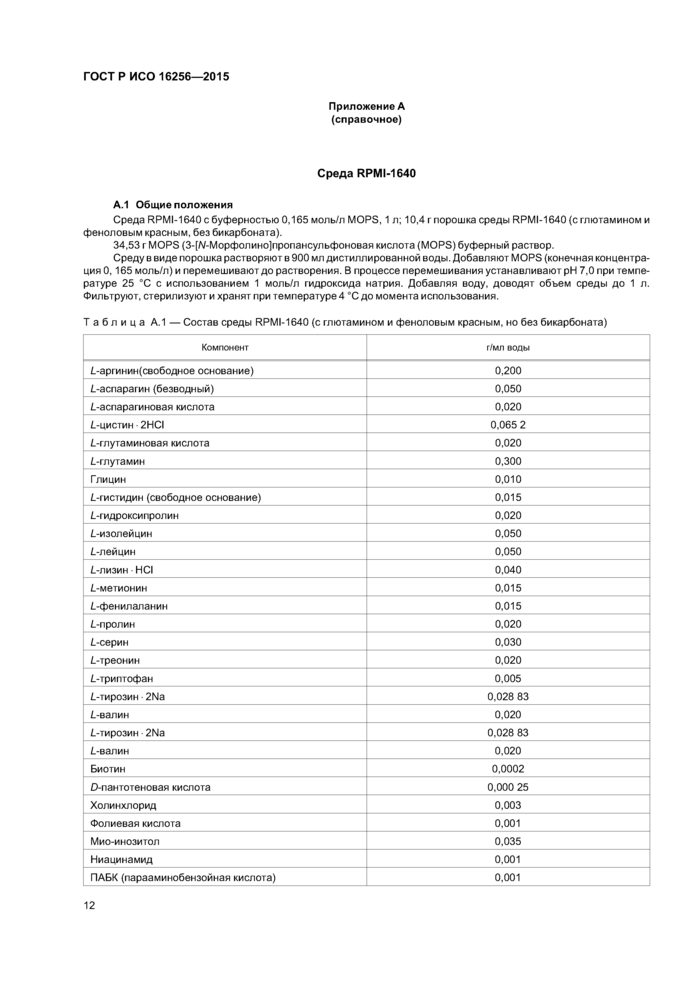
Приложение А (справочное)Среда RPMI-1640
А.1 Общие положения
Среда RPMI-1640 с буферностью 0,165 моль/л MOPS, 1 л; 10,4 г порошка среды RPMI-1640 (с глютамином и феноловым красным, без бикарбоната).
34,53 г MOPS (3-[/\/-Морфолино]пропансульфоновая кислота (MOPS) буферный раствор.
Среду в виде порошка растворяют в 900 мл дистиллированной воды. Добавляют MOPS (конечная концентрация 0,165 моль/л) и перемешивают до растворения. В процессе перемешивания устанавливают pH 7,0 при температуре 25 °С с использованием 1 моль/л гидроксида натрия. Добавляя воду, доводят объем среды до 1 л. Фильтруют, стерилизуют и хранят при температуре 4 °С до момента использования.
|
Таблица А.1 — Состав среды RPMI-1640 (с глютамином и феноловым красным, но без бикарбоната) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
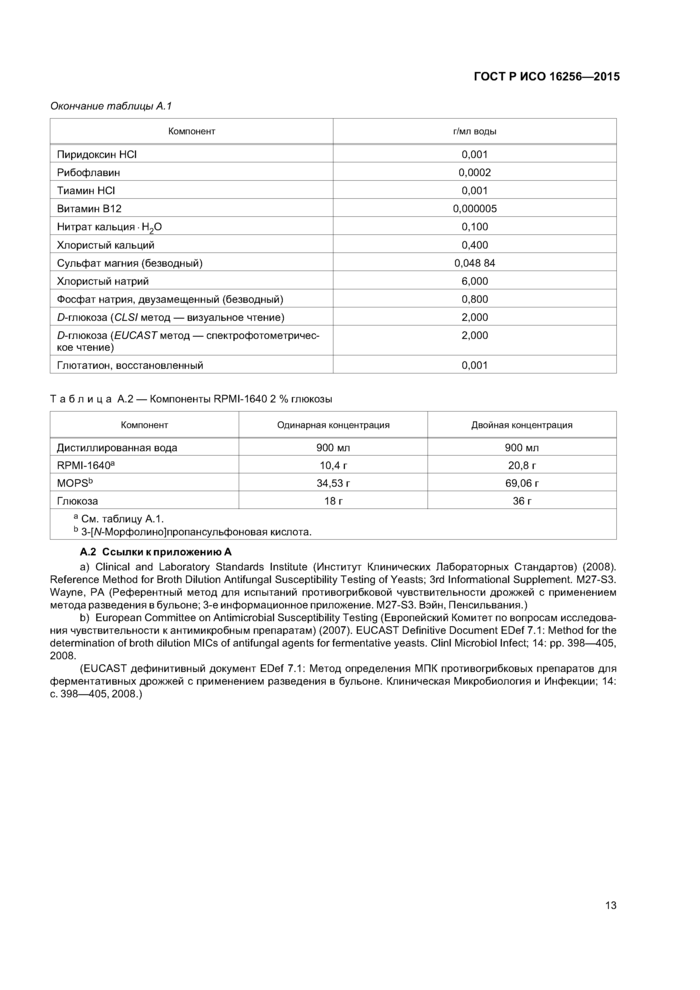
|
Окончание таблицы А. 1 | ||||||||||||||||||||||||||
|
|
Таблица А.2 — Компоненты RPMI-1640 2 % глюкозы | ||||||||||||||||||
| ||||||||||||||||||
А.2 Ссылки к приложению А
a) Clinical and Laboratory Standards Institute (Институт Клинических Лабораторных Стандартов) (2008). Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeasts; 3rd Informational Supplement. M27-S3. Wayne, PA (Референтный метод для испытаний противогрибковой чувствительности дрожжей с применением метода разведения в бульоне; 3-е информационное приложение. M27-S3. Вэйн, Пенсильвания.)
b) European Committee on Antimicrobial Susceptibility Testing (Европейский Комитет по вопросам исследования чувствительности к антимикробным препаратам) (2007). EUCAST Definitive Document EDef 7.1: Method for the determination of broth dilution MICs of antifungal agents for fermentative yeasts. Clinl Microbiol Infect; 14: pp. 398—405, 2008.
(EUCAST дефинитивный документ EDef 7.1: Метод определения МПК противогрибковых препаратов для ферментативных дрожжей с применением разведения в бульоне. Клиническая Микробиология и Инфекции; 14: с. 398—405,2008.)
13
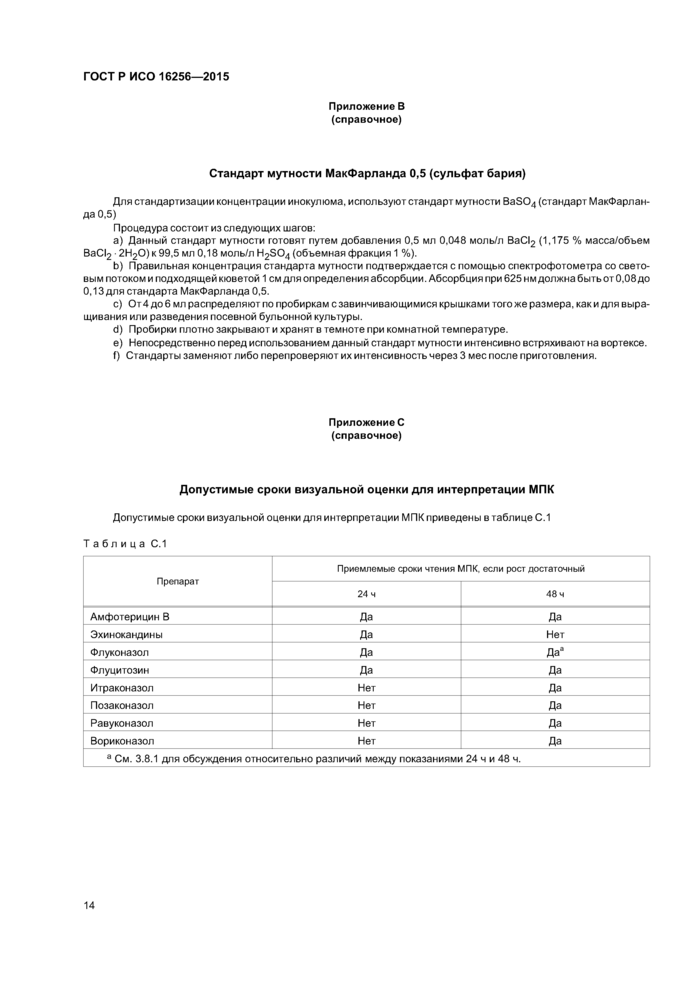
Приложение В (справочное)Стандарт мутности МакФарланда 0,5 (сульфат бария)
Для стандартизации концентрации инокулюма, используют стандарт мутности BaS04 (стандарт МакФарланда 0,5)
Процедура состоит из следующих шагов:
a) Данный стандарт мутности готовят путем добавления 0,5 мл 0,048 моль/л ВаС12 (1,175 % масса/объем ВаС12 -2Н20)к99,5 мл 0,18 моль/л H2S04 (объемная фракция 1 %).
b) Правильная концентрация стандарта мутности подтверждается с помощью спектрофотометра со световым потоком и подходящей кюветой 1 см для определения абсорбции. Абсорбция при 625 нм должна быть от 0,08 до 0,13 для стандарта МакФарланда 0,5.
c) От4 до 6 мл распределяют по пробиркам с завинчивающимися крышками того же размера, как и для выращивания или разведения посевной бульонной культуры.
d) Пробирки плотно закрывают и хранят в темноте при комнатной температуре.
e) Непосредственно перед использованием данный стандарт мутности интенсивно встряхивают на вортексе.
f) Стандарты заменяют либо перепроверяют их интенсивность через 3 мес после приготовления.
Приложение С (справочное)Допустимые сроки визуальной оценки для интерпретации МПК
Допустимые сроки визуальной оценки для интерпретации МПК приведены в таблице С.1
|
Таблица С.1 | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
|
а См. 3.8.1 для обсуждения относительно различий между показаниями 24 ч и 48 ч. | |||||||||||||||||||||||||||||
ГОСТ Р ИСО 16256-2015Библиография
[1 ] CLSIМ27-АЗ, Reference Method for Broth Dilution Antifungal Susceptibility T esting of Yeasts, Third Edition; Approved Standard. CLSI: Wayne, PA., 2008
[2] European Committee on Antimicrobial Susceptibility Testing. 2007), EUCAST Definitive Document EDef 7.1: Method for the determination of broth dilution MICs of antifungal agents for fermentative yeasts. Clinl Microbiol Infect; 14: pp. 398—405, 2008
[3] Rodriguez-Tudella J.L., Donnelly J.P., PfallerM.A., Chryssantou E., Warn P., Denning D.W. etal. Statistical analysis of correlation between fluconazole MICs for Candida spp. assessed by standard methods set forth by the European Committee on Antimicrobial Susceptibility Testing (E.Dis 7.1) and CLSI (M27-A2). J. Clin. Microbiol. 2007, 45 (1), pp. 109—111
[4] CLSI M38-A2, Reference Method for Broth Dilution Antifungal Susceptibility Testing of Filamentous Fungi, Second Edition; Approved Standard. CLSI: Wayne, PA., 2008
[5] Espinel-lngroff A., Dawson K., Pfaller M. et al. Comparative and collaborative evaluation of standardization of antifungal susceptibility testing forfilamentous fungi. Antimicrob. Agents Chemother. 1995, 39, pp. 314—319
[6] Espinel-lngroff A., Bartlett M., Bowden R. et al. Multicenter evaluation of proposed standardization procedure for antifungal susceptibility testing forfilamentous fungi. J. Clin. Microbiol. 1997, 35, pp. 139—143
[7] Rodriquez Tudela J.L., Donnelly J.P., Arendrup M.C., Arikan S., Barchiesi F., Bille J. etal. EUCAST Technical Note on the method for the determination of broth dilution minimum inhibitory concentrations of antifungal agents for conidia-forming moulds. Clin. Microbiol. Infect. 2008 Oct, 14(10), pp. 982—984
[8] Cuenca-Estrella M., Arendrup M.C., Chryssanthou E., Dannaoui E., Lass-Florl C., Sandven P. et al. the AFST Subcommittee of EUCAST. Multicenter Determination of Quality Control Strains and Quality Control Ranges for Antifungal Susceptibility Testing of Yeasts and Filamentous Fungi Using the Methods of the Antifungal Susceptibility Testing Subcommittee of the European Committee on Antimicrobial Susceptibility Testing (AFST-EUCAST). Clin. Microbiol. Infect. 2007,13 (10), pp. 1018—1022
[9] CLSI M27-S3, Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeasts, Third Informational Supplement. CLSI: Wayne, PA., 2008
[10] Lopez A.G., Arendrup M.C., Lass-Florl C., Rodriguez-Tudela J.-L., Cuenca-Estrella M. Multicenter Comparison of the ISO Standard 20776-1 and the Serial 2-Fold Dilution Procedures to Dilute Hydrophilic and Hydrophobic Antifungal Agents for Susceptibility Testing. J. Clin. Microbiol. 2010 May, 48 (5), pp. 1918—1920
[11] Arthington-Skaggs B.A., WarnockD.W., Morrison C.J. Quantitation of Candida albicans ergosterol content improves the correlation between in vitro antifungal susceptibility test results and in vivo outcome afterfluconazole treatment in a murine model of invasive candidiasis. Antimicrob. Agents Chemother. 2000,44, pp. 2081—2085
[12] Al B. etal. Quality control limits for broth microdilution susceptibility tests for ten antifungal agents. J. Clin. Microbiol.
2000, 38, pp. 3457—3459
[13] Krisher K. et al. Quality control parameters for broth microdilution tests of anidulafungin. J. Clin. Microbiol. 2004,42, p. 490
[14] Arendrup MC, & Cuenca-Estrella MHope Wand the Subcommittee on Antifungal Susceptibility Testing (AFST) of the ESCMID European Committee on Antimicrobial Susceptibility Testing (EUCAST). EUCAST Definitive Document E.DEF 7.2: Method for the determination of broth dilution minimum inhibitory concentrations of antifungal agents for yeasts. February, 2012
15
УДК 64:003:054:006:354 ОКС 11.100.10
Ключевые слова: референтный метод, тестирование активности in vitro, антимикробные препараты, дрожжевые грибки, инфекционные заболевания
Редактор О.А. Стояновская Технический редактор В.Н. Прусакова Корректор В.И. Баренцева Компьютерная верстка А.Н. Золотаревой
Сдано в набор 27.05.2015. Подписано в печать 05.06.2015. Формат 60 х 84^. Гарнитура Ариал. Уел. печ. л. 2,32. Уч.-изд. л. 1,85. Тираж 32 экз. Зак. 2078.
Издано и отпечатано во ФГУП «СТАНДАРТИНФОРМ», 123995 Москва, Гранатный пер., 4. www.gostinfo.ru info@gostinfo.ru
Содержание
1 Область применения...................................................1
2 Термины и определения................................................2
3 Процедуры испытания..................................................4
3.1 Общие положения..................................................4
3.2 Питательная среда.................................................4
3.3 Антимикотические препараты..........................................4
3.4 Хранение планшетов для микроразведения.................................7
3.5 Приготовление инокулюма............................................7
3.6 Инокулирование планшетов для микроразведения.............................8
3.7 Инкубирование планшетов для микроразведения..............................8
3.8 Чтение результатов МПК.............................................8
3.9 Интерпретация МПК................................................9
4 Контроль качества....................................................9
Приложение А (справочное) Среда RPMI-1640................................... 12
Приложение В (справочное) Стандарт мутности МакФарланда 0,5 (сульфат бария)...........14
Приложение С (справочное) Допустимые сроки визуальной оценки для интерпретации МПК.....14
Библиография........................................................15
Введение
Испытания чувствительности in vitro проводятся на микроорганизмах, предположительно являющихся причиной заболевания, особенно если организм относят к видам, которые могут проявлять резистентность к часто используемым антимикробным препаратам. Данные исследования также важны для контроля над резистентностью, в эпидемиологических исследованиях чувствительности и при сравнении новых и существующих препаратов.
Процедуры разведения используются для определения минимальных подавляющих концентраций (МПК) антимикробных препаратов и представляют собой референтный метод испытания чувствительности микроорганизмов к антимикотическим препаратам.
Методы МПК используются:
- для наблюдения над резистентностью;
- при сравнительных испытаниях новых препаратов для исследовательских и регистрационных целей;
- для определения чувствительности организмов, которые в рутинных тестах показывают сомнительные результаты;
- для испытаний на организмах, для которых рутинные тесты могут быть ненадежными, и в случае, когда для клинической практики необходим количественный результат.
В методах разведений микроорганизмы проверяются на способность к видимому росту на ряде агаризованных сред (разведение в агаре) или в бульоне (разведение в бульоне), содержащих последовательные разведения антимикробного препарата.
Наименьшую концентрацию антимикробного препарата (в мг/л), которая при определенных условиях испытаний in vitro подавляет видимый или оптически измеримый рост микроорганизмов в течение определенного промежутка времени, называют МПК.
МПК служит руководством для определения чувствительности организма кантимикробным препаратам для практикующего врача и помогает в принятии решения о проведении лечения. Необходимы тщательный контроль и стандартизация внутри- и межпабораторной воспроизводимости, поскольку результат в значительной степени зависит от методов испытания.
Общепринято, что при анализе МПК в бульонных тестах, воспроизводимых в пределах единственного двукратного разведения, результат достоверен (т. е. ± 1 лунка или пробирка в серии двукратных разведений).
Разведение в бульоне — техника, при которой емкости, содержащие идентичные объемы растворов бульона с антимикробными препаратами в постепенно возрастающих концентрациях (как правило, в два раза), инокулированы известным количеством микроорганизмов.
Микроразведение в бульоне — тестирование в бульоне, выполняемое в планшетах для микроразведения.
Референтные методы настоящего стандарта предназначены для испытаний чистых культур дрожжевых грибов. Методы микроразведения в бульоне, описанные в настоящем стандарте, по существу аналогичны методам Clinical and Laboratory Standards Institute (Института клинических и лабораторных Стандартов) (CLSI) [1] и методам European Committee on Antimicrobial Susceptibility Testing (Европейского комитета по вопросам исследования Чувствительности к Антимикробным препаратам) (EUCAST) [2].
Настоящими методами была показана схожесть, вплоть до идентичности, в определении значений МПКдля флуконазола до 2 мг/л [3]. Исследования с некоторыми другими антимикотическими препаратами запланированы или находятся в процессе подготовки. Лаборатории, желающие использовать настоящий стандарт для проведения исследований новейших антимикотических препаратов, либо в качестве референтного метода для сопоставления МПК, проводимого с помощью диагностических приборов, должны выбрать процедуры испытания, основываясь на варианте прочтения МПК, установленного путем визуального анализа (CLSI метод) или при использовании спектрофотометра (EUCAST метод). В обоих случаях должны в точности соблюдаться процедурные детали для выбранного параметра.
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИКЛИНИЧЕСКИЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ И ДИАГНОСТИЧЕСКИЕ ТЕСТ-СИСТЕМЫ
IN VITRO
Референтный метод для тестирования активности in vitro антимикробных препаратов в отношении дрожжевых грибов, вызывающих инфекционные заболевания
Clinical laboratory testing and in vitro diagnostic test systems. Reference method for testing the in vitro activity of antimicrobial agents against yeast fungi involved in infectious diseases
Дата введения — 2016—06—01
ПРЕДОСТЕРЕЖЕНИЕ! Применение настоящего стандарта может быть связано с использованием опасных материалов, процедур и оборудования. Настоящий стандарт не предусматривает решения проблем безопасности, связанных с его применением. Ответственность за введение соответствующих правил техники безопасности, мер по охране здоровья и определение применимости регулятивных ограничений до начала использования полностью лежит на пользователе настоящего стандарта.
1 Область применения
Настоящий стандарт описывает метод испытания чувствительности к антимикотическим препаратам дрожжевых культур, вызывающих инфекции, включая Candida spp. и Cryptococcus neoformans. Референтный метод, описанный в настоящем стандарте, не использовался в исследованиях дрожжевых форм диморфных грибов, таких как В. dermatitidis и/или Н. capsulatum, разновидность capsulatum. Кроме того, исследования мицелиальных грибов (плесени) позволили выявить несколько дополнительных проблем в стандартизации, которые не учтены в данной методике. Референтные методы разведения в бульоне для тестирования чувствительности к антимикотическим препаратам мицелиальных грибов разработаны и в настоящее время доступны в виде CLSI документа М38 и EUCAST документа E.DEF 9.1 [4], [5], [6], [7], [8].
Настоящий стандарт описывает референтный метод микроразведения в бульоне, который может быть выполнен двумя различными путями. Один путь подразумевает визуальное определение МПК (CLSI метод) [1]; второй — спектрофотометрическое (EUCAST метод) [2]. МПК свидетельствует об активности лекарственного препарата в описанных условиях испытания и может быть интерпретирован для целей клинической практики с учетом и других факторов, таких как фармакология лекарственных средств или механизмы антимикотической резистентности. МПК могут быть распределены по следующим категориям: «чувствительные» (Ч) («susceptible», S), «чувствительные, дозозависимые» (ЧДЗ) («susceptible dose-dependent», S-DD), «промежуточные» (П) («intermediate», I), «нечувствительные» (НЧ) («поп-susceptible», NS), резистентные» (Р) («resistant», R). Дополнительно, классификация МПК может быть использована для определения дикого и не дикого типов грибных популяций. Клиническая интерпретация значений МПК находится вне области применения настоящего стандарта; интерпретацию категорий пограничных значений, характерныхдля методов, производных от CLSI и EUCAST, можно найти, сверившись с последними пояснительными таблицами, предоставляемыми организациями [2], [9]. Желательно сравнивать методы рутинного тестирования чувствительности или диагностических приборов для тестирования с данным референтным методом с целью гарантирования сопоставимых и надежных результатов для валидации и регистрации.
Издание официальное
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 антимикотический препарат (antifungal agent): Вещество биологического, полусинтетичес-кого или синтетического происхождения, которое подавляет или полностью останавливает рост грибов, и таким образом потенциально применимо для лечения инфекций.
Примечание — Дезинфицирующие средства, антисептики и консерванты не включены в данное определение.
2.2 антимикотические препараты — свойства (antifungal agents-properties)
2.2.1 активность (potency): Активная фракция тестируемого вещества, определяемая в биопробе в сравнении с референтным образцом того же вещества.
Примечани е — Активность выражают как массовую долю в миллиграммах на грамм (мг/г), или как значение активности в Международных единицах (ME) на грамм, или как объемная доля в процентах, или как молярная концентрация в молях на литр компонентов в испытуемом веществе.
2.2.2 концентрация (concentration): Количество антимикотического препарата в определенном объеме жидкости.
Примечания
1 Концентрацию выражают в мг/л.
2 мг/л = мкг/мл, но не рекомендуется использование единицы измерения мкг/мл.
2.3 основной раствор (stock solution): Исходный раствор, используемый для дальнейших разведений.
2.4 минимальная подавляющая концентрация; МПК (minimum inhibitory concentration, MIC): Наименьшая концентрация, которая при определенных условиях испытания in vitro ослабляет рост на определенную величину в течение определенного периода времени.
Примечание — МПК выражают в мг/л.
2.5 пограничные значения (breakpoint, SP): Специфические значения МПК, которые могут быть использованы для распределения грибов по клиническим категориям: «чувствительные» (Ч) («susceptible», S), «чувствительные, дозозависимые» (ЧДЗ) («susceptible dose-dependent», S-DD), «промежуточные» (П) («intermediate», /), «нечувствительные» (НЧ) («nonsusceptible», NS) или «резистентные» (Р) («resistant», R).
Примечание — Для текущихинтерпретаций пограничныхзначений можно сослаться на последниепуб-ликации организаций, применяющих данный референтный метод (например, CLSI and EUCAST) [1], [2], [9].
2.5.1 путь визуального чтения (visual reading pathway)
2.5.1.1 «чувствительный»; Ч («susceptible», S): Грибной штамм, ингибированный in vitro концентрацией антимикотического препарата, ассоциированный с высокой вероятностью терапевтического успеха.
Примечания
1 Грибные штаммы относят к категории чувствительных при применении соответствующих пограничных значений в определенной фенотипической тест-системе.
2 Данное пограничное значение может быть изменено в определенных обстоятельствах (например, изменения в обычно используемых дозах лекарственных препаратов, появление новых механизмов резистентности).
2.5.1.2 «чувствительные, дозозависимые»; ЧДЗ (susceptibledose-dependent, S-DDJ: Грибной штамм, ингибированный in vitro концентрацией антимикотического препарата, который может быть применен in vivo при использовании повышенныхдоз препарата, если такие схемы применения безопасны.
Примечания
1 Грибные штаммы относят к категории «чувствительных, дозозависимых» при применении соответствующих пограничных значений в определенной фенотипической тест-системе.
2 Данный класс чувствительности означает, что инфекция, вызванная изолятом, может быть соответствующим образом обработана в таких участках тела, где лекарственный препарат присутствует в физиологических концентрациях, или при использовании высокой дозы лекарственного препарата.
3 Данное пограничное значение может быть изменено в определенных обстоятельствах (например, изменения в обычно используемых дозах лекарственных препаратов, появление новых механизмов резистентности).
2
2.5.1.3 «промежуточный»; П («intermediate», I): Микроорганизм, уровень противомикробной активности препарата к которому связан с неопределенным терапевтическим эффектом.
Примечание — Отсюда следует, что инфекция, вызванная изолятом, может быть соответствующим образом обработана в таких участках тела, где лекарственный препарат присутствует в физиологических концентрациях, или при использовании высокой дозы лекарственного препарата; он также указывает на буферную зону, которая должна предотвращать мелкие неконтролируемые технические факторы от несоответствий в интерпретации.
2.5.1.4 «нечувствительный»; НЧ («nonsusceptible», NS): Категория, используемая для дрожжевых грибов, для которых в настоящее время определена только интерпретативная категория «чувствительные», но не интерпретивные категории «чувствительные, дозозависимые», «промежуточные» и «устойчивые» (то есть исключительно интепретивная категория «чувствительные»).
Примечание — В данную категорию обычно включают новые антимикотические препараты, для которых еще не встречались резистентные изоляты.
2.5.1.5 резистентный; Р («resistant», R): Грибной штамм, ингибированный in vitro концентрацией антимикотического препарата, ассоциирующийся с высокой вероятностью отсутствия терапевтического успеха.
Примечания
1 Штаммы грибов относятся к категории резистентных при применении соответствующих пограничных значений в заданной фенотипической тест-системе.
2 В определенных обстоятельствах пограничные значения могут быть изменены (например, изменения в обычно используемых дозах лекарственных препаратов, появление новых механизмов резистентности).
2.5.2 путь спектрофотометрического чтения (spectrophotometric reading pathway)
2.5.2.1 чувствительный; Ч («susceptible», S): Микроорганизм, уровень антимикробной активности которого связан с высокой вероятностью терапевтического успеха.
2.5.2.2 промежуточный; П («intermediate», /): Микроорганизм, уровень антимикробной активности которого связан с сомнительным терапевтическим эффектом.
Примечание — Отсюда следует, что инфекция, вызванная изолятом, может быть соответствующим образом обработана в таких участках тела, где лекарственный препарат присутствует в физиологических концентрациях, или при использовании высокой дозы лекарственного препарата; он также указывает на буферную зону, которая должна предотвращать мелкие неконтролируемые технические факторы от несоответствий в интерпретации.
2.5.2.3 резистентный; Р («resistant», R): Микроорганизм, уровень антимикробной активности которого связан с высокой вероятностью терапевтической неудачи.
2.6 дикий тип (wild type): Отсутствие приобретенных механизмов резистентности к антимикотическому препарату для данного грибного штамма.
2.7 референтный штамм (reference strain): Зарегистрированный, полностью охарактеризованный грибной штамм с определенными стабильными фенотипами и/или генотипами чувствительности к антимикотикам.
Примечание — Референтные штаммы хранят в качестве исходных культур, из которых получают рабочие культуры. Они могут быть получены из коллекций культур и использованы для контроля качества.
2.8 методы испытания чувствительности
2.8.1 разведение в бульоне (broth dilution): Техника, при которой емкости заполняются соответствующими объемами антимикотического раствора, с использованием возрастающих (в два раза) концентраций антимикотического препарата и соответствующих объемов бульона заданного инокулюма.
Примечание — Цель этого метода заключается в определении МПК.
2.8.2 микроразведение (microdilution): Выполнение разведения в бульоне в планшетахдля микроразведения емкостью <300 мкп на лунку.
2.9 бульон (broth): Жидкая среда, обычно используемая для выращивания дрожжевых грибов
in vitro.
2.10 инокулюм (inoculum): Количество дрожжевых клеток в суспензии в расчете на конечный объем.
Примечание — Инокулюм выражается в колониеобразующих единицах на миллилитр (КОЕ/мл).
2.11 инокулюм -эффект (inoculum effect): Изменения в МПК, связанные с изменениями в иноку-люме.
з
3 Процедуры испытания3.1 Общие положения
Испытания выполняют в пластиковыходноразовых планшетах для микроразведения. Метод основан на подготовке рабочего раствора антимикотического препарата двойной концентрации объемом 100 мкп на лунку с добавлением инокулюма объемом также 100 мкл.
3.2 Питательная среда3.2.1 Общие положения
Следует использовать бульон RPMI-1640 (см. приложение А для уточнений при приготовлении двух вариантов глюкозного бульона RPMI-1640)
3.2.2 Путь визуального чтения
Среда RPMI-1640 должна содержать 0,2 % глюкозы. Бульон RPMI-1640 готовят и разливают в одинарной концентрации с двойной концентрацией разведения антимикотического препарата и инокулюма в соответствующих объемах бульона RPMI-1640, содержащего суспензию заданного дрожжевого инокулюма.
3.2.3 Путь спектрофотометрического чтения
Среда RPMI-1640 должна содержать 2 % глюкозы. Бульон RPMI-1640 и антимикотический препарат готовят в двойной концентрации с инокулюмом, добавленным позже в соответствующие объемы стерильной дистиллированной воды.
3.3 Антимикотические препараты3.3.1 Общие положения
Антимикотические препараты должны быть получены непосредственно от изготовителя либо из надежных коммерческих источников; фармацевтические препараты клинического назначения недопустимы. Антимикотические препараты должны быть снабжены номером партии, содержанием действующих веществ, сроком годности и подробными рекомендациями по условиям хранения. Вещества следует хранить в плотно закрытых контейнерах в темноте, при температуре минус 20 °С, сосушителем, если изготовителем не рекомендовано иное. Гигроскопичные препараты должны быть разделены на аликвоты, каждую из которых используют для одного испытания.
Прежде чем открывать контейнеры, их оставляют нагреваться до комнатной температуры во избежание образования конденсата и потери активности.
3.3.2 Приготовление основных растворов
Для взвешивания антимикотических препаратов требуются калиброванные аналитические весы. Расчет активности порошка для получения необходимого количества субстанции антимикотического препарата или количества разбавителя, необходимого для стандартного раствора, проводят по следующим формулам:
(1)
(2)
= \Ар.
Р
V =
т-Р
Р
где р —концентрация основного раствора, мг/л;
/г? — масса антимикотического препарата (порошок), г;
Р — активность антимикотического препарата (порошок), мг/г;
V — объем разбавителя, л.
Концентрация основного раствора должна быть 1000 мг/л или более, несмотря на то, что растворимость некоторых препаратов является лимитирующим фактором. Фактические концентрации основных растворов зависят от метода приготовления рабочих растворов (серийных разведений). Некоторые препараты требуют альтернативных растворителей (см. таблицу 1). Обычно нет необходимости в стерилизации растворов. Если требуется, стерилизация должна быть выполнена методом мембранной фильтрации, а образцы до и после стерилизации должны пройти сравнительный анализ для гарантии того, что не произошла адсорбция.
4
|
Таблица 1 — Растворители и разбавители для приготовления основного раствора противогрибкового препарата | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
Если недоступна информация о стабильности основных растворов при определенных условиях хранения, должны быть приготовлены свежие растворы для каждой серии испытаний.
3.3.3 Приготовление рабочих растворов
Диапазон концентраций, выбранных для испытания, зависит от микроорганизмов и антимикотических препаратов. Выбранный диапазон должен в полной мере обеспечивать определение конечной точки МПК для соответствующих референтных штаммов. Серии двойного разведения на базе 1 мг/л готовятся в глюкозном бульоне RPMI-1640. Процедура, представленная в таблицах 2 иЗ, известна как надежная процедура достаточных серий разведения, которую следует соблюдать, кроме случаев тщательно проверенных альтернативных методов. Например, одна рабочая группа представила отчет о том, что серийное разведение более гидрофильных соединений может давать приемлемые результаты [10]. Рабочие растворы следует использовать в день их приготовления, если информация о стабильности растворов при определенных условиях хранения не предоставлена изготовителем.
|
Таблица 2 — Схема приготовления разведений водорастворимых антимикотических препаратов для использования в испытаниях чувствительности методом разведения в бульоне | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Окончание таблицы 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Т аблицаЗ — Схема приготовления серий разведения нерастворимых в воде антимикробных препаратов для использования в испытаниях чувствительности методом разведения в бульоне | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3.4 Приготовление тестовых планшетов для микроразведения в бульоне для визуального чтения
3.3.4.1 Путь визуального чтения
Рабочие растворы распределяются по 10 лункам каждого ряда планшетов для микроразведения по 100 мкл на лунку с двойной конечной концентрацией антимикотического препарата в 96-луночных круглодонных одноразовых пластиковых планшетах.
При испытании каждого штамма для контроля роста должна быть включена как минимум одна лунка в каждом ряду, содержащая 100 мкл среды без антимикробного препарата. Также для каждого испытуемого штамма должна быть использована неинокулированная лунка, содержащая 200 мкл среды без антимикотического препарата, как лунка отрицательного контроля.
6