ГОСТ Р ИСО 15197-2015
Тест-системы для диагностики in vitro. Требования к системам мониторинга глюкозы в крови для самоконтроля при лечении сахарного диабета
Устанавливает требования для систем мониторинга in vitro глюкозы в крови, которые измеряют концентрации глюкозы в капиллярной крови, для специфического дизайна методик верификации и для валидации характеристик исследования пользователем, для которого эти системы предназначены.
Идентичен ISO 15197:2013
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Конструкция и разработка
4.1 Общие требования
4.2 Метрологическая прослеживаемость
4.3 Безопасность и менеджмент риска
4.4 Эргономика и человеческий фактор
4.5 Требования к верификации пользователем
5 Безопасность и надежность тестирования
5.1 Общие требования
5.2 Защита против электрического шока
5.3 Защита против механических опасностей
5.4 Электромагнитная совместимость
5.5 Резистентность к теплу
5.6 Резистентность к загрязнению и жидкостям
5.7 Защита против освобождающихся газов, взрыва и имплозии
5.8 Компоненты глюкометра
5.9 Тест функциональных характеристик выполнения
5.10 Механическая резистентность к вибрации и ударам
5.11 Пределы воздействия температуры на оборудование при хранении
5.12 Пределы воздействия влажности на оборудование при хранении
6 Оценка аналитических функциональных характеристик
6.1 Общие требования
6.2 Прецизионность измерения
6.3 Точность системы
6.4 Влияющие величины
6.5 Стабильность реагентов и материалов
7 Информация, предоставляемая изготовителем
7.1 Общие требования
7.2 Функциональные характеристики
7.3 Возможное дополнение инструкций по применению
8 Оценка функциональных характеристик пользователем
8.1 Общие требования
8.2 Критерии приемлемости и оценка результатов
8.3 Отбор и подготовка субъектов
8.4 Выполнение протокола изучения
8.5 Референтные значения глюкозы
8.6 Человеческие факторы
8.7 Анализ данных и представление результатов
8.8 Оценка инструкций по применению
Приложение А (справочное) Возможные интерферирующие вещества
Приложение В (справочное) Цепь прослеживаемости
Приложение С (справочное) Основания для требований к аналитическим функциональным характеристикам
Приложение ДА (справочное) Сведения о соответствии ссылочных международных и европейского стандартов национальным стандартам Российской Федерации и действующим в этом качестве межгосударственным стандартам
Библиография
46 страниц
| Дата введения | 01.06.2016 |
|---|---|
| Добавлен в базу | 12.02.2016 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
In vitro diagnostic test systems. Requirements for blood glucose monitoring systems for self-testing in managing diabetes mellitus
- ГОСТ Р ЕН 13612-2010 Оценка функциональных характеристик медицинских изделий для диагностики in vitro
- ГОСТ ISO 17511-2011 Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам
ГОСТ ISO 13485-2011Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования. Заменен на ГОСТ ISO 13485-2017.- ГОСТ ISO 14971-2011 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
- ГОСТ IEC 61010-2-101-2013 Безопасность электрических контрольно-измерительных приборов и лабораторного оборудования. Часть 2-101. Частные требования к медицинскому оборудованию для лабораторной диагностики (IVD)
- ГОСТ Р МЭК 61326-1-2014 Оборудование электрическое для измерения, управления и лабораторного применения. Требования электромагнитной совместимости. Часть 1. Общие требования
- ГОСТ Р МЭК 61326-2-6-2014 Оборудование электрическое для измерения, управления и лабораторного применения. Требования электромагнитной совместимости. Часть 2-6. Частные требования. Медицинское оборудование для диагностики в лабораторных условиях
- ГОСТ Р МЭК 62366-2013 Изделия медицинские. Проектирование медицинских изделий с учетом эксплуатационной пригодности
- ГОСТ IEC 61010-1-2014 Безопасность электрических контрольно-измерительных приборов и лабораторного оборудования. Часть 1. Общие требования
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ГОСТ Р исо 15197—
2015
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ТЕСТ-СИСТЕМЫ ДЛЯ ДИАГНОСТИКИ IN VITROТребования к системам мониторинга глюкозы в крови для самоконтроля при лечении сахарного диабета
ISO 15197:2013
In vitro diagnostic test systems - Requirements for blood glucose monitoring systems for self-testing in managing diabetes mellitus
(IDT)
Издание официальное
Предисловие
1 ПОДГОТОВЛЕН Лабораторией проблем клинико-лабораторной диагностики НИИ общественного здоровья и управления здравоохранением Государственного образовательного учреждения высшего профессионального образования «Первый Московский государственный медицинский университет им. И М. Сеченова» Минздрава России на основе аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 «Клинические лабораторные исследования и медицинские изделия для диагностики in vitro»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 27 апреля 2015 г. № 299-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 15197:2013 «Тест-системы для диагностики in vitro. Требования к системам мониторинга глюкозы в крови для самоконтроля при лечении сахарного диабета» (ISO 15197:2013 «In vitro diagnostic test systems — Requirements for blood glucose monitoring systems for self-testing in managing diabetes mellitus»).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных (региональных) стандартов соответствующие им национальные стандарты Российской Федерации и межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты» В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ. 2015
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Содержание
1 Область применения...................................................................................................................................1
2 Нормативные ссылки....................................................................................................................................1
3 Термины и определения...............................................................................................................................2
4 Конструкция и разработка............................................................................................................................7
4.1 Общие требования...............................................................................................................................7
4.2 Метрологическая прослеживаемость..................................................................................................7
4.3 Безопасность и менеджмент риска......................................................................................................8
4.4 Эргономика и человеческий фактор....................................................................................................8
4.5 Требования к верификации пользователем........................................................................................9
5 Безопасность и надежность тестирования.................................................................................................9
5.1 Общие требования................................................................................................................................9
5.2 Защита против электрического шока...................................................................................................9
5.3 Защита против механических опасностей...........................................................................................9
5.4 Электромагнитная совместимость.....................................................................................................10
5.5 Резистентность к теплу.......................................................................................................................10
5.6 Резистентность к загрязнению и жидкостям.....................................................................................10
5.7 Защита против освобождающихся газов, взрыва и имплозии.........................................................10
5.8 Компоненты глюкометра.....................................................................................................................10
5.9 Тест функциональных характеристик выполнения...........................................................................10
5.10 Механическая резистентность к вибрации и ударам......................................................................10
5.11 Пределы воздействия температуры на оборудование при хранении...........................................11
5.12 Пределы воздействия влажности на оборудование при хранении...............................................11
6 Оценка аналитических функциональных характеристик.........................................................................11
6.1 Общие требования..............................................................................................................................11
6.2 Прецизионность измерения................................................................................................................13
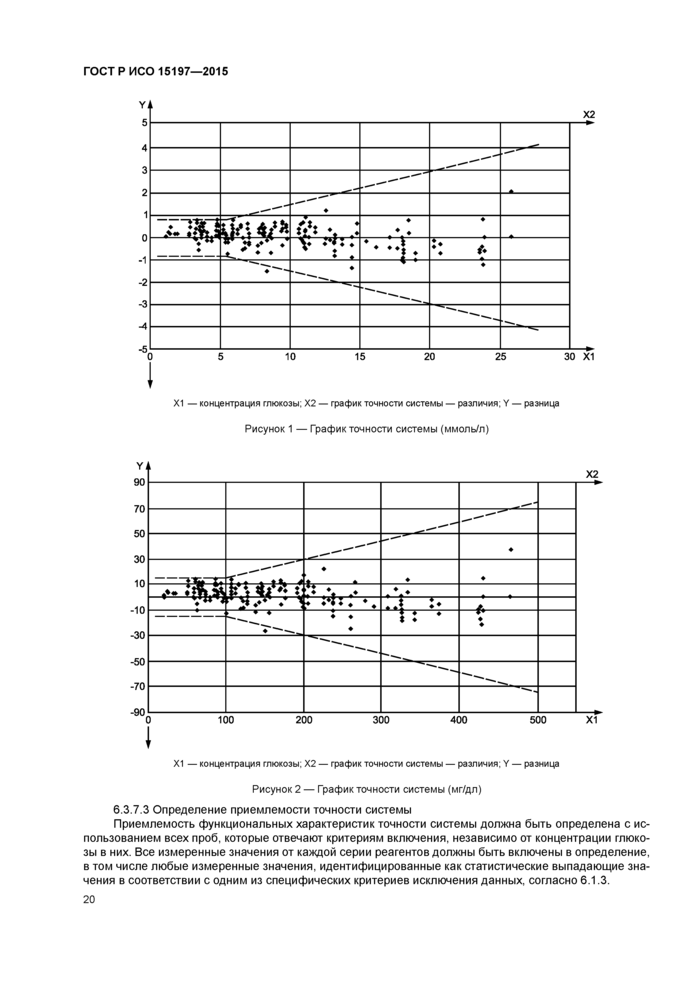
6.3 Точность системы................................................................................................................................16
6.4 Влияющие величины...........................................................................................................................22
6.5 Стабильность реагентов и материалов............................................................................................26
7 Информация, предоставляемая изготовителем......................................................................................26
7.1 Общие требования..............................................................................................................................26
7.2 Функциональные характеристики.......................................................................................................26
7.3 Возможное дополнение инструкций по применению.......................................................................26
8 Оценка функциональных характеристик пользователем........................................................................27
8.1 Общие требования..............................................................................................................................27
8.2 Критерии приемлемости и оценка результатов.................................................................................27
8.3 Отбор и подготовка субъектов............................................................................................................27
8.4 Выполнение протокола изучения.......................................................................................................28
8.5 Референтные значения глюкозы........................................................................................................28
8.6 Человеческие факторы .......................................................................................................................28
8.7 Анализ данных и представление результатов...................................................................................28
8.8 Оценка инструкций по применению...................................................................................................29
Приложение А (справочное) Возможные интерферирующие вещества..................................................31
Приложение В (справочное) Цепь прослеживаемости.............................................................................32
Приложение С (справочное) Основания для требований к аналитическим
функциональным характеристикам.................................................................................33
Приложение ДА (справочное) Сведения о соответствии ссылочных международных
и европейского стандартов национальным стандартам Российской Федерации
и действующим в этом качестве межгосударственным стандартам............................39
Библиография................................................................................................................................................40
Введение
Системы мониторинга концентрации глюкозы в крови являются медицинскими изделиями для диагностики in vitro (IVD-изделия). применяемыми преимущественно пациентами, страдающими сахарным диабетом. Сахарный диабет вызывается дефицитом секреции инсулина или резистентностью к инсулину, что ведет к аномальной высокой концентрации глюкозы в крови, которая может привести к острым и хроническим осложнениям для здоровья. При правильном использовании система мониторинга концентрации глюкозы в крови позволяет пользователю следить за концентрацией глюкозы в крови и принимать меры для ее контроля.
Настоящий стандарт предназначен для систем мониторинга глюкозы в крови, используемых непрофессионалами. Первоочередной задачей является установление требований для получения приемлемых функциональных характеристик и спецификация методик для демонстрации соответствия требованиям настоящего стандарта.
Минимальные критерии эффективности функционирования систем мониторинга глюкозы в крови были установлены, исходя из аналитических требований точности (прецизионности и правильности), требуемой для индивидуальных результатов измерения глюкозы в крови. Термин «точность системы» используется в настоящем стандарте для того, чтобы сообщить об аналитической способности системы мониторинга глюкозы в крови предназначенным пользователям (то есть непрофессионалам), которые не будут знакомы с метрологическими терминами, обычно применяемыми в лабораторной медицине. Точность системы описывает способность системы мониторинга глюкозы в крови получать результаты измерения, которые согласуются с истинными значениями глюкозы при использовании системы по предназначению. Понятие «точность системы» включает в себя смещение измерения и прецизионность измерения.
Требования к точности системы основаны на трех суждениях:
- эффективность современной технологии для мониторинга пациентов, страдающих сахарным диабетом;
- рекомендации исследователей диабета, а также существующие стандарты на продукцию и руководства технического регулирования;
- современный уровень state-of-the-art технологии мониторинга глюкозы в крови, достигнутый в лучших лабораториях.
При достижении требований к функциональным характеристикам, которые специфицированы во втором издании настоящего стандарта, желаемые цели должны быть взвешены относительно способностей существующих технологий мониторинга глюкозы в крови. Пересмотренные критерии функциональных характеристик в данном издании являются результатом усовершенствования технологий по сравнению со временем первого издания. Соображения, которые образуют основу для минимально приемлемых аналитических функциональных характеристик устройств измерения глюкозы в крови, предназначенных для самотестирования, описаны в приложении С.
Настоящий стандарт устанавливает требования, которые уникальны для устройств самотестирования глюкозы в крови. Требования, которые предъявляются вообще ко всем устройствам для диагностики in vitro, включены в ссылки на другие стандарты, соответствующие этим вопросам.
Хотя настоящий стандарт неприменим к системам мониторинга глюкозы, которые дают измеренные значения в порядковой шкале (например, визуальная, полуколичественная методика) или к медицинским устройствам, которые измеряют глюкозу в крови постоянно для самомониторинга. он может оказаться полезным как руководство по разработке методик для оценки функциональных характеристик таких систем.
IV
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТЕСТ-СИСТЕМЫ ДЛЯ ДИАГНОСТИКИ IN VITRO
Требования к системам мониторинга глюкозы в крови для самоконтроля при лечении сахарного диабета
In vitro diagnostic test systems Requirements for blood glucose monitoring systems for self-testing In managing diabetes mellitus
Дата введения — 2016—06—01
1 Область применения
Настоящий стандарт устанавливает требования для систем мониторинга in vitro глюкозы в крови, которые измеряют концентрации глюкозы в капиллярной крови, для специфического дизайна методик верификации и для валидации характеристик исследования пользователем, для которого эти системы предназначены. Данные системы предназначены для самостоятельного измерения непрофессионалами при наблюдении за течением сахарного диабета.
Настоящий стандарт предназначен для изготовителей таких систем и для организаций (например. регулирующие органы власти и органы оценки соответствия), несущих ответственность за оценку функциональных характеристик таких систем.
Настоящий стандарт не осуществляет:
- предоставление всеобъемлющей оценки всех факторов, которые могут повлиять на функциональные характеристики таких систем;
- рассмотрение измерения концентрации глюкозы для целей диагностики сахарного диабета;
- рассмотрение медицинских аспектов лечения сахарного диабета;
- рассмотрение методик измерения с измеренными значениями на порядковой шкале (например, визуальные, полуколичественные методики измерения) или систем постоянного мониторинга глюкозы;
- рассмотрение глюкометров, предназначенных для медицинского применения, отличающегося от самотестирования, при наблюдении за течением сахарного диабета.
2 Нормативные ссылки
Для применения данного документа необходимы ссылки на следующие документы. Для датированных ссылок — только цитированный документ Для недатированных ссылок — применяется последнее издание ссылочного документа (включая его поправки).
ИСО 13485 Изделия медицинские. Системы менеджмента качества. Требования для целей регулирования (ISO 13485. Medical devices — Quality management systems — Requirements for regulatory purposes)
ИСО 14971 Изделия медицинские. Применение менеджмента риска к медицинским изделиям (ISO 14971, Medical devices — Application of risk management to medical devices)
ИСО 17511 Изделия медицинские для диагностики in vitro.Измерение величин в биологических пробах Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам (ISO 17511. in vitro diagnostic medical devices — Measurement of quantities in biological samples — Metrological traceability of values assigned to calibrators and control materials)
Издание официальное
ИСО 18113-1 Изделия медицинские для диагностики in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 1. Термины, определения и общие требования (ISO 18113-1. In vitro diagnostic medical devices — Information supplied by the manufacturer (labelling) — Part 1: Terms, definitions and general requirements)
ИСО 18113-4 Изделия медицинские для диагностики in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 4. Реагенты для диагностики in vitro для самотестирования (ISO 18113-4, In vitro diagnostic medical devices — Information supplied by the manufacturer (labelling) — Part 4: In vitro diagnostic reagents for self-testing)
ИСО 18113-5 Изделия медицинские для диагностики in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 5. Инструменты для диагностики in vitro для самотестирования (ISO 18113-5. In vitro diagnostic medical devices — Information supplied by the manufacturer (labelling) — Part 5: In vitro diagnostic instruments for self-testing)
ИСО 23640 Изделия медицинские для диагностики in vitro. Оценка стабильности реагентов для диагностики in vitro (ISO 23640. In vitro diagnostic medical devices — Evaluation of stability in vitro diagnostic reagents)
МЭК 60068-2-64 Исследование окружающей среды. Часть 2-64. Тест Fh: Вибрация, случайные отклонения в средах с широкой полосой пропускания и руководство (IEC 60068-2-64, Environmental testing — Part 2-64 — Test Fh: Vibration, broadband random and guidance)
МЭК 61010 -1 Требования по безопасности для электрического оборудования для измерения, контроля и лабораторного применения. Часть 1. Общие требования (IEC 61010-1. Safety requirements for electrical equipment for measurement, control, and laboratory use — Part 1: General requirements)
МЭК 61010-2-101 Требования no безопасности для электрического оборудования для измерения, контроля и лабораторного применения. Часть 2-101. Частные требования для медицинского оборудования для диагностики in vitro (IEC 61010-2-101, Safety requirements for electrical equipment for measurement, control, and laboratory use — Part 2-101: Particular requirements for in vitro diagnostic medical (IVD) equipment) МЭК 61326-1 Требования no безопасности для электрического оборудования для измерения, контроля и лабораторного применения. Требования электромагнитной совместимости (ЕМС) Часть 1. Общие требования (IEC 61326-1. Safety requirements for electrical equipment for measurement, control, and laboratory use — EMC requirements — Part 1: General requirements)
МЭК 61326-2-6 Требования по безопасности для электрического оборудования для измерения, контроля и лабораторного применения. Требования электромагнитной совместимости (ЕМС). Часть 2-6. Частные требования. Медицинское оборудование для диагностики in vitro (IEC 61326-2-6, Safety requirements for electrical equipment for measurement, control, and laboratory use — EMC requirements — Part 2-6: Particular requirements — In vitro diagnostic medical (IVD) equipment)
МЭК 62366 Изделия медицинские. Общие требования к безопасности и существенным рабочим характеристикам — Применимость к медицинским изделиям проектирования удобства применения (IEC 62366, Medical devices — Application of usability engineering to medical devices)
EH 13612 Оценка функциональных характеристик медицинских изделий для диагностики in vitro (EN 13612. Performance evaluation of in vitro diagnostic medical devices)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 18113, а также следующие термины с соответствующими определениями:
3.1 система мониторинга глюкозы в крови (blood-glucose monitoring system): Измерительная система, состоящая из портативного инструмента и реагентов, применяемая для мониторинга in vitro концентрации глюкозы в крови.
Примечание — Система мониторинга глюкозы в крови измеряет глюкозу в пробах капиллярной крови, но может выражать измеренные значения как концентрации в капиллярной крови, так и эквивалентные концентрации в капиллярной плазме Концентрации в настоящем стандарте относятся к типу значений, сообщаемых системой
3.2 глюкометр (glucose-meter): Компонент системы мониторинга глюкозы в крови, который переводит продукт химической реакции в концентрацию глюкозы в крови.
3.3 проба капиллярной крови (capillary blood-sample): Проба крови, взятая путем пункции кожи.
Примечание — Пункцию пальца ланцетом обычно называют «fmgerstrck»
2
3.4 коммутативность референтного материала (commutability of a reference material): Свойство референтного материала демонстрировать путем близости соответствия отношения между результатами измерения для установленной величины в данном материале, полученными в соответствии с двумя данными методиками измерения, с отношением, полученным между результатами измерений для других специфицированных материалов.
Примечания
1 Оцениваемый референтный материал обычно является калибратором, а другими специфицированными материалами обычно служат рутинные пробы
2 Методики измерения, указанные в определении, являются одна предшествующая и одна последующая за оцениваемым референтным материалом (калибратором) в иерархии калибровки Для дальнейшей информации см ИСО 17511
3 Стабильность коммутативного референтного материала должна регулярно проверяться
(ИСО/МЭК Руководство 99.2007, определение 5.15]
4 Хотя кровь была бы идеальной матрицей референтных материалов для устройств мониторинга глюкозы в крови, такие материалы в настоящее время недоступны
3.5 последовательный метод отбора (consecutive selection method): Метод взятия проб для изучения, при котором все субъекты, которые соответствуют всем критериям, могут быть приняты волонтерами для участия в изучении.
Примечания
1 Этот метод позволяет получать несмещенные пробы до тех пор. пока не произошла путаница в период испытаний Например, если исследования продолжаются в течение одного утра, субъекты изучения могут быть непрезентативными для целевой популяции, поскольку субъекты, посещающие клинику утром, могут быть непре-зентативными в отношении всех субъектов, посещающих клинику в разное время дня
2 Адаптировано из (5)
3.6 дезинфекция (disinfection): Процесс разрушения патогенных организмов или превращения их в инертные.
Примечание — Адаптировано из (6]
3.7 влияющая величина (influence quantity): Величина, которая при прямом измерении не влияет на измеряемую величину, но влияет на отношение между показанием измерения и результатом измерения.
Примеры
1 Частота прямого изморония оммотром с постоянной амплитудой альтернативного тона.
2 Концентрация количества вещества билирубина при прямом измерении концентрации количества вещества гемоглобина в плазме человеческой крови.
3 Температура микрометра, используемого для измерения длины стержней, но не температура самих стержней, которыо могут войти в опродоленио измеряемой величины.
4 Основное давление в источнике ионов масс-спектрометра при измерении фракции количества вещества.
Примечания
1 Непрямое измерение вовлекает комбинацию прямых измерений, каждое из которых может подвергаться воздействию влияющих величин
2 Адаптировано из ИСО/МЭК Руководство 99:2007, определение 2.52
3.8 промежуточная прецизионность измерения (intermediate measurement precision, intermediate precision): Прецизионность измерения при ряде условий измерения, которые включают в себя те же методики измерения, в том же месте и в параллельных измерениях у тех же или подобных субъектов в течение расширенного периода времени и могут включать другие условия, влекущие изменения.
Примечания
1 Интерпретация промежуточной прецизионности измерения требует, чтобы измененные и неизмененные условия были заданы, особенно такие переменные, как калибровки, партии реагентов, измерительные системы, операторы и условия окружающей среды
2 При оценке медицинских изделий для диагностики in vitro условия промежуточной прецизионности обычно избираются таким образом, чтобы представить действительные условия использования медицинских изделий in vitro в течение продолжительного периода времени
3 Относящиеся к данному вопросу понятия приведены в ИСО 5725-3
4 Промежуточная прецизионность может быть выражена количественно в терминах дисперсии характеристик измеренных значений, таких как стандартное (среднеквадратичное) отклонение, варианса и коэффициент вариации
5 Адаптировано из ИСО/МЭК Руководство 99:2007, определения 2 22 и 2 23
3
3.9 непрофессионал (lay person): Лицо без формального обучения в соответствующей области или дисциплине.
Примечания
1 Для целей настоящего стандарта как непрофессионал рассматривается пользователь устройства для мониторинга глюкозы в крови, который не обладает специфическими медицинскими, научными или техническими знаниями, относящимися к мониторингу глюкозы в крови
2 Адаптировано из ИСО 18113-1, определение 3 34
3.10 избранные изготовителем методики измерения (manufacturer's selected measurement procedures): Методики измерения, которые калиброваны одним или несколькими калибраторами и вали-дированы для предназначенного применения.
Примечания
1 В ИСО 17511 на рисунке 1 представлена избранная изготовителем методика измерения в цепи прослеживаемости
2 См ИСО 17511, перечисление 4 2 2 0
3.11 установленные изготовителем методики измерения (manufacturer s standing measurement procedures): Методики измерения, которые калиброваны одним или несколькими рабочими калибраторами изготовителя или высшим типом калибратора и валидированы для предназначенного применения.
Примечания
1 ИСО 15711, рисунок 1 представляет положение установленной изготовителем методики измерения в цепи прослеживаемости
2 См ИСО 17511, перечисление 4 2 2 h)
3.12 точность измерения (measurement accuracy, accuracy): Близость согласования между значением измеренной величины и истинным значением величины измеренной величины.
Примечания
1 Понятие «точность измерения» не является величиной и не имеет численного значения величины Измерение называют более точным, когда оно дает меньшую ошибку измерения
2 Термин «точность измерения» не используется для правильности измерения и термин «прецизионность измерения* не используется для точности измерения, однако он связан с обоими этими понятиями
3 «Точность измерения» иногда понимается как близость согласования между значениями измеренной величины. которые приписывают измеряемой величине (мезюранду)
[ИСО/МЭК Руководство 99 2007, определения 2 13)
3.13 смещение измерения (measurement bias, bias): Оценка систематической ошибки измерения.
Примечания
1 Смещение обратно связано с правильностью
2 Оценка смещения является средним значением серии измерений минус референтное значение величины
3 Адаптировано из ИСО/МЭК Руководство 99 2007, определение 2 18
3.14 прецизионность измерения (measurement precision, precision): Близость соответствия показателей измерения или значений измеренной величины, полученных параллельными измерениями одного и того же или сходного объекта в заданных условиях.
Примечания
1 Прецизионность измерения обычно выражается численно такими мерами непрецизионности, как стандартное (среднеквадратичное) отклонение, варианса или коэффициент вариации в заданных условиях измерения
2 Термин «заданные условия» может, например, означать условия повторяемости измерения, условия промежуточной прецизионности измерения или условия воспроизводимости измерения
3 Прецизионность измерения используется для определения повторяемости измерения, промежуточной прецизионности измерения или воспроизводимости измерения
4 Параллельные измерения означают измерения, которые получены способом, не испытывающим влияний предшествующих измерений той же или сходной пробы
5 Адаптировано из ИСО/МЭК Руководство 99 2007, определение 2 15
3.15 повторяемость измерения (measurement repeatability, repeatability): Прецизионность измерения в ряде условий измерения, которые включают в себя одни и те же методики измерения, тех же операторов, ту же измерительную систему, те же условия выполнения и то же место работы и параллельные измерения тех же или подобных объектов за короткий период времени.
4
Примечания
1 В клинической химии для обозначения этого понятия иногда используется термин «внутрисерийная прецизионность».
2 При оценивании медицинского изделия для диагностики in vrtro обычно избираются условия повторяемости для того, чтобы представить не измененные существенным образом условия (называемые условиями повторяемости). приводящие к минимальной вариабельности измеренных значений Информация о повторяемости может быть полезной для целей поиска неисправностей
3 Повторяемость может быть выражена количественно в терминах характеристик дисперсии измеренных значений, таких как стандартное (среднеквадратичное) отклонение повторяемости, варианса повторяемости и коэффициент вариации повторяемости Соответствующие статистические термины приведены в ИСО 5725-2
4 Адаптировано из ИСО/МЭК Руководство 99:2007. определения 2 20 и 2 21
3.16 воспроизводимость измерения (measurement reproducibility, reproducibility): Прецизионность измерения в условиях измерения, которые включают в себя различные места выполнения, операторов. измерительные системы и параллельные измерения одних и тех же или сходных объектов.
Примечания
1 В клинической химии для обозначения данного понятия иногда употребляется термин «межлабораторная прецизионность».
2 При оценивании медицинского изделия для диагностики in vitro обычно избираются условия воспроизводимости для того, чтобы представить максимально измененные условия (называемые условиями воспроизводимости), приводящие к вариабельности измеренных значений, которые следует учитывать при сравнении результатов измерений между независимыми лабораториями в программах межлабораторных сличений (например. испытаний профессиональной компетентности, внешней оценке качества или исследований стандартизации лабораторий)
3 Воспроизводимость может быть выражена количественно в терминах характеристик дисперсии измеренных значений, таких как стагщартное(среднеквадратичное) отклонение воспроизводимости, варианса воспроизводимости и коэффициент вариации воспроизводимости Соответствующие статистические термины приведены в
ИСО 5725-2
4 Различные измерительные системы могут использовать различные методики измерения
5 Спецификации должны задать условия измененные и неизмененные, чтобы оценить степень изменений практически
6 Адаптировано из ИСО/МЭК Руководство 99:2007, определения 2 24 и 2.25
3.17 правильность измерения (measurement trueness, trueness): Близость соответствия между средним неопределенного числа повторных значений измеренных величин и референтным значением величины.
Примечания
1 Правильность измерения не является величиной и не может быть выражена численно, однако меры близости соответствия приведены в ИСО 5725-1
2 Правильность измерения имеет обратную связь с систематической ошибкой измерения, но не связана со случайной ошибкой измерения
3 Точность измерения не должна применяться для обозначения «правильности измерения» и наоборот
(ИСО/МЭК Руководство 99:2007. определение 2 14]
3.18 интервал измерения (measuring interval): Ряд значений величин одного и того же рода, которые могут быть измерены данным измерительным инструментом или измерительной системой со специфицированной неопределенностью измерения в определенных условиях.
Примечания
1 Интервал измерения, в пределах которого функциональные характеристики медицинского изделия для диагностики in vrtro были подтверждены, называют «Veportable range*
2 Нижний предел интервала измерения не обязательно совпадает с пределом обнаружения См ИСО 18113-1 2009, А 2 В для дополнительной информации
3 Для обсуждения разницы между интервалом и рядом (range) см ИСО 18113-1 2009, А 2 11
4 Адаптировано из ИСО/МЭК Руководство 99 2007, определение 4 7 Примечание
3.19 метрологическая прослеживаемость (metrological traceability): Свойство результата измерения. которым результат может быть связан со стандартом измерения через документированную цепь калибровок, каждой из которых приписана неопределенность измерения
Примечания
1 Для данного определения стандартом может быть определение единицы измерения через ее практическую реализацию или методика измерения, включающая в себя единицу измерения неординальной величины или стандарт измерения
5
2 Метрологическая прослеживаемость требует установления иерархии калибровок Последовательность стандартов измерения и калибровок, которые используются, чтобы связать результат измерения со стандартом измерения, называют цепью прослеживаемости Цепь метрологической прослеживаемости применяется для установления метрологической прослеживаемости результата измерения, включая в себя значения калибратора См ИСО 15711 для примеров цепей прослеживаемости, относящихся к медицинским изделиям для диагностики in vitro
3 Спецификации установленных стандартов измерения могут включать в себя время, когда этот стандарт измерения был использован для установления иерархии калибровок, вместе с любой другой относящейся к делу метрологической информацией относительно стандарта измерения, такой, как время выполнения первой калибровки в иерархии калибровок
4 Для измерений более одной величины на входе в модели измерения каждое из значений величины может само быть метрологически прослеженным и соответствующая иерархия калибровки может образовать ветвистую структуру или сеть Усилия, приложенные для установления метрологической прослеживаемости для каждой величины на входе должны быть соразмерными с их относительным вкладом в результат измерения
5 Сравнение между стандартами измерения может рассматриваться как калибровка, если для проверки используется сравнение и, если необходимо, корректное значение величины и неопределенность измерения приписываются одному из стандартов измерения
6 Сокращенный термин «прослеживаемость» иногда используется для обозначения метрологической прослеживаемости. а также и других понятий, таких как прослеживаемость пробы или прослеживаемость документа, или прослеживаемость инструмента, или прослеживаемость материала, когда история (след) объекта имеет значение Поэтому полный термин «метрологическая прослеживаемость» является предпочтительным, если существует вероятность неправильного понимания
7 Адаптировано из ИСО/МЭК Руководство 99 2007, определение 2 41
3.20 цепь метрологической прослеживаемости (metrological traceability chain, traceability chain): Последовательность стандартов измерения и калибровок, которая используется, чтобы связать результат измерения со стандартом.
Примечания
1 Цепь метрологической прослеживаемости определяется через иерархию калибровок
2 Цепь метрологической прослеживаемости используется для установления метрологической прослеживаемости результата измерения
3 Сравнение между двумя стандартами измерения может рассматриваться как калибровка, если сравнение используется для проверки и, если необходимо, коррекции значения величины и неопределенности измерения, приписанных одному из стандартов измерения
[ИСО/МЭК Руководство 99 2007, определение 2 42]
3.21 объемная доля эритроцитов в крови (packed cell volume): Объемная доля эритроцитов в крови.
Примечания
1 Выражается как десятичная доля (СИ) или как процент общепринятой применяемой единицы СИ (л/л).
2 Иногда применяется термин «гематокрит» по наименованию инструмента, первоначально примененного для оценки объемной доля эритроцитов в крови
3.22 система реагентов (reagent system): Медицинское изделие для диагностики in vitro, которое производит сигнал в ответ на измеримую величину.
Пример — Для устройства мониторинга глюкозы сигналом может быть химическая или электрохимическая реакция с глюкозой в пробе крови.
3.23 референтные методики выполнения измерения (reference measurement procedures): Методики выполнения измерения, принятые как дающие результаты измерения, отвечающие их предназначенному применению при оценке правильности измерения значений измеренной величины, полученных от другой методики измерения для величин того же рода, при калибровке или для характеристики референтных материалов.
[ИСО/МЭК Руководство 99:2007. определение 2.7]
3.24 референтное значение величины (reference quantity value, reference value): Значение величины. используемое как основа для сравнения со значениями величин того же рода.
Примечания
1 Референтное значение величины может быть истинным значением величины меэюрамда (измеряемой величины). в этом случае оно неизвестно, или согласованным значением величины, в этом случае оно известно
2 Референтное значение величины с сочетающейся с ним неопределенностью измерения обычно предоставляется со ссылкой на
- материал, например сертифицированный референтный материал;
- устройство, например, стабилизированный лазер,
6