ГОСТ Р ИСО 14708-3-2016
Имплантаты для хирургии. Активные имплантируемые медицинские изделия. Часть 3. Имплантируемые нейростимуляторы
Распространяется на активные имплантируемые медицинские изделия, предназначенные для электрической стимуляции центральной или периферической нервной системы.
Идентичен ISO 14708-3:2008
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Обозначения и сокращения
5 Общие требования к неимплантируемым частям
6 Требования к активным имплантируемым медицинским изделиям определенных видов
7 Общие требования к упаковке
8 Общая маркировка активных имплантируемых медицинских изделий
9 Маркировка на товарной упаковке
10 Конструкция товарной упаковки
11 Маркировка на стерильном пакете
12 Конструкция одноразовой упаковки
13 Маркировка активных имплантируемых медицинских изделий
14 Защита от непреднамеренных биологических воздействий, вызванных активным имплантируемым медицинским изделием
15 Защита пациента или пользователя от вреда, вызванного внешними физическими особенностями активного имплантируемого медицинского изделия
16 Защита пациента от вреда, вызванного электрическим током
17 Защита пациента от вреда, вызванного тепловыделениями
18 Защита от ионизирующего излучения, выделяемого или испускаемого активным имплантируемым медицинским изделием
19 Защита от непреднамеренных воздействий, вызванных изделием
20 Защита изделия от повреждений, вызванных применением наружных дефибрилляторов
21 Защита изделия от изменений, вызванных электрическими полями высокой энергии, приложенными непосредственно к пациенту
22 Защита активного имплантируемого медицинского изделия от изменений, вызванных применением разнородных видов лечения
23 Защита активного имплантируемого медицинского изделия от воздействия механических сил
24 Защита активного имплантируемого медицинского изделия от повреждений, вызванных электростатическим разрядом
25 Защита активного имплантируемого медицинского изделия от повреждений, вызванных изменениями атмосферного давления
26 Защита активного имплантируемого медицинского изделия от повреждений, вызванных изменениями температуры
27 Защита активного имплантируемого медицинского изделия от электромагнитного неионизирующего излучения
28 Сопровождающая документация
Приложение АА (справочное) Соответствие между фундаментальными принципами ИСО/ТО 14283 [8] и разделами настоящего стандарта
Приложение ВВ (справочное) Связь между разделами настоящего стандарта и фундаментальными принципами, перечисленными в приложении АА
Приложение СС (справочное) Обоснование
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Библиография
46 страниц
| Дата введения | 01.10.2017 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 21.10.2016 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1487-ст |
|---|---|---|---|
| Разработан | ООО НТЦ МЕДИТЭКС | ||
| Издан | Стандартинформ | 2016 г. |
Implants for surgery. Active Implantable medical devices. Part 3. Implantable neurostimulators
- ГОСТ Р 51317.2.5-2000 Совместимость технических средств электромагнитная. Электромагнитная обстановка. Классификация электромагнитных помех в местах размещения технических средств
- ГОСТ Р 51318.11-2006 Совместимость технических средств электромагнитная. Промышленные, научные, медицинские и бытовые (ПНМБ) высокочастотные устройства. Радиопомехи индустриальные. Нормы и методы измерений
ГОСТ Р ИСО 15223-1-2010Изделия медицинские. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации. Часть 1. Общие требования. Заменен на ГОСТ Р ИСО 15223-1-2014.- ГОСТ ISO 14971-2011 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
- ГОСТ ISO 10993-1-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
- ГОСТ Р ИСО 14708-1-2012 Имплантаты хирургические. Активные имплантируемые медицинские изделия. Часть 1. Общие требования к безопасности, маркировке и информации, предоставляемой изготовителем
- ГОСТ 30805.14.1-2013 Совместимость технических средств электромагнитная. Бытовые приборы, электрические инструменты и аналогичные устройства. Радиопомехи индустриальные. Нормы и методы измерений
- ГОСТ Р МЭК 60601-1-2-2014 Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания
- ГОСТ 30805.22-2013 Совместимость технических средств электромагнитная. Оборудование информационных технологий. Радиопомехи индустриальные. Нормы и методы измерений
- ГОСТ Р ИСО 14155-2014 Клинические исследования. Надлежащая клиническая практика
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7
стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14
стр. 15

стр. 16
стр. 17
стр. 18
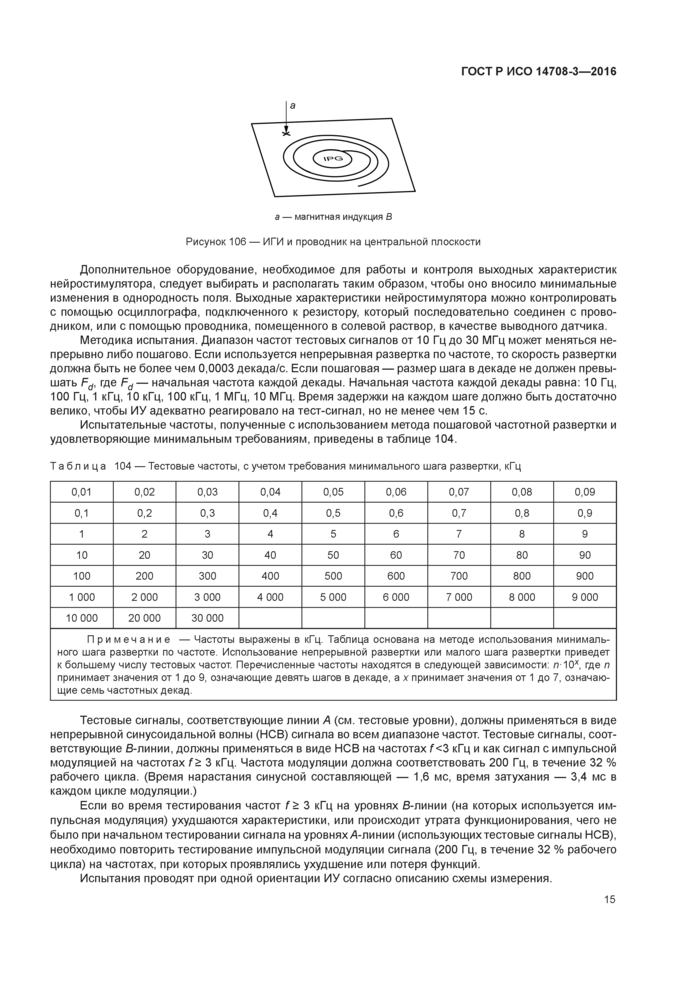
стр. 19

стр. 20

стр. 21

стр. 22
стр. 23
стр. 24
стр. 25
стр. 26
стр. 27
стр. 28
стр. 29

стр. 30
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ГОСТР ИСО 14708-3-2016
ИМПЛАНТАТЫ ДЛЯ ХИРУРГИИ
Активные имплантируемые медицинские изделия
Часть 3
Имплантируемые нейростимуляторы
(ISO 14708-3:2008, ЮТ)
Издание официальное
Москва
Стандартинформ
2016
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Научно-технический центр «МЕДИТЭКС» (ООО «НТЦ «МЕДИТЭКС») на основе собственного перевода англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 011 «Медицинские приборы, аппараты и оборудование»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерапьного агентства по техническому регулированию и метрологии от 21 октября 2016 г. № 1487-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 14708-3:2008 «Имплантаты для хирургии. Активные имплантируемые медицинские изделия. Часть 3. Имплантируемые нейростимуляторы» (ISO 14708-3:2008 «Implants for surgery — Active implantable medical devices — Part 3: Implantable neurostimulators». IDT).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации и действующие в этом качестве межгосударственные стандарты, сведения о которых приведены в дополнитепь-ном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к наспюящему стандарту публикуется в годовом (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указа тепе «Национальные стандарты» В случае пересмотра(замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной сиспюме общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ. 2016
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии II
Дополнительный подпункт:
11.101 Для приведенных ниже компонентов маркировка на стерильном пакете должна содержать следующую дополнительную информацию:
a) Имплантируемый генератор импульсов (ИГИ):
- число электропроводников и/или каналов;
- вид выходного сигнала: постоянный ток или постоянное напряжение:
- максимальная рекомендуемая глубина имплантации;
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
b) Проводник:
- тип проводника (хирургический, подкожный, наручный. ЦНС, периферический и т. д);
- число электропроводников в проводнике;
- длина проводника (в сантиметрах);
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
c) Кабель-удлинитель:
- тип кабеля (низкопрофильный, раздвоенный и т. д);
- число электропроводников в кабеле;
- длина кабеля-удлинителя (в сантиметрах);
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
d) РЧ приемник:
- максимальная рекомендуемая глубина имплантации;
- средства идентификации соответствующего радиочастотного передатчика;
- средства идентификации соответствующего проводника, если он является присоединяемым;
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
Соответствие проверяют в ходе осмотра.
12 Конструкция одноразовой упаковки
Применяют соответствующий раздел ИСО 14708-1.
13 Маркировка активных имплантируемых медицинских изделий
Применяют соответствующий раздел ИСО 14708-1. за исключением следующего.
13.1 Изменение:
Тест на влажное протирание, после которого маркировка должна оставаться читаемой, заменен пунктом 7.1.3, перечисление Ь) МЭК 60601-1:2005.
14 Защита от непреднамеренных биологических воздействий, вызванных активным имплантируемым медицинским изделием
Применяют соответствующий раздел ИСО 14708-1. за исключением следующего.
14.2 Замена:
Любая часть активного имплантируемого медицинского изделия, которая при нормальном использовании контактирует с жидкими средами организма человека, должна быть оценена на отсутствие выделения опасного числа твердых частиц.
Методика тестирования. Активное имплантируемое медицинское изделие асептически извлекают из одноразовой упаковки. Имплантируемую часть погружают в пригодный для инъекций раствор соли 9 г/л. находящийся в нейтральном стеклянном контейнере. Объем соляного раствора должен примерно в (5 ± 0.5) раз превышать объем испытуемой части. Контейнер накрывают стеклянной пластиной и выдерживают в течение временного промежутка от 8 до 18 ч при температуре (37 ± 2) “С. периодически встряхивая. Затем готовят контрольный раствор аналогичного объема с той же концентрацией соли, поддерживают те же условия, что и в контейнере с образцом. Образец жидкости из контейнера сравни-
7
вают с образцом контрольного раствора с помощью аппаратуры для автоматического измерения размеров частиц, работающей по принципу оптического затенения (к примеру, метод 2.9.19 Европейской Фармакопеи. 3 издание. 1977 (Совет Европы) [3)). При тестировании применяют процедуру отбора образцов. рекомендованную изготовителем.
Отношение среднего числа частиц, выделяющихся из образца, к среднему числу частиц, выделяющихся из контрольного раствора, не должно превышать число, определенное изготовителем как небезопасное. Если изготовитель не определил это число, среднее число частиц не должно превышать 100частиц/мл для частиц размерами более 5.0 мкм и 5 частиц/мл для частиц размерами более 25 мкм.
Соответствие должно быть подтверждено проверкой анализа конструкции, предоставленного изготовителем. при необходимости — дополнительно расчетами изготовителя и данными тестовых исследований.
14.3 Дополнение:
Биологическая совместимость может быть оценена в соответствии с частями ИСО 10993. например. ИСО 10993-1.
15 Защита пациента или пользователя от вреда, вызванного внешними физическими особенностями активного имплантируемого медицинского изделия
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
15.1 Изменение:
Пункт 23 МЭК 60601-1:1988 заменен на подраздел 9.3 МЭК 60601-1:2005 (см. раздел 5).
Соответствие должно быть проверено согласно МЭК 60601-1.
16 Защита пациента от вреда, вызванного электрическим током
Применяют соответствующий раздел ИСО 14708-1. за исключением следующего.
16.1 Изменение.
Пункт 19 МЭК 60601-1:1988 заменен на подраздел 8.7 МЭК 60601-1:2005 (с»и. раздел 5).
16.2 Дополнение:
Если результаты оценки степени риска или другие данные (например, опубликованные данные исследований, тестовые исследования, расчеты) укажут, что для отдельных видов применения предел не должен превышать 1 мкА, для снижения риска допустимый предел должен быть изменен.
Примечание — Настоящий пункт предназначен для имплантируемых частей, которые зависят от источника электрической энергии, таких как РЧ приемники
16.3 Замена:
Изолирующие части имплантируемых проводников или кабелей-удлинителей, включающие в себя электропроводники, должны быть сконструированы таким образом, чтобы выдерживать электрическое напряжение, приложенное к изоляции в нормальных условиях работы в течение запланированного срока службы изделия
Соответствие должно быть подтверждено проверкой анализа конструкции, предоставленного изготовителем. при необходимости — дополнительно расчетами изготовителя и данными тестовых исследований.
Дополнительный подпункт:
16.101 Конструкция нейростимулятора должна включать в себя защиту электрических характеристик выходного импульса от случайных изменений.
Примечание 1 — Примеры случайных изменений избыточная плотность заряда, избыточное напряжение. внезапные изменения амплитуды стимуляции и скорости распространения и т д
Соответствие должно быть подтверждено проверкой анализа конструкции, предоставленного изготовителем. при необходимости — дополнительно расчетами изготовителя и данными тестовых исследований.
Примечание 2 — Анализ может быть вклинен в результаты анализа рисков, который проводится в соответствии с 19.3.
8
17 Защита пациента от вреда, вызванного тепловыделениями
Замена:
Ни одна из наружных поверхностей имплантируемой части нейростимулятора не должна нагреваться более чем на 2 °С выше нормальной температуры тела пациента как при стабильной работе, так и в условиях единичного отказа, если изготовитель не укажет, что более значительное повышение температуры целесообразно для применения в особых случаях
Для подтверждения соответствия необходимо проанализировать документацию изготовителя, включая результаты моделирования, анализ конструкции или оценку степени риска, тестовые исследования или другие соответствующие документы.
Примечание — Современные исследования показывают, что в зависимости от местоположения определенной ткани в теле человека температурный предел 2 ’С накладывает излишние ограничения Учитывая это обстоятельство, изготовитель может привести свое обоснование
18 Защита от ионизирующего излучения, выделяемого или испускаемого активным имплантируемым медицинским изделием
Применяют соответствующий раздел ИСО 14708-1.
19 Защита от непреднамеренных воздействий, вызванных изделием
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
19.2 Замена:
Если срок службы (см. 3.106) имплантируемого нейростимулятора зависит от встроенного источника электроэнергии, такого как батарея, изготовитель должен предусмотреть в изделии индикатор, предупреждающий о низком заряде источника электроэнергии. Изготовитель также должен определить продолжительность срока службы источника электроэнергии после предупреждения о низком заряде.
Для подтверждения соответствия используется анализ конструкции, представленный изготовителем и подтвержденный результатами испытаний в соответствующей форме.
Примечание — Настоящий подпункт также применим к перезаряжающимся источникам энергии 19 3 Замена:
Конструкция имплантируемого нейростимулятора должна исключать возможность возникновения недопустимого риска в случае отказа любого из компонентов, части изделия или программного обеспечения (если изделие имеет встроенную электронную систему программирования).
Метод оценки. Оценка рисков и менеджмент рисков осуществляются в соответствии с опубликованными стандартами, такими как ИСО 14971 (5].
Соответствие должно быть подтверждено отчетами менеджмента риска или эквивалентными документами изготовителя.
19 4 Изменение:
Система оценки изменена для возможности проведения клинических исследований в соответствии с опубликованными стандартами, такими как ИСО 14155-1 (6) или ИСО 14155-2 [7].
20 Защита изделия от повреждений, вызванных применением наружных дефибрилляторов
Применяют соответствующий раздел ИСО 14708-1.
21 Защита изделия от изменений, вызванных электрическими полями высокой энергии, приложенными непосредственно к пациенту
Применяют соответствующий раздел ИСО 14708-1.
9
22 Защита активного имплантируемого медицинского изделия от изменений, вызванных применением разнородных видов лечения
Дополнение:
Должно быть рассмотрено влияние других методов диагностики и лечения, таких как магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ), ультразвуковое исследование (УЗИ), литотрипсия и т. д. Соответствие подтверждается обзором документации изготовителя, в том числе результатов моделирования, проектирования или оценки рисков, результатами испытаний и другими соответствующими данными.
23 Защита активного имплантируемого медицинского изделия от воздействия механических сил
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
23.1 Замена:
Неимплантируемые части имплантируемого нейростимулятора должны соответствовать подразделу 15.3 МЭК 60601-1:2005 (см. раздел 5). Неимплантируемые части, переносимые пациентом, должны выдерживать по три удара в трех различных направлениях, которые могут случиться при нормапь-ном использовании (см. подпункт 15.3.4.1 МЭК 60601-1:2005).
Соответствие должно быть проверено согласно МЭК 60601-1.
23.2 Изменение:
Конструкция имплантируемых частей нейростимулятора должна выдерживать механическое воздействие. которое может возникнуть при нормальных условиях использования:
a) рабочая полоса частот: от 5 до 500 Гц;
b) спектральная плотность мощности: 0.7 (м/с^/Гц;
c) форма спектральной плотности мощности: плоская горизонтальная от 5 до 500 Гц;
d) продолжительность тестирования: 30 мин по каждой из трех взаимно перпендикулярных осей.
24 Защита активного имплантируемого медицинского изделия от повреждений, вызванных электростатическим разрядом
Замена:
Неимплантируемые части имплантируемого нейростимулятора должны соответствовать пункту 6.2.2 МЭК 60601-1-2:2007 (см. раздел 5).
Соответствие проверяют по МЭК 60601-1-2.
25 Защита активного имплантируемого медицинского изделия
от повреждений, вызванных изменениями атмосферного давления
Применяют соответствующий раздел ИСО 14708-1.
26 Защита активного имплантируемого медицинского изделия от повреждений, вызванных изменениями температуры
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
26.1 Изменение:
Раздел 42 МЭК 60601-1:1998 заменен подразделом 11.1 МЭК 60601-1:2005 (см. раздел 5).
27 Защита активного имплантируемого медицинского изделия от электромагнитного неионизирующего излучения
Замена:
27.101 Помехоустойчивость
Имплантируемые части нейростимулятора не должны наносить вред или вызывать локальное увеличение плотности электрического тока в теле пациента вследствие восприимчивости к электри-10
ческим воздействиям внешних электромагнитных полей, неисправности. поврехщения или нагрева изделия.
Соответствие должно быть подтверждено анализом результатов испытаний и документацией, подготовленной изготовителем, для испытаний согласно 27.103—27.106.
27.102 Общие условия испытаний
a) Режим работы
Во время испытания на помехоустойчивость все функции имплантируемого нейростимулятора, связанные с основными функциональными характеристиками, должны быть испытаны в режимах наиболее важных с точки зрения состояния пациента, определенных на основании анализа рисков. В испытательной документации должны быть перечислены функции и используемые режимы.
Примечание — Например, основные характеристики могут быть связаны с амплитудой импульса или другими выходными характеристиками, изменение которых может быть опасным
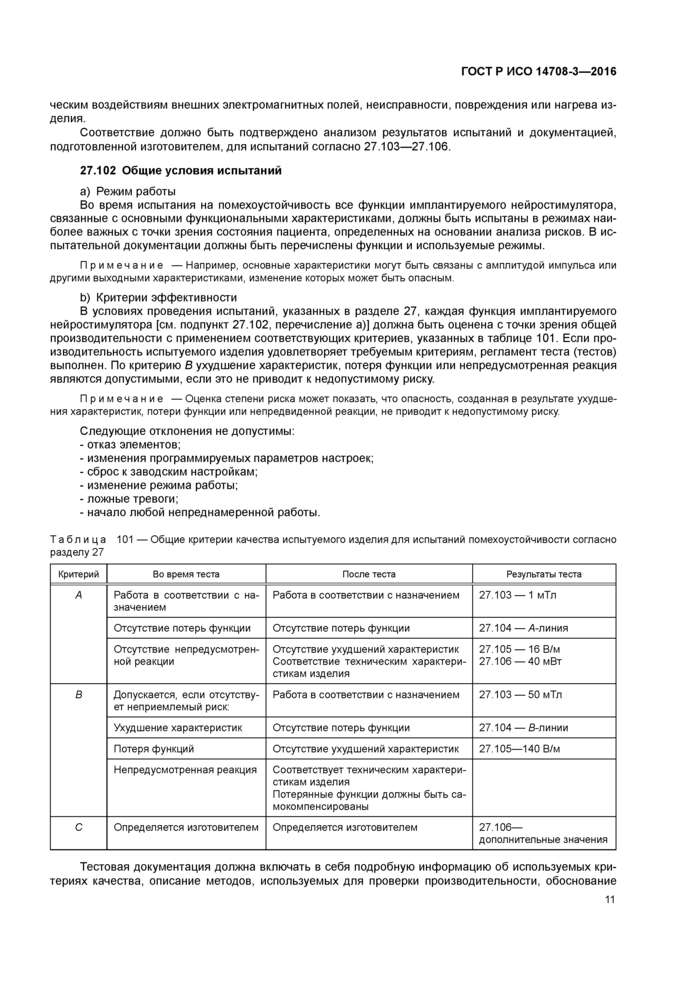
b) Критерии эффективности
В условиях проведения испытаний, указанных в разделе 27. каждая функция имплантируемого нейростимулятора [см. подпункт 27.102. перечисление а)] должна быть оценена с точки зрения общей производительности с применением соответствующих критериев, указанных в таблице 101. Если производительность испытуемого изделия удовлетворяет требуемым критериям, регламент теста (тестов) выполнен. По критерию В ухудшение характеристик, потеря функции или непредусмотренная реакция являются допустимыми, если это не приводит к недопустимому риску.
Примечание — Оценка степени риска может показать, что опасность, созданная в результате ухудшения характеристик, потери функции или непредвиденной реакции, не приводит к недопустимому риску
Следующие отклонения не допустимы:
- отказ элементов:
- изменения программируемых параметров настроек;
- сброс к заводским настройкам;
- изменение режима работы;
- ложные тревоги;
- начало любой непреднамеренной работы.
|
Таблица 101 — Общие критерии качества испытуемого изделия для испытаний помехоустойчивости согласно разделу 27 | |||||||||||||||||||||||||||||||
|
Тестовая документация должна включать в себя подробную информацию об используемых критериях качества, описание методов, используемых для проверки производительности, обоснование
11
любых используемых допущений настоящего подпункта и отчет о результатах испытаний, в котором указаны характеристики ИУ относительно критериев А. В или С.
В сопроводительной документации должны быть описаны выявленные в результате проверки помехоустойчивости ИУ электромагнитные помехи, о которых пациенту необходимо знать или избегать их (см. подпункт 28.22).
c) Конструкция ИУ
Конструкция ИУ включает ИГИ, проводник и любую другую имплантируемую часть, необходимую для работы изделия. Длина проводника и его расположение для каждого испытания приведены в описании испытательной установки.
Нейростимуляторы, которые имеют более одной допустимой конфигурации электродов для стимуляции. такие как биполярные или однополярные, необходимо испытывать с электродом, наиболее восприимчивым к электромагнитным помехам.
Примечание — Наиболее подвержены воздействию магнитного поля однополярные электроды Восприимчивость электрических полей, как правило, зависит от конструктивного исполнения нейростимулятора
Документация по тестированию должна содержать описание конфигурации ИУ и условий окружающей среды, в которых проводится испытание (например, температура и давление).
d) Проверка не наблюдаемых в норме функций
Необходимо предусмотреть методы проверки функций, которые не наблюдаются или не проверяется при нормальной работе [см. подпункт 27.102. перечисление а)). Для этого может потребоваться использование специальных аппаратных или программных средств.
e) Имплантируемые нейростимуляторы, использующие беспроводную телеметрию
Критерий В для проверки функции телеметрии применяется в виде исключения для удовлетворения требований подпункта 27.102, перечисление а). Все остальные функции должны соответствовать указанным требованиям.
Группа исключений не должна быть больше, чем это необходимо для работы в соответствии с назначением.
О Имплантируемый РЧ приемник нейростимулятора
Для нейростимуляторов, конструкция которых основана на неимплантируемом РЧ передатчике и имплантируемом РЧ приемнике, испытания проводят в соответствии с МЭК 60601-1-2. За основу установки для испытаний имплантируемой части должна быть взята установка, описанная в 27.105.
Примечание — Испытание, описанное в разделе 27 настоящего стандарта, не применяется Имплантируемый РЧ приемник работает совместно с неимплантируемым передатчиком, на который распространяется МЭК 60601-1-2. РЧ приемник можно подвергать только проверке на помехоустойчивость согласно МЭК 60601-1-2
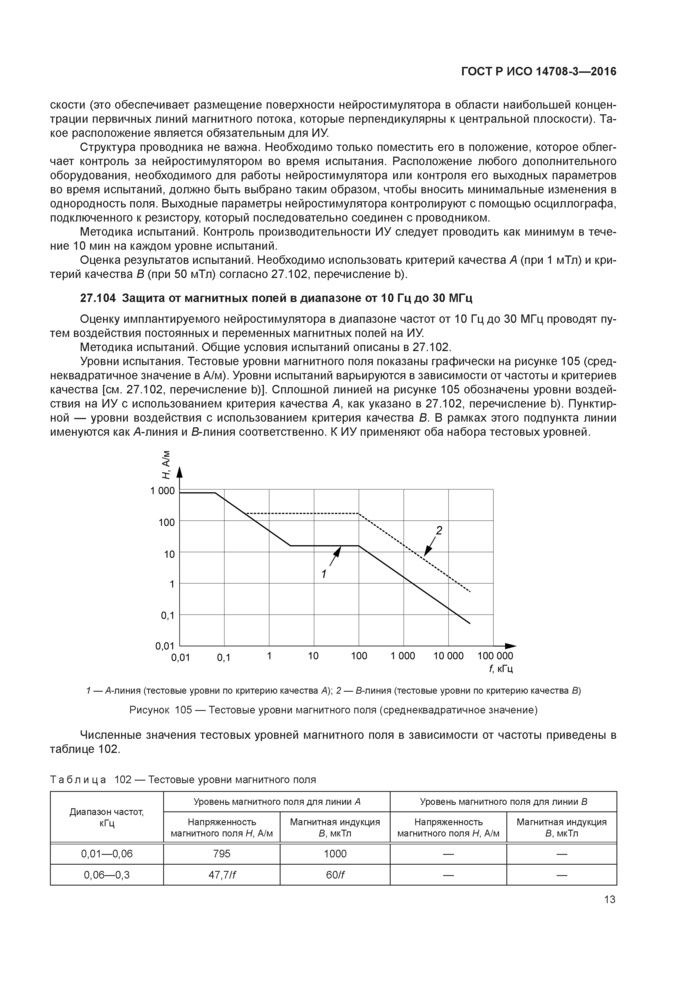
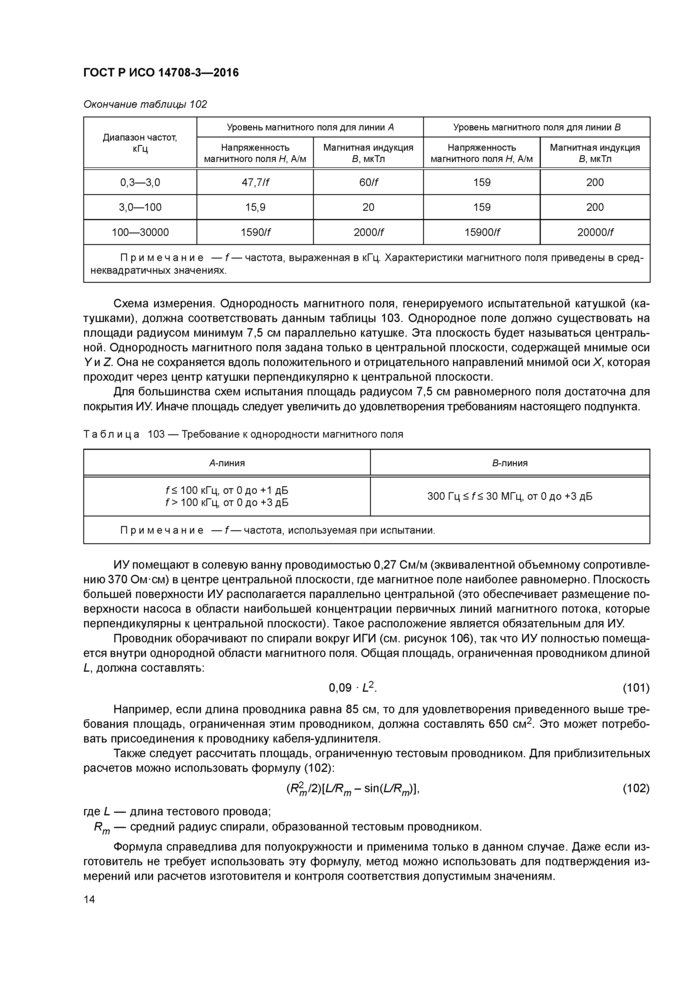
27.103 Защита от постоянного магнитного поля
Оценку работы имплантируемого нейростимулятора при постоянных магнитных полях проводят путем воздействия на ИУдвух уровней статических (не изменяющихся во времени) полей.
Метод тестирования. Общие условия испытаний описаны в 27.102.
Уровни испытания. Используют два уровня напряженности электромагнитного поля, к каждому применяют различные критерии качества. ИУ должно быть подвергнуто воздействию магнитного поля нижнего уровня индукции 1 мТл с применением критерия качества А, как указано в 27.102. перечисление Ь). Второй уровень магнитной индукции, равный 50 мТл. должен быть использован с применением критерия качества В.
Схема измерения. Устройство генерирования магнитного поля должно воспроизводить поле с однородностью от 0 до 3 дБ на площади радиусом минимум 7.5 см. лежащей в параллельной к аппарату плоскости.
Эта плоскость будет называться центральной. Однородность магнитного поля задана только в центральной плоскости, содержащей мнимые оси У и Z. Однородность магнитного поля не сохраняется вдоль положительного и отрицательного направлений мнимой оси X, которая проходит через центр изделия перпендикулярно к центральной плоскости.
Для большинства схем испытаний (см. подпункт 27.102) площадь равномерного поля радиусом 7.5 см достаточна для покрытия ИУ. Иначе площадь равномерного поля следует увеличивать до удовлетворения требованиям настоящего подпункта.
ИУ размещают в центре центральной плоскости, в котором магнитное поле является наиболее равномерным. Плоскость поверхности ИУ должна быть расположена параллельно центральной пло-12
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения...............................................................2
4 Обозначения и сокращения............................................................2
5 Общие требования к неимллантируемым частям...........................................2
6 Требования к активным имплантируемым медицинским изделиям определенных видов..........3
7 Общие требования к упаковке..........................................................5
8 Общая маркировка активных имплантируемых медицинских изделий..........................5
9 Маркировка на товарной упаковке.......................................................6
10 Конструкция товарной упаковки........................................................6
11 Маркировка на стерильном пакете......................................................6
12 Конструкция одноразовой упаковки.....................................................7
13 Маркировка активных имплантируемых медицинских изделий...............................7
14 Защита от непреднамеренных биологических воздействий, вызванных активным
имплантируемым медицинским изделием...............................................7
15 Защита пациента или пользователя от вреда, вызванного внешними физическими
особенностями активного имплантируемого медицинского изделия..........................8
16 Защита пациента от вреда, вызванного электрическим током...............................8
17 Защита пациента от вреда, вызванного тепловыделениями.................................9
18 Защита от ионизирующего излучения, выделяемого или испускаемого активным
имплантируемым медицинским изделием...............................................9
19 Защита от непреднамеренных воздействий, вызванных изделием...........................9
20 Защита изделия от повреждений, вызванных применением наружных дефибрилляторов........9
21 Защита изделия от изменений, вызванных электрическими полями высокой энергии,
приложенными непосредственно к пациенту.............................................9
22 Защита активного имплантируемого медицинского изделия от изменений, вызванных
применением разнородных видов лечения..............................................10
23 Защита активного имплантируемого медицинского изделия от воздействия механических сил ... 10
24 Защита активного имплантируемого медицинского изделия от повреждений, вызванных
электростатическим разрядом........................................................10
25 Защита активного имплантируемого медицинского изделия от повреждений, вызванных
изменениями атмосферного давления .................................................10
26 Защита активного имплантируемого медицинского изделия от повреждений, вызванных
изменениями температуры...........................................................10
27 Защита активного имплантируемого медицинского изделия от электромагнитного
неионизирующего излучения.........................................................10
28 Сопровождающая документация......................................................17
Приложение АА (справочное) Соответствие между фундаментальными принципами
ИСО/ТО 14283 (8) и разделами настоящего стандарта.........................19
Приложение ВВ (справочное) Связь между разделами настоящего стандарта и фундаментальными
принципами, перечисленными в приложении АА..............................29
Приложение СС (справочное) Обоснование...............................................31
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
национальным стандартам Российской Федерации...........................38
Библиография........................................................................40
Введение
Настоящий стандарт определяет частные требования к активным имплантируемым медицинским изделиям, предназначенным для электрической стимуляции центральной или периферической нервной системы в целях обеспечения безопасности использования как для пациентов, так и для специалистов. Настоящий стандарт вносит изменения и дополнения в ИСО 14708-1:2000. именуемый в дальнейшем ИСО 14708-1. Требования настоящего стандарта являются приоритетными по отношению к требованиям ИСО 14708-1.
Изделия, которые используют электричество для стимуляции нервной системы, называют нейростимуляторами. Они производят контролируемые электрические импульсы, которые передаются через электроды, зафиксированные в зоне предполагаемой стимуляции. В полностью или частично имплантируемых нейростимуляторах импульс стимуляции передается на электроды от генератора формы импульса. Для этого, как правило, требуется проводник или кабель-удлинитель, но при использовании новых видов изделий они необязательны Для настройки параметров изделия может быть применено внешнее программирующее устройство.
В настоящее время существует несколько видов нейростимуляторов для лечения центральной или периферической нервной системы. Настоящий стандарт применим к нейростимуляторам различных видов терапии (см. раздел 3 в части определения типа изделия.)
Действие настоящего стандарта распространяется на все части и принадлежности имплантируемых нейростимуляторов, в том числе на программатор, испытательный образец, программное обеспечение и техническую документацию. Не все детали и принадлежности предназначены для полной или частичной имплантации, но поскольку некоторые неимплантируемые части и принадлежности могут повлиять на безопасность или стабильность работы изделия, то к ним также необходимо определить ряд требований.
В настоящую редакцию стандарта не включены требования к функциям имплантируемых нейростимуляторов в части измерения физиологических параметров Они могут быть рассмотрены в последующих редакциях.
В настоящем стандарте для внесения изменений и дополнений в ИСО 14708-1 используются следующие термины:
- «Замена» означает, что соответствующие пункты ИСО 14708-1 полностью заменены текстом настоящего стандарта;
- «Дополнение» означает, что текст настоящего стандарта является дополнительным к требованиям ИСО 14708-1;
- «Изменение» означает, что соответствующие пункты ИСО 14708-1 изменены в соответствии с текстом настоящего стандарта;
- «Не применяют» означает, что соответствующий раздел ИСО 14708-1 в настоящем стандарте не применяется.
Дополнительные подпункты, рисунки и таблицы к ИСО 14708-1 пронумерованы начиная с 101; дополнительные приложения обозначены буквами АА, ВВ и т. д.
IV
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИМПЛАНТАТЫ ДЛЯ ХИРУРГИИ Активные имплантируемые медицинские изделия Часть 3 Имплантируемые нейростимуляторы
Implants for surgery Active implantable medical devices Part 3 Implantable neurostimulators
Дата введения — 2017—10—01
1 Область применения
Настоящий стандарт распространяется на активные имплантируемые медицинские изделия, предназначенные для электрической стимуляции центральной или периферической нервной системы.
Настоящий стандарт также распространяется на все неимплантируемые части и принадлежности имплантируемых нейростимуляторов, как определено в разделе 3.
Методы испытаний, приведенные в настоящем стандарте, являются типовыми для оценки соответствия образцов изделий и не предназначены для регулярных испытаний выпускаемой продукции.
Примечание — Настоящий стандарт не распространяется на неимплантируемые нейростимуляторы Тем не менее, он распространяется на испытательные образцы устройств из-за их тесного взаимодействия с имплантируемыми нейростимуляторами
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на стандарты и другие нормативные документы, которые необходимо учитывать при его использовании. Для датированных ссылок применяют только указанные издания. Для недатированных ссылок применяют самые последние издания (включая любые изменения и поправки).
ISO 14708-1, Implants for surgery — Active implantable medical devices — Part 1: General requirements for safety, marking and for information to be provided by the manufacturer (Имплантаты хирургические — Активные имплантируемые медицинские изделия. Часть 1. Общие требования к безопасности, маркировке и информации, предоставляемой изготовителем)
IEC 60601-1:2005, Medical electrical equipment — Part 1: General requirements for basic safety and essential performance (Электроаппаратура медицинская. Часть 1. Общие требования к общей безопасности и существенные рабочие характеристики)
IEC 60601-1-2:2007, Medical electrical equipment — Part 1-2: General requirements for basic safety and essential performance — Collateral standard: Electromagnetic compatibility — Requirements and tests (Электроаппаратура медицинская. Часть 1-2. Общие требования к базовой безопасности и основной эксплуатационной характеристике. Дополняющий стандарт. Электромагнитная совместимость. Требования и испытания)
IEC 61000-4-3:2002, Electromagnetic compatibility (EMC) — Part 4-3: Testing and measurement techniques— Radiated. radio-frequency, electromagnetic field immunity test (Электромагнитная совместимость. Часть 4-3. Методики испытаний и измерений. Испытание на невосприимчивость к воздействию электромагнитного поля с излучением на радиочастотах)
Издание официальное
ANSI/AAMI РС692000. Adive implantable medical devices — Eledromagnetic compatibility — EMC test protocols for implantable cardiac pacemakers and implantable cardioverter defibrillators (Активные имплантируемые медицинские устройства — Электромагнитная совместимость — Программа испытаний электромагнитной совместимости для имплантируемых кардиостимуляторов и имплантируемых карди-овертер-дефибрилляторов)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 14708-1. а также следующие термины с соответствующими определениями:
3.101 имплантируемый нейростимулятор; ИНС (implantable neurostimulator): Активное имплантируемое медицинское изделие, предназначенное для электрической стимуляции центральной или периферической нервной системы.
Примечание — Согласно настоящему стандарту имплантируемый нейростимулятор может являться как единым изделием, так и системой, состоящей из частей и принадлежностей, которые взаимодействуют друг с другом для обеспечения производительности изделия, заявленной изготовителем Не все из этих компонентов или принадлежностей могут быть частично или полностью имплантированы, например, программатор, изделие пробных измерений и радиочастотные передатчики
3.102 имплантируемый генератор импульсов; ИГИ (implantable pulse generator): Имплантируемая часть, применяемая в определенных типах нейростимуляторов, как правило, состоящая из источника питания и электронной схемы, которая генерирует стимулирующие импульсы напряжения или тока.
Примечание — Полный комплект нейростимулятора включает в себя средство передачи выходного импульса к участку стимуляции
3.103 РЧ1* передатчик (RF transmitter): Неимплантируемая часть, применяемая в определенных типах нейростимуляторов, как правило, состоящая из источника питания и электронной схемы, которая генерирует выходные электрические импульсы, передаваемые через антенну к имплантированному РЧ-приемнику.
3.104 РЧ приемник (RF receiver): Имплантируемая часть, применяемая в определенных типах нейростимуляторов, которая преобразует электрический импульс, полученный от внешнего РЧ передатчика. в стимулирующие импульсы напряжения или тока.
3.105 испытательный образец (trial screener): Неимплантируемый нейростимулятор, который используется для стимуляции в течение испытательного периода. Как правило, состоит из источника питания и электронной схемы, генерирующей импульсы напряжения или тока передаваемые в область стимуляции посредством проводника или проводников.
Примечание — В рамках настоящего стандарта испытательный образец рассматривается в качестве принадлежности имплантируемого нейростимулятора
3.106 расчетный срок службы (projected service life): Период после имплантации, в течение которого имплантируемый нейростимулятор соответствует заявленным техническим характеристикам.
3.107 ИУ (DUT): Испытуемое устройство (изделие), в том числе проводники.
3.108 требуемая производительность (essential performance): Производительность, необходимая для отсутствия недопустимого риска.
Примечание — Подробнее об основных требованиях производительности см МЭК 60601-1.
4 Обозначения и сокращения
Применяют соответствующий раздел ИСО 14708-1.
5 Общие требования к неимплантируемым частям
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
^ РЧ — радиочастотный
2
Дополнение:
Примечание 3 — Этот пункт относится к радиочастотным передатчикам, испытательным образцам и программаторам Подкожный провод может быть использован с испытательным образцом и считается имплантируемой частью
6 Требования к активным имплантируемым медицинским изделиям определенных видов
Дополнительные подпункты:
6.101 Измерение характеристик импульса стимуляции
Настоящий подпункт описывает единый метод измерения для ряда характеристик импульса стимуляции (амплитуды, длительности импульса, частоты и формы импульса). Технические характеристики. указанные изготовителем в сопроводительной документации («и. подпункт 28.8). должны соответствовать результатам, полученным при испытаниях согласно настоящему методу.
Если нейростимулятор имеет несколько каналов или выходных режимов (например, биполярные или однополярные), необходимо определить характеристики кахадого канала или режима. Испытания проводят для всех рабочих состояний изделия, т. е. для каждого канала (режима работы) отдельно или для всех одновременно.
В сопроводительных документах должны быть указаны условия испытаний и настройки изделия, применимые к характеристикам импульса стимуляции (см. подпункт 28.8).
Примечание 1 — К условиям испытаний относятся, например, температура окружающей среды и какие-либо особые условия, которые необходимо соблюдать во время измерений К параметрам изделия относятся, например, значения частоты и длительности импульса, которые необходимо устанавливать во время измерения амплитуды
Испытуемый образец должен быть репрезентативен по отношению к серийным изделиям, быть в нормальном рабочем состоянии и не иметь показаний для замены (см. подпункт 19.2).
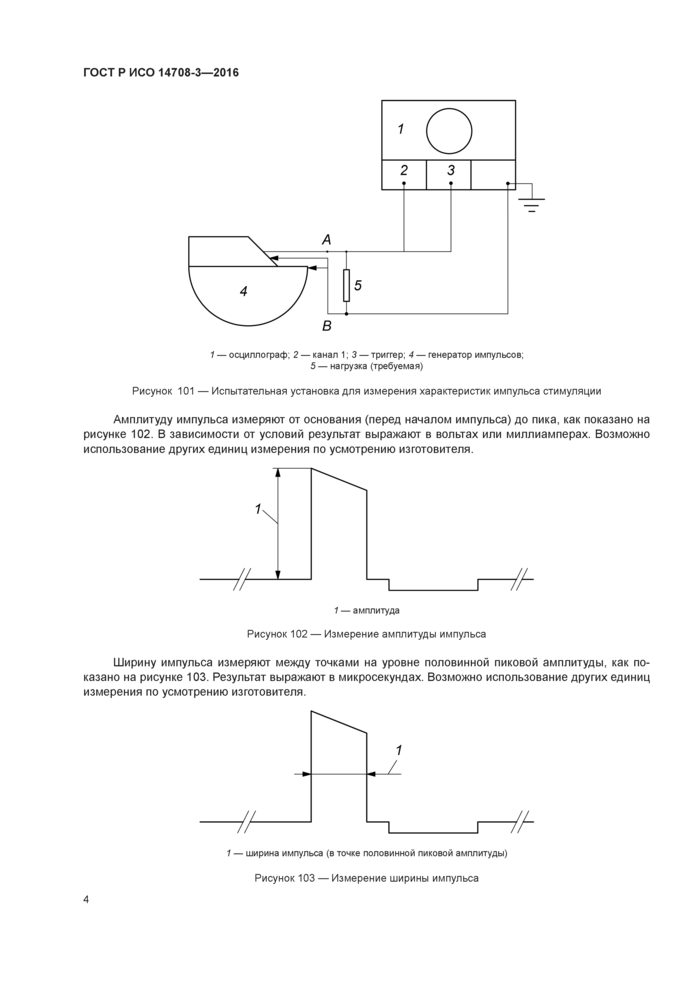
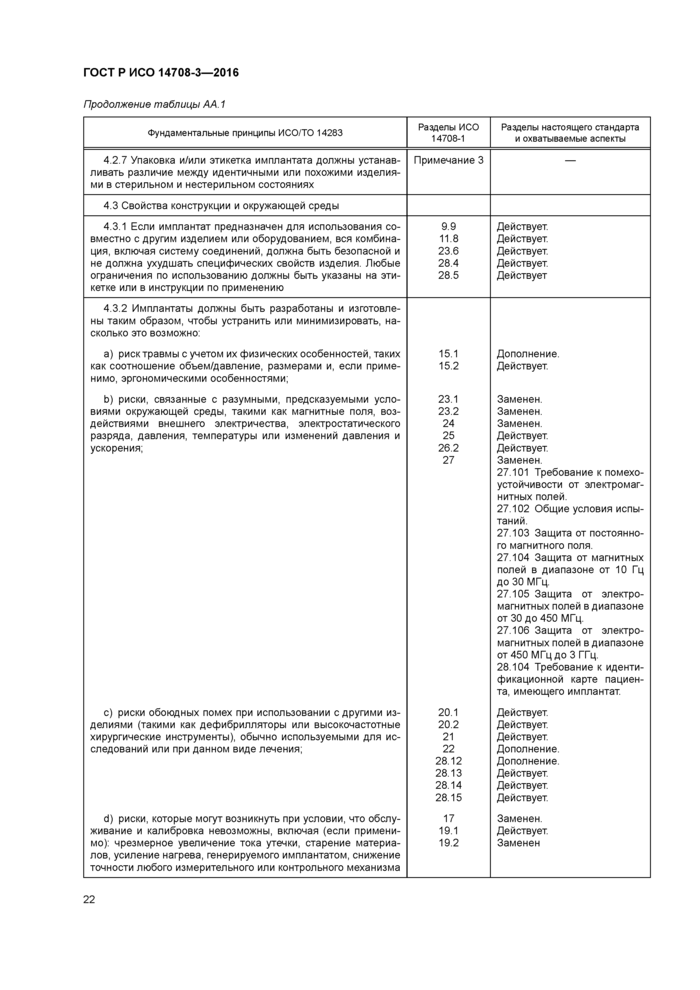
Метод испытания. Генератор импульсов (т. е. ГИ. РЧ приемник, устройство пробных измерений) подключается к нагрузке сопротивлением RL и измерительному оборудованию, как показано на рисунке 101. Значения сопротивления RL определяются изготовителем, исходя из сопротивления стимулируемых тканей В самом простом случае для определения характера работы измерения необходимо проводить на стандартном и максимальном сопротивлениях Для имитации реальных условий эксплуатации может быть использовано комплексное сопротивление. Кроме того, измерения следует выполнять с использованием номинального сопротивления RL. равного 499 Ом с погрешностью ±1 %. Также обязательным является указание сопротивлений нагрузки, используемых для получения импульсов стимуляции с характеристиками, указанными в сопроводительных документах (см. подпункт 28.8).
Точки А и В, как показано на рисунке 101. представляют собой прямой электрический выход генератора импульсов или электропроводники на дистальном конце проводника (или кабеля-удлинителя), в том случае если они применяются. Изготовитель должен однозначно указать точную конфигурацию, применимую для импульсов стимуляции с характеристиками, указанными в сопроводительной документации (см. подпункт 28.8).
Примечание 2 — Конфигурация зависит от точки измерения и сочетаний импульсов генератора, проводников и кабелей-удлинителей (если они применяются)
При выполнении этих измерений, формы импульсов каждого канала должны быть охарактеризованы и описаны в соответствующей документации (см. подпункт 28.8). Также необходимо описать все варианты формы импульсов между каналами, режимы вывода, режимы работы или условия нагрузки.
Допустимая погрешность измерения испытательной установки для измерения характеристик импульса стимуляции должна находиться в диапазоне ±5 %. Испытательное оборудование и испытуемый образец должны находиться при комнатной температуре.
3
|
1 — осциллограф. 2 — канал 1; 3 — триггер. 4 — генератор импульсов; 5 — нагрузка (требуемая) Рисунок 101 — Испытательная установка для измерения характеристик импульса стимуляции |
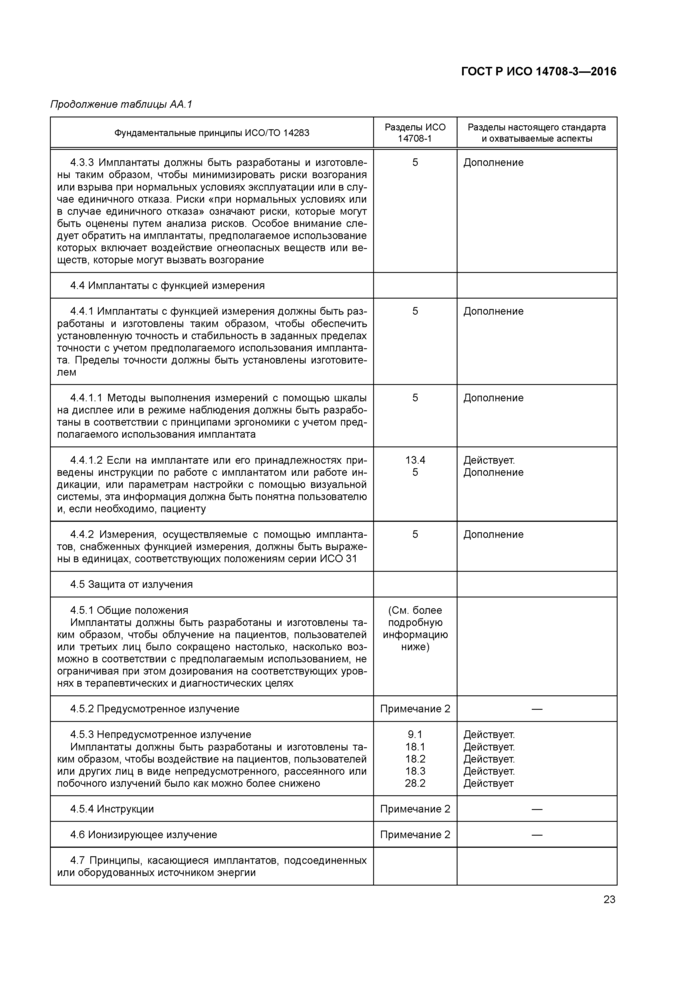
Амплитуду импульса измеряют от основания (перед началом импульса) до пика, как показано на рисунке 102. В зависимости от условий результат выражают в вольтах или миллиамперах. Возможно использование других единиц измерения по усмотрению изготовителя.
Ширину импульса измеряют между точками на уровне половинной пиковой амплитуды, как показано на рисунке 103. Результат выражают в микросекундах. Возможно использование других единиц измерения по усмотрению изготовителя.
|
1 — ширина импульса (в точке половинной пиковой амплитуды) Рисунок 103 — Измерение ширины импульса |
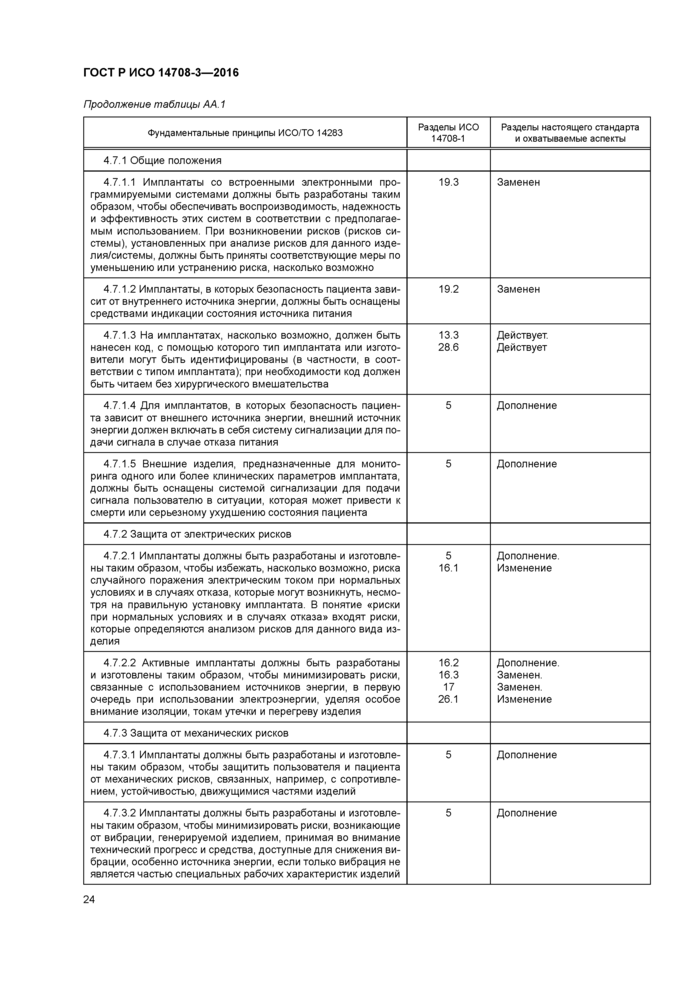
4
|
1 — интервал между импульсами (в точке половинной амплитуды) Рисунок 104 — Измерение интервала импульса для расчета частоты |
Частоту импульсов определяют путем измерения интервала от переднего фронта одного импульса до переднего фронта следующего импульса на том же уровне (рисунок 104). Фактическое значение частоты равно обратной величине измеренного интервала. Результат выражают в герцах (Гц). Возможно использование других единиц измерения по усмотрению изготовителя.
j—//
6.102 Измерение сопротивления проводника или кабеля-удлинителя при постоянном токе
Настоящий подпункт описывает единый метод измерения сопротивления проводника или кабеля-удлинителя при постоянном токе. Технические характеристики, указанные изготовителем в сопроводительной документации (см. 28.8), должны соответствовать результатам, полученным при испытаниях согласно настоящему методу.
Если проводник или кабель-удлинитель состоят из нескольких проводов, то для каждого провода необходимо определить сопротивление при постоянном токе.
Также в сопроводительной документации должны быть указаны условия испытаний проводника или кабеля-удлинителя для определения сопротивления при постоянном токе (см. 28.8).
Примечание — Под условиями испытания подразумевается, например, температура окружающей среды и прочие особые условия проведения измерений
Испытуемый образец должен быть репрезентативен по отношению к серийным изделиям, быть в нормальном рабочем состоянии и не иметь показаний для замены.
Метод тестирования. Для проведения измерений используют четырехполюсный омметр (с компенсацией смещения). Сопротивление при постоянном токе проводника и кабеля-удлинителя измеряют между проксимальным и дистальным концами каждого проводящего элемента. Результаты выражают в омах. Возможно использование других единиц измерения по усмотрению изготовителя.
Допустимая погрешность измерения испытательной установки для измерения сопротивления проводника или кабеля-удлинителя при постоянном токе должна находиться в диапазоне ±5 %. Испытательное оборудование и испытуемый образец должны находиться при комнатной температуре.
7 Общие требования к упаковке
Применяют соответствующий раздел ИСО 14708-1.
8 Общая маркировка активных имплантируемых медицинских изделий
Применяют соответствующий раздел ИСО 14708-1. за исключением следующего.
8.2 Дополнение:
Примечание — Требования не распространяются на временные провода и провода, не предназначенные для имплантации
Дополнительные подпункты:
8.101 В случае особых условий транспортирования изделия на упаковку должна быть нанесена соответствующая маркировка (см., например. ИСО 780 (1) или ИСО 15223 [2]).
Соответствие проверяют в ходе осмотра.
8.102 Допустимые условия окружающей среды транспортирования должны быть обозначены маркировкой на внешней стороне транспортной упаковки.
Соответствие проверяют в ходе осмотра.
5
9 Маркировка на товарной упаковке
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
9.4 Дополнение:
Для следующих компонентов должна быть указана дополнительная информация, приведенная
ниже:
a) Имплантируемый генератор импульсов (ИГИ) и испытательный образец:
- число электропроводников и каналов;
- вид выходного сигнала: постоянный ток или постоянное напряжение:
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
b) Проводник:
- тип проводника (хирургический, подкожный, наручный. ЦНСЧ периферический и т. д );
- число электропроводников в проводнике;
-длина проводника (в сантиметрах);
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
c) Кабель-удлинитель:
• тип кабеля (низкопрофильный, раздвоенный и т. д );
- число электропроводников в кабеле;
- длина кабеля-удлинителя (в сантиметрах);
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
d) РЧ приемник:
- число электропроводников и каналов;
- вид выходного сигнала: постоянный ток или постоянное напряжение;
- максимальная рекомендуемая глубина имплантации;
- средства идентификации соответствующего радиочастотного передатчика;
- средства идентификации соответствующего проводника, в случае если он является присоединяемым;
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
e) РЧ передатчик:
- число каналов;
- максимальная рекомендуемая глубина имплантации;
- средства идентификации соответствующего радиочастотного приемника;
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
Дополнительный подпункт:
9.101 Если изделие предназначено для однократного использования, это должно быть указано на упаковке.
10 Конструкция товарной упаковки
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
10.3 Изменение:
Испытание заменено подпунктом 7.1.3. перечисление Ь) МЭК 60601-1:2005.
Примечание — Предметом испытания не являются съемные наклейки (например, временные наклейки, используемые в процессе производства), которые содержат дополнительные данные, помимо информации, определенной в разделе 9.
11 Маркировка на стерильном пакете
Применяют соответствующий раздел ИСО 14708-1. за исключением следующего.
ЦНС — центральная нервная система
6