ГОСТ Р ИСО 13022-2016
Продукты медицинские, содержащие жизнеспособные человеческие клетки. Применение менеджмента риска и требований к методикам обработки
В стандарте определены требования и руководство по методикам обработки и управлению рисками, связанными с жизнеспособными клеточными компонентами продуктов, относящихся к медицинским продуктам, биопрепаратам, медицинским изделиям и активным имплантируемым медицинским изделиям, а также их комбинациям.
включает жизнеспособные как аутологичные, так и аллогенные ткани человека, полученные от живых и трупных доноров.
Идентичен ISO 13022:2012
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Процесс менеджмента риска
4.1 Общие положения
4.2 Опасности, связанные с клеточными компонентами
4.3 Анализ риска
4.4 Оценивание риска
4.5 Контроль риска
4.6 Оценивание допустимости общего остаточного риска
4.7 Система получения информации на этапе производства и после производства
Приложение А (справочное) Руководство по применению ИСО 13022
Приложение В (справочное) Графическое представление части процесса менеджмента риском для медицинских продуктов, содержащих клетки
Приложение С (обязательное) Требования к выбору доноров и испытания
Приложение D (справочное) Руководство по забору тканей
Приложение Е (обязательное) Требования к обращению с клетками и тканями во время производства
Приложение F (обязательное) Требования к упаковке и маркировке
Приложение G (справочное) Руководство по транспортированию
Приложение H (справочное) Руководство по хранению
Приложение I (обязательное) Требования к системе контроля
Приложение J (обязательное) Меры по снижению риска, связанного с заражением вирусами и другими инфекционными агентами, такими как ТЕ
Приложение К (справочное) Руководство, касающееся опасностей, вызванных канцерогенным потенциалом человеческих клеток или тканей, используемых при производстве медицинских продуктов
Приложение L (справочное) Руководство, касающееся микробиологической контаминации
Приложение М (справочное) Руководство, касающееся потенциального негативного влияния неклеточных остатков продукта
Приложение N (обязательное) Требования, касающиеся потенциального негативного влияния клеточных компонентов на медицинский продукт
Приложение О (справочное) Руководство по описанию клеточных компонентов медицинских продуктов
Приложение Р (справочное) Клиническая оценка и испытания
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным и межгосударственным стандартам
Библиография
49 страниц
| Дата введения | 01.01.2017 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 01.03.2016 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 102-ст |
|---|---|---|---|
| Разработан | АНО ИМБИИТ | ||
| Издан | Стандартинформ | 2016 г. |
Medical products containing viable human cells. Application of risk management and requirements for processing practices
- ГОСТ Р ИСО 22442-1-2011 Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 1. Менеджмент риска
ГОСТ ISO 13485-2011Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования. Заменен на ГОСТ ISO 13485-2017.- ГОСТ ISO 14971-2011 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14
стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ГОСТ Р исо 13022—
2016
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫМ СТАНДАРТ РОССИ ЙСКОЙ ФЕДЕРАЦИИ
ПРОДУКТЫ МЕДИЦИНСКИЕ, СОДЕРЖАЩИЕ ЖИЗНЕСПОСОБНЫЕ ЧЕЛОВЕЧЕСКИЕ КЛЕТКИ
Применение менеджмента риска и требований к методикам обработки
(ISO 13022:2012, ЮТ)
Издание официальное
Стандартинформ
2016
Предисловие
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Институт медико-биологических исследований и технологий» (АНО «ИМБИИТ») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 «Оценка биологического действия медицинских изделий»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 1 марта 2016 г. № 102-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 13022:2012 «Продукты медицинские, содержащие жизнеспособные человеческие клетки. Применение менеджмента риска и требований к методикам обработки» (ISO 13022:2012 «Medical products containing viable human cells — Application of risk management and requirements for processing practices», IDT)
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные и межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ, 2016
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Производитель должен:
a) определить и отразить документально стратегию определения критериев приемлемости риска. Стратегия должна гарантировать, что критерии основаны на применимых национальных или региональных нормативных документах и соответствующих международных стандартах, и учитывать доступную информацию, такую как современный уровень развития науки и известные опасения заинтересованных сторон;
b) проверять соответствие процесса менеджмента риском через плановые интервалы для гарантии эффективности процесса менеджмента риском , а также документально отражать все решения и принятые меры. Данная проверка может быть частью ревизии системы управления качеством.
4.2.3 Документация
4.2.3.1 Деятельность по менеджменту риском должны документально фиксировать. Соответствующим способом может быть документация менеджмента риском, которая включает план менеджмента риском.
Соответствующая информация, входящая в план менеджмента риском или его эквивалент, должна включать следующее:
a) объем запланированных мероприятий по менеджменту риском с определением и описанием медицинских продуктов на клеточной основе и фаз жизненного цикла, к которым применим каждый элемент плана;
b) распределение ответственности и полномочий;
c) требования к ревизии деятельности по менеджменту риском;
d) критерии приемлемости риска, основанные на стратегии производителя по определению приемлемости риска, включая критерии определения приемлемости риска при невозможности оценки вероятности возникновения вреда;
e) действия по верификации;
1) деятельность, связанная со сбором и проверкой соответствующей информации в процессе производства и после производства.
4.2.3.2 Для каждой определенной опасности в документации менеджмента риском или ее аналога
должна быть ссылка:
a) на анализ риска;
b) оценивание риска;
c) внедрение, верификации и мониторинга мер по контролю риска;
d) оценку допустимости любого(ых) остаточного(ых) риска(ов) с учетом рассмотрения риска и медицинской пользы при предполагаемом использовании.
4.2.4 Персонал
Персонал, непосредственно вовлеченный в деятельность по производству клеточных компонентов медицинских продуктов на клеточной основе, должен быть достаточно квалифицированным для выполнения этих задач и компетентным для выполнения этих задач с учетом его квалификации, образования и подготовки.
4.3 Анализ риска4.3.1 Общие положения
Для процесса анализа риска систематически используют доступную информацию для идентификации опасностей и определения сопряженных рисков. Чтобы решить данные задачи, необходимо рассмотреть все фазы жизненного цикла продукта. Особое внимание необходимо уделять забору клеток и/ или тканей, а также всем этапам производства, связанным сданными материалами, и, если применимо, сочетаемому элементу в случае комбинированных продуктов.
Внедрение плановой деятельности по анализу риска и результаты анализа риска необходимо отражать в документации менеджмента риском или ее эквиваленте.
Информация по методологическим средствам идентификации и оценивания рисков представлена в ИСО 14971 и Руководстве Фармацевтической системы качества (ICH Q9).
4.3.2 Предполагаемое использование и определение характеристик, связанных с безопасностью клеточного компонента продукта
Необходимо учитывать предполагаемое использование и контакт клеточных компонентов медицинского продукта на клеточной основе с организмом пациента или организмом пользователя. При анализе риска необходимо учитывать количество материала, площадь поверхности контакта и тип(ы) материала, вступающего в контакт с тканями или жидкостями организма, а также тип ткани или жидкости организма, с которыми он контактирует.
6
ГОСТ Р ИСО 13022-2016
Наиболее важен критический анализ:
a) источников клеток (см. приложения С, I, J, К и L);
b) типа клеток и статуса дифференциации клеток (см. приложения D, Е, G, Н, К, N, О и Р);
c) всех аспектов процесса производства (см. приложения Е, F, G, Н, J, L, М, N и Р);
d) конкретных действий, которые могут привести к канцерогенности или непредвиденной иммуно-генности клеток (см. приложения Е, К, М, N, О и Р);
e) возможной перекрестной контаминации (см. приложения С, D, F, Н, I, J, L и М);
f) системы контроля материала (см. приложения С, D, F, G, Н и I);
д) возможной деструкции (см. приложения D, Е, G, Н, N, О и Р);
h) непредвиденного взаимодействия между клеточными и неклеточными компонентами продукта (см. приложения Е и О);
i) клинической оценки и лабораторных исследований (см. приложение Р).
4.3.3 Определение опасностей
Возможные опасности, связанные с использованием человеческих клеток и тканей, должны быть идентифицированы и задокументированы. Особое внимание следует уделить следующим опасностям, связанным с клетками и тканями:
a) контаминация бактериями, плесенью, дрожжами или паразитами;
b) контаминация вирусами;
c) контаминация агентами, вызывающими 7SE;
d) контаминация материалом, вызывающим нежелательные пирогенные, иммуногенные или токсические реакции;
е) деструкции продукта и продуктов деструкции;
f) отсутствие обратимости воздействия;
д) опасности, связанные с канцерогенным потенциалом используемого типа клеток;
h) нарушение и/или невозможность прослеживаемости;
i) осложнения, вызванные непреднамеренными физиологическими или анатомическими последствиями. Это включает непредвиденную миграцию клеток, нежелательное выделение биологически активных веществ, таких как гормоны и цитокины, и непредвиденное взаимодействие между клеточными и неклеточными компонентами продукта.
При использовании стволовых клеток могут возникать дополнительные опасности. Особое внимание следует уделить испытаниям на канцерогенность и биораспределение. При использовании таких клеток необходимо соблюдать региональные нормативные требования.
Для оценки загрязнения другими неклассифицированными патогенными веществами могут применяться сходные принципы.
4.4 Оценивание риска
Необходимо оценить все идентифицированные риски. Для каждой идентифицированной опасности производитель, используя критерии, определенные в плане менеджмента риска, должен принять решение о необходимости снижения риска. Результаты данного оценивания риска должны быть отражены в документации менеджмента риском или ее эквиваленте.
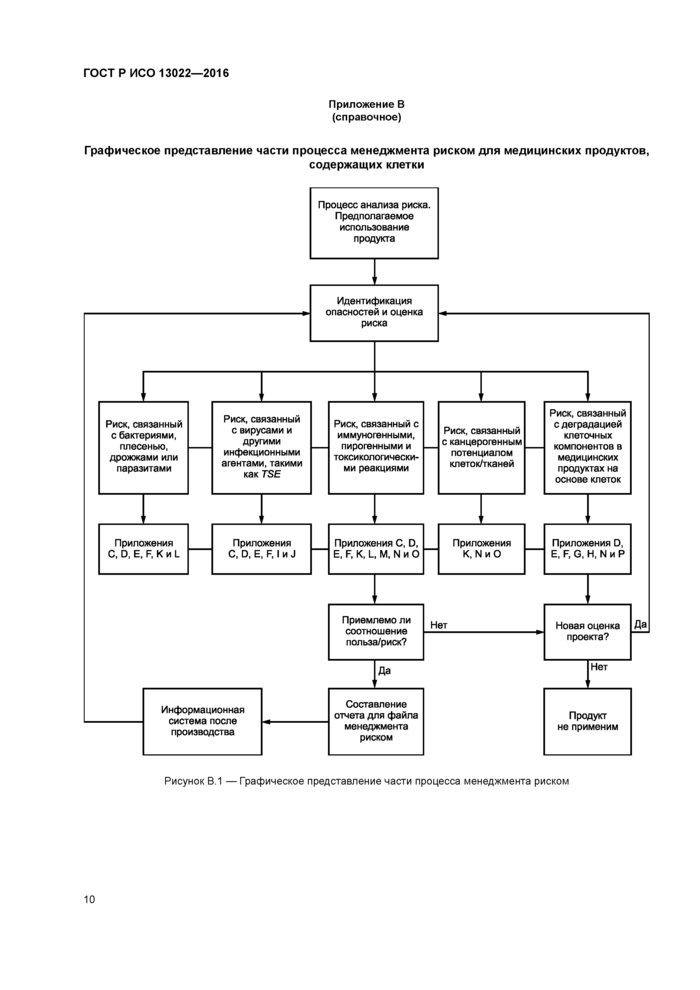
В приложении В определены основные категории риска, которые необходимо учитывать.
4.5 Контроль риска4.5.1 Общие положения
Для контроля риска необходимо принять решение и соответствующие меры для снижения риска до определенного уровня или поддержания в определенных пределах. Производитель должен определить меры по контролю риска, которые применимы для снижения риска(ов) до приемлемых уровней. Мероприятия по контролю риска должны быть отражены документально и обоснованы.
Схема в приложении В дает общее представление о процессе менеджмента риском. Если во время процесса менеджмента риском определены дополнительные риски, производитель должен выбрать соответствующие стандарты или нормативные документы и следовать им. Решение должно быть отражено документально и обосновано.
4.5.2 Оценки остаточного риска
После применения мер по контролю рисков необходимо оценить все остаточные риски, используя критерии, определенные в плане менеджмента риском. Таким образом проверяют, не появились ли новые риски в результате любых мер по снижению рисков. Результаты данной оценки должны быть отражены в документации менеджмента риском или ее эквиваленте.
7
4.6 Оценивание допустимости общего остаточного риска
Оценка допустимости общего остаточного риска должна учитывать баланс между остаточным риском после применения всех мер по контролю и ожидаемой медицинской пользой по сравнению с доступными альтернативами. Если существует остаточный риск, связанный:
-с загрязнением вирусами, паразитами, бактериями, плесенью, грибами или инфекционными агентами, вызывающими TSE; и/или
-опасностями, связанными с канцерогенным или иммуногенным потенциалом используемого типа клеток. В оценке необходимо конкретно рассмотреть риски и преимущество при использовании альтернативных материалов, не связанных с данными рисками, например синтетические материалы, материалы от другого вида животных или аутогенного человеческого материала, и применение альтернативы для той же предполагаемой цели.
Если остаточные риски не удовлетворяют критериям приемлемости риска, общий риск может считаться приемлемым только при его компенсации исключительной пользой и целесообразностью, обоснование которых должно быть задокументировано.
Если применимо, необходимо учитывать оценку конкретного контингента пациентов (например, пациентов с иммунодефицитом).
4.7 Система получения информации на этапе производства и после производства
Производитель должен внедрить, документально оформить и поддерживать систему текущего и систематического сбора и обработки информации о рисках, связанных с применением медицинских продуктов на клеточной основе и сходных продуктов на этапе производства и после производства. Полученная информация должна быть проанализирована, оценена и использована в процесса менеджмента риском.
Примечание — Для этого могут быть использованы принципы контроля за рынком продаж и/или фармаконадзора.
8
Приложение А (справочное)
Руководство по применению ИСО 13022
А.1 Общие положения
Менеджмент риском крайне важен для клеточных компонентов медицинских продуктов, включая жизнеспособные клетки или ткани человека, из-за особых характеристик данных продуктов. Они сильно подвержены биологическому загрязнению и крайне чувствительны ко всем видам воздействия, вызывающего повреждение и деградацию клеток. Следовательно, важно, что при установлении риска, связанного с данным материалом, производитель принимает меры по контролю риска или обосновывает в отчете по менеджменту риска, почему этого не было сделано.
А.2 Применение к источникам клеток и тканей человека
В настоящем стандарте рассмотрены такие материалы, как:
a) жизнеспособные клетки и ткани аутологичного и аллогенного происхождения, и
b) жизнеспособные клетки и ткани, полученные от живых и трупных доноров.
А.З Применение к материалам, полученным третьей стороной
Настоящий стандарт можно применять в том случае, если материалы, используемые производителем, были взяты от человека и подготовлены третьей стороной или субподрядчиком. При рассмотрении рисков, связанных с использованием данных продуктов, производители должны запрашивать от их поставщиков подтверждение того, что оценка применимости человеческого материала основана на соответствующих требованиях настоящего стандарта или использовались альтернативные подходы. Полученная информация должна быть включена в отчет по менеджменту риском, касающийся медицинского продукта, содержащего клетки, и если применимо, то может быть дополнена информацией, поставляемой третьей стороной или субподрядчиком.
9
Приложение В (справочное)
Графическое представление части процесса менеджмента риском для медицинских продуктов,
содержащих клетки
|
Рисунок В.1 — Графическое представление части процесса менеджмента риском |
ю
Приложение С (обязательное)
Требования к выбору доноров и испытания
С.1 Общие положения
Критерии выбора доноров основаны на анализе рисков, связанных с применением определенных клеток или тканей, и предполагаемом назначении медицинского продукта на клеточной основе. Индикаторы этих рисков должны быть определены путем медицинского осмотра, рассмотрения истории медицинского и поведенческого риска, а также посредством биологических испытаний, патологоанатомических исследований (для трупных доноров) и других подходящих исследований. Доноров исключают из списка потенциальных доноров, если они подпадают под любой критерий из перечисленных в С.2.1, кроме тех случаев, когда их использование документально обосновано в ходе оценки риска, утвержденной ответственным лицом.
Если в стране, на территории которой будут использовать медицинский продукт, существуют дополнительные национальные или региональные критерии, кроме установленных, то они также применимы.
С.2 Трупные доноры
С.2.1 Общие критерии для исключения
a) Неизвестная причина смерти, за исключением тех случаев, когда вскрытие дает информацию о причинах смерти, и ни один из общих критериев исключения, определенных в настоящем пункте, не применим.
b) История заболевания неясной этиологии.
c) Наличие в настоящее время или в анамнезе онкологических злокачественных заболеваний. Возможными исключениями для данного критерия являются первичная базальноклеточная карцинома, карцинома in situ шейки матки и некоторые первичные опухоли центральной нервной системы, которые могут быть приемлемыми при наличии известной клинической истории донора.
d) Системные инфекции, которые не контролируются на момент забора материала, включая бактериальные заболевания, системные вирусные, грибковые или паразитарные инфекции либо существенные локальные инфекции в забираемых тканях и клетках.
e) ВИЧ (вирус иммунодефицита человека), острый или хронический гепатит В (за исключением лиц с подтвержденным иммунным статусом), гепатит С и HTLVI/II (вирус Т-клеточного лейкоза человека 1/11) в анамнезе, клинически или лабораторно подтвержденный, а также риск заражения или свидетельства факторов риска данных инфекций.
f) Хроническое системное аутоиммунное заболевание, которое может повлиять на качество забираемых клеток или тканей, в анамнезе.
д) Признаки того, что результаты лабораторных исследований образцов донорской крови будут недействительны по причине:
1 случаев гемодилюции, если получить образцы крови до проведения этой процедуры невозможно; или
2 лечения иммуносупрессорами.
h) Свидетельства любых других факторов риска инфекционного заболевания на основе оценки риска с учетом истории перемещения донора и его контактов, а также локальной распространенности инфекционных заболеваний.
i) Наличие на теле донора физических признаков, которые могут указывать на риск инфекционного(ых) заболевания(ий).
j) Прием внутрь или воздействие веществ (таких как цианид, свинец, ртуть, золото), которые могут быть переданы реципиенту в дозе, которая может быть опасна для его здоровья.
k) Недавняя вакцинация живым ослабленным вирусом, если считается, что существует риск заражения.
l) Трансплантаты из ксенотканей.
т) Риск передачи заболеваний, вызываемых инфекционным агентом TSE.
Данный риск характерен, например:
1) для людей с диагностированной болезнью Крейтцфельдта-Якоба, или вариантной болезнью Крейтцфель-дта-Якоба, или имеющих в семейном анамнезе заболевание Крейтцфельдта-Якоба неятрогенного характера;
2) людей с быстро прогрессирующей деменцией или дегенеративными неврологическими заболеваниями, включая заболевания неизвестного происхождения, в анамнезе;
3) реципиентов гормонов, полученных из гипофиза человека (например, гормонов роста) и реципиентов с пересаженной роговицей, склерой и dura mater, а также лиц, которые перенесли недокументированное нейрохирургическое вмешательство (при котором могла использоваться dura mater). Для вариантной болезни Крейтцфельдта-Якоба рекомендуется использовать дальнейшие меры предосторожности.
С.2.2 Дополнительные критерии для детского посмертного донорства
Дети, рожденные от матери, инфицированной ВИЧ или подпадающей под любой критерий исключения из описанных выше, должны быть исключены из списка доноров, до тех пока нельзя будет точно исключить риск передачи инфекции.
11
Дети в возрасте младше 18 мес, рожденные от матерей, инфицированных ВИЧ, а также при наличии гепатита В, С или вируса HTLVI/II, или с риском наличия такой инфекции, которые получали грудное молоко матери в течение предыдущих 12 мес, не могут быть донорами вне зависимости от результатов аналитических исследований.
Дети, рожденные от матерей, инфицированных ВИЧ, при наличии гепатита В, С или вируса HTLVI/II, или с риском наличия такой инфекции, которые не получали грудное молоко матери в течение предыдущих 12 мес и для которых проведение аналитических исследований, медицинского осмотра и обзор медицинской документации не подтвердили наличие вышеперечисленных инфекций, могут быть донорами.
С.З Прижизненное донорство. Общие критерии отбора
С.3.1 Аутологичный живой донор
При заборе тканей и клеток следует применять тот же минимальный набор требований биологического тестирования, что и для аллогенного живого донора. Положительные результаты лабораторных исследований не обязательно препятствуют хранению, обработке и реимплантации тканей или клеток либо других продуктов, полученных из них, если имеется соответствующее изолированное хранение для обеспечения того, что нет риска перекрестной контаминации с другими трансплантатами, и/или нет риска загрязнения случайными веществами, и/ или перепутывания.
С.3.2 Аллогенный живой донор.
Аллогенных живых доноров должны отбирать на основе состояния их здоровья и медицинского анамнеза, который собирают с помощью анкетирования и интервьюирования доноров, проводимого квалифицированным и обученным медицинским персоналом. Такая оценка должна включать значимые факторы, которые могут повлиять на выявление и исключение лиц, донорство которых может представлять риск здоровью других, такой как вероятность передачи заболевания или риск их собственному здоровью. При любом донорстве процесс забора не должен влиять на здоровье донора или его ухудшать. В случае забора пуповинной крови или амниотической мембраны это правило применимо как к матери, так и к ребенку.
Критерии отбора аллогенных живых доноров должны быть установлены и отражены документально банком тканей (а также врачом, проводящим трансплантацию, в случае непосредственной передачи реципиенту), основываясь на конкретных донорских тканях или клетках, а также на физическом состоянии донора, медицинском и поведенческом анамнезе и результатах клинических исследований и лабораторных испытаний, определяющих состояние здоровья донора.
До- и послеродовой забор клеток требует оценки соответствующего риска для ребенка во время послеродового осмотра. Для забора клеток пуповинной крови до или после родов, а также амниотической мембраны мать рассматривают в качестве донора.
Следует применять те же критерии исключения, что и для трупных доноров, за исключением С.2.1, а).
В зависимости от забираемых типов клеток или тканей могут применять другие специфические критерии исключения, такие как:
a) беременность (за исключением доноров клеток пуповинной крови и амниотической мембраны и доноров-сибсов гемопоэтических прогениторных клеток);
b) грудное вскармливание;
c) гемопоэтические прогениторные клетки при возможности передачи наследственных заболеваний.
С.4 Биологические испытания, необходимые для доноров
Следующие биологические испытания должны проводить для всех доноров в качестве минимальных требований:
a) ВИЧ 1 и 2 —анти-ВИЧ-1, 2;
b) гепатиты В — HBsAg (поверхностный антиген гепатита В), НВс (антитела к сердцевине вируса гепатита В);
c) гепатиты С — anti-HCV-Ab (антитела к вирусу гепатита С);
d) сифилис — (см. далее).
Исследование на антитела к вирусу Т-клеточного лейкоза человека (HTLV) 1/11 следует проводить в соответствии с национальными нормативными документами.
Если anti-HBc положителен, a HBsAg отрицателен, то необходимы дополнительные исследования с оценкой риска для определения возможности клинического использования донорского материала.
Следует использовать валидированный алгоритм лабораторных исследований для исключения наличия активной инфекции Treponema pallidum. Нереактивный тест, специфичный или неспецифичный, допускает использование тканей и клеток. Если проводят неспецифичный тест, реактивный результат не препятствует забору или получению, если специфичный тест на Treponema pallidum, проводимый для подтверждения, не реактивен. Для донора, чей образец реактивен на Treponema pallidum при специфичном испытании, необходимо проведение оценки риска для определения допустимости клинического использования.
Могут потребоваться дополнительные исследования в зависимости от анамнеза донора и характеристик забираемых тканей или клеток, например RhD (D-антиген резус-группы), HLA (лейкоцитарный антиген человека), малярия, ЦМВ (цитомегаловирус), токсоплазмоз, EBV (вирус Эпштейна-Барра), Trypanosoma cruzi.
В отношении аутологичных доноров см. С.3.1.
С.5 Требования для определения биологических маркеров
С.5.1 Общие положения
Испытания должны проводить в квалифицированной лаборатории.
Примечание — Квалифицированной лабораторией является аккредитованная, лицензированная, зарегистрированная или авторизованная в соответствии с местными требованиями лаборатория.
Используемый тип испытаний должен быть утвержден для данных целей в соответствии с текущим уровнем развития науки. Биологические испытания должны проводить на сыворотке или плазме донора и ни в коем случае на других жидкостях или выделениях, таких как вода или стекловидное тело, если конкретно клинически не обосновано использование утвержденного испытания для таких жидкостей.
С.5.2 Гемодилюция
Если потенциальные доноры потеряли кровь и недавно получали от доноров кровь, компоненты крови, коллоиды или кристаллоиды, испытания на крови потенциальных доноров могут быть недействительными из-за гемо-дилюции образца крови. В следующих случаях необходимо использовать алгоритм оценки степени гемодилюции:
- забор образцов крови до наступления смерти: если кровь, компоненты крови и/или коллоиды были введены в течение 48 ч до забора крови или кристаллоиды были введены за 1 ч до забора образцов;
- забор образцов крови после наступления смерти: если кровь, компоненты крови и/или коллоиды были введены в течение 48 ч до смерти или кристаллоиды были введены за 1 ч до смерти.
Банк тканей может принимать ткани и клетки от доноров, которые были исследованы на определенные инфекционные заболевания, используя образец крови, который предположительно разведен более чем на 50 %, только если испытания утверждены для использования такого образца или если доступен образец, который был взят до переливания/введения.
С.5.3 Забор образцов от трупных доноров
В случае трупных доноров образцы крови должны быть получены непосредственно перед смертью, или, если это невозможно, забор образцов должен быть в течение 24 ч после смерти.
С.5.4 Забор образцов от живых доноров
a) В случае живых доноров (за исключением, по практическим причинам, аллогенных доноров стволовых клеток костного мозга и стволовых клеток периферической крови) образцы крови должны быть получены в момент забора материала или, если это невозможно, в течение семи дней после забора материала (это «образец донорского материала»),
b) Если ткани и клетки аллогенных живых доноров могут храниться в течение длительного периода времени, требуется повторный забор образцов и проведение испытаний через 180 дней. При повторных испытаниях образец донорского материала может быть получен за 30 дней до и через 7 дней после забора материала.
c) Если ткани и клетки аллогенного живого донора не могут храниться в течение длительного периода времени и повторное получение образцов, следовательно, невозможно, то применяется пункта).
Если для живых доноров (за исключением доноров стволовых клеток костного мозга и стволовых клеток периферической крови) «образец донорского материала», как определено в а), дополнительно исследуют методом амплификации нуклеиновых кислот (nucleic acid amplification technique, NAT) на ВИЧ 1 и 2, HBV (вирус гепатита В) и HCV, испытания повторных образцов крови в соответствии с Ь) не требуется. Повторные испытания также не требуются, если обработка включает этап инактивации, который был утвержден для упомянутых вирусов.
В случае забора стволовых клеток костного мозга и стволовых клеток периферической крови образцы крови должны быть взяты для исследования в течение 30 дней до забора материала.
В случае неонатальных доноров биологические исследования могут быть проведены на матери донора для предотвращения необязательных медицинских процедур для грудного ребенка.
13
Приложение D (справочное)
Руководство по забору тканей
D.1 Общие положения
Материал клеток и тканей должен быть получен от идентифицируемых должным образом доноров при получении их согласия. Специальные принципы применяют для аутологичных, живых и трупных доноров.
D.2 Согласие и идентификация доноров
До процедуры получения тканей и клеток должно быть получено согласие на процедуру и документально отражено, как и кем был достоверно идентифицирован донор.
D.3 Оценка донора для аллогенных доноров
Должна быть собрана и записана соответствующая медицинская и поведенческая информация донора в соответствии с требованиями, описанными в D.5.
Для получения соответствующей информации следует использовать различные соответствующие источники, включая, по меньшей мере, собеседование с донором для живых доноров и следующее, если применимо:
a) медицинская документация донора;
b) собеседование с лицом, хорошо знавшим донора (для посмертных доноров);
c) собеседование с лечащим врачом;
d) собеседование с врачом-терапевтом;
e) протокол результатов вскрытия.
Кроме того, в случае посмертного донорства и в случае прижизненного донорства при наличии обоснования должен быть проведен медицинский осмотр тела для выявления любых признаков, которые сами по себе могут быть достаточным основанием для исключения из списка доноров или которые должны быть рассмотрены в свете медицинского и личного анамнеза донора. Полная документация донора должна быть пересмотрена и проанализирована на предмет соответствия требованиям, прндъявляемым к донорам, и подписана квалифицированным медицинским работником.
D.4 Процедура получения тканей и клеток
Процедура получения должна соответствовать типу донора и типу забираемых тканей или клеток. Должны быть установлены процедуры для защиты безопасности прижизненного донора. Процедуры получения должны сохранять те свойства тканей или клеток, которые необходимы для их окончательного клинического использования, и в то же время минимизировать риск микробиологического загрязнения в течение процесса.
Для забора органов и тканей от трупных доноров площадь доступа должна быть ограничена. Необходимо использовать локальное стерильное поле, ограниченное стерильной простыней. Персонал, осуществляющий забор, должен быть одет соответственно типу получения. Обычно это подразумевает, что персонал вымыт, одет в стерильную одежду и стерильные перчатки, а также имеет защиту для лица и хирургические маски.
В случае трупных доноров место вскрытия должно быть отражено документально и определен временной интервал между смертью и вскрытием, чтобы гарантировать сохранение необходимых биологических и/или физических свойств тканей и/или клеток.
Любые негативные события во время забора, которые нанесли или могут нанести вред живому донору, а также результат какого-либо расследования по определению причин необходимо отразить документально и рассмотреть.
Необходимо установить правила и процедуры для сведения к минимуму риска загрязнения тканей или клеток персоналом, который может быть инфицирован трансмиссивными заболеваниями.
Для забора тканей и клеток должны использовать стерильные инструменты и устройства. Инструменты или устройства должны быть соответствующего качества, валидированы и нормативно сертифицированы и содержаться в рабочем состоянии для забора тканей и клеток. Если применяют инструменты многократного использования, соответствие утвержденному процессу чистки и стерилизации для удаления инфекционных агентов должно быть отражено документально. Необходимо внедрить систему, которая позволит обеспечить контроль всех инструментов или устройств для забора до прихода донора или до момента получения тканей или клеток.
Весь соответствующий персонал должен пройти надлежащее обучение по использованию таких устройств. Необходимо сохранять документацию, подтверждающую, что весь соответствующий персонал прошел надлежащее обучение по использованию таких устройств.
D.5 Документация донора
D.5.1 Для каждого донора должна быть заведена история, содержащая:
а) личность донора, т. е. имя, фамилию и дату рождения (если в донорстве участвуют мать и ребенок, то имя, фамилию и дату рождения матери и имя, если известно, и дату рождения ребенка);
14
b) возраст, пол, медицинский и поведенческий анамнез (собранной информации должно быть достаточно для применения критериев исключения, если необходимо);
c) время с момента смерти до момента забора;
d) выводы на основании осмотра тела, если применимо;
e) формулу гемодилюции, если применимо;
f) форму информированного согласия/разрешения, если применимо;
д) клинические данные, результаты лабораторных исследований и результаты других проведенных испытаний;
h) результаты вскрытия, если проводилось (для тканей и клеток, которые не могут храниться в течение длительного периода времени, должен быть записан предварительный устный отчет о вскрытии);
i) для доноров гемопоэтических прогениторных клеток пригодность донора выбранному реципиенту;
j) при независимом донорстве, когда организация, ответственная за забор имеет ограниченный доступ к данным реципиента, необходимо предоставить организации, проводящей трансплантацию, данные о доноре, достаточные для подтверждения пригодности донора.
D.5.2 Организация, проводящая забор, должна создавать отчет о заборе, который передается вместе с тканями.
Организация, проводящая забор, должна создать отчет о заборе, который передает в банк тканей. Данный отчет должен содержать, по меньшей мере, следующее:
a) идентификацию, наименование и адрес банка тканей, который получает клетки или ткани;
b) данные личности донора (включая информацию, как и кем была установлена личность донора);
c) описание и идентификацию забранных тканей и клеток (включая образцы для исследований);
d) личность лица, ответственного за забор, включая подпись;
е) дату, время (если применимо, время начала и окончания) и место забора, а также примененные стандартные рабочие процедуры, включая любые происшествия; если применимо, то условия окружающей среды в учреждении, в котором проводили забор (описание физической области, в которой происходил забор материала);
f) для посмертного донорства условия, в которых хранится труп, т. е. заморожен (или нет), время начала и
окончания заморозки;
д) идентификационный номер/номер партии использованных реагентов и растворов для транспортирования.
Отчет должен также содержать дату и время смерти. Все записи должны быть четкими и читаемыми, защищенными от посторонних поправок; они должны храниться и быть доступными в данном состоянии в течение всего установленного периода хранения в соответствии с законами о защите данных.
15
ГОСТ Р ИСО 13022-2016Содержание
1 Область применения ...................................................................................................................................1
2 Нормативные ссылки....................................................................................................................................2
3 Термины и определения...............................................................................................................................2
4 Процесс менеджмента риска.......................................................................................................................5
4.1 Общие положения.................................................................................................................................5
4.2 Опасности, связанные с клеточными компонентами..........................................................................5
4.3 Анализ риска..........................................................................................................................................6
4.4 Оценивание риска.................................................................................................................................7
4.5 Контроль риска......................................................................................................................................7
4.6 Оценивание допустимости общего остаточного риска.......................................................................8
4.7 Система получения информации на этапе производства и после производства............................8
Приложение А (справочное) Руководство по применению ИСО 13022.......................................................9
Приложение В (справочное) Графическое представление части процесса менеджмента
риском для медицинских продуктов, содержащих клетки...............................................10
Приложение С (обязательное) Требования к выбору доноров и испытания............................................11
Приложение D (справочное) Руководство по забору тканей.....................................................................14
Приложение Е (обязательное) Требования к обращению с клетками и тканями во время
производства.......................................................................................................................16
Приложение F (обязательное) Требования к упаковке и маркировке.......................................................18
Приложение G (справочное) Руководство по транспортированию...........................................................21
Приложение Н (справочное) Руководство по хранению.............................................................................25
Приложение I (обязательное) Требования к системе контроля.................................................................27
Приложение J (обязательное) Меры по снижению риска, связанного с заражением вирусами
и другими инфекционными агентами, такими как TSE....................................................28
Приложение К (справочное) Руководство, касающееся опасностей, вызванных
канцерогенным потенциалом человеческих клеток или тканей, используемых
при производстве медицинских продуктов........................................................................31
Приложение L (справочное) Руководство, касающееся микробиологической контаминации...............32
Приложение М (справочное) Руководство, касающееся потенциального негативного
влияния неклеточных остатков продукта..........................................................................33
Приложение N (обязательное) Требования, касающиеся потенциального негативного
влияния клеточных компонентов на медицинский продукт.............................................34
Приложение О (справочное) Руководство по описанию клеточных компонентов
медицинских продуктов......................................................................................................35
Приложение Р (справочное) Клиническая оценка и испытания................................................................38
Приложение ДА (справочное) Сведения о соответствии ссылочных международных
стандартов национальным и межгосударственным стандартам..................................39
Библиография ...............................................................................................................................................40
Приложение Е (обязател ьное)
Требования к обращению с клетками и тканями во время производства
Е.1 Общие положения
Процесс производства медицинских продуктов, содержащих клетки, должен быть тщательно разработан и утвержден для обеспечения стабильности продукции. Все требования должны быть определены и обоснованы.
Если в стране, в которой будут использовать медицинский продукт, существуют дополнительные национальные или региональные требования свыше определенных в данном приложении, то применимы такие требования.
Примечание — Руководства по специальным требованиям к обращению с клетками и тканями во время производства можно найти по ссылкам [38] и [46].
Е.2 Спецификации
Требуется наличие спецификаций для используемых клеток и тканей, всех производственных добавок, промежуточного и медицинского продукта. Спецификации должны быть документально зафиксированы.
Е.З Документация
Требуется наличие процедуры, отраженной документально, с подробным описанием производства клеточных компонентов и конечного продукта. Должен быть описан тип манипуляций, необходимых для обработки клеток и поддержания физиологической функции клеток. Должна быть подготовлена блок-схема всего процесса, начиная с биологической жидкости, ткани или органа либо с клеточного фонда, с указанием критических этапов и промежуточных продуктов (например, промежуточные партии клеток), а также рабочих параметров, параметров технологического контроля и критериев приемки.
Е.4 Комбинированные медицинские продукты на клеточной основе
Производство медицинского продукта, состоящего из клеток и матриц/устройств/каркасов, требует дополнительного внимания относительно взаимодействия между кпетками/матрицей/каркасом и вопросов качества, связанных с этими компонентами.
Матрицы/устройства/каркасы должны соответствовать своим нормативным документам и стандартам.
Необходимо обратить внимание на биодеградируемые материалы, которые могут, например, потенциально изменить окружающую среду (например, повысить значение pH) клеток во время производства или после введения.
Е.5 Производственное помещение
Производственное помещение должно быть пространственно отделено от места забора. Если в одном производственном помещении обрабатывают разные тканевые и клеточные продукты, существует повышенный риск перекрестного загрязнения во время каждого этапа производства, например через рабочее оборудование. Следовательно, необходимо внедрить соответствующие меры по чистке и контролю для предотвращения перекрестного загрязнения.
Помещение и оборудование для производства медицинских продуктов на клеточной основе должны быть соответствующими и аттестованными для асептического производства. Рекомендуется по возможности использовать отдельное, специфическое для продукта или одноразовое оборудование.
Для требований, относящихся к забору, см. приложение D.
Е.6 Процедуры обращения с клеткамиЕ.6.1 Общие положения
Все процедуры обращения с клетками должны быть обоснованы с учетом их предполагаемого использования. Влияние манипуляций клеток или тканей на всех этапах процесса производства рассматривают в процессе менеджмента риском. Значимость изменений (например, источник клеток, исходные материалы, производственные платформы, производственные зоны) требует особого внимания.
Все клеточные процедуры должны проводить в соответствии с документально подтвержденными стандартными рабочими процедурами. Различные этапы процесса должны быть утверждены. Должен быть определен соответствующий контроль. Микробиологический контроль является ключевым аспектом контроля процесса и менеджмента риском всех клеточных процедур. По возможности следует проводить контроль клеток, выращенных in vitro, на избранных этапах производства. Культура должна быть исследована на любое микробное загрязнение в соответствии с процедурами выращивания культивирования и характеристиками роста клеток.
Руководство по специальным требованиям к обращению с клетками и тканями во время производства можно найти по ссылке [38].
16
Введение
Международная организация по стандартизации (ИСО) является всемирной федерацией национальных организаций по стандартизации (комитетов — членов ИСО). Разработку международных стандартов обычно осуществляют технические комитеты ИСО. Каждый комитет — член, заинтересованный в деятельности, для которой был создан технический комитет, имеет право быть представленным в этом комитете. Международные правительственные и неправительственные организации, имеющие связи с ИСО, также принимают участие в работах. ИСО тесно сотрудничает с Международной электротехнической комиссией (МЭК) по всем вопросам электротехнической стандартизации.
Проекты международных стандартов разрабатывают в соответствии с правилами Директив ИСО/МЭК, часть 2.
Основная задача технических комитетов заключается в подготовке международных стандартов. Проекты международных стандартов, принятые техническими комитетами, рассылают комитетам-членам на голосование. Их опубликование в качестве международных стандартов требует одобрения не менее 75 % комитетов — членов, принимающих участие в голосовании.
Необходимо обратить внимание на то, что некоторые элементы настоящего стандарта могут быть объектом патентных прав. ИСО не может нести ответственность за идентификацию какого-либо одного или всех патентных прав.
ИСО 13022 был подготовлен Техническим комитетом ИСО/ТК 194 «Биологическая оценка медицинских изделий», подкомитетом SCI «Безопасность тканевых продуктов».
В некоторых медицинских продуктах используют материалы человеческого происхождения. В зависимости от требований национальных нормативных документов эти продукты рассматривают как лекарственные вещества, медицинские изделия или биопрепараты. Материалы из тканей человека применяют в разработке и производстве медицинских продуктов для обеспечения функциональных характеристик, выбор которых мог быть осуществлен ввиду их преимуществ в сравнении с материалами нечеловеческого происхождения, в частности для улучшения регенерации собственных тканей и органов пациента или для замены либо поддержки функции органа.
Медицинские продукты, использующие человеческие материалы, составляют гетерогенную группу. Примеры включают клеточные суспензии, кпеточные/матричные конструкции или клетки совместно со сложными медицинскими изделиями, например с оборудованием для диализа.
Хотя медицинские продукты, использующие человеческие материалы, очень разнообразны, опасности, конкретно связанные со всеми человеческими материалами, практически одинаковы:
a) материал может быть контаминирован инфекционными агентами [например, бактерии, плесень, дрожжи, вирусы, инфекционные агенты трансмиссивной губчатой энцефалопатии (Transmissible Spongiform Encephalopathy, TSE), паразиты];
b) материал может быть загрязнен химическими веществами;
c) материал может не подходить для предполагаемого назначения из-за непреднамеренного разложения или деградации, вызванной неправильным обращением на любом этапе производственного процесса;
d) материал может быть опасным для пациента из-за канцерогенного потенциала;
e) после применения могут возникать побочные отрицательные физиологические или анатомические последствия по причине миграции клеток и выделения биологически активных веществ;
f) нарушение и невозможность прослеживаемости;
д) материал может наносить вред пациенту, вызывая иммунную реакцию.
Для учета опасностей, связанных с загрязнением, деградацией, непреднамеренным изменением и/или перепутыванием жизнеспособных человеческих клеток и продуктов, был разработан настоящий стандарт по применению менеджмента риска при производстве медицинских продуктов, использующих жизнеспособный человеческий материал.
Опасности, упомянутые выше, связаны с соответствующими производственными этапами. Основные аспекты, включенные в настоящий стандарт, следующие:
-терминология и определения;
- отбор и исследование доноров (включая живых и трупных доноров);
- получение человеческих материалов;
- обращение с человеческими материалами (включая производство);
- упаковка, хранение и транспортирование человеческих материалов;
- маркировка человеческих материалов;
ГОСТ Р ИСО 13022-2016
- риск, связанный с обращением с продуктом при применении;
- рассмотрение рисков и преимуществ в контексте предполагаемого использования.
Настоящий стандарт оказывает поддержку производителям продуктов на основе жизнеспособных
человеческих материалов, производящим лекарственные средства, медицинские изделия или биопрепараты.
V
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИПРОДУКТЫ МЕДИЦИНСКИЕ, СОДЕРЖАЩИЕ ЖИЗНЕСПОСОБНЫЕ ЧЕЛОВЕЧЕСКИЕ КЛЕТКИПрименение менеджмента риска и требований к методикам обработки
Применение менеджмента риска и требований к методикам обработки
Medical products containing viable human cells.
Application of risk management and requirements for processing practices
Дата введения — 2017—01—01
1 Область применения
В настоящем стандарте определены требования и руководство по методикам обработки и управлению рисками, связанными с жизнеспособными клеточными компонентами продуктов, относящихся к медицинским продуктам, биопрепаратам, медицинским изделиям и активным имплантируемым медицинским изделиям, а также их комбинациям. Настоящий стандарт включает жизнеспособные как аутологичные, так и аллогенные ткани человека, полученные от живых и трупных доноров.
Для производителей медицинских продуктов, содержащих жизнеспособные клетки человека, в настоящем стандарте определены процедуры, используемые при обработке и применении, а также для идентификации опасностей и опасных ситуаций, связанных с такими клетками, для анализа и оценки конечных рисков, для контроля этих рисков и для проверки эффективности данного контроля. В настоящем стандарте определен процесс принятия решения о приемлемости остаточных рисков, принимая во внимание баланс остаточных рисков и ожидаемой медицинской пользы в сравнении с доступными альтернативами.
В настоящем стандарте определены требования и руководства по менеджменту риском, связанным с опасностями, типичными для медицинских продуктов, полученных с использованием жизнеспособных человеческих материалов, такими как:
a) контаминация бактериями, плесенью, дрожжами или паразитами;
b) контаминация вирусами;
c) контаминация агентами, вызывающими трансмиссивную губчатую энцефалопатию (Transmissible Spongiform Encephalopathy, TSE);
d) контаминация материала, вызывающая нежелательные пирогенные, иммуногенные или токсические реакции;
e) деструкция продукта и продукты деструкции, вызванные неправильным обращением;
f) опасности, связанные с канцерогенным потенциалом используемого типа клеток;
д) осложнения, вызванные побочными физиологическими или анатомическим последствиями (это включает непредвиденную миграцию клеток, нежелательное выделение биологически активных веществ, таких как гормоны и цитокины, и непредвиденное взаимодействие между клеточными и неклеточными компонентами продукта);
h) невозможность контроля;
i) осложнения, вызванные тем, что материал вызывает непредвиденную иммунную реакцию.
Для оценки контаминации другими неклассифицированными патогенами могут применять подобные принципы.
Опасности, связанные с генетическими изменениями, находятся за пределами области применения настоящего стандарта и рассматриваются в других документах.
Издание официальное
Примечание 1 — Определение «генетически модифицированный» можно найти в АСТМ Ф 2312.
Примечание 2 — В настоящем стандарте не определена система управления качеством для контроля всех этапов производства медицинских продуктов, описанных выше.
Если в странах, где используют медицинский продукт, существуют дополнительные национальные или региональные требования, они также должны быть применимы в дополнение к требованиям настоящего стандарта.
Примечание 3 — Региональные требования могут быть более строгими в отличие от требований, указанных в настоящем стандарте, особенно относительно критериев отбора доноров.
Настоящий стандарт не применим:
- к нежизнеспособным материалам человеческого происхождения;
-жизнеспособным клеткам нечеловеческого происхождения;
- крови и ее компонентам, используемым для переливания, эмбриональным клеткам, цельным органам и костному мозгу, используемым для трансплантации, и другим тканям, которые не подходят под определение «медицинский продукт»;
- приборам для диагностики in vitro.
Примечание 4 — Требования по применению настоящего стандарта см. приложение А.
2 Нормативные ссылки
Следующие документы, частично или в целом, являются необходимыми для применения настоящего стандарта. При датированной ссылке применимо только указанное издание. При ссылке без даты применимо последнее издание указанного документа, включая все поправки.
ISO 13485:2003 Medical devices — Quality management systems — Requirements for regulatory purposes (Медицинские изделия. Система менеджмента качества. Требования для регулирующих целей)
ISO 14971:2007 Medical devices —Application of risk management to medical devices (Медицинские изделия. Применение менеджмента риска к медицинским изделиям)
ISO 22442-1:2007 Medical devices utilizing animal tissues and their derivatives — Part 1: Application of risk management (Медицинские изделия, использующие ткани животных и их производные. Часть 1. Применение менеджмента риска)
ASTM F 2312 Standard Terminology Relating to Tissue Engineered Medical Products (Стандартная терминология, касающаяся медицинских продуктов, выполненных из тканей BSI PAS 84. Восстановительная медицина. Словарь, июнь 2008)
3 Термины и определения
В настоящем стандарте применены термины и определения, приведенные в ИСО 13485, ИСО 14971, ИСО 22442-1, АСТМ Ф 2312, BSI PAS 84, а также следующие термины с соответствующими определениями:
3.1 медицинское изделие (medical device): Инструмент, устройство, прибор, механизм, приспособление, имплантат, реагент in vitro или калибратор, программное обеспечение, материал или другие подобные либо сопутствующие средства, предназначенные производителем для применения человеком как отдельно, так и в сочетании друг с другом, с одной либо более определенными целями:
a) профилактики, диагностики, мониторинга, лечения или облегчения заболеваний;
b) диагностики, мониторинга, лечения, облегчения или компенсации последствий травмы;
c) исследования, замещения, изменения или поддержания анатомического строения либо физиологических процессов;
d) поддержания жизненно важных функций организма;
e) концептуального контроля;
f) дезинфекции медицинских изделий;
д) получения информации медицинского назначения посредством in vitro исследования проб, взятых из человеческого организма;
при условии, что их основное предусмотренное воздействие на организм человека не реализуется за счет фармакологических, иммунологических или метаболических средств, но может поддерживаться в своей основной функции таковыми.
Примечание 1 — Данное определение разработано Целевой группой по глобальной гармонизации (Global Harmonization Task Force, GHTF).
Примечание 2 — Следующие изделия могут рассматривать в некоторых нормативных документах как медицинские изделия, но в их отношении не выработан единый подход:
a) вспомогательные средства для лиц с ограниченными возможностями или с физическими и умственными недостатками;
b) изделия для лечения/диагностики заболеваний и травм у животных;
c) принадлежности для медицинских изделий (см. примечание 3);
d) дезинфицирующие вещества;
e) изделия, включающие в себя ткани животных или человека, которые могут отвечать требованиям определения, приведенного выше, но при этом являются предметом других нормативных требований.
Примечание 3 — Объектом настоящего стандарта также являются принадлежности, которые специально предназначены производителем для использования в комплекте с «исходным» медицинским изделием с целью обеспечения его предусмотренного применения.
Примечание 4 — Термин «медицинские изделия» включает в себя неактивные и активные медицинские изделия, а также активные имплантируемые медицинские изделия.
Примечание 5 — Адаптировано сообразно ИСО 14971, определение 2.9.
3.2 активное имплантируемое медицинское изделие (active implantable medical device): Активное медицинское изделие, предназначенное для его полного или частичного введения в тело человека хирургическим способом, или с помощью медикаментов, или путем медицинского проникновения в естественные отверстия и для нахождения в данном месте после этой процедуры.
Примечание 1 — Работа активного медицинского изделия основана на источнике электроэнергии или любом другом источнике энергии, отличной от непосредственно производимой телом человека или гравитацией.
Примечание 2 —Адаптировано сообразно ИСО 13485, определение 3.1.
3.3 лекарственный препарат (medicinal product): Вещество или комбинация веществ, представленных как имеющие свойства, обеспечивающие лечение или предотвращение заболевания человека, либо любое вещество или комбинация веществ, которые могут использовать в организме человека или вводить в организм человека либо для сохранения, корректировки или изменения физиологических функций с помощью фармакологического, иммунологического или метаболического воздействия, либо для постановки медицинского диагноза.
Примечание — См. ссылку [34].
3.4 медицинский продукт (medical product): Лекарственный препарат, биопрепарат, медицинское изделие или их комбинация.
3.5 медицинский продукт, содержащий клетки (cell-based medical product): Медицинский продукт, который включает жизнеспособные аутологичные или аллогенные клетки человека, полученные от прижизненного или посмертного донора, прошедший процесс обработки.
Примечание — Медицинский продукт не может комбинироваться с неклеточными компонентами.
3.6 биопрепараты (biologies or biological): Продукт клеточной терапии аутологичного или аллогенного происхождения, в котором клетки размножаются, выращиваются, отбираются, фармакологически обрабатываются или любым другим способом изменяются их биологические характеристики ex vivo для введения в тело человека и который применяется для профилактики, обработки, лечения, диагностики или устранения заболеваний либо повреждений.
Примечание 1 — См. ссылку [57].
Примечание 2 — Разъяснения FDA, содержащие определение биопрепарата можно найти по ссылке http://www.fda.aov/AboutFDA/CentersOffices/OfficeofMedicalProductsandTobacco/CBER/ucm133Q77.htm
3.7 донор (donor): Человеческий источник (прижизненный или посмертный) человеческих клеток или тканей.
Примечание — В случае аутологичного донорства живым донором является пациент.
3.8 забор (procurement): Процесс получения тканей или клеток от донора.
3.9 отходы (residues): Вещества или материалы, остающиеся после процесса производства, такие как клеточный детрит, продукты распада клеточного каркаса, химические вещества, факторы роста или растворители.
3.10 инактивация (inactivation): Процесс, в ходе которого снижается способность трансмиссивных агентов вызывать инфекцию или патогенную реакцию.
з
Примечание 1 — Эффективность процесса инактивации вирусов и агентов TSE выражена математически в виде коэффициента сокращения (см. ИСО 22442-3, приложение F).
Примечание 2 — Инактивация предназначена для предотвращения инфицирования трансмиссивными агентами и их репликации.
[ИСО 22442-1:2007, определение 3.5]
3.11 производство (manufacture): Любой или все этапы получения, скрининга, испытания, обработки, хранения, этикетирования, упаковки или распространения любых медицинских продуктов на основе клеток или тканей, включая скрининг и испытания для доноров клеток или тканей.
3.12 производитель (manufacturer): Физическое или юридическое лицо, несущее ответственность за проектирование, производство, упаковку и этикетирование медицинского продукта на клеточной основе перед его выпуском в продажу от своего имени независимо от того, выполняет ли эти операции вышеупомянутое лицо или третья сторона от его имени.
3.13 хранение (storage): Обеспечение соответствующих контролируемых условий для медицинского продукта, содержащего клетки, до момента последующей обработки или распространения.
3.14 транспортирование (transport): Перемещение медицинского продукта, содержащего клетки, при соответствующих контролируемых условиях.
3.15 риск (risk): Комбинация вероятности возникновения вреда и тяжести данного вреда.
[Руководство ИСО/МЭК 51:1999, определение 3.2]
3.16 вред (harm): Физическое повреждение или нарушение здоровья человека, или повреждение имущества либо окружающей среды.
[Руководство ИСО/МЭК 51:1999, определение 3.3].
3.17 опасность (hazard): Потенциальный источник вреда.
Примечание1 — См. ICH Q9.
Примечание 2 — Адаптировано из Руководства ИСО/МЭК 51:1999, определение 3.5.
3.18 остаточный риск (residual risk): Риск, остающийся после принятия мер по контролю рисков.
Примечание 1 —Адаптировано из Руководства ИСО/МЭК 51:1999, определение 3.9.
Примечание 2 — В определении 3.9 Руководства ИСО/МЭК 51:1999 использован термин «меры предосторожности», а не «меры по контролю рисков». В контексте настоящего стандарта «меры предосторожности» — это только один из возможных способов контроля рисков.
3.19 анализ риска (risk analysis): Систематическое использование доступной информации для идентификации опасностей и для определения риска.
[Руководство ИСО/МЭК 51:1999, определение 3.10]
3.20 оценка риска (risk assessment): Общий процесс, включающий анализ риска и оценивание риска.
[Руководство ИСО/МЭК 51:1999, определение 3.12]
3.21 контроль риска (risk control): Процесс принятия решений и выполнения мер по уменьшению рисков до установленных уровней или поддержания рисков на установленных уровнях.
[ИСО 14971:2007, определение 2.19]
3.22 определение риска (risk estimation): Процесс, применяемый для присвоения числовых значений вероятности возникновения вреда и тяжести этого вреда.
[ИСО 14971:2007, определение 2.20]
3.23 оценивание риска (risk evaluation): Процесс сравнения определенного риска сданными критериями риска для определения допустимости риска.
[ИСО 14971:2007, определение 2.21]
3.24 менеджмент риска (risk management): Систематическое применение правил, процедур и практических методов управления для анализа, оценивания, контроля и мониторинга риска.
[ИСО 14971:2007, определение 2.22]
3.25 документация менеджмента риска (risk management file): Совокупность записей и других документов, создаваемых в процессе менеджмента риска.
[ИСО 14971:2007, определение 2.23]
3.26 безопасность (safety): Отсутствие недопустимого риска.
[Руководство ИСО/МЭК 51:1999, определение 3.1]
3.27 степень тяжести (severity): Мера возможных последствий опасности.
[ИСО 14971:2007, определение 2.25]
ГОСТ Р ИСО 13022-20164 Процесс менеджмента риска
4.1 Общие положения
При рассмотрении менеджмента риском необходимо учитывать два компонента:
a) вероятность возникновения вреда для пациента или пользователя продукта;
b) последствия данного вреда, т. е. насколько тяжелыми они могут быть.
Менеджмент риском крайне важен для клеточных компонентов медицинских продуктов, включающих жизнеспособные клетки или ткани человека, в связи с опасностями, присущими данной группе продуктов, и большим количеством заинтересованных сторон, включая медицинских работников, организации, обеспечивающие медицинский уход, органы управления, промышленность, пациентов и рядовых членов общества. Кроме того, на заинтересованные стороны может влиять доступность данного типа медицинских продуктов (особенно важны клеточные компоненты медицинских продуктов, так как этот исходный материал может быть более редким, чем другие компоненты медицинского продукта). Следовательно, доступность для пациента должны учитывать.
Производитель должен принимать решение о безопасности медицинского продукта на клеточной основе, включая приемлемость рисков, учитывая современный уровень развития науки, для определения возможности размещения медицинского продукта на рынке для его предполагаемого использования. Настоящий стандарт устанавливает процесс, с помощью которого производитель медицинского продукта, содержащего клетки, может идентифицировать опасности, связанные с клеточным компонентом продукта, определить и оценить риски, связанные с этими опасностями, контролировать эти риски и проверять эффективность данного контроля.
Производитель должен обосновывать использование человеческого материала (включая выбор типа и источника клеток и/или тканей), основываясь на приемлемости остаточного риска, учитывая баланс остаточного риска и ожидаемой медицинской пользы по сравнению с доступными альтернативами. При рассмотрении рисков и преимуществ продукта необходимо учитывать влияние хирургических процедур, необходимых для его введения.
К медицинским веществам, составляющим часть продукта, применяют требования Фармацевтической системы качества (ICH Q9 (см. ссылку [20]) и надлежащей производственной практики.
К медицинским изделиям, составляющим часть продукта, применяют требования ИСО 14971 и ИСО 13485.
4.2 Опасности, связанные с клеточными компонентами4.2.1 Общие положения
Производитель должен установить, документально оформить и поддерживать в течение всего жизненного цикла продукта систематизированный процесс по идентификации опасностей, связанных с клеточным компонентом медицинского продукта, содержащего клетки, определить и оценить сопряженные риски по контролю этих рисков и проверке эффективности контроля.
Этот процесс должен включать следующие элементы:
a) анализ риска;
b) оценивание риска;
c) контроль риска;
d) рассмотрение информации, полученной на стадии производства и после производства.
Соответствующие части процесса менеджмента риска должны быть внедрены в документированный процесс реализации продукта на протяжении всего жизненного цикла продукта.
Примечание —Документированный процесс системы управления качеством может систематически использовать производитель для обеспечения безопасности, в частности с целью ранней идентификации опасностей и опасных ситуаций в сложных медицинских продуктах на клеточной основе.
Соответствие следует определять посредством инспекции определенных документов, таких как документация менеджмента риском. Инспекцию проводят и документально фиксируют уполномоченные сотрудники.
4.2.2 Обязанности
Производитель должен иметь организационную структуру и рабочие процедуры, соответствующие его деятельности. Организационная схема должна четко определять ответственность и схему подотчетности.
Производитель должен обеспечивать доступность адекватных источников и наличие квалифицированного персонала для производства продукта и деятельности по менеджменту риском.
5