ГОСТ Р 57492-2017
Изделия медицинские. Электрокардиостимуляторы имплантируемые. Технические требования для государственных закупок
Купить ГОСТ Р 57492-2017 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает требования к подготовке ТЗ и их оформлению при проведении государственных закупок ИЭКС. Стандарт распространяется на ИЭКС, которые являются активными имплантируемыми МИ и предназначены для терапии брадиаритмий. Стандарт также распространяется на некоторые неимплантируемые части и принадлежности ИЭКС. Стандарт не описывает и не регламентирует функциональные, технические, качественные и любые другие особенности ИЭКС, предназначенные для терапии тахиаритмий (функционал кардиоверсии и дефибрилляции).
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Общие требования к содержанию технического задания для государственных закупок медицинских изделий
5 Комплектность имплантируемой системы электрокардиостимуляции
6 Типы имплантируемых электрокардиостимуляторов
7 Режимы работы имплантируемых электрокардиостимуляторов
8 Типы электродов для имплантируемых электрокардиостимуляторов
9 Технические характеристики, указываемые в техническом задании
10 Требования к оформлению технического задания
Приложение А (обязательное) Перечень нормативных документов, определяющих требования к имплантируемым электрокардиостимуляторам
Приложение Б (справочное) Пример медико-технических характеристик имплантируемых электрокардиостимуляторов
| Дата введения | 01.06.2018 |
|---|---|
| Добавлен в базу | 01.01.2018 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 08.06.2017 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 504-ст |
|---|---|---|---|
| Разработан | ООО НТЦ МЕДИТЭКС | ||
| Издан | Стандартинформ | 2017 г. |
Medical devices. Implantable cardiac pacemakers. Technical requirements for governmental purchases
- ГОСТ 30324.0-95 Изделия медицинские электрические. Часть 1. Общие требования безопасности
- ГОСТ 20790-93 Приборы, аппараты и оборудование медицинские. Общие технические условия
- ГОСТ Р 50444-92 Приборы, аппараты и оборудование медицинские. Общие технические условия
- ГОСТ Р МЭК/ТО 60788-2009 Изделия медицинские электрические. Словарь
- ГОСТ Р ИСО 5841-3-2010 Соединители IS-1 для имплантируемых электрокардиостимуляторов низкопрофильные. Технические требования и методы испытаний
- ГОСТ Р МЭК 60601-1-2010 Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик
- ГОСТ Р 50267.0-92 Изделия медицинские электрические. Часть 1. Общие требования безопасности
- ГОСТ ISO 10993-10-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия
- ГОСТ ISO 10993-6-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации
- ГОСТ ISO 10993-4-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4. Исследования изделий, взаимодействующих с кровью
- ГОСТ ISO 10993-5-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro
- ГОСТ ISO 10993-1-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
- ГОСТ ISO 10993-11-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
- ГОСТ 31582-2012 Электроды для электрокардиостимуляторов имплантируемые. Технические требования и методы испытаний
- ГОСТ Р ИСО 14708-1-2012 Имплантаты хирургические. Активные имплантируемые медицинские изделия. Часть 1. Общие требования к безопасности, маркировке и информации, предоставляемой изготовителем
- ГОСТ Р МЭК 60601-1-2-2014 Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания
- ГОСТ 31212-2003 Электрокардиостимуляторы имплантируемые. Общие технические требования и методы испытаний
- ГОСТ Р 55719-2013 Изделия медицинские электрические. Требования к содержанию и оформлению технических заданий для конкурсной документации при проведении государственных закупок высокотехнологичного медицинского оборудования
- ГОСТ 30324.0.4-2002 Изделия медицинские электрические. Часть 1. Общие требования безопасности. 4. Требования безопасности к программируемым медицинским электронным системам
- ГОСТ ISO 10993-7-2016 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации
- ГОСТ Р 52770-2016 Изделия медицинские. Требования безопасности. Методы санитарно-химических и токсикологических испытаний
- ГОСТ Р ИСО 14630-2017 Имплантаты хирургические неактивные. Общие требования
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13
стр. 14
стр. 15
стр. 16
стр. 17

стр. 18

стр. 19

стр. 20
ГОСТР
57492-
2017
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ
Электрокардиостимуляторы имплантируемые. Технические требования для государственных закупок
Издание официальное
Москва
Стандартинформ
2017
ГОСТ P 57492—2017
Предисловие
1 РАЗРАБОТАН Обществом с ограниченной ответственностью «Научно-технический центр «МЕДИТЭКС» (ООО «НТЦ «МЕДИТЗКС»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 011 «Медицинские приборы, аппараты и оборудование»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 8 июня 2017 г. № 504-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ. 2017
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ P 57492—2017
9.1.1 Описание типа ИЭКС:
- число ИЭКС. шт.:
- тип (вид) ИЭКС по числу стимулируемых камер сердца: однокамерный, двухкамерный и т. д.;
- стимулируемая камера сердца (указывают только для однокамерных ИЭКС): правое предсердие. правый желудочек:
- поддерживаемые режимы работы (стимуляции) ИЭКС (указывают согласно разделу 7);
- функция частотной адаптации;
- функция многокамерной стимуляции;
- МРТ-совместимость.
Примечание — Необходимость в MPT-совместимости ИЭКС должна быть обоснована с точки зрения клинической необходимости как соответствующая повышенной потребительской, технической и функциональной характеристикам.
9.1.2 Программируемые параметры ИЭКС (при необходимости указывают, является ли параметр программируемым вручную и/или регулируемым автоматически);
- базовая (основная) частота стимуляции, мин'1;
- диапазон регулировки базовой (основной) частоты стимуляции, мин'1;
- шаг регулировки базовой (основной) частоты стимуляции, мин-1;
- максимальная частота синхронизации, мин'1;
- диапазон регулировки максимальной частоты синхронизации, мин'1;
- шаг регулировки максимальной частоты синхронизации, мин'1;
- максимальная сенсорная частота, мин'1;
- диапазон максимальной сенсорной частоты, мин'1;
- шаг регулировки максимальной сенсорной частоты, мин'1;
- амплитуда стимулирующего импульса. В;
- диапазон регулировки амплитуд стимулирующего импульса. В;
- шаг регулировки амплитуд стимулирующего импульса. В;
- длительность (ширина) стимулирующего импульса, мс;
- диапазон регулировки длительности (ширины) стимулирующего импульса, мс;
- шаг регулировки длительности (ширины) стимулирующего импульса, мс;
- чувствительность к предсердным сигналам. мВ;
- диапазон регулировки чувствительности к предсердным каналам. мВ;
- шаг регулировки чувствительности к предсердным каналам. мВ;
- чувствительность к желудочковым сигналам. мВ:
- диапазон регулировки чувствительности к желудочковым каналам. мВ;
- шаг регулировки чувствительности к желудочковым каналам. мВ;
- конфигурация полярности стимулирующего импульса: монополярная и/или биполярная;
- конфигурация полярности чувствительности (восприятия): монополярная и/или биполярная;
- интервал воспринятой АВ-задержки. мс (применимо только к двух- и многокамерным ИЭКС); •диапазон регулировки интервала воспринятой АВ-задержки. мс (применимо только к двух- и
многокамерным ИЭКС);
- шаг регулировки интервала воспринятой АВ-задержки (применимо только к двух- и многокамерным ИЭКС). мс;
- интервал стимулированной АВ-задержки (применимо только к двух- и многокамерным ИЭКС). мс;
- диапазон регулировки интервала стимулированной АВ-задержки (применимо только к двух- и многокамерным ИЭКС), мс;
- шаг регулировки интервала стимулированной АВ-задержки (применимо только к двух- и многокамерным ИЭКС), мс;
- длина межжелудочковой (W) задержки (применимо только к устройствам СРТ). мс;
- диапазон регулировки длин межжелудочковой (W) задержки (применимо только к устройствам СРТ). мс;
- шаг регулировки длин межжелудочковой (W) задержки (применимо только к устройствам СРТ). мс;
- постжелудочковый предсердный рефрактерный период (применимо только к двух- и многокамерным ИЭКС). мс;
- диапазон регулировки постжелудочкового предсердного рефрактерного периода (применимо только к двух- и многокамерным ИЭКС), мс;
7
- шаг регулировки постжелудочкового предсердного рефрактерного периода (применимо только к двух- и многокамерным ИЭКС), мс;
- постжелудочковый предсердный слепой период, мс;
-диапазон регулировки предсердного слепого периода, мс;
- шаг регулировки предсердного слепого периода, мс;
- желудочковый рефрактерный период (применимо только к двух- и многокамерным ИЭКС). мс;
- диапазон регулировки желудочкового рефрактерного периода (применимо только к двух- и многокамерным ИЭКС). мс;
- шаг регулировки желудочкового рефрактерного периода (применимо только к двух- и многокамерным ИЭКС). мс;
- слепой период желудочковой стимуляции, мс;
- диапазон регулировки слепого периода желудочковой стимуляции, мс;
- шаг регулировки слепого периода желудочковой стимуляции, мс.
9.1.3 Функциональные характеристики ИЭКС:
- возможность выполнения магнитного теста;
- алгоритмы динамического укорочения АВ-задержхи при учащении ритма сердца;
- алгоритм группы поиска собственного АВ-проведения (гистерезис АВ-задержек);
- алгоритм группы полной минимизации желудочковой стимуляции;
- алгоритм группы детекции фибрилляции предсердий и автоматического переключения базового режима двухкамерной стимуляции на страхующую желудочковую стимуляцию;
- алгоритм реакции на воспринятое трепетание предсердий;
- алгоритм группы детекции и автоматического прерывания пейсмейкерных тахикардий (РМТ);
- алгоритмы группы предупреждения развития наджелудочковых тахиаритмий;
- алгоритмы антитахикардитической стимуляции для купирования предсердных аритмий;
- алгоритм группы регулирования частоты сокращений желудочков при фибрилляции предсердий и сохраненной АВ-проводимости;
- алгоритм реакции на внезапную брадикардию;
- алгоритмы группы безопасной желудочковой стимуляции;
- алгоритмы односенсорной частотной адаптации (изолированное применение акселерометра, минутной вентиляции или прочих типов сенсоров);
- алгоритмы многосенсорной частотной адаптации (сочетанное или/и изолированное применение акселерометра, минутной вентиляции и прочих типов сенсоров);
- алгоритмы отслеживания эпизодов апноэ сна и реакции на них;
- алгоритмы отслеживания накопления жидкости в грудной полости, изменения внутригрудного импеданса и реакции на нее;
- алгоритм группы определения чувствительности по предсердному каналу с автоматической адаптацией величины параметра чувствительности по предсердному каналу;
- алгоритм группы определения чувствительности по желудочковому каналу с автоматической адаптацией величины параметра чувствительности по желудочковому каналу;
- алгоритм переключения полярности электрода (из биполярной в монополярную и обратно, из монополярной в биполярную) при выявлении критических показателей импеданса соответствующей конфигурации полярности электрода;
- алгоритмы распознавания шумов по желудочковому каналу;
- алгоритм автоматического определения имплантации и инициализации стимулятора.
9.1.4 Телеметрические функции ИЭКС и функции сбора статистических данных (доступные при взаимодействии с программатором врача):
- беспроводной опрос устройства;
- поддержка возможности проведения процедуры неинвазивного электрофизиологического исследования и купирования тахиаритмий посредством программатора;
- автоматическое сохранение статистической информации в памяти ИЭКС и ее получение посредством телеметрии: модель и серийный номер, напряжение батареи (источника тока), импеданс электродной системы, число событий и частотная гистограмма событий (воспринятых и навязанных), число сигналов помех, число экстрасистол, долговременные суточные тренды (предсердных аритмий; желудочковых аритмий; предсердной частоты; желудочковой частоты; % стимуляции отслеживаемых камер сердца, характеристики переключения режимов стимуляции и прочие);
8
ГОСТ P 57492—2017
- система анализа данных диагностики: автоматический анализ накопленной диагностической информации с выдачей врачу сообщений о клинически значимых событиях с графическим представлением диагностических данных;
- автоматический анализ параметров стимуляции/детекции и терапии с рекомендациями по перепрограммированию устройства для оптимизации терапии;
- функция автоматической записи предсердных и желудочковых ВСЭГ в память ИЭКС с маркерами;
- функция сохранения в памяти устройства ВСЭГ. выбранных врачом во время предыдущего программирования системы стимуляции шаблонов эпизодов, автоматически или после принудительной активации специалистом данной возможности;
- запись ВСЭГ с маркерами в реальном времени;
- функция выполнения измерений длительности циклов и амплитуды событий во время текущей и сохраненной записи;
- функция временного программирования;
- функция оценки состояния источника питания с визуализацией графика и указанием остаточного срока службы.
9.1.5 Физические параметры ИЭКС:
- материал корпуса:
- тип коннекторной части для подсоединения электродов;
Примечание — Для типа коннектора IS-1 указывают на необходимость его соответствия требованиям ГОСТ Р ИСО 5841-3.
- масса, г;
- габариты, мм (ДхВхШ);
- номинальный срок службы, лет.
9.2 Характеристики электрода(ов) для ИЭКС:
- число электродов для ИЭКС, шт.;
- тип (вид) электрода по месту камеры имплантации: желудочковый, предсердный или левожелудочковый;
- тип (вид) электрода по месту имплантации: эликардиальный или эндокардиальный;
- тип (вид) электрода по конфигурации полярности: монополярный и/или биполярный, многополярный;
- фиксация электрода, пассивная или активная;
- тип коннектора для подключения к ИЭКС;
Примечание — Для типа коннектора IS-1 указывают на необходимость его соответствия требованиям ГОСТ Р ИСО 5841-3.
- длина электрода, см;
- диаметр электрода, мм или Fr (френч);
- стероидные лекарственные средства в составе электрода.
9.3 Характеристики других комплектующих ИЭКС
Требования к другим комплектующим (например, к системе удаленного мониторинга пациента, интродьюсерам. кабелю для тестирования порогов стимуляции и т. д.) заполняют в соответствии с потребностями заказчика (медицинской организации).
10 Требования к оформлению технического задания
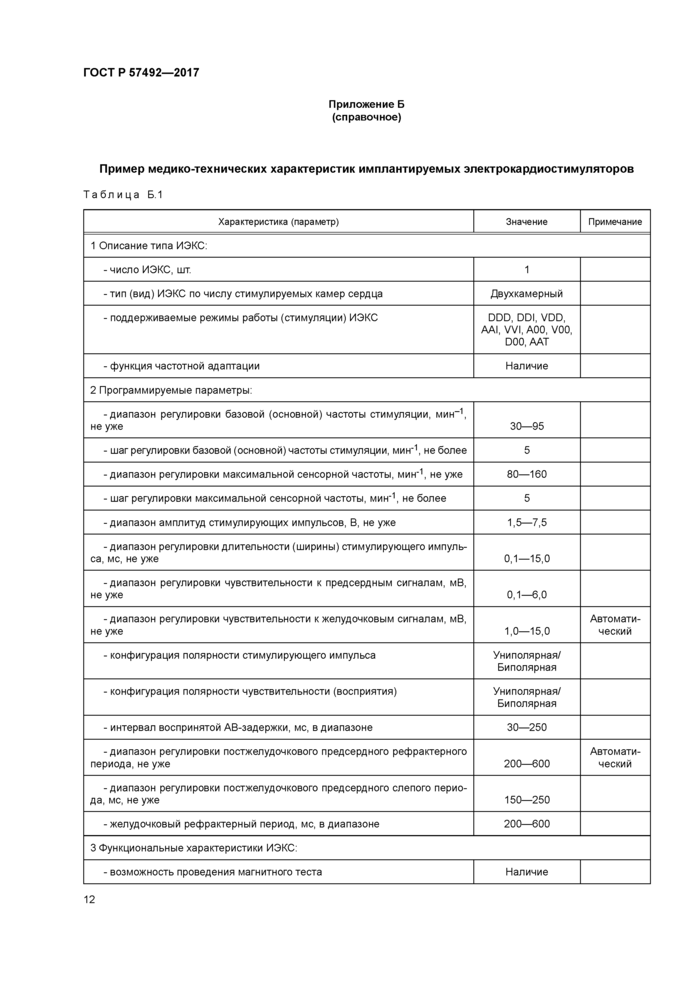
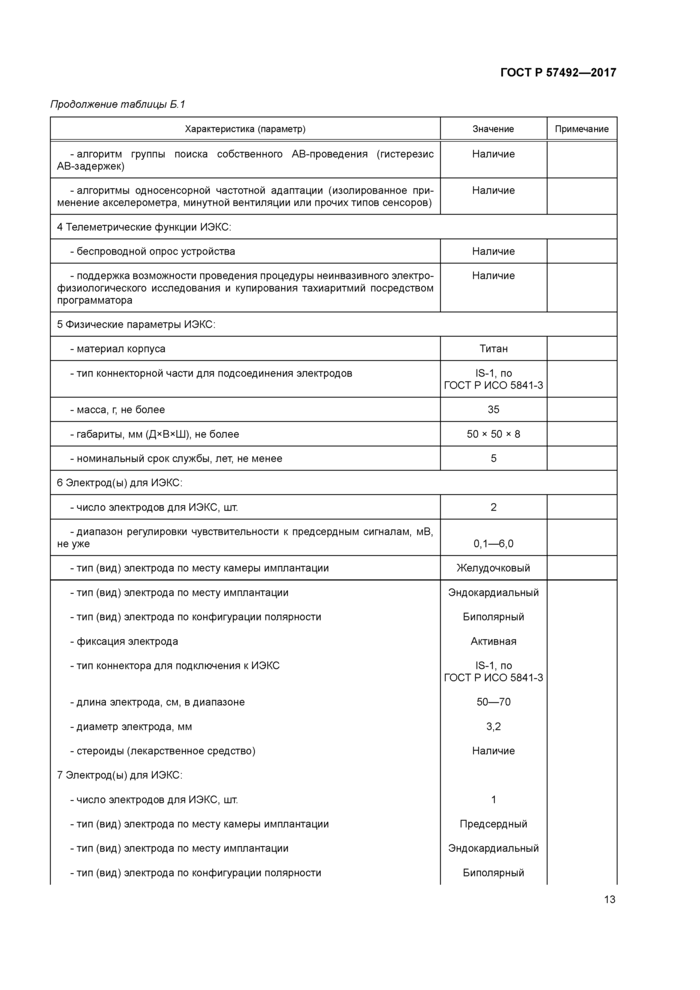
10.1 Пример медико-технических характеристик имплантируемых электрокардиостимуляторов приведен в таблице Б.1 приложения Б.
10.2 Числовые и нечисловые значения характеристик (параметров), представленные в таблице Б.1 приложения Б. носят демонстрационный характер и не могут быть использованы как типовые значения при составлении ТЗ.
10.3 Дополнительные требования, обоснованные заказчиком с позиций клинико-технической необходимости. оформляют в виде приложения к ТЗ.
9
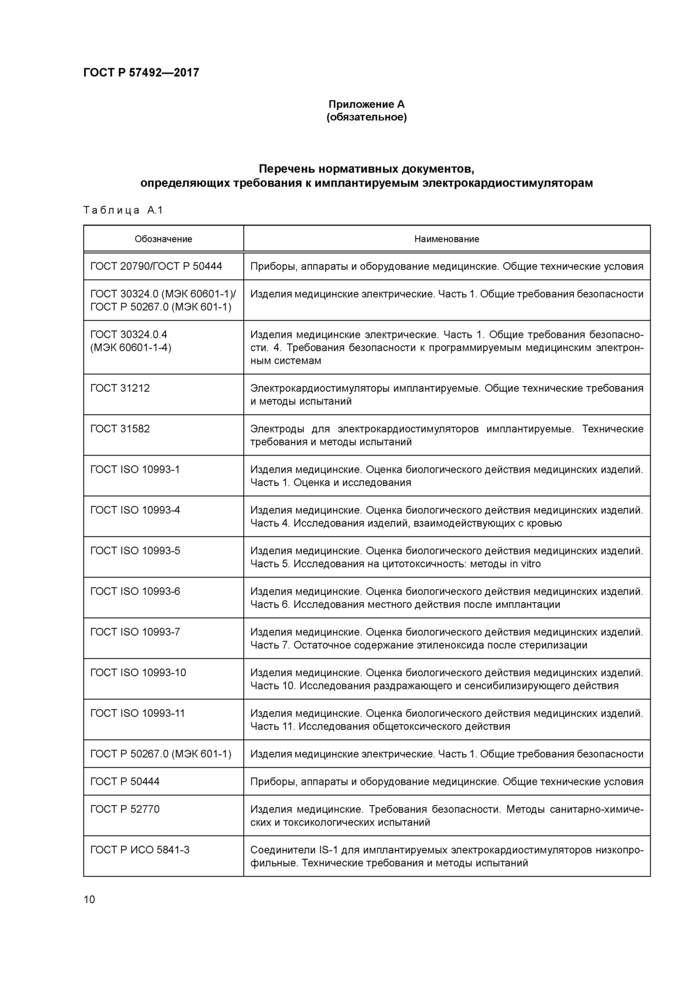
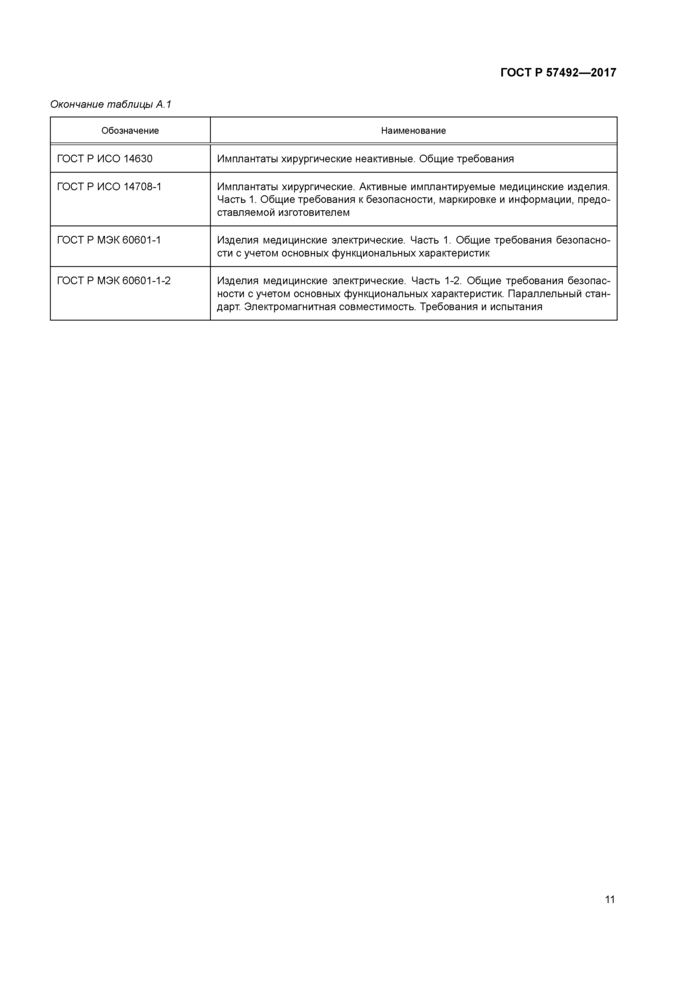
Приложение А (обязательное)
Перечень нормативных документов, определяющих требования к имплантируемым электрокардиостимуляторам
|
Таблица А1 | ||||||||||||||||||||||||||||||||||
|
|
Окончание таблицы А 1 | ||||||||||
|
11
Приложение Б (справочное)
Пример медико-технических характеристик имплантируемых электрокардиостимуляторов
|
Таблица Б1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения...............................................................2
4 Общие требования к содержанию технического задания для государственных закупок
медицинских изделий.................................................................4
5 Комплектность имплантируемой системы электрокардиостимуляции..........................5
6 Типы имплантируемых электрокардиостимуляторов........................................5
7 Режимы работы имплантируемых электрокардиостимуляторов...............................5
8 Типы электродов для имплантируемых электрокардиостимуляторов..........................6
9 Технические характеристики, указываемые в техническом задании...........................6
10 Требования к оформлению технического задания.........................................9
Приложение А (обязательное) Перечень нормативных документов, определяющих требования
к имплантируемым электрокардиостимуляторам..............................10
Приложение Б (справочное) Пример медико-технических характеристик имплантируемых
электрокардиостимуляторов ..............................................12
ГОСТ P 57492—2017
Введение
Настоящий стандарт устанавливает основные требования, которые должны содержаться в технических заданиях (ТЗ) для государственных закупок имплантируемых электрокардиостимуляторов (ИЭКС). Стандарт может использоваться самостоятельно, а также совместно со стандартами, устанавливающими основные требования, которые должны содержаться в ТЗ для государственных закупок активных имплантируемых медицинских изделий (МИ), которые выполняют антибрадикардитические функции, не являющиеся для них основными (например, в имплантируемых кардиовертерах-дефи-брилляторах). В этом случае технические требования, указанные в настоящем стандарте, дополняют требования, которые указаны в совместно используемом стандарте.
Международных аналогов настоящему стандарту не существует. Настоящий стандарт отражает специфику отечественных форм государственных закупок МИ и может быть только национальным документом.
IV
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ
Электрокардиостимуляторы имплантируемые.
Технические требования для государственных закупок
Medical devices Implantable cardiac pacemakers Technical requirements (or governmental purchases
Дата введения — 2018—06—01
1 Область применения
Настоящий стандарт устанавливает требования к подготовке ТЗ и их оформлению при проведении государственных закупок ИЭКС.
Настоящий стандарт распространяется на ИЭКС. которые являются активными имплантируемыми МИ и предназначены для терапии брадиаритмий.
Настоящий стандарт также распространяется на некоторые неимплантируемые части и принадлежности ИЭКС. как определено в разделе 5.
Настоящий стандарт не описывает и не регламентирует функциональные, технические, качественные и любые другие особенности ИЭКС, предназначенные для терапии тахиаритмий (функционал кардиоверсии и дефибрилляции).
Настоящий стандарт является частным стандартом по отношению к ГОСТ Р 55719.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 20790/ГОСТ Р 50444 Приборы, аппараты и оборудование медицинские. Общие технические условия
ГОСТ 30324.0 (МЭК 601-1)/ГОСТ Р 50267.0 (МЭК 601-1) Изделия медицинские электрические. Часть 1. Общие требования безопасности
ГОСТ 30324,0.4 (МЭК 60601-1-4) Изделия медицинские электрические. Часть 1. Общие требования безопасности. 4. Требования безопасности к программируемым медицинским электронным системам ГОСТ 31212 Электрокардиостимуляторы имплантируемые. Общие технические требования и методы испытаний
ГОСТ 31582 Электроды для электрокардиостимуляторов имплантируемые. Технические требования и методы испытаний
ГОСТ ISO 10993-1 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ГОСТ ISO 10993-4 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4. Исследования изделий, взаимодействующих с кровью
ГОСТ ISO 10993-5 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro
ГОСТ ISO 10993-6 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации
ГОСТ ISO 10993-7 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации
ГОСТ ISO 10993-10 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия
Издание официальное
ГОСТ ISO 10993-11 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
ГОСТ Р 50267.0 (МЭК 601-1) Изделия медицинские электрические. Часть 1. Общие требования безопасности
ГОСТ Р 50444 Приборы, аппараты и оборудование медицинские. Общие технические условия ГОСТ Р 52770 Изделия медицинские. Требования безопасности Методы санитарно-химических и токсикологических испытаний
ГОСТ Р 55719 Изделия медицинские электрические. Требования к содержанию и оформлению технических заданий для конкурсной документации при проведении государственных закупок высокотехнологичного медицинского оборудования
ГОСТ Р ИСО 5841-3 Соединители IS-1 для имплантируемых электрокардиостимуляторов низкопрофильные. Технические требования и методы испытаний
ГОСТ Р ИСО 14630 Имплантаты хирургические неактивные. Общие требования ГОСТ Р ИСО 14708-1 Имплантаты хирургические. Активные имплантируемые медицинские изделия. Часть 1. Общие требования к безопасности, маркировке и информации, предоставляемой изготовителем
ГОСТ Р МЭК 60601-1 Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик
ГОСТ Р МЭК 60601-1-2 Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания
ГОСТ Р МЭК/ТО 60788 Изделия медицинские электрические. Словарь
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения Если ссылочный стандарт отменен без замены, то положение. в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ Р ИСО 14708-1, ГОСТ Р МЭК/ТО 60788. а также следующие термины с соответствующими определениями:
3.1 Р(Р)-синхронизированный режим: Режим работы ЭКС, при котором выходные импульсы принудительно генерируются в ответ на детектированные (воспринятые) предсердные (Р) и/или желудочковые (R) события, обычно по окончании соответствующей задержки и/или интервала («триггерная» или «повторяющаяся» реакция ЭКС).
Примечание — При отсутствии естественной активности предсердий (желудочков) ЭКС работает на установленной частоте стимуляции
3.2 Р(Р)-запрещаемый режим: Режим работы ЭКС. при котором формирование выходного стимулирующего импульса блокируется при восприятии спонтанного или внешнего сигналов предсердных (Р) и/или желудочковых (R) событий, но стимулятор находится в постоянной готовности к нанесению стимулов («запрещающий» способ реакции ЭКС).
Примечание — При отсутствии естественной активности предсердий (желудочков) ЭКС работает на установленной частоте стимуляции
3.3 базовая частота: Частота импульсов ЭКС. с которой осуществляется стимуляция камеры сердца при отсутствии спонтанной сердечной активности.
3.4 базовый период следования импульсов (базовый интервал стимуляции): Период времени между двумя последовательными стимулами при отсутствии между ними воспринятой спонтанной активности стимулируемой камеры сердца или другого электрического воздействия.
2
ГОСТ P 57492—2017
3.5 внутрисердечная электрограмма; ВСЭГ: Графическое изображение сердечных сигналов, зарегистрированных посредством имплантированных электродов изнутри сердца и с поверхности сердца.
Примечание — ВСЭГ имеет отдельный маркерный канал, показывающий, как именно устройство восприняло события, автоматически выполнило измерения и реализовало алгоритмы
3.6 гистерезис: Параметр однокамерных и многокамерных ИЭКС, определяемый как разница между выскальзывающим интервалом и базовым интервалом стимуляции.
Примечание — Обычно используется для поиска и поддержания собственной частоты ритма сердца (параметр группы гистерезис частоты) В многокамерных ИЭКС — отдельная возможность расширения длины фиксированных предсердно-желудочковых интервалов для поиска собственного АВ-проведения (параметр группы гистерезис АВ-эадержек)
3.7 имплантируемый генератор импульсов; ИГИ: Часть ИЭКС. включающая в себя электронный блок и источник питания, обеспечивающие формирование стимулирующих импульсов.
3.8 имплантируемый электрокардиостимулятор; ИЭКС: Имплантируемое с помощью хирургического вмешательства в тело пациента активное электрическое МИ. помещенное в изолированный корпус (имплантируемый генератор импульсов), предназначенное для стимуляции сердечных сокращений посредством генерации электрических импульсов, которые передаются к сердечной мышце через имплантированные электроды, в соответствии с реализацией неинвазивно запрограммированных устройству параметров и алгоритмов (с помощью программатора).
Примечание — Согласно настоящему стандарту имплантируемый электрокардиостимулятор может являться как единым изделием, так и системой, состоящей из частей и принадлежностей, которые взаимодействуют друг с другом для обеспечения производительности изделия, заявленной изготовителем Не все из этих компонентов или принадлежностей могут быть частично или полностью имплантированы, например программатор, устройство тестовых измерений.
3.9 межжелудочковый интервал (задержка) (V-V): Параметр устройства ресинхронизирующей терапии, определяемый как интервал между правожелудочковым и левожелудочковым стимулами.
3.10 предсердно-желудочковый интервал (задержка) (A-V): Параметр многокамерных ИЭКС. определяемый как интервал после воспринятой спонтанной электрической активности предсердий, или сформированный предсердным стимуляционным импульсом и последующей воспринятой спонтанной электрической активностью желудочков, или сформированный импульсом стимуляции желудочков.
3.11 интродьюсер: Одноразовое или многоразовое устройство, обеспечивающее внутрисосудистое введение электродов и катетеров без дополнительной травмы и повторных пункций.
3.12 магнитный тест (магнитный режим): Переход на асинхронную стимуляцию в ответ на прикладывание постоянного магнита с изменением частоты стимуляции для верификации функционирования ИЭКС и оценки состояния батареи.
3.13 максимальная сенсорная частота: Максимальная частота стимуляции в ответ на сенсорный сигнал одно-, двух-, многокамерных режимов стимуляции.
3.14 максимальная частота синхронизации: Частота, на которой осуществляется максимальная частота Р-синхронизированной желудочковой стимуляции в многокамерных режимах, поддерживающих восприятие и стимуляцию отслеживаемых камер сердца в соотношении 1:1 (например, DDD. DDDR, VDD, VDDR).
3.15 межимпульсный интервал (интервал электростимуляции, автоматический интервал стимуляции): Период времени между двумя последовательными стимулами.
3.16 MPT-совместимость: Совместимость ИЭКС с процедурой магнитно-резонансной томографии (МРТ) при условии использования в составе имплантированного ИЭКС MPT-совместимого генератора импульсов, MPT-совместимых электродов и соблюдения правил проведения процедуры МРТ-сканирования согласно требованиям производителя имплантированного ИЭКС.
3.17 номинальный срок службы ИЭКС: Средняя продолжительность ожидаемого срока службы имплантата данной модели ИЭКС. определяемая расчетом исходя из емкости источника питания, обеспечивающей рабочие характеристики ИЭКС в установленных пределах при определенных условиях.
Примечание — Во внимание не принимается никакая причина выхода ИЭКС из строя, не связанная с истощением источника питания
3
3.18 программатор: Внешнее электронное контрольно-программирующее устройство, используемое для осуществления процедуры неинвазивного считывания показателей работы ИЭКС. тестирования и неинвазивного изменения его параметров.
3.19 рефрактерный период (интервал блокировки): Период времени, следующий непосредственно после воспринятого сердечного спонтанного или стимулированного события, во время которого любое воздействие игнорируется ИЭКС и не влияет на изменение каких-либо параметров и алгоритмов стимуляции.
Примечание — Рефрактерный период (РП) состоит из двух частей абсолютного РП и относительного РП Во время абсолютного РП кардиостимулятор не отвечает ни на какие электрические сигналы Во время относительного РП кардиостимулятор воспринимает сигналы и перезапускает рефрактерные периоды В многокамерных режимах стимуляции предсердный РП состоит из интервала АВ-задержки (функция абсолютного РП) и постжелудочкового предсердного рефрактерного периода (ПЖПРП в устройствах с желудочковым таймингом и его аналога в устройствах с предсердным таймингом).
3.20 сенсор: Устройство или компонент, оценивающие потребности пациента в изменении частотного профиля ритма сердца путем мониторирования какого-либо параметра, необходимые для выполнения функции частотной адаптации.
3.21 система удаленного мониторинга: Внешнее электронное контрольно-программирующее устройство коммуникационной поддержки связи лациента/оператора для передачи технической информации с ИЭКС на центральную станцию с целью мониторинга и реакции специалиста на возможные нарушения.
3.22 сопротивление электрода: Состояние сопротивления электрическому току в проводнике-электроде.
3.23 частота стимулирующих импульсов: Число импульсов за определенный период времени.
3.24 чувствительность: Значение в милливольтах (мВ) уровня чувствительности ИЭКС «по требованию». обозначаемое как порог чувствительности к тестовому сигналу отслеживаемой камеры сердца, необходимого для реализации функции «по требованию».
3.25 электрод (провод-электрод): Изолированный проводник, обеспечивающий передачу электрического импульса от имплантируемого генератора импульсов к сердечной мышце и передачу воспринимаемых сигналов от сердца к устройству.
4 Общие требования к содержанию технического задания для государственных закупок медицинских изделий
4.1 ТЗ разрабатывает заказчик. ТЗ определяет предмет размещения заказа на закупку МИ.
4.2 Общие требования к подготовке ТЗ и их оформлению при проведении государственных закупок определены в ГОСТ Р 55719.
4.3 ТЗ на закупку МИ должно содержать требования только к тем характеристикам, которые регламентированы настоящим стандартом. Заказчик вправе не включать в ТЗ несущественные для него требования.
4.4 Заказчик вправе включить в ТЗ на закупку МИ требования, не регламентированные настоящим стандартом, если они не противоречат действующим нормативно-правовым актам Российской Федерации. При этом заказчик обязан однозначно обосновать соответствующие повышенные потребительские. технические и функциональные характеристики.
4.5 Термины, представленные в настоящем стандарте, не являются единственно возможными для применения, поэтому для обеспечения или оценки соответствия требованиям настоящего стандарта необходимо руководствоваться определениями, а не наименованиями терминов, представленными в разделе 3.
4.6 Величины характеристик МИ. указываемые заказчиком в ТЗ. могут иметь конкретные значения или быть определены для интервала: «в диапазоне», «не более», «не менее». Диапазон изменения (настройки, регулировки и т. д.) указанного параметра может быть определен в терминах: «не уже» в том случае, когда требуемый диапазон должен включать указанный интервал, или «не шире» в том случае, когда требуемый диапазон должен находиться внутри указанного интервала.
Примечание — При указании конкретных значений заказчик должен обеспечить отсутствие ограничения конкуренции
4.7 Ответственность за полноту и достаточность ТЗ лежит на заказчике.
ГОСТ P 57492—2017
5 Комплектность имплантируемой системы электрокардиостимуляции
В комплект системы ИЭКС могут входить следующие изделия:
- имплантируемый кардиостимулятор;
- электрод(ы);
- другие комплектующие (программатор, интродьюсеры. кабель для тестирования порогов стимуляции. система удаленного мониторинга пациента и прочие).
Примечание — Для программирования параметров ИЭКС необходимо наличие программирующего устройства (программатора врача), индивидуального для моделей ИЭКС каждого производителя Однако при закупке ИЭКС требования к программатору врача в ТЗ не указывают из-за специфики государственных закупок МИ на расходные материалы и капитальное оборудование
Изделия могут непосредственно входить в состав ИЭКС. а также быть самостоятельными, зарегистрированными МИ. Во втором случае исполнитель обязан обеспечить совместимость поставляемых изделий и их полноценную работу в составе единого МИ.
6 Типы имплантируемых электрокардиостимуляторов
По функционалу и клиническому назначению различают следующие типы ИЭКС:
- однокамерный ИЭКС. ИЭКС с одним электродом для стимуляции и/или восприятия одной камеры сердца (или предсердия, или желудочка). Предсердный канал применяется при наличии у пациента синдрома слабости синусового узла без нарушения АВ-проводимости. Желудочковый канал применяется у пациентов с брадикардитическими нарушениями АВ-проведения, преимущественно на фоне фибрилляции предсердий. Производители для обозначения однокамерных ИЭКС. которые можно использовать либо для изолированной предсердной, либо для желудочковой стимуляции, применяют кодировку SSI/SSI(R);
- двухкамерный ИЭКС. Применяется для обеспечения антибрадикардитической стимуляции у пациентов с синусовым ритмом, имеющих нарушения синоаурикулярной и АВ-проводимости. при отсутствии и/или наличии фибрилляции предсердий, для обеспечения восприятия информации и стимуляции данных сердечных камер с целью поддержания физиологичности синхронной работы правопредсердной и правожелудочковой камер сердца. В ИЭКС. имеющих алгоритмы предсердной антитахикардити-ческой превентивной или лечебной стимуляции, осуществляется дополнительная антитахикардитиче-ская поддержка ритма сердца пациента;
- трехкамерный ИЭКС или устройство сердечной ресинхронизирующей терапии с функцией стимуляции (СРТ). СРТ применяется для обеспечения комплексной терапии сердечной недостаточности путем синхронизации миокарда левого и правого желудочков сердца с правопредсердно-правожелудоч-ковой стимуляционной синхронизацией в единый цикл сокращений сердца на фоне ослабленной фракции выброса сердца и измененного под влиянием основных деструктивных заболеваний миокарда.
7 Режимы работы имплантируемых электрокардиостимуляторов
Режимы стимуляции обозначаются соответственно классификации NASPE/BREG (пересмотр 2001 года). Для обозначения классического кода типа кардиостимулятора рекомендовано использовать последовательность из пяти символов. Первые три символа кодируют основные режимы работы ИЭКС. четвертый отображает наличие функции частотной адаптации, пятый отображает наличие функции многокамерной стимуляции.
В таблице 1 представлены основные режимы работы ИЭКС в трехсимвольной кодировке.
|
Таблица 1— Трехсимвольмая кодировка режимов работы ИЭКС | ||||||||
|
|
Окончание таблицы 1 | ||||||||||||||||
| ||||||||||||||||
|
Примечание — Трехсимвольная кодировка режимов работы ИЭКС является общепринятой Обозначения более сложных режимов различаются у фирм-проиэводителей и могут быть частью торговой марки (например. AAI(R)~DDD(R). SafeR(R). МЖС. Dplus(R), DDD/DDIR. SafeR/DDIR. Dplus/DDIR. DDD-CLS. WI-CLS. DDTAV. DDTV. DDTA, DDalvT и т д ). Поэтому в настоящем стандарте описания требований к функции частотной адаптации и функции многокамерной стимуляции выделены в отдельные требования |
8 Типы электродов для имплантируемых электрокардиостимуляторов
Электроды, предназначенные для использования совместно с ИЭКС в качестве имплантируемых электродов, различают по месту имплантации, способу фиксации и их конфигурации.
По месту имплантации электроды подразделяют на следующие типы:
- эндокардиальные. предназначенные для создания контакта с эндокардом или внутренней поверхностью сердца:
- эпикардиальные. предназначенные для создания контакта с эпикардом или внешней поверхностью сердца:
- левожелудочковые, имплантируемые в левый желудочек, используемые совместно с устройствами ресинхронизирующей терапии и многокамерными устройствами.
По способу фиксации электроды подразделяют на следующие типы:
- с пассивной фиксацией: электроды, закрепляющиеся посредством разрастающейся фиброзной капсулы вокруг дистального конца электрода, прикрепленного к сердечной стенке:
- с активной фиксацией: электроды, дистальная часть которых имеет специальный фиксирующий механизм, проникающий в сердечную стенку (например, ввинчивающаяся спираль, электрод типа «рыболовного крючка», электрод с ретракционным фиксирующим устройством).
По конфигурации полярности электроды подразделяют на следующие типы:
- с монололярной конфигурацией: монополярная конфигурация подразумевает расположение проксимального полюса на корпусе имплантированного генератора импульсов (как для детекции, так и для стимуляции), а отрицательного (дистального) — на дистальном (внутрисердечном) конце эндокар-диального/эликардиального электрода:
- с биполярной конфигурацией: биполярная конфигурация подразумевает расположение обоих полюсов на дистальной (внутрисердечной) части электрода на минимальном расстоянии друг от друга;
- с многополярной конфигурацией (триполярная. квадриполярная и пр ): многополярная конфигурация подразумевает образование системы полюсов, включающей дистальный (внутрисердечный) конец электрода и корпус имплантируемого генератора импульсов.
9 Технические характеристики, указываемые в техническом задании
Перечень нормативных документов, определяющих требования к ИЭКС, представлен в таблице А.1 приложения А.
9.1 В ТЗ могут быть указаны следующие функциональные, технические, качественные и эксплуатационные характеристики:
6