ГОСТ ISO 14971-2021
Изделия медицинские. Применение менеджмента риска к медицинским изделиям
Устанавливает терминологию, принципы и процесс менеджмента риска медицинских изделий, включая программное обеспечение как медицинское изделие и медицинские изделия для диагностики in vitro. Процесс, описанный в настоящем стандарте, предназначен для оказания помощи изготовителям медицинских изделий в идентификации опасностей, связанных с медицинским изделием, в определении и оценивании связанных с ними рисков, управлении этими рисками и мониторинге результативности предпринимаемого управления. Требования настоящего стандарта применимы ко всем стадиям жизненного цикла медицинского изделия. Процесс, описанный в настоящем стандарте, применяется к рискам, присущим медицинским изделиям, таким как риски, связанные с биологической совместимостью, безопасностью данных и систем, электричеством, движущимися частями, излучением и эксплуатационной пригодностью
42 страницы
| Дата введения | 01.10.2022 |
|---|---|
| Актуализация | 01.01.2022 |
Этот ГОСТ находится в:
- Раздел Общероссийский классификатор стандартов
- Раздел Здравоохранение
- Раздел Медицинское оборудование
- Раздел Здравоохранение
Medical devices. Application of risk management to medical devices
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1
стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28
стр. 29

стр. 30
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
ГОСТ
ISO 14971 — 2021
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ
Применение менеджмента риска к медицинским
изделиям
(ISO 14971:2019, ЮТ)
Издание официальное
Москва
Российский институт стандартизации 2021
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Рабочей группой, состоящей из представителей Общества с ограниченной ответственностью «МЕДИТЕСТ» (ООО «МЕДИТЕСТ»). Общества с ограниченной ответственностью «Лаборатория ТОСКАНИ» (ООО «Лаборатория ТОСКАНИ»). Закрытого акционерного общества «НеоКор» (ЗАО «НеоКор») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 22 октября 2021 г № 144-П)
|
За принятие проголосовали: | |||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 27 октября 2021 г. № 1339-ст межгосударственный стандарт ГОСТ ISO 14971-2021 введен в действие в качестве национального стандарта Российской Федерации с 1 октября 2022 г.
5 Настоящий стандарт идентичен международному стандарту ISO 14971:2019 «Изделия медицинские. Применение менеджмента риска к медицинским изделиям» («Medical devices — Application of risk management to medical devices», IDT)
6 ВЗАМЕН ГОСТ ISO 14971-2011
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
©ISO. 2019 © Оформление. ФГБУ «РСТ», 2021
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Примечание — Современное состояние науки и техники воплощает в себе то. что в настоящее время повсеместно принято как передовой опыт в области технологии и медицины. Современное состояние науки и техники не обязательно подразумевает наиболее перспективное с технологической точки зрения решение. Описанное здесь современное состояние науки и техники можно назвать «общепризнанное современное состояние науки и техники».
[ISO/IEC 63:2019. пункт 3.18]
3.29 высшее руководство (top management): Лицо или группа лиц, осуществляющих руководство и управление изготовителем (3.9) на высшем уровне.
[ISO 9000:2015, пункт 3.1.1, изменено — термин «организация» заменен на термин «изготовитель». примечания удалены]
3.30 ошибка применения (use error): Выполнение или невыполнение действия пользователем при применении медицинского изделия (3.10), приводящее к результату, отличающемуся от предусмотренного изготовителем (3.9) или ожидаемого пользователем.
Примечания
1 Ошибка применения включает в себя неспособность пользователя выполнить задачу.
2 Ошибки применения могут быть вызваны несоответствием между характеристиками пользователя, пользовательского интерфейса, задачи или среды применения
3 Пользователи могут знать или не знать, что произошла ошибка применения.
4 Непредвиденная физиологическая реакция пациента сама по себе не считается ошибкой применения.
5 Неправильное функционирование медицинского изделия, которое приводит к непредвиденному результату. не считается ошибкой применения.
[МЭК 62366-1:2015, пункт 3.21. изменено — примечание 6 удалено]
3.31 верификация (verification): Подтверждение на основе предоставления объективных свидетельств (3.11) того, что установленные требования выполнены.
Примечания
1 Объективное свидетельство, необходимое для верификации, может быть результатом проверки или других форм определения, таких как выполнение альтернативных расчетов или изучение документов.
2 Деятельность, осуществляемая в целях верификации, иногда называется процессом квалификации.
3 Термин «верифицировано» используется для обозначения соответствующего статуса.
[ISO/IEC 63:2019, пункт 3.19]
4 Общие требования к менеджменту риска
4.1 Процесс менеджмента риска
Изготовитель должен установить, внедрить, документировать и поддерживать в рабочем состоянии непрерывный процесс:
a) для идентификации опасностей и опасных ситуаций, связанных с медицинским изделием;
b) определения и оценивания сопутствующих рисков:
c) управления этими рисками:
d) мониторинга результативности мер по управлению рисками.
Этот процесс должен применяться на протяжении всего жизненного цикла медицинского изделия и вкпючать в себя следующие элементы:
- анализ риска;
- оценивание риска;
- управление риском;
- деятельность на стадии производства и постпроизводственную деятельность.
Если существует документированный процесс устанавливающий создание продукции в рамках жизненного цикла, то он должен включать соответствующие части процесса менеджмента риска.
Примечания
1 Процессы жизненного цикла описаны, например, в разделе 7 ISO 13485:2016.
2 Документированный процесс в рамках системы менеджмента качества может быть использован для систематического решения вопросов безопасности, в частности для обеспечения возможности ранней идентификации опасностей и опасных ситуаций в сложных медицинских изделиях.
|
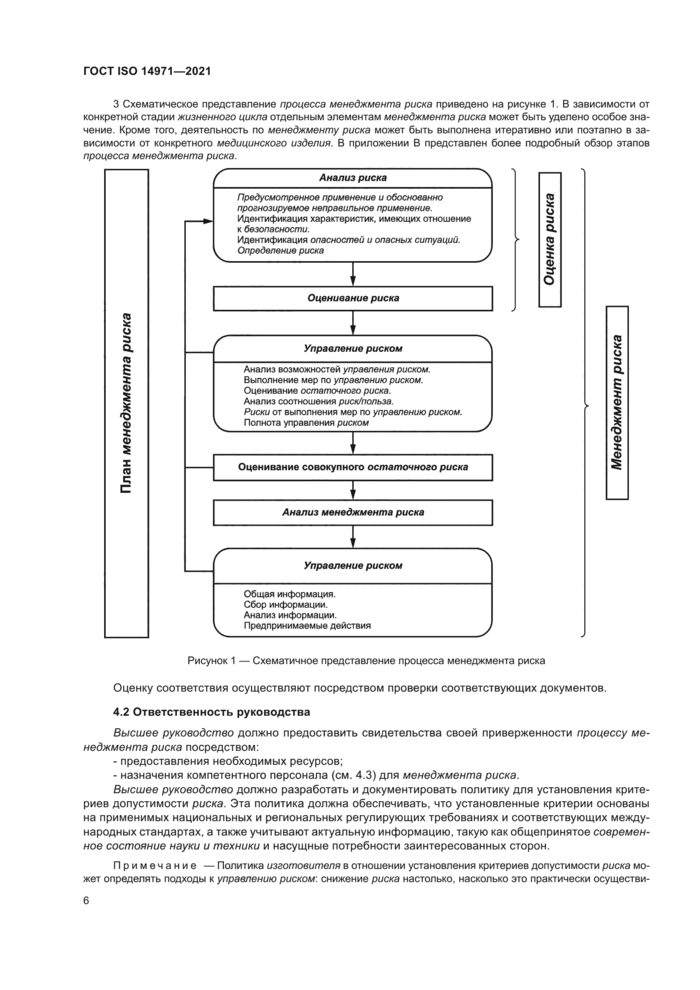
3 Схематическое представление процесса менеджмента риска приведено на рисунке 1. В зависимости от конкретной стадии жизненного цикла отдельным элементам менеджмента риска может быть уделено особое значение. Кроме того, деятельность по менеджменту риска может быть выполнена итеративно или поэтапно в зависимости от конкретного медицинского изделия. В приложении В представлен более подробный обзор этапов процесса менеджмента риска. |
|
Рисунок 1 — Схематичное представление процесса менеджмента риска |
Оценку соответствия осуществляют посредством проверки соответствующих документов.
4.2 Ответственность руководства
Высшее руководство должно предоставить свидетельства своей приверженности процессу менеджмента риска посредством:
- предоставления необходимых ресурсов:
- назначения компетентного персонала (см. 4.3) для менеджмента риска.
Высшее руководство должно разработать и документировать политику для установления критериев допустимости риска. Эта политика должна обеспечивать, что установленные критерии основаны на применимых национальных и региональных регулирующих требованиях и соответствующих международных стандартах, а также учитывают актуальную информацию, такую как общепринятое современное состояние науки и техники и насущные потребности заинтересованных сторон.
Примечание — Политика изголювителя в отношении установления критериев допустимости риска может определять подходы к управлению риском: снижение риска настолько, насколько это практически осуществи-
мо. снижение риска настолько, насколько это практически достижимо, или снижение риска настолько, насколько это возможно без отрицательного влияния на соотношение риск/попьза. Руководство по разработке такой политики приведено в ISO/TR 24971.
Высшее руководство должно проводить анализ пригодности процесса менеджмента риска в запланированные промежутки времени с целью обеспечения постоянной результативности процесса менеджмента риска, а также документировать все принятые решения и предпринятые действия. Если у изготовителя имеется действующая система менеджмента качества, то этот анализ может быть частью анализа системы менеджмента качества.
Примечания
1 Результаты анализа производственной и постпроизводственной информации могут быть использованы в качестве входных данных для анализа пригодности процесса менеджмента риска.
2 Документы, упомянутые в настоящем подразделе, могут быть включены в документированные процедуры системы менеджмента качества изготовителя, и на эти документы можно ссылаться в файле менеджмента риска.
Оценку соответствия осуществляют посредством проверки соответствующих документов.
4.3 Компетентность персонала
Лица, выполняющие задачи менеджмента риска, должны быть компетентными исходя из своего образования, профессиональной подготовки, навыков, опыта и сообразно поставленным перед ними задачам. В соответствующих случаях эти лица должны обладать знаниями и иметь опыт работы с конкретным медицинским изделием (или аналогичными медицинскими изделиями) и его практическим применением. используемыми технологиями или применяемыми методами менеджмента риска. Соответствующие записи должны поддерживаться 8 рабочем состоянии.
Примечание — Задачи менеджмента риска могут быть выполнены представителями нескольких функциональных подразделений, каждый из которых вносит свой вклад за счет имеющихся у них специальных знаний.
Оценку соответствия осуществляют посредством проверки соответствующих записей.
4.4 План менеджмента риска
Деятельность по менеджменту риска должна планироваться. Для конкретного рассматриваемого медицинского изделия изготовитель должен разработать и документировать план менеджмента риска в соответствии с процессом менеджмента риска. План менеджмента риска должен быть частью файла менеджмента риска.
Этот план должен включать, как минимум:
a) область применения запланированной деятельности по менеджменту риска, идентификацию и описание медицинского изделия и стадий жизненного цикла, для которых применим каждый элемент плана;
b) распределение ответственности и полномочий;
c) требования к анализу деятельности по менеджменту риска-,
d) критерии допустимости риска, основанные на политике изготовителя по установлению допустимого риска, включая критерии допустимости рисков, когда вероятность наступления вреда не может быть определена.
Примечание — Критерии допустимости риска имеют важное значение для достижения конечной результативности процесса менеджмента риска. Для каждого плана менеджмента риска изготовитель должен установить критерии допустимости риска, подходящие для конкретного медицинского изделия:
e) метод оценивания совокупного остаточного риска и критерии допустимости совокупного остаточного риска, основанные на политике изготовителя по установлению допустимого риска.
Примечание — Метод оценивания совокупного остаточного риска может включать сбор и анализ данных и литературы по рассматриваемому медицинскому изделию и аналогичным медицинским изделиям, представленным на рынке, и может включать обоснованное решение межфункциональной группы экспертов, обладающих прикладными знаниями и опытом клинического применения:
f) деятельность по верификациям выполнения и результативности выполненных мер по управлению рисками:
g) деятельность, связанная со сбором и анализом соответствующей производственной и постпроизводственной информации.
Примечания
1 Руководство по разработке плана менеджмента риска и определению критериев допустимости риска приведено в ISO/TR 24971.
2 Необязательно все элементы плана менеджмента риска разрабатывать одновременно. План или его элементы можно разрабатывать поэтапно.
Если в течение жизненного цикла медицинского изделия в план вносятся изменения, то записи о таких изменениях должны поддерживаться в файле менеджмента риска.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
4.5 Файл менеджмента риска
Для конкретного рассматриваемого медицинского изделия изготовитель должен создать и поддерживать файл менеджмента риска. В дополнение к требованиям других разделов настоящего стандарта файл менеджмента риска должен обеспечивать возможность прослеживания каждой идентифицированной опасности:
- при анализе риска:
- оценивании риска.
- выполнении и верификации мер по управлению рисками:
- рассмотрении результатов оценивания остаточных рисков.
Примечания
1 Записи и другие документы, входящие в состав файла менеджмента риска, могут являться частью других документов и файлов, требуемых, например, системой менеджмента качества изготовителя. Файл менеджмента риска не обязательно должен физически содержать все записи и другие документы. Однако он должен содержать, по меньшей мере, ссылки или указатели на всю требуемую документацию, чтобы изготовитель мог своевременно собрать информацию, на которую ссылается файл менеджмента риска.
2 Файл менеджмента риска может быть представлен в любой форме или на любом типе носителя.
3 Руководство по формированию файла менеджмента риска для компонентов и изделий, разработанных без применения настоящего стандарта приведено в ISO/TR 24971.
5 Анализ риска
5.1 Процесс анализа риска
Изготовитель должен провести анализ риска для конкретного медицинского изделия, как описано в 5.2—5.5. Выполнение запланированной деятельности по анализу риска и результаты анализа риска должны быть зарегистрированы в файле менеджмента риска.
Примечания
1 Если для аналогичного медицинского изделия уже проведен анализ риска или имеется другая соответствующая информация, то такой анализ или информация могут быть использованы в качестве отправной точки для проведения нового анализа риска. Степень релевантности зависит от различий между медицинскими изделиями и от того, привносят ли они новые опасности или имеют существенные различия в выходных параметрах, функциональных характеристиках или результатах. Степень использования ранее проведенного анализа риска основывается на систематическом оценивании влияния этих различий на возникновение опасных ситуаций.
2 Руководство по отдельным методам анализа риска и методам анализа риска для медицинских изделий для диагностики in vitro приведено в ISO/TR 24971.
В дополнение к записям, требуемым в соответствии с 5.2—5.5, документация о проведении и результатах анализа риска должна включать, как минимум:
a) идентификацию и описание медицинского изделия, анализ которого проводился;
b) идентификацию лица (лиц) и организации, которые проводили анализ риска:
c) область применения и дату проведения анализа риска.
Примечание — Область применения анализа риска может быть предельно широкой (например, разработка нового медицинского изделия, в отношении которого у изготовителя имеется мало опыта или данный опыт
вообще отсутствует) или ограниченной (например, анализ влияния привносимых изменений на выпускаемое медицинское изделие, в отношении которого имеется обширная информация в файлах изготовителя).
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
5.2 Предусмотренное применение и обоснованно прогнозируемое неправильное
применение
Изготовитель должен задокументировать предусмотренное применение рассматриваемого конкретного медицинского изделия.
При документировании предусмотренного применения следует учитывать такую информацию, как предусмотренные медицинские показания, категория пациентов, часть тела или тип ткани, с которой происходит взаимодействие, профиль пользователя, среда применения и принцип действия.
Изготовитель также должен документировать обоснованно прогнозируемое неправильное применение.
Эта документация должна быть включена и поддерживаться в рабочем состоянии в файле менеджмента риска.
Примечания
1 Спецификация эксплуатации (см. IEC 62366-1:2015. пункт 3.23) может быть использована в качестве входных данных при установлении предусмотренного применения.
2 Факторы, которые необходимо учитывать при установлении предусмотренного применения, а также пояснения касательно обоснованно прогнозируемого неправильного применения приведены в ISO/TR 24971.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
5.3 Идентификация характеристик, связанных с безопасностью
Изготовитель должен идентифицировать и документировать качественные и количественные характеристики конкретного рассматриваемого медицинского изделия, которые могут повлиять на безопасность медицинского изделия. Если применимо, изготовитель должен определить предельные значения данных характеристик. Эта документация должна поддерживаться в рабочем состоянии в файле менеджмента риска.
Примечания
1 Перечень вопросов, которые могут служить руководством по идентификации характеристик медицинского изделия, оказывающих влияние на безопасность, приведены в IS(VTR 24971.
2 Характеристики, потеря или ухудшение которых приводит к снижению клинической результативности медицинского изделия, что может привести к недопустимому риску, могут называть основными функциональными характеристиками (см., например. IEC 60601-1).
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
5.4 Идентификация опасностей и опасных ситуаций
Изготовитель должен идентифицировать и документировать известные и предполагаемые опасности. связанные с медицинским изделием, исходя из предусмотренного применения, обоснованно прогнозируемого неправильного применения и характеристик, связанных с безопасностью, как в исправном. так и в неисправном состоянии.
Для каждой идентифицированной опасности изготовитель должен рассматривать обоснованно прогнозируемые последовательности или комбинации событий, которые могут привести к возникновению опасной ситуации, а также идентифицировать и документировать возникающую(ие) в результате этого оласную(ые) ситуацию(и).
Примечания
1 Последовательность событий может быть инициирована на всех стадиях жизненного цикла, например при транспортировании, хранении, монтаже, техническом обслуживании, плановом осмотре, выводе из эксплуатации и утилизации.
2 Объяснение взаимосвязи между опасностью, опасной ситуацией и вредом, включая примеры, приведено в приложении С.
3 Анализ риска включает изучение различных последовательностей или комбинаций событий, связанных с одной опасностью, которые могут привести к различным опасным ситуациям. Каждая опасная ситуация может привести к различным видам вреда.
4 При идентификации ранее не выявленных опасных ситуаций могут быть использованы системные методы анализа риска, подходящие для конкретной ситуации. Руководство по некоторым доступным методам содержится в ISO/TR 24971.
Эта документация должна поддерживаться в файле менеджмента риска.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
5.5 Определение риска
Для каждой идентифицированной опасной ситуации изготовитель должен определить связанный(ые) с ней риск(и), используя имеющиеся информацию или данные. Для опасных ситуаций, по которым вероятность наступления вреда не может быть определена, должен быть составлен перечень возможных последствий для использования при оценивании риска и управлении риском. Результаты этой деятельности должны быть зарегистрированы в файле менеджмента риска.
Система, используемая для качественной или количественной градации вероятности наступления вреда и тяжести вреда, должна быть зарегистрирована в файле менеджмента риска.
Примечания
1 Определение риска включает в себя анализ вероятности возникновения вреда и тяжести вроде В зависимости от области применения только в отношении некоторых элементов процесса определения риска может потребоваться подробное рассмотрение Например, если вред минимален, то может быть достаточным лишь первоначальный анализ опасности и последствий, а если отсутствует достаточный объем информации или данных, то о риске может дать некоторое представление критический анализ вероятности его возникновения. См, также ISO/ TR 24971.
2 Определение риска может быть качественным или количественным. Методы определения риска, в том числе возникающего в результате систематических отказов, приведены в ISO/TR 24971. который также содержит информацию, полезную для определения рисков в отношении медицинских изделий для диагностики in vitro.
3 Информацию или данные для определения рисков можно получить, например, из следующих источников:
- опубликованные стандарты;
- научные или технические исследования;
• данные о применении аналогичных медицинских изделий, включая общедоступные отчеты об инцидентах;
- данные испытаний эксплуатационной пригодности с привлечением типичных пользователей;
- клинические свидетельства:
- результаты соответствующих исследований или моделирования:
- заключение экспертов:
- внешние схемы оценки качества медицинских изделий для диагностики in vitro.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
6 Оценивание риска
Для каждой идентифицированной опасной ситуации изготовитель должен оценить риски, которые уже определены, и установить, является ли риск допустимым, используя критерии допустимости риска, установленные в плане менеджмента риска.
Если риск является допустимым, то относительно этой опасной ситуации, установленные в 7.1—
7.5 требования не применяют (т. е. переход непосредственно к 7.6). и оцененный риск должен быть рассмотрен как остаточный риск.
Если риск является недопустимым, то изготовитель должен осуществить деятельность по управлению риском, установленную в 7.1—7.6.
Результаты этого оценивания риска должны быть зарегистрированы в файле менеджмента риска.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
7 Управление риском
7.1 Анализ возможностей управления риском
Изготовитель должен установить меры по управлению риском, необходимые для снижения рисков до допустимого уровня.
Изготовитель должен использовать один или несколько из следующих вариантов управления риском в указанном порядке приоритетов:
a) изначальный выбор наиболее безопасной конструкции и технологии производства;
b) защитные меры в самом медицинском изделии или принятые в процессах его производства;
c) информация по безопасности и. при необходимости, обучение пользователей.
Примечания
1 Обоснование порядка приоритета при выборе возможностей управления риском приведено в А.2.7.1.
2 Меры по управлению риском могут снизить тяжесть вреда, или вероятность наступления вреда, или вместе и то и другое.
3 Руководство по предоставлению информации по безопасности приведено в ISO/TR 24971.
В рамках анализа возможностей управления риском следует применять соответствующие стандарты.
Примечание — Многие стандарты касаются безопасности конструкции, защитных мер и информации по безопасности медицинских изделий. Кроме того, некоторые стандарты на медицинские изделия содержат интегрированные элементы процесса менеджмента риска (например, электромагнитная совместимость, эксплуатационная пригодность, биологическая оценка). Информация о роли международных стандартов в менеджменте риска приведена в ISO/TR 24971.
Выбранные меры по управлению риском должны быть зарегистрированы в файле менеджмента риска.
Если в ходе анализа возможностей управления риском изготовитель устанавливает, что снижение риска практически неосуществимо, то изготовитель должен провести анализ соотношения риск/ польза для остаточного риска (переход к 7.4).
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
7.2 Выполнение мер по управлению рисками
Изготовитель должен выполнять меры по управлению риском, выбранные в соответствии с 7.1.
Выполнение каждой из мер по управлению риском должно быть верифицировано. Результаты этой верификации должны быть зарегистрированы в файле менеджмента риска.
Примечание — Верификация выполнения может быть частью верификации проектирования и разработки или квалификации процесса в рамках системы менеджмента качества.
Результативность мер по управлению риском должна быть верифицирована. Результаты этой ве-рификации должны быть зарегистрированы в файле менеджмента риска.
Примечания
1 Верификация результативности может быть частью валидации проектирования и разработки в рамках системы менеджмента качества и может включать тестирование с привлечением пользователей. См. А.2.7.2.
2 Верификация результативности может также быть частью верификации проектирования и разработки или квалификации процесса, если установлена взаимосвязь между результативностью в снижении риска и результатом верификации проектирования и разработки или квалификации процесса.
Пример 1 — Верификация проектирования отдельной эксплуатационной характеристики, такой как точность дозирования инжектора для лекарственных средств, может служить верификацией результативности мер по управлению риском, обеспечивающих безопасное дозирование лекарственного средства.
Пример 2 — Квалификация процесса может служить верификацией результативности мер по управлению риском, связанных с риском, вызванным разбросом его результатов.
Примечание — Дополнительная информация о верификации и валидации проектирования и разработки приведена в ISO 13485. Дополнительные указания см. также в ISOfTR 24971.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
7.3 Оцениванио остаточного риска
После выполнения мер по управлению риском изготовитель должен оценить остаточный риск. используя критерии допустимости риска, установленные в плане менеджмента риска. Результаты этого оценивания должны быть зарегистрированы в файле менеджмента риска.
Если остаточный риск на основе этих критериев сочтен недопустимым, необходимо предпринять дальнейшие меры по управлению риском (возврат к 7.1).
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
7.4 Анализ соотношения рискУпольза
Если остаточный риск на основе критериев, установленных в плане менеджмента риска, сочтен недопустимым и дальнейшее управление риском практически невозможно, изготовитель может собрать и проанализировать данные и литературу, чтобы установить, превышает ли польза от предусмотренного применения этот остаточный риск.
Если собранные свидетельства не подтверждают вывод о том, что польза превышает этот остаточный риск, то изготовитель может рассмотреть возможность модификации медицинского изделия или изменения его предусмотренного применения (возврат к подразделу 5.2). В противном случае этот риск остается недопустимым.
Если польза превышает остаточный риск, то следует перейти к 7.5.
Результаты анализа соотношения риск/польза должны быть зарегистрированы в файле менеджмента риска.
Примечание — Руководство по проведению анализа соотношения риск/польза приведено в ISO/TR 24971.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
7.5 Риски, возникающие вследствие выполнения мер по управлению риском
Изготовитель должен анализировать последствия выполнения мер по управлению риском с точки зрения:
- возникновения новых опасностей или опасных ситуаций;
- влияния выполненных мер по управлению риском на уже определенные риски для ранее идентифицированных опасных ситуаций.
Все новые или возросшие риски должны управляться в соответствии с 5.5—7.4.
Результаты этого анализа должны быть зарегистрированы в файле менеджмента риска.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
7.6 Полнота управления риском
Изготовитель должен проводить анализ деятельности по управлению рисками с целью обеспечения рассмотрения всех рисков от всех идентифицированных опасных ситуаций, а также завершенности всей деятельности по управлению риском.
Результаты этого анализа должны быть зарегистрированы в файле менеджмента риска.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
8 Оценивание совокупного остаточного риска
После выполнения и верификации всех мер по управлению риском изготовитель должен оценить совокупный остаточный риск, связанный с медицинским изделием, с учетом влияния всех остаточных рисков по отношению к пользе от предусмотренного применения, используя метод и критерии допустимости совокупного остаточного риска, установленные в плане менеджмента риска (см. 4.4. е).
Если в отношении совокупного остаточного риска принимают решение о его допустимости, то изготовитель должен проинформировать пользователей о существенных остаточных рисках и включить необходимую информацию об этих остаточных рисках в сопроводительную документацию.
Примечания
1 Руководящие указания по предоставлению информации о существенных остаточных рисках приведены в А.2.8.
2 Руководство по оцениванию совокупного остаточного риска и раскрытию информации об остаточных рисках приведено в ISO/TR 24971.
Если в отношении совокупного остаточного риска принимают решение о его недопустимости по отношению к пользе от предусмотренного применения, изготовитель может рассмотреть возможность выполнения дополнительных мер по управлению риском (возврат к 7.1) или модификации медицинского изделия или изменения его предусмотренного применения (возврат к 5.2). В противном случае совокупный остаточный риск остается недопустимым.
Результаты оценивания совокупного остаточного риска должны быть зарегистрированы в файле менеджмента риска.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска и сопроводительной документации.
9 Анализ менеджмента риска
Перед выпуском медицинского изделия в обращение изготовитель должен провести анализ выполнения плана менеджмента риска. Такой анализ должен, по меньшей мере, свидетельствовать о том, что:
- план менеджмента риска выполнен должным образом;
- совокупный остаточный риск является допустимым;
- на стадиях производства и постпроизводства применены соответствующие методы сбора и анализа информации.
Результаты этого анализа должны быть зарегистрированы и поддерживаться в рабочем состоянии в виде отчета по менеджменту риска, а также должны быть включены в файл менеджмента риска.
Ответственность за проведение анализа, установленная в плане менеджмента риска, должна быть возложена на лиц, обладающих соответствующими полномочиями [см. 4.4, Ь].
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
10 Деятельность на стадии производства и постпроизводственнаядеятельность
10.1 Общие требования
Изготовитель должен создать, документировать и поддерживать в рабочем состоянии систему активного сбора и анализа информации, относящейся к медицинскому изделию, на стадиях производства и постпроизводства. При создании этой системы изготовитель должен рассмотреть подходящие методы сбора и обработки информации.
Примечания
1 См также ISO 13485:2016, подразделы 7.3.3, 8.2.1,8.4 и 8.5.
2 Руководство по производственной и постпроизводственной деятельности приведено в ISO/TR 24971.
Оценку соответствия осуществляют посредством проверки соответствующих документов.
10.2 Сбор информации
Изготовитель, где это применимо, должен осуществлять сбор:
a) информации, создаваемой в процессе производства и мониторинга производственных процессов.
b) информации, получаемой от пользователя;
c) информации, получаемой от лиц. ответственных за установку, применение и техническое обслуживание медицинского изделия;
d) информации, создаваемой цепочкой поставок;
e) общедоступной информации;
f) информации, относящейся к общепризнанному современному состоянию науки и техники.
Примечание — Информация, относящаяся к общепризнанному современному состоянию науки и техники. может включать новые или измененные стандарты, опубликованные валидные данные, относящиеся к применению рассматриваемого медицинского изделия, наличие альтернативных медицинских изделий и/или методов лечения, а также другую информацию (см. ISO/TR 24971).
Изготовитель также должен рассмотреть необходимость активного сбора и анализа общедоступной информации об аналогичных медицинских изделиях и другой аналогичной продукции, представленных на рынке.
Оценку соответствия осуществляют посредством проверки соответствующих документов.
10.3 Анализ информации
Изготовитель должен провести анализ собранной информации на предмет ее возможного влияния на безопасность, особенно если:
- появились ранее неопознанные опасности или опасные ситуации;
- уже определенный ранее риск, возникающий в результате опасной ситуации, перестал быть допустимым;
- совокупный остаточный риск перестал быть допустимым по отношению к попьзе от предусмотренного применения;
- изменилось общепризнанное соеременное состояние науки и техники.
Результаты анализа должны быть зарегистрированы в файле менеджмента риска.
Оценку соответствия осуществляют посредством проверки файла менеджмента риска.
10.4 Предпринимаемые действия
Если установлено, что собранная информация связана с безопасностью, то должны быть предприняты нижеприведенные действия.
1) В отношении рассматриваемого медицинского изделия:
- изготовитель должен провести анализ файла менеджмента риска и установить, существует ли необходимость в проведении переоценки рисков и/или оценки новых рисков;
- если остаточный риск больше не является допустимым, то влияние ранее выполненных мер по управлению риском должно быть оценено и рассматриваться в качестве входных данных для модификации медицинского изделия:
• изготовитель должен рассмотреть необходимость принятия действий в отношении медицинских изделий, выпущенных в обращение:
- все решения и действия должны быть зарегистрированы в файле менеджмента риска.
2) В отношении процесса менеджмента риска:
- изготовитель должен оценить воздействие на ранее выполненную деятельность по менеджменту риска.
- результаты этого оценивания должны быть рассмотрены высшим руководством в качестве входных данных для анализа пригодности процесса менеджмента риска (см. 4.2).
Примечание — Некоторые аспекты постпроизводственного мониторинга являются предметом национального регулирования. В таких случаях могут потребоваться дополнительные меры (например, перспективное постпроизводственное оценивание).
Оценку соответствия осуществляют посредством проверки файла менеджмента риска и других соответствующих документов.
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения................................................................1
4 Общие требования к менеджменту риска.................................................5
4.1 Процесс менеджмента риска........................................................5
4.2 Ответственность руководства.......................................................6
4.3 Компетентность персонала..........................................................7
4.4 План менеджмента риска...........................................................7
4.5 Файл менеджмента риска...........................................................8
5 Анализ риска ........................................................................8
5.1 Процесс анализа риска ............................................................8
5.2 Предусмотренное применение и обоснованно прогнозируемое неправильное применение ... .9
5.3 Идентификация характеристик, связанных с безопасностью..............................9
5.4 Идентификация опасностей и опасных ситуаций .......................................9
5.5 Определение риска ..............................................................10
6 Оценивание риска...................................................................10
7 Управление риском..................................................................10
7.1 Анализ возможностей управления риском............................................10
7.2 Выполнение мер по управлению рисками ............................................11
7.3 Оценивание остаточного риска.....................................................12
7.4 Анализ соотношения риск/польза...................................................12
7.5 Риски, возникающие вследствие выполнения мер по управлению риском..................12
7.6 Полнота управления риском .......................................................12
8 Оценивание совокупного остаточного риска..............................................12
9 Анализ менеджмента риска ...........................................................13
10 Деятельность на стадии производства и постпроизводственная деятельность ................13
10.1 Общие требования..............................................................13
10.2 Сбор информации ..............................................................13
10.3 Анализ информации.............................................................13
10.4 Предпринимаемые действия......................................................14
Приложение А (справочное) Обоснование требований ......................................15
Приложение В (справочное) Процесс менеджмента риска для медицинских изделий .............22
Приложение С (справочное) Основные концепции риска.....................................27
Библиография........................................................................33
Приложение А (справочное)
Обоснование требований
А.1 Общие сведения
Технический комитет ISO 210 и Подкомитет IEC 62А «Применение менеджмента риска к медицинским изделиям» разработали данное приложение, для того чтобы документировать обоснованность требований, содержащихся в настоящем стандарте. Лица, которые будут вносить изменения, могут использовать данное приложение наряду с опытом, накопленным при применении настоящего стандарта, чтобы сделать стандарт более полезным для изготовителей, регулирующих органов и поставщиков медицинских услуг.
Технический комитет ИСО 210 и Подкомитет МЭК 62А приняли решение объединить свои усилия, направленные на менеджмент риска, и сформировать общую рабочую группу (ОРГ) 1. задача которой состоит в разработке стандарта по применению менеджмента риска к медицинским изделиям. В начале обсуждения этого международного стандарта по менеджменту риска возникла необходимость рассмотреть важнейшие аспекты менеджмента риска, такие как процесс оценивания риска, а также баланса рисков и пользы медицинских изделий. Изготовители, регулирующие органы и поставщики медицинских услуг признали, что «абсолютная безопасность» медицинских изделий недостижима. Кроме того, риски, связанные с растущим разнообразием медицинских изделий и способов их применения, не могут быть полностью устранены с помощью стандартов по безопасности продукции. Признание данных фактов и вытекающая из этого необходимость управления рисками, связанными с медицинскими изделиями на протяжении всего их жизненного цикла, привели к принятию решения о разработке ISO 14971 в качестве результативного инструмента повышения безопасности медицинских изделий. Первое издание настоящего стандарта опубликовано в 2000 г.
Второе издание ISO 14971 разработано и опубликовано в 2007 г. с целью удовлетворения потребности в дополнительных руководящих указаниях по его применению и разъяснения взаимосвязи между опасностями и опасными ситуациями. В нормативный раздел внесены незначительные изменения, например: включено требование о планировании постпроизводственного мониторинга, из отчета по менеджменту риска исключено требование о прослеживаемости.
Систематический обзор, проведенный в 2010 г., выявил потребность в дополнительном руководстве по нескольким конкретным темам. Было решено разработать технический отчет ISO/TR 24971. поскольку даже небольшое обновление руководства потребовало бы пересмотра стандарта. Первое издание этого отчета опубликовано в 2013 г.
Настоящий стандарт разработан в целях уточнения обязательных требований и их более детального описания. в частности: положений об оценивании совокупного остаточного риска, об анализе и отчете по менеджменту риска, а также о производственной и постпроизводственной информации. Эти разъяснения сочтены необходимыми в связи с запросами о разъяснении в ходе систематического обзора ISO 14971 в 2016 г. а также с учетом более строгих требований со стороны регулирующих органов. Больше внимания уделено вопросам пользы. которая ожидается от применения медицинского изделия, а также балансу между пользой и (совокупными) остаточными рисками. Разъяснено, что описанный в настоящем стандарте процесс может применяться ко всем видам опасностей и рисков, связанных с медицинским изделием, например: к биологической совместимости, безопасности данных и систем, электрическим и подвижным частям, излучению или эксплуатационной пригодности. Несколько справочных приложений перенесены из настоящего стандарта в ISO/TR 24971. которое было пересмотрено параллельно. Это позволит проводить более частое обновление руководства независимо от стандарта.
А.2 Обоснование требований конкретных разделов и подразделов
А.2.1 Область применения
Как поясняется во введении к настоящему стандарту, существует необходимость в стандарте по менеджменту риска, применимому к жизненному циклу медицинских изделий. Программное обеспечение как медицинское изделие и медицинские изделия для диагностики in vitro специально упоминаются в области применения с целью подчеркнуть, что невзирая на различия в регулировании настоящий стандарт распространяется на такие изделия.
Риски могут присутствовать на протяжении всего жизненного цикла медицинского изделия, при этом риски. которые проявляются на одной стадии жизненного цикла, могут управляться действиями, предпринимаемыми на другой стадии жизненного цикла. По этой причине настоящий стандарт должен быть применим ко всем стадиям жизненного цикла, т. е. настоящий стандарт предписывает изготовителям применять принципы менеджмента риска к медицинскому изделию с момента его первоначального замысла до окончательного вывода из эксплуатации и утилизации.
Процесс, описанный в ISO 14971. может быть применен к опасностям и рискам, связанным с медицинским изделием. Риски, связанные с безопасностью данных и систем, специально упоминаются в области применения настоящего стандарта с целью избежать заблуждения относительно того, что для осуществления менеджмента безопасности медицинского изделия в отношении таких рисков требуется отдельный процесс. Это не исключает
Введение
Требования, установленные в настоящем стандарте, обеспечивают изготовителям основу, в рамках которой знания, опыт и обоснованные решения систематически применяются для управления рисками, связанными с применением медицинских изделий.
Настоящий стандарт разработан специально для изготовителей медицинских изделий на основе тех принципов менеджмента риска, которые развивались на протяжении многих лет. Настоящий стандарт может применяться в качестве руководства при разработке и поддержании процесса менеджмента риска касательно иной продукции, которая в определенных юрисдикциях не является медицинским изделием, а также касательно поставщиков и других сторон, участвующих в жизненном цикле медицинских изделий.
В настоящем стандарте рассмотрены процессы менеджмента рисков, которые связаны с медицинскими изделиями. Риски могут быть связаны не только с причинением вреда пациенту, но и пользователю. а также другим лицам. Риски также могут быть связаны с повреждением имущества (например, объектов, данных, другого оборудования) или причинением вреда окружающей среде.
Менеджмент риска — это сложная тема, поскольку каждая заинтересованная сторона может по-разному оценивать допустимость рисков по отношению к ожидаемой пользе. Концепции менеджмента риска особенно важны в отношении медицинских изделий из-за большого количества заинтересованных сторон, включая практикующих врачей, организации, оказывающие медицинскую помощь, правительства. промышленные предприятия, пациентов и представителей общественности.
Общепризнанно, что понятие риска имеет два ключевых компонента:
- вероятность причинения вреда, и
- последствия этого вреда, то есть насколько велика может быть его тяжесть.
Все заинтересованные стороны должны понимать, что применение медицинского изделия сопряжено с присущей ему степенью риска даже после того, как риски снижены до допустимого уровня. Общепризнанно, что в контексте клинической процедуры всегда сохраняются некоторые остаточные риски. На допустимость риска для заинтересованной стороны влияют ключевые составляющие, перечисленные выше, а также восприятие заинтересованной стороной риска и пользы, которое может варьироваться в зависимости от культурной, социально-экономической среды и образовательного уровня заинтересованного общества, а также от фактического и предполагаемого состояния здоровья пациента. Особенность восприятия риска учитывает другие факторы, например: является ли подверженность опасности или опасной ситуации вынужденной, предотвратимой, исходящей из антропогенного источника, вызванной халатностью, возникающей вследствие недостаточно изученных обстоятельств или направленной на уязвимую группу внутри общества.
Являясь одной из заинтересованных сторон, изготовитель снижает риски и принимает решения, касающиеся безопасности медицинского изделия, в том числе о допустимости остаточных рисков. Изготовитель принимает во внимание общепризнанное современное состояние науки и техники, чтобы определить пригодность медицинского изделия для его выпуска в обращение в соответствии с предусмотренным применением. Настоящий стандарт устанавливает процесс, посредством которого изготовитель медицинского изделия может идентифицировать опасности, связанные с медицинским изделием, определять и оценивать риски, связанные с этими опасностями, управлять рисками и осуществлять мониторинг результативности данного управления на протяжении всего жизненного цикла медицинского изделия.
Согласно решению о применении медицинского изделия в контексте конкретной клинической процедуры требуется, чтобы остаточные риски были сбалансированы с ожидаемой пользой от процедуры, что выходит за рамки настоящего стандарта и учитывает предусмотренное применение, обстоятельства применения, функциональные характеристики и риски, связанные с медицинским изделием. а также риски и пользу при проведении клинической процедуры. Некоторые из этих решений могут быть приняты только квалифицированным врачом, владеющим информацией о состоянии здоровья конкретного пациента.
Для каждого конкретного медицинского изделия другие стандарты или действующее регулирование могут потребовать применения конкретных методов менеджмента риска. В подобных случаях необходимо также соблюдать требования, изложенные в этих документах.
Вербальные формы, используемые в настоящем стандарте, соответствуют применению, описанному в пункте 7 Директив ISO/IEC, часть 2:2018. Для целей настоящего стандарта вспомогательный глагол:
- «должен» означает, что соответствие требованиям или испытаниям обязательно для соответствия настоящему стандарту;
- «следует» означает, что соответствие требованиям или испытаниям настоящего стандарта рекомендовано. но не обязательно для соответствия требованиям настоящего стандарта;
- «могло бы» использован для описания разрешения (например, допустимого способа достижения соответствия требованию или испытанию);
- «может» — для выражения возможности и способности; и
- «обязан» — для выражения внешнего ограничения, которое не является требованием настоящего стандарта.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ Применение менеджмента риска к медицинским изделиям
Medical devices. Application of risk management to medical devices
Дата введения — 2022—10—01
1 Область применения
Настоящий стандарт устанавливает терминологию, принципы и процесс менеджмента риска медицинских изделий, включая программное обеспечение как медицинское изделие и медицинские изделия для диагностики in vitro. Процесс, описанный в настоящем стандарте, предназначен для оказания помощи изготовителям медицинских изделий в идентификации опасностей, связанных с медицинским изделием, в определении и оценивании связанных с ними рисков, управлении этими рисками и мониторинге результативности предпринимаемого управления.
Требования настоящего стандарта применимы ко всем стадиям жизненного цикла медицинского изделия. Процесс, описанный в настоящем стандарте, применяется к рискам, присущим медицинским изделиям, таким как риски, связанные с биологической совместимостью, безопасностью данных и систем, электричеством, движущимися частями, излучением и эксплуатационной пригодностью.
Процесс, описанный в настоящем стандарте, может также применяться к продукции, которая в определенных юрисдикциях не является медицинскими изделиями, а также может быть применен другими участниками жизненного цикла медицинских изделий.
Настоящий стандарт не применим:
- к решениям о применении медицинского изделия в контексте конкретной клинической процедуры.
- менеджменту коммерческих рисков.
Настоящий стандарт требует от изготовителей установить объективные критерии допустимости риска, но не устанавливает уровни допустимости риска.
Менеджмент риска может быть составной частью системы менеджмента качества. Однако настоящий стандарт не требует наличия у изготовителя системы менеджмента качества.
Примечание — Руководство по применению настоящего стандарта приведено в ISO/TR 24971.
2 Нормативные ссылки
Настоящий стандарт не содержит нормативных ссылок.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями. ISO и IEC поддерживают терминологические базы данных для применения в целях стандартизации по следующим адресам:
- платформа просмотра сетевых ресурсов ISO, доступная по адресу: http://www.iso.org/obp
- Электропедия IEC. доступная по адресу: http://www.electropedia.org/
3.1 сопроводительная документация (accompanying documentation): Документы, прилагаемые к медицинскому изделию (3.10) и содержащие информацию для пользователя или лиц, ответственных за
Издание официальное
установку, применение, техническое обслуживание, вывод из эксплуатации и утилизацию медицинского изделия (3.10), особенно в отношении безопасного применения.
Примечания
1 Сопроводительная документация может состоять из инструкции по эксплуатации, технического описания, руководства по установке, краткого справочного руководства и т. д.
2 Сопроводительная документация не обязательно является письменным или печатным документом и может включать звуковые, визуальные или тактильные материалы и различные типы носителей информации.
3.2 польза (benefit): Положительное влияние или предпочтительный результат применения медицинского изделия (3.10) на здоровье человека или положительное влияние на ведение пациента или общественное здоровье.
Примечание — Польза может включать положительное влияние на клинический исход, качество жизни пациента, результаты, связанные с точным определением диагноза, положительное влияние применения изделий для диагностики на клинические результаты или положительное влияние на общественное здоровье.
3.3 вред (harm): Травма или ущерб здоровью людей, а также ущерб имуществу или окружающей среде.
[ISO/IEC 63:2019, пункт 3.1)
3.4 опасность (hazard): Потенциальный источник вреда (3.3).
[ISO/IEC 63:2019, пункт 3.2)
3.5 опасная ситуация (hazardous situation): Обстоятельства, при которых люди, имущество или окружающая среда подвергаются одной или нескольким опасностям (3.4).
Примечание — Для понимания взаимосвязи между опасностью и опасной ситуацией см. приложение С.
[ISO/IEC 63:2019. пункт 3.3, изменено — добавлено примечание 1)
3.6 предусмотренное применение; предусмотренное назначение (intended use/intended purpose): Применение, для которого продукция, процесс (3.14) или услуга предусмотрены в соответствии со спецификациями, инструкциями и информацией, предоставляемыми изготовителем (3.9).
Примечание — Предусмотренные медицинские показания, категория пациентов, часть тела или тип ткани, с которой происходит взаимодействие, профиль пользователя, среда применения и принцип действия являются типичными элементами предусмотренного применения.
[ISO/IEC 63:2019. пункт 3.4)
3.7 медицинское изделие для диагностики in vitro (in vitro diagnostic medical device. IVD): Изделие. в том числе реагенты, калибраторы, контрольные материалы, емкости для проб, программное обеспечение и связанные с ними инструменты, аппараты ипи другие устройства, которое, вне зависимости от использования его отдельно или в сочетании, предназначено изготовителем (3.9) для in vitro исследования полученных из тела человека проб исключительно или главным образом для предоставления информации в цепях диагностики, мониторинга или оценки совместимости.
[ISO 18113-1:2009, пункт 3.27, изменено — примечание удалено)
3.8 жизненный цикл (life cycle): Все стадии существования медицинского изделия (3.10) от первоначальной концепции до вывода из эксплуатации и утилизации.
[ISO/IEC 63:2019. пункт 3.5)
3.9 изготовитель (manufacturer): Любое физическое или юридическое лицо, ответственное за проектирование и/или производство медицинского изделия (3.10) с целью выпустить в обращение медицинское изделие (3.10) под его собственным именем независимо от того, спроектировано и/или произведено такое медицинское изделие (3.10) этим лицом или по его поручению другим(и) лицом(ами).
Примечания
1 Физическое или юридическое лицо несет конечную юридическую ответственность за обеспечение выполнения применимых регулирующих требований стран или юрисдикций в отношении медицинских изделий, для реализации в которых они предназначены, если только иное не установлено специальными требованиями регулирующего органа (РО) в пределах его юрисдикции.
2 Ответственность изготовителя описана в руководящих документах GHTF. Эта ответственность включает в себя как ответственность по выполнению требований до выпуска в обращение, так и послепродажных требований. таких как сообщения о неблагоприятных событиях и уведомления о корректирующих действиях.
3 «Проектирование и/или производство)* могут включать в себя разработку спецификаций, продукции, производство. изготовление, сборку, обработку, упаковку, переупаковку, маркировку, перемаркировку, стерилизацию.
монтаж или восстановление медицинского изделия, а также объединение изделий, возможно с другой продукцией, в единый набор для медицинского назначения.
4 Лицо, осуществляющее в соответствии с инструкцией по применению сборку и регулировку медицинского изделия, выпущенного в обращение иным лицом и предназначенного для применения конкретным пациентом, не является изготовителем, если сборка и регулировка не изменяют предусмотренного применения медицинского изделия
5 Лицо, изменяющее предусмотренное назначение медицинского изделия или модифицирующее медицинское изделие без согласия изготовителя для выпуска изделия под собственным именем, следует рассматривать как изготовителя модифицированного медицинского изделия.
6 Уполномоченный представитель, дистрибьютор или импортер, который только добавляет свой адрес и контактные данные на медицинское изделие или на его упаковку, без удаления или изменения оригинальной маркировки. не является изготовителем.
7 Если принадлежности попадают под регулирующие требования к медицинскому изделию, лица, ответственные за проектирование и/или производство таких принадлежностей, являются изготовителями.
[ISO/IEC 63:2019. пункт 3.6]
3.10 медицинское изделие (medical device): Инструмент, аппарат, прибор, устройство, оборудование. имплантат, in vitro реагент, программное обеспечение, материал или иные подобные или связанные с ними изделия, предназначенные изготовителем для применения к человеку по отдельности или в комбинации для одной или нескольких конкретных медицинских целей:
- диагностики, профилактики, мониторинга, лечения или облегчения заболеваний;
- диагностики, мониторинга, лечения, облегчения или компенсации последствий травмы;
- исследования, замещения или изменения анатомического строения или физиологических процессов;
- жизнеобеспечения или поддержания жизненных функций;
- управления зачатием;
-дезинфекции медицинских изделий (3.10);
- получения информации посредством исследования in vitro проб, взятых из тела человека.
а также не достигающие своего первичного предназначенного воздействия на организм человека за счет фармакологических, иммунологических или метаболических средств, но функции которых могут поддерживаться такими средствами.
Примечание — Некоторая продукция в отдельных юрисдикциях может рассматриваться как медицинские изделия, но не являться таковой в других, например:
- дезинфицирующие вещества;
- вспомогательные средства для людей с ограниченными возможностями;
- изделия, содержащие ткани животных и/или человека;
- изделия для экстракорпорального оплодотворения или репродуктивных технологий.
(ISO/IEC 63:2019. пункт 3.7]
3.11 объективное свидетельство (objective evidence): Данные, подтверждающие существование или истинность чего-либо.
Примечание — Объективное свидетельство может быть получено посредством наблюдения, измерения. испытания или другими способами.
(ISO 9000: 2015. пункт 3.8.3, изменено — примечание 2 удалено]
3.12 постпроизводство (post-production): Часть жизненного цикла (3.8) медицинского изделия (3.10) после завершения проектирования и изготовления медицинского изделия (3.10).
Пример — Транспортирование, хранение, монтаж, применение продукции, техническое обслуживание, ремонт, изменение продукции, вывод из эксплуатации и утилизация.
3.13 процедура (procedure): Установленный способ осуществления деятельности или процесса (3.14).
Примечание — Процедуры могут быть документированными или недокументированными.
(ISO 9000:2015. пункт 3.4.5]
3.14 процесс (process): Совокупность взаимосвязанных или взаимодействующих видов деятельности. использующих входные данные для достижения намеченного результата.
Примечания
1 Будет ли «намеченный результат» процесса называться выходными данными, продукцией или услугой, зависит от исходного контекста.
2 Входные данные для процесса, как правило, являются выходными данными других процессов, а выходные данные процесса, как правило, являются входными данными для других процессов.
3 Процессом также можно назвать два взаимосвязанных и взаимодействующих последовательных процесса или более.
[ISO 9000:2015, пункт 3.4.1, изменено — примечания 4, 5 и 6 удалены)
3.15 обоснованно прогнозируемое неправильное применение (reasonably foreseeable misuse): Применение продукции или системы способом, не предусмотренным изготовителем (3.9), но который может быть результатом легко предсказуемого поведения человека.
Примечания
1 Легко предсказуемое поведение человека включает в себя поведение всех типов пользователей, как профессиональных. так и непрофессиональных.
2 Обоснованно прогнозируемое неправильное применение может быть преднамеренным или непреднамеренным.
[ISO/IEC 63:2019, пункт 3.8)
3.16 запись (record): Документ, предоставляющий свидетельства осуществленной деятельности или достигнутых результатов.
Примечания
1 Записи могут применяться, например, для формирования прослеживаемости и предоставления свидетельств верификации, корректирующих и предупреждающих действий.
2 Как правило, записи не должны находиться под управлением изменениями.
[ISO 9000:2015, пункт 3.8.10)
3.17 остаточный риск (residual risk): Риск, остающийся после выполнения мер по управлению риском (3.21).
[ISO/IEC 63:2019, пункт 3.9)
3.18 риск (risk): Сочетание вероятности причинения вреда (3.3) и тяжести (3.27) этого вреда (3.3).
[ISO/IEC 63:2019, пункт 3.10, изменено — примечание 1 удалено)
3.19 анализ риска (risk analysis): Систематическое использование имеющейся информации для идентификации опасностей (3.4) и определения риска (3.18).
[ISO/IEC 63:2019, пункт 3.11)
3.20 оценка риска (risk assessment): Полный процесс (3.14) анализа риска (3.19) и оценивания риска (3.20).
[ISO/IEC 51:2014, пункт 3.11)
3.21 управление риском (risk control): Процесс (3.14), в ходе которого принимают решения и выполняют меры, посредством которых риски (3.18) снижаются до установленных уровней или поддерживаются в пределах установленных уровней.
[ISO/IEC 63:2019, пункт 3.12)
3.22 определение риска (risk estimation): Процесс (3.14). используемый для присвоения значений вероятности наступления вреда (3.3) и тяжести (3.27) этого вреда.
[ISO/IEC 63:2019. пункт 3.13)
3.23 оценивание риска (risk evaluation): Процесс (3.14) сравнения риска (3.18). который уже определен, с установленными критериями риска (3.18) для определения допустимости риска (3.18).
[ISO/IEC 63:2019, пункт 3.14)
3.24 менеджмент риска (risk management): Систематическое применение политики, процедур (3.13) и практических методов менеджмента для решения задач анализа, оценивания, управления и мониторинга риска (3.18).
[ISO/IEC 63: 2019, пункт 3.15)
3.25 файл менеджмента риска (risk management file): Совокупность записей (3.16) и других документов. создаваемых в процессе менеджмента риска (3.24).
3.26 безопасность (safety): Отсутствие недопустимого риска (3.18).
[ISO/IEC 63:2019, пункт 3.10)
3.27 тяжесть (severity): Мера возможных последствий опасности (3.4).
[ISO/IEC 63:2019, пункт 3.17)
3.28 современное состояние науки и техники (state of the art): Стадия технического потенциала, разработанного на данный момент времени в отношении продукции, процессов (3.14) и услуг на основании соответствующих консолидированных выводов науки, техники и опыта.