ГОСТ ISO 10993-4-2020
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4. Исследования изделий, взаимодействующих с кровью
Распространяется на медицинские изделия (МИ), включая материалы, предполагаемые для изготовления МИ, взаимодействующие с кровью, и устанавливает общие требования к оценке их биологического действия. Настоящий стандарт устанавливает общие требования к проведению оценки биологического действия МИ и не устанавливает методы испытаний МИ конкретных видов
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12
стр. 13
стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25
стр. 26

стр. 27

стр. 28

стр. 29
стр. 30
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТISO 10993-4— 2020Изделия медицинскиеОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 4Исследования изделий, взаимодействующих с кровью
Изделия медицинскиеОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 4Исследования изделий, взаимодействующих с кровью
(ISO 10993-4:2017, Biological evaluation of medical devices — Part 4: Selection of tests for interactions with blood, IDT)
Издание официальное
Сшщчш«ф1чи
20»
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Институт медико-биологических исследований и технологий (АНО «ИМБИИТ») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 31 августа 2020 г. No 132-П)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3164) 004 - 97 |
Код страны no МК (ИСО 3166) 004-97 |
Сокращенное наименование национального органа по стандартизации |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджихстандарт |
|
Узбекистан |
UZ |
Узстандарг |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 16 октября 2020 г. No 866-ст межгосударственный стандарт ГОСТ ISO 10993-4-2020 введен в действие в качестве национального стандарта Российской Федерации с 1 марта 2021 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10993-4:2017 «Оценка биологического действия медицинских изделий. Часть 4. Исследование изделий, взаимодействующих с кровью» («Biological evaluation of medical devices — Part 4: Selection of tests for interactions with blood». IDT).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВЗАМЕН ГОСТ ISO 10993-4-2011
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге о Межгосударственные стандарты»
|
И |
© ISO, 2017 — Все права сохраняются © Стандартинформ. оформление. 2020
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
значения температуры, данные о стерильности, виде и концентрации антикоагулянта (см. 6.1.12). состояние кровотока. Например, при исследовании МИ. у которых возможно вычислить значение площади поверхности (например, сосудистый стент), определяют необходимый объем жидкости для тест-системы in vitro в зависимости от исследуемой площади поверхности МИ. в см2, по отношению к объему жидкости для тест-системы in vitro. Для определения количества пробы, используемой в тест-системе, у МИ сложной геометрии или у которых невозможно вычислить значение площади поверхности (например. дисперсия частиц поливинилового спирта (ЛВС), используемого в качестве эмболов) — определяют массу вместо площади поверхности.
Исследования проводят только на той части МИ. которая контактирует с кровью прямо или косвенно. Методы исследования и регистрируемые параметры выбирают с учетом последних научных достижений в данной области.
Природу и концентрацию антикоагулянта выбирают в зависимости от конкретного применения МИ и вида проводимого метода. Исследования проводят с учетом информации о природе и концентрации выбранного антикоагулянта с целью прогнозирования возможности получения положительных и отрицательных ответов. Информация для испытаний на животных представлена в 6.1.6 и С.2, для исследований in vivo и ox vivo — в 6.1.12. для исследований in vitro — в 6.3.1. для катетеров и проводников — в А.З.
Результаты исследования гемосовместимости МИ зависят от площади поверхности МИ. контактирующей с кровью, поэтому такие методы (например, активация системы комплемента) не применяют к изделиям непрямого контакта.
6.1.3 При проведении исследований используют контроли (положительные и отрицательные), кроме тех случаев, когда их исключение обосновано. Там. где это возможно, исследование должно включать соответствующее изделие-аналог, используемое в клинической практике (т. о. LMCD). или хорошо охарактеризованный материал (6].
Контроль должен включать отрицательные и положительные эталонные материалы. Все исследуемые материалы и LMCD должны соответствовать всем требованиям контроля качества и гарантий качества изготовителя и испытательной лаборатории. Для всех испытанных МИ в протоколе должны быть указаны наименование и адрес изготовителя, класс и тип МИ.
6.1.4 При исследовании материалов, предполагаемых для изготовления компонентов МИ. допускается проводить скрининг-анализ. При этом следует учитывать, что предварительные испытания не могут заменить исследования целого стерильного МИ или его компонента в условиях, которые имитируют или ужесточают условия их клинического применения.
Примечание 1 — Следует учитывать, что изменения в производственном процессе (включая использование производственных приспособлений), которые могут изменять свойства поверхности или химический состав целого МИ. также могут повлиять на его гемосовместимость.
Примечание 2 — Если старение может повлиять на свойства готового МИ (например, свойства биологически активных покрытий, содержащих гепарин, могут изменяться с течением времени), то проводят испытания образцов после их старения.
6.1.5 Испытания, которые не имитируют условия эксплуатации МИ. не могут точно прогнозировать характер его взаимодействий с кровью, которые могут произойти при применении по назначению. Точность и достоверность результатов краткосрочных (скрининговых) исследований in vitro или ox vivo для прогнозирования гемосовместимости МИ считают более высокими, если при применении по назначению его используют не для длительного или постоянного, а для кратковременного контакта с кровью.
Примечание — Упрощенные испытания материалов, предполагаемых для изготовления компонентов МИ (например, при структурном и функциональном химическом модифицировании поверхности), являются важным этапом в идентификации, оптимизации и выборе материала изделия.
6.1.6 При испытаниях на животных МИ. предполагаемое к применению ex vivo (внешний контакт), исследуют ex vivo; МИ. предполагаемое к применению in vivo (имплантаты), исследуют in vivo на экспериментальной модели, имитирующей наиболее точно возможные условия клинического применения. Протокол должен содержать подробное описание вида исследования (см. 6.2.1) и метода испытаний.
а Для изделий прямого и непрямого контакта необходимость исследования гемосовместимости следует рассматривать. основываясь на надлежащем анализе риска, включая предшествующие исследования гемосов-местимости, клинические данные, данные по зкстрагируемостт'выщелачиваемости и/или информацию по характеристикам поверхности. Например, для изделий с прямым контактом исследование экстрагируемости/выщела-чиваемости может быть недостаточным, если морфология поверхности изменена, даже при неизменной химии экстрагируемости'выщелачиваемости (см. ISO 10993-1).
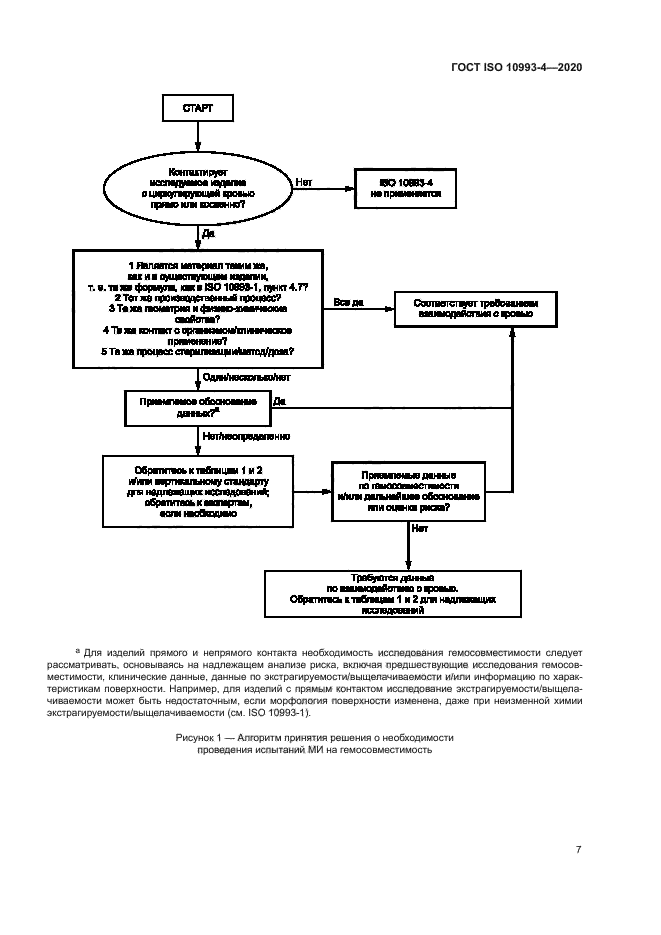
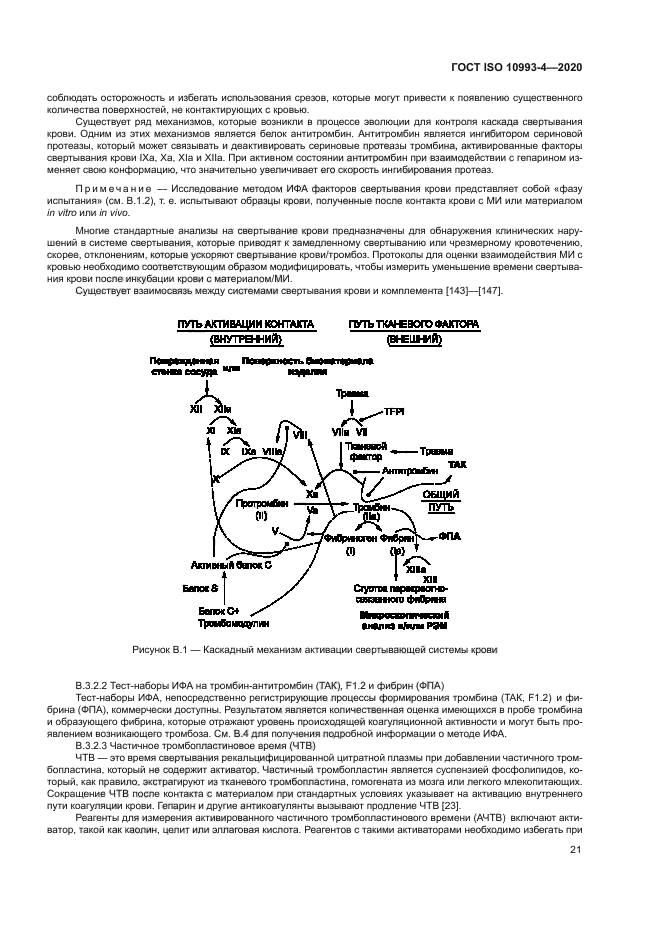
Рисунок 1 — Алгоритм принятия решения о необходимости проведения испытаний МИ на темосовмвстимость
|
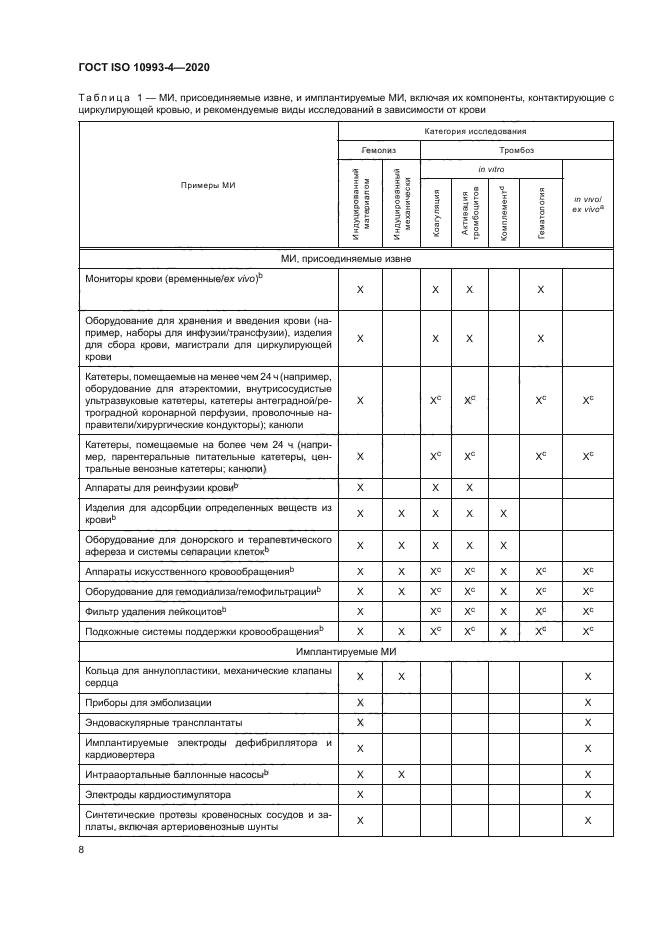
Таблица 1 — МИ. присоединяемые извне, и имплантируемые МИ. включая их компоненты, контактирующие с циркулирующей кровью, и рекомендуемые виды исследований в зависимости от крови | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
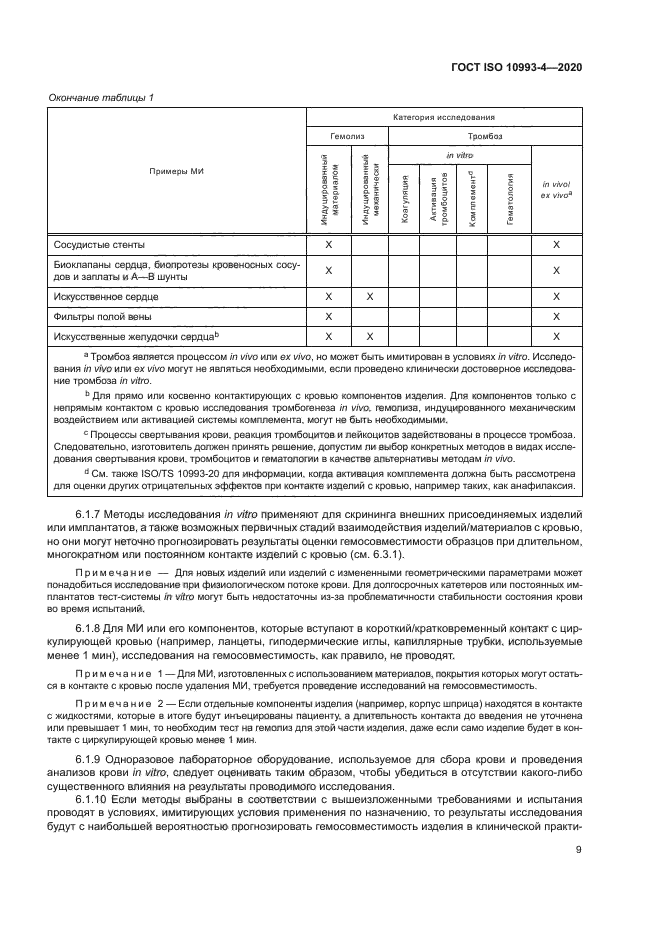
Окончание таблицы 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
6.1.7 Методы исследования in vitro применяют для скрининга внешних присоединяемых изделий или имплантатов, а также возможных первичных стадий взаимодействия изделий/материалов с кровью, но они могут неточно прогнозировать результаты оценки гемосовместимости образцов при длительном, многократном или постоянном контакте изделий с кровью (см. 6.3.1).
3 Тромбоз является процессом in vivo или ex vivo, но может быть имитирован в условиях in vitro. Исследования in vivo или ex vivo могут не являться необходимыми, если проведено клинически достоверное исследование тромбоза in vitro.
0 Для прямо или косвенно контактирующих с кровью компонентов изделия. Для компонентов только с непрямым контактом с кровью исследования тромбогенеза in vivo, гемолиза, индуцированного механическим воздействием или активацией системы комплемента, могут не быть необходимыми.
с Процессы свертывания крови, реакция тромбоцитов и лейкоцитов задействованы в процессе тромбоза. Следовательно, изготовитель должен принять решение, допустим ли выбор конкретных методов в видах исследования свертывания крови, тромбоцитов и гематологии в качестве альтернативы методам in vivo.
a См. также ISO/TS 10993-20 для информации, когда активация комплемента должна быть рассмотрена для оценки других отрицательных эффектов при контакте изделий с кровью, например таких, как анафилаксия.
Примечание — Для новых изделий или изделий с измененными геометрическими параметрами может понадобиться исследование при физиологическом потоке крови. Для долгосрочных катетеров или постоянных имплантатов тест-системы in vitro могут быть недостаточны из-за проблематичности стабильности состояния крови во время испытаний.
6.1.8 Для МИ или его компонентов, которые вступают в короткий/кратковременный контакт с циркулирующей кровью (например, ланцеты, гиподермические иглы, капиллярные трубки, используемые менее 1 мин), исследования на гемосовместимость, как правило, не проводят.
Примечание 1 —Для МИ. изготовленных с использованием материалов, покрытия которых могут остаться в контакте с кровью после удаления МИ, требуется проведение исследований на гемссовместимость.
Примечание 2 — Если отдельные компоненты изделия (например, корпус шприца) находятся в контакте с жидкостями, которые в итоге будут иньецированы пациенту, а длительность контакта до введения не уточнена или превышает 1 мин. то необходим тест на гемолиз для этой части изделия, даже если само изделие будет в контакте с циркулирующей кровью менее 1 мин.
6.1.9 Одноразовое лабораторное оборудование, используемое для сбора крови и проведения анализов крови in vitro, следует оценивать таким образом, чтобы убедиться в отсутствии какого-либо существенного влияния на результаты проводимого исследования.
6.1.10 Если методы выбраны в соответствии с вышеизложенными требованиями и испытания проводят в условиях, имитирующих условия применения по назначению, то результаты исследования будут с наибольшей вероятностью прогнозировать гемосовместимость изделия в клинической практи-
ке. Для МИ, используемых в диапазоне различных условий, необходимо рассмотреть крайние и средние условия. Тем не менее различия между видами животных и другие факторы могут ограничить про-гнозируемость любого исследования.
6.1.11 Из-за индивидуального характера реактивности крови у животных различных видов, при возможности, используют кровь человека (за исключением установленных методов исследования с кровью животных, таких как некоторые тесты на гемолиз). При необходимости использования животных. например для оценки изделий, применяемых для длительного или многократного воздействия или постоянного контакта с кровью, необходимо учитывать межвидовые различия в реактивности крови.
Показатели крови и реактивность у человека и приматов очень схожи [204]. Использование таких животных, как кролик, свинья, теленок, овца или собака, также может быть приемлемым для конкретного типа исследования. Однако, так как межвидовые различия могут быть значительными (например, адгезия тромбоцитов [148]. [150]. тромбоз [44] и гемолиз [47] при контакте крови с чужеродным материалом, как правило, менее выражено у собак, чем у человека), все результаты испытаний на крови животных следует интерпретировать с осторожностью. Выбранные виды и используемое количество животных должны быть обоснованы (см. ISO 10993-2).
Примечание — Использование приматов для исследований гемосовместимости in vivo и функциональных свойств МИ запрещено законом ЕС (86/609/ЕЕС) и отдельными государственными законами.
6.1.12 Следует избегать применения антикоагулянтов в тестах in vivo и ex vivo, кроме случаев, когда изделие предназначено для функционирования в их присутствии. Так как тип и концентрация используемого антикоагулянта влияют на взаимодействия изделия с кровью, то их выбор должен быть обоснован. Изделия, используемые с антикоагулянтами, должны быть исследованы в диапазоне концентраций антикоагулянтов, используемых в клинической практике и/или приведенных в инструкции по применению (ИП) изделия или другой соответствующей литературе. Межвидовые различия также следует учитывать при определении необходимой концентрации антикоагулянтов.
6.1.13 При модифицировании МИ. должны быть проведены исследования его гемосовместимости и функциональные свойства. К модифицированию МИ относят изменения конструкции, формы, химического состава поверхности или объемных свойств материала, текстуры, пористости или других свойств. Моделирование потока in vitro, соответствующего условиям эксплуатации МИ, может быть использовано для оценки влияния технологии модифицирования на его гомосовместимость.
6.1.14 Следует провести достаточное количество выполняемого теста, включая соответствующие контроли для статистической обработки полученных результатов. Вариативность некоторых методов исследования требует, чтобы измерения были повторены достаточное число раз для определения их достоверности. Повторные исследования, проводимые дополнительно в течение продолжительного периода контакта МИ с кровью, дают информацию о временной зависимости процессов взаимодействия изделия с кровью [213]—[216]. Необходимо соблюдать баланс между необходимостью статистического анализа результатов и состоянием животных в исследованиях in vivo (см. ISO 10993-2).
6.1.15 Рекомендации, содержащиеся в 6.1, вместе с рисунком 1 и таблицей 1, являются руководством для выбора методов исследований, перечисленных в таблице 2. Дальнейшее руководство по доклинической оценке приведено в приложениях A — G. Необходимо следовать следующей процедуре:
a) определить, какие потенциальные виды взаимодействия с кровью (см. 6.2) являются подходящими к рассмотрению для установления безопасности конкретного МИ относительно его гемосовместимости (см. примеры в таблице 1);
b) оценить существующую информацию в каждой категории исследований для МИ;
c) если существует достаточная информация по гемосовместимости МИ. то подготовить соответствующее обоснование сделанного заключения о том, что дальнейшее исследование не является необходимым.
Примечание — Отличие в составе, форме, свойствах поверхности, технологии производства, способе стерилизации и/или области клинического применения может ограничить использование информации по безопасности сходного продукта относительно его гемосовместимости;
d) если информации по категории или категориям исследований недостаточно, то необходимые исследования выбирают, основываясь на примерах, приведенных в таблицах 1 и 2. чтобы получить дополнительную информацию по гемосовместимости МИ.
6.2 Категории исследований для оценки взаимодействия медицинских изделий с кровью
6.2.1 Рекомендуемые исследования для оценки взаимодействия медицинских изделий с кровью
Рекомендуемые исследования классифицированы по типу изделия (см. примеры в таблице 1). Исследования разделяют на следующие категории, основываясь на соответствующем биологическом ответе крови, ее компонентов или систем крови на контакт с МИ:
- гемолиз:
- индуцированный материалом;
- индуцированный механическим воздействием;
- тромбоз:
- in vitro:
- коагуляция (активация свертывающей системы крови);
- активация тромбоцитов;
- активация системы комплемента;
- гематология;
- in vivo!ex vivo.
Принципы и научное обоснование для этих исследований приведены в приложениях А—Е.
|
Таблица 2 — Распространенные исследования, используемые для оценки взаимодействия изделий с кровью | ||||||||||||||||||||||
| ||||||||||||||||||||||
6.2.2 Медицинские изделия, не контактирующие с кровью
Исследования МИ. не контактирующих с кровью, на гемосовместимость не проводят.
6.2.3 Медицинские изделия, присоединяемые извне, и имплантируемые медицинские изделия
После использования таблицы 1 для сравнения нового исследуемого изделия со сходными существующими изделиями и отмечая потенциальные виды исследований, следует использовать таблицу 2. приложения А и Е как руководства для выбора конкретных адекватных испытаний для оценки гемосовместимости изделия.
6.2.4 Ограничения
При проведении исследований и анализе полученных результатов для адекватной оценки гемо-совместимости изделий следует основываться на существующих научных и технологических данных, а также учитывать условия конкретного применения изделий. Например:
a) гемосовместимость материалов/МИ в условиях высокого (артериального) кровотока может отличаться от таковой в условиях низкого (венозного) кровотока;
b) в процессе исследований с кровью могут взаимодействовать как исследуемые материалы/МИ, так и не исследуемый материал, например тест-системы. Следует соблюдать осторожность и отличать эффекты воздействия на кровь, связанные с исследуемым материалом, от эффектов, вызванных другими факторами;
c) испытания, которые основываются только на одном методе для оценки взаимодействия МИ с кровью, могут менее точно прогнозировать истинный ответ, чем испытания, которые включают несколько различных методов на гемосовместимость изделия;
d) иммунологические исследования для детектирования белковых индикаторов при тестировании гемосовместимости МИ. например ТАК. СЗа и т. д.. как правило, коммерчески доступны при использовании крови человека, но они в большинстве случаев непригодны для крови других видов.
6.3 Виды исследований
6.3.1 Исследования In vitro
Исследования in vitro (модельные условия) должны учитывать имитацию ожидаемых наиболее неблагоприятных условий клинического применения МИ. Экспериментальные параметры учитывают для каждого метода in vitro, включая гематокрит. природу и количество антикоагулянта, пробоподго-товку, срок хранения тестируемого образца, срок хранения крови/компонента крови, условия хранения тестируемого образца, содержание кислорода в воздушной среде, pH, температуру, рандомизацию при отборе образцов, отношение площади поверхности образца к объему крови, а для динамических исследований — характеристики потока жидкости, особенно скорость потока, скорость сдвига и дав-ление/давления. Испытания следует начинать с минимальной задержкой, как правило, в течение 4 ч после забора крови, так как после забора некоторые свойства крови быстро изменяются. Альтернативы к последнему могут быть возможны при валидации методов с использованием крови не в ближайшее время после ее забора. Полученные образцы крови после проведения испытаний также могут быть заморожены до будущего анализа, если процесс заморозки/оттаивания не влияет на их исследуемые свойства.
Примечание — Клинически адекватные типы и количества антикоагулянта могут быть или не быть подходящими в зависимости от тест-системы и возможности различить результаты положительных и отрицательных контролен.
При оценке гемосовместимости модифицированного изделия результаты исследований in vitro на гемолиз, тромбоз, реакцию тромбоцитов и активацию свертывающей системы крови могут быть оценены при сравнении с результатами, полученными для используемых в клинике исходных МИ (см. А.1.4).
6.3.2 Исследования ex vivo
Исследования ox vivo следует проводить, если МИ предназначено для применения ex vivo, например внешнее присоединяемое изделие. Исследование ex vivo допустимо, если МИ предназначено для применения in vivo, например для оценки острой реакции на имплантат, такой, например, как протез кровеносных сосудов. Такое испытание не должно заменять имплантационный тест.
Существуют методы ox vivo для мониторинга адгезии тромбоцитов, образования тромбоэмболов. осаждения фибриногена, массы тромба, адгезии лейкоцитов, убыли тромбоцитов и активации тромбоцитов [44], [46]. [47], [50], [54]. [70]. [78]. [80]. Скорость кровотока измеряют ультразвуковым методом (ультразвуковая расходомвтрия). основанным на эффекте Доплера, или электромагнитным методом (электромагнитная расходометрия). Изменения в скорости потока указывают на интенсивность и скорость отложения тромбов и эмболизации. Непосредственно процесс формирования тромбов оценивают макро- и/или микроскопическими методами визуализации. Возможно использование других более совершенных и технически сложных устройств [53]. [69]. [73], [74]. [79].
6.3.3 Испытания in vivo
Испытание in vivo предусматривает имплантацию материала или МИ животным. Сосудистые заплаты. катетеры и стенты, протезы кровеносных сосудов, кольца для аннулопластики, протезы клапанов сердца и вспомогательные системы кровообращения являются примерами МИ, исследуемых in vivo. Учитывая разнообразие применений МИ, контактирующих с кровью, экспериментальные модели in vivo должны быть соответственно разнообразны для адекватной имитации их применения по назначению.
Степень «проходимости доступа или изделия (т. е. незатрудненный кровоток через изделие)» является общепринятым положительным или отрицательным результатом при проведении ряда иссле-
дований in vivo. После удаления (реимплантации) МИ определяют процент окклюзии и массу тромба. Склонность тромбов, сформировавшихся на поверхности изделия, к эмболизации дистальных органов должна быть тщательно оценена макро- и микроскопическим исследованиями органов ниже по потоку от имплантированного изделия. Дополнительно полезна гистологическая оценка окружающих тканей и органов. Почки особенно имеют тенденцию захватывать тромбы, оторвавшиеся от внутренней поверхности изделий, имплантированных выше по потоку от почечных артерий (например, искусственный желудочек сердца. искусственное сердце, протезы аортальных клапанов), и попавшие в циркулирующую кровь [184), [187], [236], [237].
Существуют испытания in vivo, которые не требуют терминальной стадии для лабораторных животных при получении результатов. Артериограммы или внутрисосудистое ультразвуковое исследование (ВСУЗИ/IVUS — технология визуализации с использованием катетера) применяют для определения проходимости или осаждения тромбов на поверхности изделий. Рентгеновские снимки используют для мониторинга осаждения тромбоцитов в различные периоды времени in vivo: выживаемость тромбоцитов и их убыль могут быть использованы в качестве индикаторов взаимодействий изделия с кровью и пассивации его поверхности за счет формирования неоинтимы или адсорбции белков [46], [72], [79].
В некоторых экспериментальных моделях in vivo характер взаимодействия МИ с кровью могут определять неосновные свойства материала, влияющие на его гемосовместимость. Параметры потока, механические свойства, пористость и конструкция имплантата могут быть более важными, чем совместимость материала МИ с кровью. Например, системы с низкой скоростью потока могут давать значительно отличающиеся результаты по сравнению с тем же материалом, оцененным в системе с высокой скоростью потока. Результаты, полученные in vivo, более значимы, чем результаты испытаний in vitro.
Протоколы исследований in vivo должны содержать четко выделенные разделы, в которых для каждой выбранной категории тестов, т. е. гемолиз, тромбоз, коагуляция, тромбоциты, гематология и система комплемента, должны быть приведены и обсуждены полученные результаты.
Приложение А (справочное)
Доклинические исследования изделий и протезов для сердечно-сосудистой системы
А.1 Общие положения
А.1.1 Основание
В настоящем приложении представлены рекомендации по выбору методов для оценки гемосовместимости МИ, предназначенных для сердечно-сосудистой хирургии. Раздел 6 содержит руководство для определения необходимости проведения исследований, включая рекомендации по выбору категории исследований для конкретных МИ и перечень конкретных методов для оценки гемосовместимости МИ. не контактирующих с кровью, присоединяемых извне и имплантируемых МИ. Классификация основных процессов взаимодействий МИ с кровью, влияющих на его темосовместимость. приведена в А. 1.2.
А. 1.2 Классификация
А.1.2.1 Процессы взаимодействия с кровью, которые, как правило, влияют на МИ и могут иметь или не иметь нежелательное воздействия на животное или человека, включают:
a) адсорбцию белков плазмы, липидов, кальция или других веществ из крови на поверхность изделия или абсорбцию таких веществ в МИ;
b) адгезию тромбоцитов, лейкоцитов или эритроцитов на поверхность изделия или абсорбцию их компонентов в МИ;
c) формирование псевдоинтимы или неоинтимы на поверхности, контактирующей с кровью, и тканевой капсулы на внешней поверхности МИ.
d) изменения механических и других свойств МИ.
А. 1.2.2 Процессы взаимодействия с кровью, потенциально обладающие нежелательным воздействием на животное или человека, включают:
a) активацию тромбоцитов, лейкоцитов или других клеток или активацию путей свертывающей системы крови. фибринолиза или системы комплемента;
b) образование тромба на поверхности МИ;
c) эмболизацию тромбического или другого материала с поверхности МИ другой области кровеносной системы;
d) повреждение клеток циркулирующей крови, приводящее к анемии, гемолизу, лейкопении, тромбоцитоле-нии или изменению функции клеток крови;
e) повреждение клеток и тканей, прилетающих к МИ:
0 гиперплазия интимы или накопление другой ткани на изделии либо вблизи него, приводящие к снижению потока или влияющие на другие функции МИ;
д) адгезия и рост бактерий или других возбудителей инфекции на изделии или вблизи него.
Примечание — Для вышеуказанных пунктов Ь). с) и d) некоторые МИ (например, спирали эмболизации) требуют формирования тромба для функционирования.
А.1.3 Преимущества и ограничения экспериментальных моделей на животных
Модели на животных позволяют наиболее точно имитировать условия функционирования МИ при применении по назначению до реального его использования для пациента. Данные модели позволяют осуществлять мониторинг состояния МИ и проводить систематическое контролируемое исследование основных свойств, характеризующих его взаимодействие с кровью. При этом выбор экспериментальной модели гложет быть ограничен требованиями размера, доступностью необходимых видов и стоимостью животных. Например, в экспериментальной модели МИ может не функционировать по полному спектру его клинического применения из-за анатомических ограничений лабораторного животного. Следует учитывать физиологические отличия и сходства выбранного вида животного и человека, особенно связанные с системой свертывания крови, функциями тромбоцитов и фибрино-лизом, а также с ответом на такие фармакологические вещества, как анестетики, антикоагулянты, тромболигики, антитромбоцитарные агенты и антибиотики. Из-за межвидовых и индивидуальных отличий животных в реактивности и разной интенсивности ответов на различные изделия данные, полученные от одного вида, следует с осторожностью интерпретировать для других видов животных. Приматы, такие как бабуины, обладают большим сходством с человеком по гематологическим показателям, механизму свертывания крови и строению сердечно-сосудистой системы [50]. Дополнительным преимуществом приматов является то. что многие иммунологические пробы на тромбообразование. разработанные для человека, включающие определение ТФ-4, fi-ТП ФПА. ТАК и F1.2. приемлемы для использования на приматах.
В моделях in vivo, как правило, используют собак, что позволяет получить ценную информацию; тем не менее тромбоз, индуцированный тестируемым изделием, у них возникает быстрее, чем у человека. Указанное раз-
личие допускается рассматривать как преимущество данной модели (модель ускоренных испытаний или модель с жесткими условиями) при оценке вероятности тромбообразования при тестировании изделий. Свиней и овец, как правило, считают подходящими моделями благодаря сходству их сердечно-сосудистой системы и гематологиче-ских показателей с человеком [71]. [148]—[150]. Следует учитывать влияние протокола хирургического вмешательства при имплантации на результаты исследования и иметь соответствующие контроли. Для окончательного решения об использовании модели in vivo или in vitro следует руководствоваться доступностью животного и правилами этического обращения с ним (см. ISO 10993-2). а также доступностью и преимуществом (ограничениями) моделей in vitro для получения статистически достоверных и надежных результатов и выводов [213]—[216].
А.1.4 Преимущества и ограничения моделей in vitro
Модели контакта изделия с кровью in vitro являются привлекательными подходами к исследованию гемосов-местимости медицинских материалов и изделий для сердечно-сосудистой системы, так как они позволяют:
a) избегать дорогостоящих животных моделей:
b) проводить тестирование с большим количеством образцов исследуемого изделия вместе с контролями и материалами сравнения, используя одновременно одну партию крови:
c) использовать кровь человека или животного при стандартизированных условиях потока, температуре и антикоагулянтной схеме:
d) исследовать наиболее неблагоприятные условия, связанные с аккумуляцией продуктов активации без удаления их почками, печенью или другими органами и отсутствием ингибирующих активацию функций эндотелиальных клеток:
e) исключать искажающие факторы, связанные с имплантацией изделия/повреждением тканей в тестах in vivo.
Исследование in vitro МИ должно максимально точно имитировать варианты условий контакта МИ с кровью при его клиническом применении. Проведение исследований при условиях, отличающихся от клинических (например. отличие в виде или концентрации антикоагулянтов, условиях потока и др.). может затруднить интерпретацию результатов. При необходимости следует руководствоваться ИП на МИ или литературой по общей медицинской практике относительно вида и концентрации используемых в клинике антикоагулянтов. Если возможно, то необходимо провести исследование по полному спектру условий клинического применения изделия. Например, для оценки гемолиза и активации тромбоцитов, индуцированных механическими воздействиями, тестирование, как правило, проводят при наибольшей скорости кровотока. Исследование тромбообразования при взаимодействии изделия с кровью предпочтительно проводить при минимально возможной скорости кровотока, что важно для повышения надежности оценки безопасности изделия. Так как выявлено, что ответы крови могут значительно различаться у разных видов [47]. [148]. [149]. [150]. применение крови человека наиболее достоверно для интерпретации результатов. Другим преимуществом использования крови человека является тот факт, что это позволяет использовать более расширенный набор методов, так как наиболее современные биоанапитические методы основываются на компонентах крови^ни топах человека. В то же время существуют определенные ограничения объема крови, который может быть получен от одного человеческого донора. Использование крови от одного крупного животного может быть более практичным в случаях, когда модель, предназначенная для имитации клинически адекватных условий, требует большого обьема крови.
Для исследования гемосовместимости магериала/издепия в целом использовалась классическая модель петли Чэндлера in vitro [43] или ее модификации [193]—[195]. [199]. [200]. [203] для обеспечения физиологического или квазифизиологического потока. В качестве альтернагивы потока используют легкое взбалтывание крови, что может быть полезным в отдельных случаях при исследовании гемосовместимости материалов/изделий. Для оценки влияния модели in vitro на кровь необходимо контролировать гемолиз и общее количество клеток крови для определения пригодности крови для проведения исследований. Эти модели являются эффективными для скрининговых исследований, особенно для изделий с краткосрочным контактом с кровью.
А.1.5 Протоколы исследований моделей на животных
Тромбоз, тромбоэмболия, кровотечение и инфекция являются основными сдерживающими факторами для использования и дальнейшей разработки современных сердечно-сосудистых протезов. Для МИ с ограниченным временем воздействием на кровь (менее 24 ч) важные измерения связаны со степенью быстрых изменений гематологических и гемодинамических параметров, а также факторов, характеризующих функционирование изделия, с образованием массы тромбов и возможной эмболией. При длительном, многократном или постоянном контакте (более 24 ч и более 30 суток соответственно) внимание уделяют серийным методам измерений, которые могут дать информацию относительно времени тромбообразования и тромбоэмболии, убыли компонентов циркулирующей крови, развития гиперплазии интимы и инфекции. В обоих типах воздействия и категориях контакта важна оценка гемолиза и функции тромбоцитов. На образование тромбов могут оказывать значительное влияние характер хирургического вмешательства, разнообразные, зависящие от времени, тромболитические и тромбоэмболити-ческие эффекты, инфекции, вызванные изделием, и возможные изменения свойств контактирующей поверхности, например гиперплазия интимы, фиброзная инкапсуляция и эндотелиализация. Следует учитывать, что тип/типы и количество антикоагулянта могут иметь существенное влияние на результаты. Например, использование применяемых в клинической практике концентраций антикоагулянтов и антитромбоцитарных препаратов гложет значительно уменьшить или полностью блокировать ответные реакции тромбоцитов, процессы свертывания крови и тромбоза.
Содержание
1 Область применения.................................................................1
2 Нормативные ссылки.................................................................1
3 Термины и определения..................................... 2
4 Обозначения и сокращения .....................,.....................................3
5 Классификация медицинских изделий, контактирующих с кровью, в соответствии
с ISO 10993-1 ........................................................................4
5.1 Медицинские изделия, не контактирующие с кровью...................................4
5.2 Медицинские изделия, присоединяемые извне........................................4
5.3 Имплантируемые медицинские изделия .............................................5
6 Характеристика процессов взаимодействия медицинских изделий с кровью....................5
6.1 Общие требования............ 5
6.2 Категории исследований для оценки взаимодействия медицинских изделий с кровью.......11
6.3 Виды исследований.............................................................12
Приложение А (справочное) Доклинические исследования изделий и протезов
для сердечно-сосудистой системы .........................................14
Приложение В (справочное) Рекомендуемые лабораторные исследования.
Основные положения, научное обоснованно и интерпретация ..................18
Приложение С (справочное) Тромбоз. Методы исследования in vivo..........................27
Приложение D (справочное) Гематология/гемолиз. Методы исследования. Оценка гемолитических
свойств медицинских изделий и материалов для медицинских изделий...........33
Приложение Е (справочное) Система комплемента. Методы исследования....................38
Приложение F (справочное) Менее распространенные методы лабораторных исследований.....41
Приложение G (справочное) Методы лабораторных исследований, не применяемые
в доклинической оценке биологической безопасности медицинского изделия......44
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
межгосударственным стандартам.........................................46
Библиография......................... 47
Последствия взаимодействия чужеродных поверхностей с кровью могут быть различными: от множественного тромбоза и эмболии до малозаметных эффектов, таких как ускорение процессов, снижающих концентрацию компонентов крови, задействованных в нормальном гемостазе. Последнее может быть не клинически значимым. Например, уменьшение количества тромбоцитов при контакте МИ с кровью может быть таким незначительным, что оно не влияет на общее число тромбоцитов. С другой стороны. МИ с большой площадью поверхности может привести к существенному снижению количества тромбоцитов или факторов свертывания крови, что может значительно повлиять на общее число тромбоцитов и изменить нормальный гемостаз.
Вне зависимости от вида экспериментальной модели на животных и конкретного исследования (гемолиз, тромбоз, свертывание крови, тромбоциты, гематология и система комплемента) в протоколе исследования in vivo должна быть представлена достаточная детализация методов и критериев для оценки обоснования выбранной категории исследований. Ретроспективный отчет о результатах конкретной категории тестов без первоначального обоснования в протоколе программы исследования, как правило, рассматривают как неприемлемый документ для подачи регистрационной заявки.
А.2 Канюли, используемые для прямого сосудистого доступа и канюли для непрямого доступа
Термин «канюли» используют в двух, достаточно различных, случаях клинического применения. В одном варианте канюли вводят прямо через кожу в один или более основных кровеносных сосудов. Это делается для предоставления постоянного и прямого широкого доступа к системе кровообращения. Например, канюли большого диаметра используют при операциях в условиях искусственного кровообращения как изделие доступа локального действия для обеспечения циркуляции потока крови в процессе оксигенации. Тестирование таких канюлей должно проходить в условиях контакта с кровью, адекватно имитирующих их клиническое применение, так как они могут потенциально вызывать определенные изменения в концентрациях клеток в циркулирующей крови, а также влиять на активацию факторов свертывания или компонентов системы комплемента. Интенсивность реакции крови зависит от целого ряда факторов, таких как место имплантации, метода введения, индивидуальных факторов и режима антикоагулянтной терапии. Термин «канюли» также используется для трубчатых изделий гораздо меньшего диаметра. которые вводят только подкожно и которые могут быть использованы для ограниченного (менее 24 ч) или длительного (менее 30 сут) непрямого контакта с кровью. Такие канюли, например, применяют при инфузии инсулина посредством помп, для введения медикаментов и для подкожного измерения уровней глюкозы в крови. Последний тип канюль, как и другие изделия, служащие в качестве непрямого кровотока (см. 5.2.2). как правило, требует меньшего количества тестов, чем изделия с прямым контактом с циркулирующей кровью (см. 5.2.3 и 5.3).
А.З Катетеры и хирургические кондукторы
Большинство применяемых для исследования канюль, контактирующих с кровью, подходят и для исследования катетеров, контактирующих с кровью, и проволочных проводников/кондукторов. Местонахождение или положение катетеров в артериальной или венозной системе крови может значительно повлиять на взаимодействие МИ с кровью. Рекомендуется одновременно проводить контрольные исследования на противоположной артерии или вене, используя зарегистрированное МИ со сходными свойствами и материал омйматериалами. Следует с большой осторожностью удалять катетер, чтобы не оторвался, возможно, образовавшийся тромб. Испытание изделия in situ дает возможность оценить степень участия повреждений интимы или мест ввода катетеров или кондукторов в процессе образования тромба. Измерения кровотока по Доплеру являются более информативными, чем ангиография. Модель венозного или артериального имплантата с антикоагулянтной схемой, соответствующей клиническому применению изделий, может быть полезным инструментом для оценки реакции крови на контакт с изделием, особенно в случае нового материала или покрытия изделия с улучшенными антитромбогенными свойствами [143]. [161] — [163] (см. приложение С, С.З).
С другой стороны, подходящая модель in vitro может быть более чувствительной для обнаружения разных реакций крови на различные поверхности материала.
В случаях, когда требуется введение антикоагулянтов, выбор типа и концентрации антикоагулянтов должен быть основан на клиническом применении изделия, но быть достаточно доказательным, что при этом не будет получен ложный положительный или отрицательный результат. Например, во время тестирования тромборези-стентность гепаринового покрытия МИ может быть полностью затушевана присутствием нормальных (клинических) уровней антикоагулянта (например, раствора гепарина) в крови. При снижении концентрации гепарина в крови эффективность гепаринового покрытия относительно уменьшения вероятности формирования тромбов становится более явной. В случаях, когда применение МИ гложет быть без антикоагулянтов, тестирование следует проводить также без антикоагулянтов.
Информация по валидации теста с конкретным типом и уровнем антикоагулянтов должна демонстрировать способность отличать положительные ответы от отрицательных результатов.
А.4 Экстракорпоральные оксигенаторы крови, гемодиализаторы/устройства для гемофильтрации,
оборудование для доноров и терапевтического афереза. устройства для избирательной адсорбции
веществ из крови
Ответы крови на искусственное кровообращение могут быть значительными и острыми. Многие параметры, такие как наличие отсосов крови, состав кристаллоидного раствора, предварительно вводимого в аппарат
Введение
ISO (Международная организация по стандартизации) является федерацией национальных органов по стандартизации {органов — членов ISO). Работу по подготовке международных стандартов проводят через технические комитеты ISO. Каждая организация-член, заинтересованная в области деятельности, для которой создан технический комитет, имеет право быть представленной в данном комитете. Международные правительственные и неправительственные организации также принимают участие в работе ISO. ISO тесно сотрудничает с Международной Электротехнической Комиссией (IEC) по вопросам стандартизации электротехнической продукции.
Процедуры, примененные при разработке настоящего стандарта, а также процедуры, предназначенные для его дальнейшей поддержки, приведены в Директиве ISO/IEC. часть 1. В частности, следует обратить внимание на различные критерии утверждения для различных типов документов ISO. Настоящий стандарт составлен в соответствии с редакционными правилами Директив ISO/IEC, часть 2 (www.iso.org/directives). Следует обратить внимание на возможность того, что некоторые элементы настоящего стандарта могут быть объектом патентных прав.
ISO не несет ответственности за обозначение каких-либо таковых патентных прав. Детали каких-либо патентных прав, обозначенных при разработке настоящего стандарта, будут включены во введении и/или в списке полученных патентных деклараций ISO (см. www.iso.org/patents).
Любая торговая марка, упомянутая в настоящем стандарте, является информацией, приведенной для удобства пользователей и не является рекламой.
Для разъяснения добровольного характера стандартов, значений конкретных терминов ISO и выражений. связанных с оценкой соответствия, а также информации о приверженности ISO принципам ВТО по техническим барьерам в торговле (ТВТ) см. следующий URL: www.iso.org/iso/foroword.html.
Настоящий стандарт разработан Техническим комитетом ISO/TC 194 «Биологическая и клиническая оценка медицинских изделий».
Данное третье издание отменяет и заменяет второе издание (ISO 10993-4:2002). которое технически пересмотрено.
Оно также включает изменение ISO 10993-4:2002/Amd 1:2006.
Были сделаны следующие изменения:
a) пересмотрены некоторые определения и добавлены новые определения:
b) объединены таблицы 1 и 2 в одну новую таблицу 1 с реорганизованными категориями исследований и заголовками для подчеркивания и раздельного рассмотрения гемолиза, индуцированного материалами и механическими воздействиями, а также исследований in vitro и in vivo для оценки риска тромбоза:
c) объединены таблицы 3 и 4 в одну новую таблицу 2 с упрощенным списком рекомендуемых и наиболее распространенных тестов;
d) обновлено приложение В. включающее описание только наиболее распространенных используемых тестов для оценки взаимодействий изделий с кровью:
e) добавлено приложение С. содержащее описание тромбоза in vivo и методов исследования:
f) обновлено приложение D. бывшее приложением С в предыдущем издании, и теперь включает добавленную информацию по механически индуцированному гемолизу:
д) добавлено приложение Е, включающее описание исследования комплемента и сведения о лучших методах исследования.
h) добавлены приложения F и G. включающие менее распространенные методы, используемые для оценки взаимодействий с кровью, и методы исследований, которые не рекомендуется применять в доклинической оценке взаимодействия медицинского изделия с кровью, соответственно. Многие из этих методов ранее были включены в приложение В;
i) небольшие стилистические и лексические уточнения внесены в текст:
j) реорганизован список литературы и обновлен дополнительными и более актуальными источниками.
Выбор и планирование методов исследований взаимодействия медицинских изделий с кровью должны учитывать конструкцию изделия, материалы, клиническое применение, условия использования и риск-выгоду.
Такой уровень конкретности может быть описан только в вертикальных стандартах, применяемых к конкретному или ограниченному виду медицинских изделий.
Первоначальным источником для разработки настоящего стандарта была публикация «Guidelines for blood/material interactions» («Руководство no взаимодействию материалов с кровью»), отчет Национального института болезней сердца, легких и крови [14], главы 9 и 10. Эта публикация была впоследствии пересмотрена [15].
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Изделия медицинские ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 4
Исследования изделий, взаимодействующих с кровью
Medical devices. Biological evaluation of medical devices.
Part 4. Selection of tests for interactions with blood
Дата введения — 2021—03—01
1 Область применения
Настоящий стандарт распространяется на медицинские изделия (МИ), включая материалы, предполагаемые для изготовления МИ. взаимодействующие с кровью, и устанавливает общие требования к оценке их биологического действия.
В настоящем стандарте приведены:
a) классификация МИ. предназначенных для использования в контакте с кровью, основанная на применении и длительности контакта, в соответствии с ISO 10993-1;
b) фундаментальные принципы для оценки биологического действия МИ при контакте с кровью.
c) рекомендации по выбору методов исследований МИ в соответствии с конкретными видами и категориями.
Методы исследований МИ конкретных видов должны быть установлены в соответствующих стандартах с учетом требований к МИ и обеспечивать точность измерений.
Настоящий стандарт устанавливает общие требования к проведению оценки биологического действия МИ и не устанавливает методы испытаний МИ конкретных видов.
Для серийно выпускаемых МИ, безопасность которых подтверждена, дополнительные исследования на соответствие настоящему стандарту не требуются.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных — последнее издание (включая все изменения).
ISO 10993-1. Biological evaluation of medical devices — Part 1: Evaluation and testing within a risk management process (Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента рисков)
ISO 10993-12. Biological evaluation of medical devices — Part 12: Sample preparation and reference materials (Биологическая оценка медицинских изделий. Часть 12. Приготовление проб и стандартные образцы)
Издание официальное
3 Термины и определения
В настоящем стандарте применены термины no ISO 10993-1. ISO 10993-12, а также следующие термины с соответствующими определениями.
ИСО и МЭК ведут терминологические базы данных для использования в стандартизации по следующим адресам:
- электропедия МЭК: доступна на http:/Avww.electropedia.org/:
- платформа онлайн-просмотра ИСО: доступна на http:7/www.iso.org/obp.
3.1 антикоагулянт (anticoagulant): Агент, предотвращающий или задерживающий свертывание крови.
Пример — Гепарин. этилендиаминтетрауксусная кислота (ЭДТА), цитрат натрия.
3.2 взаимодействие изделие/кровь (btood/device interaction): Взаимодействие между МИ и кровью или компонентом крови и МИ.
3.3 коагуляция (coagulation): Процесс, обусловленный каскадом активации факторов свертывания (коагуляции) крови.
Примечание 1 — Факторы каскадной коагуляции и фибринолитической системы могут быть определены при контакте крови с МИ методами in vitro и in vivo.
3.4 система комплемента (complement system): Гуморальная составляющая естественной иммунной системы, состоящая болео чем из 30 различных белков плазмы, включая ферменты, кофакторы и клеточные рецепторы, которые могут быть задействованы в развитии тромбоза.
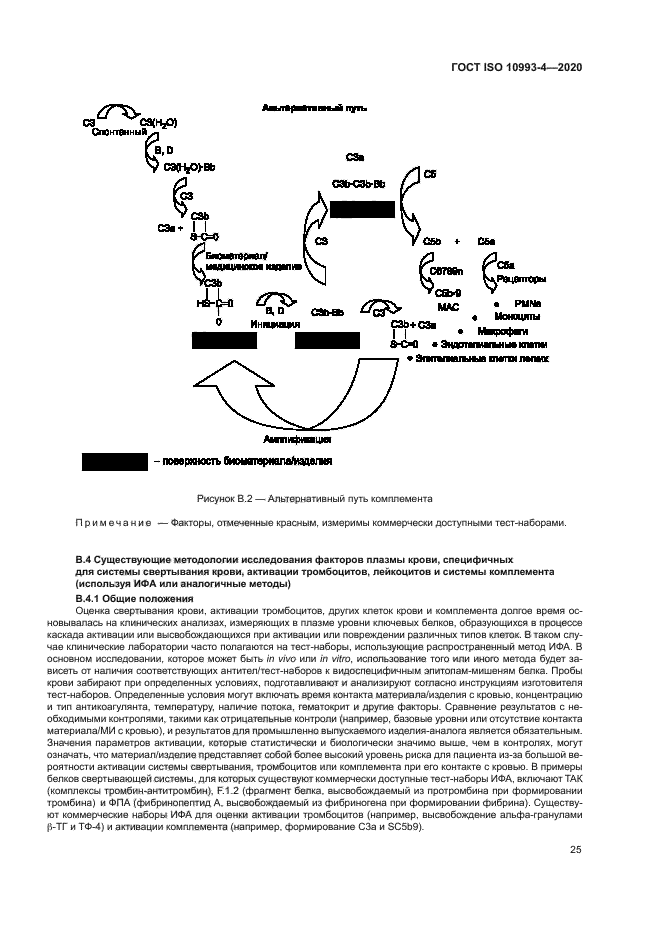
Примечание 1 — Эффекторные молекулы, получаемые из компонентов комплемента, являются возможными компонентами явлений воспаления, фагоцитоза и лизиса клеток. Настоящий стандарт не распространяется на активацию комплемента, связанную с иммунотоксичностью, гиперчувствительностью и выделением анафила-токсинов (см. ISO/TR 10993-20).
Примечание 2 — Следует учитывать, что активация системы комплемента может способствовать и ускорять гемолиз, активацию тромбоцитов и лейкоцитов, а также тромбоз на поверхностях материала МИ (см. приложение Е).
3.5 прямой контакт с кровью (direct blood contact). Контакт, при котором МИ или материал МИ вступает в непосредственный контакт с кровью или ее компонентами.
3.6 тромбоэмболизация (embolization): Процесс, при котором тромб крови или инородное тело попадает в кровоток и может его частично или полностью перекрыть и вызвать затрудненный ток крови ниже по потоку.
3.7 тест-система ex vivo (ex vivo test system): Тест-система, в которую кровь поступает непосредственно от человека или подопытного животного в камеру для исследований, расположенную вне тела.
Примечание 1 — При использовании экспериментальной модели на животных кровь может быть сразу введена обратно в кровоток животному (рециркуляция) или собрана в пробирки для исследования (однократный проток). В каждом случае камера для исследований находится вне тела.
3.8 гематология (haematology): Раздел медицины, изучающий кровь, включая количественный анализ клеточных и плазменных компонентов крови.
3.9 гоматокрит (haematocrit): Отношение объема всех форменных элементов к объему цельной крови.
3.10 гемолиз (haemolysis): Высвобождение гемоглобина из эритроцитов из-за разрушения клеточной мембраны или из-за ее частичного повреждения.
3.11 гемосовместимое МИ (haemocompatible): Изделие или материал изделия, находящиеся в контакте с кровью без каких-либо заметных клинически значимых негативных реакций (например, тромбоз, гемолиз (см. 3.10). активация тромбоцитов, лейкоцитов и комплемента) и/или других отрицательных эффектов, связанных с кровью.
3.12 непрямой контакт с кровью (indirect blood contact): Контакт, при котором МИ. используемое в качестве проводника, вступает в контакт с кровотоком только при входе в кровеносно-сосудистую систему.
Пример — Изделия доставки лекарственных средств и парентерального питательного раствора.
3.13 промышленно выпускаемое изделие; промышленное изделие сравнения: LMCD (legally-marketed comparator device; LMCD): Серийно изготавливаемое и признанное безопасным МИ. используемое в качестве сравнительного контроля в оценке безопасности исследуемого изделия методами in vitro или in vivo, со сходными конструкцией, материал омУматериалами и клиническим применением.
Примечание 1 — Рекомендуется применять LMCD. реализацию которого осуществляют в том же регионе. 8 котором проводят иследования МИ.
3.14 отсутствие контакта с кровью (non-blood-contact): Контакт МИ с организмом пациента, при котором не происходит прямого или непрямого контакта МИ с кровью.
3.15 коллоидно-осмотическое давление (colloidal osmotic pressure): Общее влияние белков или других веществ с высокой молекулярной массой на осмотическую активность плазмы.
3.16 тромбоциты (platelets): Безъядерные клетки, присутствующие в крови и способствующие тромбообраэованию за счет их адгезии к поверхности, высвобождением тромбоцитарных факторов свертывания иУили агрегацией, приводящими к формированию гемостатической пробки.
3.17 адгезия тромбоцитов (platelet adherent). Способность тромбоцитов (см. 3.16) прилипать к поверхности материала МИ.
Примечание 1 —Данное свойство испытываемого МИ. как правило, исследуют при сравнении с отрицательным контролем, положительным контролем и'йли LMCD при контакте с кровью.
Примечание 2 — Адгезия тромбоцитов не обязательно сопровождается их активацией, т. е. тромбоциты на поверхности могут быть или не быть активированными.
3.18 тромбинообразующее свойство (thrombin generating): Свойство МИ. проявляющееся при контакте с кровью и способствующее или ускоряющее процессы образования тромбина.
Примечание 1 —Даннов свойство испытываемого МИ. как правило, исследуют при сравнении с отрицательным контролем, положительным контролем и''или LMCD при контакте с кровью.
3.19 тромбогенное свойство (thrombogenic): Свойство МИ. проявляющееся при контакте с кровью и способствующее формированию тромба.
Примечание — Данное свойство испытываемого МИ. как правило, исследуют при сравнении с отрицательным контролем, положительным контролем и/или LMCD при контакте с кровью.
3.20 тромбоэмболизация (thromboembolization): Процесс, при котором происходит частичная или полная непроходимость кровеносного сосуда за счет переноса оторвавшегося тромба (см. 3.21) ниже по потоку.
3.21 тромб (thrombus): Коагулированная смесь эритроцитов, скопившихся тромбоцитов (см. 3.16). фибрина и других клеточных элементов.
3.22 тромбоз (thrombosis): Формирование тромба (см. 3.21) in vivo, ex vivo или в имитированных условиях in vitro, вызванное активацией системы свертывания крови и тромбоцитов (см. 3.16) в крови.
Примечание 1 — Тромбоз также может происходить в областях кровеносного сосуда или изделия при наличии стаза (остановки кровотока).
3.23 цельная кровь (whole blood): Нефракционированная кровь, забранная у человека или подопытного животного.
Примечание 1 — Кровь может быть без антикоагулянтов или с антикоагулянтами, например содержать цитрат натрия или гепарин.
4 Обозначения и сокращения
В настоящем стандарте применены следующие обозначения и сокращения:
ВЬ — содержащий ферменты фрагмент фактора В. произведенный расщеплением (фактором D) при активации альтернативного пути; р-ТГ (p-TG) —бета-тромбоглобулин;
C4d — продукт деградации С4 активации комплемента классическим путем;
СЗа. С5а — продукты расщепления комплемента из СЗ и С5;
СН-50 — количество комплемента, требуемого для лизиса 50 % суспензии RBC:
D-димер (D-Dimer) — определенные продукты распада фибрина (перекрестно связанный фибрин F XIII), состоящие из D-фрагментного димера:
И ФА (ELISA) — метод иммуноферментмого твердофазного анализа:
ПДФ (FDP) — продукты деградации фибрина/фибриногена:
ФПА (FPA) — фибринопептид А;
F1.2 — некаталитический фрагмент, отщепленный от протромбина при его преобразовании в тромбин (также называемый F1+2);
iC3b — неактивная форма СЗЬ. субфрагмент СЗ.
ИП (IFU) — инструкция по применению;
НПВ (IVC) — нижняя полая вена:
MPT (MRI) — магнитно-резонансная томография;
ПЭТ (РЕТ) — позитрон-эмиссмонная томография:
ТФ-4 (PF-4) — тромбоцитарный фактор 4;
ПОТ (PRP) — плазма, обогащенная тромбоцитами;
ПВ (РТ) — протромбиновое время.
ЧТВ (РТТ) — частичное (парциальное) тромболластиновое время;
SC5b-9 — продукт терминального пути активации комплемента:
РЭМ (SEM) — растровая электронная микроскопия.
ТАК (ТАТ) — тромбин-антитромбиновый комплекс:
ТКК (ТСС) — терминальный комплекс комплемента; также известен как мембраноатакующий комплекс (МАК), вычисляемый измерением SC5b-9;
ТВ (ТТ) — тромбиновое время;
ТхВ2 — тромбоксан В2.
5 Классификация медицинских изделий, контактирующих с кровью, в соответствии с ISO 10993-1
5.1 Медицинские изделия, не контактирующие с кровью
МИ. не контактирующими с кровью, являются изделия, которые не имеют прямого или непрямого контакта с кровью или с составляющими крови, находящимися в организме или возвращенными в организм. Диагностическое изделие in vitro и пробирка для забора крови являются примерами МИ. не контактирующих с кровью. Некоторые МИ. такие системы как интродьюсеры для имплантатов, могут содержать как контактирующие, так и не контактирующие с кровью компоненты.
5.2 Медицинские изделия, присоединяемые извне
5.2.1 Общие положения
К МИ, присоединяемым извне, относят изделия, контактирующие с циркулирующей кровью и служащие в качестве проводников для входа в сосудистую систему. Некоторые МИ могут иметь компоненты или составляющие с различными типами контакта (прямой и непрямой). Перечень МИ, приведенный в настоящем разделе, не является исчерпывающим.
5.2.2 Модицинскио изделия, присоединяемые извне, находящиеся в непрямом контакте с кровью
К МИ. присодениняемым извне, находящимся в непрямом контакте с кровью, относят следующие изделия:
- изделия для сбора крови:
- канюли,
- аппараты для реинфузии крови;
- изделия для хранения и введения крови и ее продуктов (например, трубки и мешки):
- набор магистралей для циркулирующей крови;
- внутрисосудистые катетеры.
5.2.3 Медицинские изделия, присоединяемые извне, находящиеся в прямом контакте с циркулирующей кровью
К МИ. присоединяемым извне, находящимся в прямом контакте с циркулирующей кровью, относят следующие изделия:
- оборудование для атерэктомии.
- мониторы крови с прямым или непрямым контактом;
- аппараты искусственного кровообращения;
- изделия для адсорбции определенных веществ из крови;
- оборудование для донорского и терапевтического афереза.
- экстракорпоральные мембранные оксигенаторы;
- оборудование для гемодиализа/гемофильтрации;
- интервенционные сердечно-сосудистые изделия;
- внутрисосудистые катетеры (баллонные, для визуализации, лазерные, ультразвуковые);
- фильтры удаления лейкоцитов;
- подкожные системы поддержки кровообращения;
- катетеры ретроградной коронарной перфузии;
- сосудистые проволочные проводники/кондукторы.
5.3 Имплантируемые медицинские изделия
К имплантируемым МИ. помещаемым в основном или полностью внутрь сердечно-сосудистой системы, относят следующие изделия:
- кольца для аннулопластики;
- артериовенозные шунты;
- мониторы крови (имплантируемые);
- вспомогательные устройства для системы кровообращения (искусственный желудочек сердца, искусственное сердце, интрааортальные баллонные насосы):
- приборы для эмболизации:
- эндоваскулярные синтетические сосудистые трансплантаты;
- имплантируемые электроды дефибриллятора и кардиовертера:
- фильтры для нижней полой вены;
- катетеры для внутренней доставки лекарств;
- внутрисосудистые оксигенаторы (искусственные легкие).
- механические или биологические клапаны сердца;
- электроды кардиостимулятора;
- хирургические синтетические или биологические сосудистые протезы;
- стенты кровеносных сосудов.
6 Характеристика процессов взаимодействия медицинских изделий с кровью
6.1 Общие требования
ВНИМАНИЕ — Надежные доказательства могут быть предоставлены для обоснования выбора категорий испытаний для тестирования изделия. Напримор, метод исследование in vivo на наличие тромбоза часто является предпочтительным методом для тестирования изделия в категории тромбоза. Том не менее в отдельных случаях письменные обоснования, которые включают сочетание исследований из категорий свертывания, тромбоцитов, гематологии и комплемента, могут быть использованы в качестве замены исследования тромбоза.
6.1.1 На рисунке 1 приведен алгоритм принятия решения о необходимости проведения испытаний МИ на гемосовместимость. Взаимодействия МИ с кровью подразделяют на несколько категорий в зависимости от измеряемой первичной реакции крови. В таблице 1 приведены примеры МИ. контактирующих с циркулирующей кровью, и категории исследования, соответствующие каждому МИ. Приведенный перечень МИ не является всеобъемлющим. Выбор категории исследования для МИ. не включенных в таблицу, осуществляют с учетом характеристик конкретного МИ и его применения.
Для МИ. на которые существует конкретный международный стандарт (вертикальный стандарт), требования к биологической оценке и методам испытаний, изложенные в этом вертикальном стандарте. имеют приоритет над общими требованиями, установленными в настоящем стандарте.
6.1.2 При исследовании следует использовать адекватную модель или систему, которые имитируют геометрию и условия контакта МИ с кровью при применении по назначению. При моделировании условий контакта МИ с кровью должны быть учтены продолжительность контакта, соответствующие