ГОСТ ISO/TS 21872-1-2013
Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения потенциально энтеропатогенных Vibrio spp. Часть 1. Обнаружение бактерий Vibrio parahaemoliticus и Vibrio cholerae
Распространяется на пищевые продукты и корма для животных и устанавливает горизонтальный метод выявления двух главных патогенных видов Vibrio, вызывающих кишечные болезни у человека: Vibrio parahaemolyticus и Vibrio cholerae. Метод применим также для выявления данных микроорганизмов в объектах окружающей среды в сфере пищевого производства и оборота пищевых продуктов.
Идентичен ISO/TS 21872-1:2007
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Сущность метода
4.1 Общие положения
4.2 Первичное обогащение в селективной жидкой среде
4.3 Вторичное обогащение в жидкой селективной среде
4.4 Выделение и идентификация
4.5 Подтверждение
5 Реактивы и среды
5.2 Плотные среды для выделения
5.2.2 Вторая среда
6 Аппаратура и материалы
7 Отбор проб
8 Приготовление испытуемой пробы
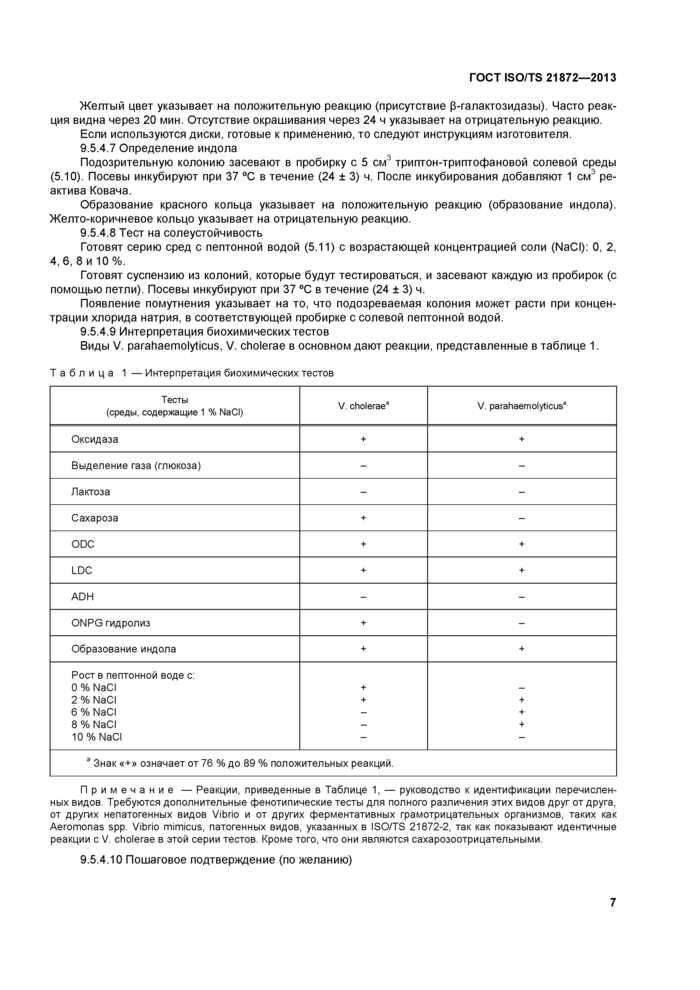
9 Проведение испытания (см. приложение А)
9.1 Проба для испытания и исходная суспензия
9.2 Первичное селективное обогащение
9.3 Вторичное селективное обогащение
9.4 Выявление и идентификация
9.5 Подтверждение
10 Выражение результатов
11 Протокол испытаний
Приложение А (обязательное) Схема проведения испытания
Приложение В (обязательное) Состав и приготовление питательных сред и реактивов
Приложение ДА (справочное) Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
Библиография
21 страница
| Дата введения | 01.07.2015 |
|---|---|
| Добавлен в базу | 21.05.2015 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел Электроэнергия
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
Организации:
| 27.12.2013 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 63-П |
|---|---|---|---|
| 17.03.2014 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 157-ст |
| Разработан | ГНУ ВНИИКОП Россельхозакадемии | ||
| Издан | Стандартинформ | 2014 г. |
Microbiology of food and animal feeding stuffs. Horizontal method for the detection of potentially enteropathogenic Vibrio spp. Part 1. Detection of Vibrio parahaemolyticus and Vibrio choleraе
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12

стр. 13
стр. 14

стр. 15

стр. 16

стр. 17

стр. 18
стр. 19

стр. 20

стр. 21
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
ГОСТ ISO/TS
21872-1—
2013
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ для животныхГоризонтальный метод обнаружения потенциально энтеропатогенных Vibrio spp.Часть 1Обнаружение бактерий Vibrio parahaemoliticus и Vibrio cholerae
Часть 1Обнаружение бактерий Vibrio parahaemoliticus и Vibrio cholerae
(ISO/TS 21872-1:2007, IDT)
Издание официальное
Москва
Стандартинформ
2014
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением Всероссийским научно-исследовательским институтом консервной и овощесушильной промышленности Российской академии сельскохозяйственных наук (ГНУ ВНИИКОП Россельхозакадемии)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (ТК 335)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 декабря 2013 г. № 63-П)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166)004-97 |
Код страны по МК (ИСО 3166)004-97 |
Со«ра1цекмое наименование национального органа no стандартизации |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргызстандарт |
|
Молдова |
MD |
Молд ова-Ста нд а рт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
4 Настоящий стандарт идентичен международному документу ISO/TS 21872-1:2007 Microbiology of food and animal feeding stuffs — Horizontal method for the detection of potentially enteropathogenic Vibrio spp. — Part 1: Detection of Vibrio parahaemolyticus and Vibrio cholerae (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения потенциально энтеролатогенных видов рода Vibrio. Часть 1: Выявление бактерий Vibrio parahaemolyticus и Vibrio cholerae).
Международный документ разработан подкомитетом ISO/ТС 34/SC 9 «Микробиология» Технического комитета по стандартизации ISO/TC 34 «Пищевые продукты» Международной организации по стандартизации (ISO).
Перевод с английского языка (еп).
Официальный экземпляр международного документа, на основе которого подготовлен настоящий межгосударственный стандарт, имеется в Федеральном агентстве по техническому регулированию и метрологии Российской Федерации.
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА
Степень соответствия — идентичная (IDT)
5 Приказом Федерального агентства по техническому регулированию и метрологии от 17 марта 2014 г. № 157-ст межгосударственный стандарт ГОСТ ISO/TS 21872-1-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2015 г.
6 ВВЕДЕН ВПЕРВЫЕ
ГОСТ isonrs 21872—2013
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе « Национальные стандарты». а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ, 2014
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен. тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ isorrs 21872—2013
Содержание
1 Область применения.....................................................................................................................................1
2 Нормативные ссылки....................................................................................................................................1
3 Термины и определения...............................................................................................................................2
4 Сущность метода...........................................................................................................................................2
4.1 Общие положения..................................................................................................................................2
4.2 Первичное обогащение в селективной жидкой среде........................................................................2
4.3 Вторичное обогащение в жидкой селективной среде.........................................................................2
4.4 Выделение и идентификация................................................................................................................2
4.5 Подтверждение.......................................................................................................................................3
5 Реактивы и среды..........................................................................................................................................3
5.2 Плотные среды для выделения............................................................................................................3
5.2.2 Вторая среда........................................................................................................................................3
6 Аппаратура и материалы..............................................................................................................................3
7 Отбор проб.....................................................................................................................................................4
8 Приготовление испытуемой пробы..............................................................................................................4
9 Проведение испытания (см. приложение А)...............................................................................................4
9.1 Проба для испытания и исходная суспензия.......................................................................................4
9.2 Первичное селективное обогащение...................................................................................................4
9.3 Вторичное селективное обогащение....................................................................................................4
9.4 Выявление и идентификация................................................................................................................4
9.5 Подтверждение.......................................................................................................................................5
10 Выражение результатов.............................................................................................................................8
11 Протокол испытаний....................................................................................................................................8
Приложение А (обязательное) Схема проведения испытания....................................................................9
Приложение В (обязательное) Состав и приготовление питательных сред и реактивов.......................10
Приложение ДА (справочное) Сведения о соответствии межгосударственных стандартов
ссылочным международным стандартам..........................................................................14
Библиография.................................................................................................................................................15
IV
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ для животных Горизонтальный метод обнаружения потенциально энтеропатогенных Vibrio spp
Часть 1
Обнаружение бактерий Vibrio parahaemoliticus и Vibrio cholerae
Microbiology of food and animal feeding stuffs.
Horizontal method for the detection of potentially cntcropathogcnic Vibrio spp.
Part 1. Detection of Vibrio parahaemolyticus and Vibrio cholerae
Дата введения — 2015—07—01
ПРЕДУПРЕЖДЕНИЕ — Для гарантии здоровья лабораторного персонала необходимо, чтобы тесты для выявления Vibrio spp. и особенно токсигенного Vibrio cholerae проводились только в лабораториях, специально оснащенных для этих целей, и под руководством опытного микробиолога, и чтобы уделялось особое внимание обеззараживанию зараженного материала.
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и корма для животных и устанавливает горизонтальный метод выявления двух главных патогенных видов Vibrio, вызывающих кишечные болезни у человека: Vibrio parahaemolyticus и Vibrio cholerae.
Метод применим также для выявления данных микроорганизмов в объектах окружающей среды в сфере пищевого производства и оборота пищевых продуктов.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ISO 6887-1 Microbiology of food and animal feeding stuffs — Preparation of test samples, initial suspension and decimal dilutions for microbiological examination — Part 1: General rules for the preparation of the initial suspension and decimal dilutions (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений)
ISO 6887-2 Microbiology of food and animal feeding stuffs — Preparation of test samples, initial suspension and decimal dilutions for microbiological examination — Part 2: Specific rules for the preparation of meat and meat products (Микробиология пищевых продуктов и кормов для животных. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологических исследований. Часть 2. Специальные правила подготовки мяса и мясных продуктов)
ISO 6887-3 Microbiology of food and animal feeding stuffs — Preparation of test samples, initial suspension and decimal dilutions for microbiological examination — Part 3: Specific rules for the preparation of fish and fishery products (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 3. Специальные правила для приготовления рыбы и рыбных продуктов)
Издание официальное
ISO 6887-4 Microbiology of food and animal feeding stuffs — Preparation of test samples, initial suspension and decimal dilutions for microbiological examination — Part 4: Specific rules for the preparation of products other than milk and milk products, meat and meat products, and fish and fishery products (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 4. Специальные правила для приготовления продуктов, кроме молока и молочных продуктов, мяса и мясных продуктов и рыбы и рыбопродуктов)
ISO 7218 Microbiology of food and animal feeding stuffs — General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
ISO 8261 Milk and milk products. General guidance for the preparation of tests samples, initial suspensions and decimal dilutions for microbiological examination (Молоко и молочные продукты — Общие правила приготовления проб для испытаний, исходных суспензий и десятикратных разведений для микробиологических исследований)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 потенциально энтеропатогенные Vibrio parahaemolyticus и Vibrio cholerae: Микроорганизмы. которые образуют типичные колонии на плотной селективной среде и которые обладают описанными биохимическими характеристиками при проведении испытания в соответствии с настоящим стандартом.
3.2 обнаружение потенциально энтеропатогенных Vibrio parahaemolyticus и Vibrio cholerae: Определение присутствия или отсутствия Vibrio parahaemolyticus и Vibrio cholerae в определенном количестве продукта, после проведения испытания в соответствии с настоящим стандартом.
4 Сущность метода
4.1 Общие положения
Метод обнаружения Vibrio parahaemolyticus и Vibrio cholerae состоит из четырех последовательных этапов (см. также приложение А).
Примечание — Vibrio parahaemolyticus и Vibno cholerae могут присутствовать в небольших количествах, часто вместе с гораздо большим количеством других микроорганизмов, относящихся к семейству Vibrionaceae или к другим семействам, поэтому два последовательных обогащения необходимы для выявления определяемых микроорганизмов
4.2 Первичное обогащение в селективной жидкой среде
Среду для обогащения (щелочную солевую пептонную воду. ASPW) (5.1) инокулируют навеской при комнатной температуре. Посевы инкубируют при 37 °С в течение (6 ± 1) ч для глубоко замороженных продуктов или при 41,5 °С в течение (6 ± 1) ч. для свежих продуктов.
4.3 Вторичное обогащение в жидкой селективной среде
Среду для обогащения (ASPW) инокулируют культурой, полученной по 4 2. Посевы инкубируют при 41,5 °С в течение (18 ± 1) ч.
4.4 Выделение и идентификация
Культуры, полученные по 4.2 и 4 3. пересевают на две селективные плотные среды:
- тиосульфат, цитратный. желчный, сахарозый (TCBS) агар:
- другая плотная селективная среда выбирается параллельно среде TCBS. позволяющей выделить Vibrio parahaemolyticus и Vibrio cholerae.
Посевы на среде TCBS инкубируют при 37 °С. посевы просматривают через (24 ± 3) ч Посевы на второй селективной среде инкубируют в соответствии с рекомендациями изготовителя этой среды
ГОСТ ISO/TS 21872—2013
4.5 Подтверждение
Типичные колонии Vibrio parahaemolyticus и Vibrio cholerae, выделенные по 4 4, пересевают и затем подтверждают с помощью биохимических тестов.
5 Реактивы и среды
Примечание — В связи с большим количеством питательных сред и реагентов и для удобства пользования их состав и приготовление представлены в приложении В
5.1 Среда для обогащения: щелочная солевая пептонная вода (ASPW) См. В.1.
5.2 Плотные среды для выделения
5.2.1 Первая среда: тиосульфат, цитратный. желчный, сахарозный (TCBS) агар. см. В 2.
5.2.2 Вторая среда
Выбор второй среды остается за выбором лаборатории, проводящей тест. Приготовление среды должно строго соответствовать инструкциям изготовителя этой среды.
Примечание — Соя пептон трифенил тетразолий хлорид агар (TSAT) и натрия додецил сульфат, полимиксин, сахароза агар (SDSPS), (mCPC, CPC, СС) агары не рекомендуются для выделения Vibrio parahaemolyticus
5.3 Солевой питательный агар (SNA)
См. В.З.
5.4 Реактив для определения оксидазы См. В.4.
5.5 Солевой трехсахарный железистый (TSA) агар См. В.5.
5.6 Солевая среда для определения орнитин декарбоксилазы (ODC)
См. В.6.
5.7 Солевая среда для определения лизин декарбоксилазы (LDC)
См. В.7.
5.8 Солевая среда для определения аргинин дегидролазы (ADH)
См. В 8.
5.9 Реактив для определения р-галактозидазы См. В.9.
5.10 Солевая среда для определения индола См. В. 10.
5.11 Солевые пептонные воды См. В.11.
5.12 Раствор хлорида натрия См. В. 12.
6 Аппаратура и материалы
Примечание — Инструменты одноразового применения — приемлемая альтернатива стеклянной посуде многократного пользования, если они имеют подходящие технические характеристики
Оборудование обычной микробиологической лаборатории (см. ISO 7218) и. в частности, следующее:
6.1 Термостат, регулируемый до (37 ± 1) вС.
6.2 Термостаты или водяные бани, регулируемые до (41.5 ± 1) *С.
6.3 Водяная баня, регулируемая от 44 *С до 47 *С.
6.4 Водяная баня, регулируемая до (37 ± 1) °С.
Рекомендуется использовать водяные бани (6.2, 6.3 и 6.4), содержащие антибактериальный агент. 1
7 Отбор проб
Важно, чтобы для испытания в лабораторию поступила представительная проба, не поврежденная и не измененная в ходе транспортирования или хранения.
Отбор проб не является частью метода, установленного в настоящем стандарте. Отбор проб — по стандарту на конкретный продукт. В случае отсутствия конкретного стандарта на отбор проб продукта рекомендуется, чтобы заинтересованные стороны достигли согласия по процедуре отбора проб.
8 Приготовление испытуемой пробы
Пробу для испытания готовят в соответствии с определенной частью ISO 6887 и/или ISO 8261 или стандарту на конкретный продукт. В случае отсутствия конкретного стандарта рекомендуется, чтобы заинтересованные стороны достигли согласия по данному вопросу.
9 Проведение испытания (см приложение А)
9.1 Проба для испытания и исходная суспензия
Для приготовления исходной суспензии используют первую среду для обогащения (ASPW), указанную в 5.1.
Берут пробу для испытания (х г, или х см1) в соответствии с требованиями, указанными на конкретный продукт, и гомогенизируют ее в 9х см ‘ (или 9х г) среды для обогащения.
В случае больших количеств высеваемого продукта перед внесением навески ASPW должна быть нагрета до 37 °С.
Если разведение продукта и инкубирование посевов не могут быть проведены в тот же день, исходную суспензию хранят до следующего дня при температуре (5 ± 3) °С.
Для уменьшения объема проводимой работы пробы могут быть объединены в случае, когда более чем одна проба (25 г) испытывается от той же партии анализируемого пищевого продукта и когда есть уверенность в том. что смесь (собранные вместе порции пробы) не изменят конечные результаты. связанные с этим продуктом.
Пример — Если анализируют 10 проб для испытаний массой 25 а, возможно их объединение для того, чтобы получить о сумме объединенную пробу массой 250 г и добавить к ней 2,25 дм1 среды для обогащения.
Количество клеток Vibrio parahaemolyticus и Vibrio cholerae значительно снижается за счет хранения при низких температурах. Хранение проб и в меньшей степени суспензий при таких температурах должно быть устранено или сведено к минимуму.
9.2 Первичное селективное обогащение
Инкубируют исходную суспензию (9.1) при 37 °С в течение (6 ± 1) ч для глубоко замороженных, сушеных или соленых продуктов или при 41,5 °С в течение (6 ± 1 ч) для свежих продуктов.
Необходимо особое внимание к применению метода для продуктов с высоким содержанием соли. так как конечная концентрация соли в среде может изменять ее качественные характеристики (см. ISO 6887-4).
9.3 Вторичное селективное обогащение
9.3.1 Переносят 1 см1 культуры, полученной по 9.2. взятой с поверхности, в пробирку, содержащую 10 см1 ASPW (5.1).
9.3.2 Посевы по 9.3.1 инкубируют при 41,5 °С в течение (18 ± 1) ч.
9.4 Выявление и идентификация
9.4.1 Культурами, выросшими на среде ASPW (9.2 и 9.3.2). засевают петлей поверхность чашек с TCBS агаром (5.2.1) так. чтобы обеспечить рост хорошо изолированных колоний.
Аналогично поступают со второй селективной средой (5.2). используя новую петлю (после фламбирования). 2
ГОСТ ISO/TS 21872—2013
9 4 2 Переворачивают чашки Петри с посевами. Чашки с посевами на TCBS агар (9.4.1) помещают в термостат (6.1). установпенный на 37 °С. Посевы на вторую селективную среду инкубируют, спедуя инструкции изготовителя.
9.4.3 Поспе инкубирования посевов (9.4.1 и 9.4.2) в течение (24 ± 3) ч их просматривают на наличие типичных колоний предположительно патогенных Vibrio spp., отмечают их расположение на дне чашки Петри.
Существуют две основные морфологические характеристики для колоний Vibrio spp. на TCBS
агар:
- типичные колонии V. parahaemolyticus гладкие зеленые (сахарозоотрицательные), от 2 до 3 мм в диаметре:
- типичные колонии V. cholerae гладкие, желтые (сахарозоположительные), от 2 до 3 мм в диаметре.
Вторую селективную среду инкубируют при соответствующей температуре в течение соответствующего периода времени, затем проверяют на наличие колоний, которые в соответствии с их характеристиками могут быть отнесены к возможно выделенным V. parahaemolyticus и V. Cholera.
9.5 Подтверждение
9.5.1 Для идентификации Vibrio до вида могут быть использованы разнообразные коммерчески доступные наборы для биохимической идентификации, обеспеченные базой данных или идентификационными таблицами. Наборы инокулируются суспензией определяемых бактерий. Суспензии для инокуляции готовятся в физиологическом растворе или жидкости для разбавления. Наборы для биохимической идентификации основаны на реакциях, полученных при использовании сред, аналогичным тем, которые описаны в настоящем стандарте Данные наборы следует использовать в соответствии с требованиями инструкций изготовителей.
Примечание — Распознавание колоний Vibrio в значительной степени вопрос опыта, их внешний вид может иногда различаться в зависимости не только от вида, а также от партии питательной среды
9.5.2 Отбор колоний для подтверждения и приготовления чистых культур
Для подтверждения пересевают с каждой селективной среды (см. 9.4) по меньшей мере пять колоний, которые считаются типичными для каждого потенциально патогенного вида Vibrio spp. (V. parahaemolyticus. V. cholerae). Если на чашке менее пяти типичных колоний, то пересевают все эти колонии.
Примечание — Пищевые продукты, особенно морепродукты, могут содержать большое число бактерий, включая непатогенные Vibno spp . которые могут расти в процессе культивирования на селективных средах Пересев малого количества колоний может привести к потере потенциально патогенных видов
Пересевают отобранные колонии на поверхность чашек с солевым питательным агаром или поверхность скошенного солевого питательного агара (5.3) для получения изолированных колоний. Посевы инкубируют при температуре 37 °С в течение (24 ± 3) ч.
Для биохимического подтверждения используют чистые культуры.
9.5.3 Тесты для идентификации
9.5.3.1 Тест на оксидазу
Используя петлю из платиново-иридиевого провода или стеклянный стержень, отбирают часть чистой культуры с солевого питательного агара (9.5.2) и проводят по поверхности фильтровальной бумаги, увлажненной реактивом на оксидазу (5.4). или используют коммерческие диски или растворы, следуя инструкциям изготовителя. Не допускается использовать никель-хромовую петлю для отбора или металлическую проволоку. Тест считается положительным, если цвет меняется на розовато-лиловый, фиолетовый или насыщенный фиолетовый в течение 10 с.
9.5.3.2 Микроскопирование
Каждую чистую культуру, полученную по 9.4.2. тестируют в соответствии с а) и Ь) как указано далее.
a) Готовят мазок для окраски по Г раму. После окраски, используя микроскоп, проверяют морфологию и отношение к окраске по Граму.
b) Инокулируют пробирку с щелочной солевой пегттонной водой (ASPW) (5.1). Посев инкубируют при 37 ®С от 1 ч до 6 ч. Наносят каплю культуры на чистую поверхность предметного стекла, накры- 3
вают покровным стеклом и проверяют подвижность культуры под микроскопом. Отбирают культуры, которые показали положительный результат на подвижность.
9.5.3.3 Отбор культур для биохимических тестов
Отбирают для биохимического подтверждения оксидазоположительные, грамотрицательные культуры, которые показывают положительный результат в тесте на подвижность.
9.5.4 Биохимическое подтверждение
9.5.4.1 Используя петлю для посевов, инокулируют среды, указанные в 9.5.4 2 — 9.5.4.8 каждой культурой, полученной из колоний, отобранных по 9.5.3.3.
9.5.4 2 Тест с солевым TSI агаром (5.5)
Инокулируют укалыванием основание столбика агара и проводят вдоль по скошенной поверхности. Посевы инкубируют при 37 °С в течение (24 ± 3) ч.
Результаты интерпретируют следующим образом:
a) Столбик плотной среды:
- желтый: глюкозо-положительный (ферментация глюкозы);
- красный или неизменившийся: глюкозо-отрицательный (нет ферментации глюкозы);
- черный: образование сероводорода;
- пузыри или трещины: образование газа из глюкозы.
b) Скошенная поверхность плотной среды
- желтый: лактозо и/или сахарозо-положительный (ферментация лактозы и/или сахарозы);
- красный или неизменившийся: лактозо и сахарозо-отрицательный (нет ферментации лактозы или сахарозы).
Типичные реакции для Vibrio parahaemolyticus соответствуют щелочной поверхности (красный цвет среды) и кислотному основанию (желтый цвет среды), без образования сероводорода или газа.
Типичные реакции для Vibrio cholerae соответствуют кислотной поверхности (желтый цвет среды) и кислому основанию (желтый цвет среды) без образования сероводорода или газа.
Инкубирование не должно превышать 24 ч. так как желтая поверхность V. cbolerae может через 24 ч преобразоваться в красную.
9.5.4.3 Определение орнитин декарбоксилазы
Инокулируют жидкую солевую среду (5.6) чуть ниже поверхности. Добавляют около 1 см стерильного минерального масла на поверхность среды. Посевы инкубируют при 37 ®С в течение (24 ± 3) ч.
Помутнение и фиолетовый цвет среды после термостатирования указывают на положительную реакцию (бактериальный рост и декарбоксилирование орнитина). Желтый цвет показывает отрицательную реакцию.
9.5.4 4 Определение l-лизин декарбоксилазы
Инокулируют жидкую солевую среду (5.7) чуть ниже поверхности. Добавляют около 1 см стерильного минерального масла на поверхность среды. Посевы инкубируют при 37 °С в течение (24 ± 3) ч.
Помутнение и фиолетовый цвет после инкубирования указывают на положительную реакцию (бактериальный рост и декарбоксилирование лизина). Желтый цвет указывает на отрицательную реакцию.
9.5.4.5 Определение аргинин дигидролазы
Инокулируют жидкую солевую среду (5.8) чуть ниже поверхности. Добавляют около 1 см3 стерильного минерального масла на поверхность среды. Посевы инкубируют при 37 °С в течение (24 ± 3) ч.
Помутнение и фиопетовый цвет после инкубирования указывают на положительную реакцию (бактериальный рост и дигидрирование аргинина). Желтый цвет указывает на отрицательную реакцию.
9.5.4.6 Определение р-галактозидазы
Инокулируют подозрительную колонию в пробирку, содержащую 0.25 см3 солевого раствора (5.12). Добавляют одну каплю толуола и встряхивают пробирку.
Помещают пробирку в водяную баню (6.4). установленную на 37 °С и оставляют ее приблизительно на 5 мин.
Добавляют 0.25 см' реактива для определения Р-галактозидазы (5.9) и перемешивают, после чего пробирку возвращают в водяную баню, установленную на 37 °С. оставляют ее на (24 ± 3) ч. проверяя время от времени.
1
2
3