ГОСТ 34661-2020
Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке канцерогенной активности
Купить ГОСТ 34661-2020 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает требования к оценке канцерогенной активности при внутрижелудочном поступлении химических веществ
| Дата введения | 01.07.2021 |
|---|---|
| Актуализация | 01.01.2022 |
Этот ГОСТ находится в:
- Раздел Общероссийский классификатор стандартов
- Раздел Здравоохранение
- Раздел Фармацевтика
- Раздел Фармацевтика в целом
- Раздел Фармацевтика
- Раздел Здравоохранение
Methods of testing the impact of chemical products on the human body. Testing to evaluate the carcinogenic activity
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13
стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
ГОСТ
34661—
2020
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКАИспытания по оценке канцерогенной активности
Издание официальное
Сшщчш«ф1чи
20»
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия» (ФГУП «СТАН-ДАРТИНФОРМ») на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 июня 2020 г. № 131-П)
|
За принятие проголосовали: | ||||||||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 октября 2020 г. № 913-ст межгосударственный стандарт ГОСТ 34661-2020 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2021 г.
5 Настоящий стандарт является модифицированным по отношению к международному документу OECD Test No 451:2018 «Руководство по испытанию химических веществ. Исследования канцерогем-ности» {«Guideline for Testing of Chemicals. Carcinogenicity Studies», MOD) путем:
* включения дополнительного раздела 1 и дополнительного примечания (подраздел 5.2), которые выделены в тексте курсивом;
- изменения его структуры для приведения в соответствие с правилами, установленными в ГОСТ 1.5 (подразделы 4.2 и 4.3).
Сопоставление структуры настоящего стандарта со структурой указанного международного документа приведено в дополнительном приложении ДА.
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
дозы для выявления основных органов-мишеней и токсического воздействия, избегая при этом страданий. сильной токсичности, болезненности или смерти животных. Принимая во внимание факторы, приведенные ниже, максимальный уровень дозы следует, как правило, выбирать для получения доказательств токсичности, о чем свидетельствует, например, снижение прибавления массы тела (приблизительно на 10 %). Однако в зависимости от целей исследования (см. Введение) может быть выбран уровень максимальной дозы меньше уровня дозы, обеспечивающий выраженность токсичности, например, если уровень дозы вызывает побочные эффекты, которые тем не менее мало влияют на продолжительность жизни или массу тела.
5.3.4 Для установления зависимости доза — ответ могут быть выбраны уровни доз и интервалы между уровнями доз в зависимости от механизма действия исследуемого химического вещества, значения NOAEL или другого предполагаемого результата исследования, например BMD (см. 5.3.5) при самом низком уровне доз. Факторы, которые следует учитывать при введении более низких уровней доз. включают ожидаемый наклон кривой доза — ответ, дозы, при которых могут произойти важные изменения в метаболизме или способе токсического действия, или ожидаемое пороговое значение, или предполагаемую точку отсчета для экстраполяции низких доз.
5.3.5 Выбор интервала между уровнями доз зависит от характеристик исследуемого химического вещества и не может быть установлен в настоящем стандарте, но двух-, четырехкратный интервал, как правило, обеспечивает хороший результат испытания для установления нисходящих уровней доз, и добавление четвертой подопытной группы часто предпочтительнее использования очень больших интервалов (например, более чем в 6—10 раз) между дозами. В целом следует избегать использования кратности, превышающей 10, и использование интервалов должно быть обосновано.
5.3.6 В соответствии с нормативным документом1 > при выборе дозы следует учитывать следующие моменты.
- токсикокинетику и диапазоны доз. при которых происходит или не происходит индукция метаболизма, насыщение или нелинейность между наружным или внутренним введением доз;
- предшествующие поражения, маркеры воздействия или индикаторы функционирования ключевых базовых биологических процессов.
- основные (или предполагаемые) аспекты способа действия, такие как дозы, при которых начинает возникать цитотоксичность, нарушаются уровни гормонов, перегружаются механизмы гомеостаза и т. д.;
- области кривой доза — ответ, в которых требуется особенно надежная оценка, например в диапазоне ожидаемого значения BMD или предполагаемого порогового значения;
- рассмотрение предполагаемых уровней воздействия на человека.
5.3.7 Контрольной группе не вводят исследуемое вещество, а вводят только носитель (растворитель). если его используют при проведении испытания химического вещества. За исключением введения исследуемого химического вещества, с животными контрольной группы обращение такое же. как и с подопытными животными. При использовании носителя контрольная группа получает его в максимальном объеме, используемом для подопытных групп при введении дозы. Если вводимое с пищей исследуемое химическое вещество вызывает значительное сокращение потребления пищи из-за снижения ее вкусовых качеств, может быть полезна дополнительная контрольная группа, получающая одинаковое кормление, служащая для более подходящего контроля.
5.4 Подготовка доз и введение исследуемого вещества
5.4.1 Исследуемое химическое вещество вводят, как правило, перорально с пищей, питьевой водой или через зонд. Дополнительная информация о путях и способах введения приведена в нормативном документе1 >. Путь и способ введения зависят от цели исследования, физико-химических свойств исследуемого химического вещества, его биодоступности, преобладающего пути и способа воздействия на человека. Следует представить обоснование выбранного пути и способа введения. В интересах благополучия животных желудочный зонд обычно следует выбирать только для тех веществ, для которых этот путь и этот метод введения разумно представляют потенциальное воздействие на человека (например, фармацевтические препараты). Введение пищевых или химических соединений, оказывающих вредное воздействие на окружающую среду, включая пестициды, обычно осуществляют
И См. [7].
с пищей или питьевой водой. Однако в некоторых случаях, например при воздействии, связанном с профессиональной деятельностью, более целесообразным может оказаться введение другим путем.
5.4.2 При необходимости исследуемоо химическое вещество растворяют или суспендируют в соответствующем носителе (растворителе). Необходимо обратить внимание на следующие характеристики носителя и других добавок: влияние на абсорбцию, распределение, метаболизм или удерживание исследуемого химического вещества: воздействие на химические свойства исследуемого химического вещества, которое может изменить его токсические характеристики: влияние на потребление пищи, воды или пищевой статус животных. Рекомендуется сначала рассмотреть возможность использования водного раствора/суспензии, затем раствора/эмульсии в масле (например, кукурузном масле), а потом возможность растворения в других носителях. Для носителей, отличных от воды, должны быть известны токсические характеристики. Должна быть в распоряжении информация о стабильности исследуемого химического вещества, однородности вводимых растворов или пищи (при наличии) и условиях введения (например, с пищей).
5.4.3 Для веществ, вводимых с пищей или питьевой водой, важно, чтобы количество исследуемого химического вещества не нарушало нормальное питание или водный баланс. В долгосрочных исследованиях токсичности при использовании введения с пищей содержание химического вещества в пище, как правило, не должна превышать 5 % общего количества пищи для предотвращения нарушения пищевого баланса. При введении исследуемого химического вещества с пищей еженедельно вычисляют ого постоянную концентрацию в пище, при этом используют единицы измерения: мг/кг пищи или ppm. или постоянный уровень дозы в пересчете на массу тела животного, мг/кг массы тела. Следует указать альтернативный вариант при использовании.
5.4.4 При пероральном введении животным ежедневно (7 дней в неделю) вводят исследуемое химическое вещество, обычно в течение 24 мес для грызунов (см. 5.4.5). Любой другой режим введения доз, например 5 дней в неделю, должен быть обоснован. При нанесении на кожу животных обычно подвергают воздействию исследуемого химического вещества не менее 6 ч в день 7 дней в неделю, как установлено в нормативном документе11, в течение 24 мес. Воздействие ингаляционным способом осуществляют в течение 6 ч в день 7 дней в неделю, но можно использовать воздействие в течение 5 дней в неделю, если оно обосновано. Период воздействия, как правило, составляет 24 мес. Если воздействию только через нос подвергают грызунов других видов, кроме крыс, максимальная продолжительность воздействия может быть скорректирована для сведения к минимуму видоспецифического дистресса. При использовании продолжительности воздействия менее 6 ч в день должно быть предоставлено обоснование1 2».
5.4.5 При введении исследуемого химического вещества животным через зонд это делают с использованием соответствующего желудочного зонда или интубационной канюли каждый день в одно и то же время. Обычно однократную дозу вводят один раз в день, но если, например, вещество является местным раздражителем, для обеспечения суточной дозы можно использовать дробное введение дозы (два раза в день). Максимальный объем жидкости, которую можно вводить за один раз. зависит от размера подопытного животного. Объем должен быть по возможности небольшим и не превышать 1 сма/100 г массы тела для грызунов3'. Вариабельность объема вводимого вещества должна быть сведена к минимуму путем корректировки концентрации для обеспечения постоянного объема на всох уровнях дозы. Потенциально разъедающие или раздражающие вещества являются исключением, и их необходимо разбавлять для предотвращения тяжелых местных воздействий. Следует избегать испытаний в концентрациях, которые могут вызвать разъедание или раздражение желудочно-кишечного тракта.
5.5 Продолжительность исследования
Продолжительность исследования для грызунов обычно составляет 24 мес, что составляет большую часть нормальной продолжительности жизни используемых животных. Могут быть использованы более короткие или более длинные продолжительности исследования, в зависимости от продолжительности жизни линии вида животного в исследовании, но они должны быть обоснованы. Для конкретных линий мышей, например линий AKR/J, C3H/J или C57BL/6J. более подходящей может быть
продолжительность 18 мес. Ниже приведены некоторые рекомендации по продолжительности исследования, по его окончанию и по выживаемости. Дополнительные указания, включая рассмотрение вопроса о приемлемости отрицательного результата канцерогенности относительно выживаемости в исследовании, приведены в нормативном документе1'.
Следует рассмотреть вопрос о прекращении исследования, когда число выживших животных в группах с более низкой дозой или в контрольной группе падает ниже 25 %.
Если из-за токсичности преждевременно умирает только группа с высокими дозами, это не должно приводить к прекращению исследования.
Выживание животных каждого пола следует рассматривать отдельно.
Исследование не следует расширять за пределы, когда полученных в исследовании данных уже недостаточно для проведения статистически обоснованной оценки.
6 Наблюдения
Всех животных следует проверять на наличие заболеваемости или смерти — обычно в начале и в конце каждого дня. в том числе в выходные и в праздничные дни. Животных также следует дополнительно {один раз в день) проверять на наличие специфических токсикологически значимых признаков, с учетом пикового периода ожидаемых эффектов после введения доз через желудочный зонд. Особое внимание следует уделять развитию опухоли. Следует зарегистрировать время возникновения опухоли, ее местоположение, размеры, внешний вид и прогрессирование каждой видимой невооруженным глазом или пальпируемой опухоли.
6.1 Масса тела, потребление пищи/воды и эффективность пищи
Все животных взвешивают в начале исследования и не менее одного раза в неделю в течение первых 13 недель, а затем не менее одного раза в месяц. Измерения потребления пищи и ее эффективности следует проводить не реже одного раза в неделю в течение первых 13 недель и не реже одного раза в месяц — в последующий период. Потребление воды при введении вещества с питьевой водой следует измерять не менее одного раза в неделю в течение первых 13 недель и впоследствии — не реже одного раза в месяц. Если во время исследования изменяется активность потребления воды, следует также предусмотреть измерение ее потребления.
6.2 Гематология, клиническая биохимия и другие исследования
В целях максимального использования информации, полученной в результате исследования, особенно в отношении механизма действия, по усмотрению руководителя исследования могут быть взяты образцы крови для гематологии и клинической биохимии. Анализ мочи также может быть уместным. Дополнительные сведения относительно полезности отбора таких проб в рамках исследования канцерогенности содержатся в нормативном документе’1. Если это признано целесообразным, забор крови для гематологических и клинико-химических исследований и анализ мочи могут быть проведены в рамках промежуточного умерщвления (см. 5.2) и по окончании исследования не менее чем у 10 животных каждого пола в каждой группе. Образцы крови должны быть взяты из указанного места, например путем пункции сердца или из ретроорбитальной пазухи под анестезией, и должны храниться при соответствующих условиях. Мазки крови также могут быть подготовлены для исследования, особенно если органом-мишенью является костный мозг несмотря на то. что ценность такого исследования для оценки канцерогенного/онкогенного потенциала была поставлена под сомнение2».
7 Патологическое исследование
7.1 Общая некропсия
7.1.1 Все животные в исследовании, за исключением животных сателлитных (сигнальных) групп (см. 5.2) должны быть подвергнуты полной и подробной общей некропсии, включающей тщательное исследование наружной поверхности тела, всех отверстий, а также черепной, грудной и брюшной по-
11 См. [7].
21 См. [32].
лостей и их содержимого. Может потребоваться некропсия животных сателлитмых (сигнальных) групп в зависимости от конкретного случая по усмотрению руководителя исследования. Массы органов обычно не являются частью исследования канцерогенеза, поскольку гериатрические изменения и развитие опухолей на более поздних стадиях ставят под сомнение полезность данных о массе органов. Вместе с тем они могут иметь решающее значение при проведении оценки весомости доказательств, особенно для соображений, касающихся способов действий. Если они являются частью исследования сателлит-ных (сигнальных) групп, их следует получать не позднее чем через год после начала исследования.
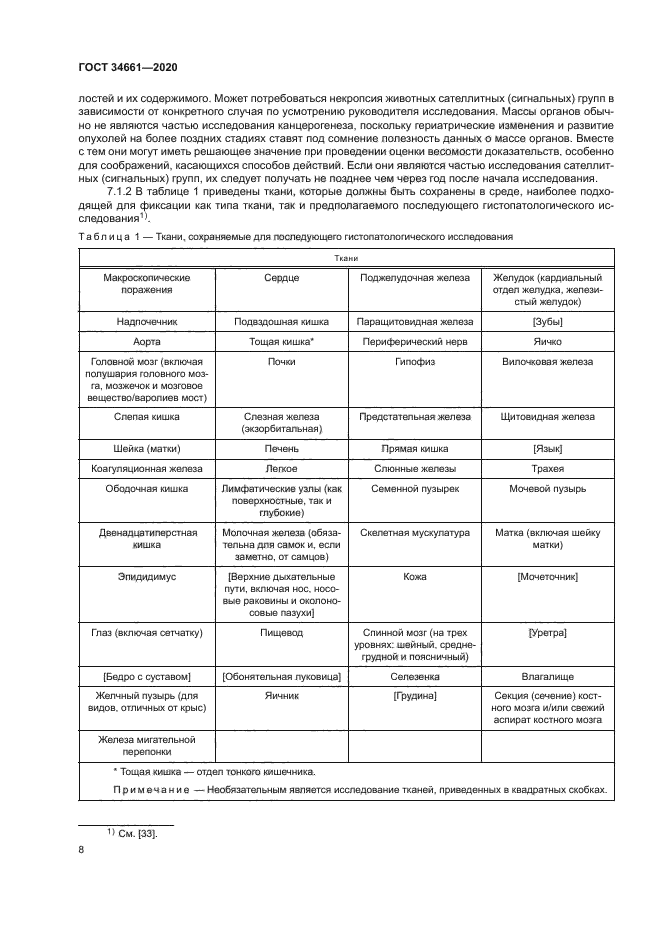
7.1.2 В таблице 1 приведены ткани, которые должны быть сохранены в среде, наиболее подходящей для фиксации как типа ткани, так и предполагаемого последующего гистолатологического исследования^.
|
Таблица 1 — Ткани, сохраняемые для последующего гистолатологического исследования | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
’> См. (33]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В случае парных органов, например почек, надпочечников, должны быть сохранены оба органа. Результаты клинических и других исследований могут указывать на необходимость изучения дополнительных тканей. Кроме того, следует сохранить органы, которые могут быть органами-мишенями на основе известных свойств исследуемого химического вещества. В исследованиях, связанных с нанесением на кожу, список органов, указанных для перорального пути, должен быть сохранен. С учетом специфики воздействия важное значение имеет взятие и консервация (сохранение) кожи с места нанесения исследуемого вещества. При ингаляционных исследованиях перечень сохраняемых и исследуемых тканей дыхательных путей должен соответствовать нормативным документам’». Для других органов/тканей (в дополнение к специфически сохраненным тканям дыхательного тракта) должен быть рассмотрен перечень органов, сохранение которых установлено для орального введения.
7.2 Гистопатология
Практические рекомендации по проведению токсикологических патологоанатомических исследований приведены в документе4 5'. Должны быть исследованы следующие ткани:
- все ткани животных с большой дозой и контрольных групп;
- все ткани животных, умерших или гуманно умерщвленных во время исследования:
- все ткани, показывающие макроскопические аномалии, включая опухоли;
- когда в группе с высокими дозами наблюдают гистопатологические изменения, связанные с воздействием исследуемого вещества, эти же ткани должны быть исследованы у всех животных во всех других группах доз:
- в случае парных органов, например почек, надпочечников, следует исследовать оба органа.
8 Данные испытаний и отчет
8.1 Данные испытаний
8.1.1 Для всех оцениваемых параметров должны быть представлены данные по отдельным животным. Кроме того, все данные должны быть обобщены в табличной форме с указанием: числа животных в каждой подопытной группе в начале испытания, числа животных, обнаруженных мертвыми во время испытания или умерщвленных по соображениям гуманности; времени гибели или гуманного умерщвления: числа признаков токсичности; времени начала и описания наблюдаемых признаков токсичности. включая продолжительность и тяжесть любых токсических эффектов; числа животных с проявлениями патологического изменения; типа поражения и процента животных с отображением каждого вида поражения. В дополнение к классификации поражений сводные таблицы данных должны содержать средние значения и стандартные отклонения (для данных непрерывных испытаний) относительно животных с выявленными токсическими эффектами или поражениям.
8.1.2 При интерпретации результатов исследования могут быть полезны исторические контрольные данные, например при наличии признаков того, что предоставленные параллельные и контрольные данные существенно выходят за рамки по сравнению с последними данными от контрольных животных из того же испытательного центра/группы. При оценке исторических контрольных данных они должны быть представлены из той же лаборатории и относиться к животным того же возраста и линии, полученным в течение пяти лет. предшествующих данному исследованию
8.1.3 Когда это применимо, численные результаты должны оцениваться с помощью соответствующих и общепринятых статистических методов. Статистические методы и данные, подлежащие анализу, должны быть выбраны в ходе разработки дизайна исследования (см. 2.3). Выборочная совокупность должна предусматривать корректировку на выживание, при необходимости.
8.2 Отчет об испытании
Отчет об испытании должен включать следующую информацию:
8.2.1 Исследуемое вещество:
- физические свойства, чистота и физико-химические свойства;
- идентификационные данные;
- поставщик вещества;
- номер партии:
- сертификат химического анализа.
8.2.2 Носитель (растворитель), при использовании:
- обоснование выбора носителя (если это не вода).
8.2.3 Подопытные животные:
- используемый вид/линия и обоснование выбора;
- число, возраст и пол животных в начале испытания;
- источник, условия содержания, кормления и т. д.;
- индивидуальные массы животных в начале испытания.
8.2.4 Условия испытания:
- обоснование способа введения и выбора дозы;
- по возможности, статистические методы, использованные для анализа данных;
- детали химического состава исследуемого вещества/подготовки пищи;
- аналитические данные о достигнутой концентрации, стабильности и гомогенности препарата:
- способ введения дозы и детали введения исследуемого химического вещества;
- при ингаляционном воздействии, только через нос или все тело;
- фактические дозы (мг/кг массы тела в день) и коэффициент пересчета концентрации в пище/питьевой воде исследуемого химического вещества на фактическую дозу (мг/кг или ppm), при применении;
- детали качества пищи и воды.
8.3 Результаты
Результаты должны быть представлены в виде сводных табличных данных и индивидуальных данных для животных.
8.3.1 Общие сведения:
- данные о выживании;
- масса тела/изменение массы тела:
- потребление пищи, определение пищевой эффективности (если проведено) и потребление воды (если предусмотрено);
- токсикокинетические данные (при наличии);
- офтальмоскопия (при наличии);
- гематология (при наличии);
- клиническая химия (при наличии).
8.3.2 Клинические данные;
- признаки токсичности;
- частота возникновения (и. если отмечено, серьезность) любой аномалии:
- характер, серьезность и продолжительность клинических наблюдений (как преходящих, так и необратимых).
8.3.3 Данные некропсии:
- конечная масса тела:
- масса органов и их соотношения (если предусмотрено);
- результаты некропсии. частота и тяжесть аномалий.
8.3.4 Гистопатология:
- результаты гистопатологического исследования, не связанные с новообразованиями:
- гистопатологические данные, связанные с новообразованиями;
- корреляция между макроскопическими и микроскопическими результатами;
- подробное описание всех гистопатологических результатов, связанных с введением вещества, включая классификацию степени тяжести;
- отчет о любом сравнительном исследовании.
8.3.5 Статистическая обработка результатов в зависимости от требований.
8.3.6 Обсуждение результатов должно содержать:
- обсуждение любых подходов к моделированию;
- зависимость доза — ответ;
■ исторические контрольные данные;
- рассмотрение информации о любом способе действия.
- результаты определения BMD. NOAEL или LOAEL;
- актуальность для человека.
8.4 Заключение о результатах исследований.
Приложение ДА (справочное)
Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа
|
Таблица ДА.1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||
|
Примечание — После заголовков разделов настоящего стандарта приведены в скобках номера аналогичных им параграфов международного документа. |
Библиография
(1] OECD (1995). Report of the Consultation Meeting on Sub-chronic and Chronic Toxicity/Carcinogenicity Testing (Rome, 1995). internal working document. Environment Directorate. OECD. Paris
(2] EPA(2005). Guidelines for Carcinogen Risk Assessment Forum U.S. Environmental Protection Agency Washington. DC
htto:iVcfpub.epa.qov.lnceai'cfm''recordisplav.cfm?deid=116283&CFID=1267360&CFTOKEN= 65052793&isessionid=9830b2c4116e3d8fbbf017414e1 a782e7f79TR
(3] Combes RD. Gaunt I. Balls M (2004). A Scientific and Animal Welfare Assessment of the OECD Health Effects Test Guidelines for the Safety Testing of Chemicals under the European Union REACH System. ATLA32. 163—208
(4] Bartow SM, Greig JB. Bridges JW et al (2002). Hazard Identification by Methods of Animal-based Toxicology. Food. Chem. Toxicol. 40. 145—191
(5] Chhabra RS, Bucher JR. Wolfe M, Portier C (2003). Toxicity Characterization of Environmental Cemicals by the US National Toxicology Programme: an overview. Int. J. Hyg. Environ. Health. 206. 437—445
(6] OECD (1998), Repeat Dose 90-day Oral Toxicity Study in Non-Rodents. Test Guideline № 409, OECD Guidelines for the Testing of Chemicals. OECD. Paris1*
(7] OECD (2009). Draft Guidance Document on the Design and Conduct of Chronic Toxicity and Carcinogenicity Studies. Series on Testing and Assessment No. 116. available on the OECD public svebsite for Test Guideline at www.oeod.org/env/testguidelines
(8J OECD (2009). Guidance Document on Acute Inhalation Toxicity Testing, Series on Testing and Assessment No. 39. ENV/JM/MONO<2009)28. OECD. Paris
[9] OECD (2009), Subacute Inhalation Toxicity: 28-Day Study. Test Guideline No. 412. OECD Guidelines for the Testing of Chemicals. OECD. Paris6 7'
[10] OECD (2009). Subchronic Inhalation Toxicity: 90-Day Study. Test Guideline No. 413. OECD Guidelines for the Testing of Chemicals. OECD. Paris8'
[11] OECD (1981), Repeated Dose Dermal Toxicity: 21/28-day Study. Test Guideline № 410. OECD Guidelines for the Testing of Chemicals. OECD. Paris9'
[12] Boobis, A.R.. Cohen. S.M.. Dellarco. V.. McGregor. D.. Meek. M.E.. Vickers. C.. Willcocks. D. & Farland. W. IPCS Framework for analyzing the Relevance of a Cancer Mode of Action for Humans. CriL Rev. in Toxicol. (2006) 36. 793—801
[13] Cohen. S.M.. Meek, M.E.. Klaunig. J.E., Patton. D.E.. and Fenner-Crisp, P.A. (2003) The human relevance of information on carcinogenic Modes of Action: An Overview. Crit. Rev. Toxicol. 33, 581—589
[14] Holsapple. M.P.. Pitot. H.C., Cohen. S.N., Boobis. A.R., Klaunig. J.E.. Pastcor, T.. Dellarco. V.L. & Dragan. Y.P. (2006) Mode of Action in Relevance of Rodent Liver Tumors to Human Cancer Risk. Toxicol. Sci. 89. 51—56
[15] Meek. E.M., Bucher. J.R.. Cohen. S.M.. Dellarco. V., Hill. R.N.. Lehman-McKemmon. L.D.. Longfellow. D.G.. Pastoor. T, Seed. J. & Patton. D.E. A Framework for Human Relevance analysis of Information on Carcinogenic Modes of Action. Crit. Rev. Toxicol. (2003). 33. 591—653
Информация о введении в действие (прекращении действия) настоящего стандарта и uat/e-нений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случав пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
©Стандартинформ, оформление. 2020
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
[16] Carmichael NG. Barton HA, Boobis AR et al (2006). Agricultural Chemical Safety Assessment: A Multisector Approach to the Modernization of Human Safety Requirements. Critical Reviews in Toxicology. 36. 1—7
[17] Barton HA, PastoorTP. BaetckeTetal (2006). The Acquisition and Applicationof Absorption. Distribution. Metabolism, and Excretion (ADME) Data in Agricultural Chemical Safety Assessments. Critical Reviews in Toxicology. 36.9—35
[18] Doe JE. Boobis AR. Blacker A et al (2006). A Tiered Approach to Systemic Toxicity Testing for Agricultural Chemical Safety Assessment. Critical Reviews in Toxicology 36. 37—68
[19] Cooper RL. Lamb JS. Barlow SM et al (2006). A Tiered Approach to Life Stages Testing for Agricultural Chemical Safety Assessment. Critical Reviews in Toxicology. 36. 69—98
[20] OECD (2002). Guidance Notes for Analysis and Evaluation of Chronic Toxicity and Carcinogenicity Studies. Series on Testing and Assessment No. 35 and Series on Pesticides No. 14. ENV/JM/MONO(2002)19. OECD. Paris
[21] OECD (2000). Guidance Document on the recognition, assessment, and use of clinical signs as humane endpoints for experimental animals used in safety evaluation. Series on Testing and Assessment No. 19. ENV/JM/ MONO(2000)7. OECD, Paris
[22] Rhomberg, LR. Baetcke. K, Blancato. J. Bus, J. Cohen. S. Conotly. R. Dixit R. Doe. J. Ekelman. K. Fenner-Crisp. P, Harvey. P. Hattis. D. Jacobs, A. Jacobson-Kram. D. Lewandowski. T. Litepfo. R. Pelkonen. O. Rice. J. Somers. D. Turturro, A. West. W. Olin. S. Issues in the Design and Interpretation of Chronic Toxicity and Carcinogenicity Studies in Rodents: Approaches to Dose Selection Crit Rev. Toxicol. 37 (9). 729—837 (2007)
[23] ILSI (International Life Sciences Institute) (1997). Principles for the Selection of Doses in Chronic Rodent Bioassays. Foran JA (Ed.). ILSI Press, Washington. DC.
[24] Griffiths SA, Parkinson C. McAuslane JAN and Lumley CE (1994) The utility of the second rodent species in the carcinogenicity testing of pharmaceuticals. The Toxicologist 14(1):214.ork
[25] Usui T, Griffiths SA and Lumley CE (1996). The utility of the mouse for the assessment of the carcinogenic potential of pharmaceuticals. In D'Arcy POF & Harron DWG (eds). Proceedings of the Third International Conference on Harmonisation. Queen's University Press, BelfasL pp: 279—284
[26] Carmichael NG. Enzmann H. Pate I, Waechter. F (1997). The Significance of Mouse Liver Tumor Formation for Carcinogenic Risk Assessment: Results and Conclusions from a Survey of Ten Years of Testing by the Agrochemical Industry. Environ Health Perspect 105.1196—1203
[27] EEC Council Directive 86/609/EEC on the approximation of laws, regulations, and administrative provisions of the Member States regarding the protection of animals used for experimental and other scientific purposes. Official Journal 29. L358. 18 December 1986
[28] National Research Council, 1985. Guide for the care and use of laboratory animals. NIH Publication No. 86-23. Washington. D.C.. US Dept, of Health and Human Services
[29] GV-SOLAS (Society for Laboratory Animal Science. Gesellschaft fur Versuchstierkunde. 1988). Publication on the Planning and Structure of Animal Facilities for Institutes Performing Animal Experiments. ISBN 3-906255-04-2. http:// wvnv.gv-solas .de/pubt'heft 1 _1988. pdf
[30] GV-SOLAS (Society for Laboratory Animal Science. Gesellschaft fur Versuchstierkunde. 2006). Microbiological monitoring of laboratory animals in various housing systems. http://www.gv-solas.de/auss/hyg/*hyg-p7_e.html
[31] Diehl K-H. Hull R. Morton D. Pfister R. Rabemampianina Y. Smith D, Vidal J-M. van de Vorstenbosch C. 2001. A good practice guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology, 21.15—23. Available at: http://wvAv.ff.up.pt/farmacologial'pdf/good _practice_lab_animate.pdf
[32] Weingand. K.. et al. 1996. Harmonization of Animal Clinical Pathology Testing in Toxicity and Safety Studies. Fund. Appl. Toxicol. 29. 198—201
[33] Crissman. J.. Goodman D.. Hildebrandt P.. et al. (2004). Best Practices Guideline: Toxicological Histopathology. Toxicologic Pathology. 32. 126—131
Содержание
1 Область применения.................................................................1
2 Основные положения.................................................................1
3 Правила проведения испытаний........................................................2
4 Описание метода....................................................................3
5 Проведение испытаний...............................................................4
6 Наблюдения........................................................................7
7 Патологическое исследование.........................................................7
8 Данные испытаний и отчет.............................................................9
Приложение ДА (справочное) Сопоставление структуры настоящего стандарта
со структурой примененного в нем международного документа.................12
Библиография................ 14
Введение
Руководства Организации экономического сотрудничества и развития (OECD) по испытаниям химических веществ периодически пересматриваются для приведения в соответствие с новыми научными данными, изменяющимися методами оценки и в целях гуманного обращения с животными. Предыдущая версия данного документа по исследованию канцерогенности была принята в 1981 г. Пересмотр руководства был признан необходимым для отражения последних достижений в области защиты животных и нормативных требований'1. Работа над документом проводилось параллельно с пересмотром рекомендаций по испытанию OECD Test No 452 «Исследования хронической токсичности» и OECD Test No 453 «Исследования комбинированной хронической токсичности/канцерогенности» с целью получения дополнительной информации о животных, использованных в исследованиях, и подробного описания выбора дозы. Настоящее руководство предназначено для использования при испытаниях широкого спектра химических веществ, включая пестициды и промышленные химические вещества. Однако следует отметить, что некоторые подробности и требования к фармацевтическим препаратам могут различаться (см. руководство S1B Международной конференции по гармонизации (ICH) по испытанию на канцерогенность фармацевтических препаратов).
Большинство исследований канцерогенности проводят на разных видах грызунов и поэтому предназначено, в первую очередь, для проведения исследований на этих видах животных.
Если проведение таких исследований потребует использования других видов животных, кроме грызунов, принципы и процедуры, изложенные в настоящем руководстве и в OECD Test N<? 409 (90-дневное исследование пероральной токсичности), следует использовать при исследовании других видов животных21 с соответствующими изменениями. Подробное руководство приведено в OECD Test No 116 по разработке и проведению исследований хронической токсичности и канцерогенности10 11.
При исследованиях канцерогенности используют три основных способа введения вещества — пероральный, кожный и ингаляционный. Выбор способа введения зависит от физических и химических характеристик исследуемого химического вещества и преобладающего способа воздействия на человека. Дополнительная информация о выборе пути воздействия представлена в нормативном документе11.
В настоящем руководстве основное внимание уделяется оральному введению, которое чаще всего используется в исследованиях канцерогенности. Несмотря на то, что исследования канцерогенности. связанные с воздействием вещества через кожу или ингаляционным путем, также могут быть необходимы для оценки риска для здоровья человека и/или могут потребоваться при определенных режимах регулирования, эти способы воздействия связаны со значительной технической сложностью. Такие исследования будет необходимо разработать для каждого конкретного случая, однако результаты оценки при пероральном введении могут послужить основой процедуры исследований при ингаляционном и/или кожном воздействии относительно периодов воздействия, характеристик клинических и патологических параметров и т. д. Имеются руководства OECD по введению исследуемых химических веществ кожным11 и ингаляционным путями41. При разработке долгосрочных исследований, связанных с ингаляционным воздействием, следует руководствоваться OECD Test No 4125> и OECD Test № 4136) вместе с соответствующим документом OECD по острым ингаляционным испытаниям71. При проведении испытаний путем нанесения на кожу следует обратиться к OECD Test № 41081.
Исследование канцерогенности дает информацию о возможных опасностях для здоровья, которые могут возникнуть в результате повторного воздействия в течение всей продолжительности жизни животных используемых видов. Исследование позволит получить информацию о токсическом действии вещества, включая потенциальную канцерогенность. и указать органы-мишени и возможность
кумуляции. Оно позволит получить оценку уровня наблюдаемого отсутствия отрицательного воздействия для токсических эффектов и (в случае негенотоксичных канцерогенов) для ответа опухоли, которые могут быть использованы для установления критериев безопасности при воздействии на человека. Также подчеркивается необходимость тщательных клинических наблюдений за животными, чтобы получить по возможности больше информации.
Целями исследований канцерогенности. на которые распространяется настоящий стандарт, являются:
- выявление канцерогенных свойств химического вещества, приводящих к увеличению частоты новообразований, увеличению доли злокачественных новообразований или сокращению времени появления новообразований по сравнению с одновременными контрольными группами;
- идентификацию органа(ов)-мишени(ей) канцерогена;
- определение времени появления новообразований;
- характеристику зависимости доза — ответ опухоли;
- определение уровня наблюдаемого отсутствия неблагоприятного воздействия (NOAEL) или исходной точки для установления контрольной дозы [«бенчмарк-дозы». (BMD)];
- экстраполяцию канцерогенных эффектов на уровни воздействия низких доз на человека.
- представление данных для проверки гипотез о способе действия11. 12
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Испытания по оценке канцерогенной активности
Methods of testing the impact of chemical products on the human body.
Testing to evaluate the carcinogenic activity
Дата введения — 2021—07—01
1 Область применения
Настоящий стандарт устанавливает требования к оценке канцерогенной активности при внутрижелудочном поступлении химических веществ.
2 Основные положения
2.1 При изучении и оценке потенциальной канцерогенности химического вещества испытательной лабораторией перед проведением исследования должна быть учтена вся имеющаяся информация об исследуемом химическом веществе, чтобы сконцентрировать план исследования на более эффективном испытании канцерогенного потенциала и минимизировать использование животных. Особенно важно рассмотреть информацию о способе действия предполагаемого канцерогена12, поскольку оптимальный дизайн исследования может отличаться в зависимости от того, является ли вещество известным или предполагаемым генотоксическим канцерогеном. Руководство по дальнейшим действиям можно найти в нормативном документе2».
2.2 В разработке дизайна исследования может помочь информация, включающая в себя: идентификацию. химическую структуру и физико-химические свойства исследуемого химического вещества; результаты испытаний на токсичность in vitro или in vivo, включая испытания на генотоксичность. предполагаемое(ые) использование(я) и потенциал воздействия на человека; имеющиеся данные количественных соотношений структура — активность (Q SAR данные), мутагенность/гвнотоксичность, канцерогенность и другие токсикологические данные о структурно родственных веществах и токсикоки-нетические данные (однократная доза, а также кинетика повторных доз. при наличии) и данные, полученные из других исследований повторного воздействия. Оценку канцерогенности следует проводить после получения исходной информации о токсичности химического вещества на основании результатов повторных 28-дневных и/или 90-дневных испытаний на токсичность. Краткосрочные испытания, способствующие инициации рака, также могут предоставить полезную информацию. Поэтапный подход к испытанию на канцерогенность следует рассматривать как часть общей оценки потенциальных вредных воздействий конкретного химического вещества3*.
2.3 До начала исследования должны быть установлены статистические методы, наиболее подходящие для анализа полученных результатов, с учетом плана и целей эксперимента. При этом рассматривают следующие вопросы; должны ли статистические методы включать корректировку на выжива-
См. (2), [7]. [12]—(15]. 2) См. [7].
3> См. [16]—[19]. 13
емость; анализ кумулятивных рисков развития опухоли относительно продолжительности выживания, анализ времени до опухоли и анализ в случае преждевременного умерщвления одной или нескольких групп. Руководство по соответствующему статистическому анализу и основные ссылки на международно признанные статистические методы приведены в нормативном документе1*, а также в руководящем документе по анализу и оценке исследований хронической токсичности и канцерогенное™14 15*.
2.4 При проведении исследования канцерогенное™ всегда следует соблюдать руководящие принципы и положения, изложенные в нормативном документе16*, касающиеся распознавания, оценки и использования клинических признаков в качестве гуманных конечных точек для подопытных животных, используемых при оценке безопасности. В вышеуказанном нормативном документе говорится, что «В исследованиях, включающих повторное введение доз при проявлении у животного прогрессирующих клинических признаков, приводящих к дальнейшему ухудшению состояния, должно быть принято обоснованное решение об умерщвлении животного гуманным способом. Решение должно включать рассмотрение вопроса о ценности информации, получаемой при продолжении исследования этого животного, относительно его общего состояния. При принятии решения продолжить испытания на животном, должна быть увеличена частота наблюдений, при необходимости. Также допускается, не оказывая отрицательного влияния на цель испытания, временно прекратить введение доз, если это позволит ослабить боль или дистресс животного или уменьшить исследуемую дозу».
2.5 Подробное руководство и обсуждение принципов выбора дозы для исследований хронической токсичности и канцерогенное™ приведено в нормативном документе1*, а также в нормативных документах17*. Стратегия выбора уровня дозы зависит от основной цели или задач исследования (см. Введение). При выборе соответствующих уровней доз следует обеспечить баланс между скринингом опасности — с одной стороны и характеристикой реакций на низкие дозы и их актуальностью — с другой. Это особенно важно в ситуации, когда необходимо провести комбинированное исследование хронической токсичности и канцерогенное™ (см. 2.6).
2.6 Следует рассмотреть возможность проведения комбинированного исследования хронической токсичности и канцерогенное™ (OECD Test № 453), а не выполнения отдельно исследования хронической токсичности (OECD Test No 452) и исследования канцерогенное™ по настоящему стандарту. Комбинированное исследование обеспечивает ббльшую эффективность с точки зрения затрат времени (по сравнению с проведением двух отдельных исследований) без ущерба для качества данных при исследовании хронической токсичности или канцерогенное™. Однако при проведении комбинированного исследования хронической токсичности и канцерогенное™ (OECD Test No 453) следует тщательно учитывать принципы выбора дозы (см. 2.5 и 5.3.2—5.3.6), кроме того следует учитывать, что в соответствии с определенными нормативными рамками может потребоваться проведение отдельных исследований.
2.7 Определения терминов, применяемых в настоящем стандарте, приведены в нормативном документе1*.
3 Правила проведения испытаний
Исследуемое химическое вещество вводят ежедневно в градуированных дозах нескольким группам подопытных животных в точение большей части их жизни, обычно пероральным способом. Также может быть рекомендовано проведение испытания ингаляционного воздействия исследуемого химического вещества или путем нанесения на кожу. За животными внимательно наблюдают для обнаружения признаков токсичности и развития опухолевых очагов. Животных, пожбших или умерщвленных во время испытания, подвергают вскрытию, выживших животных при завершении испытания также умерщвляют и подвергают вскрытию.
4 Описание метода
4.1 Выбор вида животных
4.1.1 Настоящий стандарт в основном распространяется на изучение и оценку канцерогенного воздействия на грызунов (см. Введение). Использование других видов животных может быть рассмотрено при наличии данных, свидетельствующих о их большей актуальности для прогнозирования воздействия на здоровье человека. Выбор вида животных должен быть обоснован. Предпочтительным видом грызунов являются крысы, однако можно использовать и другие виды грызунов, например, мышей. Несмотря на то. что использование мышей в испытаниях на канцерогенное воздействие может иметь ограниченное значениеЧ для некоторых нормативных программ все еще необходимы испытания кан-церогенности на мышах. Крысы и мыши являются предпочтительными подопытными животными из-за их относительно короткой продолжительности жизни, широкого использования в фармакологических и токсикологических исследованиях, восприимчивости к индукции опухоли и доступности достаточно охарактеризованных линий. Вследствие этого доступно большое количество информации по их физиологии и патологии. Дополнительная информация о выборе видов и линий животных приведена в нормативном документе2*.
4.1.2 Используют молодых, здоровых, половозрелых животных обычно применяемых лабораторных линий. Исследование канцерогенности следует проводить предпочтительно на животных той же линии и из того же источника, что и те. которых использовали в предварительном(ых) исследовании(ях) токсичности более короткой продолжительности, однако если известно, что животные этой линии и из того же источника имели проблемы в достижении обычно принятых критериев выживаемости при долгосрочных исследованиях2>, следует рассмотреть вопрос об использовании линии животных, имеющих приемлемую выживаемость при долгосрочном исследовании. Самки должны быть нерожавшими и небеременными.
4.2 Условия содержания и кормления
Животные могут содержаться индивидуально или небольшими группам и одного пола. Индивидуальное содержание следует рассматривать только в том случае, если оно научно обосновано31. Клетки должны быть расположены таким образом, чтобы возможные последствия, связанные с размещением клетки. были сведены к минимуму. Температура в помещении для подопытных животных должна составлять (22 ± 3) °С. Относительная влажность должна быть не менее 30 % и не превышать 70 %, кроме времени уборки помещения, оптимальная влажность — от 50 % до 60 %. Освещение должно быть искусственным с чередованием периодов света (12 ч) и темноты (12 ч). Для кормления можно использовать обычные лабораторные рационы с неограниченным количеством питьевой воды. Корм должен отвечать всем пищевым потребностям подопытных животных, а содержание примесей, включая остаточные количества пестицидов, стойких органических загрязнителей, фитоэстрогенов, тяжелых металлов и микотоксинов. которые могут повлиять на результаты испытания, должно быть по возможности низким. Аналитическую информацию об уровнях содержания питательных веществ и пищевых загрязнителей следует периодически проверять (как минимум) в начале исследования и при получении новой партии пищи и включать в окончательный отчет. Аналитическую информацию о качестве питьевой воды, используемой в исследовании, следует предоставлять аналогичным образом. На выбор рациона может повлиять необходимость обеспечения подходящей смеси с исследуемым химическим веществом и удовлетворения потребности животных в питании при введении исследуемого химического вещества с кормом.
4.3 Подготовка животных
Следует использовать здоровых животных, прошедших акклиматизацию в лабораторных условиях не менее семи дней и ранее не подвергавшихся экспериментальным процедурам. При использовании грызунов введение доз животным следует начинать (по возможности) сразу после отъема и акклиматизации, предпочтительно до того, как животным исполнилось восемь недель. Подопытные 18 19 20
животные должны быть охарактеризованы по виду, линии, источнику, полу, массе тела и возрасту. В начале исследования отклонение массы тела для животных каждого пола должно быть минимальным и не превышать ±20 % от средней массы тела всех животных в исследовании для каждого пола отдельно. Животные должны быть случайным образом распределены в контрольные и подопытные группы. После рандомизации различия средней массы тела между группами внутри каждого пола не должны превышать вышеуказанных пределов. При наличии статистически значимых расхождений массы тела процедуру рандомизации следует повторить, при возможности. Каждому животному должен быть присвоен уникальный идентификационный номер, и оно должно быть помечено этим номером с помощью татуировки, имплантации микрочипа или другим подходящим способом.
5 Проведение испытаний
5.1 Число и пол животных
Следует использовать животных обоих полов. Для обеспечения тщательной биологической и статистической оценок необходимо использовать достаточное число животных. Поэтому для каждого уровня дозы и параллельной контрольной группы должно быть использовано не менее 50 животных каждого пола. В зависимости от цели исследования статистическую мощность ключевых оценок можно повысить путем неравномерного распределения животных по разным группам доз, причем в группах с низкой дозой должно быть более 50 животных, как, например, для оценки канцерогенного потенциала при низких дозах. Однако следует признать, что незначительное увеличение размера группы обеспечит сравнительно небольшое увеличение статистической мощности исследования. Дополнительная информация о статистическом дизайне исследования и выборе уровней доз для максимизации статистической мощности приведена в нормативном документе1 >.
5.2 Резерв на промежуточные умерщвления и сателлитные (сигнальные) группы
В исследовании могут быть предусмотрены промежуточные умерщвления, например через 12 мес, для представления информации о прогрессировании опухолевых изменений и информации о механизме действия, если это научно обосновано. Если такая информация уже получена в предыдущих исследованиях токсичности этого вещества при повторных дозах, промежуточные умерщвления не могут считаться научно обоснованными. Если промежуточные умерщвления включены в план исследования, число животных в каждой дозовой группе, запланированных для промежуточного умерщвления, обычно составляет по 10 животных каждого пола, и общее число животных, включенных в план исследования. должно быть увеличено на число животных, которых планируется умертвить до завершения исследования. При необходимости может быть включена дополнительная сигнальная группа животных (обычно по пять животных каждого пола) для мониторинга выраженности заболевания во время исследования21 22^ Подробные указания приведены в нормативном документе1 >.
Примечание — Животных сатвллитной группы содержат в условиях, аналогичных подопытным животным. и подвергают тем же воздействиям, но используют для тохсикокинвтических исследований.
5.3 Дозовые группы и дозирование
5.3.1 Руководство по всем аспектам выбора дозы и интервалов между уровнями доз приведены в нормативном документе1'. Следует использовать не менее трех дозовых групп и параллельную контрольную группу. Уровни доз. как правило, выбирают на основании результатов краткосрочных исследований повторных доз или определения диапазона с учетом существующих токсикологических и токсико-кинетических данных, имеющихся для исследуемого химического вещества или родственных веществ.
5.3.2 При выборе дозы исследователю следует учитывать и обеспечивать соответствие полученных данных нормативным требованиям стран OECD (например, оценке опасности и риска, классификации и маркировки, оценке эффективной (ED) дозы и т.д.).
5.3.3 За исключением случаев, ограниченных физико-химическими свойствами или биологическим воздействием исследуемого химического вещества, следует выбирать максимальный уровень
1
11 См. (11].
2
» См. также (9].
3
> См. [31].
4
’>См. [9]. [10J.
5
» См. (33).
6
'' Действует ГОСТ P 56697—2015 «Методы испытания no воздействию химической продукции на организм человека. Изучение токсичности у негрызунов при пероральном многократном введении в течение 90 дней».
7
' Действует ГОСТ 32642-2014 «Методы испытания по воздействию химической продукции на организм человека. Определение токсичности при повторном/многократном накожном поступлении. 2821-дневный тест».
8
' Действует ГОСТ 32636-2014 «Методы испытания по воздействию химической продукции на организм человека. Субхроническая ингаляционная токсичность: 90-дневное исследование».
9
' Действует ГОСТ 32642-2014 «Методы испытания по воздействию химической продукции на организм человека. Определение токсичности при повторном/многократном накожном поступлении. 28'21-дневный тест».
10
11 См. [1)—(5]. 2> См. 16].
11
См. [7].
41 См. 17]. [8]. 51 См. [9].
61 См. [10].
71 См. [8].
81 См. [11].
12
См. [2]. [7]. [12J—J15J.
13
Издание официальное
14
** См. [7].
15
* См. [20).
16
* См. [21], параграф 62.
17
> См. [22]. [23].
18
См. [24J—126],
19
> См. [7].
20
> См. [27J—[29).
21
11 См. (7).
22
> См. [30].