ГОСТ 32637-2020
Методы испытания по воздействию химической продукции на организм человека. Повторное исследование пероральной токсичности на грызунах: 90-дневное
Купить ГОСТ 32637-2020 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает требования к 90-дневному исследованию пероральной токсичности на грызунах для полной характеристики токсичности исследуемого химического вещества, предоставляет информацию о возможных рисках для здоровья, которые могут возникнуть в результате повторного воздействия этого химического вещества и позволяет выявить органы-мишени и возможность его накопления в организме, а также позволяет оценить уровень отсутствия наблюдаемого вредного воздействия после введения химического вещества (NOAEL). В настоящем стандарте особое внимание уделено конечным точкам со стороны эндокринной системы в сочетании с существующей чувствительностью к неврологическим, иммунологическим и репродуктивным эффектам
| Дата введения | 01.07.2021 |
|---|---|
| Актуализация | 01.01.2022 |
Этот ГОСТ находится в:
- Раздел Общероссийский классификатор стандартов
- Раздел Здравоохранение
- Раздел Фармацевтика
- Раздел Фармацевтика в целом
- Раздел Фармацевтика
- Раздел Здравоохранение
Methods of testing the impact of chemical products on the human body. Repeated dose oral toxicity study in rodent: 90 days
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
ГОСТ
32637—
2020
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКАПовторное исследование пероральной токсичности на грызунах: 90-дневное
Издание официальное
Сшщчш«ф1чи
20»
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия» (ФГУП «СТАН-ДАРТИНФОРМ») на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 июня 2020 г. No 131-П)
|
За принятие проголосовали: | ||||||||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 21 октября 2020 г. No 890-ст межгосударственный стандарт ГОСТ 32637-2020 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2021 г.
5 Настоящий стандарт является модифицированным по отношению к международному документу OECD Test No 408:2018 «Руководство по испытанию химических веществ. Повторное 90-дневное исследование пероральной токсичности на грызунах» («Guideline for Testing of Chemicals. Repeated dose 90-day oral toxicity study in rodents», MOD) путем.
* включения дополнительного раздела 1 и подраздела 2.2, выделенных в тексте курсивом,
- изменения его структуры для приведения в соответствие с ГОСТ 1.5 (подразделы 4.2 и 4.3).
Сопоставление структуры настоящего стандарта со структурой указанного международного документа приведено в дополнительном приложении ДА.
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВЗАМЕН ГОСТ 32637-2014
6.5 Наблюдения
6.5.1 Период наблюдений должен составлять не менее 90 дней. Животные в сопутствующей группе. предназначенные для последующего наблюдения, должны содержаться в течение соответствующего периода без введения исследуемого вещества с целью выявления персистенции (сохранения) или восстановления после токсического воздействия.
6.5.2 Общие клинические наблюдения следует проводить не реже одного раза в день, желательно в одно и то же время, с учетом пикового периода предполагаемого воздействия после введения дозы вещества. Клиническое состояние животных должно быть зарегистрировано. Не реже двух раз в сутки, обычно в начале и в конце каждого дня. всех животных проверяют на наличие признаков клинических проявлений и смертности1).
6.5.3 Не менее чем один раз до первого воздействия (для внутригрупповых сравнений) и один раз в неделю после этого проводят тщательные клинические наблюдения всех животных. Такие наблюдения следует проводить вне жилой клетки, желательно на стандартной площадке, и каждый раз в одно и то же время. Результаты наблюдений должны быть подробно задокументированы, желательно с использованием системы оценок в баллах, четко определенной испытательной лабораторией. Должны быть приняты меры, обеспечивающие минимальные отклонения в условиях наблюдений. Отмеченные признаки должны включать (но не ограничиваться ими) изменения кожи, шерстного покрова, глаз, слизистых оболочек, появление выделений или экскреции и вегетативную активность (например, слезотечение. пилоэрекция. изменение размера зрачков, необычный характер дыхания). Изменения походки, позы и реакции на обращение, а также наличие клонических или тонических движений, стереотипов (например, чрезмерный уход за шерстью, повторяющееся движение по кругу) или необычное поведение (например, самокалечение. хождение задом наперед) также следует регистрировать2'.
6.5.4 До введения исследуемого химического вещества и в конце исследования проводят офтальмологическое обследование с использованием офтальмоскопа или эквивалентного подходящего оборудования, желательно у всех животных, но обязательно в группах с высокой дозой и в контрольной группе. При обнаружении изменений в глазах должны быть обследованы все животные.
6.5.5 К концу периода воздействия и не ранее чем на 11-й неделе проводят оценку сенсорной реактивности на раздражители разных типов3) (например, слуховые, визуальные и проприоцептивные раздражители)4 5), оценку силы схвата5) и двигательной активности61. Более подробное описание используемых процедур приведено в соответствующих ссылочных документах. Тем не менее могут быть использованы альтернативные процедуры, отличные от приведенных в ссылочных документах.
6.5.6 Функциональные наблюдения, проводимые ближе к концу исследований, можно не проводить, если данные функциональных наблюдений доступны из других исследований, а ежедневные клинические наблюдения не выявили никаких функциональных нарушений.
6.5.7 В порядке исключения функциональные наблюдения можно также не проводить для групп, в которых иным образом проявились признаки токсичности в той степени, в которой они могли бы существенно воспрепятствовать проведению функциональных наблюдений.
6.6 Масса тела и потребление пищи/воды
Всех животных взвешивают не реже одного раза в неделю. Измерения потребляемой пищи следует проводить не реже одного раза в неделю. Если исследуемое химическое вещество вводят с питьевой водой, потребление воды также следует измерять не реже одного раза в неделю. Измерение потребления воды также может быть предусмотрено при введении вещества с пищей или при принудительном введении в желудок.
6.7 Гематология и клиническая биохимия
6.7.1 Образцы крови берут из определенного места и хранят, если это применимо, в соответствующих условиях. В конце испытаний образцы берут непосредственно перед умерщвлением или как часть процедуры умерщвления животных.
6.7.2 В конце периода исследования и когда все промежуточные образцы крови собраны, проводят следующие гематологические исследования: гематокрит, концентрация гемоглобина, количество эритроцитов, количество ретикулоцитов, общее и дифференциальное количество лейкоцитов, количество тромбоцитов — и определяют время свертываемостиУспособности к свертыванию крови.
6.7.3 Для изучения основных токсических эффектов в тканях, а именно воздействия на почки и печень, проводят клинические биохимические исследования на образцах крови, полученных от каждого животного непосредственно перед умерщвлением или как часть процедуры умерщвления животных (за исключением животных, обнаруженных в состоянии агонии и/или умерщвленных на промежуточной стадии). Аналогично гематологическим исследованиям можно проводить промежуточный забор образцов для клинических биохимических исследований. Рекомендуется брать образцы крови животных утром натощак’*. При анализе плазмы или сыворотки крови определяют содержание натрия, калия, глюкозы, общее содержание холестерина, HDL, LDL. мочевины, азота мочевины крови, креатинина, общего белка и альбумина и более двух ферментов, указывающих на гепатоцеллюлярные эффекты (такие, как алани-наминотрансфераза. аспартатаминотрансфераза. щелочная фосфатаза, гамма-глутамилтранспептида-за и сорбитолдегидрогеназа). Анализ может также включать определение дополнительных ферментов (печени или другого происхождения) и желчных кислот, которые могут дать важную информацию при определенных обстоятельствах, также может быть включено определение билирубина.
6.7.4 Данные клинической биохимии следует оценивать как потенциальные маркеры общего повреждения тканей. Если известные свойства исследуемого химического вещества могут влиять или предположительно влияют на соответствующие метаболические профили, должны быть проведены другие исследования, включающие определение натощак содержания кальция, фосфора, триглицеридов, а также специфических гормонов, метгемоглобина и холинэстеразы. Результаты таких определений могут быть идентификационными для химических веществ определенных классов или индивидуальными.
6.7.5 Общее содержание Т4. ТЗ и TSH в сыворотке крови определяют на образцах, полученных от каждого животного в основной и вспомогательной группах и/или группах восстановления в конце исследования. Другие гормоны, например тестостерон, эстрадиол, фолликулостимулирующий гормон (FSH), лютеинизирующий гормон (LH), следует рассматривать индивидуально в каждом конкретном случае. Сыворотка может храниться в замороженном виде, что дает время для принятия решения о наиболее информативном анализе гормонов на основе результатов, полученных для других конечных точек (например, массы органа и гистологии). Гормоны могут быть определены в плазме при наличии соответствующих данных валидации и базы исторического контроля.
6.7.6 На изменчивость и абсолютную концентрацию содержания гормонов могут влиять следующие факторы:
- время гуманного умерщвления из-за суточных колебаний концентрации гормонов;
- стадия эструсного цикла;
- метод гуманного умерщвления для предотвращения чрезмерного стресса для животных, который может повлиять на концентрацию гормонов;
- тест-системы для определения гормонов, которые могут отличаться по своим стандартным кривым.
6.7.7 Образцы крови, специально предназначенные для определения гормонов, должны быть получены в одно и то же время суток. Численные значения, полученные при анализе концентраций гормонов, отличаются для разных коммерческих наборов реактивов. Следовательно, может быть невозможным представить критерии эффективности, основанные на единых исторических данных. Чтобы различить случайные изменения и изменения, связанные с воздействием вещества, следует прини-
Для некоторых измерений в сыворотке и плазме, особенно для определения содержания глюкозы, предпочтительно голодание в течение ночи. Основная причина этого заключается в том. что повышенная изменчивость. являющаяся неизбежным результатом при анализе не натощак, будет маскировать более тонкие эффекты и затруднять интерпретацию. Однако, с другой стороны, голодание в течение ночи мешает общему метаболизму животных и (особенно в исследованиях с введением препарата с пищей) может нарушить ежедневное воздействие исследуемого химического вещества. Если принято ночное голодание, клинические биохимические определения следует выполнять после проведения функциональных наблюдений.
мать во внимание контрольные уровни гормонов (определенные в одной и той же лаборатории для одной и той же линии грызунов с использованием одного и того же метода). При возможности следует использовать лучшие (из применяемых на практике) методы сбора, обработки и анализа образцов крови6». Лаборатории должны по возможности стремиться поддерживать контрольные коэффициенты вариации ниже 25 для ТЗ и Т4 и ниже 35 для TSH. Все концентрации должны быть записаны в нано-граммах на кубический сантиметр (нг/см7). Стабильность ТЗ. Т4 и TSH в выбранных условиях хранения должна быть подтверждена как часть валидации анализа гормонов.
6.7.8 При необходимости в течение последней недели исследования могут быть выполнены следующие определения с использованием собранного за фиксированный промежуток времени объема мочи: внешний вид. объем, осмоляльность или удельный вес, pH. белок, глюкоза и кровь/клетки крови.
6.7.9 Если исходные данные базы исторического контроля недостаточно корректны, следует рассмотреть вопрос о необходимости определения вариабельности гематологических и клинических биохимических данных до начала дозирования: обычно не рекомендуется формировать эти данные до начала воздействия вещества8».
6.8 Патология
6.8.1 В момент завершения исследования регистрируют массу яичка и придатка яичка у всех самцов. Как правило, один придаток яичка от каждого самца должен быть зарезервирован для гистопато-логического исследования. Оставшийся придаток яичка может быть использован для факультативного подсчета запасов сперматозоидов хвоста придатка яичка, морфологии или подвижности сперматозоидов7».
6.8.2 Для факультативной оценки морфологии сперматозоидов образец спермы эпидидимального (или семявыносящего протока) исследуют в виде фиксированных или влажных препаратов и не менее 200 сперматозоидов на образец классифицируют как нормальные (в том числе головка и шейка/хвост сперматозоида оказываются нормальными) или с патологией. Примеры морфологических нарушений сперматозоидов могут включать слияние, изолированные и деформированные головки и/или хвосты. Деформированные или большие головки сперматозоидов могут свидетельствовать о патологии выработки спермы. Подвижность сперматозоидов может быть оценена сразу после гуманного умерщвления или зарегистрирована для последующего анализа. Процент прогрессивной подвижности сперматозоидов может быть определен визуально или с использованием компьютерного анализа движений.
6.8.3 Анализ параметров спермы может быть ограничен самцами контрольной группы и группы с высоким уровнем дозы. Однако, если наблюдают эффекты, связанные с воздействием вещества, следует также оценить группы с более низкой дозой.
6.8.4 При аутопсии определяют астральный цикл у всех самок путем взятия мазков из влагалища. Эти наблюдения предоставят информацию относительно стадии астрального цикла во время гуманного умерщвления и помогут в гистологической оценке чувствительных к эстрогену тканей9*.
6.9 Общая аутопсия
6.9.1 Всех животных, включенных в исследование, подвергают полной подробной макроскопической некропсии, включающей тщательный осмотр внешней поверхности тела, всех отверстий, а также черепной, грудной и брюшной полостей и их содержимого. Печень, почки, надпочечники, яички, придатки яичка, предстательная железа + семенные пузырьки с коагулирующими железами в целом (как вариант, сначала взвешивают всю предстательную железу вместе с семенными пузырьками/коагуля-ционными железами, затем отсекают и взвешивают отдельно предстательную железу), матка, яичники, тимус, селезенка, мозг и сердце всех животных должны быть иссечены от всех прилегающих тканей (в зависимости от требований) и взвешены во влажном состоянии как можно быстрее после вскрытия во избежание высыхания. Гипофиз может быть взвешен свежим сразу после иссечения или после фиксации. При иссечении комплекса предстательной железы следует соблюдать осторожность для предотвращения прокола наполненных жидкостью семенных пузырьков. В качестве альтернативы семенные пузырьки и предстательная железа могут быть иссечены и взвешены после фиксации.
6.9.2 Щитовидную железу следует взвешивать с особой осторожностью, поскольку эта ткань легко повреждается11. Повреждение ткани может поставить под угрозу гистопатологический анализ. Поэтому иссечение и взвешивание щитовидной железы следует проводить очень аккуратно и предпочтительно после фиксации для предотвращения повреждения тканей.
6.9.3 Следующие ткани должны быть сохранены в среде, наиболее подходящей как для фиксации типа ткани, так и для предполагаемого последующего гистопатологического исследования10 11: все макроскопические поражения, головной мозг (характерные отделы, включая большой мозг, мозжечок, продолговатый мозг/мост),спинной мозг (на трех уровнях: шейный, средне-грудной и поясничный).гипофиз, щитовидная железа, паращитовидная железа, вилочковая железа, пищевод, слюнные железы, желудок. тонкий и толстый кишечник (включая лейеровы бляшки), печень, поджелудочная железа, почки, надпочечники, селезенка, сердце, трахея и легкие (сохраняют путем заполнения фиксатором с последующим погружением в него), аорта, яичники, матка, шейка матки, влагалище, яички, придатки яичка, предстательная железа, семенные пузырьки, коагуляционные железы, молочные железы (самцов и самок), предстательная железа, мочевой пузырь, желчный пузырь (для мышей), лимфатические узлы (желательно один лимфатический узел, охватывающий путь введения вещества, и еще один — удаленный от пути введения, включающий системные эффекты), периферический нерв (седалищный или большеберцовый, желательно в непосредственной близости от мышцы), скелетные мышцы и кости с костным мозгом (срез и/или свежий пуиктат костного мозга), кожа и глаза (если в ходе офтальмологического исследования были выявлены какие-либо изменения). Рекомендуется сохранять яички путем погружения в фиксатор Буэна или модифицированный фиксатор Дэвидсона, а при гистопатологической оценке следует учитывать промежуточные сечения семенных канальцев, как приведено в документе^. В документе41 описаны фиксация и гистологическая оценка эндокринных органов. Клинические и прочие данные могут привести к необходимости исследования дополнительных тканей. Кроме того, следует оценивать любые органы, которые могут считаться органами-мишенями на основе известных свойств исследуемого химического вещества.
6.9.4 Гистопатологическую оценку яичек следует проводить с учетом специфических для стадии изменений, как описано в документе51. Следует провести подробное гистолатологическое исследование. чтобы определить связанные с воздействием эффекты, такие как задержка сперматид. отсутствие оболочек или типов половых клеток, гигантских многоядерных клеток или отторжение слерматогенных клеток в просвет, как указано в документе51. Фиксация и гистологическая оценка эндокринных органов описаны в нормативном документе61.
6.10 Гистопатология
6.10.1 Проводят полное гистопатологическое исследование сохраненных органов и тканей всех животных контрольной группы и группы, получавшей максимальную дозу. Эти исследования следует распространять на животных всех других доэовых групп, на те ткани, в которых наблюдают изменения, связанные с введением вещества в группе с высокой дозой.
6.10.2 Исследованию подлежат все макроскопические повреждения.
6.10.3 При использовании сопутствующей группы животных гистопатологическое исследование следует проводить на тканях и органах, воздействие на которые было выявлено в подопытных группах.
7 Данные исследований и отчет
7.1 Данные исследований
7.1.1 Необходимо представлять индивидуальные данные. Кроме того, все данные должны быть сведены в табличную форму и должно быть указано: число животных в каждой подопытной группе
на начало исследования; число животных, обнаруженных мертвыми при проведении испытаний или умерщвленных по соображениям гуманности, время смерти или умерщвления; число животных с признаками токсичности, и должно быть приведено описание наблюдавшихся признаков токсичности, включая время начала проявления, продолжительность и степень тяжести токсического действия, число животных, у которых выявлены поражения, тип поражений и процент животных, демонстрирующих каждый тип поражения.
7.1.2 По возможности численные результаты следует оценивать с использованием соответствующего и общепринятого статистического метода. Статистические методы и данные, которые подлежат анализу, должны быть выбраны во время планирования исследования.
7.1.3 Для контроля качества рекомендуется сравнивать результаты исследований со значениями базы данных исторического контроля, полученными в той же лаборатории для того же вида и линии в аналогичных условиях. При этом для эндокринной активности вычисляют коэффициент вариаций для непрерывных параметров, приведенных в приложении А. Эти данные могут быть использованы для сравнения результатов исследований. При оценке данных базы исторического контроля должны быть приняты во внимание различия между линиями крыс.
7.2 Отчет
Отчет по результатам исследования должен содержать следующую информацию:
Исследуемое вещество:
- химическая идентификация, такая как наименование по IUPAC или CAS. регистрационный номер CAS. код SMILES или InChl, структурная формула и/или другие идентификационные данные;
- поставщик, номер парии, срок хранения (при наличии);
- стабильность химического вещества, если известна;
- физические свойства и. при необходимости, физико-химические свойства;
- идентификация, включая номер CAS, если известем/установлен. а также
- чистота.
Однокомпонентное вещество:
- внешний вид. растворимость в воде и дополнительные важные физико-химические свойства.
Многокомпонентное вещество. UVBC и смеси:
- характеризуют, по возможности, химическим наименованием (см. выше), количественным содержанием и соответствующими физико-химическими свойствами компонентов.
Носитель (растворитель) при необходимости:
- обоснование выбора растворителя, за исключением воды.
Подопытные животные:
- используемый вид и линия;
- число, возраст и пол животных;
- поставщик, условия содержания, кормления и т. д.;
- индивидуальная масса животных в начале исследования;
- обоснование вида, если это не крысы.
Условия проведения испытаний:
- обоснование выбора уровня доз;
- подробный состав исследуемого вещества/подготовка пищи, полученная концентрация, стабильность и гомогенность препарата;
- подробная информация о введении исследуемого химического вещества;
- фактические дозы (мг/кг массы тела в сутки) и коэффициент пересчета концентрации исследуемого химического вещества, вводимого с пищей/питьевой водой (мг/л). в фактическую дозу, при необходимости;
- подробная информация о качестве пищи и воды.
Результаты:
- масса тела и изменения массы тела:
- потребление пищи и потребление воды в соответствующих случаях;
- данные о токсическом действии в зависимости от пола и уровня дозы, включая признаки токсичности;
- характер, серьезность и продолжительность клинических проявлений (обратимость или необратимость);
- результаты офтальмологических исследований:
- сенсорная активность, сила схвата и оценка двигательной деятельности (при наличии);
- гематологические исследования с соответствующими исходными показателями;
- клинические биохимические исследования с соответствующими исходными показателями:
- циркулирующие гормоны щитовидной железы (Т4. ТЗ. TSH — обязательно);
- измерения других гормонов (факультативно)
- метод определения содержания гормонов (метод анализа, поставщик, процедура и т. д.);
- масса тела в конце исследования, масса органов и отношения массы органое/тела;
- результаты некропсии;
• терминальная вагинальная цитология;
• подробное описание результатов гистопатологических исследований;
- общее количество сперматозоидов хвоста придатка яичка, процент прогрессивно-подвижных сперматозоидов, процент морфологически нормальных сперматозоидов и процент сперматозоидов с каждой выявленной аномалией (факультативно);
- данные об абсорбции (например, информация о ADME или ТК). если анализировали:
- статистическая обработка результатов, если применяли:
- для животных, умерщвленных до окончания исследования, должно быть представлено обоснование такого решения;
- для животных, обнаруженных мертвыми в ходе исследования, по возможности следует установить причину смерти.
Обсуждение результатов Выводы
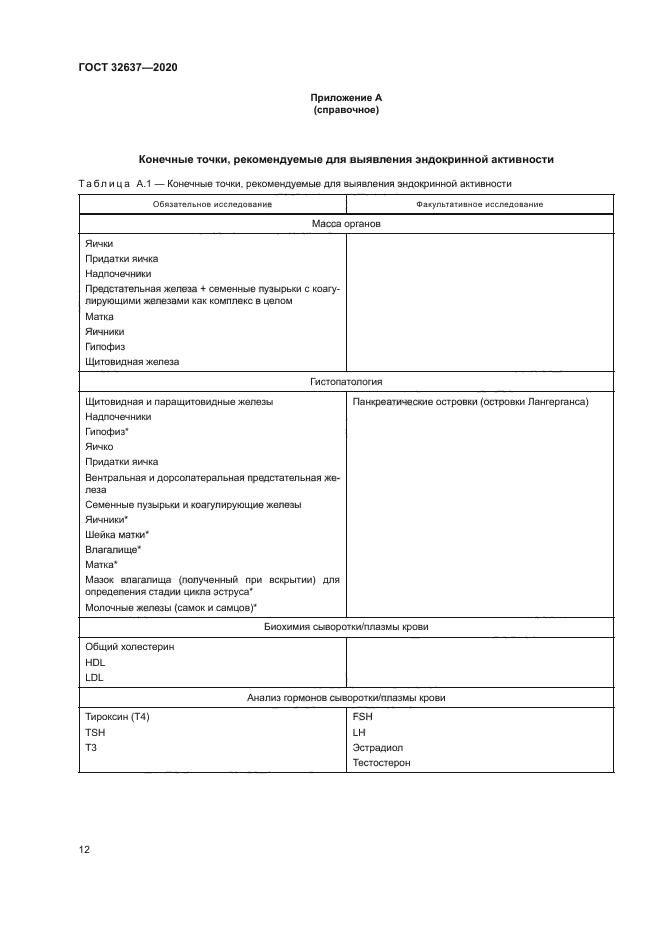
Приложение А (справочное)
Конечные точки, рекомендуемые для выявления эндокринной активности
|
Таблица А.1 — Конечные точки, рекомендуемые для выявления эндокринной активности | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Окончание таблицы А. 1 | ||||||
| ||||||
|
* Состояние чувствительных к эстрогену органов у самки следует оценивать при прекращении зстрально-го цикла, поскольку исследуемые вещества могут активно воздействовать на эндокринную систему и вызывать гистологические изменения, которые, хоть и не являются явно патологическими, могут отличаться от ожидаемого состояния в зависимости от стадии овариального цикла1). | ||||||
^См. [17J. части 3. 4.
Приложение ДА (справочное)
Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа
|
Таблица ДАЛ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Продолжение таблицы ДА. 1 | ||||||||||||||||||||||||
|
Информация о введении в действие (прекращении действия) настоящего стандарта и uat/e-нений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случав пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
©Стандартинформ, оформление. 2020
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
|
Окончание таблицы ДА. 1 | ||||||||
| ||||||||
Содержание
1 Область применения.................................................................1
2 Термины, определения и сокращения...................................................1
3 Основные положения.................................................................2
4 Принцип исследования.................... 3
5 Описание метода....................................................................3
6 Проведение испытаний...............................................................4
7 Данные исследований и отчет..........................................................9
Приложение А (справочное) Конечные точки, рекомендуемые для выявления эндокринной
активности .............................................................12
Приложение ДА (справочное) Сопоставление структуры настоящего стандарта
со структурой примененного в нем международного документа.................14
Библиография.......................................................................17
Введение
1 Руководства Организации экономического сотрудничества и развития (OECD) по испытаниям химических веществ периодически пересматриваются с учетом научно-технического прогресса, изменяющихся нормативных требований и в связи с необходимостью гуманного обращения с животными. Метод испытаний по настоящему руководству был принят в 1981 г. В 1998 г. он был пересмотрен на основе результатов Консультативного совещания экспертов ОЭСР по вопросам проведения испытаний субхронической и хронической токсичности, состоявшегося в Риме в 1995 г.1); в него были внесены изменения с целью получения дополнительной информации о животных, используемых в исследовании.
2 Настоящее руководство было пересмотрено в 2018 г. с целью включения дополнительной информации по конечным точкам, чувствительным для эндокринной системы, предназначенным для лучшего обнаружения потенциальной эндокринной активности исследуемых химических веществ. Оно содержит уточнения к документу OECD Test No 40712 13.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Повторное исследование пероральной токсичности на грызунах: 90-дневное
Methods of testing the impact of chemical products on the human body. Repeated dose oral toxicity study in rodent: 90 days
Дата введения — 2021—07—01
1 Область применения
Настоящий стандарт устанавливает требования к 90-дневному исследованию пероральной токсичности на грызунах для полной характеристики токсичности исследуемого химического вещества. предоставляет информацию о возможных рисках для здоровья, которые могут возникнуть в результате повторного воздействия этого химического вещества, и позволяет выявить органы-мишени и возможность его накопления в организме, а также позволяет оценить уровень отсут-ствия наблюдаемого вредного воздействия после введения химического вещества (NOAEL).
В настоящем стандарте особое вниманио уделено конечным точкам со стороны эндокринной системы в сочетании с существующей чувствителыюстью к неврологическим, иммунологическим и репродуктивным эффектам.
2 Термины, определения и сокращения
2.1 В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1.1 андрогенная активность (androgenicity): Способность химического вещества действовать как естественный андрогенный гормон (например, тестостерон) в организме млекопитающего.
2.1.2 антиандрогенная активность (antiandrogenicity): Способность химического вещества подавлять действие естественного андрогенного гормона (например, тестостерона) в организме млекопитающего.
2.1.3 антиэстрогенная активность (antioestrogenicity): Способность химического вещества подавлять действие естественного эстрогенного гормона (например, эстрадиола) в организме млекопитающего.
2.1.4 антитироидная активность (antithyroid activity): Способность химического вещества подавлять действие естественного гормона щитовидной железы (например, ТЗ) в организме млекопитающего.
2.1.5 тироидная активность (thyroid activity): Способность химического вещества действовать как естественный тироидный гормон (например. ТЗ) в организме млекопитающего.
2.1.6 дозировка (dosage): Обобщающий термин, означающий исследуемую дозу, а также частоту и продолжительность ее введения.
2.1.7 доза (dose): Количество вводимого исследуемого вещества.
Примечание — Доза выражается в виде массы исследуемого химического вещества (г. мг). или массы исследуемого химического вещества на единицу массы подопытного животного (например, мг/кг). или в виде постоянной концентрации в пище (ppm).
2.1.8 выраженная токсичность (evident toxicity): Обобщающий термин, характеризующий наличие признаков токсичности, наблюдаемых после введения исследуемого вещества.
Примечание — Признаки токсичности должны быть достаточными для оценки опасности и такими, чтобы увеличение вводимой дозы вещества могло привести к развитию признаков серьезного отравления и возможной смерти.
2.1.9 эстрогенная активность (oestrogenicity): Способность химического вещества действовать как естественный эстрогенный гормон (например, эстрадиол) в организме млекопитающего.
2.1.10 трийодтиронин; ТЗ (tri-iodothyronine; ТЗ): Активная форма гормонов щитовидной железы.
2.1.11 тироксин: Т4 (thyroxine; Т4): Основной циркулирующий продукт щитовидной железы, который превращается в ТЗ.
2.1.12 тироидная активность (thyroid activity): Способность химического вещества действовать как естественный тироидный гормон (например. ТЗ) в организме млекопитающего.
2.1.13 тиреостимулирующий гормон; TSH (thyroid stimulating hormone; TSH): Тиреотропный гормон гипофиза — регулятор биосинтеза и секреции гормонов щитовидной железы.
2.1.14 валидация (validation): Процесс научных исследований, предназначенный для характеристики технических требований и ограничений метода испытания и демонстрации его надежности и соответствия конкретной цели.
2.2 В настоящем стандарте использованы следующие сокращения:
ADME (absorption, distribution, metabolism, and excretion) — всасывание, распределение, метаболизм и выведение;
FSH (follicle stimulating hormone) — фолликулостимулирующий гормон:
HDL (high density lipoprotein) — липопротеин высокой плотности;
LDL (tow density lipoprotein) — липопротеин низкой плотности.
LH (luteinizing hormone) — лютвинизирующий гормон:
NOAEL (no-observed-adverse-effect level) — уровень отсутствия наблюдаемого вредного воздействия после введения вещества.
Примечание — Является максимальной дозой, не вызывающей обнаруживаемого вредного воздействия на здоровье:
ТК (thymidine kinase) — тимидинкиназа.
3 Основные положения
3.1 При исследовании и оценке токсических характеристик химического вещества определение субхронической пероральной токсичности при многократном введении доз возможно после получения исходной информации об острой токсичности и токсичности при 28-дневном многократном введении вещества. Исследование многократного 90-дневного введения вещества предоставляет информацию о возможных рисках для здоровья, которые могут возникнуть в результате повторного воздействия в течение продолжительного периода времени, охватывающего период развития после отъема от матери и период полового созревания. Исследование позволит получить информацию об основных токсических эффектах, выявить органы-мишени и возможность накопления вещества, а также позволит оценить уровень отсутствия наблюдаемого вредного воздействия (NOAEL) после введения вещества, который можно использовать при подборе уровня доз при длительных исследованиях и для установления критериев безопасности при воздействии химической продукции на организм человека. С другой стороны, это исследование дает данные зависимости доза — ответ, которые можно использовать для оценки отправной точки при оценке опасности с использованием соответствующих методов моделирования (например, анализа ориентировочной дозы).
3.2 В настоящем стандарте особое внимание уделено конечным точкам со стороны эндокринной системы в сочетании с известным влиянием на неврологические, иммунологические и репродуктивные эффекты. Также подчеркивается необходимость тщательных клинических наблюдений за животными для получения максимального объема информации. Требуемые конечные точки включают измерение тироксина (Т4), трийодтиронина (ТЗ), тиреотропного гормона (TSH) и массы щитовидной железы, так как данные параметры чувствительны к нарушению функции щитовидной железы11. Кроме того, должно
быть определено содержание общего холестерина, липопротеинов низкой плотности (LDL) и липопротеинов высокой плотности (HDL), так как уровни этих параметров напрямую обеспечиваются действием гормонов щитовидной железы и способствуют (наряду с другими конечными точками щитовидной железы) доказательству воздействия на щитовидную железу14*. Факультативные конечные точки включают измерения других гормонов, а также оценку параметров спермы. В приложении А приведен перечень обязательных и факультативных исследований, значения показателей которых могут быть изменены в результате воздействия на эндокринную систему. Оценка факультативных показателей может быть рассмотрена, если существующая информация о исследуемом химическом веществе или родственных соединениях предполагает их потенциальное влияние или может быть вызвана результатами наблюдений необходимости количественной оценки данных, полученных в рамках настоящего стандарта. Данное исследование позволит определить химические вещества, способные оказывать нейротоксиче-ское. иммунное воздействие или влиять на репродуктивную систему организма, что может обусловить необходимость проведения дальнейших углубленных исследований.
3.3 Результаты, полученные для параметров, связанных с эндокринной системой, должны оцениваться в контексте «Концептуальной основы OECD для исследования и оценки химических веществ, разрушающих эндокринную систему»15).
3.4 Все процедуры на животных должны соответствовать стандартам обращения с животными, приведенные ниже описания ухода и обработки являются минимальными нормативными требованиями и при необходимости могут быть заменены местными правилами, если они более строгие. Дальнейшее руководство по гуманному обращению с животными приведено в нормативном документе31.
4 Принцип исследования
Исследуемое вещество вводят перорально ежедневно градуированными дозами нескольким группам подопытных животных, при этом каждой группе вводят один уровень дозы в течение 90 дней. На протяжении периода введения вещества животные должны находиться под пристальным наблюдением для выявления признаков токсического воздействия в соответствии с нормативным документом16). Животных, умерших или умерщвленных гуманным способом в ходе исследования, подвергают аутопсии. После завершения испытания выживших животных также умерщвляют гуманным способом и подвергают аутопсии.
5 Описание метода
5.1 Выбор видов животных
Предпочтительным видом животных являются крысы, хотя возможно использование других видов грызунов, например мышей. Если параметры, приведенные в настоящем стандарте, исследуют на других видах грызунов, следует привести подробное обоснование выбора вида, включая адаптацию к измерению параметров. Хотя биологически правдоподобно, что другие виды реагируют на токсические вещества аналогично крысе, использование более мелких видов может привести к увеличению вариабельности измерений конечных точек из-за технических проблем рассечения более мелких органов. Обычно используют лабораторные линии молодых, здоровых, половозрелых животных. Самки должны быть нерожавшими и небеременными. Введение доз следует начинать сразу после отъема, но в любом случае до того, как животным исполнится девять недель. В начале исследования отклонение массы тела используемых животных должно быть минимальным и не превышать ± 20 % средней массы тела для животных каждого пола. При проведении предварительного исследования перед долгосрочным исследованием хронической токсичности в обоих исследованиях следует использовать животных одной и той же линии и из одного источника.
5.2 Условия содержания и кормления
5.2.1 Все процедуры должны соответствовать местным стандартам ухода за лабораторными животными. Температура в помещении с подопытными животными должна быть (22±3) °С. Несмотря на
то. что относительная влажность воздуха не должна быть ниже 30 % и, предпочтительно, не превышать 70 %, за исключением периода уборки помещения, оптимальное значение относительной влажности должно быть от 50 % до 60 %. Освещение в помещении должно быть искусственным, с чередованием периодов света (12 ч) и темноты (12 ч). Для кормления можно использовать обычный лабораторный рацион питания с неограниченной подачей питьевой воды. На выбор рациона может повлиять необходимость обеспечения соответствующей смеси исследуемого химического вещества при его введении в соответствии с настоящим методом. Следует избегать использования пищи и постилочного материала. которые могут содержать недопустимо высокие уровни гормонально активных веществ (например, фитоэстрогенов), способных или с большой вероятностью склонных помешать интерпретации результатов исследования. Известно, что высокий уровень фитоэстрогенов в лабораторной пище увеличивает массу матки у грызунов. Рекомендуемые уровни фитоэстрогенов в пище не должны превышать 350 мкг эквивалентов генистеина на грамм лабораторной пищи для грызунов.
5.2.2 Животных следует размещать небольшими группами одного пола. Животные могут быть размещены индивидуально, если это научно обосновано, и продолжительность одиночного содержания должна быть ограничена минимально необходимым периодом1 К
5.3 Подготовка животных
Для исследования используют здоровых животных, прошедших акклиматизацию к лабораторным условиям не менее 5 дней и не подвергавшихся ранее экспериментальным процедурам. Подопытных животных характеризуют по виду, линии, источнику, полу, массе тела и/или возрасту. Животных распределяют в контрольную и подопытные группы случайным образом. Клетки с животными располагают таким образом, чтобы свести к минимуму потенциальное воздействие от размещения клеток. Каждому животному присваивают уникальный идентификационный номер. Для индивидуальной идентификации животных используют наименее инвазивные методы, такие как кольцевание, электронные бирки, микрочипирование и биометрическую идентификацию.
5.4 Подготовка доз
5.4.1 Исследуемое вещество вводят через желудочный зонд, добавляют в пищу или растворяют в питьевой воде. Способ перорального введения зависит от цели исследования и физических/химиче-ских свойств исследуемого материала.
5.4.2 При необходимости исследуемое вещество растворяют или суспендируют в подходящем растворителе. Рекомендуется (при возможности) в первую очередь использовать водный раствор/су-спензию. затем масляный раствор/эмульсию (например, в кукурузном масле) и потом растворы в других растворителях (носителях). Для любых растворителей (носителей), кроме воды, должны быть известны их токсические характеристики. Необходимо определить гомогенность и стабильность исследуемого химического вещества в условиях введения.
6 Проведение испытаний
6.1 Число и пол животных
Для каждого уровня дозы следует использовать не менее 20 животных (10 самок и 10 самцов). Если запланированы промежуточные умерщвления, число подопытных животных следует увеличить на число животных, которых планируют умертвить до завершения исследования. На основании результатов предварительных испытаний химического вещества или наиболее близких аналогов следует предусмотреть включение дополнительной группы но менее чем из 10 животных (по пять особей каждого пола) в контрольную группу и группу с максимальной дозой для наблюдения за обратимостью или устойчивостью токсического эффекта после периода воздействия. Продолжительность периода после воздействия устанавливают с учетом наблюдаемых эффектов.
6.2 Дозировка
6.2.1 При проведении исследований следует использовать не менее трех уровней доз вещества и параллельную контрольную группу, за исключением случаев, когда проводят испытания предельной дозы (см. 6.2.3). Уровни дозы могут быть основаны на результатах многократного воздействия доз или исследований по определению диапазона доз и должны учитывать любые имеющиеся токсиколо-
гические и токсикокинетические данные, доступные для исследуемого соединения или родственных материалов. За исключением случаев ограничений, обусловленных физико-химическими свойствами или биологическим воздействием, максимальную дозу выбирают с целью вызвать интоксикацию, а не смерть или мучительные страдания животного17. Убывающую последовательность уровней дозы выбирают таким образом, чтобы продемонстрировать реакцию на вводимую дозу и уровень отсутствия наблюдаемого вредного воздействия (NOAEL) при самом низком уровне дозы. Обычно двух—четырехкратный интервал является оптимальным для установления снижения уровней дозы, и введение дополнительной четвертой подопытной группы является более предпочтительным, чем использование очень больших интервалов (например, более чем в 6—10 раз) между дозами.
6.2.2 Контрольную группу не подвергают воздействию исследуемого вещества, она получает только растворитель (носитель), если его используют для введения исследуемого химического вещества. С животными контрольной группы обращаются так же, как с животными подопытных групп, кроме введения исследуемого вещества. При использовании растворителя контрольная группа должна получать его в максимальном объеме. Если исследуемое химическое вещество введено в пищу и вызывает снижение потребления пищи, тогда контрольная группа, получающая одинаковое питание, может быть использована для разграничения снижения потребления пищи вследствие вкусовых качеств или токсикологических изменений у подопытных животных.
6.2.3 При необходимости следует учитывать следующие характеристики растворителя (носителя): влияние на абсорбцию, распределение, метаболизм или удерживание исследуемого химического вещества; влияние на химические свойства исследуемого химического вещества, которое может изменить его токсические характеристики; влияние на потребление пищи или воды или пищевой статус животных.
6.3 Испытание предельной дозы
Если испытание одной дозы, эквивалентной не менее чем 1000 мг/кг массы тела животных в сутки. по настоящему стандарту не вызывает наблюдаемых неблагоприятных воздействий и если токсичность не предполагается на основании данных о структурно родственных соединениях, то проведение полного исследования с использованием трех уровней дозы может не считаться необходимым. В тех случаях, когда воздействие на организм человека указывает на необходимость использования более высоких уровней доз вещества, испытание предельной дозы не применяют.
6.4 Введение доз вещества
6.4.1 Животным вводят исследуемое вещество ежедневно семь дней в неделю в течение не менее 90 дней. Использование любого другого режима дозирования (например, пять дней в неделю) требует обоснования. При принудительном введении исследуемого вещества его вводят животным однократно с использованием желудочного зонда или подходящей интубационной канюли. Максимальный объем жидкости, который может быть введен за один раз. зависит от размера подопытного животного. Объем не должен превышать 1 см3/100 г массы тела, за исключением водных растворов, когда можно использовать 2 см3/100 г массы тела животного. За исключением раздражающих или вызывающих коррозию веществ, которые обычно проявляют обостренные эффекты при более высоких концентрациях, следует свести к минимуму вариабельность вводимого объема регулированием концентрации исследуемого вещества для обеспечения постоянного объема при всех уровнях доз.
6.4.2 Для химических веществ, вводимых с пищей или питьевой водой, важно, чтобы вкусовые характеристики исследуемого вещества не влияли на нормальное питание или водный баланс. При введении исследуемого химического вещества с пищей можно использовать его постоянную концентрацию в пище (ppm) или постоянный уровень дозы в пересчете на массу тела животного (например, мг/кг массы тела животного в сутки); при использовании альтернативного варианта он должен быть подробно описан. Для химического вещества, вводимого принудительно, дозу вводят ежедневно в одно и то же время, корректируя ее при необходимости для обеспечения постоянного уровня дозы в пересчете на массу тела.
1
11 См. [19].
2
> См. [8]. [19].
3
3) См. [5].
4
> См. [9]. [10], [11].
5
> См. [12]. в> См. [13].
6
»» См. [23].
7
» См. [15].
8
» См. [14].
9
> См. [17].
10
11 См. [20].
11
См. [16]. [17]. 3» См. [16].
41 См. [17].
51 См. [21]. е> См. [17].
12
См. [1].
13
См. ГОСТ 32641-2014 «Методы испытания по воздействию химической продукции на организм человека. Определение токсичности при повгорном/многократном пероральном поступлении вещества на грызунах. 28-дневный тест» (OECD Test N? 407: 2008 «Guidelines for the testing of chemicals. Repeated dose 28-day oral toxicity study in rodents». IDT).
Издание официальное
’) См. (2).
14
’) См. (3J.
15
2) См. [4].
16
> См. [19].
D См. (5)—[7].
17
’> См. (19].