ГОСТ 32293-2013
Методы испытаний химической продукции, представляющей опасность для окружающей среды. Испытание водорослей и цианобактерий на задержку роста
Купить ГОСТ 32293-2013 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает метод определения воздействия исследуемого вещества на рост водорослей и (или) цианобактерий.
Идентичен OECD Test No. 201
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Общие сведения
5 Принцип тестирования
6 Информация об исследуемом веществе
7 Достоверность тестирования
8 Стандартные вещества
9 Применимость тестирования
10 Описание тестирования
11 Проведение тестирования
12 Данные и отчет о проведении тестирования
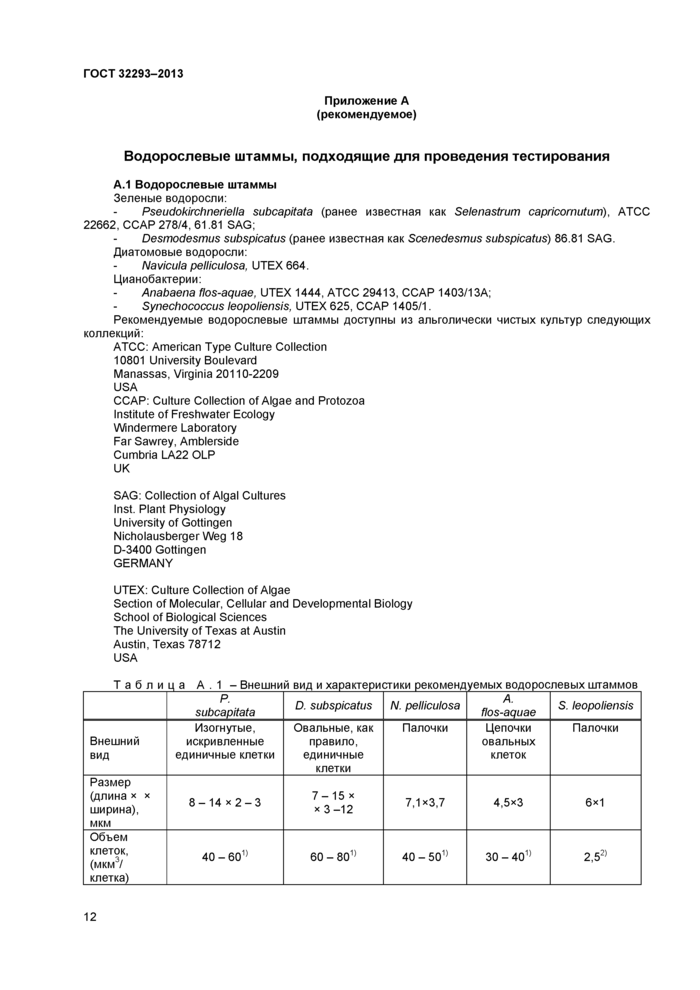
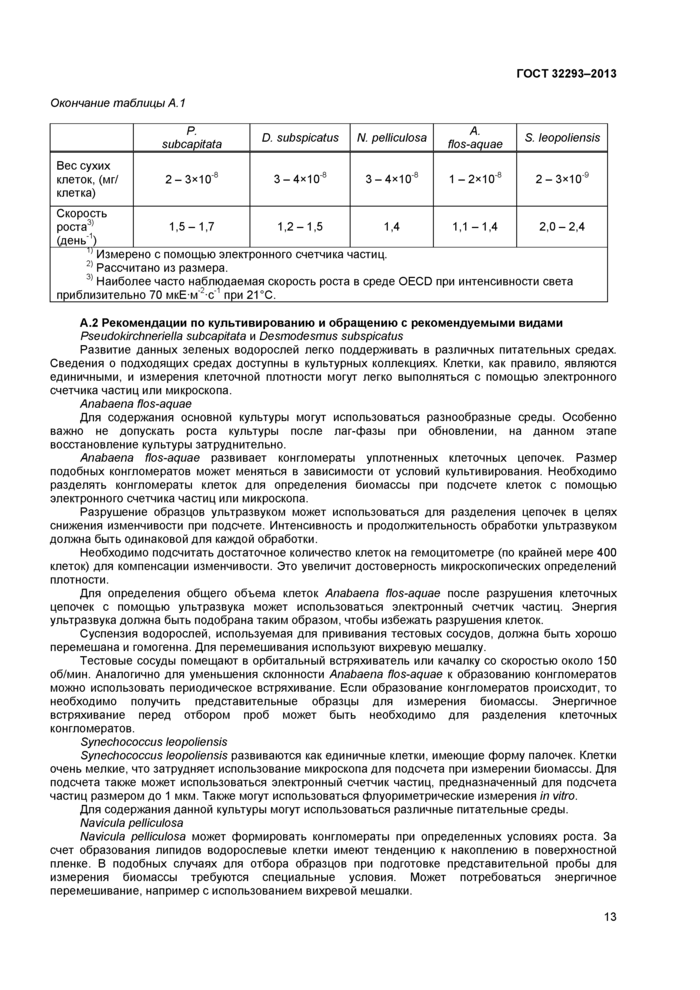
Приложение А (рекомендуемое) Водорослевые штаммы, подходящие для проведения тестирования
Приложение В (рекомендуемое) Питательная среда
Приложение С (рекомендуемое) Процедура культивирования морских водорослей
Приложение D (справочное) Регрессионный анализ данных (нелинейная регрессионная модель)
Библиография
| Дата введения | 01.08.2014 |
|---|---|
| Добавлен в базу | 21.05.2015 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 05.11.2013 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 61-П |
|---|---|---|---|
| 22.11.2013 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 777-ст |
| Разработан | ФГУП ВНИЦ СМВ | ||
| Издан | Стандартинформ | 2015 г. |
Testing of chemicals of environmental hazard. Alga and cyanobacteria, growth lnhibition test
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13
стр. 14
стр. 15

стр. 16
стр. 17
стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ (МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION (ISC)
ГОСТ
межгосударственный 32293_
СТАНДАРТ
2013
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Испытание водорослей и цианобактерий на задержку роста
(OECD, Test No. 201, IDT)
Издание официальное
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 - 2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены».
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием
«Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ» (ФГУП «ВНИЦСМВ»)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии Российской Федерации
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 5 ноября 2013 г. № 61-П)
|
За принятие проголосовали: | |||||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г, № 777-ст межгосударственный стандарт ГОСТ 32293-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному стандарту OECD Test No. 201:2011 «AJga, Growth Inhibition Test» (Испытание водорослей на задержку роста).
Перевод с английского языка (еп).
Степень соответствия - идентичная (IDT)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
О Стандартинформ, 2015
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
СТАНДАРТ
МЕЖГОСУДА Р С Т ВЕННЫЙ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ. ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ
ОКРУЖАЮЩЕЙ СРЕДЫ
Испытание водорослей и цианобактерий на задержку роста
Testing of cherrecals of environmental hazard Alga and Cyanobacteria. Growth inhibition Test
Дата введения - 2014-08-01
1 Область применения
Настоящий стандарт устанавливает метод определения воздействия исследуемого вещества на рост водорослей и (или) цианобактерий.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ИСО 14442:2006 Качество воды. Руководящие указания по испытанию на торможение малорастворимыми веществами, летучими соединениями, металлами и сточными водами роста водорослей (Water quality - Guidelines for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waste water);
ИСО 5667-16:1998 Качество воды. Отбор проб. Часть 16. Руководство по биотестированию проб (Water quality - Sampling - Part 16: Guidance on biotesting of samples);
ИСО 8692:2012 Качество воды. Испытание на подавление роста водорослей в пресной воде с использованием одноклеточных зеленых водорослей (Water quality - Fresh water algal growth inhibition test with unicellular green algae).
3 Термины и определения
В настоящем стандарте применены термины с соответствующими определениями:
3.1 Биомасса (Biomass): Сухая масса живого материала, присутствующего в популяции, выраженная по отношению к данному объему, например, мг водорослей на 1 л тестируемого раствора. В стандарте используются показатели - заменители биомассы, такие, как количество клеток, флюоресценция и т.д. Использование термина «биомасса» также относится и к показателям-заменителям.
3.2 наименьшая наблюдаемая эффективная концентрация (Lowest Observed Effect Concentration - LOEC): Минимальная концентрация исследуемого вещества, при которой наблюдается статистически значимое уменьшение роста водорослей и (или) цианобактерий (при р < 0,05) по сравнению с контрольной группой в пределах установленного периода экспозиции. Все тестируемые концентрации, превышающие LOEC. должны иметь токсический эффект, равный или больше наблюдаемого при LOEC. Если данные условия не соблюдаются, то должно быть приведено достаточное обоснование того, как может быть выбрана LOEC.
3.3 неэффективная наблюдаемая концентрация (No Observed Effect Concentration -NOEC): Концентрация исследуемого вещества, находящаяся сразу под LOEC. которая не оказывает никакого статистически значимого воздействия на рост тестируемой группы водорослей и (или) цианобактерий по сравнению с контрольной группой в пределах установленного периода экспозиции.
3.4 коэффициент изменчивости (КИ) (Coefficient of variation): Безразмерная величина
изменчивости показателя, определяемая как отношение стандартного отклонения к среднему. Данный коэффициент также может быть выражен в процентах. Средний коэффициент изменчивости средней специфической скорости роста водорослей и (или) цианобактерий в параллельных контрольных тестах вычисляют как среднее значение коэффициента изменчивости средней специфической скорости роста водорослей и (или) цианобактерий для суток или группы в соответствующем параллельном контрольном тесте._
Издание официальное
1
3.5 ЕСХ: Концентрация исследуемого вещества, которая приводит к х%-ному (например. 50%-ному) сокращению роста водорослей и (или) цианобактерий в течение установленного периода воздействия (период воздействия должен быть указан отдельно, если он отличается от стандартного или полного периода тестирования). Для однозначного обозначения величины ЕС. полученной из скорости роста, используется обозначение Е.С. из прироста - обозначение Е,С.
3.6 переменная отклика (Response variable): Переменная для оценки токсичности, полученная на основании любых измеряемых параметров описания биомассы с помощью различных расчетных методов. Для данного тестирования скорость роста и прирост являются переменными отклика, полученными при измерении непосредственно биомассы или любого из показателей-заменителей.
3.7 питательная среда (Growth medium): Синтетическая питательная среда, в которой развиваются тестируемые водоросли и (или) цианобактерии. Как правило, исследуемое вещество растворяют в питательной среде.
3.8 прирост (Yield): Измеренная величина переменной в конце тестирования за минусом измеренной величины переменной в начале тестирования, используемая для выражения увеличения биомассы во время тестирования.
3.9 скорость роста (средняя специфическая скорость роста) (Growth rate): Логарифмическое увеличение биомассы во время воздействия исследуемого вещества.
3.10 специфическая скорость роста (Specific growth rate): Переменная отклика, определяемая как соотношение разности натуральных логарифмов параметра наблюдения (биомассы) и соответствующего периода.
4 Общие сведения
Тестирование позволяет оценить воздействие более чем на несколько поколений водорослей и (или) цианобактерий.
Экспоненциально растущие водоросли и (или) цианобактерии подвергаются воздействию исследуемого вещества в течение 72 ч.
Отклик водорослей и (или) цианобактерий заключается в сокращении их роста при воздействии различных концентраций исследуемого вещества.
Отклик оценивают как функцию концентрации исследуемого вещества по сравнению со средним ростом водорослей и (или) цианобактерий в параллельных, не подверженных воздействию исследуемого вещества, контрольных пробах.
Для полного выражения системного отклика на токсическое воздействие (оптимальной чувствительности) водоросли и (или) цианобактерии неограниченно экспоненциально растут при соблюдении соответствующих питательных условий и параметров освещения в течение определенного периода, достаточного для измерения снижения специфической скорости роста.
5 Принцип тестирования
5.1 Рост и ингибирование роста водорослей и (или) цианобактерий могут быть определены количественно на основании измерений водорослевой биомассы в зависимости от времени.
Водорослевую биомассу определяют как сухую массу водорослей на 1 л тестируемого раствора.
Поскольку сухую массу трудно измерить, используют показатели - заменители биомассы, например количество клеток (объем клеток, флюоресценция, оптическая плотность).
5.2 Результатом тестирования является ингибирование роста, выраженное как логарифмическое увеличение биомассы (средней специфической скорости роста) в течение периода воздействия.
Из средних специфических скоростей роста, зарегистрированных в серии тестируемых растворов, концентрация, вызывающая определенное х%-ное ингибирование роста (например. 50%-ное) определяется и выражается как Е,С« (например. Е,См)
5.3 В качестве дополнительного параметра отклика рекомендуется использовать прирост, который определяется как изменение биомассы в конце тестирования по отношению к ее значению в начале тестирования. От прироста, зарегистрированного в серии тестируемых растворов, концентрация, вызывающая определенное х%-ное ингибирование роста (например. 50%-ное), определяется и выражается как Е,С, (например. EyCso)-
5.4 В результате тестирования могут быть определены наименьшая наблюдаемая эффективная концентрация (LOEC) и неэффективная наблюдаемая концентрация (NOEC).
2
6 Информация об исследуемом веществе
6.1 Информация об исследуемом веществе должна содержать сведения о растворимости исследуемого вещества в воде, коэффициенте распределения н-октанол - вода Р,** и давлении пара Количественное определение исследуемого вещества в тестируемых растворах необходимо проводить с помощью достоверного аналитического метода с известной точностью и пределом обнаружения.
6.2 Полезной может быть также информация:
о структурной формуле исследуемого вещества;
- о чистоте исследуемого вещества;
об устойчивости на свету;
о стабильности в условиях тестирования;
- о способности поглощать свет;
о константе диссоциации рКа;
- о способности к трансформациям в окружающей среде, включая результат тестирования на потенциальную способность исследуемого вещества к биоразложению.
7 Достоверность тестирования
Устанавливаются следующие критерии достоверности:
- биомасса в контрольных пробах должна увеличиваться экспоненциально с минимальным коэффициентом 16 в течение 72 ч. что соответствует специфической скорости роста, равной 0.92 за 24 ч (день ). Для часто используемых видов водорослей скорость роста существенно выше (приложение А). Данный критерий может не устанавливаться, если используются виды, растущие медленнее, чем виды, указанные в приложении А В таком случае период тестирования должен быть продлен для того, чтобы получить 16-кратный рост контрольной группы водорослей и (или) цианобактерий. В то же время рост контрольной группы водорослей и (или) цианобактерий должен быть экспоненциальным в течение тестирования Период тестирования может быть сокращен до 48 ч для поддержания неограниченного экспоненциального роста контрольной группы водорослей и (или) цианобактерий до тех пор. пока коэффициент роста не достигнет 16;
средний коэффициент изменчивости для специфической скорости роста (дни 0 - 1. 1 - 2 и 2 - 3-й для 72 ч) в контрольных группах не должен превышать 35%. Данный критерий относится к средним значениям КИ. вычисленным в параллельных контрольных пробах;
коэффициент изменчивости средней специфической скорости роста в параллельных контрольных пробах не должен превышать 7% при тестировании Pseudokirchneriella subcapitata и Desmodesmus subspicatus Для остальных видов водорослей данная величина не должна превышать 10%.
8 Стандартные вещества
Для оценки правильности проведения тестирования рекомендуется использовать стандартное вещество, например 3,5-дихлорфенол. Для зеленых водорослей в качестве стандартного вещества может быть использован дихромат калия. Необходимо проводить тестирование со стандартным веществом как минимум два раза в год.
9 Применимость тестирования
Тестирование, как правило, проводят для растворимых в воде веществ. Для исследования летучих веществ, сильных адсорбентов, окрашенных веществ, имеющих низкую растворимость, или веществ, которые могут повлиять на доступность питательных веществ или минералов в питательной среде, могут понадобиться изменения процедуры тестирования (например, использование закрытой системы, кондиционирование тестовых сосудов) (1) - (3).
3
10 Описание тестирования
10.1 Оборудование
10.1.1 При тестировании используются сосуды, изготовленные из стекла или другого химически инертного материала. Оборудование необходимо тщательно промыть. Никакие органические или неорганические загрязнители не должны влиять на рост водорослей и (или) цианобактерий или на состав питательной среды.
10.1.2 В качестве тестовых сосудов, как правило, используются стеклянные колбы объемом, достаточным для проведения измерений и обеспечивающим необходимый массовый перенос углекислого газа (СО;) из атмосферы. Объем жидкости должен быть достаточным для аналитических определений.
10.1.3 Может потребоваться:
аппарат для культивирования: рекомендуется использовать емкости, в которых может поддерживаться выбранная температура инкубации ± 2*С;
оборудование для измерения освещенности: метод измерения интенсивности света, и в частности тип рецептора (коллектора), может оказать существенное влияние на измеряемую величину. Рекомендуется проводить измерения с использованием сферического 4тт рецептора, который реагирует на прямой или отраженный свет от всех углов выше и ниже уровня измерения, или 2тт рецептора, который реагирует на свет от всех углов выше уровня измерения;
оборудование для измерения водорослевой биомассы: количество клеток водорослей является наиболее часто используемым показателем-заменителем биомассы. Подсчет клеток проводится с использованием электронного счетчика частиц или микроскопа.
Другие показатели-заменители могут быть измерены с помощью проточного цитометра, флуориметра. спектрофотометра или колориметра. Необходимо вычислить коэффициент перевода количества клеток в сухой вес биомассы. Для проведения значимых измерений для низких концентраций биомассы с помощью спектрофотометра необходимо использовать кюветы со световым путем г 4 см.
10.2 Выбор видов
10.2.1 Возможно использование нескольких видов неприкрепленных водорослей и (или) цианобактерий. Водорослевые штаммы, подходящие для проведения тестирования, перечислены в приложении А.
10.2.2 Если используются другие виды водорослей и (или) цианобактерий, то в отчете о проведении тестирования необходимо указать штаммы и (или) их происхождение. Необходимо убедиться в том. что экспоненциальный рост выбранного вида водорослей может поддерживаться на протяжении всего тестирования при преобладающих условиях.
10.3 Питательная среда
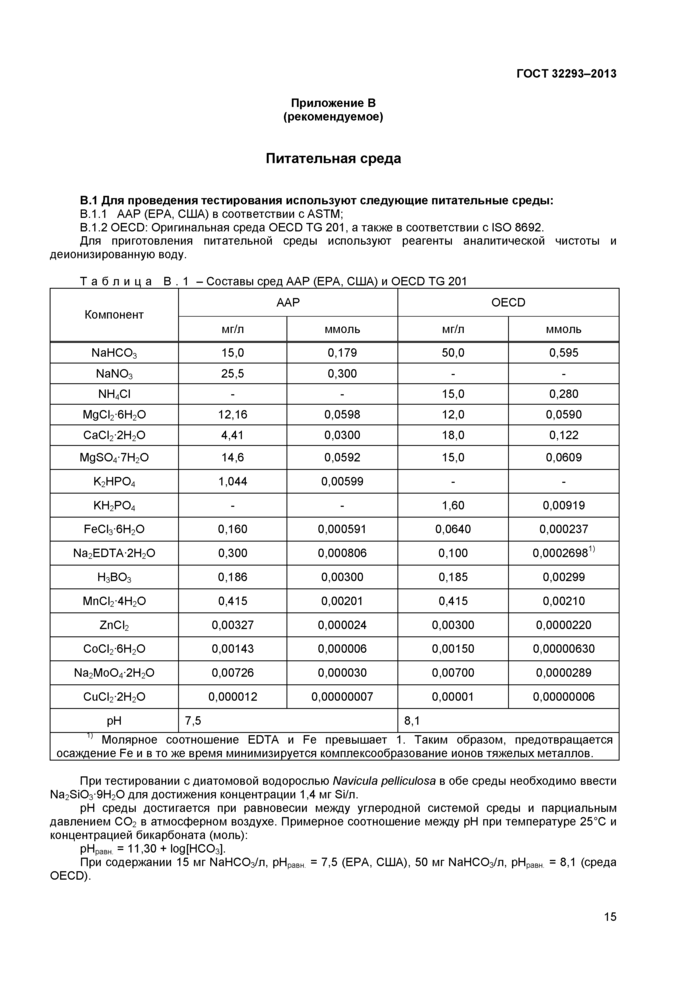
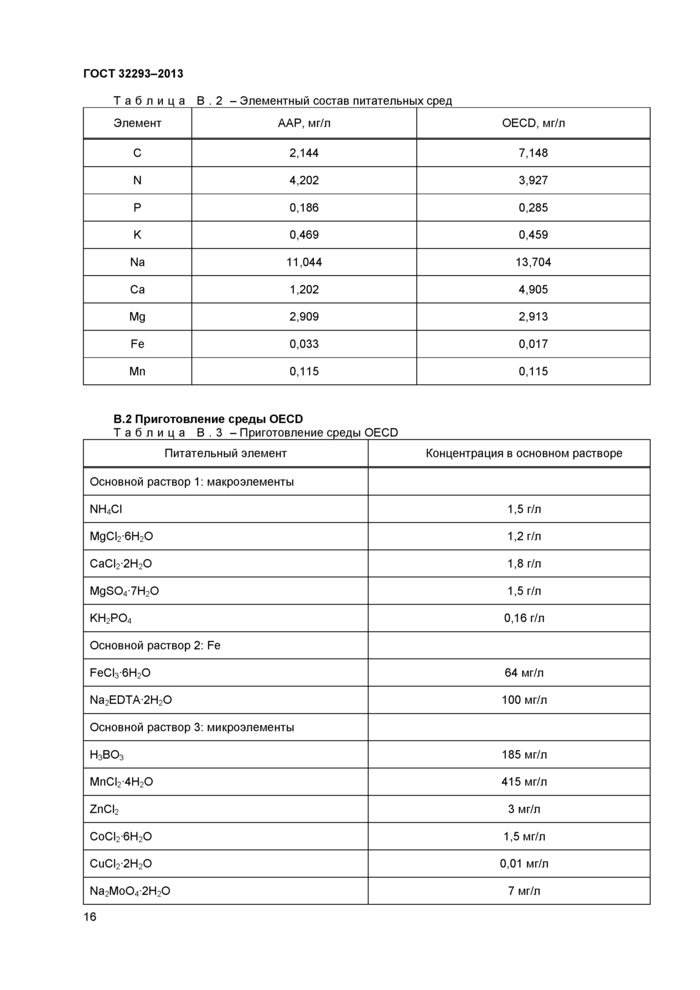
10.3.1 При проведении тестирования рекомендуется использовать две аналогичные питательные среды - ААР и OECD. Составы питательных сред приведены в приложении В.
Начальное значение pH и буферная емкость (регулирующая увеличение pH) у данных сред различны.
Результаты тестирования могут отличаться в зависимости от используемой питательной среды, особенно при тестировании диссоциирующих веществ.
10.3.2 Модификация питательной среды может быть необходима при исследовании металлов и комплексообразующих веществ, а также при исследовании различных значений pH.
Использование модифицированной среды должно быть обосновано в отчете о проведении тестирования.
10.4 Начальная концентрация биомассы
Количество биомассы в начале тестирования должно быть одинаковым для всех тестируемых видов и достаточно низким для того, чтобы наблюдался экспоненциальный рост в течение инкубационного периода без риска питательного истощения. Начальное количество биомассы не должно превышать 0.5 мг/л в пересчете на сухой вес. Рекомендуется использовать следующее начальное количество биомассы:
- Pseudokirchneriella subcapitata: 5 * 10J - 104 клеток/мл;
- Desmodesmus subspicatus: 2 - 5 *10э клеток/мл;
- Navicula pelliculosa: 104 клеток/мл;
- Anabaena flos-aquae 104 клеток/мл;
- Synecbococcus leopoliensis. 5 * 104 - 10' клеток/мл.
10.5 Концентрации исследуемого вещества
Диапазон концентраций, в котором, вероятно, будет наблюдаться воздействие, может быть определен на основе результатов исследования по подбору диапазона концентраций. Для заключительного определяющего исследования необходимо выбрать по крайней мере, пять концентраций, составляющих геометрическую прогрессию со знаменателем, не превышающим 3.2. Для исследуемых веществ, показывающих пологие кривые отклика, может быть выбран более высокий коэффициент. Необходимо, чтобы тестируемые концентрации находились в диапазоне, вызывающем ингибирование скорости роста водорослей в диапазоне от 5 до 75%.
10.6 Параллельные и контрольные пробы
10.6.1 Предусмотрено использование трех параллельных проб для каждой тестируемой концентрации. Если не требуется определять NOEC. то количество тестируемых концентраций может быть увеличено, а количество параллельных проб для каждой концентрации уменьшено Количество контрольных проб должно в два раза превышать количество параллельных проб для каждой тестируемой концентрации.
10.6.2 Отдельный набор тестируемых растворов готовят для аналитического определения концентраций исследуемого вещества.
10.6.3 Если для подготовки тестируемого раствора используется растворитель, то готовят дополнительную контрольную пробу с растворителем в используемой концентрации.
11 Проведение тестирования
11.1 Подготовка прививочной культуры
11.1.1 Для адаптации исследуемых водорослей к условиям тестирования и гарантии того, что водоросли находятся в фазе экспоненциального роста при прививании тестируемых растворов, прививочная культура в питательной среде готовится за 2 - 4 дня до начала тестирования.
11.1.2 Водорослевая биомасса должна быть приспособлена к условиям тестирования так. чтобы экспоненциальный рост преобладал в прививочном материале до начала тестирования.
11.1.3 Прививочную культуру выдерживают при тех же условиях, что и тестируемые виды. Измеряют увеличение биомассы в прививочной культуре для проверки того, что скорость роста находится в пределах нормального диапазона для тестируемого вида в условиях культивирования. Пример процедуры культивирования морских водорослей описан в приложении С. Для того чтобы избежать синхронного деления клеток во время тестирования, может потребоваться второй этап культивирования прививочной культуры.
11.2 Подготовка тестируемых растворов
11.2.1 Все тестируемые растворы должны содержать одинаковое количество питательной среды и начальной биомассы. Тестируемые растворы с выбранными концентрациями обычно готовятся путем перемешивания основного исследуемого вещества с питательной средой и прививочной культурой. Основные растворы обычно готовятся путем растворения исследуемого вещества в питательной среде.
11.2.2 Растворители, например ацетон, трет-бутиловый спирт и диметилформамид. могут использоваться в качестве носителей для добавления плохо растворимых веществ к питательной среде. Концентрация растворителя не должна превышать 100 мл/л, такая же концентрация растворителя должна быть добавлена ко всем пробам, включая контрольные пробы.
11.3 Инкубация
11.3.1 Тестовые сосуды укупоривают водонепроницаемыми заглушками. Тестовые сосуды встряхивают и помещают в аппарат для культивирования. Во время тестирования необходимо поддерживать суспензию водорослей и стимулировать перенос углекислого газа (СО.--) за счет непрерывного встряхивания сосудов. Температуру тестовых сосудов необходимо поддерживать в диапазоне от 21 до 24 ± 2°С.
11.3.2 Для культивирования видов, отличных от перечисленных в приложении А. например тропических видов, могут быть необходимы более высокие температуры при условии, что выполняются критерии достоверности тестирования.
11.3.3 Рекомендуется помещать тестовые сосуды в инкубатор в случайном порядке и ежедневно перемещать их.
11.3.4 Значение pH контрольной пробы во время тестирования не должно увеличиваться более чем на 1.5 единицы. Для металлов и соединений, которые частично ионизируются при pH в диапазоне тестового значения pH, необходимо ограничить отклонения значений pH. чтобы получить воспроизводимые и четкие результаты. Отклонение pH < 0.5 может быть технически обеспечено и достигается путем установления соответствующего уровня переноса углекислого газа (СО;) из
5
окружающего воздуха к тестируемому раствору, например за счет увеличения скорости перемешивания или снижения потребления углекислого газа (СО:) путем сокращения начальной биомассы или продолжительности тестирования.
11.3.5 Поверхность, на которой выдерживаются тестовые сосуды, должна получать непрерывное, однородное флуоресцентное освещение, например «холодный» белый или дневной свет.
Штаммы водорослей и (или) цианобактерий требуют различных условий освещенности.
Интенсивность света должна быть подобрана с учетом тестируемых видов.
Примеры
1 Для рекомендуемых видов зеленых водорослей выбирают интенсивность света на уровне тестируемых растворов в диапазоне от 60 до 120 мкЕм2с' в фотосинтетически эффективном диапазоне длин волн 400 - 700 нм при измерении с использованием соответствующего рецептора.
2 Anabaena flos-aquae хорошо растут при более низкой интенсивности света и могут быть повреждены при высокой интенсивности света. Для таких видов должна быть подобрана средняя интенсивность света в диапазоне от 40 до 60 мкЕм'2?1. Для измерительных приборов, откалиброванных в люксах, эквивалентный диапазон от 4440 до 8880 люксов для «холодного» белого света приблизительно соответствует рекомендуемой интенсивности света в диапазоне от 60 до 120 мкЕ м 2 с'\
Интенсивность света поддерживают в пределах ± 15% от средней интенсивности света в зоне инкубации.
11.4 Продолжительность тестирования
Продолжительность тестирования обычно составляет 72 ч. Она может быть уменьшена или увеличена при условии, что все критерии достоверности выполняются.
11.5 Измерения и аналитические определения
11.5.1 Водорослевая биомасса в каждом тестовом сосуде измеряется как минимум ежедневно.
11.5.2 Измерение биомассы выполняется с помощью микроскопа или электронного счетчика частиц (количество клеток и (или) биообьем). Альтернативные методы, например поточная цитометрия, in vitro или in vivo, флюоресценция или оптическая плотность могут использоваться, если в тестовом диапазоне биомассы может быть продемонстрирована удовлетворительная корреляция с биомассой.
11.5.3 Величины pH тестируемых растворов измеряют в начале и в конце тестирования.
11.54 Концентрацию исследуемого вещества в тестируемых растворах необходимо проанализировать для проверки начальных значений и поддержания необходимых значений во время тестирования.
11.5.5 Если в течение тестирования с низкой и высокой тестируемой концентрацией и концентрацией, близкой к ожидаемой величине ЕС;ю, начальная концентрация исследуемого вещества изменяется менее чем на 20% от номинального значения, то достаточно проводить определение концентрации в начале и в конце тестирования.
11.5.6 Определение всех тестируемых концентраций в начале и в конце тестирования рекомендуется проводить, если маловероятно, что тестируемые концентрации сохранятся в диапазоне от 80 до 120% от номинальных значений.
11.5.7 Для летучих, нестабильных или сильно адсорбирующихся исследуемых веществ рекомендуется дополнительный отбор проб для анализа в 24-часовые интервалы во время периода воздействия в целях более точного описания потребления исследуемого вещества. Для таких веществ необходимо использовать дополнительные параллельные пробы.
11.5.8 Во всех случаях определение концентраций вещества должно только выполняться в одной из параллельных проб для каждой тестируемой концентрации.
11.5.9 Питательная среда, приготовленная специально для анализа концентраций во время тестирования, должна подвергаться такой же обработке, что и среда, используемая для тестирования, например, она должна быть инокулирована водорослями и культивироваться в аналогичных условиях. Если требуется проводить анализ концентрации исследуемого вещества, то необходимо отделять водоросли от питательной среды. Осаждение водорослей предпочтительно проводить центрифугированием с низкой центробежной силой.
11.5.10 Если концентрация исследуемого вещества сохраняется в пределах ± 20% от номинальной или начальной концентрации во время тестирования, то анализ результатов тестирования проводится с использованием номинальных или начальных величин. Если отклонение от номинальной или начальной величины превышает ± 20%. то анализ результатов должен основываться на средней геометрической концентрации исследуемого вещества, наблюдаемой во
6
время тестирования, или на моделях, описывающих снижение концентрации исследуемого вещества.
11.5.11 Вследствие динамичного роста водорослей трудно определить фактические концентрации исследуемого вещества, особенно для адсорбирующихся веществ в низких концентрациях. В подобных случаях снижение концентрации исследуемого вещества в тестируемом растворе вследствие адсорбции на увеличивающейся водорослевой биомассе не означает, что вещество удаляется из тестовой системы.
11.5.12 При проведении анализа результатов тестирования необходимо проверить, сопровождается ли снижение концентрации исследуемого вещества во время тестирования замедлением ингибирования роста водорослей. В этом случае необходимо использовать модель, описывающую снижение концентрации исследуемого вещества. В ином случае необходимо проводить анализ результатов на основании начальной (номинальной или измеренной) концентрации исследуемого вещества.
11.6 Прочие наблюдения
Для проверки нормального и здорового развития прививочного материала и наблюдения за любыми отклонениями в развитии водорослей (вследствие воздействия исследуемого вещества) в конце тестирования должны проводиться микроскопические наблюдения.
11.7 Определение диапазона предельных концентраций исследуемого вещества
11.7.1 В некоторых случаях, например когда предварительное тестирование показывает, что исследуемое вещество не оказывает токсичного воздействия в концентрациях ниже 100 мг/л или ниже своего предела растворимости в питательной среде (по наименьшему показателю), может быть проведено определение диапазона предельных концентраций исследуемого вещества, направленное на сравнение откликов в контрольной пробе и одной из тестовых проб (100 мг/л или концентрация, равная пределу растворимости).
11.7.2 Все указанные ранее условия проведения тестирования и критерии достоверности применимы к определению диапазона предельных концентраций исследуемого вещества, за исключением того, что количество параллельных проб должно быть не менее шести. Анализ переменных отклика в контрольной пробе и тестовых пробах может быть проведен с использованием статистического теста, например t-теста Стьюдента. Если расхождения в этих пробах неравны, то должен быть проведен t-тест. приспособленный для неравных расхождений.
12 Данные и отчет о проведении тестирования
12.1 Кривые роста
12.1.1 Биомасса в тестовых сосудах может быть выражена в единицах показателя-заменителя, используемого для измерения (например, число клеток, флюоресценция).
12.1.2 В таблицу сводят следующие показатели: измеренную концентрацию биомассы в тестовых и контрольных пробах, концентрации исследуемого вещества и время их измерения, зарегистрированное с интервалом в 1 ч. Для построения графиков могут использоваться как логарифмическая, так и линейная шкалы, но использование логарифмической шкалы является обязательным и дает лучшее представление об изменениях в тестовой пробе во время тестирования. Следует отметить, что экспоненциальный рост дает прямую линию при использовании логарифмической шкалы и наклон линии указывает на определенную скорость роста водорослей и (или) цианобактерий.
12.1.3 Используя графики, выясняют, происходит ли рост водорослей и (или) цианобактерий экспоненциально с ожидаемой скоростью во время тестирования. Изучают все значения показателей, внешний вид графиков и проводят анализ возможных ошибок. В частности, проверяют любые значения, которые отклоняются за счет систематических ошибок. Если очевидно, что могут быть идентифицированы ошибки, допущенные в процедурах, или их появление возможно с большей вероятностью, то соответствующие значения расцениваются как отклоняющиеся и не включаются в последующий статистический анализ. Нулевая концентрация водорослей в одной из параллельных проб может указывать на то. что инокулирование было проведено неправильно или сосуд был промыт ненадлежащим образом. В отчете о проведении тестирования необходимо указать на причины рассмотрения того или иного значения в качестве отклоняющегося. Статистический анализ для идентификации отклоняющихся значений имеет ограниченное использование для данного вида задач и не может заменить оценки эксперта. Отклоняющиеся значения (отмеченные как таковые) должны быть сохранены среди остальных значений, указанных на графике или представленных в таблице.
12.2 Переменные отклика
12.2.1 В настоящем стандарте рассматриваются две переменные отклика, с использованием которых должно быть оценено воздействие на:
а) среднюю специфическую скорость роста: данная переменная отклика вычисляется на основе логарифмического увеличения биомассы во время тестирования из расчета на один день:
б) прирост: данная переменная отклика равна биомассе в конце тестирования за минусом биомассы в начале тестирования.
12.2.2 Необходимо отметить, что показатели токсичности, вычисленные с использованием данных переменных отклика, не сопоставимы друг с другом, и данное различие должно учитываться при использовании результатов тестирования. Значения ЕС,, основанные на средней специфической скорости роста (Е,С,). как правило, будут выше результатов, основанных на приросте (ЕУС,). если изложенные в настоящем стандарте условия соблюдаются. Это не должно интерпретироваться как различие в чувствительности между данными переменными отклика, величины отличаются только математически. Понятие «средняя специфическая скорость роста» дается на общем образце экспоненциального роста водорослей в неограниченных культурах, где токсичность оценивается на основании воздействия на скорость роста и не зависит от абсолютного уровня специфической скорости роста в контрольной пробе, наклона кривой тестируемая концентрация - отклик или на продолжительности тестирования.
12.2.3 Результаты, основанные на переменной прироста, зависят от всех переменных. ЕуС* зависит от специфической скорости роста водорослей, используемых в каждом тестировании, и от максимальной специфической скорости роста, которая может измениться в зависимости от вида или штамма водорослей. Переменная прироста не должна использоваться для сравнения чувствительности к токсичным веществам среди видов или различных штаммов водорослей.
12.3 Средняя специфическая скорость роста
\nX.-\nXl( .v
Ц.-t =— ->')•
12.3.1 Средняя специфическая скорость роста вычисляется как логарифмическое увеличение биомассы для каждой тестовой и контрольной пробы по соотношению:
(1)
где р,.у- средняя специфическая скорость роста от момента времени / до момента времени у;
X, - биомасса в момент времени /;
X. - биомасса в момент времени /
Для каждой тестовой и контрольной пробы вычисляют среднее значение для скорости роста наряду с оценкой различий.
12.3.2 Вычисляют среднюю специфическую скорость роста (обычно 0-3 дня), в качестве начального значения используя номинально привитую биомассу, а не измеренное начальное значение, поскольку в подобном случае достигается большая точность.
12.3.3 Оценивают поэтапные скорости роста, вычисляемые как специфические скорости роста в течение каждого дня проведения тестирования (0 - 1, 1 - 2 и 2 - 3-го дня), и определяют, остается ли скорость роста в контрольных пробах постоянной. Если значение специфической скорости роста в 1-й день тестирования значительно ниже, чем полная средняя специфическая скорость роста, то это может указывать на лаг-фазу. В то время как лаг-фаза может быть минимизирована или фактически устранена в контрольных пробах путем продления периода предварительной подготовки, наличие лаг-фазы в тестовых пробах может указывать на восстановление после начального воздействия или снижение экспозиции за счет потребления исследуемого вещества (включая адсорбцию на водорослевой биомассе) после начального воздействия.
12.3.4 Поэтапные скорости роста могут быть оценены в целях определения воздействия исследуемого вещества на рост водорослей и (или) цианобактерий во время тестирования. Существенные различия между поэтапной и средней скоростью роста указывают на отклонение от постоянного экспоненциального роста В этом случае необходимо более тщательное рассмотрение кривых роста.
12.3.5 Рассчитывают замедление средней специфической скорости роста для каждого тестирования по соотношению:
/, = -<—-4 00. (2)
Ис
где /г- ингибирование средней специфической скорости роста. %;
Рс - среднее значение средней специфической скорости роста (р) в контрольной пробе; рг- средняя специфическая скорость роста в параллельной пробе.