Методические рекомендации
Методика определения микроэлементов в диагностируемых биосубстратах методом масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС)
Купить Методические рекомендации — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Документ устанавливает методику количественного определения методом масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС) элементов (серебра, алюминия, мышьяка, золота, бария, бериллия, висмута, бора, кальция, кадмия, кобальта, хрома, меди, железа, галлия, германия, ртути, калия, лития, магния, марганца, молибдена, натрия, никеля, свинца, платины, рубидия, фосфора, сурьмы, селена, олова, стронция, титана, таллия, ванадия, вольфрама, цинка, циркония) в диагностируемых биосубстратах: волосы, ногти, кровь, плазма, грудное молочко, моча, аутопсийные материалы (печень, почки, миокард, плацента), слюна, зубы.
Документ предназначен для учреждений Государственной санитарно-эпидемиологической службы Российской Федерации, специальных служб федеральных органов исполнительной власти, осуществляющих ведомственный санитарно-эпидемиологический надзор, учреждений Минздрава России, лабораторий санитарно-гигиенического, клинического, экологического, скринингового и исследовательского профилей.
Оглавление
1. Назначение и область применения
2. Нормативные ссылки
3. Термины и определения
4. Принцип методики
5. Диапазон определяемых содержаний и характеристика погрешности
6. Характеристика масс-спектрометра
7. Оборудование, материалы, реактивы
8. Условия безопасного проведения работ
9. Требования к квалификации лиц, работающих на спектрометре
10. Условия выполнения измерений
11. Подготовка к проведению измерений
11.1. Отбор, хранение и подготовка проб
11.2. Разложение проб биосубстратов
11.3. Приготовление стандартных калибровочных растворов
11.4. Подготовка прибора
11.5. Коррекция спектральных изобарных наложений, коррекция полиатомных наложений, вызванных матрицами образцов, реагентов и газами плазмы, коррекция транспортных помех
11.6. Калибровка спектрометра
12. Выполнение измерений
13. Обработка и оформление результатов измерений
14. Контроль погрешности методики масс-спектрометрического определения микроэлементов
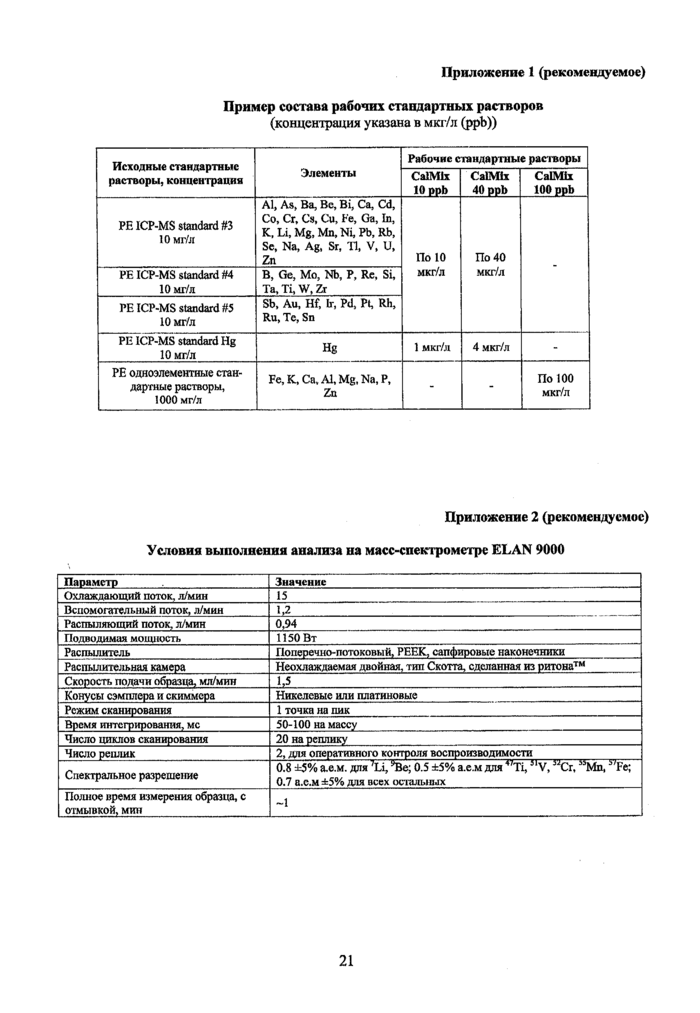
Приложение 1 (рекомендуемое). Пример состава рабочих стандартных растворов
Приложение 2 (рекомендуемое). Условия выполнения анализа на масс-спектрометре ELAN 9000
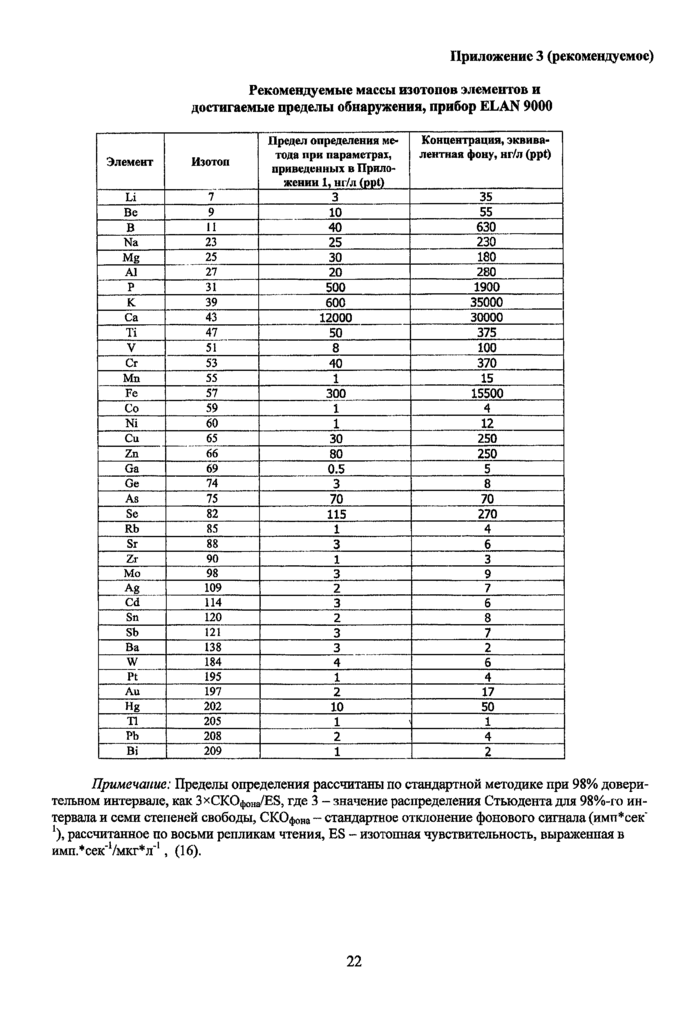
Приложение 3 (рекомендуемое). Рекомендуемые массы изотопов элементов и достигаемые пределы обнаружения, прибор ELAN 9000
Приложение 4. Форма протокола результатов определения микроэлементов в биосубстратах
Библиографические данные
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- Постановление 554 Об утверждении Положения о государственной санитарно-эпидемиологической службе Российской Федерации и Положения о государственном санитарно-эпидемиологическом нормировании
- Р 1.1.001-96 Общие требования к организации разработки нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования
- Р 1.1.002-96 Классификация нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования
- Р 1.1.003-96 Общие требования к построению, изложению и оформлению нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования
- Р 1.1.004-96 Порядок проведения научной экспертизы нормативных и методических документов
- Р 1.1.005-96 Порядок утверждения, регистрации, издания и распространения нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9
стр. 10
стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21
стр. 22
стр. 23

стр. 24

стр. 25
МЕТОДИКА ОПРЕДЕЛЕНИЯ МИКРОЭЛЕМЕНТОВ В ДИАГНОСТИРУЕМЫХ БИОСУБСТРАТАХ МЕТОДОМ МАСС-СПЕКТРОМЕТРИИ С ИНДУКТИВНОСВЯЗАННОЙ ПЛАЗМОЙ (ИСП-МС)
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Минздрав России Москва 2003 г.
МЕТОДИКА ОПРЕДЕЛЕНИЯ МИКРОЭЛЕМЕНТОВ В ДИАГНОСТИРУЕМЫХ БИОСУБСТРАТАХ МЕТОДОМ МАСС-СПЕКТРОМЕТРИИ С ИНДУКТИВНОСВЯЗАННОЙ ПЛАЗМОЙ (ИСП-МС)
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
|
г~1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
0,0001-0,001 |
40 |
41 |
40 |
90 | ||
|
Bi |
0,001-0,01 |
30 |
26 |
30 |
71 | |
|
0,01-0,1 |
25 |
15 |
15 |
35 | ||
|
В |
0,001-0,01 |
40 |
26 |
30 |
50 | |
|
0,01-1 |
20 |
20 |
20 |
30 | ||
|
1-10 |
20 |
10 |
10 |
15 | ||
|
Ge |
0,0001-0,01 |
40 |
41 |
40 |
90 | |
|
0,01-0,1 |
30 |
26 |
30 |
71 | ||
|
0,1-0,5 |
25 |
15 |
15 |
35 | ||
|
Hg |
0,0001-0,01 |
40 |
41 |
40 |
60 | |
|
0,01-0,1 |
20 |
26 |
30 |
40 | ||
|
0,1-1 |
20 |
15 |
15 |
20 | ||
|
Mo |
0,0001-0,01 |
40 |
41 |
40 |
60 | |
|
0,01-0,1 |
20 |
26 |
30 |
40 | ||
|
0,1-0,5 |
20 |
15 |
15 |
20 | ||
|
Pt |
0,0001-0,001 |
40 |
41 |
40 |
60 | |
|
0,001-0,01 |
20 |
26 |
30 |
40 | ||
|
0,01-0,1 |
20 |
15 |
15 |
20 | ||
|
Sb |
0,0001-0,01 |
40 |
41 |
40 |
90 | |
|
0,01-0,1 |
30 |
26 |
30 |
71 | ||
|
0,1-1 |
25 |
15 |
15 |
35 | ||
|
Se |
0,0005-0,005 |
40 |
41 |
40 |
90 | |
|
0,005-0,05 |
30 |
26 |
30 |
71 | ||
|
0,05-2 |
25 |
15 |
15 |
35 | ||
|
Sn |
0,0001-0,01 |
40 |
41 |
40 |
90 | |
|
0,01-0,1 |
30 |
26 |
30 |
71 | ||
|
0,1-2 |
25 |
15 |
15 |
35 | ||
|
Sr |
0,0001-0,01 |
40 |
26 |
30 |
50 | |
|
0,01-0,1 |
20 |
20 |
20 |
30 | ||
|
0,1-5 |
20 |
10 |
10 |
15 | ||
|
Tt |
0,00005- |
40 |
41 |
40 |
90 | |
|
0,0005 | ||||||
|
0,0005-0,005 |
30 |
26 |
30 |
71 | ||
|
0,005-0,1 |
25 |
15 |
15 |
35 | ||
|
V |
0,0005-0,05 |
40 |
26 |
30 |
50 | |
|
0,05-0,5 |
20 |
20 |
20 |
30 | ||
|
0,5 |
20 |
10 |
10 |
15 | ||
|
w |
0,0001-0,01 |
40 |
41 |
40 |
90 | |
|
0,01-0,1 |
30 |
26 |
30 |
71 | ||
|
0,1-0,5 |
25 |
15 |
15 |
35 |
• Стандартные образцы состава растворов одно- и многоэлементные, сертифицированные,
• Скальпель хирургический.
• Фильтровальная бумага.
■ Пластиковые промывалки для деионизованной воды и разбавленной азотной кислоты
• Пленка лабораторная герметизирующая PAKAFILM® или аналогичная
• Одноразовые полипропиленовые градуированные центрифужные пробирки без крышек, емкостью 15 мл, для хранения растворенных образцов
• Одноразовые полипропиленовые градуированные центрифужные пробирки с винтовыми крышками, емкостью 50 мл, для хранения рабочих стандартов.
8. Условия безопасного проведения работ
8.1. При работе с химическими веществами и реактивами необходимо соблюдать требования техники безопасности, установленные для работ с токсичными, едкими и легковоспламеняющимися веществами по ГОСТ 12.4.021. При работе необходимо соблюдать «Правила по технике безопасности и производственной санитарии при работе в химических лабораториях», утвержденные М3 СССР 20.12.82. (М., 1981).
8.2. Рабочие столы и поверхности должны содержаться в чистоте. В конце рабочего дня после отключения всех приборов проводится влажная уборка рабочих поверхностей.
8.3. Безопасность при работе с электроустановками обеспечивается по ГОСТ по ГОСТ 12.1.019 и осуществляется соблюдением «Правил технической эксплуатации электроустановок потребителей», утвержденных Госэнергонадзором от 21.12.1984 г.
8.4. Безопасность при работе с баллонами с аргоном обеспечивается соблюдением «Правил устройства и безопасной эксплуатации сосудов, работающих под давлением», утвержденные Госгортехнадзором СССР 27.11.87 (М.: Недра, 1989).
8.5. Помещение для проведения измерений должно соответствовать требованиям «Пожарных норм проектирования зданий и сооружений» (СНиП ПА-5-700, «Санитарных норм проектирования промышленных предприятий» (СН-245-71) и СниП-74, ГОСТ 12.1.004.
8.6. При выполнении работ должны быть соблюдены меры противопожарной безопасности в соответствии с требованиями ГОСТ 12.1.004-8.7. В лаборатории должны иметься средства пожаротушения по ГОСТ 12,4.009.
8.7. Требования безопасности соответствуют правилам и рекомендациям, изложенным в техническом описании на приборы.
9. Требования к квалификации лиц, работающих на спектрометре
К выполнению измерений на масс-спектрометре допускаются лица, прошедшие обучение навыкам работы на приборе ИСП-МС, подтвержденное аттестатом фирмы-производителя прибора; изучившие техническое описание измерительного прибора и методику выполнения измерений; обученные в соответствии с ГОСТ 12.0.004-79 и имеющие квалификационную группу не ниже 1 согласно «Правилам технической эксплуатации электроустановок потребителей», утвержденных Госэнергонадзором от 21.12.1984 г.; прошедшие инструктаж по технике безопасности на рабочем месте и ознакомленные с правилами обслуживания спектрометра. Для работы с источниками огнеопасных и токсичных газов допускаются лица, прошедшие соответствующую подготовку.
К проведению пробоподготовки допускаются операторы с квалификацией лаборант, имеющие опыт работы в химической лаборатории.
10. Условия выполнения измерений
Выполнение измерений проводят при нормальных климатических условиях испытаний в соответствии с ГОСТ 15150. Помещение не должно содержать токсичных паров и газов.
11
Температура окружающего воздуха в лаборатории 18 - 25°С. Атмосферное давление 84-106 кПа (630-800 мм рт. ст.). Относительная влажность воздуха 75±5 %. Градиент температуры не должен превышать 1,5 °С/час.
При использовании электроприборов частота переменного тока 50±1 Гц„ напряжение сети 220±10 В.
Освещение помещения естественное или искусственное, не ограничивается особыми требованиями.
11. Подготовка к проведению измерений
Подготовка проб указанных продуктов к анализу на содержание химических элементов должна обеспечивать надлежащее хранение проб, правильные процедуры проботбора и извлечения микроэлементов из проб, а также подготовку рабочего места для обработки доставленных в лабораторию проб. Все процедуры подготовки проб к анализу должны исключать возможность внесения в них загрязнений.
11.1. Отбор, хранение и подготовка проб
Волосы состригают с затылочной части головы на всю длину в количестве не менее 0.1г. Для снятия поверхностного загрязнения и обезжиривания волос применяется способ подготовки проб волос, рекомендованный МАГАТЭ. Для этого волосы обрабатываются ацетоном в течение 10-15 минут, а затем три раза промываются деионизованной водой. Сушка волос производится при комнатной температуре в течение 10-15 минут. Для длительного хранения используют обычные бумажные конверты.
Для проведения анализа ногтей необходимо срезать ногти с обеих рук. Полученное количество ногтей обрабатывают ацетоном в течение 10-15 минут, а затем три раза промывают дистиллированной водой. Сушка ногтей производится при комнатной температуре в течение 10-15 минут. Для длительного хранения используют обычные бумажные конверты.
Кровь может быть получена из локтевой вены (венозная, в условиях стационара) или из пальцев рук (капиллярная). Объем отобранной крови должен составлять не менее 1мл. Образцы крови хранятся в обычном холодильнике до 3-5 суток (от 0 до +4°С), либо замораживаются (до -4 -18°С), либо лиофилизуются, или высушиваются в сушильном шкафу (для длительного хранения). Отборы и техники забора таких биосубстратов как эритроцитарная масса, молоко, спермальная жидкость, слюна, сыворотка крови, лаваж та же.
Моча может собираться в течение 24 часов или быть средней порцией утренней мочи. Для исследования достаточно 5 мл. При длительном хранении мочу помещают в герметичную посуду (из лабораторного пластика), и хранят в холодильнике до 3-х суток.
Биоптаты мягких тканей (мышцы, кожа, эпителий, печень и др.) сразу же после забора, препарирования, удаления крови взвешиваются о точностью до 5 мг и помещаются в лабораторную пластиковую или стеклянную посуду, обеспечивающую герметичность хранения. Масса образца ткани от ОД г (минимальная, определение макроэлементов - железо, цинк, медь), до 3-5 г (определение содержания более 20 химических элементов). Хранение в холодильнике при температуре 0-+4°С до 7 суток или в морозильной камере до 20 суток или высушивание и лиофилизация образцов для длительного хранения.
Пробы конкрементов - зубов, фрагментов костной ткани особых условий хранения не требуют, помещаются в герметичную упаковку из лабораторного пластика.
12
11.2. Разложение проб биосубстратов
11.2.1. Волосы, Ногти. Другие твердые образцы. Открытое разложение. На аналитических весах берут навеску высушенных, обезжиренных по 11.1. и неизмельченных волос массой 0,01 - ОД г. Образец волос помещают во фторопластовый цилиндр, приливают 0,2-1 мл. концентрированной азотной кислоты, накрывают кусочком лабораторной пленки и помещают в термоблок, разогретый до температуры 115°С, выдерживают в течение 0,5-1,0 часов до полного растворения пробы. Растворенный образец количественно переносят в мерную полипропиленовую пробирку, троекратно смывая со стенок фторопластового цилиндра, и доводят деионизованной водой до 10 мл. Герметично закрывают кусочком лабораторной пленки, перемешивают и передают на анализ.
11.2.2. Жидкие образцы. Открытое разложение. Навеску анализируемого объекта ОД - 0,5 г (ОД - 0,5 мл) берут на аналитических весах во фторопластовые цилиндры, определяя массу навески по разнице массы пробирки до и после взятия навески. В пробирку приливают 0,3-1 мл концентрированной азотной кислоты, накрывают кусочком лабораторной пленки и помещают в термоблок, разогретый до 115°С. Выдерживают в термоблоке в течение 0,5-1,0 часов до гомогенизации пробы и далее действуют, как описано в п. 11.2.1.
При работе с гомогенными водными средами, такими как моча, лимфа, плазма и даже цельная кровь допускается простое разбавление образца 2-3 % азотной кислотой, непосредственно перед анализом. Для этого к навеске образца в мерной пробирке приливается 5-7 мл деионизованной воды, затем 0,3-0,5 мл концентрированной азотной кислоты и проба доводится до 10-15 мл деионизованной водой. В этом случае не рекомендуется уменьшать фактор разбавления пробы ниже, чем 1 : 100, во избежание осаждения белков, а также для компенсации высокой вязкости образцов и склонности к пенообразованию. Пробы, растворенные таким способом не рекомендуется хранить до анализа долгое время (свыше суток).
11.2.3. Микроволновая пробоподготовка. Навеску образца по п. 11.2.1 или по 11.2.2 помещают во фторопластовый вкладыш и добавляют 5 мл азотной кислоты. Автоклав с пробой во вкладыше помещают в микроволновую печь и разлагают пробу, используя пренрамму разложения, рекомендованную производителем печи. В общем случае, для мягких тканей, волос и жидкостей можно применять следующий режим нагрева: подъем температуры до 200 °С в течение 5 мин, выдерживание в течение 5 мин при 200 °С, охлаждение до 45 °С. Охлажденный автоклав встряхивают для перемешивания содержимого и приоткрывают крышку для уравновешивания давления. Качественно разложенная проба после отгона окислов азота должна представлять собой бесцветный или желтоватый прозрачный раствор, без нерастворившихся частиц на дне и на стенках вкладыша. Растворенную пробу количественно переносят в пробирку объемом 15 мл, троекратно встряхивая вкладыш с крышкой с 1 мл деионизованной воды и перенося каждый смыв в пробирку, доводят объем до 10 мл деионизованной водой, закрывают и перемешивают. Автоматическим дозатором со сменным наконечником отбирают аликвоту 1 мл и доводят до 10 мл 0.5% азотной кислотой, закрывают, передают на анализ. Данные об объеме аликвоты и объеме разведения вводят в программное обеспечение спектрометра вместе с названием и навеской образца.
Допускается непосредственный отбор аликвоты объемом 0,1-0,5 мл из разложенной пробы в автоклаве. Чтобы скомпенсировать при этом погрешность разбавления, перед разложением в пробу нужно добавить раствор внутреннего стандарта (In или Rh), чтобы концентрация внутреннего стандарта в конечном растворе, направляемом на анализ, составляла примерно 10 мкг/л (например, добавить в пробу 100 мкл раствора, содержащего 10 мг/л Rh, затем из 5 мл разложенной пробы взять аликвоту 0,5 мл и довести до 10 мл). Раствор внутреннего стандарта необходимо добавлять во все холостые пробы и в калибровочные растворы. Заданную концентрацию внутреннего стандарта (10 мкг/л) в холостых и стандартных растворах необходимо точно соблюдать.
11.2.4. Раствор холостой пробы готовят с выполнением всех указанных выше операций, за исключением операции взятия навески.
13
11.3. Приготовление стандартных калибровочных растворов
Рабочие стандартные растворы готовят путем смешивания нескольких опорных многоэлементных стандартных растворов, содержащих разные группы элементов. Для калибровки спектрометра используются два-три рабочих стандарта, содержащих, например, по 10, 40 и 100 мкг/л всех элементов, за исключением ртути, содержание которой составляет 1 и 4 мкг/л в первых двух стандартных растворах. Стандартный раствор, содержащий по 100 мкг/л элементов используется для калибровки спектрометра для определения матричных элементов, таких как Na, Mg, Al, Р, К, Са, Fe, Zn. Для более точного определения матричных элементов, может потребоваться применение стандартного раствора, в котором их концентрации были бы одного порядка с верхними границами диапазона содержаний элементов в исследуемом объекте, с учетом применяемого фактора разбавления. Приготовленные рабочие растворы сохраняются в полипропиленовых центрифужных пробирках объемом 50 мл. Рекомендуется использовать рабочие стандарты для калибровки в течение 3-5 дней после приготовления. Пример состава рабочих калибровочных растворов приведен в Приложении 1.
11.4. Подготовка прибора
Масс-спектрометр подготавливают к работе в соответствии с руководством пользователя (инструкцией по эксплуатации). Необходимые режимы работы устанавливают в соответствии с рекомендациями производителя. Пример режима проведения измерений приведен в Приложении 2. Для конкретного типа прибора оптимальные режимы могут быть установлены экспериментально. После запуска прибора производят проверку рабочих характеристик прибора, включая проверку чувствительности во всем диапазоне масс, проверку уровня фона, уровня вторичных оксидных и двузарядпых ионов, воспроизводимости (путем рассчета СКО по 5-6 последовательным измерениям сигналов),
11.5 Коррекция спектральных изобарных наложений, коррекция полиатомных наложений, вызванных матрицами образцов, реагентов и газами плазмы, коррекция транспортных помех
Коррекция трех основных видов помех в традиционном ИСП-МС анализе с вводом жидкой пробы (без применения динамических реакционных систем), проводится с использованием трех разных методов, отличающихся между собой как сложностью, так и надежностью. Выявление помех при отладке методики проводится путем определения стандартных добавок и измерением серии последовательно разбавленных проб.
Коррекция изобарных наложений. Примеры применяемых коррекции наложений от изобарных ионов приведены в таблице 2. В программных пакетах современных масс-спектрометров такие процедуры коррекции предлагаются автоматически. Точные коэффициенты коррекции определяются экспериментально.
Таблица 2.
|
Некоторые изобарные наложения | ||||||||||||||||||
| ||||||||||||||||||
|
14 |
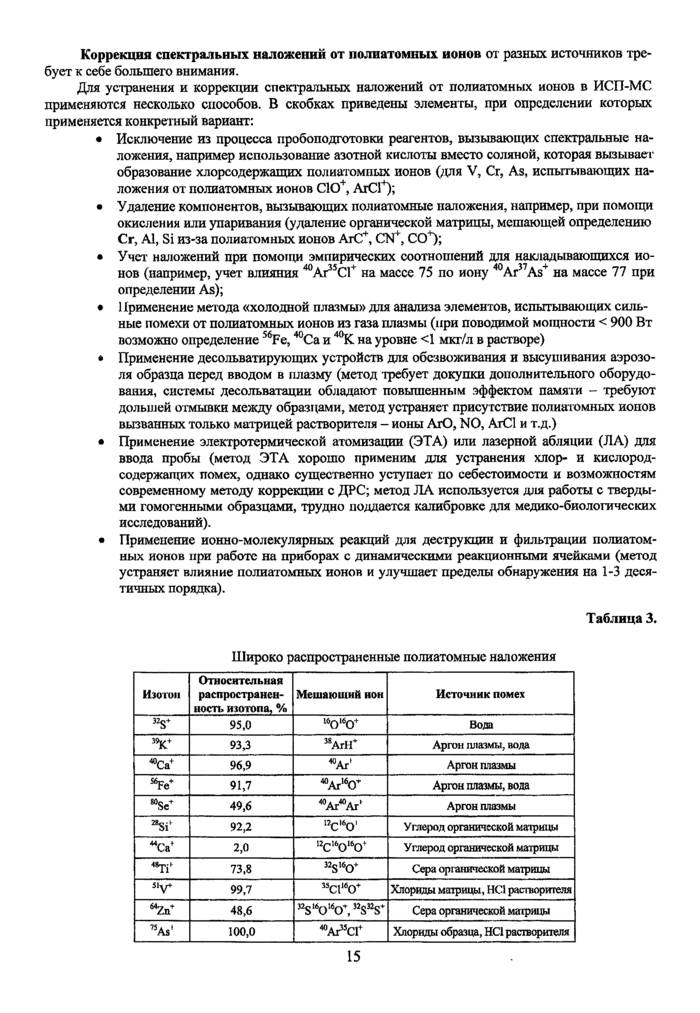
Коррекция спектральных наложений от полиатомных ионов от разных источников требует к себе большего внимания.
Для устранения и коррекции спектральных наложений от полиатомных ионов в ИСП-МС применяются несколько способов. В скобках приведены элементы, при определении которых применяется конкрешый вариант:
• Исключение из процесса пробоподготовки реагентов, вызывающих спектральные наложения, например использование азотной кислоты вместо соляной, которая вызывает образование хлорсодержащих полиатомных ионов (для V, Сг, As, испытывающих наложения от полиатомных ионов СЮ+, АгС1+);
• Удаление компонентов, вызывающих полиатомные наложения, например, при помощи окисления или упаривания (удаление органической матрицы, мешающей определению Сг, Al, Si из-за полиатомных ионов АгС+, CN+, ССГ);
• Учет наложений при помощи эмпирических соотношений для накладывающихся ионов (например, учет влияния 40Аг35С1+ на массе 75 по иону 40Ar37As+ на массе 77 при определении As);
• Применение метода «холодной плазмы» для анализа элементов, испытывающих сильные помехи от полиатомных ионов из газа плазмы (при поводимой мощности < 900 Вт возможно определение S6Fe, 40Са и 40К на уровне <1 мкг/л в растворе)
• Применение десольватирующих устройств для обезвоживания и высушивания аэрозоля образца перед вводом в плазму (метод требует докупки дополнительного оборудования, системы десольватации обладают повышенным эффектом памяти - требуют дольшей отмывки между образцами, метод устраняет присутствие полиатомных ионов вызванных только матрицей растворителя - ионы ArO, NO, АгС1 и т.д.)
• Применение электротермической атомизации (ЭТА) или лазерной абляции (ДА) для ввода пробы (метод ЭТА хорошо применим для устранения хлор- и кислородсодержащих помех, однако существенно уступает’ по себестоимости и возможностям современному методу коррекции с ДРС; метод ДА используется для работы с твердыми гомогенными образцами, трудно поддается калибровке для медико-биологических исследований).
• Применение ионно-молекулярных реакций для деструкции и фильтрации полиатомных ионов при работе на приборах с динамическими реакционными ячейками (метод устраняет влияние полиатомных ионов и улучшает пределы обнаружения на 1-3 десятичных порядка).
Таблица 3.
|
Широко распространенные полиатомные наложения | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
|
15 |
Наиболее серьезные помехи от матрицы образцов и от примесей в плазмообразующем аргоне вызываются полиатомными ионами NN* и ССГ при анализе кремния. Все три изотопа кремния испытывают наложения, что уменьшает возможности определения Si в органических матрицах.
При определении мышьяка в биологических образцах с высоким содержанием хлоридов требуется применение уравнения коррекции влияния полиатомного иона 40Аг33С1 на массе 75, в котором используется соотношение полиатомных ионов 40Аг35С1 / 40Аг37С1, приблизительно равное природному отношению 35С1/37С1, также при этом учитывается вклад от 77Se на массе 77 (по 82Se):
I(75As)„CT = mass75-3.0*(mass77-(0.874*(mass82-1.0078*83Kr))), где
massNN - измеренный сигнал на соответствующей массе,
I(75As)hCT. ~ истинный сигнал 75 As
Коэффициенты в уравнении уточняются экспериментально, в ходе отладки рабочего метода.
Для определения Ti, V и Сг в образцах с высоким содержанием хлоридов и/или углерода традиционным методом ИСП-МС, требуется применять довольно высокие факторы разбавления образцов (от 1 : 300 до 1 : 500), для снижения уровня полиатомных ионов СЮ (при работе с мочой и кровью) и АгС (в присутствии органической матрицы), либо проводить измерения методом стандартных добавок.
Проблемы, связанные с полиатомными ионами, вызванными матрицей образцов, реагентов и газов плазмы радикально устраняются при использовании для измерений приборов с динамической реакционной системой (ДРС)*. В системе ДРС используется дополнительный квадруполь -ячейка ДРС, расположенная перед квадруполем масс-анализатора. Влияние полиатомных ионов устраняется путем их избирательного разрушения в результате взаимодействий с молекулами нейтрального и/или реакционного газа, напускаемого в ячейку ДРС. В качестве реакционного газа обычно используется безводный аммиак или метан. Помимо проведения реакций, квадруполь ячейки ДРС обеспечивает динамическое выделение узкого диапазона пропускания интересующих ионов и препятствует продвижению паразитных продуктов реакций к квадруполю масс-анализатора. Таким образом, система ДРС осуществляет эффективную фильтрацию полиатомных ионов, уменьшает общий фон и увеличивает стабильность сигналов. Эти особенности ИСП-ДРС-МС приборов позволяют достигать лучших пределов обнаружения, уверенно определять традиционно трудные элементы для ИСП-МС анализа в органических матрицах (Si, К, Са, Ti, V, Cr, Fc, As, Se), а также проводить более точный изотопный анализ вещества.
Устранение н учет транспортных помех. Транспортные помехи возникают из-за различия в вязкости и поверхностном натяжении между градуировочными стандартами и образцами. Вязкость растворов влияет на эффективность распыления и, как следствие, воздействует на сигнал каждого анализируемого изотопа в растворе, в идеале пропорционального его концентрации, Вязкость водных растворов зависит от концентрации кислоты и от концентрации матричных компонентов. Используя довольно высокие факторы разбавления для образцов с остаточной органической матрицей (1 : 300 - 1 : 500) и нормализуя кислотный фон в стандартах, холостых и образцах, влияние транспортных помех можно уменьшить до незначимого уровня. При работе с меньшими факторами разбавления (от 1 : 10 до 1 : 100 для мочи, крови и т.д.) рекомендуется убедиться в отсутствии помех, проанализировав серию последовательных разбавлений одной пробы (например 1: 10,1 : 50, 1 : 100,1 : 200) и выбрать компромиссный фактор разбавления, при котором не страдает чувствительность определения интересующих элементов. Если транспортные помехи невозможно устранить, следует применить внутреннюю стандартизацию, добавляя во все холостые пробы, стандартные растворы и образцы внутренний стандарт - раствор Rh или In, чтобы получить конечную концентрацию во всех растворах 10 мкг/л. Применение внутренней стандаргиза-
* Прибор ELAN DRC II, PerkinElmer Sciex Cotp.
16
щщ также позволяет компенсировать погрешности разбавления образцов и учесть многие матричные влияния на плазму и поток ионов.
17
11.6* Калибровка спектрометра
Калибровку спектрометра выполняют перед началом измерений полностью подготовленных проб, используя градуировочные растворы по 11.3 при параметрах, установленных по 11.3, 11.4,
11.5. Определение градуировочной зависимости, обработка и хранение результатов калибровки выполняются программным обеспечением спектрометра.
Проверка калибровок проводится перед началом анализа образцов. Проверка заключается в измерении внутрилабораторного проверочного стандарта или стандартного аттестованного образца исследуемой матрицы. Современные программные пакеты для ИСП-МС систем позволяют задавать критерии допустимого качества калибровок, основанные на точности и воспроизводимости результатов для проверочных стандаргов, а также на коэффициенте корреляции и программировать алгоритм автоматических измерений, который может включать повторные проверки калибровок и перекалибровки без участия оператора.
Для выявления и учета дрейфа чувствительности прибора, повторные измерения проверочных стандартов и/или полные перекалибровки рекомендуется проводить каждые 1-2 часа работы (через каждые 15-30 образцов), в зависимости от стабильности окружающей температуры, питающего напряжения и других условий в лаборатории.
12. Выполнение измерений
12.1. Ввод в масс-спектрометр подготовленной пробы, измерение сигналов изотопов проводят при нормальных климатических условиях испытаний в соответствии сп. 10 с учетом требований руководства (инструкции) по эксплуатации прибора. Устанавливают оптимальный режим регистрации масс-спектров и измерений в соответствии с рекомендациями производителя данного прибора. Типичные установки рабочих параметров при измерениях приведены в приложении 2. Первичная обработка сигналов и расчет концентраций проводится программным обеспечением автоматически, на основании параметров используемого метода и данных проведенной калибровки.
12.2. Выбор изотопов для определения концентрации элементов. Для измерений используются изотопы, наиболее предпочтительные по совокупности характеристик. Важнейшими из них являются относительная распространенность, отсутствие или низкий уровень спектральных поли-атомных наложений, достигаемый предел обнаружения. При отладке программного метода проводят измерения в режиме сканирования пиков, для определения возможных влияний от прилежащих пиков и установки оптимального разрешения для каждого изотопа. Примеры выбора оптимальных масс и достигаемых при этом пределов обнаружения приведены в Приложении 3.
13. Обработка и оформление результатов измерений
Аналитические сигналы обрабатываются программным обеспечением масс-спектрометра, основываясь на построенных калибровочных линейных регрессиях, рассчитанных методом наименьших квадратов, с учетом коррекции фона, сигнала внутренних стандартов, а также с учетом влияния изобарных и полиатомных спектральных наложений. Результат определения каждого элемента представляется как среднее из нескольких (типично 2-х) параллельных измерений анализируемого образца. Обработка результатов измерений соответствует ГОСТ 8.207. Результаты измерений отображаются на мониторе, распечатываются и/или сохраняются в виде файла на жестком диске компьютера. Распечатанные результаты оформляют согласно требуемому протоколу.
14. Контроль погрешности методики масс-спектрометрического определения
микроэлементов
Контроль погрешности методики производят в соответствии с ГОСТ Р ИСО 5725-6-94. Внутренний контроль качества результатов определения микроэлементов (сходимость, воспроизводимость, точность) осуществляют с целью получения оперативной информации о качестве анализов и принятия при необходимости оперативных мер по его повышению. Оперативный контроль качества осуществляют путем проведения анализа испытуемых проб и стандартного образца, химический состав которого не должен отличаться от состава испытуемой пробы настолько, чтобы потребовалось изменить методику проведения анализа.
14.1. Оперативный контроль воспроизводимости
Периодичность контроля воспроизводимости результатов анализа определяется количеством рабочих измерений за контролируемый период и определяется планами контроля. В работе участвуют 2 аналитика. Образцами для контроля являются представительные пробы, каждую из которых анализируют в точном соответствии с прописью, максимально варьируя условия проведения анализа: получают два результата, используя разные наборы мерной посуды, разные партии реактивов и разные экземпляры ГСО для градуировки прибора.
Результаты контроля признаются удовлетворительным, если выполняется условие:
\ХХ-Хг\ < О.ОШ-^где
X/ - результат анализа рабочей пробы, мкг/см3;
Х2 “ результат анализа этой же пробы, полученный другим аналитиком с использованием
другого прибора, другой мерной посуды и другой партии реактивов, мкг/см3;
D - допустимые расхождения между результатами анализа одной и той же пробы, % (см.
таблицу.
При превышении норматива оперативного контроля воспроизводимости эксперимент повторяют. При повторном превышении указанного норматива D выясняют причины, приводящие к неудовлетворительным результатам работы и контроля, и устраняют их.
14.2. Оперативный контроль точности
Периодичность контроля воспроизводимости результатов анализа определяется количеством рабочих измерений за контролируемый период и определяется планами контроля. Используют технику метода стандартных добавок или, при наличии стандартных образцов состава, выполняют их анализ.
Метод стандартных добавок. Отбирают две пробы и к одной из них делают добавку в виде раствора таким образом, чтобы содержание определяемого элемента увеличилось по сравнению с исходным на 50-150%. Каждую пробу анализируют в точном соответствии с прописью методики и получают результат анализа исходной рабочей пробыXи рабочей пробы с добавкой Х\ Результаты анализа исходной рабочей пробы X и рабочей пробы с добавкой X7 получают в строго одинаковых условиях, т. е. их получает один аналитик с использованием одного набора мерной посуды, одной партии реактивов и т.д.
Результаты контроля признаются удовлетворительными, если выполняется условие:
I X'-X-Cl < К№ где
К- норматив оперативного контроля пшрешности, мкг/см3;
С - добавка к пробе в виде раствора с концентрацией, мкг/см3
При внешнем контроле (Р = 0,95) принимают
Кд = ^ А2Х- + Л2Х, где
ДХ' и Дх- характеристики погрешностей для исходной пробы и пробы с добавкой, мкг/см3.
Ах> = 0.165 X и А “ 0.165 X При внутрилабораторном контроле (Р = 0,90) принимают, что
Хэ=0,84-/&
Методика определения микроэлементов в диагностируемых биосубстратах методом масс-спектрометрии с индуктивно-связанной плазмой. Методические рекомендации. М.: Федеральный центр Госсанэпиднадзора Минздрава России. 2003. - с. 22.
Методические рекомендации разработаны: Федеральным центром Госсанэпиднадзора Минздрава России (д.м.н. Подунова Л.Г., к.м.н. Скачков В.Б.), АНО Центр биотической медицины (д.м.н. Скальный А.В., к.б.н. Демидов В.А., к.м.н. Скальная М.Г., Серебрянский Е.П., Грабеклис А.Р.), Российским химикотехнологическим университетом им. Д.И.Менделеева (д.х.н. Кузнецов В.В.), представительством PerkinElmer в СНГ (Тимофеев П.В.).
Тиражировано Издательским отделом Федерального центра Госсанэпиднадзора Минздрава России
© Федеральный центр Госсанэпиднадзора Минздрава России
2
При превшпении норматива оперативного контроля погрешности эксперимент повторяют. При повторном превышении указанного норматива выясняют причины, приводящие к неудовлетворительным результатам контроля, и их устраняют.
Метод стандартных образцов. Выполняют анализ пробы, приготовленной из стандартного образца, по методике и сравнивают его результаты с аттестованным содержанием элементов. Погрешность аттестации не должна быть большей, чем 1/3 погрешности методики.
Результаты контроля признаются удовлетворительными, если выполняется условие:
I С-А | < К, где
С - найденное содержание элемента в пробе, приготовленной из стандартного образца, А = ЛА -аттестованное содержание элемента в стандартном образце.
При внутрилабораторном контроле (Р = 0,90) принимают, что
К= 0,84 -А
При внешнем контроле (Р = 0,95) принимают
К= Д где
А - общая погрешность результата анализа по методике.
При превышении норматива оперативного контроля погрешности эксперимент повторяют. При повторном превышении указанного норматива выясняют причины, приводящие к неудовлетворительным результатам контроля, и их устраняют.
143. Оперативный контроль сходимости
Периодичность контроля сходимости результатов анализа определяется количеством рабочих измерений за контролируемый период и определяется планами контроля. Используют результаты параллельных анализов.
Норматив оперативного контроля сходимости рассчитывают по формуле:
Стах " Cmiti ^ d
г де Сщах, Сщзд - наибольшее и наименьшее значения параллельных определений; d - норматив оперативного контроля воспроизводимости, d = 2,77 а (А), где а {А) - характеристика случайной составляющей погрешности.
При превышении норматива оперативного контроля погрешности эксперимент повторяют. При повторном превышении указанного норматива выясняют причины, приводящие к неудовлетворительным результатам контроля, и их устраняют путем корректирующих воздействий..
14.4. Представление результатов анализа
Результаты анализа оформляют протоколом по рекомендуемой форме, приведенной в приложении 4.
20
Содержание
1. Назначение и область применения.................................................4
2. Нормативные ссылки............................................................5
3. Термины и определения..........................................................5
4. Принцип методики..............................................................5
5. Диапазоны определяемых содержаний. Характеристика погрешностей..................6
6. Характеристика масс-спектрометра с индуктивно связанной аргоновой плазмой ....... 6
7. Оборудование» материалы, реактивы...............................................6
8. Условия безопасного проведения работ.............................................8
9. Требования к квалификации лиц, работающих на масс-спектрометре.................... 9
10. Условия выполнения измерений...................................................9
11. Подготовка к проведению измерений...............................................9
11.1. Отбор, хранение и подготовка проб............................................9
11.2. Разложение проб биосубстратов...............................................10
11.3. Приготовление стандартных градуировочных растворов......................... 10
11.4. Подготовка прибора..........................................................10
11.5. Устранение мешающих влияний................................................11
11.6. Градуировка масс-спектрометра.............................................. 11
12. Выполнение измерений...........................................................11
13. Обработка и оформление результатов измерений......................................11
14. Контроль погрешности методики масс-спектрометрического определения микроэлементов ..11
14.1. Оперативный контроль воспроизводимости......................................12
14.2. Оперативный контроль точности...............................................12
14.3. Оперативный контроль сходимости...........................................13
14.4. Представление результатов анализа.............................................13
Приложение 1. Пример состава рабочих стандартных растворов............................14
Приложение 2. Условия выполнения анализа на масс-спектрометре..........................14
Приложение 3. Рекомендуемые для анализа изотопы и достигаемые пределы обнаружения......
Приложение 4. Форма протокола результатов определения микроэлементов в биосубстратах .. ..16 Библиографические данные...........................................................17
3
|
'УТВЕРЖДАЮ" Главный врач Федерального центра |
Методика определения микроэлементов в диагностируемых биосубстратах масс-сиектрометрией с индуктивно связанной аргоновой плазмой (ИСП-МС)Методические рекомендации1. Назначение и область применения
1. Назначение и область применения
Настоящий документ устанавливает методику количественного определения методом масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС) элементов (серебра, алюминия, мышьяка, золота, бария, бериллия, висмута, бора, кальция, кадмия, кобальта, хрома, меди, железа, галлия, германия, ртути, калия, лития, магния, марганца, молибдена, натрия, никеля, свинца, платины, рубидия, фосфора, сурьмы, селена, олова, стронция, титана, таллия, ванадия, вольфрама, цинка, циркония) в диагностируемых биосубстратах: волосы, ногти, кровь, плазма, грудное молочко, моча, аутопсийные материалы (печень, почки, миокард, плацента), слюна, зубы.
Документ предназначен для учреждений Государственной санитарно-эпидемиологической службы Российской Федерации, специальных служб! федеральных органов исполнительной власти, осуществляющих ведомственный санитарно-эпидемиологический надзор, учреждений Минздрава России, лабораторий санитарно-гигиенического, клинического, экологического, скринингового и исследовательского профилей.
Результаты оценки элементного статуса человека используют при решении актуальных задач современной медицины по оценке состояния здоровья человека на индивидуальном и популяционном уровнях и в современной медико-биологической экспертизе.
Их целесообразно учитывать при оценке эффективности санитарно-противоэпидемических мероприятий и текущего санитарного контроля и надзора за объектами, воздействующими на окружающую среду населенного пункта и региона, при решении задач предварительной популяционной санитарно-эпидемиологической диагностики массовых заболеваний неизвестной этиологии, при мониторинге состояния здоровья, уровня работоспособности и эффективности лечения, при формировании групп риска по гипо- и гиперэлементозам, профессиональным заболеваниям, связанным с интоксикацией химическими элементами, при скрининг-диагностических исследованиях больших групп населения, при составлении карт экологического природного и техногенного неблагополучия регионов, при экспертно-криминалистических исследованиях.
4
2. Нормативные ссылки
1. Основы законодательства Российской Федерации об охране здоровья граждан от 22 июля 1993 года, № 5487-1
2. Федеральный Закон «О санитарно-эпидемиологическом благополучии населения» от 30 марта 1999г. № 52-ФЗ (Собрание законодательств Российской Федерации, 1999г., № 14, ст. 1650).
3. Постановление Правительства Российской Федерации «Об утверждении Положения о государственной санитарно-эпидемиологической службе Российской Федерации и Положения о государственном санитарно-эпидемиологическом нормировании» от 24 июля 2000 г. № 554.
4. Порядок разработки, экспертизы, утверждения, издания и распространения нормативных и методических документов системы санитарно-эпидемиологического нормирования. ОР 1.1.001-1.1,005-96.
5. Санитарно-эпидемиологическое благополучие населения. Нормативно-правовое обеспечение. Онищенко Г.Г., Шестопалов Н.В. М., 2002.
3. Термины и определения
Государственный санитарно-эпидемиологический надзор - деятельность по предупреждению, обнаружению, пресечению нарушений законодательства Российской Федерации в области обеспечения санитарно-эпидемиологического благополучия населения в целях охраны здоровья населения и среды обитания.
Санитарно-эпидемиологическая оценка территорий (населенных пунктов) - изучение механизмов причинно-следственной связи изменений состояния здоровья населения (социальной группы) определенной территории и качества среды обитания (окружающей среды) с использованием гигиенических, эпидемиологических, клинических, токсикологических, химикоаналитических и других методов исследования и соответствующих критериев.
Санитарно-эпидемиологическая диагностика - диагностика массовых экологически обусловленных изменений состояния здоровья населения путем выявления показателей изменения состояния здоровья населения (популяции, социальной группы) в связи с изменением качества среды обитания, при этом используется метод эпид анализа и гигиенической оценки опасности вредных факторов среды обитания.
Микроэлементы - группа химических элементов, которые содержатся в организме человека и животных в очень малых количествах в пределах 10~~3 - 10”12 %; характерной чертой микроэлементов является их низкая концентрация в живых тканях,
Микроэлементозы - совокупность всех патологических процессов, вызванных избытком или дисбалансом макро- и микроэлементов в организме человека.
Микроэлементозы - совокупность всех патологических процессов, вызванных избытком или дисбалансом макро- и микроэлементов в организме человека.
Масс-спектрометрия с индуктивно-связанной аргоновой плазмой - универсальный метод современной аналитической химии, используемый для определения химических элементов и их изотопов в различных объектах, на уровнях до 10“*.Л0'И %. В качестве источника ионизации вещества в методе используется индуктивно-связанная аргоновая плазма, образующиеся ионы разделяются в электромагнитном поле спектрометра в зависимости от отношения массы к заряду частицы.
4, Принцип методики
Метод ИСП-МС комбинирует использование индуктивно-связанной плазмы в качестве источника ионов с квадрупольным масс-спектрометром, выступающем в роли масс-анализатора (фильтра) и дискретпо-динодным детектором, который используется для регистрации отдельных ионов и их потоков. Ипдуктивно-связанпая плазма, поддерживаемая в специальной горелке способна эффективно возбуждать однозарядные ионы из атомов вводимого образца. Далее ионы фокусируются ионно-оптической системой (и отделяются от лолиатомных и изобарных ионов в сле-
5
диальных моделях приборов) и попадают в анализатор масс-спектрометра, где разделяются по отношению массы к заряду (m/z). Соответствующий ионный поток регистрируется детектором. Через масс-спектрометр в каждый момент времени пропускаются ионы со строго определенным (m/z), которые затем попадают в детектор для количественной регистрации. Число соударений за единицу времени пропорционально количеству атомов каждого определяемого изотопа в исходном образце. Линейный диапазон зависимости интенсивности сигнала от концентрации на современных приборах превышает шесть-восемь десятичных порядков, позволяя в одном цикле сканирования масс-спектра регистрировать и единичные импульсы от малых концентраций и ионные токи от высоких концентрации элементов. Для достижения такого широкого динамического диапазона в современных ИСП-МС приборах применяется двойная регистрация сигналов: импульсный режим одного сегмента детектора используется для подсчета отдельных ионов и аналоговый режим другого - для регистрации ионных токов. Таким образом, современные приборы ИСП-МС позволяют определять концентрации элементов и отдельных изотопов на уровне от сотых долей нанограммов до сотен миллиграммов на литр (О.ОпхЮ"12.. п><10“2 %)\ Достигаемые пределы обнаружения, высокие чувствительность и избирательность метода ИСП-МС позволяет количественно определять во многих биологических и медицинских объектах и материалах до 40-50 элементов в течение 2-3 мин (без учета времени пробоподготовки).
Для подготовки образцов биосубстратов к анализу методом ИСП-МС используются два метода разложения: 1) кислотное растворение в открытых сосудах, без полного разрушения органической матрицы; 2) кислотное разложение («мокрое озоление») с использованием систем микроволновой пробоподготовки.
Метод открытого разложения характеризуется следующими особенностями:
• высокой производительностью при небольшом расходе реактивов, что привлекательно малой поправкой на холостой опыт
® способ не применим для разложения материалов, содержащих много жирового вещества и конкрементов (жировые ткани, новообразования во внутренних органах),
• возможность частичной или иногда полной потери летучих элементов (As, Hg, I, Se).
• органическая матрица, сохраняющаяся в растворах проб, может быть источником серьезных матричных помех при ИСП-МС измерениях, ограничивающих определение и изотопный анализ некоторых элементов (Табл. 3).
Метод микроволнового разложения обеспечивает следующие преимущества:
• высокую производительность разложения
• более полное окисление органической матрицы практически любых биосубстратов
• существенное уменьшение потерь летучих элементов при разложении.
5, Диапазон определяемых содержаний и характеристика погрешности
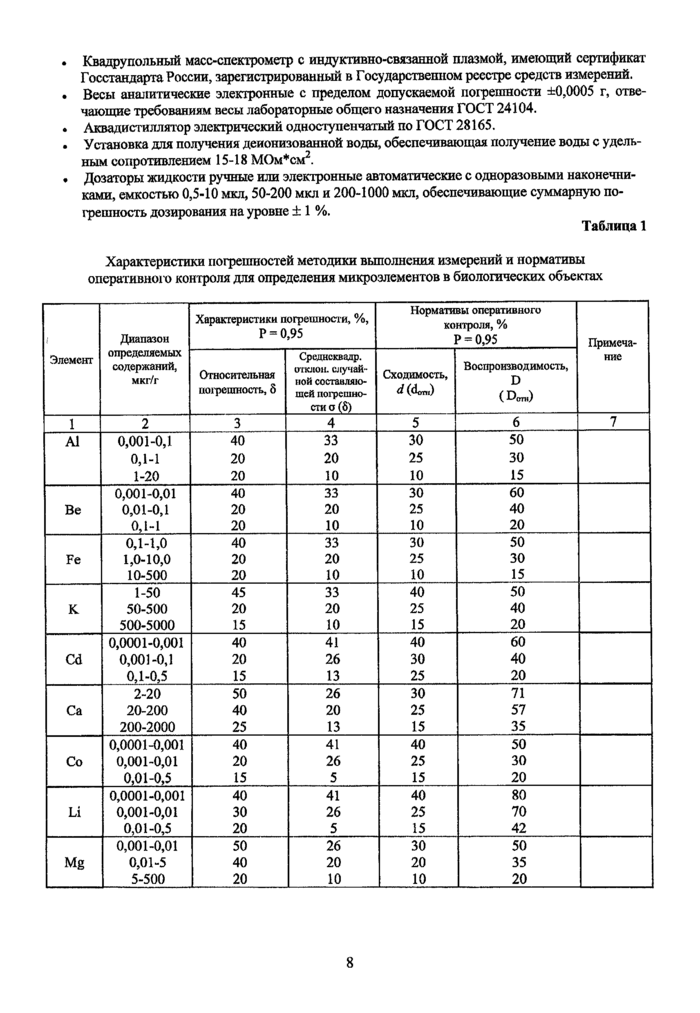
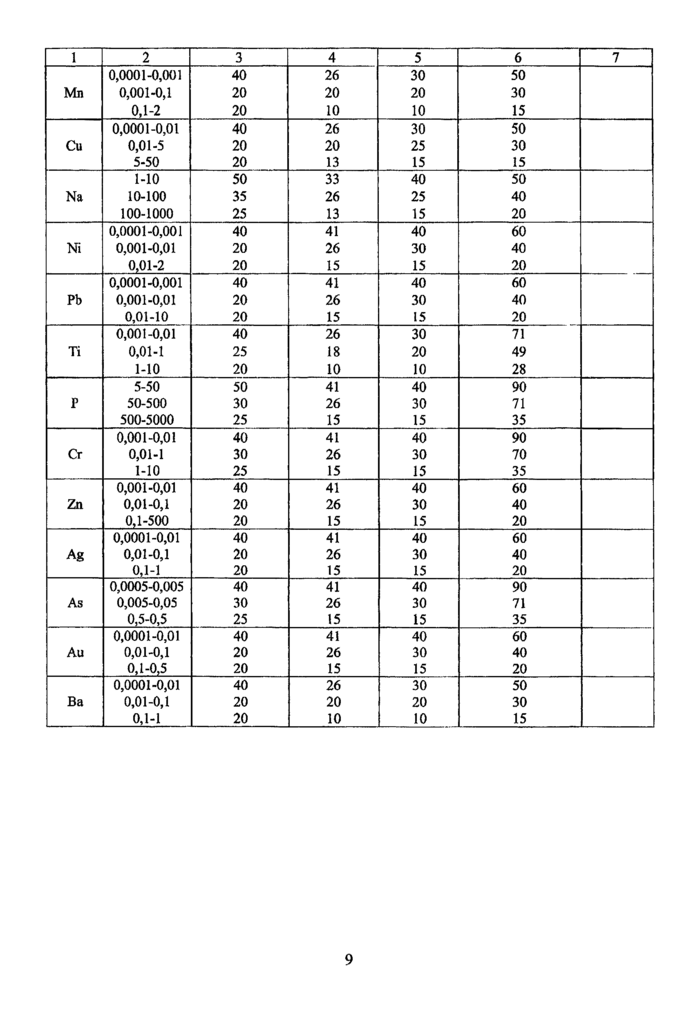
Данные о диапазонах определяемых содержаний и характеристиках погрешностей методики выполнения измерений и нормативы оперативного контроля для определения элементов в биологических объектах приведены в Таблице 1. Систематическая составляющая погрешности незначима на фоне относительной составляющей.
6. Характеристика масс-спектрометра
Для измерений используется масс-спектрометр, обладающий следующими характеристками:
Диапазон сканирования масс, а.е.м,: 2-270
Динамический диапазон системы детектирования: 1 х 10"1-1 х 109 импульсов в секунду
Диапазон разрешения, а.е.м.: 0.3-3.0
Прибор с динамической реакционной ячейкой ELAN DRC IT, производства PerkinElmer Sciex Coip.
6
Пределы обнаружения: Be < 3 нг/л, Со < 1 нг/л, In <0,5 нг/л, U < 0,5 нг/л.
Чувствительность (имп, в секунду на 1 мкг/л): 24Mg > 4000,115In > 30000,238U > 25000
Кратковременная стабильность, CKO: <3%
Долговременная стабильность, СКО: <4%
Двузарядные ионы, Ва++/Ва+: <3%
Оксидные ионы, СеО/Сс; <3%
Уровень фона на массе 220: < 25 импульсов в секунду
Стандартное отклонение уровня фона на массе 220: < 5 ими. в сек
Для достижения лучших пределов обнаружения до уровня сотых долей нг/л) и устранения полиатомных наложений, вызванных матрицей образцов и матрицей растворителя, а также газами плазмы (Табл. 1), рекомендуется проводить измерения на приборах с динамической реакционной системой (ДРС). Лучшие пределы обнаружения на этих приборах достигаются за счет уменьшения уровня фона и фокусировки ионов в дополнительном газонаполненом квадруполе (ДРС), расположенном перед квадрудолем масс-анализатора. Устранение полиатомных и изобарных наложений осуществляется путем удаления мешающих ионов в результате реакций и взаимодействий с молекулами реакционного газа, напускаемого в ячейку (аммиак, метан и др.).
Программное обеспечение масс-спектрометра должно обеспечивать выполнение следующих функций:
• Поддержку следующих методов анализа: количественного, полуколичественного (обзорного), методов изотопного отношения и изотопного разбавления;
• Проведение автоматических измерений без участия оператора. Для проведения автоматических измерений спектрометр должен быть оборудован устройством автоматического пробоотбора;
• Автоматизацию процедур калибровки и настройки шкалы масс и рабочих параметров спектрометра;
• Статистическую обработку и сохранение результатов в общепринятых форматах;
• Возможность повторной обработки данных без проведения дополнительных измерений;
• Возможность использования аппарата контроля качества, для оперативного автоматического управления ходом измерений в соответствии с заданными критериями качества и расчет статистических параметров качества.
7. Оборудование, материалы, реактивы
Для сведения к минимуму уровня лабораторного фона, все операции по подготовке образцов к измерениям и сами измерения следует проводить в чистом помещении, в котором не скапливается пыль. Для анализа сверхнизких концентраций, загрязнения из окружающей среды являются основным фактором, ограничивающим пределы обнаружения и определения методом ИСП-МС. Для количественного определения элементов, распространенных в окружающей среде, как например, Na, Mg, К, Са, Fe, и других, на уровне концентраций порядка и ниже 1 мкг/л, подготовку образцов и измерения следует проводить в чистых комнатах класса 1000 (< 1000 взвешенных частиц на 1 м3 воздуха). Это является ограничением для достижимых характеристик метода лишь для некоторых наиболее распространенных в конкретной лаборатории элементов, и является рекомендацией для работы в сверхчистой среде. Для подготовки образцов необходимо пользоваться сосудами из фторопласта (PTFE, Viton™, Teflon™) или перфторалкоксиполимера (PFA). Для временного хранения образцов и рабочих градуировочных растворов настоятельно рекомендуется пользоваться одноразовой посудой из полипропилена (пробирки вместимостью 15-20 мл для хранения образцов, и вместимостью 50 мл с винтовой крышкой для хранения рабочих стандартов).
• Квадрупольный масс-спектрометр с индуктивно-связанной плазмой, имеющий сертификат Госстандарта России, зарегистрированный в Государственном реестре средств измерений.
• Весы аналитические электронные с пределом допускаемой погрешности ±0,0005 г, отвечающие требованиям весы лабораторные общего назначения ГОСТ 24104.
• Аквадистиллятор электрический одноступенчатый по ГОСТ 28165.
. Установка для получения деионизованной воды, обеспечивающая получение воды с удельным сопротивлением 15-18 МОм*см2.
« Дозаторы жидкости ручные или электронные автоматические с одноразовыми наконечниками, емкостью 0,5-10 мкл, 50-200 мкл и 200-1000 мкл, обеспечивающие суммарную погрешность дозирования на уровне ± 1 %.
Таблица 1
Характеристики погрешностей методики выполнения измерений и нормативы оперативного контроля для определения микроэлементов в биологических объектах
|
i Элемент |
Диапазон определяемых содержаний, мкг/г |
Характеристики погрешности, %, Р = 0,95 |
Нормативы оперативного контроля, % Р = 0,95 |
Примеча- ние | ||
|
Относительная погрешность, 6 |
Среднсквадр. отклон. случайной составляющей погрешности а (5) |
Сходимость, <*(0 |
Воспроизводимость, D ( D(mi) | |||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
А1 |
0,001-0,1 |
40 |
33 |
30 |
50 | |
|
0,1-1 |
20 |
20 |
25 |
30 | ||
|
1-20 |
20 |
10 |
10 |
15 | ||
|
0,001-0,01 |
40 |
33 |
30 |
60 | ||
|
Be |
0,01-0,1 |
20 |
20 |
25 |
40 | |
|
0,1-1 |
20 |
10 |
10 |
20 | ||
|
0,1-1,0 |
40 |
33 |
30 |
50 | ||
|
Fe |
1,0-10,0 |
20 |
20 |
25 |
30 | |
|
10-500 |
20 |
10 |
10 |
15 | ||
|
1-50 |
45 |
33 |
40 |
50 | ||
|
К |
50-500 |
20 |
20 |
25 |
40 | |
|
500-5000 |
15 |
10 |
15 |
20 | ||
|
0,0001-0,001 |
40 |
41 |
40 |
60 | ||
|
Cd |
0,001-0,1 |
20 |
26 |
30 |
40 | |
|
ОД-0,5 |
15 |
13 |
25 |
20 | ||
|
2-20 |
50 |
26 |
30 |
71 | ||
|
Са |
20-200 |
40 |
20 |
25 |
57 | |
|
200-2000 |
25 |
13 |
15 |
35 | ||
|
0,0001-0,001 |
40 |
41 |
40 |
50 | ||
|
Со |
0,001-0,01 |
20 |
26 |
25 |
30 | |
|
0,01-0,5 |
15 |
5 |
15 |
20 | ||
|
0,0001-0,001 |
40 |
41 |
40 |
80 | ||
|
Li |
0,001-0,01 |
30 |
26 |
25 |
70 | |
|
0,01-0,5 |
20 |
5 |
15 |
42 | ||
|
0,001-0,01 |
50 |
26 |
30 |
50 | ||
|
Mg |
0,01-5 |
40 |
20 |
20 |
35 | |
|
5-500 |
20 |
10 |
10 |
20 | ||
8
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
0,0001-0,001 |
40 |
26 |
30 |
50 | ||
|
Mn |
0,001-0,1 |
20 |
20 |
20 |
30 | |
|
0,1-2 |
20 |
10 |
10 |
15 | ||
|
0,0001-0,01 |
40 |
26 |
30 |
50 | ||
|
Си |
0,01-5 |
20 |
20 |
25 |
30 | |
|
5-50 |
20 |
13 |
15 |
15 | ||
|
1-10 |
50 |
33 |
40 |
50 | ||
|
Na |
10-100 |
35 |
26 |
25 |
40 | |
|
100-1000 |
25 |
13 |
15 |
20 | ||
|
0,0001-0,001 |
40 |
41 |
40 |
60 | ||
|
Ni |
0,001-0,01 |
20 |
26 |
30 |
40 | |
|
0,01-2 |
20 |
15 |
15 |
20 | ||
|
0,0001-0,001 |
40 |
41 |
40 |
60 | ||
|
Pb |
0,001-0,01 |
20 |
26 |
30 |
40 | |
|
0,01-10 |
20 |
15 |
15 |
20 | ||
|
0,001-0,01 |
40 |
26 |
30 |
71 | ||
|
Ti |
0,01-1 |
25 |
18 |
20 |
49 | |
|
1-10 |
20 |
10 |
10 |
28 | ||
|
5-50 |
50 |
41 |
40 |
90 | ||
|
P |
50-500 |
30 |
26 |
30 |
71 | |
|
500-5000 |
25 |
15 |
15 |
35 | ||
|
0,001-0,01 |
40 |
41 |
40 |
90 | ||
|
Cr |
0,01-1 |
30 |
26 |
30 |
70 | |
|
1-10 |
25 |
15 |
15 |
35 | ||
|
0,001-0,01 |
40 |
41 |
40 |
60 | ||
|
Zn |
0,01-0,1 |
20 |
26 |
30 |
40 | |
|
0,1-500 |
20 |
15 |
15 |
20 | ||
|
0,0001-0,01 |
40 |
41 |
40 |
60 | ||
|
Ag |
0,01-0,1 |
20 |
26 |
30 |
40 | |
|
0,1-1 |
20 |
15 |
15 |
20 | ||
|
0,0005-0,005 |
40 |
41 |
40 |
90 | ||
|
As |
0,005-0,05 |
30 |
26 |
30 |
71 | |
|
0,5-0,5 |
25 |
15 |
15 |
35 | ||
|
0,0001-0,01 |
40 |
41 |
40 |
60 | ||
|
Au |
0,01-0,1 |
20 |
26 |
30 |
40 | |
|
0,1-0,5 |
20 |
15 |
15 |
20 | ||
|
0,0001-0,01 |
40 |
26 |
30 |
50 | ||
|
Ba |
0,01-0,1 |
20 |
20 |
20 |
30 | |
|
0,1-1 |
20 |
10 |
10 |
15 |
9