Временные методические рекомендации по организации и проведению комплекса санитарно-гигиенических мероприятий в отделениях, больницах, клиниках и институтах хирургического профиля
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
I. Общие положения
II. Санитарно-гигиенический режим в приемном отделении и палатах
III. Санитарно-гигиенический режим в операционном блоке, перевязочных и послеоперационных палатах, отделениях реанимации и палатах интенсивной терапии
IV. Обработка операционного поля, рук, хирургических перчаток в ходе операции
V. Подготовка хирургических инструментов к операции
VI. Стерилизация хирургических инструментов, резиновых перчаток, перевязочного материала, хирургического белья
VII. Бактериологический контроль комплекса санитарно-гигиенических мероприятий в хирургических отделениях
А. Исследования микробной обсемененности воздушной среды
Б. Исследования микробной обсемененности объектов внешней среды
Ориентировочный перечень объектов, подлежащих бактериологическому контролю
А. Наркозная комната
Б. Предоперационная
В. Операционная
Г. Послеоперационные палаты, отделения реанимации и интенсивной терапии
Д. Перевязочные комнаты
В. Исследование на стерильность хирургического материала
Правила отбора проб на стерильность
Учет результатов
Г. Бактериологический контроль эффективности обработки кожи операционного поля и рук хирургов
Учет результатов
Приложение 1. Режимы стерилизации и дезинфекции отдельных объектов
Приложение 2. Методика санации носителей патогенного стафилококка
Приложение 3. Аппараты для снижения микробной обсемененности воздуха в помещениях малого объема
Приложение 4. Некоторые методы диагностики патогенных стафилококков
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 29.12.1973 | Утвержден | Главное управление лечебно-профилактической помощи МЗ СССР | 10/8-43 |
|---|---|---|---|
| 29.12.1973 | Утвержден | Главное санитарно-эпидемиологическое управление МЗ СССР | 1142-73 |
| Разработан | Всесоюзный научно-исследовательский институт дезинфекции и стерилизации Министерства здравоохранения СССР | ||
| Разработан | Городская санитарно-эпидемиологическая станция г. Москвы | ||
| Издан | Типография Министерства здравоохранения СССР | 1974 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18
стр. 19

стр. 20
стр. 21
стр. 22
стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28
ВРЕМЕННЫЕ
МЕТОДИЧЕСКИЕ
РЕКОМЕНДАЦИИ
1974
ПО ОРГАНИЗАЦИИ И ПРОВЕДЕНИЮ КОМПЛЕКСА САНИТАРНО-ГИГИЕНИЧЕСКИХ МЕРОПРИЯТИИ В ОТДЕЛЕНИЯХ, БОЛЬНИЦАХ, КЛИНИКАХ И ИНСТИТУТАХ ХИРУРГИЧЕСКОГО ПРОФИЛЯ
Москва
Методические рекомендации разработаны Всесоюзным научно-исследовательским институтом дезинфекции и стерилизации Министерства здравоохранения СССР, Городской сани-тарно-зпидемиологической станцией г. Москвы.
VI. СТЕРИЛИЗАЦИЯ ХИРУРГИЧЕСКИХ ИНСТРУМЕНТОВ, РЕЗИНОВЫХ ПЕРЧАТОК,ПЕРЕВЯЗОЧНОГО МАТЕРИАЛА, ХИРУРГИЧЕСКОГО БЕЛЬЯ
50. Стерилизация обеспечивает гибель в стерилизуемом материале вегетативных и споровых форм патогенных и непатогенных микрооргаизмов.
51. Стерилизацию проводят различными методами: паром, сухим горячим воздухом, растворами химических веществ н газами. Выбор того или иного способа стерилизации зависит от особенностей стерилизуемого объекта и метода, от его достоинств и недостатков.
В паровых стерилизаторах стерилизуют: белье, перевязочный материал, хирургические инструменты, детали приборов и аппаратов, изготовленных из коррозионностойких металлов и сплавов: шприцы с надписью 200°С, стеклянную посуду, изделия из резины (перчатки, трубки, катетеры, зонды и т. д.).
Стерилизацию в паровых стерилизаторах (автоклавах) осуществляют водяным насыщенным паром:
при температуре 132° ±2 (давл. 2 ати) —20 мнн.
при температуре 126° ±2 (давл. 1,5 ати)—30 мнн.
при температуре 120° + 2 (давл. 1,1 атн)—45 мши.
Последний режим рекомендован для изделий из резины
п резиновых перчаток. Резиновые перчатки перед стерилизацией внутри и снаружи пересыпают тальком для предохранения их от склеивания. Между перчатками прокладывают марлю; каждую пару перчаток завертывают отдельно в марлю п в таком виде помещают в биксы. Хирургическое белье, перевязочный материал, резиновые перчатки, хирургические инструменты стерилизуют в стандартных биксах, рыхло закладывая их для свободного поступления пара.
В качестве упаковочных материалов используют двойной слой бязевой ткани или однослойные конверты из растительного пергамента ГОСТ 1341-60.
52. Хирургичеокие, гинекологические и стоматологические инструменты, детали и узлы приборов и аппаратов, в том числе изготовленные из коррозионнонестойких материалов и сплавов, шприцы с надписью 200°С, режущие инструменты стерилизуют в воздушных стерилизаторах.
Стерилизацию в воздушных стерилизаторах осуществляют сухим горячим воздухом:
при температуре 180°С — 45 мин.
при температуре 160°С — 60 мин.
В качестве упаковочного материала используют стандартные биксы, металлические пеналы, упаковку из крафт-бумаги, швы конверта заклеивают 10% клеем из поливинилового спирта или 5% крахмальным клеем.
53. Хирургические инструменты из коррозионностойких металлов и сплавов, изделия из резины, пластических масс, в том числе с металлическими частями, стерилизуют в 6% растворе перекиси водорода при температуре раствора 50°С, экспозиции 3 часа, или при температуре раствора 18°С, экспозиции 6 часов.
54. Газовый метод стерилизации применяют для эндоскопических инструментов, аппаратов экстракорпорального кровообращения, изделий из пластических масс, кетгута.
В качестве стерилизующих агентов используют:
окись этилена и смесь «ОБ» или «ОКЭБМ» (окись этилена с бромистым метилом в соотношении 1 :1,5 и 1 :2,5 по весу соответственно).
Норма расхода окиси этилена при температуре 18°С составляет 2,5 г/л, экспозиция 16 часов; при температуре 50°С — 1,2 г/л, экспозиция 6 часов. Норма расхода смеси «ОБ» при температуре 18°С составляет 3,5 г/л, экспозиция 16 часов, при температуре 50°С—1,6 г/л, экспозиция 6 часов. В качестве упаковочных материалов при газовом методе стерилизации применяют полиэтиленовую пленку низкого давления.
55. Смотровые инструменты (отоларингологические, стоматологические и т. д.) обеззараживают:
— кипячением в дистиллированной воде в течение 30 минут;
— погружением:
а) в тройной раствор (2% раствор формалина, 0,3% раствор фенола и 1,5% раствор двууглекислой соды) на 45 минут;
б) в 6% раствор перекиси водорода на 3 часа;
в) в 10% раствор формальдегида на 3 часа; последние два раствора рекомендованы для обеззараживания зубных, гортанных и носоглоточных зеркал.
VII. БАКТЕРИОЛОГИЧЕСКИЙ КОНТРОЛЬ КОМПЛЕКСА САНИТАРНО-ГИГИЕНИЧЕСКИХ МЕРОПРИЯТИЙ В ХИРУРГИЧЕСКИХ ОТДЕЛЕНИЯХ
56. Бактериологический контроль проводят работники бактериологических лабораторий лечебно-профилактических учреждений и сотрудники бактериологических лабораторий санитарно-эпидемиологических и дезинфекционных станций.
57. Объектами исследования при проведении бактериологического контроля являются:
— воздушная среда;
— различные объекты внешней среды;
— медицинский инструментарий, перевязочный и шовный материал;
— руки хирургов и кожа операционного поля.
58. Бактериологические лаборатории санитарно-эпидемиологических или дезинфекционных станций проводят контроль не реже двух раз в год, бактериологические лаборатории лечебных учреждений контролируют санитарно-гигиенический режим (обсемененность различных объектов и воздуха) 1 раз в месяц, а контроль стерильности инструментов, перевязочного материала, операционного белья, рук хирургов и кожи операционного поля (выборочно) — 1 раз в неделю.
59. Методика микробиологических исследований:
А. Исследования микробной обсемененности воздушной среды
Бактериологическое исследование воздушной среды предусматривает:
— определение общего содержания микробов в 1 м3 воздуха;
— определение содержания патогенных стафилококков в 1 м3 воздуха.
Отбор проб воздуха для бактериологического контроля проводят в следующих помещениях:
— операционных блоках;
— послеоперационных палатах;
— отделениях реанимации, интенсивной терапии и других помещениях, требующих асептических условий.
Пробы воздуха отбирают аспирационным методом с помощью аппарата Кротова. Скорость протягивания воздуха составляет 25 метров куб. в 1 минуту. Количество пропущенного воздуха — 100 литров для определения общей обсемененности и 250 литров — для определения наличия патогенной микрофлоры.
Для определения общей бактериальной обсемененности воздуха забор проб производят на 2% мясо-пептонный агар. Инкубируют посевы при температуре 37°С в течение 24 часов, затем посевы оставляют па 24 часа при комнатной температуре, после чего подсчитывают количество выросших колоний и производят пересчет на 1 м3 воздуха. Если на чашках мясо-пептонного агара выросли колонии плесневых грибов, последние подсчитывают и пересчитывают на 1 м3 воздуха. В протоколе количество плесневых грибов указывают отдельно.
Учет результатов при посеве на кровяную среду производят через 24 часа, при использовании солевых сред посевы после термостатирования в течение 24 часов выдерживают 48 часов при комнатной температуре.
Культуры стафилококка на кровяном агаре могут давать очень слабую зону гемолиза, нередко видимую только после снятия культуры петлей. Подобные культуры стафилококка подлежат обязательной микроскопии и дальнейшей идентификации. Если на чашках с кровяным агаром не выделен стафилококк, то проводят выделение колоний с солевых сред.
На молочно-солевом агаре изучению подлежат колонии, которые образуют золотистый, палевый или белый пигмент. С желточно-солевого агара снимают колонии, которые образуют мутную зону и радужный венчик вокруг колонии. Подозрительные колонии пересевают секторами па чашку с кровяным агаром н дальнейшее изучение их проводят по вышеприведенной схеме.
Подлежат учету те культуры стафилококка, которые коагулируют нитратную плазму, при бактериоскопии имеют вид характерных мелких кокков в виде типичных гроздеподобных колоний, окрашенных грамм-положительно и обладают гемолитическими свойствами.
|
КРИТЕРИЙ ОЦЕНКИ МИКРОБНОЙ ОБСЕМЕНЕННОСТИ ВОЗДУХА В ХИРУРГИЧЕСКИХ КЛИНИКАХ | |||||||||||||||
| |||||||||||||||
|
послеоперационные пала: до начала не выше не должно быть ты, отделения реанима- работы 750 цни, интенсивной терапии 14 |
Б. Исследования микробной обсемененности объектов внешней среды
Бактериологическое исследование микробной обсемененности предметов внешней среды предусматривает выявление патогенных стафилококков, синегнойной палочки и бактерий кишечной группы. Забор проб с поверхностен различных объектов осуществляют методом смывов.
Взятие смывов производят стерильными ватными тампонами на палочках, тампоны монтируют в пробирки. Можно брать смывы марлевыми салфетками размером 5X5 см, про-стерилпзованными в бумажных пакетах или чашках Петри. Для увлажнения тампонов в пробирки с тампонами наливают по 0,2 мл 6,5% солевого бульона. Тампоны увлажняют непосредственно перед взятием смывов. При использовании салфеток 6,5% солевой бульон разливают в стерильные пробирки по 2 мл. Салфетку захватывают стерильным пинцетом, увлажняют солевым бульоном из пробирки и после протирания исследуемого объекта помещают в ту же пробирку.
При контроле мелких предметов смывы производят с по верхностей всего предмета. При контроле предметов с большой поверхностью смывы производят в нескольких местах исследуемого предмета площадью примерно в 100—200 см2.
Для выделения стафилококков производят посев непосредственно на чашку Петри с молочно-солевым пли желточносолевым агаром. В качестве среды накопления используют бульоны с 6,5% NaCI и 1% глюкозы, разлитые в пробирки по 5 мл.
Для выявления бактерий кишечной группы производят посев на среду обогащения, для чего тампон (марлевую салфетку) погружают в 10—20% желчный бульон или среду Кесслера или другую среду накопления. Через сутки инкубирования при температуре 37°С делают пересев на среду Эндо. Подозрительные колонии на среде Эндо микроскопируют и пересевают на 2-ю бродильную пробу — среду Гисса с глюкозой, посев выдерживают 24 часа при температуре 43°.
Примечание: Пр^и использовании свиной желчи для приготовления желчного бульона концентрация желчи должна быть в 20 раз меньше.
Если на кровяном агаре или среде Эндо вырастает культура, подозрительная на синегнойную палочку, ее пересевают на скошенный агар. Колонии синегнойной палочки дают на поверхности косяка обильный рост с зеленоватым оттенком масля: истой консистенции с характерным медовым запахом.
ОРИЕНТИРОВОЧНЫЙ ПЕРЕЧЕНЬ ОБЪЕКТОВ, ПОДЛЕЖАЩИХ БАКТЕРИОЛОГИЧЕСКОМУ КОНТРОЛЮ:
А. Наркозная комната
1. Интубационная трубка
2. Маска наркозного аппарата
3. Тройник наркозного аппарата
4. Гофрированная трубка
5. Ларингоскоп
6. Роторасширитель
7. Дыхательный мешок
8. Руки врача, сестер-анестезистов, врачей-анестезиологов-реаниматологов
Б. Предоперационная
1. Тазы для мытья рук хирургов
2. Чистые щетки для мытья рук
3. Фартуки (клеенчатые или полиэтиленовые)
В. Операционная
1. Рабочий стол анестезиологов
2. Операционный стол
3. Шланг вакуумнасоса
4. Шланг кислородной подводки
5. Смывы с рук всех участвующих в операции
6. Кожа операционного поля
Г. Послеоперационные палаты, отделения реанимации и интенсивной терапии
1. Кровать, подготовленная для больного
2. Полотенце для рук персонала
3. Щетка на раковине
4. Шланг кислородной подводки
5. Запасная наркозная аппаратура (набор реанимационной укладки)
6. Шланг вакуумотсоса
7. Внутренняя поверхность холодильника (для хранения лекарств или градусников)
8. Градусники
Д. Перевязочные комнаты
1. Кушетка для перевязок
2. Полотенце для рук персонала
3. Щетка на раковине
4. Халат медицинских сестер
5. Руки медицинских сестер
6. Рабочий медицинский стол
7. Внутренняя поверхность холодильника для хранения лекарств
В. Исследование на стерильность хирургического материала
Исследование хирургического материала на стерильность производят с целью лабораторного контроля за эффективностью стерилизации перевязочного, шовного материала и инструментария.
Объектами бактериологического контроля являются:
— перевязочный материал (марлевые салфетки, ватные шарики, тампоны, др.), подвергавшийся стерилизации в лечебно-профилактическом учреждении;
— шовный материал — кетгут, шелк (подвергают проверке каждую партию шовного материала);
— хирургический инструментарий i епосредственно после стерилизации и подготовленный к использованию;
— шприцы и иглы к ним.
Забор проб на стерильность проводит операционная сестра под руководством сотрудника бактериологической лаборатории.
ПРАВИЛА ОТБОРА ПРОБ НА СТЕРИЛЬНОСТЬ:
— перевязочный материал для исследования отправляют в биксах, в которых проводили его стерилизацию.
Отбор проб производят в специально подготовленном боксе лаборатории непосредственно перед посевом;
— шовный материал — кетгут и шелк — отбирают из банок с приготовленным для операции материалом в количестве 1—2 мотков из каждой банки. Каждую пробу помещают у пламени горелки в сухую стерильную посуду (колбу или пробирку), фламбируя край колб или пробирок;
— хирургическим инструментарий, ножницы, иглы — забор проб производят из биксов после стерилизации инструментария, подготовленного к операции (на стерильном столе). Инструментарий, подлежащий исследованию, опуокают в колбу или пробирку с питательной средой, соблюдая правила, асептики, и ополаскивают. Посевы этикируют и отправляют в бактериологическую лабораторию.
Для посева материала на стерильность используют:
— тиогликолевую среду — для выявления анаэробных и аэробных бактерий или мясо-пептонный бульон с 0,5% глюкозы для выявления аэробных бактерий, среду Тароцци с 0,15% агар-агара для выявления анаэробов.
Примечание: тиогликолевую среду нельзя до использования выдерживать при повышенной температуре. Поэтому от каждой серии среды отбирают 1% пробирок среды и выдерживают при 37°С двое суток. При проросте хотя бы части сред в пробирках, инкубируемых при ЪТ’С, бракуют всю партию сред. Пробирки с тногликолевоп средой, выдержанные 2 суток, для проверки па стерильность в дальнейшей работе не используют.
Питательные среды разливают в колбы по 50 мл, инкубируют посевы при температуре 37°С 7 суток.
УЧЕТ РЕЗУЛЬТАТОВ
Материал стерилен при отсутствии роста во всех посевах.
Материал нестерилен при росте микрофлоры.
Г. Г>акгериологический контроль эффективности обработки кожи операционного поля и рук хирургов
Смi.iвы с кожи операционного поля н рук хирургов производят стерильными марлевыми салфетками, размером 5 X 5 см1, смоченными в растворе нейтрализатора (если таковой имеется) или в физиологическом растворе. Ма.рлевой салфеткой тщательно протирают ладони, околоногтевые и меж-иальцевые пространства обеих рук. После забора проб марлевую салфетку помещают в шпрокогорлые пробирки или колбы с раствором нейтрализатора (воды или физиологического .раствора) н стеклянными бусами, встряхшвают в течение 10 минут, производят отмыв марлевой салфетки. Отмыв-иую жидкость засевают глубинным способом по 0,5 мл на 2 чашки Петри с мясопептоиным агаром, а марлевую салфетку — в 0,5% сахарный бульон. Посевы инкубируют при температуре 37°С в течение 48 часов.
УЧЕТ РЕЗУЛЬТАТОВ
Кожа и руки стерильны при отсутствии роста микроорганизмов как на твердой, так и на жидкой питательной среде.
Приложение -V» 1
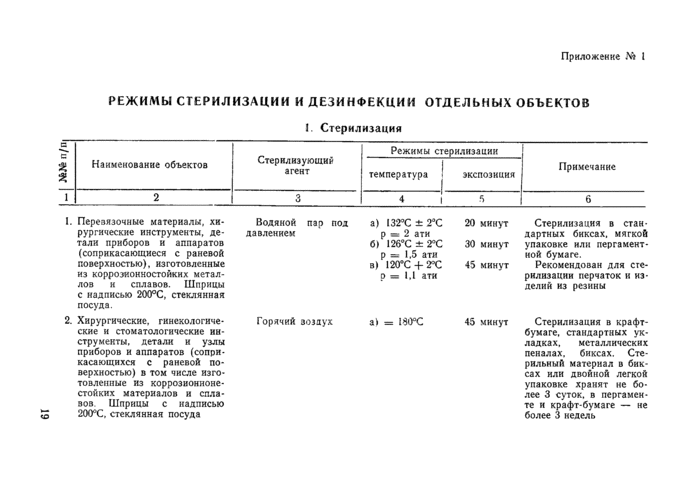
РЕЖИМЫ СТЕРИЛИЗАЦИИ И ДЕЗИНФЕКЦИИ ОТДЕЛЬНЫХ ОБЪЕКТОВ
20 минут Стерилизация в стан
дартных биксах, мягкой 30 минут упаковке или пергаментной бумаге.
45 минут Рекомендован для сте
рилизации перчаток и изделий из резины
I. Стерилизация
20 минут Стерилизация в стан
дартных биксах, мягкой 30 минут упаковке или пергаментной бумаге.
45 минут Рекомендован для сте
рилизации перчаток и изделий из резины
| |||||||||||||||||
|
I. Перевязочные материалы, хи- Водяной пар под а) 132°С ± ТС | |||||||||||||||||
рургические инструменты, де- давлением р ш 2 ати
тали приборов и аппаратов б» 126°С ± 2°С
(соприкасающиеся с раневой р = 1.5 ати
поверхностью), изготовленные в) 120*С + УС
из коррозионносгойких метал- о = 1.1 ати
45 минут Стерилизация в крафт-бумаге. стандартных укладках. металлических пеналах, биксах. Стерильный материал в биксах или двойной легкой упаковке хранят не более 3 суток, в пергаменте и крафт-бумаге — не более 3 недель
лов и сплавов. Шприцы с надписью 200°С, стеклянная посуда. 1
|
Хирургические инструменты из коррозионмостойких металлов и сплавов. Изделия из резины, пластичссхих масс, в том числе с металлическими частями из коррозиоиностой-ких металлов и сплавов |
6% раствор перекиси водорода |
а) 18°С б) 5<ГС |
6 часов 3 часа |
Погружение с последующим промыванием стерильной водой |
|
Эндоскопы, изделия из пластических масс, в том числе с металлическими частями. Изделия из резины и пластических масс, в том числе однократного пользования |
Смесь «ОБ* или «ОКЭБМ» (окись этилена с бромистым метилом в соотношении 1 : 1,5; I : 2,8 по весу соответственно) |
а) 18®С (при расходе 3.5 г/л) б) 50®С (при расходе 1.6 г/л) |
16 часов 6 часов |
Упаковка э полиэтиленовую пленку, пергамент |
|
II. Дезинфекция |
(обеззараживание) | |||
|
Отолярингологичсскис и др. инструменты, применяемые для осмотра |
а) Кипячение б) «Тройной раствор* |
2% раствор формалина. 0.3% раствор фенола. 1,5% раствор двууглекислой соды |
30 минут 45 минут |
В воде Погружение з раствор |
|
Зеркала зубные, гортанные и носоглоточные |
Перекись водорода |
6% |
1 час |
Погружение в раствор с последующим промыванием водой |
|
Шпатели металлические |
Кипячение |
15 минут | ||
|
Щетки для мытья рук |
Автохлавиропание |
0,5 ати |
20 минут |
ские и стоматологические ин-струмекты. детали и узлы приборов и аппаратов (соприкасающихся с раневой поверхностью) в том числе изготовленные из хоррознонноне-стойких материалов и сплавов Шприцы с надписью 200°С. стеклянная посуда
|
УТВЕРЖДАЮ: Начальник Главного Управления лечебно профилактической помощи Сафонов А. Г. 29 декабря 1973 г. № 10/8-43 |
УТВЕРЖДАЮ: Начальник Главного Санитарно-эпидемиологического Управления Минздрава СССР Ковшило В. Е. 29 декабря 1973 г. № 1142-73 |
ВРЕМЕННЫЕ МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОРГАНИЗАЦИИ И ПРОВЕДЕНИЮ КОМПЛЕКСА САНИТАРНО-ГИГИЕНИЧЕСКИХ МЕРОПРИЯТИЙ В ОТДЕЛЕНИЯХ, БОЛЬНИЦАХ, КЛИНИКАХ И ИНСТИТУТАХ ХИРУРГИЧЕСКОГО ПРОФИЛЯ
I. ОБЩИЕ ПОЛОЖЕНИЯ
1. Основным возбудителем внутрибольничных гнойно-септических заболеваний и послеоперационных осложнений является патогенный стафилококк.
2. Источником инфекции в хирургических клиниках являются больные острыми и хроническими формами гнойничковых заболеваний и носители патогенного стафилококка среди больных и обслуживающего персонала.
3. Стафилококк хорошо переносит высыхание; прямой солнечный свет вызывает гибель стафилококка в течение 4—5 часов. Стафилококки устойчивы к высокой температуре, менее устойчивы к действию различных химических веществ.
4. Передача патогенного стафилококка происходит двумя путями: воздушнокапельным и контактным.
5. Для профилактики и борьбы с послеоперационными гнойными осложнениями необходимо организовать и проводить комплекс санитарно-гигиенических мероприятий, направленных на обезвреживание источников инфекции и на перерыв путей передачи.
6. Данные методические указания предназначены для санитарно-эпидемиологических станций, дезинфекционных станций и дезинфекционных отделов санитарно-эпидемиологических станций, главных врачей лечебно-профилактических учреждений, персонала приемных отделений и отделений хирургического профиля клиник, больниц, институтов.
7. Заведующий хирургическим отделением несет ответственность за выполнение комплекса мероприятий по борьбе
| ||||||||||||||||||||||||||||||||||||||||||||||
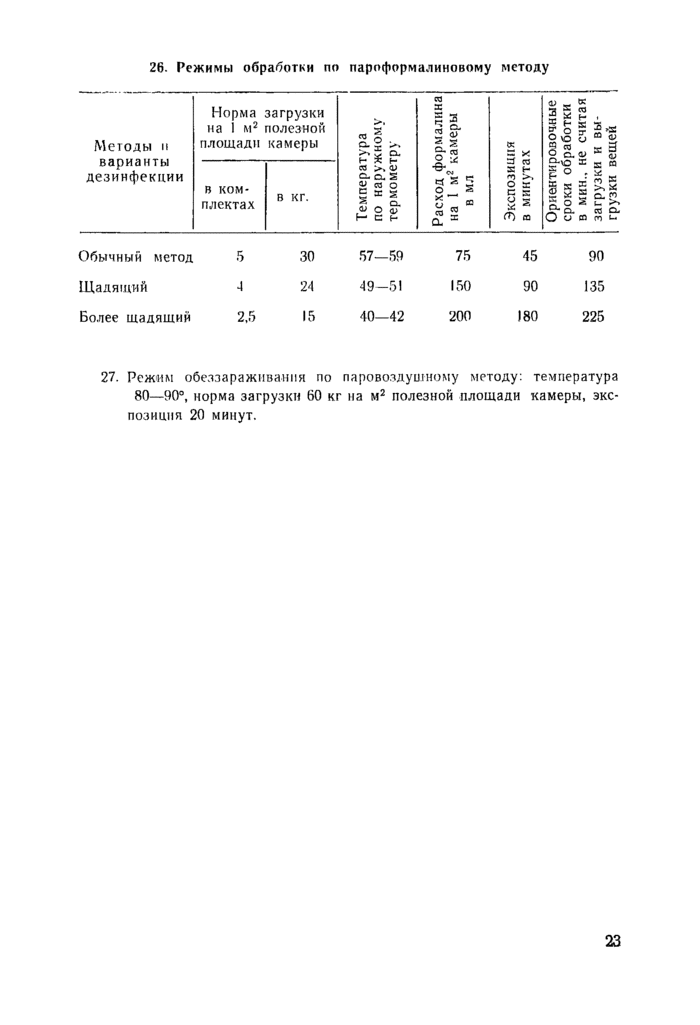
|
малиновому или паровоздушному методу |
| ||||||||||||||||||||||||
|
CM. n. 26, CTp. 21. |
с послеоперационными осложнениями; назначает врача, который вместе со старшей сестрой отделения организует и контролирует выполнение рекомендаций.
8. Заведующий отделением один раз в квартал организует обследование обслуживающего персонала на носительство патогенного стафилококка и в случае выявления носителей организует проведение их санации.
9. Старшая сестра отделения проводит инструктаж среднего и младшего медицинского персонала по выполнению комплекса противоэпидемических мероприятий.
II. САНИТАРНО-ГИГИЕНИЧЕСКИЙ РЕЖИМ В ПРИЕМНОМ ОТДЕЛЕНИИ И ПАЛАТАХ
10. У всех поступающих в приемное отделение больных осматривают кожные покровы, зев и измеряют температуру. Деревянные шпатели одноразового пользования после использования уничтожают, а металлические кипятят в течение 15 мимут. Термометры целиком помещают в сосуд с 0,5% раствором хлорамина с ежедневной сменой дезинфицирующего раствора.
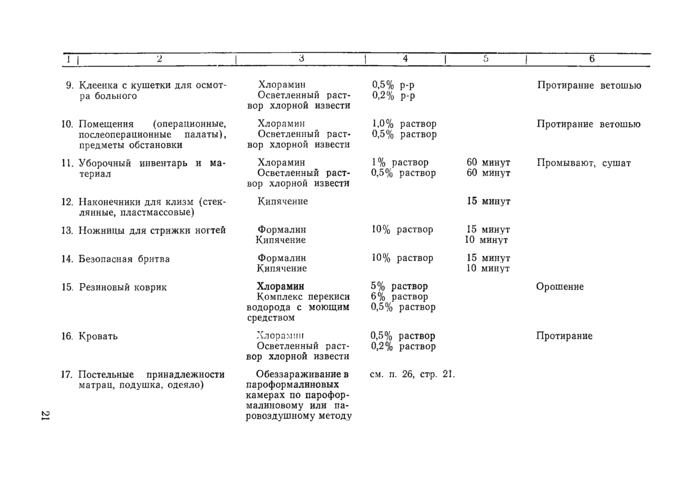
11. Осмотр больного проводят на кушетке, покрытой клеенкой; после приема каждого больного клеенку протирают ветошью, смоченной 0,5% раствором хлорамина или 0,2% осветленным раствором хлорной извести.
12. Больной в приемном покое проходит полную санитарную обработку: принимает душ, стрижет ногти и т. д. Для мытья больной получает обеззараженную мочалку. После использования мочалку кипятят в 2% растворе соды в течение 15 минут, сушат и хранят в чистой посуде; если мочалки кипятить сразу после использования не представляется возможным, то их собирают в маркированную емкость с 0,5% раствором хлорамина или 0,2% осветленным раствором хлорной извести, затем промывают проточной водой.
13. Щетки для обработки рук моют, сушат и автоклавируют при 0,5 ати в течение 30 минут. Хранят до использования в биксах, вынимают по мере надобности стерильным корнцангом.
14. Наконечники для клизм после каждого использования кипятят 15 минут, хранят в посуде с надписью «чистые» в сухом виде. Для обработки собирают в сосуд с 0,5% раствором хлорамина или 0,2% осветленным раствором хлорной извести.
15. Перед поступлением больного в палату кровать, прикроватную тумбочку, подставку для подкладного судна протирают ветошью, обильно смоченной дезинфицирующим раствором (0,5% раствор хлорамина или 0,2% раствор осветленной хлорной извести). Кровать застилают постельными принадлежностями, прошедшими камерную обработку по режиму для вегетативных форм микробов (приложение № 1). По возможности соблюдают цикличность заполнения палат.
16. Больному выделяют индивидуальные предметы ухода: плевательницу, поильник, подкладное судно и т. д., которые после употребления тщательно моют. После выписки больного предметы индивидуального ухода подвергают обеззараживанию (приложение № 1).
17. Для мытья рук больных, а также обслуживающего персонала используют жидкое гексахлорофеновое мыло. Допускают использование хозяйственного мыла в мелкой фасовке на 1 употребление.
18. Запрещают больным пользоваться личными шерстяными вещами, в случае необходимости шерстяные вещи больным выдают после камерной обработки.
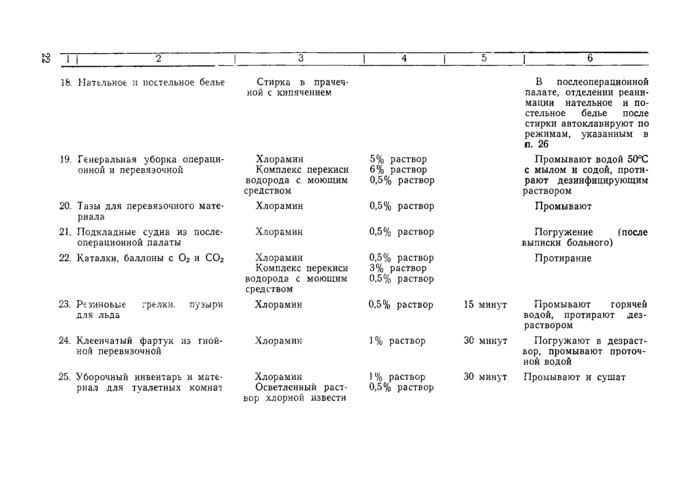
19. При смене нательного и постельного белья его аккуратно собирают в мешки из хлопчатобумажной ткани или емкости с крышкой. Запрещают сбрасывать бывшее в употреблении белье на пол или в открытые приемники. Сортировку и разборку грязного белья производят в специально выделенном помещении. После смены белья протирают предметы в палате и пол с дезинфицирующим раствором (приложение № 1).
20. Уборку приемного отделения и палат производят не реже 2 раз в день влажным способом. Дезинфицирующие средства используют после смены белья и в случае возникновения послеоперационных осложнений.
21. Уборочный материал (ведра, тазы и пр.) маркируют и используют строго по назначению. Ветошь выделяют и хранят строго по объектам обработки. После использования уборочный материал обеззараживают замачиванием на 1 час в 1% растворе хлорамина или 0,5% осветленном растворе хлорной извести.
22. Категорически запрещают принимать в хирургическое отделение мягкие игрушки и другие предметы, не выдерживающие дезинфекционной обработки.
III. САНИТАРНО-ГИГИЕНИЧЕСКИЙ РЕЖИМ В ОПЕРАЦИОННОМ БЛОКЕ, ПЕРЕВЯЗОЧНЫХ ИПОСЛЕОПЕРАЦИОННЫХ ПАЛАТАХ, ОТДЕЛЕНИЯХ РЕАНИМАЦИИ И ПАЛАТАХ ИНТЕНСИВНОЙ ТЕРАПИИ
23. Операционные блоки оборудуют стационарными бактерицидными облучателями и вентиляционными установками с преобладанием притока воздуха над вытяжкой. В приточную вентиляционную систему устанавливают бактерицидные фильтры.
24. В операционных, послеоперационных палатах, перевязочных, отделениях реанимации и интенсивной терапии для снижения микробной обсеменепности рекомендуется установка воздухоочистителей передвижных рециркуляционных (ВОПР-0,9 н ВОПР-1,5) (приложение № 3).
25. Строго разделяют операционные для чистых и гнойных операций. В случае отсутствия условий для выполнения этого требования операции по поводу гнойных процессов производят в специально выделенные дни с последующей тщательной дезинфекцией после операции операционного блока и всего оборудовання.
26. Хирурги, операционные сестры и все лица, участвующие в операции, перед операцией принимают гигиенический душ, надевают операционное белье (пижаму, тапочки, шапочку, халат). Перед входом в операционный блок халат снимают, надевают маску, бахилы и проходят в предоперационную, где производят обработку рук и надевают стерильный халат, перчатки и маску.
27. Все лица перед входом в операционную надевают 4 слойную марлевую маску и тщательно убирают волосы под шапочку, после чего надевают бахилы. Для использованных бахил устанавливают баж или ведро с крышкой. Не разрешают хождение персонала в операционном блоке в уличной обуви.
Вход в операционный блок персоналу, не участвующему в операции, запрещают.
28. Все предметы, ввозимые и вносимые в операционный блок (каталку, баллоны с Ог, ССЬ, кардиографы и т. д.), перед входом в операционный блок обрабатывают ветошью, обильно смоченной дезинфицирующим раствором.
29. Стол для стерильного инструментария покрывают стерильной простыней непосредственно перед операцией и раскладывают на нее стерильный инструментарий, сверху закрывают стерильной простыней.
30. Перевязочный материал и инструментарий, использованные в ходе операции, собирают в специально выделенные емкости.
31. Двери в операционном блоке держат постоянно закрытыми.
32. Категорически запрещают храпение в операционном зале предметов, не используемых во время операционного вмешательства.
33. Строго разделяют перевязочные для чистых и гнойных перевязок. В случае наличия одной перевязочной обработки гнойных ран производят после проведения чистых манипуляций с последующей тщательной обработкой помещения и всего оборудования дезинфицирующими растворами.
34. Сотрудники перевязочных, послеоперационных палат, палат интенсивной терапии и отделений реанимации ежедневно меняют халаты, шапочки, маски.
35. Медицинская сестра во время перевязок больных с на-гноительными процессами надевает клеенчатый фартук, который после каждой перевязки протирает ветошью, смоченной в дезинфицирующем растворе, и моет руки жидким гексахло-рофеновым мылом.
36. После проведения перевязок и сбора перевязочного материала в специально выделенные емкости производят влажную уборку с применением дезинфицирующих растворов.
Инфицированный перевязочный материал подлежит дезинфекционной обработке (приложение № I).
37. Персоналу, не работающему в перевязочных, отделениях реанимации, палатах иитенсивцой терапии и послеоперационных палатах, вход в них запрещен.
38. Перед поступлением больного в послеоперационную палату из операционного блока кровать, прикроватную тумбочку обрабатывают дезинфицирующим раствором. Кровать заправляют постельными принадлежностями, прошедшими камерную обработку.
39. Уборку операционного блока, перевязочных, послеоперационных палат, палат интенсивной терапии, отделений реанимации проводят влажным способом не реже 2 раз в день с использованием дезинфицирующих средств (приложение № I).
40. Один раз в неделю проводят генеральную уборку операционного блока и перевязочных. Помещения операционного блока, перевязочных предварительно освобождают от предметов, оборудования, инвентаря, инструментов, медикаментов, и т. д. В качестве дезинфектантов используют 5%
раствор хлорамина или комплекс состоящий из 6% перекиси водорода и 0,5% моющего средства. После дезинфекции помещения операционного блока и перевязочные облучают ультрафиолетом, включая настенные или потолочные бактерицидные облучатели (ОБН-200 или ОБН-350, один облучатель на 30 м3 помещения; ОБН-150 или ОБН-ЗОО — на 60 м3 на 2 часа).
41. Для каждого вида уборочных работ выделяют материал и строго промаркированный инвентарь. Использованный мягкий материал (ветошь) кипятят в течение 15 минут, сушат и хранят до следующей уборки в закрывающемся шкафу или тумбочке. Уборочный материал после мытья полов заливают 1 % раствором хлорамина на 60 минут в том же ведре, которое использовали для уборки, затем прополаскивают в проточной воде и сушат. Следят, чтобы инвентарь использовали строго по назначению.
IV. ОБРАБОТКА ОПЕРАЦИОННОГО ПОЛЯ, РУК, ХИРУРГИЧЕСКИХ ПЕРЧАТОК В ХОДЕ ОПЕРАЦИИ
42. Обязательной является обработка рук всех, участвующих в операции: хирургов, анестезиологов,, операционных
сестер, функциональных диагностов и т. д.
43. Для обработки рук используют различные препараты, разрешенные Фармакологическим комитетом Министерства здравоохранения СССР в том числе рецептуру «С-4» (смесь перекиси водорода и муравьиной кислоты) и иодопирон.
44. Рецептуру «С-4» готовят из необходимого количества перекиси водорода и муравьиной кислоты, которые смешивают в стеклянном сосуде, последний помещают в холодную воду на 1—1,5 часа и периодически встряхивают. Полученный раствор хранят не более суток в стеклянном сосуде с герметической пробкой в прохладном месте.
Для обработки рук используют 2,4% раствор рецептуры «С-4».
Количество ингредиентов для приготовления рецептуры «С-4»:
|
Количество рабочего раствора (л) |
Количество ингредиентов | |||
|
30-33% перекись водорода (мл) |
Муравьиная кислота |
Вода (л) | ||
|
100% (мл) |
85% (мл) | |||
|
1 |
17,1 |
6,9 |
8,1 |
до 1 |
|
2 |
34,2 |
13,8 |
16,2 |
до 2 |
|
5 |
85,5 |
34,5 |
40,5 |
до 5 |
|
10 |
171,0 |
69,0 |
81,0 |
до 10 |
Раствор готовят и используют только в день операции.
Перед обработкой рук раствором рецептуры «С-4» руки моют водой с мылом (без щетки) в течение 1 минуты. После этого руки ополаскивают водой для удаления мыла и вытирают насухо стерильной салфеткой. Затем руки обрабатывают в течение 1 минуты рецептурой «С-4» в эмалированном тазу, после чего вытирают стерильной салфеткой и надевают стерильные перчатки.
После окончания работы руки смазывают обычным смягчающим средством.
45. Рабочие растворы иодопирона 2 готовят в эмалированном тазу, дважды обожженном горящим спиртом, наливают два литра теплой воды и добавляют (по мерному сосуду) 20 мл моющего порошка-лаурилсульфата, после растворения которого добавляют 40 мл иодопирона. Тщательно перемешивают стеклянной палочкой или деревянной. Раствор содержит 0,05% свободного иода.
Предварительно руки моют под краном стерильной щеткой 1—2 мин., обращая особое внимание на околоногтевые пространства, вытирают стерильной салфеткой. Затем руки моют в растворе иодопирона в течение 4—5 мин. После чего их вытирают стерильной марлевой салфеткой, надевают стерильные перчатки.
46. Обработка перчаток в ходе операции.
Таз с раствором иодопирона или рецептуры «С-4» после обработки рук перед операцией вносят в операционную н через каждые 45—60 миНут проводят повторную обработку перчаток в процессе операции.
47. Для обработки кожи операционного поля применяют иодопирон, иодонат.
Рабочие растворы иодоната готовят ex tempore путем разбавления исходного раствора в 5 раз кипяченой или стернль-
нон водой. Кожу операционного поля без предварительного мытья обрабатывают двухкратным смазыванием стерильными тампонами, смоченными 5—7 мл раствора иодоната или иодопирона 1% концентрации по свободному иоду.
V. ПОДГОТОВКА ХИРУРГИЧЕСКИХ ИНСТРУМЕНТОВ К ОПЕРАЦИИ
48. После окончания операции весь хирургический инструментарий разбирают и промывают проточной водой. Промытые инструменты (шприцы, иглы, и части аппаратов) замачивают в горячем (50°С) моющем растворе (0,5% раствор перекиси водорода с моющим средством, взятых в соотношении I : 1) в течение 15 минут, полностью погружая их в раствор и заполняя полости.
Инструменты после гнойных операций перед обработкой погружают на 30 минут в 3% раствор перекиси водорода с моющим средством или 1 % раствор хлорамина.
49. После замачивания в этом растворе инструменты моют ершами или ватно-марлевыми тампонами в среднем 25—30 секунд на предмет. Раствор употребляют однократно при сильном загрязнении предметов кровью. Если раствор не изменяет цвета, его используют повторно. Вымытые предметы прополаскивают в проточной воде, затем в дистиллированной. Качество мытья инструментов определяют путем постановки бензидиновой пробы на наличие крови.
Бензидиновая проба основана на окислении бензидина перекисью водорода за счет пероксидазного действия кровяного пигмента.
Чаще используют модификацию бензидиновой пробы Гре-герсена: смешивают 0,0025 г основного бензидина с 0,1 г переписного бария (перекись бария может быть заменена 3% раствором перекиси водорода) и перед использованием добавляют 5 мл 50% раствора уксусной кислоты, взбалтывают до полного растворения.
Указанным раствором смачивают тампон и протирают инструменты, шприцы и части аппаратов. Появление зеленого окрашивания указывает на наличие крови на предметах, следовательно, изделие подлежит повторной обработке. Полноту отмывания щелочных добавок к ПАВ моющего препарата проверяют качественной реакцией с 0,1% спиртовым раствором фенолфталеина путем нанесения 2—3 капель раствора на вымытый инструмент. При появлении розового окрашивания инструменты подлежат повторной промывке в проточной воде в течение 5 минут.
1
Хирургические, гинехологиче- Горячий воздух ак = 160°С
2
Препарат рекомендован Фармакологическим комитетом и в ближайшее время будет налажен его выпуск.