МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ (Минздрав России)
министерство истине «всийской ФЕДЕРАЦИИ
Об утверждении
формы документа о результатах мониторинга безопасности биомедицинского клеточного продукта, осуществляемого владельцем регистрационного удостоверения биомедицинского клеточного продукта
В соответствии с частью 3 статьи 22 Федерального закона от 23 июня 2016 г. № 180-ФЗ «О биомедицинских клеточных продуктах» (Собрание законодательства Российской Федерации, 2016, № 26, ст. 3849) и подпунктом 5.2.20723 Положения о Министерстве здравоохранения Российской Федерации, утвержденного постановлением Правительства Российской Федерации от 19 июня 2012 г. № 608 (Собрание законодательства Российской Федерации, 2012, № 26, ст. 3526; 2013,
№ 16, ст. 1970; № 20, ст. 2477; № 22, ст. 2812; № 33, ст. 4386; № 45, ст. 5822; 2014 № 12, ст. 1296; № 26, ст. 3577; № 30, ст. 4307; № 37, ст. 4969; 2015, № 2, ст. 491 № 12, ст. 1763; № 23, ст. 3333; 2016, № 2, ст. 325; № 9, ст. 1268; № 27, ст. 4497 № 28, ст. 4741; № 34, ст. 5255; № 49, ст. 6922; 2017, № 7, ст. 1066; № 33, ст. 5202
№ 37, ст. 5535; № 40, ст. 5864), приказываю:
Утвердить прилагаемую форму документа о результатах мониторинга безопасности биомедицинского клеточного продукта, осуществляемого владельцем регистрационного удостоверения биомедицинского клеточного продукта.
УТВЕРЖДЕНА приказом Министерства здравоохранения Российской Федерации от «20» 2017 г. № И
Форма
Результаты мониторинга безопасности биомедицинского клеточного продукта, осуществляемого владельцем регистрационного удостоверения биомедицинского клеточного продукта
1. Наименование и адрес местонахождения владельца регистрационного удостоверения биомедицинского клеточного продукта либо уполномоченного им юридического лица, которое осуществляло мониторинг безопасности биомедицинского клеточного продукта за отчетный период
2. Номер и дата регистрационного удостоверения биомедицинского
клеточного продукта_
3. Наименование биомедицинского клеточного продукта, торговое наименование биомедицинского клеточного продукта (при наличии)
4. Период осуществления мониторинга безопасности биомедицинского клеточного продукта:
с «_»_20_г.
по «_»_20_г.
5. Дата представления результатов мониторинга безопасности
биомедицинского клеточного продукта «_»_20_г.
(должность) (фамилия, имя отчество (при наличии) (подпись)
уполномоченного лица)
6. Результаты мониторинга безопасности биомедицинского клеточного продукта представлены:
7. Информация о регистрации биомедицинского клеточного продукта в зарубежных странах, в которых разрешено его медицинское применение
|
Страна |
Наименование биомедицинского клеточного продукта |
Сведения о регистрации биомедицинского клеточного продукта |
Отличия, содержащиеся в инструкции по применению биомедицинского клеточного продукта (показания к применению, противопоказания к применению, режим и способ применения биомедицинского клеточного продукта, продолжительность лечения, иные отличия) |
|
|
|
|
|
|
8. Информация о случаях приостановления применения и (или) запрета применения биомедицинского клеточного продукта в зарубежных странах, в которых разрешено его медицинское применение_ |
|
Страна |
Наименование
биомедицинского
клеточного
продукта |
Дата (период) приостановления применения биомедицинского клеточного продукта, основания такого приостановления |
Дата (период) запрета применения биомедицинского клеточного продукта, основания такого запрета |
|
|
|
|
|
|
|
9. Информация об отказах в регистрации биомедицинского клеточного продукта в зарубежных странах _ |
|
Страна |
Наименование биомедицинского клеточного продукта |
Дата отказа в регистрации биомедицинского клеточного продукта и основания, послужившие отказом в регистрации биомедицинского клеточного продукта |
|
|
|
|
|
|
10. Информация о проведенных и (или) проводимых в период представления результатов мониторинга безопасности биомедицинского клеточного продукта клинических исследований биомедицинского клеточного продукта на территории Российской Федерации и на территории зарубежных стран_____ |
|
Страна |
Наименование
биомедицинского
клеточного
продукта |
Цель проведения клинического исследования биомедицинско го клеточного продукта |
Сведения об этапе клинического исследования биомедицинского клеточного продукта или его завершении |
Количество пациентов, участвующих в проведении клинического исследования биомедицинского клеточного продукта |
Оценка результатов клинического исследования биомедицинского клеточного продукта |
|
|
|
|
|
|
|
|
|
11. Информация о количестве пациентов, которым применен биомедицинский клеточный продукт на территории Российской Федерации и на территории зарубежных стран, в которых разрешено его медицинское применение |
|
Страна |
Количество пациентов, которым применен биомедицинский клеточный продукта |
Общее количество биомедицинского клеточного продукта, примененного пациентам |
|
|
|
|
|
|
12. Информация о количестве биомедицинского клеточного продукта, поступившего в обращение на территории Российской Федерации и на территории зарубежных стран, в которых разрешено его медицинское применение |
|
Страна |
Количество упаковок биомедицинского клеточного продукта, поступивших в обращение |
|
|
|
|
|
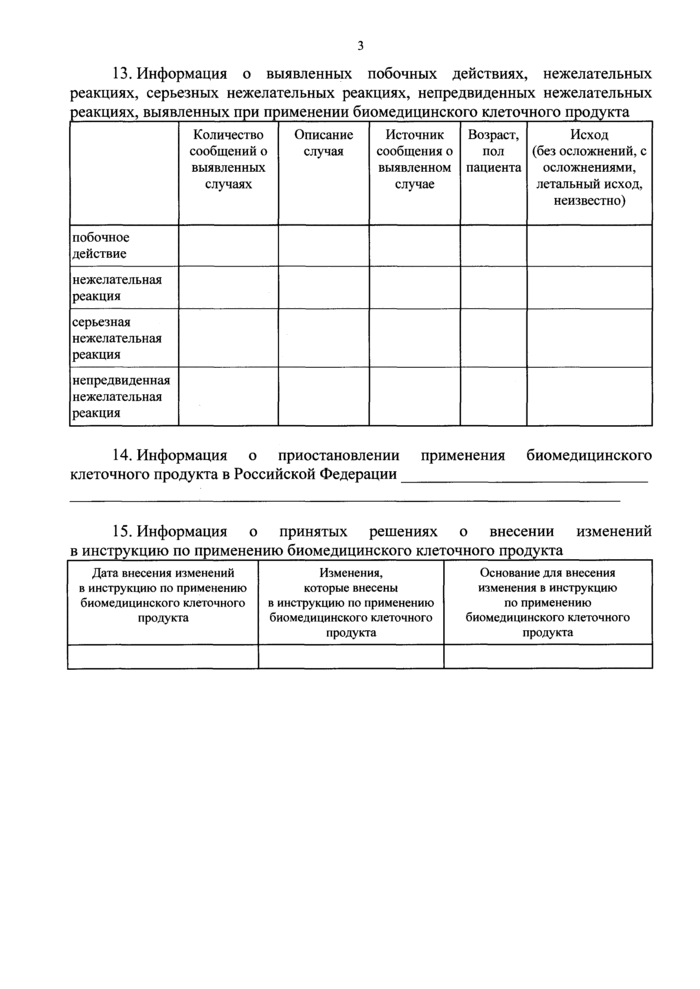
13. Информация о выявленных побочных действиях, нежелательных реакциях, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях, выявленных при применении биомедицинского клеточного продукта |
|
|
Количество сообщений о выявленных случаях |
Описание
случая |
Источник сообщения о выявленном случае |
Возраст,
пол
пациента |
Исход (без осложнений, с осложнениями, летальный исход, неизвестно) |
|
побочное
действие |
|
|
|
|
|
|
нежелательная
реакция |
|
|
|
|
|
|
серьезная
нежелательная
реакция |
|
|
|
|
|
|
непредвиденная
нежелательная
реакция |
|
|
|
|
|
|
14. Информация о приостановлении применения биомедицинского клеточного продукта в Российской Федерации_
|
15. Информация о принятых решениях о внесении изменений в инструкцию по применению биомедицинского клеточного продукта_ |
|
Дата внесения изменений в инструкцию по применению биомедицинского клеточного продукта |
Изменения, которые внесены в инструкцию по применению биомедицинского клеточного продукта |
Основание для внесения изменения в инструкцию по применению биомедицинского клеточного продукта |
|
|
|
|
|