ГОСТ ISO 10993-11-2011
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
Устанавливает требования и дает рекомендации по процедурам, необходимым для оценки потенциального общетоксического действия химических компонентов, мигрирующих в организм из медицинских изделий. Стандарт распространяется на оценку конечного продукта и компонентов его вымывания. Исследования экстрактов из изделия или продуктов вымывания следует проводить с использованием модельной среды, которая обеспечивает максимальную экстракцию продуктов вымывания для дальнейшего биологического исследования.
Идентичен ISO 10993-11:2006
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Основные требования
4.1 Общие положения
4.2 Выбор вида животных
4.3 Статус животных
4.4 Уход и содержание животных
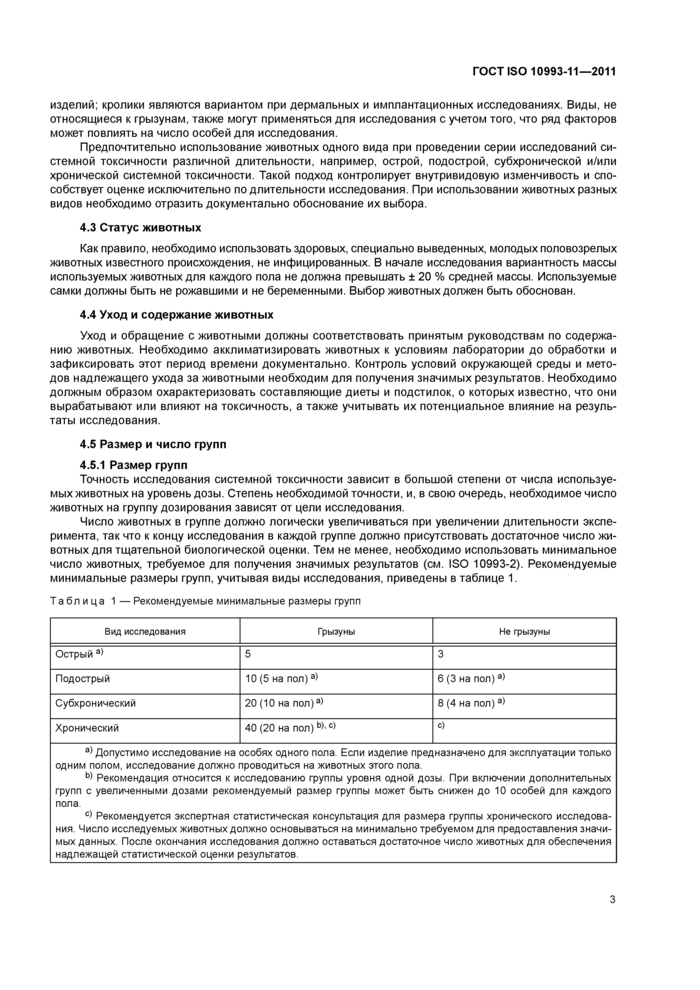
4.5 Размер и число групп
4.6 Путь введения
4.7 Подготовка образца
4.8 Дозирование
4.9 Масса тела и потребление пищи/воды
4.10 Клинические наблюдения
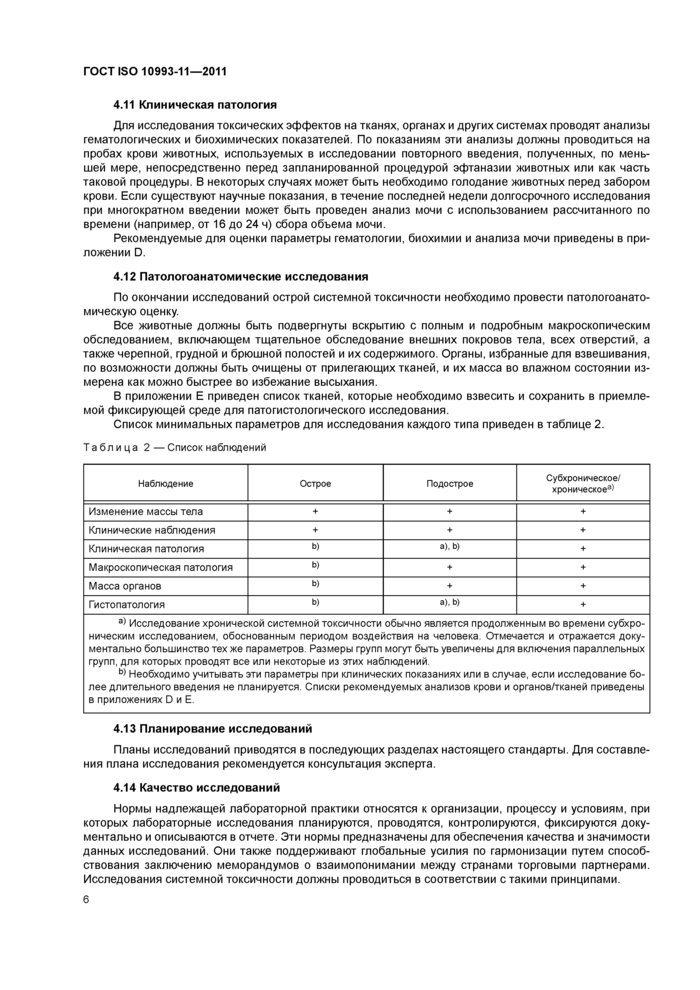
4.11 Клиническая патология
4.12 Патологоанатомические исследования
4.13 Планирование исследований
4.14 Качество исследований
5 Острая системная токсичность
5.1 Общие положения
5.2 Планирование исследования
5.3 Критерии оценки
5.4 Заключительный отчет
6 Системная токсичность многократного введения (подострая, субхроническая и хроническая системная токсичность
6.1 Общие положения
6.2 Планирование исследования
6.3 Критерии оценки
6.4 Заключительный отчет
Приложение А (справочное) Пути введения
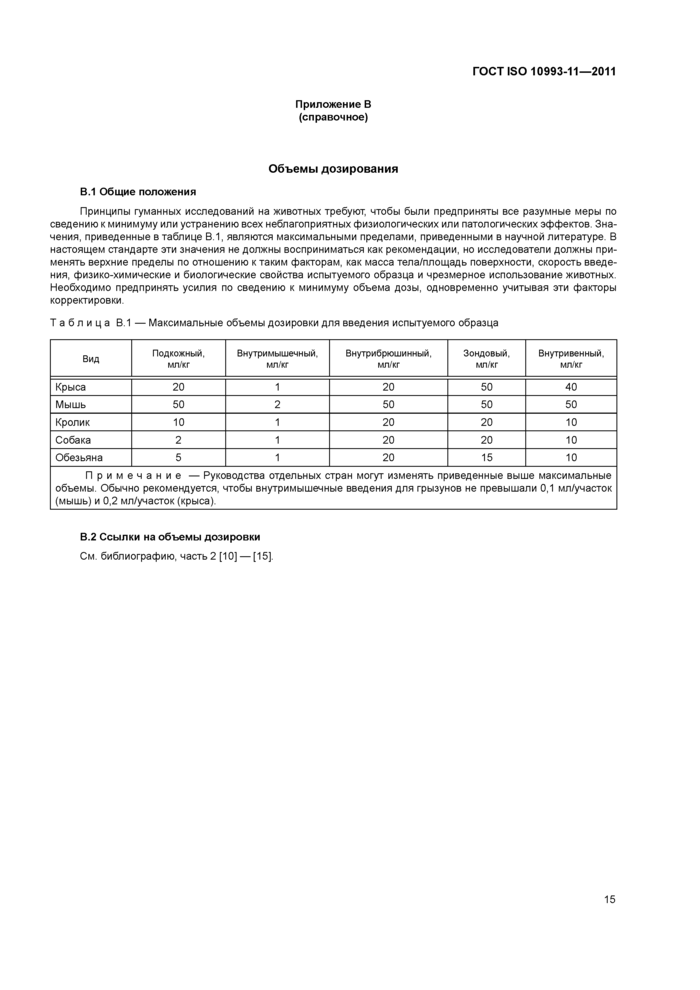
Приложение В (справочное) Объемы дозирования
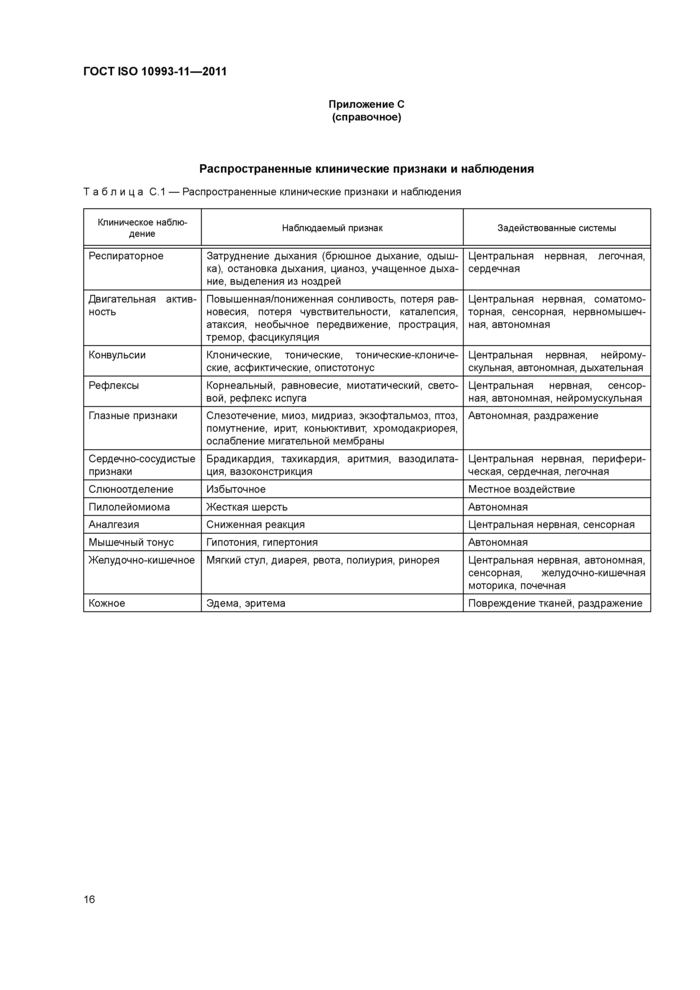
Приложение С (справочное) Распространенные клинические признаки и наблюдения
Приложение D (справочное) Рекомендуемые параметры гематологии, клинической химии и анализа мочи
Приложение Е (справочное) Список рекомендуемых органов для гистопатологической оценки
Приложение F (справочное) Информация по пирогенам, опосредованным материалом
Приложение ДА (справочное) Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
Библиография
28 страниц
| Дата введения | 01.01.2013 |
|---|---|
| Добавлен в базу | 01.10.2014 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 29.11.2011 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 40 |
|---|---|---|---|
| 13.12.2011 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1327-ст |
| Разработан | ФГУП ВНИИНМАШ | ||
| Издан | Стандартинформ | 2014 г. |
Medical devices. Biological evaluation of medical devices. Part 11. Tests for systemic toxicity
ГОСТ ISO 10993-12-2011Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы. Заменен на ГОСТ ISO 10993-12-2015.- ГОСТ ISO 10993-1-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9

стр. 10

стр. 11
стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20
стр. 21
стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
ГОСТ ISO/TS 10993-19— 2011
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ. ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 19
Исследования физико-химических, морфологических и топографических свойств
материалов
(ISO/TS 10993-19:2006, ЮТ)
Издание официальное
Москва
Стандартинформ
2013
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт стандартизации и сертификации в машиностроении» (ВНИИНМАШ)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 29 ноября 2011 г. № 40)
За принятие проголосовали:
|
Краткое наименование страны по MK (ИСО 3166) 004—97 |
Код страны по МК (ИСО 3166) 004—97 |
Сокращенное наименование национального органа по стандартизации |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Кыргызстан |
KG |
Кыргызстандарт |
|
Российская Федерация |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Т аджикстандарт |
|
Узбекистан |
UZ |
Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 13 декабря 2011 г. № 1311-ст межгосударственный стандарт ГОСТ ISO 10993-19-2011 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2013 г.
5 Настоящий стандарт идентичен международному документу ISO/TS 10993-19:2006 Biological evaluation of medical devices — Part 19: Physico-chemical, morphological and topographical characterization of materials (Оценка биологического действия медицинских изделий. Часть 19. Исследования физико-химических, морфологических и топографических свойств материалов).
Наименование настоящего стандарта изменено по отношению к наименованию указанного международного документа для приведения в соответствие с ГОСТ 1.5-2001 (пункт 3.6).
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
Степень соответствия — идентичная (ЮТ).
Стандарт подготовлен на основе применения ГОСТ Р ИСО/ТС 10993-19—2009
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта публикуется в ежемесячно издаваемом информационном указателе «Национальные стандарты».
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра или отмены настоящего стандарта соответствующая информация будет опубликована в ежемесячно издаваемом информационном указателе «Национальные стандарты»
© Стандартинформ, 2013
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ ISO/TS 10993-19-20116.4 Количественные данные
В случае, если качественной информации о материале не достаточно для определения его полной пригодности, необходимая количественная информация должна быть получена, документирована и подвергнута оценкам на пользу и риск.
6.5 Количественная оценка
Частью оценки биологических свойств медицинских изделий является получение достаточной количественной информации, необходимой для того, чтобы оценить пригодность использования всех материалов по назначению в готовом для применения изделии. Эти количественные характеристики могут быть сопоставлены с соответствующими данными, полученными для материалов и/или готовых для применения медицинских изделий, безопасность и эффективность использования которых для данной цели клинически установлена. Полезно также сопоставить количественную информацию с информацией, полученной для материалов или продуктов, характеристики которых не пригодны для данного использования. Такая полная оценка находится за пределами области применения настоящего стандарта и будет дополняться сведениями, взятыми из многих других частей серии международных стандартов ISO 10993, а также будет использовать информацию, содержащуюся в ISO 14971.
7 Характеристические параметры и методы
В разделе 6 сформулированы качественные и количественные ФМТ характеристики для использования их при оценке пригодности и риска. В таблице 2 суммируются примеры параметров, необходимых для оценки свойств материалов, и примеры методов, которые могут быть использованы для получения качественной или количественной информации. Соответствующие стандарты и/или ссылки даны для каждого параметра, например для топографии. Не все параметры и связанные с ними методы могут быть применены для материалов всех типов. Характерные параметры следует выбирать соответственно материалу или готовому для применения медицинскому изделию. Вследствие многообразия медицинских изделий установлено, что не все параметры, присущие данному материалу, будут существенны для всех или некоторых применений медицинских изделий. Как отмечается в 6.2, степень оценки свойств материалов, которую необходимо применить, определяется ивазивностью и длительностью клинического использования при данном применении.
Аналитик и специалист в области материаловедения в процессе консультаций с экспертом по оценке риска должны определить, какие параметры существенны при
7
оценке материала или медицинского изделия. Соответствующие данные должны быть получены для всех параметров, являющихся существенными по мнению эксперта по оценке риска.
Примечание - Для природных макромолекул важно, чтобы организм (или его часть), являющийся их источником, а также его происхождение/состояние были бы идентифицированы с самого начала. Серия стандартов ISO 22442 описывает безопасное использование биотканей животного происхождения и их производных при изготовлении медицинских изделий. EN 455-3 описывает оценку рисков, связанных с остаточным содержанием протеинов в натуральном латексе.
Природные макромолекулы, используемые в медицинских изделиях, включают в себя белки, гликопротеины, полисахариды, керамику и другие соединения. Примерами таких соединений являются: желатин, коллаген, эластин, фибрин, альбумин, альгинат, целлюлоза, гепарин, хитозан, переработанные кости, коралловая и натуральная губка. Все эти материалы могут быть переработаны, очищены и модифицированы до различной степени. Многие их этих материалов описаны в фармакологических монографиях. Характеристики этих материалов содержатся в некоторых стандартах
|
Таблица 2- Примеры параметров и методов исследования материалов, включая полимеры, металлы, сплавы, керамику и природные макромолекулы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
9
|
Продолжение таблицы 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
10
|
Окончание таблицы 2 | |||||||||||||||||||||||||||||
|
11
8 Отчет о полученных данных
Отчеты по измерениям должны точно формулировать цель проведения оценки свойств материалов и при необходимости должны содержать:
a) детальное описание материалов и готовых к применению медицинских изделий;
b) методы, используемые для определения свойств материалов;
c) полученные количественные данные.
В тех областях, в которых стандартов не существует, полученные качественные и количественные данные будут собираться и документироваться для информационных целей.
12
ГОСТ ISO/TS 10993-19-2011Приложение А (справочное)Принципы оценки эквивалентности материала
Принципы оценки эквивалентности материала
В 6.3 данные по свойствам материала используют для оценки риска при принятии решения об эквивалентности предложенного материала тому материалу, который уже используется в клинической практике или в готовом к применению медицинском изделии в той же клинической области. Ключевым принципом при выносе данного суждения является тот факт, что свойства предложенного материала или медицинского изделия, касающиеся биологической безопасности и клинического применения, эквивалентны аналогичным свойствам материала или медицинского изделия, который уже используется в клинической практике. Следующий список содержит примеры того, как такая эквивалентность может быть установлена, и является руководством к проведению таких оценок, описанных в разделах 5 и 6:
a) предложенный материал или готовое к применению медицинское изделие удовлетворяет по длительности контакта и инвазивности существующему стандарту при его использовании по данному назначению.
b) предложенный материал или готовое к применению изделие уже используется в более инвазивных применениях, чем то, которое рассматривается.
c) предложенный материал или готовое к применению изделие обладает свойствами, очень близкими к свойствам соответствующего материала или готового к применению изделия, которые уже используются в клинической практике.
13
Приложение В (справочное)Наночастицы. Специальное пояснение принципов оценки эквивалентности материала и биологических свойств
В случае, если материал состоит из наночастиц (НЧ меньше или равные 100 нм в диаметре), то нельзя считать, что его физико-химические и биологические свойства эквивалентны соответствующим свойствам материала, состоящего из частиц большего размера, например в микронном диапазоне или еще больших размеров. НЧ, производимые в коммерческом масштабе, изготовлены, например из переходных металлов, кремния, углерода (односторонние углеродные нанотрубки, фуллерены) и окислов металлов (оксид цинка, диоксид титана). НЧ должны оцениваться в каждом конкретном случае с учетом направления и длительности применения, а также взаимодействия с жидкостями, клетками и тканями. Известно, что НЧ имеют тенденцию к агрегации.
Согласно немногочисленным исследованиям токсичности наночастиц, находящихся в производстве, они имеют уникальные физико-химические свойства и проявляют легочную токсичность при высоких дозах, которая, по-видимому, связана с большим отношением поверхности к массе (Donaldson et al., [51]; Dreher, [52] Everitt and Bermudez, [54]; Lam et al., [64]; Warheit et al., [78]). Легочное воспаление, вызванное углеродными НЧ, растет прямо пропорционально общей поверхности внесенных частиц, причем дополнительное осложнение может быть вызвано присутствием ионов переходных металлов на поверхности НЧ (Brown et al., [47]; Wilson et al., [83]).
Отличие в восприимчивости легочной токсичности к вдыхаемым НЧ диоксида титана большего размера наблюдалось даже для грызунов. Наибольшей восприимчивостью обладали крысы, промежуточной - мыши, а хомяки были совсем нечувствительны (Everitt and Bermudez, [54]). НЧ могут перераспределяться по отношению к месту их внесения, например, после вдыхания НЧ, они, как было показано, двигаются по носовому нерву в мозг и из легких попадают в кровь (Kreuter et al., [61]; Kreyling et al., [62]; Nemmar et al., [67]; Oberdorster et al., [70]). Внесение в легкие НЧ полистирола приводило к коагуляции крови у хомяков, причем образование сгустков возрастало при аминировании поверхности НЧ, т.е. делало их более реакционноспособными. (Nemmar et al., [68]). НЧ материалов, наоборот характеризуемых низкой токсичностью и низкой растворимостью, могут генерировать
ГОСТ ISO/TS 10993-19-2011
свободные радикалы на своей поверхности, что вызывает эффект появления сигнального кальция, что, в свою очередь, может приводить к воспалению (Stone et al., [76]). При контакте с НЧ дозу следует оценивать не по общей массе НЧ на кг массы тела, а по общей площади поверхности НЧ и массе НЧ на кг массы тела.
15
Приложение ДА (справочное)
Сведения о соответствии межгосударственных[ стандартов ссылочным международным стандартам
|
Табл ица ДА.1 | ||||||||||||
| ||||||||||||
16
Содержание
1 Область применения...................................................1
2 Нормативные ссылки..................................................1
3 Термины и определения................................................2
4 Символы и сокращения.................................................2
5 Основные принципы...................................................3
6 Процедура определения свойств материалов...................................5
6.1 Общие положения..................................................5
6.2 Качественная оценка................................................6
6.3 Эквивалентность материала...........................................6
6.4 Количественные данные..............................................7
6.5 Количественная оценка..............................................7
7 Характеристические параметры и методы.....................................7
8 Отчет о полученных данных.............................................12
Приложение А (справочное) Принципы оценки эквивалентности материала................13
Приложение В (справочное) Наночастицы. Специальное пояснение принципов оценки эквивалентности материала и биологических свойств ..............................14
Приложение ДА (справочное) Сведения о соответствии межгосударственных стандартов ссылочным
ГОСТ ISO/TS 10993-19—2011
Библиография
международным стандартам...................................16
........................................................17
ГОСТ ISO/TS 10993-19-2011
Библиография
[1]
ISO 3274:1996
[2]
ISO 4287:1997
[3]
ISO 4288:1996
[4]
ISO 5436-1:2000
[5]
ISO 5436-2:2001
[6]
ISO 5832-1:1997
[7]
ISO 10993-9:1999
[8]
ISO 10993-13:1998
Geometrical Product Specifications (GPS) — Surface texture: Profile method — Nominal characteristics of contact (stylus) instruments
(Геометрические характеристики изделий (GPS). Структура поверхности. Профильный метод. Номинальные характеристики контактных (щуповых) приборов) Geometrical Product Specifications (GPS) — Surface texture: Profile method — Terms, definitions and surface texture parameters
(Геометрические характеристики изделий (GPS). Структура поверхности. Профильный метод. Термины. Определения и параметры структуры)
Geometrical Product Specifications (GPS) — Surface texture: Profile method — Rules and procedures for the assessment of surface texture
(Геометрические характеристики изделий (GPS). Структура поверхности. Профильный метод. Определение и параметры структуры)
Geometrical Product Specifications (GPS) — Surface texture: Profile method; Measurement standards — Part 1: Material measures
(Геометрические характеристики изделий. Текстура поверхности: профильный метод; эталоны. Часть 1. Вещественные меры)
Geometrical Product Specifications (GPS) — Surface texture: Profile method; Measurement standards — Part 2: Software measurement standards (Геометрические характеристики изделий. Текстура поверхности: профильный метод; эталоны. Часть 2. Эталоны программного обеспечения)
Implants for surgery — Metallic materials — Part 1: Wrought stainless steel
(Имплантаты для хирургии. Металлические материалы. Часть 1. Деформируемая нержавеющая сталь)
Biological evaluation of medical devices — Part 9: Framework for identification and quantification of potential degradation products
(Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деградации)
Biological evaluation of medical devices — Part 13: Identification and quantification of degradation products from polymeric medical devices
(Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественное определение продуктов деградации полимерных медицинских изделий)
17
Введение
Соблюдение положений стандартов серии ISO 10993 «Оценка биологического действия медицинских изделий» позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление единообразных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией их по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие соответствующую подготовку и опыт вобласти санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты серии ISO 10993 являются руководящими документами для прогнозирования и исследования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых изделий.
В серию ISO 10993 входят следующие части под общим названием «Оценка биологического действия медицинских изделий»:
Часть 1 — Оценка и исследования;
Часть 2 — Требования к обращению с животными;
Часть 3 — Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
Часть 4 — Исследование изделий, взаимодействующих с кровью;
Часть 5 — Исследование на цитотоксичность: методы in vitro;
Часть 6 — Исследование местного действия после имплантации;
Часть 7 — Остаточное содержание этиленоксида после стерилизации;
Часть 9 — Основные принципы идентификации и количественного определения потенциальных продуктов деградации;
Часть 10 — Исследование раздражающего и сенсибилизирующего действия;
Часть 11 —Исследование общетоксического действия;
Часть 12 — Приготовление проб и стандартные образцы;
Часть 13 — Идентификация и количественное определение продуктов деградации полимерных
медицинских изделий;
Часть 14 — Идентификация и количественное определение продуктов деградации изделий из
керамики;
Часть 15 — Идентификация и количественное определение продуктов деградации изделий из металлов и сплавов;
Часть 16 — Моделирование и исследование токсикокинетики продуктов деградации и вымывания;
Часть 17 — Установление пороговых значений для вымываемых веществ;
Часть 18 — Исследование химических свойств материалов;
Часть 19 — Исследование физико-химических, морфологических и топографических свойств материалов;
Часть 20 — Принципы и методы исследования иммунотоксического действия медицинских изделий.
ISO 14971 указывает на то, что при анализе токсикологического риска следует принимать во внимание природу материала.
ISO 10993-1 формулирует рамки структурной программы оценки биологической безопасности. ISO 10993-1, раздел 3, устанавливает, что при выборе материалов, используемых при изготовлении медицинского оборудования, главным критерием должно быть его соответствие конкретному применению. Это относится к характеристикам и свойствам материала, включающим химические, токсикологические, физические, электрические, морфологические и механические свойства. Эту информацию необходимо получить до любых биологических испытаний. IS010993-1,7.2 отмечает, что важным аспектом качества программы является постоянное развитие методов биологической оценки.
Определение и оценка физико-химических, морфологических и топографических свойств материалов, используемых в конечном медицинском изделии, важны для оценки биологических свойств изделий и материалов, из которых они изготовлены. Такая информация может быть использована для:
- оценки биологических свойств медицинских изделий в целом (ISO 10993);
- поиска новых перспективных материалов и/или процессов, способствующих более эффективному использованию данного медицинского оборудования.
Состав материалов, используемых при изготовлении, находится под контролем изготовителя этих материалов. Другие же характеристики, в основном, определяются требованиями, предъявляемыми к конечному медицинскому изделию, а также процессами изготовления изделий, используемыми производителем.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТИЗДЕЛИЯ МЕДИЦИНСКИЕ ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙЧасть 19Исследования физико-химических, морфологических и топографических свойств материалов
Часть 19Исследования физико-химических, морфологических и топографических свойств материалов
Medical devices. Biological evaluation of medical devices. Part 19. Physico-chemical, morphological and topographical characterization of materials
Дата введения - 2013-01-01
1 Область применения
Настоящий стандарт содержит сводку параметров и методов тестирования, которые могут быть использованы для идентификации и определения физикохимических, морфологических и топографических (ФМТ) свойств материалов, используемых в медицинских изделиях. Такая оценка ограничена только теми параметрами, которые имеют отношение к биологическим свойствам и конкретной области применения медицинского изделия (клиническое применение, длительность использования), даже если эти параметры не согласуются с клинической эффективностью.
2 Нормативные ссылки
Для датированных ссылок необходимо использовать только то издание, которое указано в ссылке. Для недатированных ссылок следует применять последнее издание документа со всеми прилагаемыми поправками.
ISO 10993-1 Biological evaluation of medical devices — Part 1: Evaluation and testing (Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования)
Издание официальное
ISO 10993-18:2005 Biological evaluation of medical devices — Part 18: Chemical characterization of materials (Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов)
3 Термины и определения
В настоящем стандарте применены термины по ISO 10993-1, ISO 10993-18, а также следующие термины и определения с соответствующими определениями:
3.1 физико-химический: Имеющий отношение к физической химии
(материалов).
3.2 морфологический: Имеющий отношение к форме, контурам и
микроструктурной организации (материалов).
3.3 топографический: Имеющий отношение к особенностям поверхности (материалов).
4 Символы и сокращения
В настоящем стандарте применены следующие сокращения:
- НЧ - наночастицы;
- ФМТ - физико-химические, морфологические и топографические.
Сокращения, приведенные в таблице 1, применены в пункте 7.
2
ГОСТ ISO/TS 10993-19-2011
|
Таблица 1 - Методологические сокращения | ||||||||||||||||||||||||||||||||||||||||||||
|
5 Основные принципы
Рассмотрение ФМТ характеристик материалов, из которых изготовлено медицинское изделие, например его химических характеристик (описанных в ISO 10993-18), является необходимым этапом при оценке биологической безопасности и клинической эффективности изделия. Такое рассмотрение характеристик также имеет значение для выноса суждения об эквивалентности:
a) предложенного материала материалу, отвечающему клиническим требованиям или
b) прототипа конечному изделию.
Установление связи ФМТ характеристик материалов, используемых в изделиях, с их биосовместимостью и клинической эффективностью является все еще развивающейся областью исследований. Однако существует несколько примеров того, как эти связи себя проявляют. Ниже приведены такие примеры.
1 Использование пористых материалов с определенными ФМТ
характеристиками на поверхности ортопедических имплантатов может способствовать росту ткани на поверхности имплантата и, тем самым, приводить к лучшей интеграции его с окружающими тканями.
2 Использование матриксов и сеток с определенными ФМТ
характеристиками в качестве имплантатов в мягкие и твердые ткани может способствовать дополнительной инфильтрации клеток определенных типов, что способствует процессу выздоровления (Dexter et al. [50]).
3 ФМТ характеристики поверхности материалов, используемых в катетерах, имеют определяющее влияние на адгезию бактерий и протеинов на внутреннюю и внешнюю поверхности, что, в свою очередь, сказывается на риске занесения инфекции или закупорки катетера.
4 Изменение микротопографии поверхности, например нанесение микроцарапин или другой определенной картинки, оказывает влияние на адгезию и направление движения клеток определенных типов на поверхности (Alaerts et al. [46], Dewez et al. [49]).
5 Для определенных медицинских изделий, например ортопедических имплантатов или сосудистых протезов, механические свойства могут вызывать биологическую реакцию, например перестройку ткани.
Примечание - Форма и геометрические размеры медицинских изделий и их частей
могут оказывать влияние на биологические свойства изделий. Это касается, например,
отношения поверхности к объему, толщины и формы по отношению к потоку крови.
Информация по конкретным изделиям может быть найдена в соответствующих стандартах на
данное изделие.
4
ГОСТ ISO/TS 10993-19-2011
Настоящий стандарт содержит ряд примеров с описанием ФМТ параметров и методов, которые могут быть использованы для получения ФМТ характеристик материалов, используемых для медицинских изделий.
Изготовители медицинских изделий должны выбрать соответствующие параметры и методы, а также обосновать сделанный выбор.
Степень оценки свойств материалов должна отражать природу и длительность клинического применения, а также может представлять интерес для оценки биологической безопасности изделия. ФМТ характеристики должны также отражать тип материала и его физическое состояние, например, твердое тело, жидкость, гель, полимер, металл, керамика, композит или материал биологического происхождения. Оценка свойств материалов, как правило, требует тесной кооперации материаловедов, аналитиков и экспертов по оценке риска.
6 Процедура определения свойств материалов6.1 Общие положения
Выбор аналитических методов диктуется тем, какая информация должна быть получена для оценки. Перед тем, как разрабатывать новые методы, необходимо изучить существующие стандарты, монографии, научные статьи и другие научные источники по соответствующей тематике на предмет уже существующих методов тестирования. Методы, найденные в литературе, должны быть соответствующим образом адаптированы и подтверждены перед использованием. Если существующие методы не подходят, то тогда необходимо провести разработку новых методов.
Аналитические методы должны быть проверены, подтверждены и описаны в разделах 7 и 8. Подтверждение аналитического метода - это процесс, в котором устанавливается пригодность характеристик, полученных данным методом, требованиям соответствующего аналитического применения. Аналитические методы должны быть подтверждены соответствующими утвержденными характеристиками: точность, ошибка измерения, специфичность, предел детектирования, предел количественной оценки, линейность, диапазон, прочность, сопротивляемость и системная пригодность.
Адекватность полученных данных на каждом этапе процедуры оценки свойств материалов должна быть подтверждена на основе анализа рисков. Данная процедура должна касаться каждого материала по мере его появления в конструкции конечного изделия.
5
Примечание - Поставщик может рекомендовать использование соответствующих аналитических методов. В отсутствие каких-либо начальных данных по свойствам материалов выбор соответствующих аналитических методов может быть сделан на основе анализа литературы.
6.2 Качественная оценка
Описывают материал/изделие и цель его использования. Рекомендуется документированное качественное описание ФМТ характеристик конечного изделия, включая характеристики каждого материала, используемого в изделии (см. 3.2 и раздел 4 ISO 10993-1) (см. приложение А). Уровень качественных данных должен отражать категорию медицинского изделия в терминах инвазивности и длительности клинического использования, а также природы данного материала.
Качественное описание, по мере возможности, должно включать детали партии или лота, поставщика и спецификацию для каждого материала.
Изготовители медицинского изделия должны иметь качественную и количественную информацию о характеристиках конечного продукта. Такая информация может быть получена от поставщика исходного материала, из литературы или путем дополнительного тестирования. ФМТ характеристики данного материала должны либо, находится в соответствии со стандартами, принятыми для данных материалов, либо быть предоставлены изготовителем. На этой начальной стадии необходимо получить как можно больше информации, чтобы обеспечить понимание возможных опасностей (потенциальных рисков) и возможных преимуществ от использования данного материала и оценить его пригодность для данного применения. Данная оценка будет в дальнейшем улучшена по мере получения дополнительной информации в процессе разработки продукта.
6.3 Эквивалентность материала
Частью оценки пригодности материала является сопоставление этих данных с целью определения эквивалентности данного материала материалу, используемому в изделии с той же длительностью клинического использования, полученного в результате того же процесса изготовления и подвергнутого той же процедуре стерилизации, например, для установления безопасного и эффективного использования материалов в продукте, предназначенном для контакта с кожей. В приложении А содержится дальнейшее руководство, согласно которому можно судить об эквивалентности материала, а в приложении В содержится информация, касающаяся специального случая материала, используемого в виде наночастиц (размер < 100 нм хотя бы в одном измерении).