МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ВАКЦИНА ПРОТИВ БОТУЛИЗМА НОРОК
ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ И МЕТОДЫ КОНТРОЛЯ
|
Москва
Стандартинформ
2007 |
УДК 616.981.553-085.371:619:006.354
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ВАКЦИНА ПРОТИВ БОТУЛИЗМА НОРОКТехнические требования и методы контроля
Vaccine for mink botulism.
Technical requirements and methods of control
ГОСТ28087-89
Настоящий стандарт распространяется на вакцину против ботулизма норок, изготовленную из культуры штамма Cl. botulinum типа С-альфа, инактивированную формалином и осажденную алюмокалиевыми квасцами и предназначенную для профилактической иммунизации норок.
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
По физико-химическим и иммунобиологическим свойствам вакцина должна соответствовать требованиям и нормам, указанным в табл. 1.
|
Таблица 1 |
|
Наименование показателя |
Характеристика и норма |
|
1. Внешний вид |
Суспензия серовато-белого цвета, после отстаивания на дне флакона выпадает рыхлый осадок светло-серого цвета, легко разбивающийся при встряхивании в гомогенную взвесь. Не допускается наличие примесей, плесени, неразбившихся хлопьев, трещин флаконов |
|
2. Концентрация водородных ионов (pH) |
7,0-7,2 |
|
3. Типичность микрофлоры |
В мазках, окрашенных по Граму, крупные (4,6 х 0,8—1,2 мкм) грампо-ложительные палочки с закругленными концами, овальные споры или палочки со спорой, имеющие характерную форму теннисной ракетки |
|
4. Стерильность |
В посевах из вакцины на питательных средах не должно быть роста бактериальной и грибковой микрофлоры |
|
5. Безвредность |
Подкожное введение вакцины белым мышам в дозе 1 см3 и морским свинкам в дозе 2 см3 не должно вызывать их заболевания и гибели в течение 10 сут наблюдения |
|
6. Иммуногенная активность |
Доза вакцины в количестве 0,071—0,21 см3 предохраняет от гибели 50 % белых мышей при введении им через 21 сут 10 ДЛМ ботулического токсина типа С, при гибели 60 %—100 % не вакцинированных (контрольных) животных, которым вводят токсин в дозе 1,0 ДЛМ |
|
Издание официальное |
Перепечатка воспрещена |
|
© Издательство стандартов, 1989 © Стандартинформ, 2007
2. МЕТОДЫ ИСПЫТАНИЙ2.1. Отбор проб
2.1.1. Для проверки качества вакцины против ботулизма норок из разных мест каждой серии отбирают 20 флаконов, из которых 10 используют для проведения испытания, а 10 — хранят в архиве государственного контролера в пределах срока годности препарата.
2.1.2. Пробы, направляемые в архив, опечатывают и снабжают документом установленной формы с указанием:
наименования биопрепарата; даты изготовления; номера серии; номера контроля; даты отбора проб; объема серии; срока годности;
обозначения настоящего стандарта; должности и подписи лица, отобравшего пробу.
2.2. Определение внешнего вида
Внешний вид определяют визуально. Каждый флакон с вакциной встряхивают, просматривают в проходящем свете и одновременно проверяют герметичность укупорки, наличие трещин и правильность этикетирования.
2.3. Определение концентрации водородных ионов (pH)
Для проведения испытания используют два флакона с вакциной.
Концентрацию водородных ионов вакцины определяют электрометрическим методом, применяя потенциометры. Порядок определения — в соответствии с правилами, приложенными к прибору.
2.4. Определение типичности микрофлоры
Сущность метода заключается в определении типичности микрофлоры при микроскопическом исследовании окрашенных мазков из вакцины.
2.4.1. Аппаратура и материалы
Микроскоп биологический с иммерсионной системой по НТД.
Стекла предметные по ГОСТ 9284.
Масло иммерсионное по ГОСТ 13739.
Набор бактериологических красок.
2.4.2. Проведение испытания
Мазки готовят на предметных стеклах из 3 флаконов с вакциной. Мазки окрашивают по Граму и просматривают под иммерсионной системой микроскопа.
2.4.3. Обработка результатов
Наличие грамположительных палочек с закругленными концами, овальных спор или палочек со спорой в форме теннисной ракетки свидетельствует о типичности данной микрофлоры.
2.5. Определение стерильности
Сущность метода заключается в определении отсутствия роста бактериальной и грибковой микрофлоры в посевах из вакцины на питательные среды.
2.5.1. Аппаратура, материалы и реактивы — по ГОСТ 28085.
2.5.2. Проведение испытания
Для определения стерильности используют 10 флаконов с вакциной. Перед проведением испытания флаконы с вакциной встряхивают до получения гомогенной взвеси.
Испытание проводят путем посева из каждого флакона по 1,0 см3 вакцины в 3 пробирки с МПБ, МПА, МППБ под вазелиновым маслом, агаром Сабуро или Чапека и по 2,0 см3 в два флакона с МПБ и МППБ под вазелиновым маслом.
Через 20 сут инкубирования из посевов во флаконах проводят пересев на все вышеуказанные среды.
2.5.3. Обработка результатов
Отсутствие роста бактериальной и грибковой микрофлоры в посевах вакцины на питательных средах после их выдерживания в термостате в течение 35 сут и в пересевах в течение 15 сут при температуре (37 + 0,5) °С, для среды Сабуро или Чапека при (22 + 1) °С, свидетельствует о стерильности вакцины.
ГОСТ 28087-89 С. 32.6. Определение безвредности
Сущность метода заключается в определении реакции у лабораторных животных на введение вакцины в тест-дозе.
2.6.1. Аппаратура и материалы
Шприцы вместимостью 2 и 5 см3 по ГОСТ 22967.
Иглы инъекционные по ГОСТ 25377*.
Флаконы стеклянные вместимостью 200 см3.
Пипетки стеклянные мерные вместимостью 1, 5 и 10 см3.
2.6.2. Подготовка к испытанию
Для проведения испытания используют 10 флаконов с вакциной. Из каждого флакона после тщательного встряхивания отбирают по 5—10 см3 вакцины в стерильной флакон, объединяя пробы.
2.6.3. Проведение испытания
Для определения безвредности вакцины используют белых мышей живой массой 18—20 г и морских свинок живой массой 350—400 г. Десяти белым мышам вакцину вводят подкожно в области спины по 1 см3 и пяти морским свинкам подкожно в области живота по 2 см3.
2.6.4. Обработка результатов
Вакцину считают безвредной, если в течение 10 сут после ее введения не наступает гибель или заболевание животных. Допускается на месте введения вакцины образование припухлости.
2.7. Определение иммуногенной активности
Сущность метода заключается в определении специфической активности вакцины в сравнении с референс-препаратом.
2.7.1. Аппаратура и реактивы
Шприцы вместимостью 1 см3 по ГОСТ 22967.
Иглы инъекционные по ГОСТ 25377.
Флаконы стеклянные вместимостью 100 см3.
Пипетки стеклянные мерные вместимостью 5 и 10 см3.
Референс-препарат сухой.
Токсин ботулический типа С.
2.7.2. Подготовка к испытанию
Для определения иммуногенной активности вакцины используют 10 флаконов с вакциной. Объединенную пробу вакцины для испытания готовят по и. 2.6.2.
2.7.3. Проведение испытания
Иммуногенную активность вакцины определяют на белых мышах живой массой 18—20 г в параллельном опыте в сравнении с референс-препаратом.
Референс-препарат представляет собой сухую вакцину против ботулизма норок, фасованную в ампулы по 2 см3, с определенной иммуногенностью.
Вакцину и референс-препарат вводят однократно подкожно двум группам белых мышей по 40 голов в каждой группе. Одну группу белых мышей вакцинируют испытуемой вакциной, а вторую группу референс-препаратом. Мышей обеих групп иммунизируют дозами 0,05; 0,1; 0,2 и 0,4 см3, используя по 10 белых мышей на каждую дозу испытуемой вакцины и референс-препарата.
Через 21 сут после вакцинации животным обеих групп вводят подкожно ботулический токсин типа С в дозе 10 ДЛМ. Одновременно токсин вводят 5 контрольным белым мышам такой же живой массой в дозе по 1 ДЛМ, которым не вводилась испытуемая вакцина и референс-препарат. Результаты учитывают в течение 120 ч с момента введения токсина.
2.7.4. Обработка результатов
Подсчитывают по каждой дозе в группе животных, вакцинируемых испытуемой серией вакцины, и группе животных, привитых референс-препаратом, отношение количества выживших животных к их числу, взятому для опыта.
Значения отношений суммируют по каждой группе отдельно.
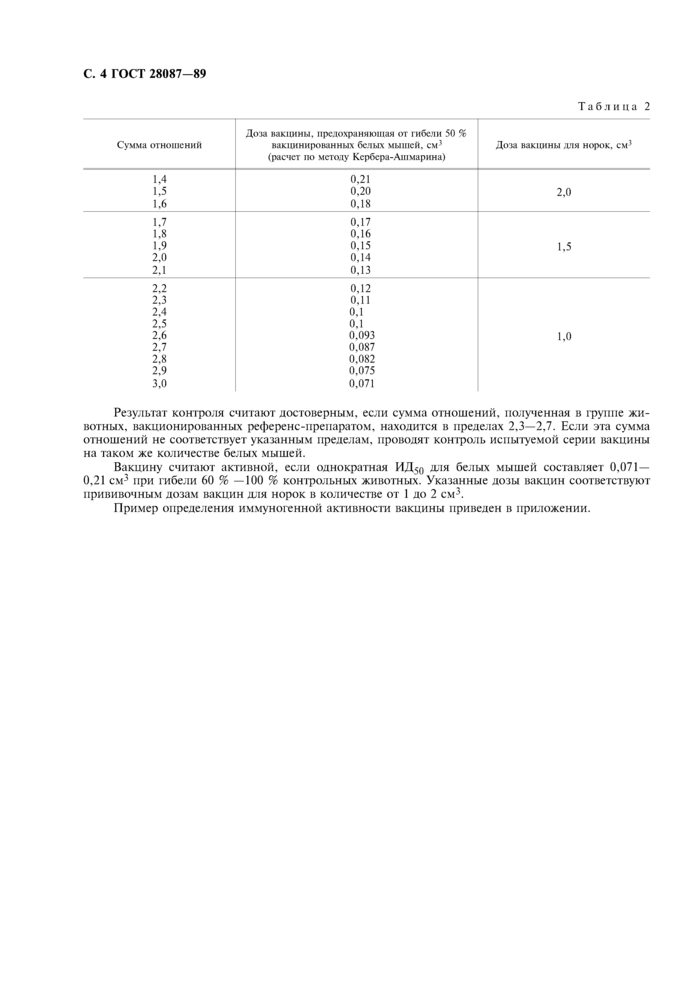
По сумме отношений по табл. 2 находят дозу испытуемой серии вакцины и дозу референс-препарата, предохраняющих от гибели 50 % вакционированных белых мышей, а также прививочную дозу для норок.
ГОСТ 25377-82 действует только на территории Российской Федерации (здесь и далее).
|
Таблица 2 |
|
|
Доза вакцины, предохраняющая от гибели 50 % |
|
|
Сумма отношений |
вакцинированных белых мышей, см3 (расчет по методу Кербера-Ашмарина) |
Доза вакцины для норок, см3 |
|
1,4 |
0,21 |
|
|
1,5 |
0,20 |
2,0 |
|
1,6 |
0,18 |
|
1,7 |
0,17 |
|
|
1,8 |
0,16 |
|
|
1,9 |
0,15 |
1,5 |
|
2,0 |
0,14 |
|
2,1 |
0,13 |
|
|
2,2 |
0,12 |
|
|
2,3 |
0,11 |
|
|
2,4 |
ОД |
|
|
2,5 |
ОД |
|
|
2,6 |
0,093 |
1,0 |
|
2,7 |
0,087 |
|
2,8 |
0,082 |
|
|
2,9 |
0,075 |
|
|
3,0 |
0,071 |
|
|
Результат контроля считают достоверным, если сумма отношений, полученная в группе животных, вакционированных референс-препаратом, находится в пределах 2,3—2,7. Если эта сумма отношений не соответствует указанным пределам, проводят контроль испытуемой серии вакцины на таком же количестве белых мышей.
Вакцину считают активной, если однократная ИД50 для белых мышей составляет 0,071— 0,21 см3 при гибели 60 % —100 % контрольных животных. Указанные дозы вакцин соответствуют прививочным дозам вакцин для норок в количестве от 1 до 2 см3.
Пример определения иммуногенной активности вакцины приведен в приложении.
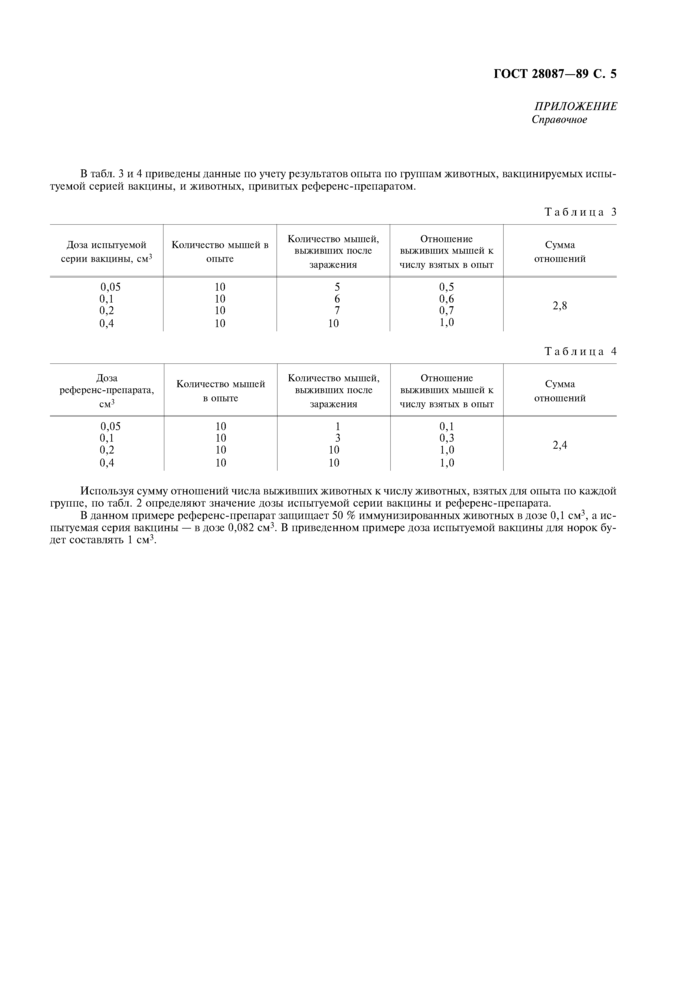
ГОСТ 28087-89 С. 5
ПРИЛОЖЕНИЕ
Справочное
В табл. 3 и 4 приведены данные по учету результатов опыта по группам животных, вакцинируемых испытуемой серией вакцины, и животных, привитых референс-препаратом.
|
Таблица 3 |
|
Доза испытуемой серии вакцины, см3 |
Количество мышей в опыте |
Количество мышей, выживших после заражения |
Отношение выживших мышей к числу взятых в опыт |
Сумма
отношений |
|
0,05 |
10 |
5 |
0,5 |
|
|
0,1 |
10 |
6 |
0,6 |
2,8 |
|
0,2 |
10 |
7 |
0,7 |
|
0,4 |
10 |
10 |
1,0 |
|
|
|
Таблица 4 |
|
Доза
референс-препарата,
см3 |
Количество мышей в опыте |
Количество мышей, выживших после заражения |
Отношение выживших мышей к числу взятых в опыт |
Сумма
отношений |
|
0,05 |
10 |
1 |
0,1 |
|
|
0,1 |
10 |
3 |
0,3 |
2,4 |
|
0,2 |
10 |
10 |
1,0 |
|
0,4 |
10 |
10 |
1,0 |
|
|
Используя сумму отношений числа выживших животных к числу животных, взятых для опыта по каждой группе, по табл. 2 определяют значение дозы испытуемой серии вакцины и референс-препарата.
В данном примере референс-препарат защищает 50 % иммунизированных животных в дозе 0,1 см3, а испытуемая серия вакцины — в дозе 0,082 см3. В приведенном примере доза испытуемой вакцины для норок будет составлять 1 см3.
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Госагропромом СССР
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 31.03.89 № 916
3. Стандарт полностью соответствует СТ СЭВ 6282—88
4. ВВЕДЕН ВПЕРВЫЕ
5. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
6. Ограничение срока действия снято по протоколу № 4—93 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 4—94)
7. ПЕРЕИЗДАНИЕ. Май 2007 г.
Редактор М.И. Максимова Технический редактор Н. С. Гришанова Корректор ЕМ. Капустина Компьютерная верстка И.А. Налейкиной
Сдано в набор 05.06.2007. Подписано в печать 25.06.2007. Формат 60 х 84 Vs- Бумага офсетная. Гарнитура Таймс. Печать офсетная. Уел. печ. л. 0,93. Уч.-изд. л. 0,60. Тираж 41 экз. Зак. 508.
ФГУП «СТАНДАРТИНФОРМ», 123995 Москва, Гранатный пер., 4. www.gostinfo.ru info@gostinfo.ru Набрано во ФГУП «СТАНДАРТИНФОРМ» на ПЭВМ Отпечатано в филиале ФГУП «СТАНДАРТИНФОРМ» — тип. «Московский печатник», 105062 Москва, Лялин пер., 6