Государственное санитарно-эпидемиологическое нормирование _Российской Федерации_
4.2. МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Организация и проведение вирусологических исследований материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича (ОВП)
Методические указания МУК 4.2.2410—08
Издание официальное
Москва • 2009
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Организация и проведение вирусологических исследований материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича (ОВП)
Методические указания МУК 4.2.2410—08
Органы и учреждения Роспотребнадзора обеспечивают выполнение всех необходимых требований по доставке проб в установленном порядке.
5. Порядок проведения вирусологических исследований
5.1. Получение и подготовка проб для исследования
5.1.1. Получение и регистрация проб
Немедленно после доставки материалов в лабораторию упаковочную коробку/термоконтейнер/термос распаковывают в отведанной для этого зоне, соблюдая при этом требования нормативных и методических документов.
В зоне, где происходит распаковка, должны иметься ёмкость для мусора, тампоны, смоченные 70 %-м раствором этилового спирта, биологическое защитное укрытие (далее - БЗУ) 2-го класса безопасности (или рабочий стол с покрытием, которое легко подвергается обработке лабораторными дезинфектантами). Распаковка и регистрация материалов осуществляется двумя сотрудниками - один регистрирует поступившие материалы в рабочем журнале, другой открывает упаковку, проверяет целость ёмкостей с материалом, отсутствие протечек, полноту сопроводительных документов. В этот момент фиксируется состояние присланных проб («хорошее» или «плохое»).
Проверяют соответствие сведений на этикетке присланной пробы и в направлении на исследование. В случае несовпадения или неполноты сведений, делают запрос в организацию, направившую материал для исследования. Каждой пробе присваивают идентификационный номер, под которым она регистрируется в лабораторном журнале. Этим номером помечают направление на исследование, а также все ёмкости (центрифужные пробирки, флаконы/пробирки с культурой клеток и пр.), относящиеся к данной пробе в процессе её исследования и хранения в данной лаборатории. Если исследование будет начато в течение 48 ч. пробы для выделения вируса помещают в холодильник (от 2 до 8 °С), если исследование будет начато позже, пробы хранят при температуре -20 °С.
Все процедуры во время получения, распаковки и регистрации материалов осуществляют в защитной одежде и резиновых перчатках. Все работы по подготовке проб фекалий, фекальных суспензий, секционных материалов для исследования проводятся в БЗУ 2-го класса безопасности.
МУК 4.2.2410—08
Лаборатория может получать много проб из разных источников в течение рабочего дня, поэтому следует проявлять особую тщательность и осторожность при обращении с пробами не только для защиты персонала, но и для избежания перекрёстной контаминации между пробами.
5.1.2. Подготовка фекальных проб для исследования в культуре клеток
До приготовления фекальной суспензии присланную в лабораторию «исходную» пробу делят пополам, одну часть используют для приготовления суспензии, другую хранят при -20 °С (для отправки в НЦ, для повторного исследования пробы в случае необходимости).
Для исследования в культуре клеток фекальные пробы обрабатывают хлороформом для удаления бактерий, грибков, цитотоксических липидов, для разъединения вирусных аггрегатов.
Для приготовления 20 % фекальной суспензии устойчивые к хлороформу полиэтиленовые центрифужные пробирки ёмкостью 50 мл маркируют в соответствии с номером пробы. В каждую пробирку вносят 10 мл фосфатно-солевого буферного раствора (ФСБ) с антибиотиками (прилож. 3), 1 г стеклянных бусин и 1 мл хлороформа. В пробирку вносят 2 г фекальной пробы. Плотно закрывают центрифужную пробирку и тщательно встряхивают в течение 20 мин в механическом шейкере или вручную. Центрифугируют 20 мин при 1 500 g в центрифуге с охлаждением. Надосадочную жидкость каждой пробы переносят в два маркированных флакона с винтовой крышкой. Если жидкость непрозрачна, обработку хлороформом повторяют. Суспешию из одного флакона используют для исследования, второй флакон хранят при -20 °С для отправки в НЦ, если это будет необходимо.
Пробы, отобранные с помощью ректальных «соломинок», готовят для исследования так же, как и фекальные пробы.
5.1.3. Приготовление проб, отобранных с помощью ректального
тампона
Ёмкость, содержащую ректальный тампон в транспортировочной среде, тщательно встряхивают в механическом шейкере или вручную для того, чтобы фекальный материал перешёл в жидкость. Стерильным пинцетом плотно прижимают тампон к стенке ёмкости, отжимают жидкость, которую переносят в центрифужную пробирку и центрифугируют 20 мин при 1 500 g в центрифуге с охлаждением. Надосадочную жид-
кость осторожно переносят в два маркированных флакона и хранят при -20 °С.
5.1.4. Приготовление секционных проб
Из тканей ЦНС (головной мозг, продолговатый мозг, спинной мозг), помещённых в транспортировочную среду, готовят 10 % суспензию в ФСБ с антибиотиками. Гомогенизируют в измельчителе, переносят жидкость в центрифужную пробирку и центрифугируют 20 мин при 1 500 g в центрифуге с охлаждением. Надосадочную жидкость осторожно переносят в два маркированных флакона и хранят при -20 °С.
Участок толстой кишки вместе с содержимым используют для приготовления 20 % суспензии и обрабатывают так же, как пробы фекалий.
5.2. Выделение и идентификация вирусов 5.2.1. Клеточные линии, рекомендуемые для выделения полиовирусов. Основные принципы работы
Для выделения полиовирусов из проб используют перевиваемые линии культур клеток RD и L20B.
Клетки рабдомиосаркомы человека - RD, чувствительны к полиовирусам, вирусам группы ECHO, некоторым вирусам группы Кохсаки А (за исключением А1, А19, А22), энтеровирусам 68—71. Иногда вирусы группы Коксаки В проявляют цитопатический эффект (далее - ЦПЭ) на клетках RD. L20B - линия мышиных клеток (L-клеток), способная экспрессировать рецептор полиовируса. Клетки L20B избирательно чувствительны к полиовирусам, которые вызывают в них характерный ЦПЭ. Ряд вирусов - аденовирусы, реовирусы, некоторые НПЭВ (Коксаки А 2—6, 8, 10, 14) могут вызывать ЦПЭ в этих клетках, однако он значительно отличается от вызываемого полиовирусом. Использование комбинации этих двух клеточных линий обеспечивает высокую чувствительность и специфичность выявления полиовируса. Использование культуры клеток НЕр-2 (Cincinnati), чувствительной к полиовирусам и вирусам группы Коксаки В, не является обязательным. Однако исключение их из работы может привести к потере НПЭВ, в частности Коксаки В.
Культуры клеток должны быть получены по запросу из официальных источников (для НЦ - из лабораторий глобальной лабораторной сети по полиомиелиту ВОЗ, для РЦ - из НЦ). После получения клеток лаборатория создаёт банк клеток. Запас каждой линии культуры клеток должен составлять не менее 12 ампул, которые используются по мере необходимости для создания «рабочей» линии клеток. Для сохранения
МУК 4.2.2410—08
чистоты, аутентичности и стабильности клеточных культур следует заменять «рабочую» линию после 3-х мес. или 15 пассажей культивирования в лаборатории. Все манипуляции с культурами клеток фиксируют в рабочем журнале, обозначая тип клеток, номер пассажа, дату посева и все смены среды.
Все работы с неинфицированными культурами клеток проводятся в отдельном боксированном помещении, расположенном в «неинфекционной зоне» лаборатории, в БЗУ 2-го класса безопасности. Для избежания перекрёстной контаминации между различными типами клеточных культур никогда не работают одновременно с несколькими культурами клеток. Все неинокулированныс культуры клеток следует считать потенциально опасными, поэтому после окончания работы все культуральные жидкости и культуры обеззараживают автоклавированием.
При работе с культурами клеток, создании клеточных банков следует руководствоваться приёмами в соответствии с «Руководством по лабораторным исследованиям полиомиелита» (4-е изд., ВОЗ, 2005).
Для контроля чувствительности клеток к полиовирусам проводят ежеквартальное титрование вакцинных штаммов Сэбина вируса полиомиелита типов 1, 2 и 3 (референс-штаммы) на каждой из культур клеток после 8—10 пассажей (прилож. 5, рис. 1). Если титр референс-штаммов не отличается от установленного ранее или отличается в пределах ± 0,5 lg, можно считать, что чувствительность клеток не понизилась. Превышение ожидаемого значения на 0,5 lg или более может быть связано с погрешностями в приготовлении разведений вируса. Снижение титра по сравнению с ожидаемым на 0,5 lg или более может указывать на снижение чувствительности клеток. В этом случае выполняют титрование новой порции референс-штамма. Одновременно проверяют возможные изменения в условиях культивирования клеток. Если низкий титр воспроизводится при титровании новой порции, а изменений в условиях культивирования клеток не выявлено, используемые клетки необходимо заменить на клетки из клеточного банка лаборатории (или получить по запросу в НЦ или РЦ).
5.2.2. Выделение полиовирусов, других (неполно) эытеровирусов
Микроскопируют культуры с недавно сформированным монослоем клеток RD и L20B, выращенные на поверхности пластиковых флаконов площадью 25 см2 или пробирок (нормальный монослой формируется в течение 2—3 дней после посева клеток). Ростовую среду, содержащую
13
сыворотку, заменяют поддерживающей средой (8,0—10,0 мл на флакон, 1,0—1,5 мл на пробирку). Флаконы/пробирки маркируют, указывая номер пробы, дату инокуляции, номер пассажа. Для исследований одной пробы используют по 1 флакону каждой культуры или по 2 пробирки на один пассаж. По 1 флакону/пробирке с каждым типом клеток оставляют незаряженными в качестве отрицательного контроля.
Флаконы/пробирки с клетками обеих линий инокулируют одновременно, внося заражающий материал из расчёта 0,4—0,6 мл во флакон или 0,2 мл в пробирку. Культуры инкубируют при 36 °С, ежедневно микроскопируют, наблюдая за появлением ЦПЭ.
Результаты наблюдений за инокулированными и контрольными культурами регистрируют в рабочем журнале: развитие ЦПЭ, охватывающего 25 % монослоя, обозначают как 1+, 25—50 % - 2+, 50—75 % -3+, 75—100 % - 4+. Быстрая дегенерация клеток в течение одного-двух дней после инокуляции может быть вызвана неспецифической токсичностью пробы. Культуры, проявившие признаки неспецифической дегенерации, замораживают при -20 °С, оттаивают и пассируют на клетках того же типа. Если признаки токсичности проявляются снова, возвращаются к исходному экстракту пробы, разводят его 1 : 10 в ФСБ и повторяют процесс инокуляции как описано выше. В случае бактериальной контаминации среды, возвращаются к исходному экстракту пробы, вновь обрабатывают его хлороформом, повторяют процедуры инокуляции.
После появления характерного для энгеровирусов ЦПЭ, оцененного как 4+, прекращают инкубацию, культуру замораживают при -20 °С для последующего пассажа. При появлении ЦПЭ 4+ материал второго пассажа используют для идентификации вируса и проведения ВТД.
Если в первом пассаже ЦПЭ в течение 7 дней не проявился, проводят «слепой» пассаж и наблюдают культуры в течение 7 дней. Общий срок наблюдения за культурами с отрицательным результатом должен составлять не менее 14 дней, после чего их уничтожают, а результат исследования образца расценивается как «отрицательный».
При наличии ЦПЭ на клетках RD, но отсутствии на клетках L20B после 14 дней наблюдения, проводят пассирование культурального материала, полученного на уровне 2-го пассажа на клетках RD, культуре L20B.
Некоторые пробы фекалий содержат вирусы, вызывающие ЦПЭ в клетках L20B, но не относящиеся к энтеровирусам (например, отдельные рео- и аденовирусы). Во многих случаях вызываемый ими ЦПЭ чёт-
14
МУК 4.2.2410—08
ко отличается от ЦПЭ, свойственного энтеровирусам. Присутствие такого агента в пробе регистрируется. Следует предпринять попытку идентифицировать агент, чтобы исключить присутствие полиовируса. При получении неопределённых или трудно интерпретируемых результатов выделенный агент следует отправить в НЦ.
5.2.3. Идентификация выделенных полиовирусов
Идентификацию выделенных штаммов полиовирусов проводят в реакции нейтрализации инфекционности на культуре клеток микрометодом. В основе реакции нейтрализации лежит взаимодействие исследуемого вируса с гомологичной антисывороткой (или смесью антисывороток), которая нейтрализует вирус, что проявляется в виде отсутствия ЦПЭ на культуре клеток. В опыте по нейтрализации вирусную суспензию, содержащую 100 ТЦД50, смешивают в равном объёме с диагностическими сыворотками в лунках планшета для микронейтрализации, инкубируют 1 ч при 36 °С, добавляют суспензию клеток, помещают в термостат, проводят ежедневное микроскопирование до получения окончательного результата идентификации (как правило, в течение 5 сут.).
Для идентификации используют сыворотки к полиовирусам типа 1,2 и 3, которые распространяются ВОЗ для лабораторий, включённых в глобальную лабораторную сеть по диагностике полиомиелита. Могут быть использованы сыворотки к полиовирусам типа 1, 2 и 3, зарегистрированные и разрешённые в Российской Федерации к применению в установленном порядке. Подготовку рабочих разведений сыворо-ток/смесей сывороток проводят в соответствии с инструкциями производителя.
Проведение теста микронейтрализации, интерпретацию результатов выполняют в соответствии с «Руководством по лабораторным исследованиям полиомиелита» (4-е изд., ВОЗ, 2005).
Типирование выделенного вируса проводят на той культуре, на которой он выделен. Если вирус выделен и на клетках RD, и на клетках L20B, проводят идентификацию на обеих культурах, при этом в первую очередь исследуют штамм, выделенный на L20B, для быстрого получения наиболее важного результата.
Выделенные штаммы полиовирусов (и исходные образцы фекалий, из которых они были выделены) в течение 7 дней после идентификации направляют в НЦ для проведения ВТД. Если при проведении идентификации на разных культурах клеток были получены одинаковые результаты, то в НЦ отправляют изолят, выделенный на какой-то одной куль-
15
ББК51.9
064
064 Организация и проведение вирусологических исследований материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича (ОВП): Методические указания.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009.—36 с.
ISBN 978—5—7508—0866—3
1. Разработаны ГУ Инстшут полиомиелита и вирусных энцефалитов им. М. П. Чумакова РАМН (О. Е Иванова, Т. П. Еремеева, С. Г. Дроздов,
М. И. Михайлов, О. Ю. Байкова, О. В. Юрашко), Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Г. Ф. Лазикова, Е Б. Ежлова); ФГУЗ «Федеральный центр гигиены и эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (J. В. Воронцова, А. А. Ясинский, О. П. Чернявская) с учетом замечаний и предложений ФГУЗ «Центр гигиены и эпидемиологии» в г. Москве, Ставропольском, Хабаровском краях. Омской, Свердловской областях; Санкт-Петербургского НИИЭМ им. Пастера Роспотребнадзора.
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 3 июля 2008 г. № 2).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защипы прав потребителей и благополучия человека, Главным госуддрствекным санитарным врачом Российской Федерации Г. Г. Онищенко 28 июля 2008 г.
4. Введены в действие с 1 сентября 2008 г.
5. Введены впервые.
ББК 51.9
Редакторы Л. С. Кучурова, Е. В. Николаева
Технический редактор Г. И. Климова
Подписано в печать 01.12.09 Формат 60x88/16 Печ. л. 2,25
Тираж 500 экз. Заказ 89
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека 127994, Москва, Вадковский пер., д. 18, стр. 5,7
Оригинал-макет подготовлен к печати и тиражирован отделом издательского обеспечения
Фед ерального центра гигиены и эпидемиологии Роспотребнадзора 117105, Москва, Варшавское ш., 19а Отделение реализации, телУфакс 952-50-89
© Роспотребнадзор, 2009 © Федеральный центр гигиены и
эпидемиологии Роспотребнадзора, 2009
МУК 4.2.2410—08
Содержание
1. Область применения.............-.......................................................................................4
2. Общие положения..........................................................................................................5
3. Организация вирусологических исследований материалов от больных
полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича на полиовирусы, другие (неполно) энтеровирусы.....................................5
4. Правила сбора, маркировки, хранения и транспортирования материалов для
исследования..................................................................................................................7
4.1. Клинические материалы............................................................... 7
4.2. Изоляты полиовирусов, других (неполно) энтеровирусов..................................8
4.3. Маркировка материалов........................................................................... 9
4.4. Упаковка и транспортирование материалов для исследования..........................9
5. Порядок проведения вирусологических исследований.................................... 10
5.1. Получение и подготовка проб для исследования..............................................10
5.1.1. Получение и регистрация проб................................................................10
5.1.2. Подготовка фекальных проб для исследования в культуре клеток.....11
5.1.3. Приготовление проб, отобранных с помощью ректального тампона.........11
5.1.4. Приготовление секционных проб............................................................12
5.2. Выделение и идентификация вирусов................................................................12
5.2.1. Клеточные линии, рекомендуемые для выделения полиовирусов.
Основные принципы работы....................................................................12
5.2.2. Выделение полиовирусов, других (неполно) энтеровирусов................13
5.2.3. Идентификация выделенных полиовирусов...........................................15
5.2.4. Идентификация выделенных других (неполно) энтеровирусов............16
5.3. Внутритиповая дифференциация полиовирусов...............................................16
5.4. Сроки хранения материалов от больных полиомиелитом, с
подозрением на это заболевание, с синдромом ОВП, а также от лиц, общавшихся с ними.........................................................17
5.5. Выявление и титрование нейтрализующих антител к полиовирусу.................17
6. Обеспечение биологической безопасности при проведении вирусологических
исследований материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича........................-............... 18
Приложение 1. Нормативные ссылки..........................................................................- 21
Приложение 2. Определение приоритетного («горячего») случая острого вялого
паралича.......................................................................................................................24
Приложение 3. Приготовление сред и растворов......................................... 25
Приложение 4. Направление на лабораторное исследование......................................26
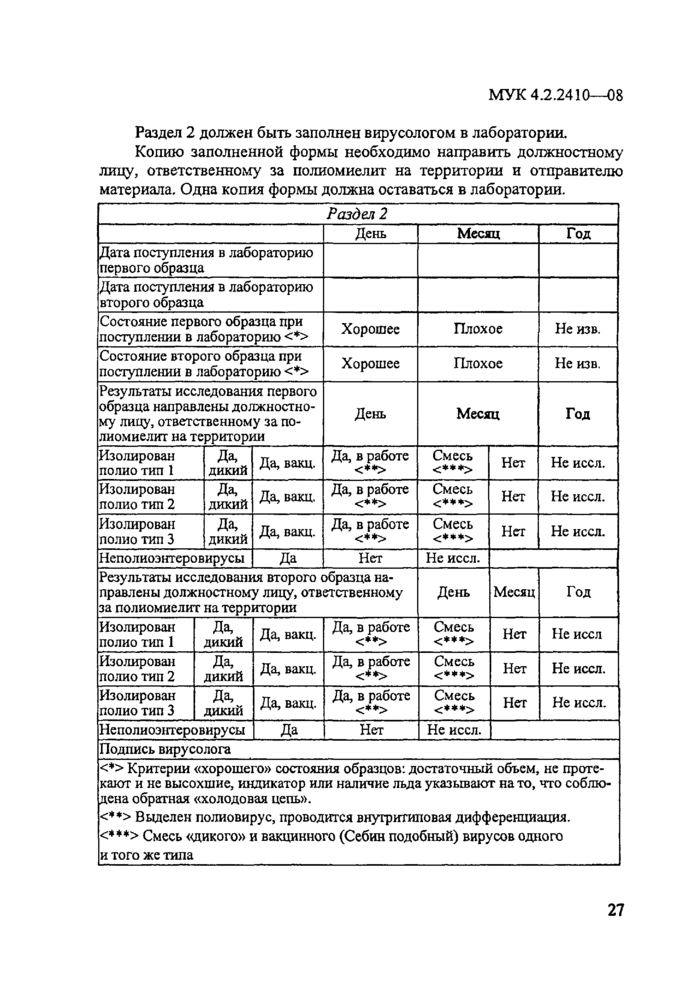
Приложение 5. Приготовление и титрование референоштаммов (вакцинных
штаммов Сэбина) вируса полиомиелита типов 1,2 и 3..............................................28
Приложение 6. Проведение реакции нейтрализации для определения титра
нейтрализующих антител к полиовирусу..................................................................31
Приложение 7. Список лабораторий Российской Федерации, осуществляющих вирусологические исследования материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича...................35
3
МУК 4.2.2410—08
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
28 июля 2008 г.
Дата введения: 1 сентября 2008 г.
4.2. МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Организация и проведение вирусологических исследований материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича (ОВП)
Методические указания МУК 4.2.2410—08
1. Область применения
1.1. Настоящие методические указания предназначены для специалистов органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (далее - Роспотребнадзор), осуществляющих государственный санитарно-эпидемиологический надзор за полиомиелитом, острыми вялыми параличами в рамках Национального плана действий по поддержанию свободного от полиомиелита статуса Российской Федерации, а также могут быть использованы специалистами организаций здравоохранения, сотрудниками научно-исследовательских институтов и других заинтересованных организаций.
1.2. В методических указаниях определены требования к порядку сбора, упаковки, хранения, транспортирования и проведения вирусологических исследований материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича (ОВП) в целях установления этиологических агентов заболеваний, а также изучения циркуляции полиовирусов, других (неполно) энтеровирусов среди населения.
4
МУК 4.2.2410—08
2. Общие положения
2.1. Вирусологические исследования материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича (далее - ПОЛИО/ОВП) на полиовирусы, другие (неполно) энтеровирусы (далее - НПЭВ) являются одним из важнейших элементов системы эпидемиологического надзора за ПОЛИО/ОВП, энтеро-вирусными инфекциями.
2.2. Все процедуры по сбору, транспортированию, подготовке к вирусологическому исследованию материалов от больных ПОЛИО/ОВП осуществляются в соответствии с требованиями нормативных и методических документов (прилож. 1).
2.3. Выполнение требований настоящих методических указаний направлено на совершенствование эпидемиологического надзора за ПОЛИО/ОВП, энтеровирусными инфекциями.
3. Организация вирусологических исследовании материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом острого вялого паралича на полиовирусы, другие (неполно) эптеровирусы
3.1. Забор материалов от больных полиомиелитом, с подозрением на это заболевание, с синдромом ОВП проводят в лечебно-профилактических организациях (далее - ЛПО) в установленном порядке в соответствии с нормативными и методическими документами.
3.2. Вирусологические исследования материалов от больных ПОЛИО/ОВП осуществляют: Национальный центр по лабораторной диагностике полиомиелита в Институте полиомиелита и вирусных энцефалитов им. М. П. Чумакова РАМН (далее - НЦ), вирусологические лаборатории региональных центров эпидемиологического надзора за полиомиелитом и ОВП в г. Москве, Хабаровском, Ставропольском краях, Свердловской, Омской областях, Санкт-Петербургском НИИЭМ им. Пастера (далее - РЦ).
3.3. Вирусологическому исследованию в РЦ подлежат материалы:
• пробы фекалий от больных детей в возрасте до 15 лет с явлениями ОВП (две пробы);
• пробы фекалий от детей в возрасте до 5 лет, общавшихся с больным ПОЛИО/ОВП, в случае позднего (после 14 дня с момента выявления паралича), неполного (1 проба стула) обследования больного (по одной пробе, не более 5 детей);
5
• пробы фекалий лиц, прибывших из эндемичных (неблагополучных) по полиомиелиту страы/территорий, общавшихся с больным ПОЛИО/ОВП (по одной пробе, не более 5 контактных);
• парные сыворотки крови больных с подозрением на полиомиелит или больных, отнесенных к приоритетным «горячим» случаям ОВП (прилож. 2). Сыворотки могут быть доставлены и исследованы в НЦ (по согласованию).
3.4. Вирусологическому исследованию в НЦ подлежат материалы:
• пробы фекалий от больных полиомиелитом, с подозрением на это заболевание независимо от возраста (две пробы);
• пробы фекалий от больных детей, отнесенных к приоритетным («горячим») случаям ОВП (две пробы);
• пробы фекалий от детей в возрасте до 5 лет, общавшихся с больным ПОЛИО/ОВП, отнесённым к приоритетному («горячему») случаю (одна проба);
• пробы фекалий лиц, прибывших из эндемичных (неблагополучных) по полиомиелиту стран/территорий, общавшихся с больным ПОЛИО/ОВП, отнесенным к «горячему» случаю (по одной пробе, не более 5 контактных);
• пробы фекалий от больных вакциноассоциированым полиомиелитом, собранные повторно на 60-й и 90-й день от начала заболевания (по две пробы). В случае получения положительного вирусологического результата проводят повторный отбор проб для последующего исследования (по согласованию с НЦ);
• материалы от больных детей в возрасте до 15 лет с явлениями ОВП, исследованные в РЦ, из которых выделены полиовирусы, НПЭВ (пробы фекалий и изоляты);
• материалы от детей в возрасте до 5 лет, общавшихся с больным ПОЛИО/ОВП, в случае позднего, неполного обследования больного, исследованные в РЦ, из которых выделены полиовирусы, НПЭВ (пробы фекалий и изоляты);
• материалы от лиц, прибывших из эндемичных (неблагополучных) по полиомиелиту стран/территорий, общавшихся с больным ПОЛИО/ОВП, исследованные в РЦ, из которых выделены полиовирусы, НПЭВ (пробы фекалий и изоляты);
3.5. Результаты вирусологических исследований, идентификации и внутритиповой дифференциации сообщаются в организации здравоохранения, органы и учреждения Роспотребнадзора, направившие мате-
6
МУК 4.2.2410—08
риалы, а также в установленном порядке в НЦ, РЦ, Координационный центр ликвидации полиомиелита Роспотребнадзора.
4. Правила сбора, маркировки, хранения и транспортирования материалов для исследования
4.1. Клинические материалы
4.1.1. Отбор клинического материала и его упаковку осуществляет медицинский работник ЛПО в установленном порядке.
4.1.2. От больного ПОЛИО/ОВП берут две пробы фекалий в максимально ранние сроки от момента возникновения ОВП (до 7-го, но не позднее 14-го дня). Первую пробу фекалий отбирают в день установления клинического диагноза, вторую через 24—48 ч после взятия первой пробы. Оптимальный размер фекальной пробы 8—10 г, что соответствует величине двух ногтей большого пальца взрослого человека. Сбор проб производят в специальные пластиковые ёмкости с завинчивающейся крышкой для забора фекальных проб.
4.1.3. В тех случаях, когда получить фекалии от больного невозможно, можно получить фекальную пробу с помощью ректальной «соломинки» или ректального тампона. Ректальную «соломинку» (натуральную или пластиковую, твёрдую, с внутренним диаметром 5 мм) осторожно вводят в прямую кишку и медленными движениями набирают достаточное количество фекальной массы. После выведения из прямой кишки соломинку сгибают или переламывают и помещают в стерильный флакон/пробирку. При использовании ректального тампона стерильный ватный тампон на деревянной палочке вводят в прямую кишку и протирают слизистую оболочку так, чтобы захватить фекальный материал. Тампон извлекают и, отломив палочку, помещают в стерильную пробирку/флакон с 1—2 мл транспортировочной среды (прилож. 3).
4.1.4. В летальных случаях берут пробы (кусочки ткани) из шейного и поясничного отделов спинного мозга, продолговатого мозга. Варолиева моста, нисходящего отдела толстой кишки. Пробы отбирают как можно раньше после наступления смерти. Ткани иссекают стерильными инструментами, помещают в отдельные стерильные пластиковые или стеклянные ёмкости с транспортировочной средой, добавленной в таком количестве, чтобы сохранить их влажными. Объём каждой пробы (кусочка тканей ЦНС) должен составлять примерно 1 см3; из толстой кишки иссекают сегмент д линой 3—5 см, содержащий фекальные массы.
4.1.5. Для диагностических серологических исследований у больных ПОЛИО/ОВП отбирают две пробы крови. Первая должна быть взя-
7
та в первые семь дней от начала заболевания, вторая - спустя 2—3 нед. Оптимальный объём пробы - 3—5 мл. Если взятие крови из вены по каким-либо причинам невозможно, берут кровь уколом пальца, что позволяет взять 0,3—0,4 мл крови. Пробы крови помещают в стерильные ёмкости (пробирки, флакончики) без антикоагулянтов или консервантов. Пробы оставляют при комнатной температуре на 2 ч для свёртывания крови. После образования сгустка его отделяют от стенки сосуда, пробу помещают в холодильник при температуре от 2 до 8 °С и спустя 24 ч отбирают сыворотку. Центрифугированием при I 500 g в течение 5—10 мин сыворотку осветляют, переносят стерильной пипеткой в стерильную ёмкость. Если нельзя воспользоваться центрифугой или обработке подлежит сразу большое количество проб, с помощью стерильной пипетки можно осторожно отсосать сыворотку от сгустка так, чтобы в неё не попали выпавшие в осадок эритроциты. Во всех случаях следует предотвращать попадание в сыворотку эритроцитов, т. к. при хранении они подвергаются гемолизу, что может повлиять на результаты серологических исследований.
4.1.6. Пробы фекалий должны быть доставлены в РЦ или в НЦ в течение 72 ч с момента отбора. До отправки их хранят в холодильнике при температуре от 2 до 8 °С. Транспортирование проб осуществляют при температуре от 2 до 8 °С (обратная «холодовая» цепь). Если доставка проб по какой-либо причине задерживается, пробы хранят при температуре -20 °С. Условия транспортирования должны обеспечивать их сохранение.
4.1.7. Пробы крови (сыворотки) доставляют в лабораторию в течение 72 ч от момента отбора. До отправки пробы хранят при температуре от 2 до 8 °С. Эту же температуру обеспечивают при транспортировании проб. Если доставка по какой-либо причине задерживается, сыворотки хранят при температуре -20 °С. Условия транспортирования должны обеспечивать их сохранение.
4.2. Изоляты полиовирусов, других (неполио) энтеровирусов
Изоляты полиовирусов, НПЭВ, выделенные в РЦ из материалов от больных ПОЛИО/ОВП, должны быть отправлены для подтверждения и внутритиповой дифференциации (далее - ВТД) в НЦ в течение 7 дней от момента идентификации вируса в РЦ. Для доставки изолятов используют пластиковые пробирки с завинчивающимися крышками с наружной резьбой объёмом 2,0 мл. Вместе с изолятами доставляются образцы фекалий, из которых они были выделены. До отправки изоляты хранят при
МУК 4.2.2410—08
температуре -20 °С. Транспортирование проб осуществляют в условиях «холодовой цепи», обеспечивающих их сохранение.
4.3. Маркировка материалов
Все материалы должны быть снабжены этикеткой, на которой четко обозначают фамилию и инициалы больного, идентификационный номер, тип пробы, дату отбора. Пробы доставляются с направлением (в 2 экз.) на лабораторное исследование (прилож. 4).
4.4. Упаковка и транспортирование материалов для исследования
При транспортировании материалов в лабораторию необходимо соблюдать принцип «тройной упаковки», которая включает следующие компоненты:
1) первичная ёмкость - маркированный контейнер/пробирка/флакон с пробой, надёжно закрытые крышкой, герметизированной лабораторной плёнкой или парафином;
2) вторичная ёмкость - прочный водонепроницаемый, непротекающий контейнер (или полиэтиленовый пакет) с адсорбирующим материалом в количестве, достаточном для адсорбции всего образца в случае его протечки. Во вторичную ёмкость помещают контейнер/пробирку/флакон с пробой. Образцы от одного пациента упаковываются отдельно. Также во вторичную ёмкость помещают направление на исследование, вложенное в полиэтиленовый пакет;
3) внешняя упаковка - прочный термоизолирующий контейнер или термос, предназначенные для транспортирования биологических материалов. Для обеспечения температурных условий транспортирования, в термоконтейнеры помещают охлаждающие элементы или пакеты со льдом. На внешней поверхности термоконтейнера или термоса укрепляют этикетку с указанием адреса, телефона, факса, электронной почты отправителя, адреса, телефона, факса, электронной почты получателя, условий транспортирования.
Перед отправкой материалов отправитель должен проинформировать получателя о планируемой отправке и её сроках. Недопустимо отправлять материалы без предварительной договорённости с получателем.
Транспортирование проб осуществляется в соответствии с требованиями нормативных и методических документов. Упаковка и материалы, которые использовались для транспортирования, могут быть конта-минированы инфекционными агентами, поэтому первичная и вторичная упаковки должны быть уничтожены.
9