Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств аминопиралида в воде, почве, зерне и соломе зерновых колосовых культур методом газожидкостной хроматографии
Методические указания МУК 4.1.2591—10
ББК 51.21 060
060 Определение остаточных количеств аминопиралида в воде, почве, зерне и соломе зерновых колосовых культур методом газожидкостной хроматографии: Методические указания.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010.—20 с.
1. Разработаны Российским государственным аграрным университетом - МСХА им. К. А. Тимирязева, Учебно-научным консультационным центром «Агроэкология пестидов и агрохимикатов» Минсельхоза России (В. А. Калинин, Т. С. Калинина, Е. В. Довгилевич, А. В. Довгилевич,
А. В. Калинин).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 03.12.2009 № 3).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г. Г. Онищенко 26 марта 2010 г.
4. Введены в действие с 26 марта 2010 г.
5. Введены впервые.
ББК 51.21
Редактор Е. В. Николаева Технический редактор Г. И. Климова
Подписано в печать 21.10.10 Формат 60x88/16 Печ. л. 1,25
Тираж 100 экз. Заказ 82
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека 127994, Москва, Вадковский пер., д. 18, стр. 5, 7
Оригинал-макет подготовлен к печати и тиражирован отделом издательского обеспечения
Федерального центра гигиены и эпидемиологии Роспотребнадзора 117105, Москва, Варшавское ш., 19а Отделение реализации, тел./факс 952-50-89
О Роспотребнадзор, 2010 О Федеральный центр гигиены и
эпидемиологии Роспотребнадзора, 2010
МУК 4.1.2591—10
7.4.2. Подготовка патронов Диапак П
Патрон промывают последовательно 10 см3 метанола и 10 см3 деионизированной воды, не допуская высыхания поверхности патрона.
7.4.3. Изучение хроматографичесого поведения аминопиралида на патроне Диапак П
Помещают в стакан 1 см3 стандартного раствора аминопиралида с концентрацией 1 мкг/см3 и удаляют растворитель током теплого воздуха или азота. Добавляют к сухому остатку 2 см3 1н раствора соляной кислоты, 5 см3 деионизированной воды и помещают стаканчик на 1 мин в ультразвуковую ванну. Содержимое стаканчика наносят на кондиционированный патрон. Смыв отбрасывают.
Промывают патрон последовательно 30 см3 деионизированной воды и 20 см3 1 %-го водного раствора уксусной кислоты, смывы отбрасывают.
Элюируют аминопиралид 1 %-го раствором уксусной кислоты в метаноле, пропуская через патрон 4—5 порций раствора по 5 см3 каждая и собирая их в отдельные концентраторы емкостью 100 см3. Собранные фракции выпаривают досуха. В каждый концентратор добавляют 4 см3 бутилирующей смеси, обмывают стенки концентратора и выдерживают 1—2 мин в ультразвуковой ванне. Отбирают пипеткой 2 см3 раствора из концентратора и переносят его в виалу. Виалу плотно закрывают крышкой и помещают на 30 мин в нагревательный блок для бутилирования аминопиралида.
Далее виалу вынимают из блока, охлаждают до комнатной температуры, добавляют 10 см3 гексана и 25—30 см3 дистиллированной воды. Смесь интенсивно встряхивают и после разделения фаз из верхнего гексанового слоя аликвоту 1 мм3 вводят в хроматограф.
После введения бутилированных проб в хроматограф рассчитывают содержание вещества в элюате, определяют полноту смыва с патрона и необходимый объем элюата.
7.4.4. Подготовка колонки с Флоризилом
В пластмассовую колонку длиной 15 см и диаметром 1,5 см помещают на дно стекловату и заполняют 5 г флоризила б0/юо меш, уплотняя его путем вибрации колонки. На слой флоризила наносят слой безводного серно-кислого натрия толщиной 1 см. За день до определения флори-зил в колонке промывают 20 см3 ацетона, а в день определения - 10 см3 гексана.
11
МУК 4.1.2591—10
7.4.5. Проверка хроматографического поведения бутилированного аминопиралида на колонке с флоризилом
Отбирают пипеткой 5 см3 раствора бутилированного аминопиралида в гексане с концентрацией 1 мкг/см3 (см. раздел 7.3) и наносят его на колонку. Промывают колонку последовательно 10 см3 гексана и 10 см3 смеси гексан : ацетон-9 : 1, смывы отбрасывают.
После этого пропускают через колонку 3—4 порции смеси гексан : ацетон-1 : 1 по 5 см3 каждая, собирая их в отдельные концентраторы. Собранные фракции выпаривают досуха на ротационном вакуумном испарителе при температуре не выше 35 °С. Сухой остаток в концентраторе разводят в 10 см3 гексана и вводят в хроматограф 1 мм3 пробы. После введения проб в хроматограф рассчитывают содержание вещества в элюате, определяют полноту смыва с колонки и необходимый объем элюата.
8. Отбор проб и хранение
Отбор проб производится в соответствии с «Унифицированными правилами отбора проб сельскохозяйственной продукции, пищевых продуктов и объектов окружающей среды для определения микроколичеств пестицидов» от 21.08.79 №2051—79, а также в соответствии с ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ГОСТ 1743.01—83 «Почвы. Общие требования к отбору проб», ГОСТ 26950-89 «Почвы. Отбор проб», ГОСТ 13586.3-83 «Зерно. Правила приемки и методы отбора проб», ГОСТ Р 50436-92 (ИСО 950—79) «Зерновые. Отбор проб зерна» и ГОСТ 27262 «Корма растительного происхояще-ния. Методы отбора проб».
Пробы воды хранят в стеклянной герметично закрытой таре в холодильнике при температуре 4 °С; пробы почвы - в полиэтиленовой таре в морозильнике при температуре -18 °С.
Отобранные пробы зерна и соломы подсушивают до стандартной влажности и хранят в бумажных или тканевых мешочках в сухом, хорошо проветриваемом шкафу, недоступном для грызунов.
Для длительного хранения пробы почвы подсушивают при комнатной температуре в отсутствие прямого солнечного света. Сухие почвенные образцы могут храниться в темной таре в течение года. Перед анализом сухую почву просеивают через сито с отверстиями диаметром 1 мм.
МУК 4.1.2591—10
9. Проведение определений
9.1. Вода
Пробу воды объемом 200 см3 фильтруют в коническую колбу емкостью 250 см3 через бумажный фильтр «синяя лента» и подкисляют 2н соляной кислоты до pH = 1.
9.1.1. Очистка пробы воды на патроне Диапак П
Всю пробу воды пропускают со скоростью не более 2 см3/мин через предварительно кондиционирующий патрон Диапак П (раздел 7.4.2). Затем промывают патрон 20 см3 1 %-го водного раствора уксусной кислоты. Смыв отбрасывают. Элюируют аминопиралид 20 см3 1 %-го раствора уксусной кислоты в метаноле, собирая элюат в концентратор. Пробу выпаривают досуха на ротационном вакуумном испарителе при температуре не выше 35 °С.
9.1.2. Бутилирование пробы воды
Добавляют в концентратор 4 см3 бутилирующей смеси, обмывают стенки концентратора и помещают его на 1—2 мин в ультразвуковую ванну. Отбирают пипеткой 2 см3 пробы, переносят в виалу. Закрывают виалу крышкой, помещают ее в блок для впал, нагретый до 100 °С, и оставляют на 30 мин. Далее виалу вынимают из блока, охлаждают до комнатной температуры, добавляют 10 см3 гексана и 25—30 см3 дистиллированной воды. Смесь интенсивно встряхивают и после разделения фаз из верхнего гексанового слоя аликвоту 1 мм3 вводят в хроматограф.
В случае недостаточной очистки пробы воды на патроне Диапак П, используют для очистки бутилированной пробы колонку с флоризилом.
9.1.3. Очистка пробы воды на колонке с флоризилом
На подготовленную (как указано в разделе 7.4.4) колонку наносят 5 см3 (72 часть) бутилированной пробы в гексане, отобранной из впалы. Промывают колонку последовательно 10 см3 гексана и 10 см3смеси гексан : ацетон-9 : 1. Смывы отбрасывают.
Элюируют аминопиралид 15 см3 смеси гексан : ацетон-1 : 1. Элюат выпаривают досуха на ротационном вакуумном испарителе при температуре не выше 35 °С. Сухой остаток разводят в 5 см3 гексана и вводят в хроматограф 1 мм3 пробы.
13
МУК 4.1.2591—10
9.2. Почва
9.2.1. Экстракция
Навеску почвы (10 г) помещают в центрифужную банку емкостью 200 см3, заливают 50 см3 смеси ацетонитрил : ОДн соляная кислота-1 : 1 и встряхивают в течение 30 мин. По окончании встряхивания пробу центрифугируют 15 мин при скорости 4 000 об./мин. Фильтруют экстракт в концентратор емкостью 250 см3 через бумажный фильтр («синяя лента»). Повторяют экстракцию еще 2 раза, встряхивая пробу по 15 мин и заливая навеску каждый раз 30 см3 смеси. Объединенный экстракт выпаривают досуха на ротационном вакуумном испарителе при температуре не выше 35 °С.
Добавляют в концентратор 2 см3 ацетонитрила и 8 см3 дистиллированной воды (соотношение ацетонитрил : вода-1 : 4), обмывают стенки концентратора, помещают его на 1—2 мин в ультразвуковую ванну (при необходимости объединенный экстракт можно оставить на ночь). Затем экстракт очищают на патроне Диапак С16.
9.2.2. Очистка пробы почвы на патроне Диапак С16
Пробу пропускают через кондиционированный (раздел 7.4.1) патрон со скоростью не выше 2 см3/мин, собирая весь элюат в концентратор емкостью 100 см3. Содержимое концентратора упаривают на ротационном вакуумном испарителе при температуре не выше 35 °С до объема 1—2 см3. Добавляют в концентратор 5 см3 деионизированной воды, перемешивают содержимое и помещают концентратор на 1—2 мин в ультразвуковую ванну. Далее очищают пробу на патроне Диапак П.
9.2.3. Очистка пробы почвы на патроне Диапак П
Наносят пробу на кондиционированный патрон (раздел 7.4.2). Промывают патрон последовательно 20 см3 деионизированной воды и 20 см3 1 %-го водного раствора уксусной кислоты. Смывы отбрасывают.
Элюируют аминопиралид 20 см3 1 %-го раствора уксусной кислоты в метаноле. Элюат собирают в концентратор (при необходимости элюат можно оставить на ночь) и выпаривают содержимое досуха на ротационном вакуумном испарителе при температуре не выше 35 °С.
Далее проводят бутилирование пробы, как указано в разделе 9.1.2.
После бутилирования пробу очищают на колонке с флоризилом, как указано в разделе 9.1.3. Элюат выпаривают досуха на ротационном вакуумном испарителе при температуре не выше 35 °С. Сухой остаток разводят в 5 см3 гексана и вводят в хроматограф 1 мм3 пробы.
МУК 4.1.2591—10
9.3. Зерно пшеницы
9.3.1. Экстракция и предварительная очистка
Навеску зерна (10 г) в полипропиленовой банке емкостью 200 см3 тщательно смачивают 5 см3 дистиллированной воды. Для экстракции аминопиралида щелочного гидролиза белков и для разрушения конъюгатов добавляют к пробе 50 см3 водноспиртового раствора щелочи и встряхивают банку 30 мин. По окончании встряхивания центрифугируют пробу 15 мин при скорости 4 000 об./мин. Фильтруют экстракт в концентратор емкостью 250 см3 через бумажный фильтр («синяя лента»), смоченный дистиллированной водой. Повторяют экстракцию еще
2 раза, встряхивая пробу по 15 мин и заливая навеску каждый раз 30 см3 щелочного этанола.
К объединенному экстракту добавляют 3 см3 2н соляной кислоты (при необходимости объединенный экстракт можно оставить на ночь) и выпаривают экстракт досуха на ротационном вакуумном испарителе при температуре 35—40 °С. (Внимание! Последующий этап анализа следует проводить только в вытяжном шкафу!)
Добавляют в концентратор 4 см3 концентрированной серной кислоты и тщательно обмывают стенки концентратора. Оставляют концентратор на 10 мин. По истечении этого времени осторожно наливают в концентратор 20 см3 дистиллированной воды, перемешивают его содержимое и охлаждают раствор до комнатной температуры.
Затем добавляют в концентратор 25 см3 20 %-го раствора едкого натра до pH 1, перемешивают раствор в концентраторе и упаривают его на ротационном вакуумном испарителе при температуре не выше 35 °С до объема 1—2 см3.
Остаток в концентраторе разводят 10 см3 метанола, обмывают стенки концентратора и помещают на 1 мин в ультразвуковую ванну. Содержимое концентратора фильтруют в чистый концентратор емкостью 250 см3 через стеклянную воронку с небольшим количеством (2—
3 г) безводного серно-кислого натрия Во избежание потерь тщательно обмывают концентратор еще 3 раза: двумя порциями по 10 см3 1 %-го раствора уксусной кислоты в метаноле и 10 см3 метанола, каждый раз помещая концентратор в ультразвуковую ванну. Все порции объединяют в один концентратор, пропуская их через безводный сульфат натрия, и упаривают на ротационном вакуумном испарителе при температуре не выше 35 °С до объема 0,5—1,0 см3.
МУК 4.1.2591—10
9.3.2. Очистка пробы зерна на патроне Диапак С16
К остатку в концентраторе добавляют 2 см3 ацетонитрила, перемешивают содержимое, обмывая стенки концентратора. Затем приливают в концентратор 8 см3 воды, еще раз перемешивают содержимое, выдерживают концентратор в ультразвуковой ванне 1—2 мин и пропускают раствор через кондиционированный патрон, собирая смыв в концентратор емкостью 100 см3. Обмывают концентратор второй порцией тех же растворителей, пропускают смесь через патрон и собирают ее в концентратор, объединив с первой порцией. Объединенные смывы упаривают до объема 1—2 см3 на ротационном вакуумном испарителе при температуре не выше 35 °С.
Приливают в концентратор 5 см3 деионизированной воды, перемешивают содержимое и помещают концентратор на 1—2 мин в ультразвуковую ванну.
Далее очищают пробу на патроне Диапак П, как указано в разделе 9.2.3. Затем проводят бутилирование (раздел 9.1.2).
После бутилирования очищают пробу на колонке с флоризилом (раздел 9.1.3). Элюат выпаривают досуха на ротационном вакуумном испарителе при температуре не выше 35 °С. Сухой остаток разводят в 5 см3 гексана и вводят в хроматограф 1 мм3 пробы.
9.4. Солома пшеницы
Навеску соломы (5 г) в полипропиленовой банке емкостью 200 см3 смачивают 10 см3 дистиллированной воды, добавляют 70 см3 водно-спиртового раствора щелочи и встряхивают 30 мин. По окончании встряхивания фильтруют экстракт в концентратор емкостью 250 см3 через бумажный фильтр («синяя лента»), смоченный дистиллированной водой. Повторяют экстракцию еще 2 раза, встряхивая пробу по 15 мин и заливая навеску каждый раз 50 см3 водноспиртового раствора щелочи.
К объединенному экстракту добавляют 6 см3 2н соляной кислоты и выпаривают экстракт на ротационном вакуумном испарителе досуха при температуре 35—40 °С. (Внимание! Последующий этап анализа следует проводить только в вытяжном шкафу!).
Добавляют в концентратор 4 см3 концентрированной серной кислоты и тщательно обмывают стенки концентратора. Оставляют концентратор на 10 мин. По истечении этого времени осторожно наливают в концентратор 20 см3 дистиллированной воды, перемешивают его содержимое и охлаждают раствор до комнатной температуры.
МУК 4.1.2591—10
Затем добавляют в концентратор 25 см3 20 %-го раствора едкого натра до pH 1, перемешивают раствор в концентраторе и упаривают его на ротационном вакуумном испарителе при температуре не выше 35 °С до объема 1—2 см3.
Остаток в концентраторе разводят 10 см3 метанола, обмывают стенки концентратора и помещают на 1 мин в ультразвуковую ванну. Содержимое концентратора фильтруют в чистый концентратор емкостью 250 см3 через стеклянную воронку с небольшим количеством (2—3 г) безводного сернокислого натрия. Во избежание потерь тщательно обмывают концентратор еще 3 раза: двумя порциями по 10 см3 1 %-го раствора уксусной кислоты в метаноле и 10 см3 метанола, каждый раз помещая концентратор в ультразвуковую ванну. Все порции объединяют в один концентратор, пропуская их через безводный сульфат натрия, и упаривают на ротационном вакуумном испарителе при температуре не выше 35 °С до объема 0,5—1,0 см3.
Далее очищают пробу, как указано в разделе 9.3.
После очистки пробы на колонке с флоризилом и выпаривания сухой остаток разводят в 10 см3 гексана и вводят в хроматограф 1 мм3 пробы.
9.5. Условия хроматографирования
Хроматограф «Кристалл 2000м» с детектором постоянной скорости рекомбинации ионов 63Ni, с пределом детектирования по Линдану не выше 4 х К) м.
Колонка капиллярная кварцевая НР-5, длина 15 м, внутренний диаметр 0,32 мм, толщина пленки - 0,25 мкм.
Температура термостата колонки программированная. Начальная температура - 150 °С, выдержка 2 мин; нагрев колонки по 10°/мин до температуры 200 °С, выдержка 2 мин, нагрев колонки по 5°/мин до 220 °С, выдержка 5 мин.
Температура испарителя - 260 °С, детектора - 350 °С.
Газовый режим работы - Splitless.
Регулятор расхода гелия: тип регулятора - РРГ-11; минимальный расход гелия - 20 см3/мин; длительность сброса - 2 мин.
Газ 1 - гелий, расход - 0,5 см3/мин, линейная скорость - 20 см/с, давление на входе - 26,66 кПа.
Газ 2 - гелий (продувка испарителя), сброс 1 : 100, начало сброса -30 с, расход - 50 см3/мин.
17
МУК 4.1.2591—10
Газ 3 - азот (поддув в детектор), расход во время анализа -45 см3/мин.
Продувка детектора азотом - 65 см3/мин после анализа при температуре 270 °С в течение 5 мин.
Абсолютное время удерживания аминопиралида - 11,08—11,15 мин.
Объем вводимой пробы - 1 мм3.
Линейность детектирования сохраняется в пределах 0,01—0,2 иг.
Каждую анализируемую пробу вводят в хроматограф 3 раза и вычисляют среднюю площадь пика. Образцы, дающие пики больше, чем стандартный раствор с концентрацией 0,2 мкг/ см3, разбавляют.
10. Обработка результатов
Для обработки результатов хроматографического анализа используется программа сбора и обработки хроматографической информации «Хроматэк Аналитик», версия 1.20.
Альтернативная обработка результатов.
Содержание аминопиралида в пробах воды, почвы, зерна и соломы пшеницы при анализе методом ГЖХ рассчитывают методом абсолютной калибровки по формуле:
X — содержание аминопиралида в пробе, мг/кг;
Si - площадь пика образца, мВ;
S0 - площадь пика стандарта, мВ;
А - концентрация стандартного раствора, мкг/см3;
V - объем экстракта, подготовленного для хроматографирования (см3);
т - масса или объем анализируемого образца, г или см3;
D - коэффициент пересчета на взятие аликвоты;
Р - содержание аминопиралида в аналитическом стандарте, мг/кг.
11. Проверка приемлемости результатов параллельных определений
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, расхождение между которыми не превышает предела повторяемости:
МУК 4.1.2591—10
2-\Xl -Х2|-100
(*1+Х2)
Хи Х2 - результаты параллельных определений, мг/кг; г - значение предела повторяемости (табл. 1), при этом г = 2,8 ог.
12. Оформление результатов
Результат анализа представляют в виде:
(X ± А) мг/кг при вероятности Р = 0,95, где
X - среднее арифметическое результатов определений, признанных приемлемыми, мг/кг;
А - граница абсолютной погрешности, мг/кг;
Д= 5 • X/100, где 5 - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций, табл. 1), %.
В случае если содержание компонента менее нижней границы диапазона определяемых концентраций, результат анализа представляют в виде:
«содержание вещества в пробе менее 0,01 мг/кг» *
* 0,01 мг/кг - предел обнаружения.
13. Контроль качества результатов измерений
Оперативный контроль погрешности и воспроизводимости измерений осуществляется в соответствии с ГОСТ Р ИСО 5725-1-6-2002 «Точность (правильность и прецизионность) методов и результатов измерений».
13.1. Стабильность результатов измерений контролируют перед проведением измерений, анализируя один из градуировочных растворов.
13.2. Плановый внутрилабораторный оперативный контроль процедуры выполнения анализа проводится методом добавок.
Величина добавки Сд должна удовлетворять условию:
С д = А - + А - где
° л,х л.х ? ^
±Д -(±Д - характеристика погрешности (абсолютная по
грешность) результатов анализа, соответствующая содержанию компонента в испытуемом образце (расчетному значению содержания компонента в образце с добавкой соответственно), мг/кг, при этом:
А л = ± 0,84 А, где
19
А - граница абсолютной погрешности, мг/кг;
5 - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций, табл. 1), %.
Результат контроля процедуры Кк рассчитывают по формуле:
Х\ X, Сд- среднее арифметическое результатов параллельных определений (признанных приемлемыми по и. 11), содержания компонента в образце с добавкой, испытуемом образце и концентрация добавки соответственно, мг/кг;
Норматив контроля К рассчитывают по формуле:
К = J А2 - + А2 -
\ л,х л,х
Проводят сопоставление результата контроля процедуры (Кк) с нормативом контроля (К).
Если результат контроля процедуры удовлетворяет условию:
|Кк|<К, (2)
процедуру анализа признают удовлетворительной.
При невыполнении условия (2) процедуру контроля повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
13.3. Проверка приемлемости результатов измерений, полученных в условиях воспроизводимости:
Расхождение между результатами измерений, выполненных в двух разных лабораториях, не должно превышать предела воспроизводимости (R):
ХЬХ2 - результаты измерений в двух разных лабораториях, мг/кг;
R - предел воспроизводимости (в соответствии с диапазоном концентраций, табл. 1), %.
МУК 4.1.2591—10
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
26 марта 2010 г.
Дата введения: 26 марта 2010 г.
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств аминопиралида в воде, почве, зерне и соломе зерновых колосовых культур методом газожидкостной хроматографииМетодические указания _МУК 4.1.2591—10_
Настоящие методические указания устанавливают метод газожидкостной хроматографии для определения концентрации аминопиралида в воде в диапазоне 0,0005—0,01 мг/дм1 и почве - 0,01—0,2 мг/кг, а также уровня его остаточных количеств в зерне - 0,01—0,2 мг/кг и соломе зерновых колосовых культур в диапазоне 0,04—0,8 мг/кг.
Название действующего вещества по ИСО: аминопиралид.
Название действующего вещества по ИЮПАК: 4-амино-3,6-дихлор-пиридино-2-карбоновая кислота.
Структурная формула:
Эмпирическая формула: C6H4CI2N2O2.
Молекулярная масса: 207,026.
Физическое состояние технического продукта - желтоватый порошок. Давление насыщенного пара: 9,52 х К) Па при 20 °С.
МУК 4.1.2591—10
Температура плавления: 163,5—165,2 °С, разлагается в точке плавления.
Коэффициент перераспределения октанол/вода: Kow logP = 1,76 при pH 5; 2,87 при pH 7; 2,96 при pH 9 (при температуре 19 °С).
Константа диссоциации рКа 2,56 при 20 °С.
Растворимость в воде при температуре 20 °С: 2,48 г/дм3 при pH 2,35; 212 г/дм3 при pH 5; 205—203 г/дм3 при pH 7 и 9. Растворимость в органических растворителях при 20 °С: гептане < 10 мг/см3; ксилоле -0,05, дихлорэтане - 0,15, этилацетате - 4,37, ацетоне - 37,0, метаноле -66,4 г/кг.
Стабилен к гидролизу при pH 5, 7 и 9 при температуре от 20 до 50 °С.
Фотолитически малостоек, разрушается на свету с периодом полураспада - 0,6 дня.
Устойчив к разложению в почве в анаэробных условиях: DT50 при 20 °С составляет в среднем 67 дней (от 18 до 143 дней в различных почвах Европы); DT90 - от 26 до 116 дней. В аэробных условиях скорость деградации аминопиралида значительно выше: DT50 в среднем составляет 25 дней (от 8 до 35 дней); DT90 - 84 дня (от 26 до 116 дней). Основным метаболитом является СО2 как при анаэробном, так и при аэробном разложении аминопиралида.
Краткая токсикологическая характеристика: аминопиралид относится к веществам малоопасным по острой оральной и дермальной токсичности (СД50 для крыс - более 5 000 мг/кг), но умеренно опасным по ингаляционной токсичности (СК50 для крыс, 4 ч, более 5 500 мг/м3. При продолжительном контакте раздражает слизистые оболочки. Малотоксичен для водных организмов (СК50 для рыб и дафний более 100 мг/дм3).
В России установлены следующие гигиенические нормативы:
ПДК в воде - 0,1 мг/ дм3;
ПДК в почве - 0,2 мг/кг;
МДУ в зерне зерновых культур - 0,1 мг/кг.
Область применения препарата: аминопиралид - гербицид системного ауксиноподобного действия из группы гетерилкарбоновых кислот. Рекомендуется для послевсходовой обработки зерновых культур и пастбищ против широкого спектра широколистных сорняков в смеси с фло-расуламом. Норма расхода препарата - 10—20 г д.в./га.
Метрологическая характеристика метода
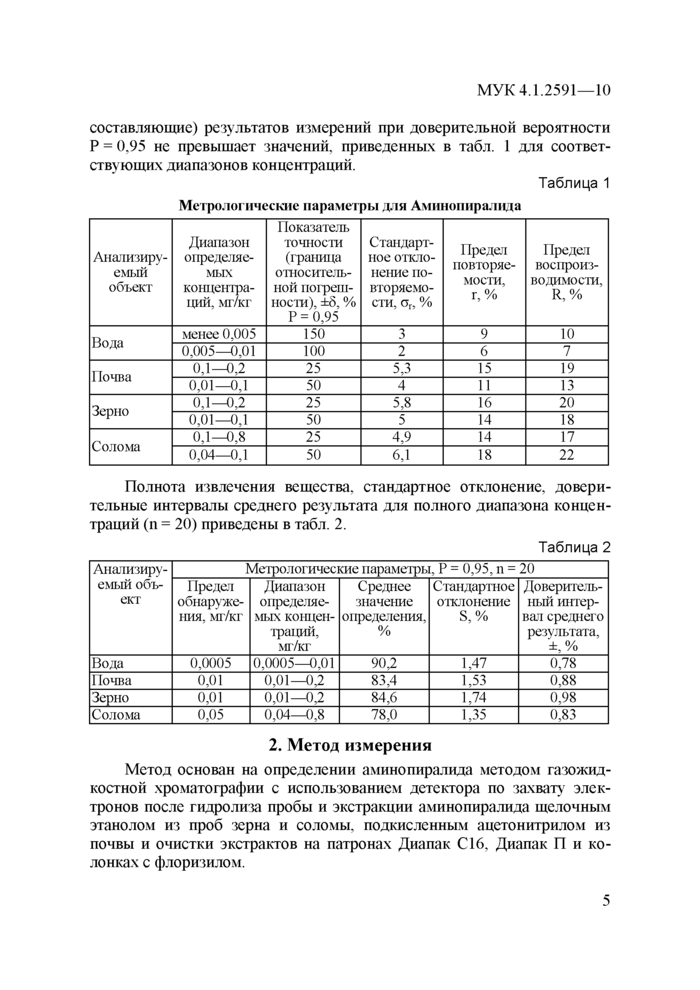
При соблюдении всех регламентированных условий проведения анализа в точном соответствии с данной методикой погрешность (и ее
МУК 4.1.2591—10
составляющие) результатов измерений при доверительной вероятности Р = 0,95 не превышает значений, приведенных в табл. 1 для соответствующих диапазонов концентраций.
Таблица 1
|
Метрологические параметры для Аминопиралида |
|
Анализиру
емый
объект |
Диапазон определяемых концентраций, мг/кг |
Показатель точности (граница относительной погрешности), ±5, % Р = 0,95 |
Стандартное отклонение повторяемости, ог, % |
Предел
повторяе
мости,
г,% |
Предел воспроизводимости, R, % |
|
Вода |
менее 0,005 |
150 |
3 |
9 |
10 |
|
0,005—0,01 |
100 |
2 |
6 |
7 |
|
Почва |
0,1—0,2 |
25 |
5,3 |
15 |
19 |
|
0,01—0,1 |
50 |
4 |
11 |
13 |
|
Зерно |
0,1—0,2 |
25 |
5,8 |
16 |
20 |
|
0,01—0,1 |
50 |
5 |
14 |
18 |
|
Солома |
0,1—0,8 |
25 |
4,9 |
14 |
17 |
|
0,04—0,1 |
50 |
6,1 |
18 |
22 |
|
Полнота извлечения вещества, стандартное отклонение, доверительные интервалы среднего результата для полного диапазона концентраций (п = 20) приведены в табл. 2.
|
Таблица 2 |
|
Анализиру-емый объект |
Метрологические параметры, Р = 0,95, п = 20 |
|
Предел обнаружения, мг/кг |
Диапазон определяемых концентраций, мг/кг |
Среднее
значение
определения,
% |
Стандартное
отклонение
S,% |
Доверительный интервал среднего результата, ±,% |
|
Вода |
0,0005 |
0,0005—0,01 |
90,2 |
1,47 |
0,78 |
|
Почва |
0,01 |
0,01—0,2 |
83,4 |
1,53 |
0,88 |
|
Зерно |
0,01 |
0,01—0,2 |
84,6 |
1,74 |
0,98 |
|
Солома |
0,05 |
0,04—0,8 |
78,0 |
1,35 |
0,83 |
|
2. Метод измерения
Метод основан на определении аминопиралида методом газожидкостной хроматографии с использованием детектора по захвату электронов после гидролиза пробы и экстракции аминопиралида щелочным этанолом из проб зерна и соломы, подкисленным ацетонитрилом из почвы и очистки экстрактов на патронах Диапак С16, Диапак П и колонках с флоризилом.
МУК 4.1.2591—10
Идентификация проводится по времени удерживания. Количественное определение - методом абсолютной калибровки.
В предлагаемых условиях анализа метод специфичен. Избирательность обеспечивается путем подбора капиллярной колонки и условий программирования температуры.
3. Средства измерений, реактивы, вспомогательные устройства и материалы
3.7. Средства измерений Весы аналитические «ОН AUS». ЕР 114 с наибольшим пределом взвешивания до 110 г и дискретностью 0,0001 г, класс точности - специальный (I)
Весы лабораторные общего назначения с наибольшим пределом взвешивания до 600 г и пределом допустимой погрешности ± 0,038 г «ACCULAB» V600 Колбы мерные на 25, 50, 100 и 1 000 см3 Микрошприц на 10 мм3 Пипетки градуированные, вместимостью 1, 2, 5 и 10 см3
Хроматограф газовый «Кристалл 2000м» с детектором по захвату электронов (ЭЗД) с пределом детектирования по Линдану 4 х К) Ь| г/см3 и приспособлениями для капиллярной колонки Номер в Государственном реестре средств измерений
Цилиндры мерные на10,25и50 см3
Допускается использование средств измерения с аналогичными или лучшими характеристиками.
3.2. Реактивы
Аминопиралид, CAS 150114-71-9 - аналитический стандарт чистотой не менее 98,0 %
Азот, осч Ацетон, хч Ацетонитрил, чда Бутанол, хч, свежеперегнанный Вода бидистиллированная (бидистиллят), деионизированная или перегнанная над КМпО|
н-Г ексан, ч
Гелий очищенный, марки «А»
Калий марганцо во-кислый (перманганат), хч
Кальций хлористый, безводный, хч Кислота серная концентрированная, осч Кислота хлороводородная,
концентрированная, хч Кислота уксусная, концентрированная, осч Натрий серно-кислый, безводный, хч Натрия гидроксид, хч Патроны концентрирующие Диапак С16 и Диапак П (0,6 г), фирма «БиоХимМак», МГУ Спирт метиловый, хч Спирт этиловый, ректифицированный Флоризил® (Магния силикат, 99 %,
CAS 1343-88-0) для колоночной хроматографии, зернение 60/100 меш, фирмы «Флюка»
Допускается использование реактивов иных производителей с
ТУ 4215-002-05451931 ГОСТ 6995 ТУ-6-09-1710—77
логичными или лучшими характеристиками.
3.3. Вспомогательные устройства и материалы
Алонж прямой с отводом для вакуума для работы с концентрирующими патронами Диапак Аппарат для встряхивания проб «SKLO UNION ТУР LT1»
Банки с крышками для экстракции на 250 см3, полипропилен, кат. № 3120-0250, NALGENE Блок нагревательный для впал,
Dri-Block DB-3, Tecam
Ванна ультразвуковая «UNITRA»
UNIMA OLSZTYN UM-4
Впалы (пузырьки) с тефлоновыми прокладками
емкостью 40 см3, кат. № Z 27,702-9, Aldrich
Воронки лабораторные, стеклянные ГОСТ 25336-82
Воронки делительные на 250 см3 ГОСТ 25336-82
Испаритель ротационный Rota vapor
R110 Buchi с водяной баней
Колбы конические плоскодонные
на 100 и 250 см3 ГОСТ 25336-82
Колонка хроматографическая капиллярная кварцевая HP-5, (5 % Фенил и 95 % метилсилоксана), длина 15 м, внутренний
МУК 4.1.2591—10
диаметр 0,32 мм, толщина пленки 0,25 мкм, фирмы «Хьюлетт Паккард»
Колбы круглодонные со шлифом
(концентраторы) на 100 и 250 см3, ТС ТУ 92-891.029—91
Насос диафрагменный FT. 19 фирмы «KNF Neu Laboport»
Стаканы стеклянные, термостойкие,
объемом 100—500 см3 ГОСТ 25336-82
Установка для перегонки растворителей
Фильтры бумажные, «синяя лента» ТУ-6-09-1678—86
Шприц медицинский с разъемом типа Люер, объемом не менее 10 см3
Допускается применение хроматографических колонок и другого оборудования с аналогичными или лучшими техническими характеристиками.
4. Требования безопасности
4.1. При выполнении измерений необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ
12.1.007, требования электробезопасности при работе с электроустановками по ГОСТ 12.1.019, а также требования, изложенные в технической документации на газовый хроматограф.
4.2. Помещение должно соответствовать требованиям пожаробезопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009. Содержание вредных веществ в воздухе не должно превышать норм, установленных ГН 2.2.5.1313—03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны». Организация обучения работников безопасности труда - по ГОСТ 12.0.004.
5. Требования к квалификации операторов
К выполнению измерений допускают специалистов, имеющих квалификацию не ниже лаборанта-исследователя, с опытом работы на газовом хроматографе.
К проведению пробоподготовки допускают оператора с квалификацией «лаборант», имеющего опыт работы в химической лаборатории.
6. Условия измерений
При выполнении измерений соблюдают следующие условия:
• процессы приготовления растворов и подготовки проб к анализу проводят при температуре воздуха (20 ± 5) °С и относительной влажности не более 80 %;
• выполнение измерений на газовом хроматографе проводят в условиях, рекомендованных технической документацией к прибору.
МУК 4.1.2591—10
7. Подготовка к выполнению определений
Выполнению измерений предшествуют следующие операции: очистка растворителей (при необходимости), приготовление растворов, кондиционирование хроматографической колонки, подготовка концентрирующих патронов Диапак для очистки экстракта, проверка хроматографического поведения вещества на патронах, построение калибровочной кривой.
7.7. Подготовка органических растворителей
7.1.1. Очистка ацетонитрила. Ацетонитрил перегоняют.
7.1.2. Очистка гексана. Гексан встряхивают с концентрированной серной кислотой, промывают бледно-розовым водным раствором марганцово-кислого калия (в 100 см3 воды растворяют несколько кристаллов марганцовокислого калия) до тех пор, пока раствор не перестанет обесцвечиваться, затем промывают водой, сушат над безводным хлористым кальцием и перегоняют.
7.1.3. Очистка ацетона. Ацетон перегоняют над небольшим количеством мар ганцо во-кислого калия.
7.2. Приготовление рабочих растворов
7.2.1. Приготовление деионизированной воды
Деионизированную воду получают при кипячении бидистиллиро-ванной воды в течение 6 ч с марганцово-кислым калием, добавленным из расчета 1 г/л, и затем перегоняют.
7.2.2. Приготовление 10 %-го водного раствора едкого натра
На лабораторных весах общего назначения взвешивают 100 г едкого натра и в вытяжном шкафу осторожно пересыпают навеску в термостойкий стакан объемом 500 см3, содержащий примерно 350 см3 биди-стиллированной воды, тщательно размешивая раствор. Полученный раствор охлаждают до комнатной температуры и переносят в мерную колбу объемом 1 000 см3. Объем доводят до метки бидистиллированной водой, охлаждая колбу.
7.2.3. Приготовление водноспиртового раствора щелочи
Водноспиртовой раствор щелочи готовят путем смешивания 950 см3 этилового спирта и 50 см310 % водного раствора едкого натра.
7.2.4. Подготовка бутилирунщей смеси
Бутилируюгцую смесь готовят в мерной колбе на 100 см3 в вытяжном шкафу. Наливают в колбу 50—60 см3 бутанола, осторожно прили-
9
МУК 4.1.2591—10
вают пипеткой 2 см3 концентрированной серной кислоты, доводят объем до метки бутанолом и перемешивают содержимое.
73. Приготовление стандартных растворов
Взвешивают 50 мг аминопиралида в мерной колбе на 50 см3, растворяют навеску в ацетоне и доводят объем до метки ацетоном (стандартный раствор № 1, концентрация 1 мг/см3). Стандартный раствор № 1 можно хранить в холодильнике в течение 6 месяцев. Методом последовательного разбавления готовят стандартный раствор аминопиралида в ацетоне с концентрацией 100; 10; 1,0 и 0,1 мкг/см3 для построения калибровочного графика и внесения в контрольный образец.
Для построения калибровочного графика отбирают пипеткой 1 см3 стандартного раствора аминопиралида с концентрацией 10 мкг/см3, помещают его в виалу и удаляют растворитель током теплого воздуха или азота. Проводят бутилирование, как указано в разделе 7.3.1. После бути-лирования слой гексана отбирают пипеткой и помещают в чистую виалу. Полученный раствор имеет концентрацию 1,0 мкг/см3. Далее методом последовательного разбавления этого раствора гексаном готовят стандартные растворы с концентрацией 0,1; 0,05; 0,1 и 0,005 мкг/см3.
7.3.1. Бутилирование
Бутилирование проводят в вытяжном шкафу. К сухому остатку в виале добавляют 2 см3 2 %-го раствора концентрированной серной кислоты в бутаноле (раздел 2.4.1.3). Плотно закрывают виалу крышкой, помещают в блок для виал, нагретый до 100 °С, и оставляют на 30 мин. Далее виалу вынимают из блока, охлаждают до комнатной температуры, добавляют 10 см3 гексана и 25—30 см3 дистиллированной воды. Смесь интенсивно встряхивают и после разделения фаз из верхнего гексанового слоя аликвоту 1 мкл вводят в хроматограф.
7.4. Подготовка концентрирующих патронов Диапак и колонок с Флоризилом и изучение хроматографического поведения аминопиралида
7.4.1. Подготовка патронов Диапак С16
Патрон устанавливают на алонж с отводом для вакуума, сверху в патрон вставляют шприц с разъемом типа Люер объемом не менее 10 см3, который используют как емкость для элюента. Патрон промывают последовательно 10 см3 ацетонитрила и 10 см3 деионизированной воды. Промывку проводят под вакуумом непосредственно перед очисткой экстрактов образцов со скоростью не более 2 см3/мин, не допуская высыхания поверхности патрона.
1